-
Medical journals
- Career
Léčba multicentrické a unicentrické formy Castlemanovy nemoci
Authors: Z. Král 1; Z. Adam 1; M. Krejčí 1; L. Pour 1; P. Volfová 2; Marta Ježová 3; Z. Řehák 4; R. Koukalová 4
Authors‘ workplace: Interní hematologická a onkologická klinika LF MU a FN Brno 1; Interní hematologická a onkologická klinika – Centrum molekulární biologie a genové terapie, sekce oportunních, infekcí, Dětská nemocnice 2; Ústav patologie LF MU a FN Brno 3; Oddělení nukleární medicíny, Centrum PET, Masarykův onkologický ústav 4
Published in: Transfuze Hematol. dnes,26, 2020, No. 3, p. 186-195.
Category: Review/Educational Papers
Overview
Castlemanova nemoc je velmi vzácné onemocnění. Multicentrická forma se projeví nejčastěji systémovou zánětlivou reakcí, lokalizovaná forma pak lokálními příznaky z místní expanze ložiska. Pro léčbu multicentrické formy je v Evropě registrován siltuximab (protilátka proti interleukinu 6). Mimo Evropu se používá také tocilizumab, protilátka proti receptoru pro interleukin 6. Na patofyziologii této nemoci se podílejí výrazně B-lymfocyty, a proto je velmi účinná protilátka anti-CD20, rituximab, který je v ČR stále nejvíce používán. Další léky, u nichž byla formou popisů případů potvrzena účinnost, je thalidomid, lenalidomid, anakinra. Pro léčbu TAFRO syndromu, což je vzácná varianta Castlemanovy nemoci vedoucí až k anasarce, byl s úspěchem použit cyklosporin. V případě velmi agresivního průběhu (sepsis-like) při neúčinnosti výše uvedených postupů lze použít chemoterapeutické režimy používané u lymfomů.
Klíčová slova:
Castlemanova nemoc – TAFRO syndrom – siltuximab – rituximab – anakinra – cyklosporin
ÚVOD
Příznaky a diagnostika Castlemanovy nemoci jsou rozebrány v článku nazvaném Castlemanova nemoc, jedna z příčin chronické systémové zánětlivé reakce, někdy i retence tekutin, vaskulitid a poruch imunity. Mezinárodní diagnostická kritéria z roku 2018, jež byl otištěn v předchozím čísle Transfuze a hematologie dnes [1]. V tomto článku se soustředíme na léčbu této nemoci. Léčba Castlemanovy nemoci byla dříve odvozována ze znalostí publikací popisujících jednotlivé případy či malé série nemocných [2]. První mezinárodní doporučení pro léčbu této nemoci, založené na analýze všech publikovaných informací, bylo zveřejněno koncem roku 2018 [3, 4]. Vzhledem k tomu, že léčbu Castlemanovy nemoci lze často realizovat pouze postupem na paragraf 16 zákona 48/1997 Sb., o veřejném zdravotním pojištění, po domluvě s revizními lékaři, ponecháváme v textu o léčbě více citací dokladujících efektivitu jednotlivých léků.
KLASIFIKACE IDIOPATICKÉ MULTICENTRICKÉ FORMY CASTLEMANOVY NEMOCI PODLE ZÁVAŽNOSTI NEMOCI NA TYP SEPSIS-LIKE A FLU-LIKE
Podle intenzity příznaků a míry agresivity průběhu se rozlišuje forma závažná (sepsis-like neboli též severe form) a forma méně závažná (flu-like neboli též nonsevere form). Pacienti se závažnou formou mají různé orgánové dysfunkce (renální insuficienci, anasarku, těžkou anémii, pulmonální dysfunkci), což vede ke zhoršení celkové zdatnosti. Pro závažnou formu Castlemanovy nemoci je charakteristická hodnota CRP > 100 mg/l, hodnota albuminu 20 g/l či nižší, počet trombocytů pod 100 × 109/l [4]. Pacienti s lymfocytární intersticiální pneumonií se mohou při neúspěšné léčně dostat do plicní fibrózy. Kritéria těchto dvou forem onemocnění uvádí tabulka 1.
Table 1. Kritéria závažné formy Castlemanovy nemoci podle International, evidence based consensus treatment guidelines for idiopathic multicentric Castleman disease [4] ![Kritéria závažné formy Castlemanovy nemoci podle International, evidence based consensus treatment guidelines for idiopathic
multicentric Castleman disease [4]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/441def9a233d2cd59de6276ff1a8044d.png)
HODNOCENÍ LÉČEBNÉ ODPOVĚDI
Kritéria pro hodnocení léčebné odpovědi byla poprvé zveřejněna v roce 2018 [4], uvádíme je v tabulce 2. Pro hodnocení velikosti uzlin jsou akceptována Chesonova kritéria, používaná u lymfomů. Hodnocení jako kompletní remise (CR) vyžaduje splnění všech podmínek CR. Hodnocení jako parciální remise (PR) vyžaduje ve všech kategoriích dosažení alespoň PR. Hodnocení progrese (progresive disease – PD) vyžaduje alespoň v jedné z kategorií splnění kritéria progrese [4].
Table 2. Hodnocení léčebné odpovědi podle International, evidence based consensus treatment guidelines for idiopathic multicentric Castleman disease [4] ![Hodnocení léčebné odpovědi podle International, evidence
based consensus treatment guidelines for idiopathic multicentric
Castleman disease [4]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/3e1ca0eb5217ad3a122ee38a4525ab97.png)
CR – complete remission (kompletní remis), PD – partial remission (parciální remise), PD – progressive disease (progrese nemoci) PŘEHLED LÉKŮ POUŽÍVANÝCH PRO LÉČBU MULTICENTRICKÉ FORMY CASTLEMANOVY NEMOCI
Glukokortikoidy
Glukokortikoidy tlumí jak akutní, tak i chronickou zánětlivou reakci. Snižují tvorbu proinflamatorních cytokinů a chemokinů a klíčových enzymů zánětlivé reakce, tedy IL-2, IL-6, TNF alfa. Pro potlačení příznaků nemoci je však třeba vysokých dávek glukokortikoidů, přičemž tyto vysoké dávky nelze podávat dlouhodobě. Příznaky nemoci se rychle obnovují po ukončení kortikoterapie či při snížení jejich dávky. Proto jsou dnes používány jako součást kombinační léčby [3–5].
Klasická chemoterapie
V letech před příchodem biologických léků do klinické praxe (anti-CD20 protilátky a thalidomidu, lenalidomidu a siltuximabu) byly testovány klasické chemoterapeutické kombinace používané pro léčbu maligních lymfomů, tedy kombinace CHOP (cyklofosfamid, vinkristin, adriamycin a prednison), CVAD (cyklofosfamid, vinkristin, adriamycin a dexametazon), případně režimy s etoposidem, monoterapie etoposidem podaným denně či intermitentně, aplikace kladribinu, chlorambucil v monoterapii a podobné režimy v té době považované za moderní léčbu maligních lymfomů [3, 4].
V době, kdy byly tyto klasické režimy používány bez přidání nových léků, byla diagnostika této nemoci méně přesná než dnes. V literatuře jsou popsány zkušenosti s aplikací chemoterapie malým skupinkám pacientů s Castlemanovou nemocí. V roce 1998 Herrada popsal 27 % dlouhodobých remisí po klasické chemoterapii [5]. Chronowsky (2001) popsal progression free interval 23–119 měsíců u 4 z 9 pacientů léčených klasickou chemoterapií [6].
Zhu (2013) popsal 10 pacientů léčených kombinací CHOP, nebo COP. U jednoho pacienta bylo dosaženo kompletní remise, u 6 parciální remise, při mediánu sledování 34 měsíce zůstávali všichni pacienti naživu [7]. Liu v recentním retrospektivním přehledu z roku 2016 uvádí, že cytostatická terapie navodila kompletní remisi u 19 ze 43 pacientů s mediánem intervalu do selhání léčby (time to treatment failure) 6 měsíců [8].
Léčba založená na kombinaci cytostatik v některých případech vedla k vymizení symptomů nemoci, tedy k léčebné odpovědi u 36 % pacientů [2, 9].
Mezinárodní doporučení pro léčbu Castlemanovy nemoci z roku 2018 uvádí, že kombinované chemoterapeutické režimy je vhodné ponechat pro ty pacienty, jejichž nemoc progreduje při použití nových účinných léků, jako je rituximab, siltuximab či tocilizumab, případně IMIDy [3, 4]. Tento názor je založen na mínění odborníků, kteří se touto léčbou zabývají, protože pro nízkou incidenci této nemoci nebyly prováděny srovnávací klinické studie, vyjma klinické studie se siltuximabem zmíněné níže.
Anti-CD20 protilátka (rituximab)
Rituximab je monoklonální protilátka proti povrchovému antigenu CD20, který je lokalizovaný na fyziologických i transformovaných B-lymfocytech. Po navázání dochází k destrukci těchto lymfocytů. Protože polyklonální B-lymfocyty tvoří převážnou část uzlin postižených Castlemanovou chorobou, je racionální použít cílené destrukce těchto buněk pomocí anti-CD20 protilátky. Rituximab je u této choroby účinný i v monoterapii, jak vyplývá z četných citovaných popisů případů, ale je možné také účinek rituximabu potencovat kombinací s dalšími léky, které jsou používány při léčbě maligních lymfomů, tedy s glukokortikoidy, a dále s alkylačními či antracyklinovými cytostatiky. Rituximab má potenciál navodit léta trvající kompletní remisi a podstatné je, že účinnost této léčby byla potvrzena velkým počtem publikací, takže na rituximab v této indikaci lze nahlížet jako na léčbu první volby [9–19], pokud není dostupný siltuximab. Gerald (2007) popsal 92 % léčebných odpovědí při monoterapii rituximabem, přičemž léčebné odpovědi měly dlouhodobý charakter, 79 % pacientů bylo po dvou letech sledování stále v remisi [20]. Léčba rituximabem snižuje podle některých pozorování riziko pozdější transformace v maligní lymfom [21]. Před podáním rituximabu se doporučuje vyšetřit virové hepatitidy, protože léčba rituximabem může vést k reaktivaci těchto infekcí. Rituximab je také účinný v léčbě HHV-8 pozitivní formy nemoci, protože eradikuje lymfocyty, v nichž HHV-8 virus žije, a tím sníží tvorbu IL-6 [9–12].
IMIDs – imunomodulační léky
Thalidomid byl jako první zařazen do skupiny IMIDs – immunomodulatory drugs. V lidském organismu má velmi pestré účinky. Mimo jiné potlačuje tvorbu některých cytokinů, mezi nimi IL-1, IL-6, IL-12 a VEGF. Stimuluje naopak T-buňky cestou cereblonové inhibice.
A právě tato jeho vlastnost, potlačování tvorby prozánětlivých cytokinů, jej činí účinným při léčbě Castlemanovy nemoci, jak dokládají četné popisy případů [22–31]. Podání imidů vede k poklesu tvorby IL-6, a to má za následek pokles hodnoty CRP.
V literatuře lze najít několik prací, které popisují synergický účinek podání rituximabu a thalidomidu. Thalidomid, imunomodulační, anti-inflamatorní a anti-angiogenní lék má silnou aktivitu proti této nemoci i v monoterapii. Proto je doporučována kombinovaná léčba rituximab a thalidomid [22, 23].
Bortezomib
Bortezomib je selektivní inhibitor proteazomu, preferenčně působící na plazmatické buňky, v nichž mimo jiné snižuje tvorbu IL-6 a také inhibuje NFkappaB. Úspěchy bortezomibu u mnohočetného myelomu vedly k testování bortezomibu u plazmocelulární varianty Castlemanovy nemoci. A podle publikací, které popisují tuto léčbu, bylo podání bortezomibu spojeno s dosažením kompletní remise. Bortezomib je tedy po rituximabu dalším novým účinným lékem pro tyto nemocné [32–34].
Protilátka proti interleukinu-6 a jeho receptoru
V literatuře lze nalézt popisy případů s multicentrickou formou Castlemanovy nemoci úspěšně léčených protilátkou proti receptoru IL-6, zvanou tocilizumab. Tato látka je používána hlavně v Asii a Japonsku, jak plyne z citované literatury [35–44].
Tocilizumab je humanizovaný antagonista receptoru IL-6, je schopen zablokovat transmembránovou signalizaci, kterou by se normálně aktivoval IL-6. Tocilizumab snižuje zánětlivou reakci mediovanou signální kaskádou navázanou na receptor IL-6. Tocilizumab je registrován pro léčbu idiopatické multicentrické Castlemanovy nemoci v Japonsku, v jiných zemích je registrován pro léčbu revmatoidní artritidy.
Po léčbě tocilizumabem byla také popsána regrese orgánového poškození při Castlemanově nemoci, ústup kardiomyopatie anebo zlepšení funkce ledvin [42–46].
V Evropské unii je od května roku 2014 registrována pro léčbu multicentrické formy Castlemanovy choroby protilátka proti IL-6 zvaná siltuximab (SYLVANT).
Siltuximab je chimérická IgG1 protilátka, která tvoří komplexy s IL-6, takže brání jeho vazbě na solubilní a membránové receptory. Siltuximab má registraci pro léčbu idiopatické multicentrické formy Castlemanovy nemoci v USA a v Evropě. Podmínkou pro jeho podání je diagnóza idiopatické formy Castlemanovy nemoci, tedy nepřítomnost infekce HHV-8 a nepřítomnost infekce HIV. Siltuximab tvoří stabilní komplexy s bioaktivními formami IL-6 a brání jeho vazbě na rozpustné i membránové vazebné receptory. Siltuximab se podává v doporučené dávce 11 mg/kg formou intravenózní infuze 1× za tři týdny až do případného selhání léčby (anebo nepřijatelné toxicity). Ošetřující lékař si musí být vědom, že přípravek siltuximab může maskovat známky akutního zánětu, včetně potlačení horečky a reaktantů akutní fáze, a naopak může vést ke zvýšení hodnoty triglyceridů a cholesterolu v séru. Proto se požaduje, aby pacienti vždy před podáním siltuximabu měli počet neutrofilů vyšší než 1,0 × 109/l a počet trombocytů vyšší než 50 × 109/1, a při závažné infekci by se léčba siltuximabem měla vždy přerušit [47–51].
V první klinické studii bylo léčeno 37 pacientů s multicentrickou Castlemanovou chorobou. Léčebné odpovědi bylo dosaženo u 32 (86 %). Celkový počet léčebných odpovědí v této studii během 2,4 roku byl 92 % [49]. V následující fázi II. klinického zkoušení bylo 79 pacientů randomizováno v poměru 2 : 1 do skupiny dostávající 11 mg/kg siltuximabu 1× za tři týdny, nebo do skupiny dostávající placebo. Celkem 18 (34 %) pacientů dosáhlo léčebné odpovědi: 1× kompletní remise a 17 parciální remise, definované nejen vymizením symptomů, ale také zmenšením lymfadenopatie. U dalších 30 pacientů (57 %) byl pozorován ústup symptomů beze změny při hodnocení nemoci pomocí zobrazovacích vyšetření. Ve skupině s placebem bylo dosaženo léčebné odpovědi jen u 5 (19 %) pacientů [50]. Do prodloužené léčby bylo pak zařazeno 19 pacientů, kteří dostávali siltuximab dlouhodobě (až 7 let) bez průkazu toxicity [51].
Nejčastější nežádoucí účinky byly pruritus (42 %), infekce horního dýchacího traktu (36 %), patologická únava (34 %), makulopapulární raš (34 %) a periferní edémy (32 %).
Randomizované srovnání léčby siltuximabu ve srovnání s placebem prokázalo u 53 hodnotitelných pacientů léčených siltuximabem celkem jen 34 % léčebných odpovědí [51], takže siltuximab jako jediný má sice registraci pro léčbu Castlemanovy nemoci, ale zásadní zlepšení přinesl pouze třetině nemocných. Srovnání účinnosti siltuximabu a rituximabu v rámci klinické studie nebylo provedeno.
Anakinra
Anakinra je monoklonální protilátka proti receptoru pro interleukin-1 (IL-1 receptor antagonist). Její biologický poločas je ale jen 4–6 hodin. Anakinra je schválená agenturou FDA pro léčbu revmatoidní artritidy, ale v průběhu posledních let se prokázal účinek tohoto léku u četných dalších chorob včetně Stillovy nemoci, juvenilní artritidy a také u četných autoinflamatorních chorob s manifestací v dětství a také u syndromu Schnitzlerové. Podává se obvykle denně v dávce 100 mg 1× denně. Jeho léčebné použití u Castlemanovy nemoci je založeno na faktu, že IL-1 stimuluje tvorbu IL-6, který stimuluje projevy Castlemanovy nemoci. Siltuximab tlumí chorobu blokádou účinku IL-6. Anakinra tlumí chorobu blokádou aktivity IL-1, takže jednu úroveň níže než siltuximab. V odborné literatuře není zatím žádná randomizovaná klinická studie analyzující účinek anakinry u Castlemanovy nemoci. K dispozici jsou tři publikace popisující zásadní zlepšení po podání anakinry u pacientů s Castlemanovou chorobou, často již značně předléčených. První popis léčby Castlemanovy nemoci anakinrou je z roku 2008. U tohoto pacienta předcházela léčba chemoterapií a rituximabem, která však nedosáhla léčebné odpovědi. Až podání anakinry vedlo k vymizení příznaků nemoci [52].
V dalším případě byla anakinra s úspěchem použita u ještě více předléčeného pacienta, u něhož předcházela léčba kladribinem, rituximabem, steroidy etanerceptem (protilátka proti TNF) a protilátkou proti IL-6, přičemž nemoc byla na vše uvedené refrakterní. Takže klasické léčebné možnosti byly u této paní, léčené v MD Anderson Cancer, vyčerpány. Proto byla použita anakinra (100 mg denně), do týdne příznaky vymizely a na kontrolních FDG-PET/CT zobrazeních vymizela lymfadenopatie a vymizela zvýšená akumulace FDG v kostní dřeni [53].
Anakinru použili také francouzští autoři u případu Castlemanovy nemoci s anasarkou a trombotickou trombocytopenickou purpurou odpovídající TAFRO syndromu [54].
Takže anakinra představuje léčebnou alternativu, která ale z hlediska tolerance je excelentní a ekonomicky je dostupnější.
Cyklosporin a sirolimus
Kalcineurinové inhibitory, cyklosporin a sirolimus, působí na T-buňky. A protože u Castlemanovy nemoci dochází také k jejich aktivaci, byly tyto léky také testovány v léčbě této choroby. Klinické zkušenosti v indikaci Castlemanovy nemoci jsou zatím omezené, cyklosporin navodil remisi u pacientů s TAFRO syndromem [55, 56].
Vysokodávkovaná chemoterapie s autologní transplantací krvetvorných buněk
V literární databázi Medline není zmínka o použití alogenní transplantace krvetvorných buněk, k dispozici jsou jen tři zprávy o použití vysokodávkované chemoterapie: 2× melfalanu v dávce 200 mg/m2 [57, 58] a 1× kombinace etoposid thiotepa, cytarabin cyklofosfamid a melfalanu s podporou autologní transplantace krvetvorných buněk [59]. Všichni autoři popisují dosažení kompletní remise. Takže i vysokodávkovaná chemoterapie s autologní transplantací je alternativou, kterou možno zvážit při neúspěchu klasické léčby.
DOPORUČENÍ PRO LÉČBU PODLE INTERNATIONAL EVIDENCE-BASED CONSENSUS TREATMENT GUIDELINES FOR IDIOPATHIC MULTICENTRIC CASTLEMAN DISEASE 2018
Léčba závažné formy (sepsis-like) idiopatické multicentrické formy Castlemanovy nemoci
Přibližně 10–20 % pacientů s idiopatickou Castlemanovou nemocí splňuje kritéria závažné formy nemoci s orgánovou dysfunkcí, špatným celkovým stavem a potřebuje velmi intenzivní léčbu. Pro tuto podskupinu pacientů se doporučuje zahájit léčbu vysokými dávkami glukokortikoidů (metylprednisolon 500 mg denně) spolu se siltuximabem. V tomto případně se doporučuje podávání siltuximabu 1× týdně po dobu jednoho měsíce.
U pacientů, kteří na tuto léčbu reagují, se má po měsíci přejít na aplikaci v třítýdenních intervalech a postupně snižovat glukokortikoidy. V případě, že v prvním týdnu nedojde ke zlepšení, doporučuje se použít polychemoterapeutické režimy používané pro B-lymfomy, tedy režimy obsahující anti-CD20 protilátku rituximab, nebo režimy obsahující etoposid a cyklofosfamid, které se používají pro léčbu hemofagocytující lymfohistiocytózy [2–4].
Léčba méně závažné formy (flu-like) idiopatické multicentrické formy Castlemanovy nemoci
Vzhledem k tomu, že jediná léčba testovaná v rámci klinické studie byl siltuximab, případně příbuzný tolicilizumab, tak v obou případech sepsis-like i flu-like průběhu citované mezinárodní doporučení [3, 4] začíná léčbu siltuximabem či tocilizumabem, při neúčinnosti této léčby pak doporučuje rituximab v kombinaci s glukokortikoidy a případně s dalšími imunomodulačními, imunosupresivními či cytostatickými léky [3, 4], jak uvádí tabulka 3.
Table 3. Doporučené léčebné postupy podle International evidence based consensus treatment guildelines for idiopathic multicentric Castleman disease 2018 [4]. V ČR při omezené dostupnosti siltuximabu používáme v rámci první linie léčbu založenou na rituximabu. ![Doporučené léčebné postupy podle International evidence based
consensus treatment guildelines for idiopathic multicentric Castleman
disease 2018 [4]. V ČR při omezené dostupnosti siltuximabu používáme
v rámci první linie léčbu založenou na rituximabu.](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image_pdf/ac2c91109068903e115fbacae18d8aeb.png)
Co považovat za léčbu volby v ČR pro idiopatickou multicentrickou formu Castlemanovy nemoci?
Tabulka 3 uvádí názory na optimální léčbu podle mezinárodního doporučení [4]. Předchozí publikace doporučovaly v případě flu-like průběhu začít léčbu léčebným režimem obsahujícím rituximab a v případě sepsis-like průběhu zahájit léčbu aplikací siltuximabu 1× týdně po době 1 měsíce s následným přechodem na aplikaci 1× za tři týdny [2–4].
V podmínkách ČR považujeme za vhodné začít u všech pacientů s uvedenou diagnózou léčebným režimem obsahujícím rituximab. Účinnost rituximabu je dostatečně doložená mnoha publikacemi i posledním shrnutím léčebných možností, které vyšlo v roce 2018 [3, 4]. Rituximab podáváme v stejné dávce jako u lymfomů (375 mg/m2 ) a kombinujeme jej s dexametazonem a cyklofosfamidem, tedy ve stejném schématu jako u Waldenströmovy makroglobulinemie.
V případě nedostatečné účinnosti režimu s rituximabem či časné recidivě pak již volíme léky, které jsou pro naše nemocné snáze dostupné přes paragraf 16, a to jsou IMIDy, thalidomid a méně často lenalidomid. Thalidomid i lenalidomid používáme ve stejném dávkování jako u mnohočetného myelomu. Měli jsme nemocné, jejichž nemoc nereagovala na anti-CD20 protilátku a reagovala na IMIDy a opačně. V případě, že neúčinnosti režimu obsahujícím rituximab v kombinaci s glukokortikoidy a cyklofosfamidem (R-CD) a nereagující na IMIDy, jsme jednou použili bortezomib s dobrým, i když jen dočasným efektem.
Se schválením revizních lékařů lze použít kombinaci rituximabu a IMIDu. S efektem anakinry anebo cyklosporinu nemáme vlastních zkušeností, ale nečetné informace, které jsou o účinnosti těchto dvou léků dostupné, jsou velmi slibné. Léčba anakinrou je zásadně levnější než léčba siltuximabem.
V ČR je dostupná léčba tocilizumabem (RoActemra inj.) v revmatologických indikacích, v případě Castlemanovy nemoci by bylo potřeba požádat o schválení plátce zdravotní péče. Naopak siltuximab, který je sice registrován pro léčbu Castlemanovy nemoci, by se v ČR musel žádat na mimořádný dovoz.
Léčba lokalizované formy Castlemanovy nemoci
Kompletní chirurgická excize je kurativní léčba pro unicentrickou formu nemoci s excelentními dlouhodobými výsledky, bezpříznakové 10leté období se popisuje u 95 % operovaných. Pokud radikální operační léčba není možná, je nutno provést maximální možné operační odstranění tumoru s následnou léčbou medikamenty či radioterapií.
Částečná resekce je alternativou pro velké tumory totálně neodstranitelné. Je možné použít před operací systémovou léčbu, která zmenší ložisko na velikost, kdy již může chirurg provést totální resekci. V této indikaci bylo popsáno neoadjuvantní podání rituximabu před provedením operace [60].
Radioterapie je také alternativa pro neresekovatelná ložiska. Publikovaných zkušeností je relativně málo, literatura obsahuje data 17 pacientů, kteří byli léčeni radioterapií v dávce 40–45 (rozmezí 27–60) Gy. Radioterapie vedla v 35 % k dosažení kompletní remise a v 41 % k dosažení parciální remise [61–72]. Přehled publikovaných zkušeností s radioterapií včetně použitých dávek uvádíme v tabulce 4 jako základ pro zvažování léčby radioterapií. Přehled léčby unicentrické formy uvádí samostatná publikace [71, 72].
Table 4. Shrnutí zkušeností s radioterapií u operačně neodstranitelné unicentrické Castlemanovy nemoci 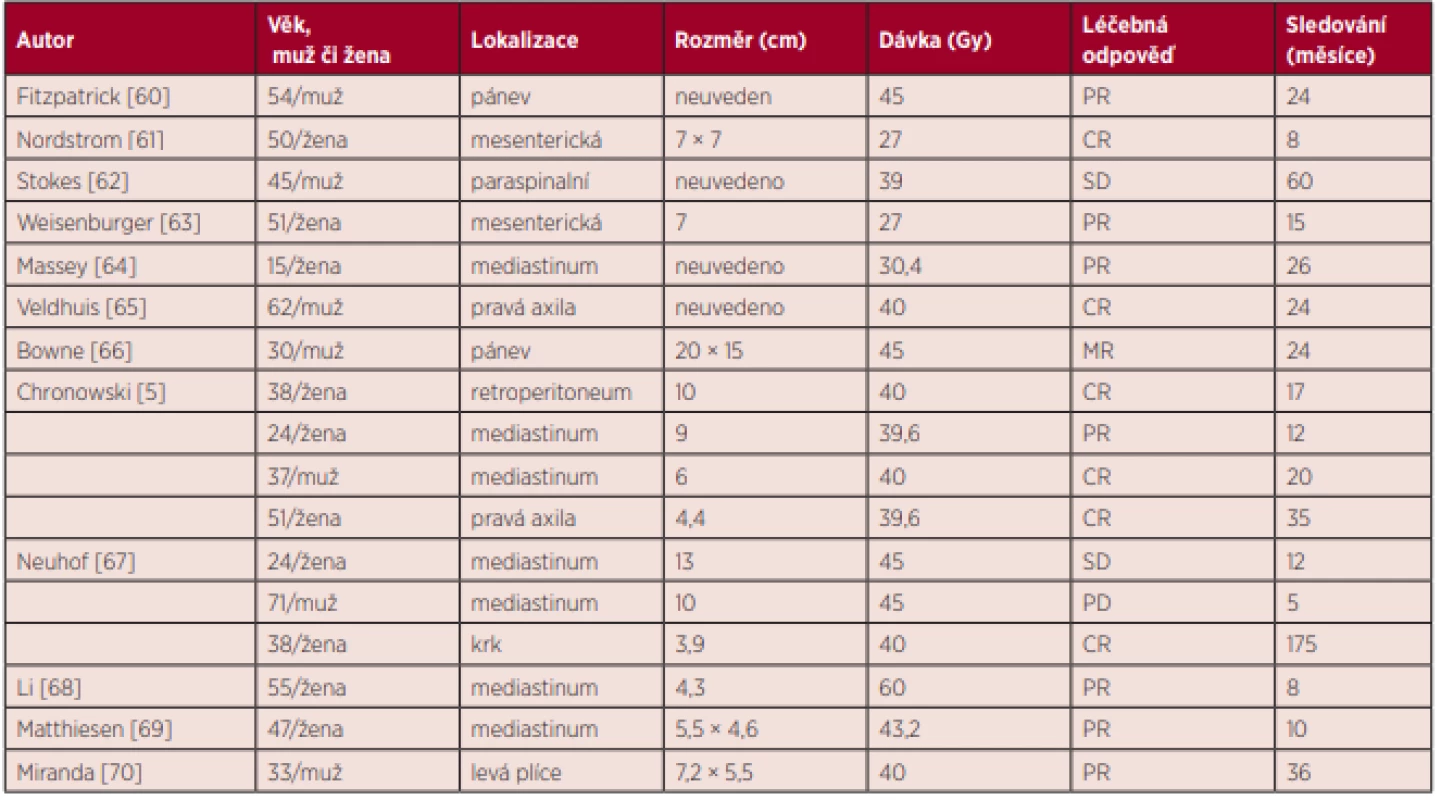
Léčba TAFRO syndromu
- Vysoké dávky glukokortikoidů prednison 1 mg/kg/ den po dva týdny, s následným postupným snižováním dávek, nebo metylprednisolon 500–1000 mg/ den 3 dny po sobě v případě kritického stavu, s následným přechodem na prednison.
- Cyklosporin lze přidat pacientům, kteří jsou buď refrakterní na glukokortikoidy, nebo kteří se stanou na nich dependentní. Počáteční dávka cyklosporinu je 3–5 mg/kg/den rozdělená do dvou denních dávek. Cílem je dosáhnout průměrné hladiny 150–250 ng/ ml. Pokud se v průběhu užívání léku zvýší hladina kreatininu, je třeba redukovat dávku cyklosporinu.
- Glukokortikoidy jsou považovány za lék volby, cyklosporin za lék druhé linie. V případě netolerance či neúčinnosti pak tocilizumab anebo rituximab. Při jejich neúčinnosti pak cyklofosfamid či kombinovaná chemoterapie jako u lymfomů, případně IMIDy [3, 4].
Prognóza
Na Mayo Clinic byla popsána série 113 pacientů. Celkové pětileté přežití (OS) bylo jen 65 % u pacientů s multicentrickou formou nemoci a 91 % s unicentrickou formou nemoci při mediánu sledování 5,8 roku. V průběhu sledování zemřelo 37 pacientů. Nejvíce indolentní průběh byl u pacientů, kteří měli současně i POEMS syndrom s osteosklerotickými ložisky. Tato podskupina měla pětileté OS 90 % [2–4].
Závěry pro praxi
- PET-CT zobrazení je užitečné pro nasměrování odběru uzliny u místa nejvyšší akumulace FDG, ale také pro zjištění rozsahu nemoci i pro hodnocení léčebného efektu.
- Základními léky pro multicentrickou formu Castlemanovy choroby jsou monoklonální protilátka anti-CD20, rituximab (Mabthera), léky ze skupiny IMIDs (thalidomid, lenalidomid) a monoklonální protilátka proti IL-6 (siltuximab) a proti receptoru pro IL-6 (tocilizumab).
- Ve formě popisů případu byla potvrzena účinnost protilátky proti receptoru interleukinu-1 (anakinra). Hypotetické zdůvodnění účinnosti anakinry u této nemoci je blokáda stimulace tvorby interleukinu-6 vlivem blokády interleukinu-1.
- V případě, že nemoc nereaguje na jednu z výše uvedených alternativ, je třeba otestovat další ze jmenovaných léků, protože nemoc nereagující na jeden typ léčby může kompletně ustoupit po jiné léčbě. U některých pacientů nemoc lépe ustupuje po léčbě obsahující IMIDs, zatímco u jiných po léčbě obsahující rituximab a praxe vždy ukáže, který z výše jmenovaných léků je pro konkrétního pacienta optimální.
Podíl autorů na přípravě rukopisu
ZK – napsání první verze, revize rukopisu
Ostatní autoři – připomínkování rukopisu, schválení konečné verze
Čestné prohlášení
Autoři práce prohlašují, že v souvislosti s tématem, vznikem a publikací tohoto článku nejsou ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou.
Do redakce doručeno dne 11. 10. 2019.
Přijato po recenzi dne 16. 12. 2019.
prof. MUDr. Zdeněk Adam, CSc.
Interní hematologická a onkologická klinika LF MU a FN Brno
Jihlavská 25
625 00 Brno
e-mail: adam.zdenek@fnbrno.cz
Sources
1. Adam Z, Volfová P, Ježová M, et al. Castlemanova nemoc, jedna z příčin chronické systémové zánětlivé reakce, někdy i retence tekutin, vaskulitid a poruch imunity. Mezinárodní diagnostická kritéria z roku 2017. Transfuze Hematol dnes 2020;26(2):90–98.
2. Szalat R, Munshi NC. Diagnosis of Castleman disease. Hematol Oncol Clin North Am. 2018;32(1):53–64.
3. van Rhee F, Greenway A, Stone K. Treatment of idiopathic Castleman disease. Hematol Oncol Clin North Am. 2018;32(1):89 – 106.
4. Van Rhee F, Voorhees P, Dispenzieri A, et al. International evidence based consensus treatment guidelines for idiopahtic multicentric Castleman disease. Blood. 2018;132(20):2115–2124.
5. Herrada J, Cabanillas F, Rice L, et al. The clinical behavior of localized and multicentric Castleman disease. Ann Intern Med. 1998;128(8):657–662.
6. Chronowski GM, Ha CS, Wilder RB, et al.Treatment of unicentric and multicentric Castleman disease and the role of radiotherapy Cancer. 2001;92(3):670–676.
7. Zhu SH, Yu YH, Zhang Y, et al. Clinical features and outcome of patients with HIV-negative multicentric Castleman‘s disease treated with combination chemotherapy: a report on 10 patients. Med Oncol. 2013;30(1):492–498.
8. Liu AY, Nabel CS, Finkelman BS, et al. Idiopathic multicentric Castleman‘s disease: a systematic literature review. Lancet Haematol. 2016;3(4):e163–e175.
9. Peker D, Martinez AE, Schwartz MA, et al. Complete remission in 4 patients with human herpesvirus 8-associated multicentric Castleman disease using rituximab and liposomal doxorubicin, a novel chemotherapy combination. Clin Adv Hematol Oncol. 2012;10(3):204–206.
10. Hoffmann C, Schmid H, Müller M, et al. Improved outcome with rituximab in patients with HIV-associated multicentric Castleman disease. Blood. 2011;118(13):3499–3503.
11. Fragasso A, Mannarella C, Ciancio A, et al. Complete remission and virologic response to combined chemoimmunotherapy (R-CVP) followed by rituximab maintenance in HIV-negative, HHV-8 positive patient with multicentric Castleman disease. Leuk Lymphoma. 2008;49(11):2224–2226.
12. Casquero A, Barroso A, Fernández Guerrero ML. Use of rituximab as a salvage therapy for HIV-associated multicentric Castleman disease. Ann Hematol. 2006;85(3):185–187.
13. Ide M, Kawachi Y, Izumi Y, et al. Long-term remission in HIVnegative patients with multicentric Castleman‘s disease using rituximab. Eur J Haematol. 2006;76(2):119–123.
14. Powles T, Stebbing J, Montoto S, et al. Rituximab as retreatment for rituximab pretreated HIV-associated multicentric Castleman disease. Blood. 2007;110(12):4132–4133.
15. Bestawros A, Michel R, Séguin C, Routy JP. Multicentric Castleman‘s disease treated with combination chemotherapy and rituximab in four HIV-positive men: a case series. Am J Hematol. 2008;83(6):508–511.
16. Buchler T, Dubash S, Lee V, et al. Rituximab failure in fulminant multicentric HIV/human herpesvirus 8-associated Castleman‘s disease with multiorgan failure: report of two cases. AIDS. 2008;22(13):1685–1687.
17. Bower M, Veraitch O, Szydlo R, et al. Cytokine changes during rituximab therapy in HIV-associated multicentric Castleman disease. Blood. 2009;113(19):4521–4540.
18. Mian H, Leber B. Mixed variant multicentric Castleman disease treated with rituximab: case report. J Pediatr Hematol Oncol. 2010;32(8):622.
19. Lee JP, Kim DK, Oh DY, Successfully treated multicentric Castleman‘s disease with renal thrombotic microangiopathy using rituximab and corticosteroid. Clin Nephrol. 2011;75(2):165–170.
20. Gérard L, Bérezné A, Galicier L, et al. Prospective study of rituximab in chemotherapy-dependent human immunodeficiency virus associated multicentric Castleman‘s disease: ANRS 117 CastlemaB Trial. J Clin Oncol. 2007;25(22):3350–3356.
21. Gérard L, Michot JM, Burcheri S, et al. Rituximab decreases the risk of lymphoma in patients with HIV-associated multicentric Castleman disease. Blood. 2012;119(10):2228–2233.
22. Ramasamy K, Gandhi S, Flowers MT, et al. Rituximab and thalidomide combination therapy for Castleman disease. Brit J Haematol. 2012;158 : 415–429.
23. Stary G, Kohrgruber N, Herneth AM, et al. Complete regression of HIV-associated multicentric Castleman disease treated with rituximab and thalidomide. AIDS. 2008;22(10):1232–1234.
24. Lee FC, Merchant SH. Alleviation of systemic manifestations of multicentric Castleman‘s disease by thalidomide. Am J Hematol. 2003;73 : 48–53.
25. Starkey CR, Joste NE, Lee FC. Near-total resolution of multicentric Castleman disease by prolonged treatment with thalidomide. Am J Hematol. 2006;81 : 303–304.
26. Kim SY, Lee SA, Ryoo HM, et al. Thalidomide for POEMS syndrome. Ann Hematol. 2006;85 : 545–546.
27. Wang X, Ye S, Xiong C, et al. Successful treatment with bortezomib and thalidomide for POEMS syndrome associated with multicentric mixed-type Castleman‘s disease. Jpn J Clin Oncol 2011;41(10):1221 – 1224.
28. Menegato MA, Canelles MF, Tonutti E, et al. Remission of nephrotic syndrome after thalidomide therapy in a patient with Castleman‘s disease. Clin Nephrol. 2004;61 : 352–356.
29. Miltenyi Z, Toth J, Gonda A, et al. Successful immunomodulatory therapy in castleman disease with paraneoplastic pemphigus vulgaris. Pathol Oncol Res. 2009;15 : 375–381.
30. Zhao X, Shi R, Jin X, Zheng J. Diffuse hyperpigmented plaques as cutaneous manifestation of multicentric Castleman disease and treatment with thalidomide: report of three cases. J Am Acad Dermatol. 2011;65(2):430–432.
31. Jung CP, Emmerich B, Goebel FD, et al. Successful treatment of a patient with HIV-associated multicentric Castleman disease (MCD) with thalidomide. Am J Hematol. 2004;75 : 176–177.
32. Yoshizaki K, Murayama S, Ito H, et al. The role of interleukin-6 in Castleman disease. Hematol Oncol Clin North Am. 2018;32(1):23–36.
33. Hess G, Wagner V, Kreft A, et al. Effects of bortezomib on proinflamatory cytokine levels and transfusion dependency in patient with multicentric Castleman disease. Brit J Haematol. 2006;134 : 602–605.
34. Sobas MA, Alonso Vence N, Diaz Arias J, et al. Efficacy of bortezomib in refractory form of multicentric Castleman disease associated to POEMS syndrome (MCD-POEMS variant). Ann Hematol. 2010;89(2):217–219.
35. Galeotti C, Boucheron A, Guillaume S, et al. Sustained remission of multicentric Castleman disease in children treated with tocilizumab, an anti-interleukin-6 receptor antibody. Mol Cancer Ther. 2012;11(8):1623–1626.
36. Yuzuriha A, Saitoh T, Koiso H, Mitsui T, et al. Successful treatment of autoimmune hemolytic anemia associated with multicentric Castleman disease by anti-interleukin-6 receptor antibody (tocilizumab) therapy. Acta Haematol. 2011;126(3):147–150.
37. Higuchi T, Nakanishi T, Takada K, et al. A case of multicentric Castleman‘s disease having lung lesion successfully treated with humanized anti-interleukin-6 receptor antibody, tocilizumab. J Korean Med Sci. 2010;25(9):1364–1367.
38. Arita Y, Sakata Y, Sudo T, et al. The efficacy of tocilizumab in a patient with pulmonary arterial hypertension associated with Castleman‘s disease. Heart Vessels. 2010;25(5):444–447.
39. Song SN, Tomosugi N, Kawabata H, et al. Down-regulation of hepcidin resulting from long-term treatment with an anti-IL-6 receptor antibody (tocilizumab) improves anemia of inflammation in multicentric Castleman disease. Blood. 2010;116(18):3627–3634.
40. Nishimoto N, Terao K, Mima T, et al. Mechanisms and pathologic significances in increase in serum interleukin-6 (IL-6) and soluble IL-6 receptor after administration of an anti-IL-6 receptor antibody, tocilizumab, in patients with rheumatoid arthritis and Castleman disease. Blood. 2008;112(10):3959–3964.
41. Williams SC. First IL-6-blocking drug nears approval for rare blood disorder. Nat Med. 2013;19(10):1193.
42. Robey RC, Mletzko S, Colley C, et al. The use of monoclonal antibodies to treat Castleman‘s disease. Immunotherapy. 2014;6(2):211 – 219.
43. Nagai K, Ueda A, Yamagata K. Successful use of tocilizumab in a case of multicentric Castleman‘s disease and end-stage renal disease. Ther Apher Dial. 2014;18(2):210–211.
44. Man L, Goudar RK. Reversal of cardiomyopathy with tocilizumab in a case of HIV-negative Castleman‘s disease. Eur J Haematol. 2013;91(3):273–276.
45. Fajgenbaum DC, Shilling D. Castleman disease pathogenesis. Hematol Oncol Clin North Am. 2018;32(1):11-21.
46. Otani N, Morishita Y, Oh I, et al. Successful treatment of a mesangial proliferative glomerulonephritis with interstitial nephritis associated with Castleman‘s disease by an anti-interleukin-6 receptor antibody (tocilizumab). Intern Med. 2012;51(11):1375–1378.
47. Liu YC, Stone K, van Rhee F. Siltuximab for multicentric Castleman disease. Expert Rev Hematol. 2014;7(5):1–13.
48. van Rhee F, Fayad L, Voorhees P, et al. Siltuximab, a novel anti - -interleukin-6 monoclonal antibody, for Castleman‘s disease. J Clin Oncol. 2010;28(23):3701–37028.
49. Kurzrock R, Voorhees PM, Casper C, et al. A phase I, open-label study of siltuximab, an anti-IL-6 monoclonal antibody, in patients with B-cell non-Hodgkin lymphoma, multiple myeloma, or Castleman disease. Clin Cancer Res. 2013;19(13):3659–3670.
50. Van Rhee F, Wong RS, Munshi N, et al. Siltuximab for multicentric Castleman´s disease. A randomized double blind placebo controlled trial. Lancet Oncol. 2014;15(9):966–974.
51. Van Rhee F, Casper C, Voorhees PM, et al. Phase 2 open labaled multicenter study of long term safety of siltuximab in patients with multicentric Castleman´s disease. Oncotarget. 2015;6(30):30408–30419.
52. Galeotti C, Tran TA, Franchi-Abella S, et al. IL-1RA agonist (anakinra) in the treatment of multifocal castleman disease: case report. J Pediatr Hematol Oncol. 2008;30(12):920–924.
53. El-Osta H, Janku F, Kurzrock R. Successful treatment of Castleman‘s disease with interleukin-1 receptor antagonist (Anakinra). Mol Cancer Ther. 2010;9(6):1485–1488.
54. Jouvray M, Terriou L, Meignin V, et al. Pseudo-adult Still‘s disease, anasarca, thrombotic thrombocytopenic purpura and dysautonomia: An atypical presentation of multicentric Castleman‘s disease. Discussion of TAFRO syndrome. Rev Med Interne. 2016;37(1):53–57.
55. Yamaga Y, Tokuyama K, Kato T, et al. Successful treatment with cyclosporin A in tocilizumab-resistant TAFRO syndrome. Intern Med. 2016;55(2):185–190.
56. Inoue M, Ankou M, Hua J, et al. Complete resolution of TAFRO syndrome (thrombocytopenia, anasarca, fever, reticulin fibrosis and organomegaly) after immunosuppressive therapies using corticosteroids and cyclosporin A: a case report. J Clin Exp Hematop. 2013;53(1):95–99.
57. Repetto L, Jaiprakash MP, Selby PJ, et al. Aggressive angiofollicular lymph node hyperplasia (Castleman‘s disease) treated with high dose melphalan and autologous bone marrow transplantation. Hematol Oncol. 1986;4(3):213–217.
58. Ganti AK, Pipinos I, Culcea E, et al. Successful hematopoietic stem - -cell transplantation in multicentric Castleman disease complicated by POEMS syndrome. Am J Hematol. 2005;79(3):206–210.
59. Tal Y, Haber G, Cohen MJ, et al. Autologous stem cell transplantation in a rare multicentric Castleman disease of the plasma cell variant. Int J Hematol. 2011;93(5):677–680.
60. Bandera B, Ainsworth C, Shikle J, et al. Treatment of unicentric Castleman disease with neoadjuvant rituximab. Chest. 2010; 138(5):1239–1241.
61. Fitzpatrick PJ, Brown TC. Angiofollicular lymph node hyperplasia. Can Med Assoc J. 1968;99(25):1259–1262.
62. Nordstrom DG, Tewfik HH, Latourette HB. Plasma cell giant lymph node hyperplasia responding to radiation therapy. Am J Roentgenol. 1978;130(1):169–171.
63. Stokes SH, Griffith RC, Thomas PR. Angiofollicular lymph node hyperplasia (Castleman’s disease) associated with vertebral destruction. Cancer. 1985;56(4):876–879.
64. Weisenburger DD, DeGowin RL, Gibson P, Armitage JO. Remission of giant lymph node hyperplasia with anemia after radiotherapy. Cancer. 1979;44(2):457–462.
65. Massey GV, Kornstein MJ, Wahl D, et al. Angiofollicular lymph node hyperplasia (Castleman’s disease) in an adolescent female. Clinical and immunologic findings. Cancer. 1991;68(6):1365–1372.
66. Veldhuis GJ, van der Leest AH, et al. A case of localized Castleman’s disease with systemic involvement: treatment and pathogenetic aspects. Ann Hematol. 1996;73(1):47–50.
67. Bowne WB, Lewis JJ, Filippa DA, et al. The management of unicentric and multicentric Castleman’s disease: a report of 16 cases and a review of the literature. Cancer. 1999;85(3):706–717.
68. Neuhof D, Debus J. Outcome and late complications of radiotherapy in patients with unicentric Castleman disease. Acta Oncol. 2006;45(8):1126–1131.
69. Li YM, Liu PH, Zhang YH, et al. Radiotherapy of unicentric mediastinal Castleman’s disease. Chin J Cancer. 2011;30(5):351–356.
70. Matthiesen C, Ramgopol R, Seavey J, et al. Intensity modulated radiation therapy (IMRT) for the treatment of unicentric Castlemans disease: a case report and review of the use of radiotherapy in the literature. Radiol Oncol. 2012;46(3):265–270.
71. Miranda FA, Faria VH, Arruda GV, Silva LG. Radiation therapy in the treatment of unicentric Castleman’s disease. J Bras Pneumol. 2013;39(1):116–118.
72. Wong RSM. Unicentric Castleman disease. Hematol Oncol Clin North Am. 2018;32(1):65–73.
Labels
Haematology Internal medicine Clinical oncology
Article was published inTransfusion and Haematology Today

2020 Issue 3-
All articles in this issue
- COVID-19 a transfuzní služba v ČR
- Regenerující krvetvorba se podobá embryonální krvetvorbě nezávislé na kmenových buňkách
- Příznaky a projevy Erdheimovy-Chesterovy choroby
- Aktuální pohled na léčbu nově diagnostikovaných nemocných s periferními T-lymfomy a novinky v této oblasti s důrazem na využití brentuximab vedotinu
- Léčba multicentrické a unicentrické formy Castlemanovy nemoci
- Tematizace problémů komplexní péče z perspektivy osob s hemofilií
- Charakteristika a výsledky léčby mladších nemocných s akutní myeloidní leukemií pod 60 let: Analýza reálných dat z české databáze DATOOL-AML
- Vzácné kožní změny asociované s monoklonální gamapatií: skleredém, skleromyxedém a IgA pemfigus – popis pěti případů a přehled léčebných možností
- Doporučený postup pro použití rekonvalescentní plazmy v léčbě dospělých pacientů s COVID-19
- Doporučený postup při řešení a vyšetřování potransfuzních reakcí
- Konsenzuální doporučení Českého národního hemofilického programu (ČNHP) pro zajištění chirurgických a invazivních výkonů u pacientů s hemofilií, vydání 2., rok 2020
- Hodnocení znalosti transfuzního lékařství u lékařů po promoci v Turecku
- Transfusion and Haematology Today
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Příznaky a projevy Erdheimovy-Chesterovy choroby
- Doporučený postup při řešení a vyšetřování potransfuzních reakcí
- Charakteristika a výsledky léčby mladších nemocných s akutní myeloidní leukemií pod 60 let: Analýza reálných dat z české databáze DATOOL-AML
- Aktuální pohled na léčbu nově diagnostikovaných nemocných s periferními T-lymfomy a novinky v této oblasti s důrazem na využití brentuximab vedotinu
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

