-
Medical journals
- Career
Současnost a budoucnost alternativních zdrojů hematopoetických buněk včetně pupečníkové krve. Perspektivy bank pupečníkové krve. Závěry Panelu expertů
Authors: P. Cetkovský 1; Z. Kořístek 2; J. Starý 3; J. Štěrba 4; P. Žák 5
Authors‘ workplace: Ústav hematologie a krevní transfuze, Praha 1; Klinika hematoonkologie, Fakultní nemocnice Ostrava, Ostrava 2; Klinika dětské hematologie a onkologie, Fakultní nemocnice Motol, Praha 3; Klinika dětské onkologie, Fakultní nemocnice Brno, Brno 4; IV. interní hematologická klinika, FN Hradec Králové, Hradec Králové 5
Published in: Transfuze Hematol. dnes,22, 2016, No. 3, p. 210-223.
Category: Comprehensive Reports, Original Papers, Case Reports
Overview
Většina pacientů, kteří jsou indikováni k alogenní transplantaci krvetvorných buněk, nemá k dispozici HLA identického sourozence. Až pro 25 % těchto pacientů není k dispozici ani shodný nepříbuzný dárce. Tito pacienti jsou kandidáti pro transplantace s využitím dárců alternativních: haploidentických rodinných dárců, neshodných nepříbuzných dárců a pupečníkové krve. Díky alternativním dárcům lze nabídnout alogenní transplantaci téměř každému pacientovi, u kterého je indikována. Jednotlivé typy alternativních dárců mají svoje výhody a nevýhody, medicínské i ekonomické. Cílem této práce bylo přinést srovnání jednotlivých alternativních dárců. Nelze také pominout, že v posledních letech došlo díky metodě podávání potransplantačního cyklofosfamidu k významnému rozšíření haploidentických transplantací a změně trendů využívání alternativních zdrojů krvetvorných buněk. Význam pupečníkové krve postupně klesá, což ovlivňuje postavení a ekonomickou situaci veřejných bank pupečníkové krve. Předkládané závěry panelu expertů se proto rovněž věnují budoucnosti využívání pupečníkové krve a jsou diskutovány různé koncepty bank pupečníkové krve.
KLÍČOVÁ SLOVA:
hematopoetické buňky – alogenní transplantace – alternativní dárci – haploidentická transplantace – nepříbuzný dárce – HLA – pupečníková krev – banka pupečníkové krve – hybridní banka
Důvody pozvání odborníků do Panelu expertů (PE) k tématu „Budoucnost transplantací hematopoetických buněk z alternativních zdrojů a využití pupečníkové krve v hematologii; budoucnost koexistence veřejných a privátních bank pupečníkové krve“.
Klinická denní praxe při provádění transplantací hematopoetických buněk (hematopoietic cell transplantation, HCT) z alternativních zdrojů se liší mezi jednotlivými centry; hematolog je zatím ponechán při rozhodování jen na zvyklostech, zkušenostech, historii, druhu nemocných či finančních možnostech daného centra, stejně jako na praxi či osobních preferencích. Důvodem je určitá absence studií porovnávající jednotlivé metody navzájem (jsou prováděny, ale zatím nebyly všechny ukončeny a publikovány) a klinický hematolog může být často při rozhodnutí, jaký použít alternativní zdroj hematopoetických buněk, se současnými znalostmi v rozpacích. Ředitel ÚHKT proto svolal PE, složený z některých předních tuzemských odborníků v problematice transplantací krvetvorných buněk u pediatrických či dospělých pacientů: prof. MUDr. Jan Starý, DrSc., prof. MUDr. Jaroslav Štěrba, Ph.D., doc. MUDr. Pavel Žák, Ph.D., MUDr. Zdeněk Kořístek, Ph.D., prof. MUDr. Petr Cetkovský, Ph.D. Úkolem PE bylo vyjádřit se ke dvěma okruhům problémů:
1. Budoucnost HCT od alternativních dárců se zdůrazněním výhod a nevýhod jednotlivých zdrojů
V případě, že neexistuje ideální HLA shodný dárce (příbuzný či nepříbuzný), tak stále není jasné, jaký zdroj hematopoetických buněk (hematopoietic cells, HC) vybrat pro nemocného indikovaného k alogenní HCT. K dispozici jsou následující druhy štěpů HC: akceptovatelně neshodný nepříbuzný dobrovolník z registru, haploidentický příbuzný dárce (obvykle potomek či rodič) nebo dopředu připravený kryokonzervovaný štěp pupečníkové krve z veřejných bank pupečníkové krve.
Může proto dojít k situaci, kdy je nemocný s akutní myeloidní leukemií (AML) s vysokým rizikem bez HLA vhodného dárce (u něhož je alogenní HCT jedinou kurativní metodou) léčen ve třech podobných centrech naprosto rozdílně. V jednom transplantačním centru je využita haploidentická (haplo) HCT, v odlišném centru bude transplantován od akceptovatelně HLA neshodného nepříbuzného dárce, zatímco v některých centrech budou jako zdroj HC použity buňky z pupečníkové krve (umbilical cord blood, UCB).
Každý tento postup má svoje výhody i nevýhody (odborné, finanční, etické i další aspekty) a tento PE má pomoci odpovědět na většinu problémů, které se v denní praxi objevují. Po každé z těchto metod dojde v případě úspěšné HCT k lymfo-hematopoetické rekonstituci, ale jednotlivé metody se liší podle rychlosti a kvality engraftmentu, ve frekvenci selhání štěpu, v incidenci relapsů, nemoci z reakce štěpu proti hostiteli (GvHD) či mortality metody (především z důvodů infekcí).
2. Současnost a budoucnost veřejných bank pupečníkové krve a jejich koexistence s privátními bankami pupečníkové krve
V minulosti byly zakládány po celém světě veřejné banky UCB pro alogenní použití u hematologických nemocných. Současně vznikaly i privátní banky pupečníkové krve, které ale mají naprosto jiný cíl: uskladnění UCB pro autologní použití v budoucnosti, se zatím nejasným účelem, pravděpodobně v rámci regenerativní medicíny. Po dvaceti letech úspěšného využívání UCB pro HCT začalo u dospělých pacientů docházet k poměrně dramatickému poklesu počtu transplantací UCB. Důsledkem jsou finanční potíže naprosté většiny veřejných bank UCB, protože jejich provozní a fixní náklady stále stoupají, ale příjmy z vydaných štěpů v posledních letech trvale klesají. Existence veřejných bank UCB začala být na základě neúprosných ekonomických zákonitostí ohrožena. V této situaci se objevily nové modely fungování bank UCB a v současné době jsme však svědky toho, že nastává období spolupráce veřejných a privátních bank UCB, těchto původně naprosto nesmiřitelných a nepřátelských světů. Tato problematika je druhým tématem, ke kterému se měl PE vyjádřit.
Závěry a očekávání od doporučení Panelu expertů
Při snaze co nejlépe poradit našim nemocným (a jejím blízkým) není finální rozhodnutí se současnými poznatky jednoduché. Vždy se musí brát v úvahu základní diagnóza, rizikovost choroby a její stav před HCT, všechny další parametry nemocného i štěpů přicházejících v úvahu a podle těchto parametrů vybrat typ štěpu současně s předtransplantační přípravou, stejně jako potransplantační imunosupresivní strategií. Přestože se výsledky HCT se štěpem z alternativních zdrojů v posledním období výrazně zlepšily, tak zbývá ještě mnoho věcí objevit, aby se tyto transplantace dostaly na úroveň HCT od HLA shodných dárců. Závěry PE tak by mohly pomoci v rozhodování těm, kteří se zabývají problematikou HCT od alternativních dárců.
Petr Cetkovský
ÚVOD
Alogenní transplantace krvetvorných buněk (hematopoietic cell transplantation, HCT) je využívána k léčbě vysoce rizikových maligních onemocnění krvetvorby, selhání kostní dřeně, vrozených těžkých imunodeficiencí a některých vrozených poruch metabolismu. HLA identický sourozenec je obvykle k dispozici pro méně než 30 % pacientů indikovaných k HCT [1]. Díky pokroku v časné diagnostice potransplantačních komplikací a v podpůrné léčbě jsou výsledky HCT s použitím transplantátů krvetvorných buněk (hematopoietic cells, HC) od HLA identických sourozenců a od shodných nepříbuzných dárců (matched unrelated donor, MUD) v současnosti srovnatelné. Vyššímu výskytu závažné reakce štěpu proti hostiteli (graft-versus-host disease, GvHD) po HCT od nepříbuzných dárců lze do značné míry předcházet intenzivnější imunosupresí, i když má za následek pomalejší imunologickou rekonstituci provázenou častějšími infekčními, zejména virovými komplikacemi. HCT od nepříbuzných dárců tak v tomto ohledu zůstává nadále náročnější a nákladnější léčbou s porovnání s HCT od HLA identického sourozence. Důsledkem prudkého rozvoje molekulární diagnostiky HLA systému a expanzivního nárůstu počtu dobrovolných dárců v registrech během posledních 10 letech je pravděpodobnost asi 75 % na nalezení HLA shodného (8/8) nepříbuzného dárce pro pacienty kavkazské rasy a evropského původu. Pacienti jiného původu mají podle NMDP (National Marrow Donor Program) výrazně horší šanci na nalezení MUD, u pacientů bílé rasy původem ze Středního východu a severní Afriky jde o 46 %, u Afroameričanů černé rasy je pravděpodobnost nalezení MUD menší než 20 % a pro ostatní skupiny pacientů různého původu 27–52 % [2]. Z uvedených dat vyplývá, že téměř 20 % pacientů kavkazské rasy a většina nemocných jiného etnického původu nemá k dispozici HLA identického nebo nepříbuzného shodného dárce. Léčebnou alternativou pro tyto nemocné je HCT od alternativních dárců, mezi které řadíme neshodné nepříbuzné dárce (miss-matched unrelated donors, MMUD), pupečníkovou krev (umbilical cord blood, UCB) a haploidentické rodinné dárce (rodič, sourozenec nebo potomek sdílející s příjemcem jeden haplotyp). S využitím alternativních zdrojů HC lze nabídnout alogenní HCT v podstatě téměř každému pacientovi, u kterého je indikována. V případě pupečníkové krve se uvádí, že ve Spojených státech je k dispozici pro 80 % dospělých a 95 % pediatrických pacientů jakékoli etnicity pupečníková krev se shodou ≥ 4/6 [2]. Pokud uvažujeme o haploidentickém příbuzném dárci, tak je nedostupný jen ve výjimečných případech. Úspěšnost a četnost haploidentických HCT se zásadně změnily se zavedením časné aplikace cyklofosfamidu po převodu transplantátu. Tuto metodu potransplantačního cyklofosfamidu (PTCy) zavedla do praxe skupina z Johns Hopkins Medical Institutions s cílem zredukovat výskyt a závažnost GvHD po haploidentických HCT (haplo HCT). Používání PTCy vedlo k významnému zjednodušení haplo HCT a rychlému rozšíření tohoto typu HCT, kromě toho také došlo k významnému snížení nákladů na provedení haplo HCT, protože odpadla nutnost manipulace s transplantátem (selekce CD34+ buněk apod.) [3]. V dalším textu se budeme zabývat pouze haplo HCT s podáním PTCy, bez manipulace s transplantátem.
V současnosti stále ještě není všeobecná shoda, jaký zdroj HC pro nemocného indikovaného k HCT zvolit v případě, když HLA identický nebo shodný dárce k dispozici není. Každý alternativní zdroj HC má svoje výhody i nevýhody, které jsou odborného, finančního či etického charakteru. Cílem této práce je přinést srovnání jednotlivých alternativních zdrojů HC pro alogenní HCT, informovat o posledních trendech ve využívání alternativních zdrojů HC a konečně se také zamyslet nad budoucností využívání pupečníkové krve a nad vývojem v oblasti bank pupečníkové krve.
POTRANSPLANTAČNÍ PRŮBĚH A VÝSLEDKY HCT PŘI VYUŽITÍ ALTERNATIVNÍCH DÁRCŮ
Jednotlivé typy transplantátů se liší v celkové buněčnosti, obsahu krvetvorných buněk a T-lymfocytů, v případě UCB je navíc nutno počítat s dodatečnými ztrátami buněk a určitým poklesem jejich viability, což je způsobeno zpracováním, kryoprezervací a rozmražením. Parametry transplantátů a míra shody v HLA ovlivňují zejména rychlost obnovy krvetvorby, incidenci selhání štěpů, resp. jejich rejekce, výskyt a závažnost GVHD. Vše se dále promítá do celkových léčebných výsledků, které je možno popsat hodnotami peritransplantační mortality (TRM, transplant-related mortality), délkou celkového přežití (OS, overall survival), mortalitou v remisi základního onemocnění (NRM, non-relapse mortality) a přežitím bez relapsu (EFS, event-free survival).
Riziko selhání štěpu se pro MMUD uvádí okolo 10 %, přičemž při použití kostní dřeně je výrazně vyšší (16 %) než při použití periferních HC (3 %). S ohledem na zvyšující se podíl periferních HC u nepříbuzných dárců se celková pravděpodobnost rizika selhání MMUD štěpů snižuje [4, 5]. Pro haplo HCT s PTCy dostupné práce uvádí 10 % riziko selhání štěpu v případě myeloablativních přípravných režimů [6] a až 13 % u přípravných režimů s redukovanou intenzitou [3]. UCB obsahuje řádově 10krát méně HC než jiné typy transplantátů, počet CD34+ buněk v UCB transplantátech se pohybuje mezi 0,7 až 1,2 x 105/kg hmotnosti příjemce. Výrazně nižší je oproti jiným zdrojům HC také počet T-lymfocytů, které mají protektivní efekt proti rejekci štěpu [5, 7, 8]. Četnost selhání štěpů UCB u dospělých pacientů, resp. u pacientů s hmotností nad 30 kg, je proto nejvyšší a dosahuje v případě přípravných režimů s redukovanou intenzitou až 10 % [9, 10, 11], po myeloablativních přípravných režimech 20 % [5, 7]. Vedle CD34+ buněk se kvalita štěpů UCB odvozuje od počtu jaderných buněk (TNC, total nucleated cells) v transplantátu před zamražením. Z analýz vyplynulo, že optimální je podat více než 2,5 x 107 TNC/kg hmotnosti příjemce, transplantace štěpy obsahujícími méně TNC než 1,8 x 107/kg výrazně zvyšuje pravděpodobnost selhání štěpu a zvyšuje TRM [12, 13]. Transplantace pomocí UCB obsahujícími méně než 1,7 x 105 CD34+ buněk/kg byly zatíženy až 68% TRM, vyšší dávka CD34+ buněk vedla ke snížení TRM na 29 % [14]. K zásadnímu snížení TRM po UCB HCT vedla technika současné transplantace dvou jednotek UCB (double UCB transplantace) u pacientů, u kterých primární UCB obsahovala méně jak 2,5 x 107 TNC/kg hmotnosti. Uvedený postup se osvědčil a umožnil bezpečné transplantace UCB u dospělých pacientů. Významné zlepšení výsledků double UCB transplantací bylo potvrzeno řadou publikací, které doložily zásadní snížení TRM a incidence relapsů, i když za cenu vyššího výskytu závažnější akutní GvHD [15, 16, 17]. Double UCB HCT se rychle rozšířily a z dat evidovaných americkým transplantačním registrem (CIBMTR, Center for International Blood and Marrow Transplant Research) vyplývá, že v posledním desetiletí byly v USA podány dva štěpy UCB u přibližně 80 % dospělých pacientů, příjemců UCB [18]. V dalším textu budeme proto vycházet z novějších prací, ve kterých byly uvedené požadavky na adekvátní buněčnost UCB zohledněny.
Pokud se týká rychlosti přihojení, doba do restituce granulocytů a trombocytů se podstatněji neliší u transplantací od MMUD, MUD a HLA identických příbuzných dárců [19]. Více záleží na zdroji HC, protože platí, že přihojení v neutrofilních granulocytech je v průměru o pět dnů (medián) rychlejší po převodu periferních HC ve srovnání s transplantací kostní dřeně. Po haplo HCT s PTCy nedochází k významnému oddálení přihojení a koncentrace granulocytů nad 0,5 x 109/l je dosahována v mediánu 16 dnů [9]. Naproti tomu, při použití UCB je nutno počítat s významným prodloužením doby potřebné k obnově krvetvorby. Scaradavou et al. [18] sice uvádí u transplantací UCB s dávkou TNC více jak 2,5 x 107/kg (single nebo double UCB transplantace) dosažení koncentrace granulocytů 0,5 x 109/l v mediánu 20 dnů, ale pravděpodobnost přihojení v granulocytech do dne +42 byla jen 78 % (double UCB), resp. 81 % (single UCB). Z analýzy UCB transplantací u dospělých, provedených v Evropě v letech 2000–2014, vyplynuly podobné údaje, tedy medián doby do přihojení v granulocytech 23 dnů [20]. Stejný výsledek, tedy medián 23 dnů do přihojení granulocytů, uvádí rovněž Wagner et al. [14], ale pouze u pacientů, kteří dostali UCB obsahující více než 1,7 x 105 CD34+ buněk/kg; pokud UCB obsahovala méně CD34+ buněk, tak k restituci granulocytů docházelo v mediánu 34 dnů.
Přihojení v trombocytech, tedy první den z nejméně dvou, kdy dojde ke spontánnímu vzestupu (bez předchozí substituce) koncentrace trombocytů nad 20 x 109/l, je po převodu periferních HC o sedm dnů rychlejší (medián) ve srovnání s transplantací kostní dřeně [4]. Po haplo HCT s PTCy je medián přihojení v trombocytech 24 dnů (1-92) od převodu štěpu [9], po UCB je uváděna střední doba potřebná k přihojení trombocytů 46 dnů (single UCB), resp. 55 dnů (double UCB) [18]. Další vzestup koncentrace trombocytů je po UCB transplantacích rovněž zpomalený, koncentrace 50 x 109/l je dosahována v mediánu 86 dnů a třetina pacientů má trombocytopenii pod 50 x 109/l ještě 6 měsíců po HCT [14].
Celkové výsledky transplantační léčby s použitím HC od MUD, MMUD a UCB byly porovnávány v několika retrospektivních studiích [21–25]. Většinou byly hodnoceny výsledky u pacientů indikovaných k HCT pro akutní myeloidní leukemii (AML) a jednalo se o dospělé pacienty nebo pacienty od 10 let věku, což odpovídá hmotnosti příjemce 30 kg a více. Tyto studie shodně ukázaly, že UCB transplantace měly ve srovnání s jinými typy HCT vyšší TRM i NRM, což vyústilo v kratší OS ve srovnání s jinými typy dárců, rozdíl však nebyl vždy statisticky významný. Na těchto výsledcích se jistě podílela také opožděná lymfoimunologická rekonstituce a vyšší výskyt závažných infekcí v prvních 3 měsících po transplantacích UCB [26]. Na druhé straně, nižší počet T-lymfocytů v UCB vedl k menší incidenci akutní formy GvHD (aGvHD) v porovnání s HCT od MMUD a MUD, což ale neplatilo pro těžkou aGvHD stupně 3–4. Podobně byl po UCB nejnižší výskyt chronických forem GvHD (cGvHD), i když rozdíly nebyly vždy statisticky významné [21–25]. Granier et al. [27] porovnali léčebné výsledky 344 HCT u dospělých, kdy zdrojem štěpu byla u 64 pacientů UCB, u 84 pacientů MMUD 9/10 a u 196 pacientů MUD 10/10. Z multivariantní analýzy vyplynulo, že použití UCB bylo spojeno s nižším výskytem aGvHD stupně 2–4, incidence cGvHD se mezi jednotlivými typy HCT nelišila. Medián OS byl nejdelší u MUD HCT, nebyl však zjištěn statisticky významný rozdíl mezi UCB a MMUD v OS, incidenci relapsů a NRM. Brunstein et al. [28] shodně uvádí v prvních 100 dnech po HCT signifikantně vyšší výskyt aGvHD u MMUD (85 %) ve srovnání s UCB (53 %), přičemž výskyt těžkých forem aGvHD stupně 3–4 se mezi MMUD a UCB nelišil. Výskyt cGvHD do 2 let po HCT byl statisticky významně vyšší po MMUD v porovnání s UCB (48 % vs 26 %). Je ale vhodné zdůraznit, že výskyt GvHD po MMUD transplantacích se výrazně snížil po zařazení antithymocytárního globulinu (ATG) do předtransplantačního přípravného režimu. Incidence aGvHD stupně 2–4 po MMUD transplantacích klesla při kombinaci kalcineurinových imunosupresiv a ATG přibližně na polovinu, tedy na 30–40 % [29–31].
Podobně se ukázalo, že podávání PTCy po haplo HCT je až nečekaně efektivní a incidence aGvHD po převodu jinak nemanipulovaných štěpů dosahuje pouze 34 %. Většina pacientů přitom zaznamená jen lehkou formu aGVHD, protože aGvHD stupně 3–4 se rozvinula u 6 % pacientů. Extenzivní cGvHD byla zaznamenána pouze u 5 % příjemců haploidentických štěpů, kteří dostali 2 dávky PTCy. Účinnost PTCy potvrdily tři recentně publikované retrospektivní studie, které porovnávaly léčebné výsledky a výskyt GvHD u haplo HCT s použitím PTCy a u HCT s využitím HLA identických a MUD dárců. Studie se shodují v závěru, že haplo HCT s PTCy nemají významně horší výsledky v porovnání s HCT od standardních dárců, u kterých PTCy nebylo využito [32–34].
Srovnání UCB a haploidentických HCT (haplo HCT) bylo cílem paralelně probíhajících studií BMT CTN 0604 (UCB transplantace) a BMT CTN 0603 (haploidentické transplantace kostní dřeně), které probíhaly ve 27 transplantačních centrech USA [9]. V obou studiích byl zvolen přípravný režim s redukovanou intenzitou, po haplo HCT byl v den +3 a +4 podáván PTCy a transplantáty nebyly nijak dále manipulovány. Ve všech případech UCB transplantací byly použité dva štěpy (double UCB) a vždy byl dodržen požadavek na minimální podaný počet TNC 2,5–3,0 × 107/kg (obsah v UCB před zamražením). OS v jednom roce po HCT bylo 54 % (UCB) a 62 % (haplo). UCB HCT měly vyšší NRM (UCB 24 %, haplo 7 %), po haplo HCT bylo více relapsů (45 % versus 31 % po UCB). Kumulativní incidence aGvHD stupně 2–4 ke dni 100 byla 40 % (UCB) a 32 % (haplo). Těžká aGVHD stupně 3–4 se po haplo HCT vůbec neobjevila (haplo 0 %, UCB 21 %). Podobně to platilo i pro cGvHD, která byla referovaná v jednom roce po výkonu u 25 % pacientů po UCB a pouze u 13 % pacientů po haplo HCT s PTCy. Autoři uzavírají, že obě multicentrické studie prokázaly význam UCB a haplo HCT [9]. Výsledky přežití byly podobné, jako publikované výsledky léčby pacientů s vysoce rizikovými hematologickými malignitami, kteří podstoupili HCT od MUD [35].
Nedávno byla také publikována rozsáhlá analýza EBMT zahrnující přímé srovnání výsledků haploidentických (s podáním PTCy) a UCB transplantací u pacientů s akutními leukemiemi. Tato práce potvrdila, že použití UCB bylo ve srovnání s haploidentickým dárcem spojeno s opožděným přihojením a vyšší frekvencí selhání štěpu, přičemž incidence relapsů, TRM a EFS se statisticky nelišily [19].
Je vysoce pravděpodobné, že strategie podávání PTCy přinese pozitivní výsledky také u HCT od MMUD. Mehta et al. nedávno informovali o výsledcích HCT od MMUD transplantací, kdy jedna skupina pacientů dostávala standardní profylaxi GvHD včetně ATG, u druhé skupiny pacientů byl podáván PTCy bez ATG ve stejném schématu, jako po haplo HCT. Incidence aGvHD stupně 2–4 (37 % a 36 %) a stupně 3–4 (17 % a 12 %) se ke dni 100 nelišila, nicméně do dne 30 se aGvHD stupně 2–4 u pacientů po PTCy vůbec neobjevila. Přihojení bylo po aplikaci PTCy sice mírně oddálené, ale v ostatních parametrech (selhání štěpu, cGvHD, výskyt relapsů, OS) nebyl mezi skupinami statisticky významný rozdíl. Tyto výsledky jsou velmi povzbudivé i s ohledem na skutečnost, že cyklofosfamid je výrazně levnější než ATG [36].
Závěrem lze konstatovat, že MMUD, UCB a haplo dárci jsou srovnatelné zdroje HC pro alogenní HCT v případech, kdy není k dispozici HLA identický dárce nebo MUD, a že transplantace UCB obsahující adekvátní počet TNC či HC nemá obvykle významně horší výsledky ve srovnání s MMUD a haplo HC. Při rozhodování, který zdroj v konkrétním případě použít, je vhodné zvažovat vliv dalších proměnných, především kombinace pohlaví a CMV statutu dárce a příjemce. Typ transplantátu je nutné pečlivě zvážit i u pacientů, kteří měli během předchozí léčby protrahované granulocytopenie komplikované závažnými, především mykotickými infekcemi [27].
EKONOMICKÉ SROVNÁNÍ HCT PODLE TYPU ZDROJE KRVETVORNÝCH BUNĚK
Toto téma je velmi důležité, nicméně poměrně obtížné. V podmínkách českého zdravotnictví nebyla dosud publikována práce srovnávající jednotlivé typy alogenních HCT jak s ohledem na druh štěpu (kostní dřeň, periferní HC a UBC), tak i druh dárce HC (od HLA identických příbuzných, MUD, MMUD a UCB). Ve světové odborné literatuře sice existují práce zabývající se podobným srovnáním, ale jejich interpretace je problematická pro zásadně rozdílnou ekonomickou situaci a nastavení plateb za jednotlivé výkony v různých zemích. Publikované práce také nezahrnují do analýzy náklady na získání transplantátu (cost of graft acquisi-tion), které se opět významně liší v různých zemích, resp. u různých registrů, a zahrnují náklady na vyšetření dárce, HLA typizaci, aferézu nebo odběr kostní dřeně, zpracování štěpu (především u pupečníkové krve), náklady na chod registru, skladování, transport apod. Majhail et al. uvádí pro USA náklady na získání štěpu, které musí uhradit transplantační centrum, následovně (mediány): HLA identický dárce 9.566 USD (přibližně 230 tis. Kč), nepříbuzný dárce z registru 55.121 USD (1.300 tis. Kč), pupečníková krev 68.830 USD (1.600 tis Kč, tady autoři pravděpodobně uvažovali double UCB transplantaci, která je v USA obvyklá). Bart et al. se zaměřili pouze na UCB a za rok 2010 uvádí 30.358 USD (730 tis. Kč) jako průměrnou cenu za poskytnutí jednoho štěpu UCB k transplantaci [37–38]. Náklady na transplantační léčbu do dne 100 od převodu štěpu očištěné o náklady na získání transplantátu byly v případě UCB 137.564 USD (medián, 81-256 tis. USD) a v případě HLA identických dárců 83.583 USD (6-124 tis. USD). Střední náklady na provedení UCB transplantace se tedy ve Spojených státech pohybují okolo 200 tisíc USD, což je přibližně dvojnásobek nákladů, které jsou spojené s transplantací od HLA identického dárce [38]. V Evropě je situace poněkud odlišná s ohledem na nižší náklady spojené s léčebnou péčí (resp. nižší platby poskytovatelům péče). Cordonnier et al. publikovali nákladovou analýzu z francouzského pracoviště, kdy se zaměřili na alogenní transplantace od příbuzných dárců. Průměrné náklady na transplantaci včetně odběru štěpu a péče v prvním roce činily 62 tis. USD, náklady na odběr a zpracování transplantátu představovaly asi 7 % z celkových nákladů, tedy asi 4,5 tis. USD [39]. S ohledem na to, že náklady na odběr a zpracování transplantátů se u HLA identických příbuzných dárců a rodinných haploidentických dárců v zásadě neliší, lze konstatovat, že cena haplo HCT bude výrazně levnější, než cena HCT od MUD, MMUD či UCB, protože náklady na pořízení haploidentického transplantátu od rodinného dárce jsou 5–10krát nižší. Rovněž v podmínkách českého zdravotnictví jsou náklady na získání transplantátu – především ze zahraničí – brány do úvahy a mohou významně ovlivnit rozhodnutí o typu dárce.
TRENDY VE VYUŽÍVÁNÍ ALTERNATIVNÍCH DÁRCŮ
V posledních letech dochází ke změně trendů v oblasti využívání alternativních dárců a tyto změny se projevují stejně v Evropě i v Severní Americe. Přesto, že počet alogenních HCT na obou stranách oceánu trvale narůstá, je možné od roku 2010 zaznamenat určité změny, které se týkají především využívání nepříbuzných a alternativních dárců. Nárůst v počtu HCT od nepříbuzných dárců se v centrech, která reportují transplantační data do EBMT, zpomalil. Zatímco v letech 2004–2010 byl meziroční nárůst počtu HCT od nepříbuzných dárců okolo 12 %, v letech 2011–2014 se každoroční nárůst pohyboval okolo 5 %. Od roku 2010 rovněž vytrvale klesá počet každoročně prováděných transplantací pupečníkové krve. Dostupná data naopak ukazují, že výrazně stoupá počet haplo HCT a zatímco meziroční nárůst v počtu těchto procedur byl v letech 2004–2010 pouze 2 %, v letech 2011–2014 se počet haplo HCT zvyšoval každoročně o 25 % a v roce 2014 dosáhl podíl haplo HCT více než 10 % alogenních HCT. Počet ročně provedených haplo HCT v centrech EBMT (European Society for Blood and Marrow Transplantation) překračuje počet provedených UCB transplantací už přibližně třikrát. S tím také souvisí skutečnost, že zatímco počet center provádějících haplo HCT se rychle zvyšuje, počet center provádějících UCB transplantace a reportujících do databáze EBMT klesá. Podobný vývoj je v posledních letech patrný rovněž v USA, kdy CIBMTR (Center for International Blood and Marrow Transplant Research) a Stem Cell Transplant Outcome Database (k dispozici na webových stránkách Health Resources and Services Administration: http://bloodcell.transplant.hrsa.gov) uvádí pozvolný pokles v počtu provedených UCB transplantací a naopak rychle narůstající počet haplo HCT v letech 2011–2014, kdy od roku 2013 počet haplo HCT už převýšil počet UCB HCT. Přesto, že stejně jako v Evropě celkový počet alogenních HCT od nepříbuzných nebo alternativních dárců narůstá, počty UCB transplantací u příjemců starších 20 let stagnují a u pediatrických pacientů (do 20 let věku) dokonce vytrvale klesají [40–42]. Popsané trendy vyplývají zejména z následujících skutečností:
- Jak bylo uvedeno výše, výsledky haplo HCT s využitím PTCy se neliší od výsledků transplantací UCB.
- Výskyt GvHD a dalších komplikací je po haplo HCT v porovnání s transplantacemi UCB je přibližně stejný nebo nižší.
- Získání UCB štěpu je oproti odběru haploidentického štěpu od příbuzného pacienta administrativně a organizačně náročnější.
- Riziko selhání štěpu je u haplo HCT nižší.
- Náklady spojené se pořízením a transportem UCB dramaticky (několikanásobně) převyšují náklady na získání haploidentického transplantátu.
Základní otázkou je, zda lze do budoucna očekávat ještě větší pokles v počtech UCB transplantací, které v roce 2014 v centrech reportujících do EBMT představovaly jen 3,5 % (589 UCB HSCT) z celkem 16.946 alogenních HCT [40]. Odklon od UCB transplantací nepochybně významně ovlivňuje veřejné banky pupečníkové krve, a to zejména jejich ekonomickou situaci, jak bude probráno dále.
SITUACE VEŘEJNÝCH BANK PUPEČNÍKOVÉ KRVE
Úspěch první alogenní transplantace pupečníkové krve v roce 1988 potvrdil předpoklady, že UCB budou po kostní dřeni a krvetvorných buňkách z periferní krve třetím zdrojem HC pro HCT. Ukázalo se, že získávání a zpracování UCB je poměrně nekomplikované a že úplná shoda v HLA systému mezi dárcem a příjemcem není podmínkou úspěšné transplantace. Z historických kontextů je pochopitelné, že výhody UCB v porovnání s tradičními zdroji HC a s ohledem na v té době neuspokojivé počty dobrovolných dárců v registrech katalyzovaly na začátku 90. let 20. století snahy o vytvoření veřejných bank pupečníkové krve. V roce 1991 byla pomocí grantové podpory založena v New Yorku první veřejná banka UCB a už v roce 1993 tato banka poskytla první transplantát pro alogenní HCT. Důležitým argumentem bylo, že uložení dostatečného počtu UCB v bankách pupečníkové krve významně urychlí dostupnost transplantátu, protože UCB na rozdíl od jiných nepříbuzných HC je k dispozici ve velmi krátkém čase. Druhým argumentem bylo, že diverzita UCB ve veřejných bankách výrazně zvýší šance na získání alogenního transplantátu pro rasové minority, což bylo důležité zejména v USA, Francii a Velké Británii [43]. To se ostatně potvrdilo, protože NMDP uvádí, že 47 % UCB uložených ve veřejných bankách pupečníkové krve jsou od dárců z různých minorit (afroamerické, hispánské, asijské, indiánské atd.). Veřejné banky UCB začaly být rychle provozovány i v dalších zemích a díky tomu v roce 1997 vznikla síť veřejných bank pupečníkové krve pod názvem Netcord. Tato organizace rovněž vydala první standardy pro odběry a zpracování UCB pro HCT. Postupně bylo celosvětově založeno 84 veřejných bank UCB (spolu s pobočkami jde o více než 160 zařízení), ve kterých je v současnosti uloženo přes 730 tisíc jednotek UCB. Přibližně 35 tisíc jednotek UCB bylo již vydáno a použito pro alogenní HCT, což představuje přibližně 5 % uložených transplantátů [44].
Zpočátku bylo cílem získat rychle velký počet jednotek UCB, až postupně – s nástupem transplantací UCB u dospělých pacientů – se ukázalo, že je zapotřebí soustředit se více na kvalitu než kvantitu uložených transplantátů. Banky UCB se rychle přizpůsobovaly požadavkům na vyšší buněčnost uložených štěpů, velmi významný ekonomický efekt přinesla i praxe transplantace dvěma jednotkami UCB (double UCB). Jak už bylo výše uvedeno, v posledním desetiletí byly v USA použity dvě jednotky UCB u 80 % dospělých pacientů [18]. To s sebou samozřejmě neslo vysoké finanční náklady, protože za jednu jednotku UCB musí transplantační centrum v průměru zaplatit okolo 25 tisíc USD (Evropa), resp. 30–40 tisíc USD (USA) [43]. Nicméně bankám UCB se většinou dařilo být do roku 2008 ekonomicky soběstačnými, protože vydávaly stále okolo 5 % štěpů ročně. Se zvyšujícím se počtem dárců v registrech začal výdej UCB a počet transplantací UCB stagnovat, i když banky stále rozšiřovaly počty skladovaných štěpů [37, 43, 45]. Udržení provozu veřejných bank začalo vyžadovat stále větší přísun financí z jiných zdrojů, ať už od sponzorů, nebo ze státních dotací. V kontextu úsporných ekonomických opatření posledních let však došlo k poklesu veřejného i filantropického financování veřejných bank UCB, což je vedle nástupu haplo HCT dalším problémem, se kterým se musí veřejné banky vyrovnávat. Následkem tohoto nepříznivého vývoje byla rychle se zhoršující ekonomická situace bank UCB, takže v roce 2013 už pouze 13 ze 139 veřejných bank pupečníkové krve uvedlo, že jejich provoz je ekonomicky udržitelný [46].
Ve snaze zvýšit využívání UCB pro HCT se v zásadě rozvíjely dva směry. Jeden směr se zaměřil na zvýšení využitelnosti UCB, kdy byly testovány různé možnosti expanze HC v transplantátech UCB, za účelem urychlení a vyšší jistoty engraftmentu se UCB kokultivovaly například s mezenchymálními kmenovými buňkami, UCB se podávala přímo do dřeňové dutiny, kombinovala se s haploidentickým nemanipulovaným štěpem apod. Manipulace a další postupy však byly komplikované a nákladné [47–54], takže nemohly obhájit svůj přínos v porovnání s MMUD a zejména haplo HCT s PTCy. Druhý směr znamenal zaměřit se na zvýšení kvality a buněčnosti UCB, protože pouze UCB s vysokým obsahem jaderných buněk mohou být alternativou jiných zdrojů HC. Zvýšení nároků na buněčnost odebrané UCB však s sebou přináší i sekundární zvýšení nákladů, protože počet uskladněných UCB se snížil a objem finančních prostředků vynakládaných na odběry se nezměnil. Nepoměr mezi náklady a výnosy a současně snížení poptávky po UCB způsobil, že některé veřejné banky UCB byly nuceny ukončit činnost a řadě dalších bezprostředně ukončení činnosti hrozí. Tuto situaci asi nejlépe ilustruje příklad Francie, kde byla v roce 2014 ukončena činnost poloviny veřejných bank UCB pouhé dva roky poté, co byl ve Francii vyhlášen národní program podpory odběrů a veřejného ukládání pupečníkové krve [55]. Pro udržení veřejných bank UCB je v současnosti více než kdy jindy zcela zásadní střízlivé a pečlivé ekonomické plánování, snížení nákladů při zvýšení výnosů a zajištění vícezdrojového financování provozu. Modelováním nastavení odběrové politiky bank UCB ve vztahu k maximalizaci výdeje transplantátů se zevrubně zabývali Magalon et al. [45]. Analyzovali přitom čtyři náborové strategie lišící se podle selekčního skóre, které vyjadřovalo, kolik procent odebraných UCB je vybráno k uskladnění a je tedy nabízeno k využití. Selekční skóre pro jednotlivé strategie (A, B, C a D) bylo 33 %, 20 %, 6 % a 2 %. Model přitom pracoval s jednotným odebraným počtem UCB (28.473 UCB). Strategie se samozřejmě lišily podle nákladů a podle odhadovaných výnosů, které odpovídaly reálně předpokládanému počtu UCB vydaných k HCT při čistém příjmu banky ve výši 29 tis. USD za vydanou jednotku UCB, jinak se použily střední ceny a náklady, které jsou obvyklé v USA a v západní Evropě. Výsledky byly alarmující, protože ani jedna ze strategií nevedla ke kladnému hospodářskému výsledku. Nejhorší výsledek měla strategie A (ze 100 % odebraných UCB uloženo 33 %), která vedla ke ztrátě ve výši téměř 6 milionů USD (144 milionů Kč). Nejlepšího výsledku dosáhla strategie C (ze 100 % odebraných UCB uloženo 6 %), která sice rovněž vedla ke ztrátě, ale pouze ve výši necelého 1 milionu USD (24 milionů Kč). Z uvedeného vyplývají dva závěry:
- Ani velmi dobře nastavená strategie výběru UCB k uložení založená na buněčnosti štěpů na základě obsahu jaderných buněk a obsahu HSC (v praxi CD34+ buněk) nedosáhne veřejná banka v současných podmínkách ekonomické soběstačnosti.
- Je nutné hledat nové modely financování veřejných bank pupečníkové krve, které by měly být vícezdrojové a v ideálním případě využijí know-how související s odběry a zpracováním pupečníkové krve. Jako nejlepší se v tomto ohledu jeví model tzv. hybridní banky pupečníkové krve [56].
HYBRIDNÍ BANKY PUPEČNÍKOVÉ KRVE
Prakticky současně s veřejnými bankami UCB začaly být zakládány soukromé (privátní) banky pro uložení UCB pro autologní, případně rodinné použití. První banka UCB tohoto typu vznikla v USA v roce 1992, přičemž v současnosti funguje v 54 zemích světa přibližně 215 privátních bank UCB, ke kterým je potřeba přičíst dalších cca 200 poboček. Celkově tedy existuje možnost privátního uložení UCB ve více než 70 zemích světa, přičemž tyto banky registrují přes 4 miliony uložených pupečníkových krví [57]. Indikace pro použití autologní UCB jsou od počátku velmi omezené a autologních transplantací UCB se v Evropě provede pouze okolo 5 ročně, což je, s ohledem na přibližně 20 tisíc každoročně reportovaných autologních transplantací do databáze EBMT, zanedbatelné číslo [40, 41, 58]. Na druhé straně, řada privátních bank UCB poskytuje možnost uložení pupečníkové krve pro alogenní použití v rámci rodiny, resp. u sourozenců dárce. S tím také souvisí skutečnost, že přibližně polovina UCB vydaných z privátních bank UCB byla použita pro alogenní HCT v rámci rodiny, především pro léčbu thalasemií, srpkovité anémie a dalších hemoglobinopatií. Databáze EBMT uvádí okolo 60 alogenních transplantací UCB od sourozenců ročně [40, 41, 58]. Podle dostupných zdrojů byly do konce roku 2013 z privátních bank vydány pupečníkové krve k léčebnému použití pro 1015 pacientů, v 530 případech šlo o autologní použití a ve 485 případech šlo o alogenní HCT [59]. Transplantace UCB v rámci rodiny má při shodě v HLA systému oproti HCT od nepříbuzného dárce samozřejmě stejné výhody jako jakákoli HCT od HLA identického dárce: vyšší pravděpodobnost úspěšnosti a přežití, snížení pravděpodobnosti a závažnosti GvHD a možnost odběru například kostní dřeně od stejného dárce v případě relapsu či rejekce [60]. Význam rodinného uchovávání UCB vyhodnotil například Reed et al. v publikaci zaměřené na model sběru a uchovávání UCB v rodinném režimu [61]. Celkem bylo vyhodnoceno 540 rodin, u kterých byl použit režim rodinného uchovávání UCB. Přes rozdílnou úroveň a heterogenitu odběrových center byl počet jaderných buněk v odebraných UCB uspokojivý a přes 93 % uložených jednotek UCB obsahovalo dostatek buněk pro provedení alogenní transplantace krvetvorby. Do doby analýzy bylo pro transplantaci použito 17 jednotek UCB (3,4 %).
Ve srovnání s veřejnými bankami UCB, které průměrně vykazují téměř 5 % využitelnost skladovaných pupečníkových krví, bylo v případě privátních bank UCB do roku 2013 použito k léčbě pouhých 0,025 % skladovaných jednotek UCB [57]. Když vyloučíme UCB použité pro alogenní HCT v rámci rodiny, pak se dostáváme na pravděpodobnost využití privátně uložené UCB přibližně 1 : 7500 (0,013 %). Z těchto údajů vyplývá, že nelze spoléhat na platbu za vydanou jednotku UCB, ale pro udržení rentability musí být model financování soukromých bank UCB průběžný a částečně zálohový. Rodiče buď zaplatí základní činnosti (odběr, zpracování, vyšetření, zamrazení a krátkodobé skladování, obvykle po dobu prvního roku) a pak v ročních intervalech hradí uložení (dlouhodobé skladování), případně je služba poskytována jako kompletní, tedy včetně například 20letého uložení, kdy je platba přirozeně vyšší.
Opatřování a uchovávání pupečníkových krví se liší napříč různými státy Evropské unie. Některé země, např. Velká Británie, Španělsko, Německo a Švýcarsko zachovávají liberálnější postoj a matka se může svobodně rozhodnout, zda bezplatně poskytne pupečníkovou krev dítěte pro veřejnou banku UCB, nebo uhradí náklady vyplývající ze smlouvy s privátní bankou UCB. Naproti tomu, např. ve Francii a v Itálii platná národní legislativa neumožňuje existenci privátních bank UCB. Na druhé straně však mohou rodiče z Itálie a Francie nechat odebranou pupečníkovou krev za poplatek (typicky okolo 300 Euro) převést do jiné země, kde je v privátní bance UCB zpracována a uskladněna. Tento přístup lze označit za poněkud pokrytecký, protože rodiče oficiálně sice nemají možnost volby, ale na druhé straně mohou postupovat jinak, když jsou ochotní za to zaplatit.
Zatímco model rodinného uchovávání UCB pro alogenní účely není eticky kontroverzní, o soukromém ukládání UCB pro potenciální autologní použití se stále diskutuje, protože zatím chybí dostatek medicínských důkazů, které by jednoznačně tuto strategii podpořily. Navzdory tomu se privátní banky UCB rychle rozvinuly a jsou využívány zejména ekonomicky zdatnějšími rodinami. Soukromé uchovávání UCB je prezentováno a konzumováno jako forma „biologického životního pojištění“ i přesto, že dosud není naprosto jasné, zda vůbec a jak může uchovávaná autologní UCB v budoucnu přispět k záchraně zdraví či života dítěte. Na druhé straně, jde o jednu z dalších investic do budoucnosti dítěte, kterou ekonomicky zdatní rodiče rádi podstoupí, protože to z nich v jejich očích dělá „dobré a odpovědné rodiče“. Vzhledem k tomu, že náklady na uložení autologní UCB jsou srovnatelné například s náklady na pořízení kvalitního kočárku, tak pro ekonomicky zajištěné rodiny nejde o zásadní položku v jejich rodinném rozpočtu. Forma soukromého uchovávání UCB pro pojištění budoucnosti svých dětí je tedy založena na neoliberálních principech soukromého pojištění, které za odpovídající cenu nabízí osobní rizikové služby jako zajištění proti budoucím nejistotám a problémům. Liberální pohled na soukromé uchovávání UCB velmi dobře vystihuje věta: „There is no reason not to bank cord blood.“, čili „Není žádný důvod, proč pupečníkovou krev neuchovávat.“ [62].
Během posledních let se postupně hranice mezi veřejným a soukromým bankovnictvím UCB začala pomalu stírat, když některé banky začaly nabízet služby v kombinovaném režimu tzv. hybridní banky UCB [56]. Tento model ukládání UCB kombinuje principy veřejných a soukromých systémů. Hybridní modely bank pupečníkové krve spadají do dvou širokých kategorií (tab. 1). Do první kategorie spadají veřejné i soukromé banky UCB, které nabízí rodičům možnost jak veřejného dárcovství, tak soukromého skladování. Do druhé kategorie lze zařadit soukromé banky UCB, které provádí HLA typizace uložených UCB, přičemž je v případě potřeby možné privátně uloženou UCB vydat k alogennímu použití.
Table 1. Typy hybridních bank UCB 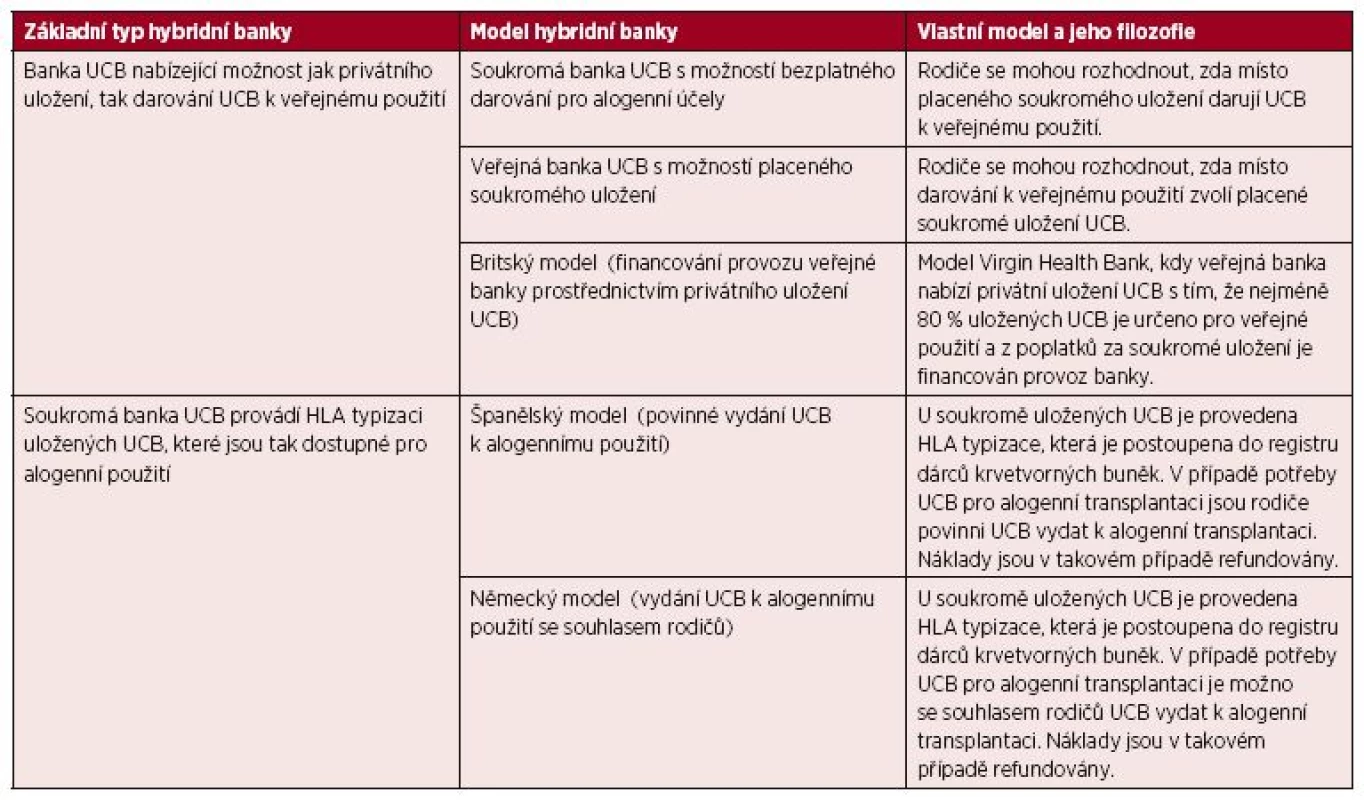
Nejrychleji se model hybridní banky UCB rozvíjí v USA, kde výběr mezi veřejným darováním a soukromým uložením nabízí například společnosti Lifeforce Cryobanks (Florida), Celebration Stem Cell Centre (Arizona) a StemCyte (Kalifornie). Další společnosti připravují přechod na model hybridní banky v nejbližší době (například Cord Blood Bank of Arkansas). První veřejnou bankou UCB, která začala nabízet kromě veřejného darování UCB také službu privátního uložení UCB pro autologní použití, je Alberta Cord Blood Bank v Kanadě [56,63].
V Evropě model hybridní banky nabízí například švýcarská společnost CordSavings SA, britská Virgin Health Bank a německá eticur). Jak už bylo řečeno, některé banky řeší hybridní model uchovávání UCB tak, že na jedné straně je pupečníková krev za poplatek primárně uložena pro autologní použití a vlastnická práva zůstávají rodičům, na druhé straně je u této pupečníkové krve provedena HLA typizace a údaje o pupečníkové krvi jsou postoupeny do registru veřejných bank UCB pro alogenní použití. Pokud vznikne potřeba použití této konkrétní pupečníkové krve pro alogenního příjemce, pak je uvolněna pro transplantaci. V některých zemích je podmínkou uvolnění souhlas rodičů s darováním (Německo), v jiných zemních se na názor rodičů nebere ohled (Španělsko), ale vždy jsou rodičům plně refundovány prostředky dosud vynaložené na odběr, zpracování a skladování.
Vznik hybridních bank UCB je do značné míry logickým krokem a z řady hledisek přináší tento vývoj významná pozitiva [64]. Uchovávání pupečníkové krve je nutné, stejně jako je tomu u jiných zdravotnických služeb, hodnotit z pohledu etiky a morálky, ekonomiky, medicíny, dostupnosti, praktického provádění a vědy.
EKONOMICKÝ A ETICKÝ POHLED NA HYBRIDNÍ BANKY PUPEČNÍKOVÉ KRVE
Veřejné banky jsou ekonomicky soběstačné při splnění kombinace nejméně dvou základních předpokladů. Prvním je průběžné vydávání uložených UCB k použití, druhým je úhrada za vydanou jednotku UCB v takové výši, že násobeno počtem vydaných UCB během daného období se náklady a výnosy vyrovnají. Obecně se uvádí, že hranice pro rentabilitu veřejné banky UCB je vydávání 4-5 % uložených UCB ročně [64]. Výše úhrady za vydanou UCB se samozřejmě liší podle toho, jaké má konkrétní banka provozní náklady. Jiné náklady bude mít banka ve Spojených státech, jiné náklady bude mít banka sídlící v rozvojovém světě. Podíl vydaných UCB na druhé straně také souvisí s počtem uložených UCB, protože s vyšším počtem se zvyšuje pravděpodobnost, že potřebnou UCB bude mít banka k dispozici. Jak bylo popsáno výše, v současnosti se potýkají veřejné banky UCB s vážnými ekonomickými problémy, protože náklady trvale narůstají a přitom dochází k poklesu využívání UCB, které jsou nahrazovány především haploidentickými transplantáty.
V případě privátní banky je model financování průběžný, protože klienti platí za zpracování UCB ihned, za uložení (skladování) platí buď předem, nebo průběžně. Model hybridní banky může eliminovat problémy s pokrytím provozních nákladů veřejné banky, protože výnos privátní části banky může průběžně financovat provoz veřejné části banky. Další úsporu nákladů přináší sdílení sítě odběrových zařízení a celého provozu včetně kryobanky [56]. Na privátní banky UCB se často pohlíží jako na medicínské podnikání na hraně či za hranou morálky a etiky. Je to dáno tím, že filozofie uchovávání autologní UCB jako forma „biologického životního pojištění“ není v současnosti všeobecně přijímaná, protože zatím existuje jen minimální počet indikací pro použití UCB k autologní léčbě. Některé státy soukromé uložení UCB proto dokonce nedovolují, v jiných zemích je možné privátně uloženou UCB vydat k alogennímu použití i bez svolení rodičů v rámci „veřejného zájmu“ (viz tab. 1), což má ve svém důsledku podporovat veřejné dárcovství. Na jedné straně tedy proti sobě stojí veřejný zájem, který je reprezentovaný veřejnou bankou UCB, na straně druhé pak svoboda jednotlivce rozhodovat o tom, jak bude s jeho tkání nakládáno (diskutabilní je z tohoto pohledu zejména španělský model, kdy pro vydání soukromě uložené UCB pro alogenní účely není vyžadován souhlas rodičů).
Současná existence veřejných a privátních bank má do určité míry konkurenční charakter, což je vnímáno negativně zejména proto, že veřejná banka apeluje především na altruismus a solidaritu, kdežto privátní banka na odpovědnost a lásku k vlastnímu dítěti. Pokud přichází obě výzvy či nabídky současně, tak se rodiče, především samozřejmě matky, přirozeně ocitají pod určitým emocionálním tlakem, kdy jakékoli rozhodnutí vede k určitým pochybám, zda se zachovali úplně správně.
Zásadní výhodou hybridní banky je, že rodiče jsou od počátku ze strany jedné instituce informováni o všech možnostech, které souvisí s odběrem pupečníkové krve dítěte, tedy o uložení UCB do veřejné banky, privátním uložení nebo jejím poskytnutím k vědecko-výzkumným účelům. Rodiče se tak mohou svobodně a plně informovaně rozhodnout, jak má být s pupečníkovou krví jejich potomka naloženo. V případě zvolení privátního uložení nejsou v případě hybridní banky rodiče konfrontováni s pocitem výčitek ze sobeckého jednání, protože – pokud je realizován model alespoň částečného financování veřejné části banky prostřednictvím výnosů z privátního ukládání UCB – nepřímo přispívají pro dobro věci. Jinými slovy, jako akt solidarity vnímají obě možnosti uložení, kdy uložení do veřejné banky představuje zcela nezištný dar a privátní uložení nepřímou finanční podporu. Skutečnost, že se část prostředků získaných provozováním privátní banky přímo a cíleně vrací do veřejné služby, přispívá k pozitivnímu vnímání hybridní banky v očích veřejnosti [56, 63].
Lze předpokládat, že spojení veřejné a privátní banky do hybridní banky UCB může přinést i další, nepřímé pozitivní efekty v podobě většího zapojení hybridních bank do oblasti vědy a výzkumu. Veřejné banky jsou obvykle úzce napojené na transplantační centra a potažmo univerzitní nemocnice a další akademické vědecké instituce. Privátní banky UCB zase často spolupracují se soukromými biotechnologickými firmami a výzkumnými laboratořemi. Hybridní banky mohou mít oproti privátním bankám UCB nepochybně vyšší prestiž a lepší přístup k akademickému výzkumu, který mohou dále podporovat například finančně. Sdílení know-how a podpora výzkumu by mohly přinést nové a zásadní poznatky v oblasti využití buněk pupečníkové krve a tkání pupečníku v budoucnosti, např. pro regenerativní medicínu a další obory. S ohledem na unikátní vlastnosti pupečníkové krve lze do budoucna předpokládat, že by se pupečníková krev mohla stát významným zdrojem pro výrobu přípravků moderní terapie; je to ostatně příčinou současné motivace rodičů k ukládání autologních štěpů UCB do privátních bank [63, 65, 66].
A nebylo by vhodné pominout ani další etický (a ekonomický) aspekt: požadavky kladené na pupečníkovou krev pro veřejné banky jsou dosti náročné a těmto nárokům vyhoví v současnosti méně než 10 % odběrů; současně poplatky spojené s privátním uložením UCB nejsou rozhodně malé a pro řadu rodičů může být privátní uchovávání UCB obtížně dostupné z ekonomických důvodů. Významná skupina rodičů tak v současnosti do určité míry postrádá možnost nějakým způsobem přispět, protože privátní uchovávání a finanční dary mohou být mimo jejich finanční možnosti a pupečníková krev dítěte nesplnila požadavky veřejné banky. Hybridní banka by toto dilema mohla vyřešit, neboť v takovém případě by měla být pro tyto rodiče otevřená cesta pro možnost darovat UCB alespoň pro vědecko-výzkumné účely.
ZÁVĚRY
Navzdory velkému počtu studií a prací, věnujících se problematice alternativních zdrojů HC pro alogenní HCT a jejich vzájemnému porovnávání, je čistě vědecké upřednostňování některého druhu alternativního štěpu obtížné. Do úvahy je potřeba zavzít také čas potřebný pro nalezení dárce, zkušenosti transplantačního centra, ale i náklady spojené se získáním transplantátu. V současnosti se zdá, že v případě nedostupnosti HLA identických nebo MUD dárců bude stále častěji využíváno haploidentických dárců, kteří jsou k dispozici velmi rychle a téměř vždy, navíc s významně menšími náklady ve srovnání s ostatními alternativními zdroji HC. UCB pravděpodobně i v blízké budoucnosti zůstane důležitým zdrojem HC v případě pediatrických alogenních HCT indikovaných pro některé vrozené těžké imunodeficity, kde je UCB rychleji k dispozici než štěp od nepříbuzného dárce. Včasná transplantace hraje u těchto onemocnění zásadní roli pro riziko rozvoje závažných infekčních komplikací v prvních měsících života [67]. U mukopolysacharidóz je UCB dokonce jednoznačně preferována [68, 69]. Nicméně, lysosomální nemoci a primární imunodeficity patří mezi vzácná onemocnění a počet HCT pro tyto indikace bude vždy nízký [70]. Ekonomické fungování většiny veřejných bank pupečníkové krve zřejmě nebude ve standardním modelu do budoucna ekonomicky únosné (část z nich už není rentabilní několik posledních let). Na druhé straně by bylo zejména eticky obtížně obhájitelné zlikvidovat všechny skladované pupečníkové krve z ekonomických důvodů. Zdá se, že jedním z východisek by mohl být koncept hybridních bank pupečníkové krve, který by se mohl uplatnit i v podmínkách České republiky.
Podíl autorů na rukopisu
Všichni autoři se podíleli na vypracování textu stanoviska panelu přibližně stejným dílem na základě svých odborných znalostí, praktických zkušeností a na základě studia odborné literatury.
Prohlášení o konfliktu zájmů
P. Cetkovský prohlašuje, že v souvislosti s tématem, vznikem a publikací tohoto článku není ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Toto prohlášení se týká i spoluautorů J. Starého, J. Štěrby a P. Žáka. Spoluautor Z. Kořístek je odborným konzultantem společnosti PrimeCell Therapeutics a.s.
Doručeno do redakce dne 18. 8. 2016.
Přijato po recenzi dne 8. 9. 2016.
prof. MUDr. Petr Cetkovský, Ph.D., MBA
Ústav hematologie a krevní transfuze
U Nemocnice 1
128 20 Praha 2
e-mail: petr.cetkovsky@uhkt.cz
Sources
1. Ballen KK, King RJ, Chitphakdithai P, et al. The national marrow donor program 20 years of unrelated donor hematopoietic cell transplanta-tion. Biol Blood Marrow Transplant 2008; 14 (9 Suppl): 2–7.
2. Gragert L, Eapen M, Williams E, et al. HLA match likelihoods for haematopoietic stem-cell grafts in the U.S. registry. N Engl J Med 2014; 371 : 339–348.
3. Luznik L, O’Donnell PV, Symons HJ, et al. HLA-haploidentical bone marrow transplantation for hematologic malignancies using nonmyeloablative conditioning and high-dose, posttransplantation cyclophosphamide. Biol Blood Marrow Transplant 2008; 14 : 641–650.
4. Anasetti C, Logan BR, Lee SJ, et al. Blood and Marrow Transplant Clinical Trials Network. Peripheral-blood stem cells versus bone marrow from unrelated donors. N Engl J Med 2012; 367 : 1487–1496.
5. Kekre N, Antin JH. Hematopoietic stem cell transplantation donor sources in the 21st century: choosing the ideal donor when a perfect match does not exist. Blood 2014; 124 : 334–343.
6. Raiola AM, Dominietto A, Ghiso A, et al. Unmanipulated haploidentical bone marrow transplantation and posttransplantation cyclophosphamide for hematologic malignancies after myeloablative conditioning. Biol Blood Marrow Transplant 2013; 19 : 117–122.
7. Rocha V, Labopin M, Sanz G, et al. Acute Leukemia Working Party of European Blood and Marrow Transplant Group; Eurocord-Netcord Registry. Transplants of umbilical-cord blood or bone marrow from unrelated donors in adults with acute leukemia. N Engl J Med 2004; 351(22): 2276–2285.
8. Sanz J, Sanz MA, Saavedra S, et al. Cord blood transplantation from unrelated donors in adults with high-risk acute myeloid leukemia. Biol Blood Marrow Transplant 2010; 16 : 86–94.
9. Brunstein CG, Fuchs EJ, Carter SL, et al. Alternative donor transplantation after reduced intensity conditioning: results of parallel phase 2 trials using partially HLA-mismatched related bone marrow or unrelated double umbilical cord blood grafts. Blood 2011; 118 : 282–288.
10. Ballen KK, Spitzer TR, Yeap BY, et al. Double unrelated reduced-intensity umbilical cord blood transplantation in adults. Biol Blood Marrow Transplant 2007; 13 : 82–89.
11. Brunstein CG, Barker JN, Weisdorf DJ, et al. Umbilical cord blood transplantation after nonmyeloablative conditioning: impact on transplantation outcomes in 110 adults with hematologic disease. Blood 2007; 110 : 3064–3070.
12. Laughlin MJ, Barker J, Bambach B, et al. Hematopoietic engraftment and survival in adult recipients of umbilical-cord blood from unrelated donors. N Engl J Med 2001; 344 : 1815–1822.
13. Barker JN, Scaradavou A, Stevens CE. Combined effect of total nucleated cell dose and HLA match on transplantation outcome in 1061 cord blood recipients with hematologic malignancies. Blood 2010; 115 : 1843–1849.
14. Wagner JE, Barker JN, DeFor TE, et al. Transplantation of unrelated donor umbilical cord blood in 102 patients with malignant and nonmalignant diseases: influence of CD34 cell dose and HLA disparity on treatment-related mortality and survival. Blood 2002; 100 : 1611–1618.
15. Barker JN, Weisdorf DJ, DeFor TE, et al. Transplantation of 2 partially HLA-matched umbilical cord blood units to enhance engraftment in adults with hematologic malignancy. Blood 2005; 105 : 1343–1347.
16. Avery S, Shi W, Lubin M, et al. Influence of infused cell dose and HLA--match on engraftment after double unit cord blood allografts. Blood 2011; 117 : 3277–3285.
17. Ponce DM, Zheng J, Gonzales AM, et al. Reduced late mortality risk contributes to similar survival after double-unit cord blood transplant compared with related and unrelated donor hematopoietic stem cell transplant. Biol Blood Marrow Transplant 2011; 17 : 1316–1326.
18. Scaradavou A, Brunstein CG, Eapen M, et al. Double unit grafts successfully extend the application of umbilical cord blood transplanta-tion in adults with acute leukemia. Blood 2013; 121 : 752–758.
19. Ruggeri A, Labopin M, Sanz G, et al. Eurocord, Cord Blood Committee of Cellular Therapy and Immunobiology working party-EBMT; ALWP-EBMT study. Comparison of outcomes after unrelated cord blood and unmanipulated haploidentical stem cell transplantation in adults with acute leukemia. Leukemia 2015; 29 : 1891–1900.
20. Baron F, Labopin M, Ruggeri A, et al. Unrelated cord blood transplantation for adult patients with acute myeloid leukemia: higher incidence of acute graft-versus-host disease and lower survival in male patients transplanted with female unrelated cord blood – a report from Eurocord, the Acute Leukemia Working Party, and the Cord Blood Committee of the Cellular Therapy and Immunobiology Working Party of the European Group for Blood and Marrow Transplantation. J Hematol Oncol 2015; 8 : 107–118.
21. Atsuta Y, Suzuki R, Nagamura-Inoue T, et al. Disease-specific analyses of unrelated cord blood transplantation compared with unrelated bone marrow transplantation in adult patients with acute leukemia. Blood 2009; 113 : 1631–1638.
22. Brunstein CG, Eapen M, Ahn KW, et al. Reduced-intensity conditioning transplantation in acute leukemia: the effect of source of unrelated donor stem cells on outcomes. Blood 2012; 119 : 5591–5598.
23. Eapen M, Rocha V, Sanz G, et al. Effect of graft source on unrelated donor haemopoietic stem-cell transplantation in adults with acute leukaemia: a retrospective analysis. Lancet Oncol 2010; 11 : 653–660.
24. Peffault de Latour R, Brunstein CG, Porcher R, et al. Similar overall survival using sibling, unrelated donor, and cord blood grafts after reduced-intensity conditioning for older patients with acute myelogenous leukemia. Biol Blood Marrow Transplant 2013; 19 : 1355–1360.
25. Weisdorf D, Eapen M, Ruggeri A, et al. Alternative donor transplantation for older patients with acute myeloid leukemia in first complete remission: a center for international blood and marrow transplant research-eurocord analysis. Biol Blood Marrow Transplant 2014; 20 : 816–822.
26. Jacobson CA, Turki AT, McDonough SM, et al. Immune reconstitution after double umbilical cord blood stem cell transplantation: comparison with unrelated peripheral blood stem cell transplantation. Biol Blood Marrow Transplant 2012; 18 : 565–574.
27. Granier C, Biard L, Masson E, et al. Impact of the source of hematopoietic stem cell in unrelated transplants: comparison between 10/10, 9/10-HLA matched donors and cord blood. Am J Hematol 2015; 90 : 897–903.
28. Brunstein CG, Gutman JA, Weisdorf DJ, et al. Allogeneic hemato-poietic cell transplantation for hematologic malignancy: relative risks and benefits of double umbilical cord blood. Blood 2010; 116 : 4693–4699.
29. Weisdorf D, Cooley S, Devine S, et al. T cell-depleted partial matched unrelated donor transplant for advanced myeloid malignancy: KIR ligand mismatch and outcome. Biol Blood Marrow Transplant 2012; 18 : 937–943.
30. Devillier R, Fürst S, Crocchiolo R, et al. A conditioning platform based on fludarabine, busulfan, and 2 days of rabbit antithymocyte globulin results in promising results in patients undergoing allogeneic transplantation from both matched and mismatched unrelated donor. Am J Hematol 2014; 89 : 83–87.
31. Kumar A, Mhaskar AR, Reljic T, et al. Antithymocyte globulin for acute-graft-versus-host-disease prophylaxis in patients undergoing allogeneic hematopoietic cell transplantation: a systematic review. Leukemia 2012; 26 : 582–588.
32. Bashey A, Zhang X, Sizemore CA, et al. T-cell-replete HLA--haploidentical hematopoietic transplantation for hematologic malignancies using post-transplantation cyclophosphamide results in outcomes equivalent to those of contemporaneous HLA-matched related and unrelated donor transplantation. J Clin Oncol 2013; 31 : 1310–1316.
33. Raiola AM, Dominietto A, di Grazia C, et al. Unmanipulated haploidentical transplants compared with other alternative donors and matched sibling grafts. Biol Blood Marrow Transplant 2014; 20 : 1573–1579.
34. Di Stasi A, Milton DR, Poon LM, et al. Similar transplantation outcomes for acute myeloid leukemia and myelodysplastic syndrome patients with haploidentical versus 10/10 human leukocyte antigen-matched unrelated and related donors. Biol Blood Marrow Transplant 2014; 20 : 1975–1981.
35. Giralt S, Logan B, Rizzo D, et al. Reduced-intensity conditioning for unrelated donor progenitor cell transplantation: long-term follow-up of the first 285 reported to the national marrow donor program. Biol Blood Marrow Transplant 2007; 13 : 844–852.
36. Mehta RS, Saliba RM, Chen J, et al. Post-transplantation cyclophosphamide versus conventional graft-versus-host disease prophylaxis in mismatched unrelated donor haematopoietic cell transplantation. Br J Haematol 2016; 173 : 444–455.
37. Bart T, Boo M, Balabanova S, et al. Impact of selection of cord blood units from the United States and swiss registries on the cost of banking operations. Transfus Med Hemother 2013; 40 : 14–20.
38. Majhail NS, Mothukuri JM, Brunstein CG, Weisdorf DJ. Costs of haematopoietic cell transplantation: comparison of umbilical cord blood and matched related donor transplantation and the impact of posttransplant complications. Biol Blood Marrow Transplant 2009; 15 : 564–573.
39. Cordonnier C, Maury S, Esperou H, et al. Do minitransplants have minicosts? A cost comparison between myeloablative and nonmyeloablative allogeneic stem cell transplant in patients with acute myeloid leukemia. Bone Marrow Transplant 2005; 36 : 649–654.
40. Passweg JR, Baldomero H, Bader P, et al. Hematopoietic stem cell transplantation in Europe 2014: more than 40 000 transplants annually. Bone Marrow Transplant 2016; 51 : 786–792.
41. Passweg JR, Baldomero H, Bader P, et al. European Society for Blood and Marrow Transplantation (EBMT). Hematopoietic SCT in Europe 2013: recent trends in the use of alternative donors showing more haploidentical donors but fewer cord blood transplants. Bone Marrow Transplant 2015; 50 : 476–482.
42. Anasetti C. Use of alternative donors for allogeneic stem cell transplantation. Hematology Am Soc Hematol Educ Program 2015; 2015 : 220–224.
43. Broxmeyer HE, Farag S. Background and future considerations for human cord blood hematopoietic cell transplantation, including economic concerns. Stem Cells Dev 2013; 22 (Suppl 1): 103–110.
44. Zdroj: www.bmdw.org.
45. Magalon J, Maiers M, Kurtzberg J, et al. Banking or Bankrupting: Strategies for Sustaining the Economic Future of Public Cord Blood Banks. PLoS ONE 2015; 10: e0143440.
46. WMDA annual report cord blood Bank/Registries. 2014.
47. Farag SS, Srivastava S, Messina-Graham S, et al. In vivo DPP-4 inhibition to enhance engraftment of single-unit cord blood transplants in adults with hematological malignancies. Stem Cells Dev 2013; 22 : 1007–1015.
48. Cutler C, Multani P, Robbins D, et al. Prostaglandin-modulated umbilical cord blood hematopoietic stem cell transplantation. Blood 2013; 122 : 3074–3081.
49. Popat U, Mehta RS, Rezvani K, et al. Enforced fucosylation of cord blood hematopoietic cells accelerates neutrophil and platelet engraftment after transplantation. Blood 2015; 125 : 2885–2892.
50. Delaney C, Heimfeld S, Brashem-Stein C, Voorhies H, Manger RL, Bernstein ID. Notch-mediated expansion of human cord blood progenitor cells capable of rapid myeloid reconstitution. Nat Med 2010; 16 : 232–237.
51. de Lima M, McNiece I, Robinson SN, et al. Cord-blood engraftment with ex vivo mesenchymal-cell coculture. N Engl J Med 2012; 367 : 2305–2315.
52. Horwitz ME, Chao NJ, Rizzieri DA, et al. Umbilical cord blood expansion with nicotinamide provides long-term multilineage engraftment. J Clin Invest 2014; 124 : 3121–3128.
53. Rocha V, Labopin M, Ruggeri A, et al. Unrelated cord blood transplantation: outcomes after single-unit intrabone injection compared with double-unit intravenous injection in patients with hematological malignancies. Transplantation 2013; 95 : 1284–1291.
54. Liu H, Rich ES, Godley L, et al. Reduced-intensity conditioning with combined haploidentical and cord blood transplantation results in rapid engraftment, low GVHD, and durable remissions. Blood 2011; 118 : 6438–6445.
55. Le plan greffe 2012-2016. l’Agence de la biomédecine. Agence relevant du ministère de la Santé, France. 2012.
56. Matsumoto MM, Matthews KR. A need for renewed and cohesive US policy on cord blood banking. Stem Cell Rev 2015; 11 : 789–797.
57. Ballen KK, Verter F, Kurtzberg J. Umbilical cord blood donation: public or private? Bone Marrow Transplant 2015; 50 : 1271–1278.
58. Passweg JR, Baldomero H, Peters C, et al. European Society for Blood and Marrow Transplantation EBMT. Hematopoietic SCT in Europe: data and trends in 2012 with special consideration of pediatric transplantation. Bone Marrow Transplant 2014; 49 : 744–750.
59. Zdroj: www.parentsguidecordblood.org .
60. Gluckman E, Ruggeri A, Rocha V, et al. Eurocord, Netcord, World Marrow Donor Association and National Marrow Donor Program. Family-directed umbilical cord blood banking. Haematologica 2011; 96 : 1700–1707.
61. Reed W, Smith R, Dekovic F, et al. Comprehensive banking of sibling donor cord blood for children with malignant and nonmalignant disease. Blood 2003; 101 : 351–357.
62. Manegold G, Meyer-Monard S, Tichelli A, Granado C, Hösli I, Troeger C. Controversies in hybrid banking: attitudes of Swiss public umbilical cord blood donors toward private and public banking. Arch Gynecol Obstet 2011; 284 : 99–104.
63. Wagner AM, Krenger W, Suter E, en Hassem D, Surbek DV. High acceptance rate of hybrid allogeneic-autologous umbilical cord blood banking among actual and potential Swiss donors. Transfusion 2013; 53 : 1510–1590.
64. Katz G. Industrial economics of cord blood banks. In: Cord Blood Stem Cells Medicine. Edit.: Stavropoulos-Giokas, Charron, Navarrete. Elsevier 2015. Kapitola 24, s. 325–340.
65. Corsano B, Sacchini D, Šuleková M, Minacori R, Refolo P, Spagnolo AG. Allogeneic versus autologous: ethical issues in umbilical cord blood use. Eur J Bioethics 2015; 6 : 67–85.
66. O’Connor MAC, Samuel G, Jordens CFC, Kerridge IH. Umbilical cord blood banking: Beyond the public-private divide. J Law Med 2012; 19 : 512–516.
67. Burroughs L, Woolfrey A. Hematopoietic cell transplantation for treatment of primary immune deficiencies. Cell Ther Transplant 2010; 2 : 10.3205/ctt-2010-en-000077.01.
68. Aldenhoven M, Jones SA, Bonney D, et al. Hematopoietic cell transplantation for mucopolysaccharidosis patients is safe and effective: results after implementation of international guidelines. Biol Blood Marrow Transplant 2015; 21 : 1106–1109.
69. Aldenhoven M, Kurtzberg J. Cord blood is the optimal graft source for the treatment of pediatric patients with lysosomal storage diseases: clinical outcomes and future directions. Cytotherapy 2015; 17 : 765–774.
70. Malinová V, Honzík T. Lysosomální onemocnění – současné možnosti diagnostiky a terapie. Pediatr praxi 2013; 14 : 157–160.
Labels
Haematology Internal medicine Clinical oncology
Article was published inTransfusion and Haematology Today

2016 Issue 3-
All articles in this issue
- Imunogenetické faktory ovlivňující aloimunizaci proti antigenům krevních skupinových systémů
- Rutinné používanie tromboelastometrie (ROTEM) k hodnoteniu koagulácie (adopcia ,,novej“ paradigmy hodnotenia koagulácie) na jednotke intenzívnej starostlivosti vedie k značnému zníženiu podávania krvnej plazmy
- Analýza zhody vyšetrenia inhibítorov FVIII Bethesda metódou a modifikovanou Nijmegen metódou a vplyv hraničných titrov inhibítorov na farmakodynamiku a farmakokinetiku FVIII u pacientov s hemofíliou A
- Analýza variantních nálezů počtu signálů při určení translokace t(4;14)(p16.3;q32.3) metodou FICTION u nemocných s mnohočetným myelomem
- Diagnostika a prognostické faktory lymfomu z buněk pláště
- Alfa-talasemie u 45 českých rodin a 37 rodin cizinců žijících v České republice: přehled literatury a molekulárně-genetická diagnostika
- Současnost a budoucnost alternativních zdrojů hematopoetických buněk včetně pupečníkové krve. Perspektivy bank pupečníkové krve. Závěry Panelu expertů
- Transfusion and Haematology Today
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Alfa-talasemie u 45 českých rodin a 37 rodin cizinců žijících v České republice: přehled literatury a molekulárně-genetická diagnostika
- Diagnostika a prognostické faktory lymfomu z buněk pláště
- Imunogenetické faktory ovlivňující aloimunizaci proti antigenům krevních skupinových systémů
- Analýza zhody vyšetrenia inhibítorov FVIII Bethesda metódou a modifikovanou Nijmegen metódou a vplyv hraničných titrov inhibítorov na farmakodynamiku a farmakokinetiku FVIII u pacientov s hemofíliou A
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

