-
Medical journals
- Career
Analýza zhody vyšetrenia inhibítorov FVIII Bethesda metódou a modifikovanou Nijmegen metódou a vplyv hraničných titrov inhibítorov na farmakodynamiku a farmakokinetiku FVIII u pacientov s hemofíliou A
: A. Morongová 1; D. Jankovičová 1; A. Bátorová 1; T. Prigancová 1; E. Khúnová 1; I. Waczulíková 2; M. Skraková 1; M. Mistrík 1
: Klinika hematológie a transfuziológie LF UK, SZU, Univerzitná nemocnica Bratislava 1; Fakulta matematiky, fyziky a informatiky Univerzity Komenského Bratislava 2
: Transfuze Hematol. dnes,22, 2016, No. 3, p. 172-181.
: Comprehensive Reports, Original Papers, Case Reports
Inhibítory faktora VIII (FVIII), ktoré predstavujú závažnú komplikáciu hemofílie A spôsobujúcu neúčinnosť substitučnej liečby, sa vyšetrujú klasickou Bethesda metódou a modifikovanou Nijmegen metódou. V práci sme vyhodnotili koreláciu výsledkov inhibítorov zistených obidvomi metódami a sledovali sme vplyv hraničných titrov inhibítorov na farmakodynamiku (in vivo recovery a vzostup aktivity FVIII) a farmakokinetiku FVIII (biologický polčas – T1/2 a klírens) po jeho intravenóznej aplikácii. Porovnali sme 265 paralelných vyšetrení inhibítora Bethesda a Nijmegen metódou vykonaných u 77 pacientov s ťažkou hemofíliou A; z nich 60 pacientov bez inhibítora (súbor 1) a 17 pacientov s anamnézou inhibítorov (súbor 2) po absolvovaní imunotolerančnej liečby (ITT) s parciálnym (n = 4) alebo kompletným (n = 13) úspechom. Nijmegen metóda spoľahlivo vylúčila falošnú pozitivitu nízkych titrov inhibítora medzi 0,51–0,9 Bethesda jednotiek/ml (BU/ml) zistených Bethesda metódou. Potvrdili sme dobrú koreláciu medzi cut-off 0,7 BU/ml a 0,5 Nijmegen BU/ml (NBU/ml). Hodnotenie 120 vyšetrení farmakodynamiky FVIII v súbore 1 ukázalo pri aktuálnom titri inhibítora 0,2 ± 0,1 NBU/ml hodnoty in vivo recovery (IVR) 109 ± 19,4 % (rozptyl 60–160 %) a vzostup FVIII 2,2 ± 0,7 (1,4–3,5) %/1 IU/kg. V súbore 2 (72 vyšetrení) sme pri aktuálnom titri inhibítora 0,5 ± 0,15 NBU/ml zistili signifikantne nižšie hodnoty IVR 86 ± 32 % (rozptyl 44–136 %) a vzostupu FVIII 1,6 ± 0,6 (0,72–2,8) %/1 IU/kg (p < 0,05). Aj vyšetrenie farmakokinetiky ukázalo signifikantné rozdiely medzi súborom 1 (20 pacientov/20 vyšetrení) a súborom 2 (13 pacientov po ITT/26 vyšetrení): T1/2 11,5 ± 1,8 (8,2–16,2) h versus 8,14 ± 3,61 (2,9–16,4) h a klírens 3,7 ± 1,2 (2,6–6,5) ml/kg/h versus 6,48 ± 2,24 (2,9–11,9) ml/kg/h; (p < 0,05).
Záver:
Ako referenčnú metódu vyšetrenia inhibítorov odporúčame Nijmegen modifikáciu s hranicou negativity 0,5 NBU/ml. Keďže u časti pacientov po ITT negatívny výsledok inhibítora nekoreluje s výsledkami farmakodynamiky a farmakokinetiky FVIII, pre spoľahlivé hodnotenie úspechu ITT je potrebné ďalšie sledovanie a metódy s vyššou senzitivitou a špecificitou na detekciu inhibítorov.KĽÚČOVÉ SLOVÁ:
inhibítor FVIII – Bethesda metóda – Nijmegen metóda – cut-off – nízky titer inhibítoraÚVOD
Vznik protilátok proti FVIII je dnes najzávažnejšou komplikáciou liečby hemofílie A, ktorá postihuje približne 10–30 % pacientov s ťažkým stupňom ochorenia [1]. Ide o neutralizujúce protilátky (inhibítory) typu IgG (IgG4 a IgG1), ktoré väzbou na funkčné epitopy na doménach A2, C2 prípadne A3 molekuly FVIII blokujú jeho interakcie s koagulačnými proteínmi (faktormi X a IXa) a fosfolipidom [2]. Prítomnosť inhibítorov znemožňuje účinnú profylaxiu a liečbu krvácaní u pacientov s hemofíliou a vyžaduje zásadnú zmenu liečebného režimu, vrátane používania menej účinných bypassových aktivít a pokusu o eradikáciu inhibítorov pomocou náročnej imunotolerančnej liečby (ITT). Inhibítory FVIII vznikajú najčastejšie u pacientov s ťažkým stupňom hemofílie krátko po začatí substitučnej liečby v priebehu prvých 30–50 expozičných dní (ED) s mediánom 15 ED [2, 3], sú teda najčastejšie u malých detí. Druhý pík výskytu inhibítorov predstavuje 5.–7. dekáda života hemofilikov [1]. Príčina, prečo táto komplikácia liečby vzniká len u časti chorých, nie je známa, predpokladá sa súvislosť s celým radom endogénnych (genetických) aj environmentálnych a s liečbou súvisiacich rizikových faktorov [4]. V súvislosti so súčasnou dostupnosťou vysoko purifikovaných koncentrátov FVIII a častejším používaním intenzívnejších liečebných režimov i skorej profylaxie sa odporúča pravidelné vyšetrenie inhibítorov FVIII od začiatku liečby hemofílie. Inhibítor je potrebné vylúčiť aj pri slabšej klinickej účinnosti liečby a pred každým plánovaným operačným výkonom [2, 5].
Špecifické vyšetrenie inhibítora sa zakladá na dôkaze zníženia aktivity FVIII v normálnej poolovanej plazme (NPP) zmiešanej 1 : 1 s plazmou pacienta s predpokladanou prítomnosťou inhibítora. Súčasne sa vyšetruje kontrolná zmes NPP s FVIII defektnou plazmou bez prítomnosti inhibítora. Aktivita FVIII v testovaných zmesiach sa stanoví jednostupňovou koagulačnou metódou na princípe aktivovaného parciálneho tromboplastínového času (aPTT) alebo chromogénnou metódou. Pri klasickej Bethesda metóde sa do kontrolnej zmesi namiesto FVIII defektnej plazmy pridáva imidazolový pufer [6]. Po 2-hodinovej inkubácii pri 37oC by mala aktivita FVIII v oboch zmesiach klesnúť približne na polovicu východiskovej hodnoty. Inhibítor sa stanoví na základe výpočtu tzv. reziduálnej aktivity, t. j. pomeru aktivity FVIII v zmesi plazmy pacienta s NPP a v kontrolnej zmesi a titer sa odčíta na semilogaritmickom grafe. Ak je reziduálna aktivita FVIII nižšia ako 25 %, vykonajú sa ďalšie vyšetrenia s riedenými vzorkami plazmy pacienta a zistený titer sa násobí použitým riedením. Pri inkubácii dochádza k posunu pH vo vyšetrovaných zmesiach na alkalickú stranu, čo spôsobuje mierne zníženie aktivity faktora VIII aj bez prítomnosti inhibítora a môže viesť k falošnej pozitivite, najmä pri nízkom titri inhibítora [7]. Modifikovaná, tzv. Nijmegen metóda vyšetrenia obchádza tento nedostatok klasickej metódy tým, že používa NPP pufrovanú na pH 7,4 a namiesto imidazolového pufra do kontrolnej zmesi pridáva defektnú plazmu bez prítomnosti inhibítora, zbavenú FVIII imunologickou metódou [7]. Titer inhibítora sa udáva v Nijmegen-Bethesda jednotkách (NBU/ml) [8]. Obidve, Besthesda i Nijmegen metóda, majú však stále limitovanú senzitivitu pri nízkom titri inhibítora. V literatúre sa nejednotne uvádza dolná hranica pozitivity inhibítora od 0,4 [2] do 0,7 BU/ml [3–6] pri Nijmegen metóde 0,3–0,5 NBU/ml [8–9]. Podozrenie na inhibítor možno vysloviť aj na základe vyšetrenia farmakodynamiky FVIII. „In vivo recovery“ (IVR) odráža vzťah medzi veľkosťou podanej dávky FVIII a zistenou aktivitou FVIII a tzv. „incremental response“ (IR) informuje, aký je vzostup aktivity FVIII (%) po dávke FVIII prepočítanej na 1 kg hmotnosti a výsledok sa vyjadruje ako %/1 IU/kg [2, 5, 10]. Diagnózu inhibítora podporí aj vyšetrenie farmakokinetiky FVIII, ktoré hovorí o distribúcii a eliminácii aplikovaného FVIII. Skrátený biologický polčas (T ½) a zrýchlený klírens FVIII svedčia pre prítomnosť inhibítora [2, 5].
Na našom pracovisku vyšetrujeme inhibítory FVIII klasickou Bethesda metódou a od roku 1993 aj modifikovanou Nijmegen metódou [11]. V práci sme sa zamerali na retrospektívne vyhodnotenie korelácie výsledkov inhibičných protilátok vyšetrených paralelne Bethesda aj Nijmegen metódou u pacientov s hemofíliou A bez anamnézy inhibítora aj u pacientov s inhibítormi, ktorí sa podrobili imunonolerančnej liečbe. Ďalším cieľom našej práce bolo porovnať hodnoty cut-off pre negativitu inhibítora pri oboch metódach a overiť negativitu inhibítora pri stanovenom cut-off ≤ 0,5 NBU/ml pre Nijmegen metódu aj pomocou vyšetrenia farmakodynamiky a farmakokinetiky faktora VIII v oboch sledovaných súboroch pacientov.
MATERIÁL A METÓDY
Súbor pacientov
Inhibítory a farmakodynamické a farmakokinetické parametre sme vyhodnotili u 77 pacientov s ťažkým stupňom hemofílie A (FVIII < 1 %). Súbor 1 tvorilo 60 pacientov s negatívnou anamnézou inhibítora a vekovým mediánom 17 rokov (rozptyl 1,5–68 rokov), z nich bolo 20 dospelých pacientov a 40 pacientov z prospektívnej štúdie, zameranej na incidenciu inhibítorov u predtým neliečených pacientov narodených v rokoch 1997–2015. Súbor 2 tvorilo 17 pacientov s anamnézou inhibítora, z nich 7 pacientov s mediánom veku 35 rokov (rozptyl 15–67 rokov) po úspešnej eradikácii inhibítora v rokoch 1993–2004 a 10 pacientov s vekovým mediánom 5 rokov (2–21 rokov), ktorí dostávali ITT v rokoch 2009–2016 a dosiahli kompletnú eradikáciu inhibítora alebo zníženie titra na úroveň < 0,8 BU/ml.
Vyšetrenie FVIII a inhibítora FVIII
Vyšetrenie FVIII sme robili v bezdoštičkovej plazme jednostupňovou metódou pomocou aPTT reagens (Pathromtin SL, Siemens) na koagulometri BCS XP© (Siemens). Inhibítor vyšetrujeme klasickou Bethesda metódou (BM) štandardným postupom a za pozitívny výsledok považujeme hodnotu > 0,7 BU/ml [6, 12]. Pri modifikovanej Nijmegen metóde (NM) používame NPP pufrovanú 0,1 M imidazolovým pufrom (Imidazol pufer, Siemens) s upraveným pH na 7,4 pridaním 1 M HCl pri 4 °C. Do kontrolnej zmesi sa pridáva komerčná deficitná plazma zbavená FVIII imunoabsorbciou (Factor VIII deficient, Siemens) [7, 11]. Prítomnosť inhibítora potvrdzuje opakovaný nález titra > 0,5 NBU/ml pri ≥ 2 nasledujúcich vyšetreniach [8]. Pri vyšetrovaní inhibítora v priebehu ITT v predvyšetrovacej fáze inaktivujeme reziduálny FVIII vo vzorke plazmy pacienta jej zahriatím na teplotu 58 °C po dobu 90 min s následnou krátkou centrifugáciou počas 2 min pri 1800 × g [8]. Vyšetrením FVIII potvrdíme jeho absenciu v inaktivovanej vzorke.
Vyšetrenie farmakodynamických parametrov
Základom je vyšetrenie aktivity FVIII pred aplikáciou a po aplikácii definovanej dávky FVIII [2, 13]. Kalkulácie vychádzajú z predpokladu, že v cirkulácii sa objaví 100 % podaného FVIII a že aplikácia každej 1 IU/kg hmotnosti vedie k vzostupu aktivity FVIII o 2 %. IVR sa počíta podľa vzorca: IVR (%) = [vzostup FVIII (%) x cirkulujúci objem plazmy (ml)]/ dávka FVIII (IU). Objem plazmy u jedinca s normálnym hematokritom je približne 45–50 ml/kg [6]. Na výpočet „incremental response“ sa používa vzorec: IR (%/1 IU/kg) = [vzostup FVIII (%)]/ dávka FVIII (IU/kg). Za normálnu hodnotu sa považuje IR 2 %/1 IU/kg a pomer medzi skutočne zistenou a normálnou hodnotou IR > 0,66 [9].
Vyšetrenie farmakokinetiky FVIII
Vyšetrenie farmakokinetiky VIII robíme štandardným postupom podľa odporučení ISTH (International Society of Thrombosis and Haemostasis): po 48–72 h vynechaní FVIII sa podá FVIII v dávke 30–50 IU/kg a stanoví sa jeho aktivita v sérii vzoriek odobratých za 10 min. 1 hod., 3 hod., 6 hod., 9 hod., 12 hod., 24 hod., prípadne 48 hod. po podaní [14]. Farmakokinetické parametre, t.j. T1/2, klírens FVIII, stredný rezidenčný čas a AUC (area under the curve) hodnotíme pomocou počítačového programu, ktorý nám poskytol jeho autor prof. Morfini a ktorý používa nekompartmentový model distribúcie a eliminá-cie FVIII [15]. Normálna hodnota T1/2 je 7,2–13,1 hod. [2], hodnoty klírensu FVIII sa pohybujú medzi 3,5 a 6,5 ml/kg/h, s priemerom 3,5 ml/kg/h u dospelých a 5,0 ml/kg/h u detí [15].
Kritériá úspechu ITT a eradikácie inhibítora
ITT sa hodnotí ako úspešná po dosiahnutí opakovane potvrdenej negativity inhibítora, hodnoty IVR ≥ 66 % a T1/2 ≥ 6 hod. [1, 3], viacerí autori dnes odporúčajú hodnotu T1/2 > 7 hod. [2, 3]. O parciálnom úspechu ITT hovoríme pri dosiahnutí dvoch z vyššie uvedených kritérií úspešnej liečby [3].
Hodnotenie výsledkov
Porovnali sme výsledky paralelného vyšetrenia inhibítorov Bethesda a Nijmegen metódou a určili sme cut-off pozitivity inhibítora pri oboch metódach. Pri stanovenom cut-off > 0,5 NBU/ml pre pozitivitu inhibítora pri Nijmegen metóde sme vyhodnotili vplyv negatívnych a hraničných titrov (0,51–0,8 NBU/ml) na farmakodynamiku FVIII.
Porovnali sme farmakodynamiku a farmakokinetiku FVIII u pacientov bez pozitívnej anamnéze inhibítora a s pozitívnou anamnézou inhibítora.
Štatistická analýza vyšetrení
Paralelné kvantitatívne hodnoty inhibítora získané Bethesda a Nijmegen metódou vyjadrené prie-merom ± SD, v zátvorkách uvádzame minimálnu a maximálnu hodnotu, sme porovnali štandardnou metódou (Studentov test) a koreláciu cut-off hodnôt negativity pri oboch metódach sme hodnotili metódou Blanda a Altmana s určením miery zhody, ktorou je vnútrotriedny korelačný koeficient (intraclass correlation coefficient). Diagnostickú výkonnosť metódy BU vzhľadom na referenčnú NBU sme overili analýzou ROC krivky (Receiver Operating Characteristic) pri vybraných cut-off bodoch, s uvedením senzitivity a špecificity. Stupeň zhody uvádzame ako mieru zhody Cohenovo kappa, stupeň všeobecnej nezhody sme testovali Maxwellovým chi-kvadrát testom a asymetriu nezhodných kategórií McNemarovým testom.
VÝSLEDKY
V celom súbore 77 pacientov sme retrospektívne vyhodnotili celkom 580 vyšetrení inhibítora, z nich 530 vyšetrení tvorilo paralelné vyšetrenie 265 vzoriek klasickou Bethesda metódou a Nijmegen modifiká-ciou. Vo vzorkách vyšetrených BM bol titer inhibítorov 0,8 ± 1,55 BU/ml (rozptyl 0,0–19,0 BU/ml) a pri vyšetrení NM bol titer 0,7 ± 1,58 NBU/ml (0,0–20,3 NBU/ml). Rozptyl zistených hodnôt nám umožnil porovnať obidve metódy pri rôznych titroch inhibítorov. Tabuľka 1 uvádza priemerné hodnoty zistené BM a paralelným vyšetrením NM vo vopred zvolených pásmach titrov medzi 0,0–4,0 BU/ml. V pásme medzi 0,5–1,0 BU/ml boli priemerné hodnoty titrov inhibítorov zistených NM signifikantne nižšie ako pri BM.
1. Priemerné hodnoty titrov inhibítora (± SD) pri vyšetrení Bethesda metódou v určenom rozpätí titrov v intervale medzi 0,0–3,0 BU/ml a výsledky paralelného vyšetrenia vzoriek Nijmegen metódou 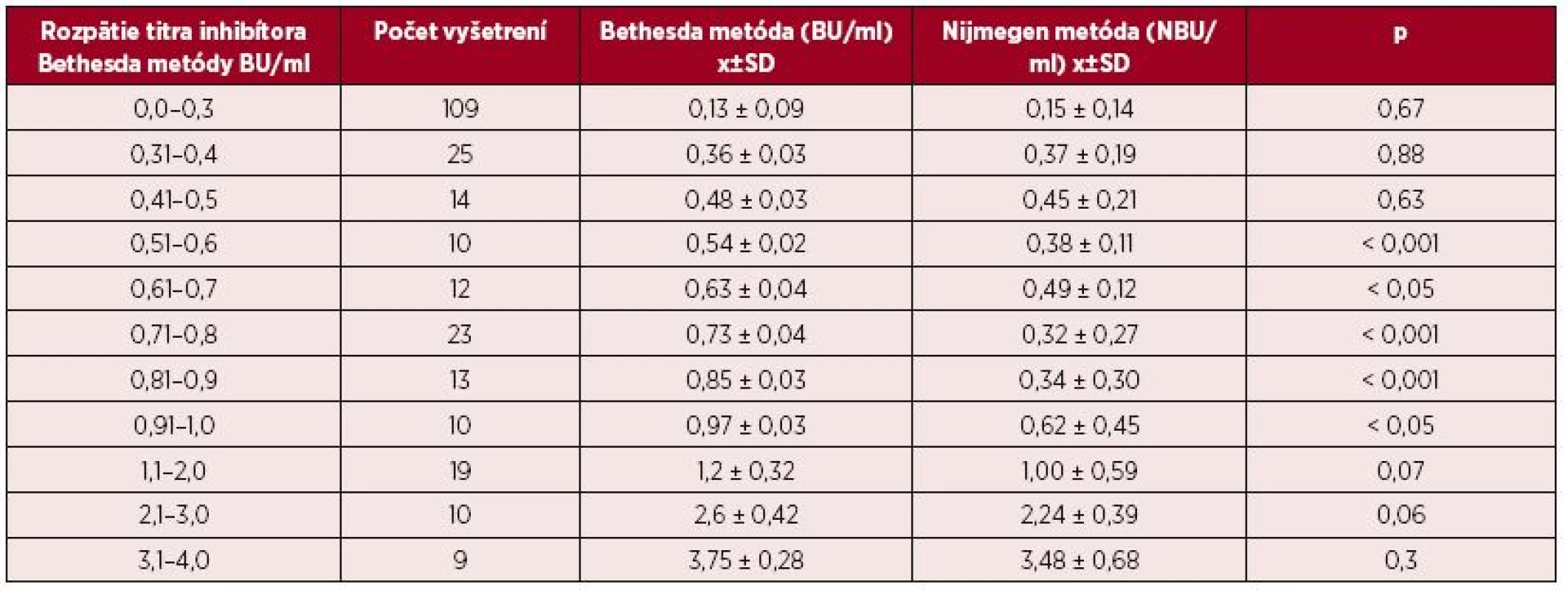
BU/ml = Bethesda jednotky/ml NBU/ml= Nijmegen Bethesda jednotky/ml Na porovnanie zhody oboch metód sme použili analýzu podľa Blanda a Altmana. Tabuľka 2 uvádza priemerné hodnoty a 95% hranice zhody sledovaných titrov stanovených Nijmegen metódou oproti BM. Pri referenčnej hranici negativity inhibítora 0,5 NBU/ml Nijmegen metódy sa potvrdila dobrá priemerná zhoda [0,023; (-0,346)-0,393] a súčasne pomerne silná vnútrotriedna korelácia s hraničným titrom 0,7 BU (0,638) Bethesda metódy. V prípade dichotomizácie hraničných hodnôt negativity inhibítora sa dosahuje najvyššia zhoda medzi 0,7 BU/ml a 0,5 NBU/ml (77,1 %). Podľa Cohenovho kappa korelačného koeficientu je vo výsledkoch stredne silná korelácia (p < 0,0001, 95 % CI 0,352–0,591), pričom nezhoda vyhodnotená McNemarovým testom bola nevýznamná. Grafické vyjadrenie dobrej priemernej zhody cut-off 0,5 NBU/ml a 0,7 BU/ml demonštruje Bland-Altmanov graf (obr. 1). ROC krivka (Receiver operating characteristic) svojím umiestením a veľkosťou plochy pod krivkou (AUC) 87,7 % (95% CI 83,6–91,8 %) vypovedá o dobrej diagnostickej výkonnosti klasifikovania inhibítora Bethesda metódou pri cut-off 0,7 BU/ml, ak za referenčnú považujeme Nijmegen metódu s cut-off 0,5 NBU/ml (obr. 2).
2. Bland-Altmanova metóda hodnotenia zhody výsledkov inhibítorov vyšetrených Nijmegen metódou pri rôznych hraniciach sledovaných titrov inhibítora do úrovne 1,0 BU/ml zistenej Bethesda metódou 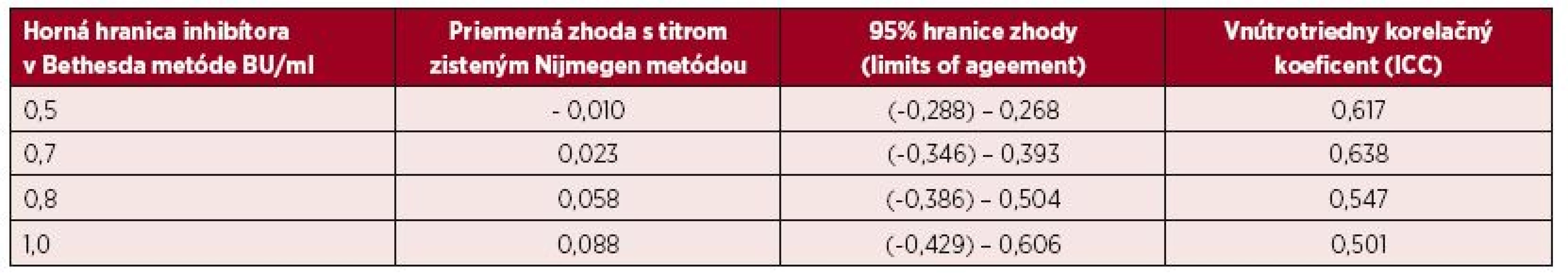
BU/ml = Bethesda jednotky/ml 1. Bland-Altmanov graf Rozloženie výsledkov okolo hodnoty priemernej zhody pre titer inhibítora do 0,7 BU/ml. 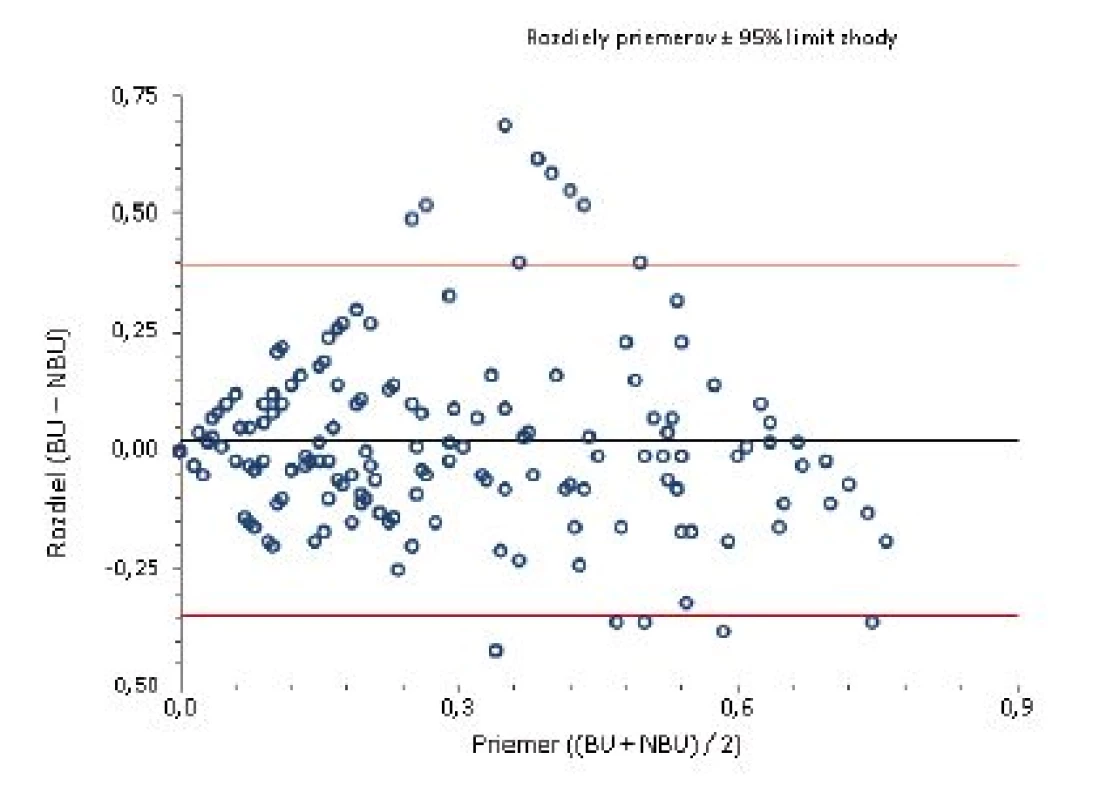
2. ROC krivka Krivka ROC (Receiver operating characteristic) vyjadrujúca špecificitu a senzitivitu vyšetrenia inhibítorov Bethesda metódou v porovnaní s Nijmegen metódou (referenčná metodika). Plocha pod krivkou (AUC) je 87,7 %. 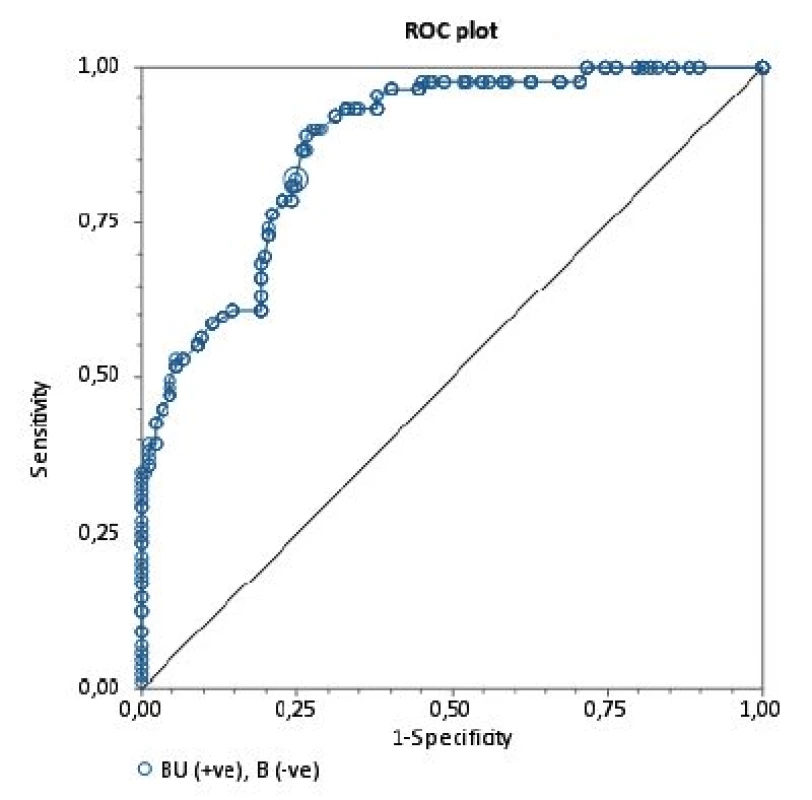
Klinický význam hraničných a nízkych titrov inhibítora do 0,8 NBU/ml sme hodnotili pomocou vyšetrenia farmakodynamických ukazovateľov (tab. 3). V súbore 1 (120 vyšetrení) bol pri negatívnom titri inhibítora IVR 109 ± 19,4 % (60–160 %) a IR 2,2 ± 0,7 (1,4–3,5) %/1 IU/kg. U 15 pacientov s ITT a negatívnym alebo redukovaným titrom inhibítora ≤ 0,8 NBU/ml sme 72 vyšetrení farmakodynamiky hodnotili v troch kategóriách podľa aktuálneho titra inhibítora v čase vyšetrenia. Priemerné hodnoty IVR a IR vo všetkých troch skupinách síce spĺňali kritériá kompletnej remisie, ale boli signifikantne nižšie ako u pacientov bez anamnézy inhibítora. Obrázky 3 a 4 demonštrujú, že u pacientov po ITT boli v 8 z 37 (22 %) vyšetrení vykonaných pri negatívnych titroch inhibíora hodnoty IVR a IR nižšie ako očakávané. Paradoxne, z 35 vyšetrení farmakodynamiky vykonaných pri titroch inhibítorov 0,55–0,8 NBU/ml bol až v 22 prípadoch (63 %) normálny IVR a v 18 (51,4 %) prípadoch normálna hodnota IR.
3. Parametre farmakodynamiky FVIII u 60 pacientov bez anamnézy inhibítora a u 15 pacientov s anamnézou inhibítora a ITT po dosiahnutí negativity inhibítora alebo redukcie titra ≤ 0,8 NBU/ml 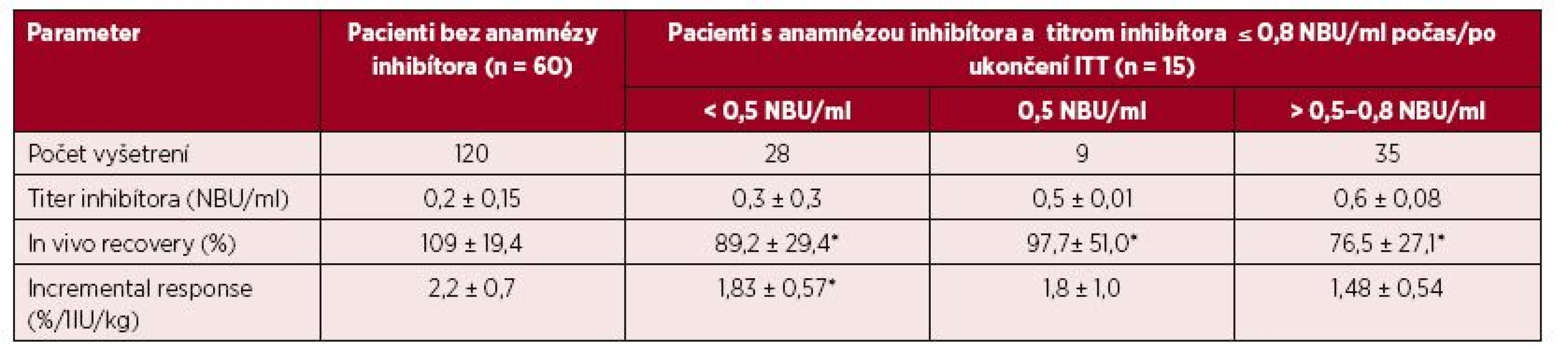
** N = počet vyšetrení; hodnoty vyjadrené priemerom ±SD *p < 0,05 – oproti pacientom bez anamnézy inhibítora **p < 0,05 – oproti pacientom bez anamnézy inhibítora a pacientom po ITT s negatívnym titrom inhibítora 3. Hodnoty iv recovery (IVR) FVIII po podaní dávky 40–50 IU/kg v súbore 2 pri rôznych titroch inhibítora po úspešnej alebo parciálne úspešnej imunotolerančnej liečbe 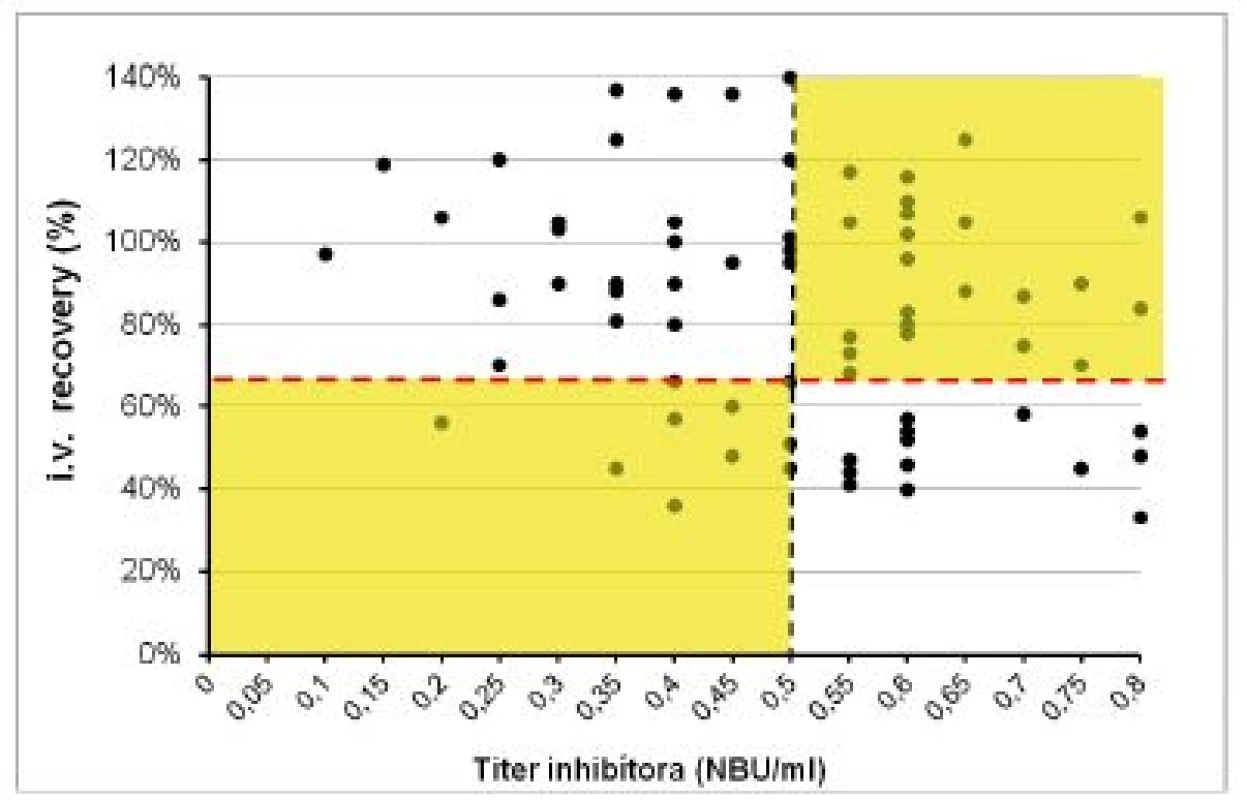
4. Hodnoty vzostupu aktivity FVIII („incremental response“) po podaní dávky 40–50 IU/kg u pacientov s anamnézou inhibítora pri rôznych titroch inhibítora po úspešnej alebo parciálne úspešnej imunotolerančnej liečbe 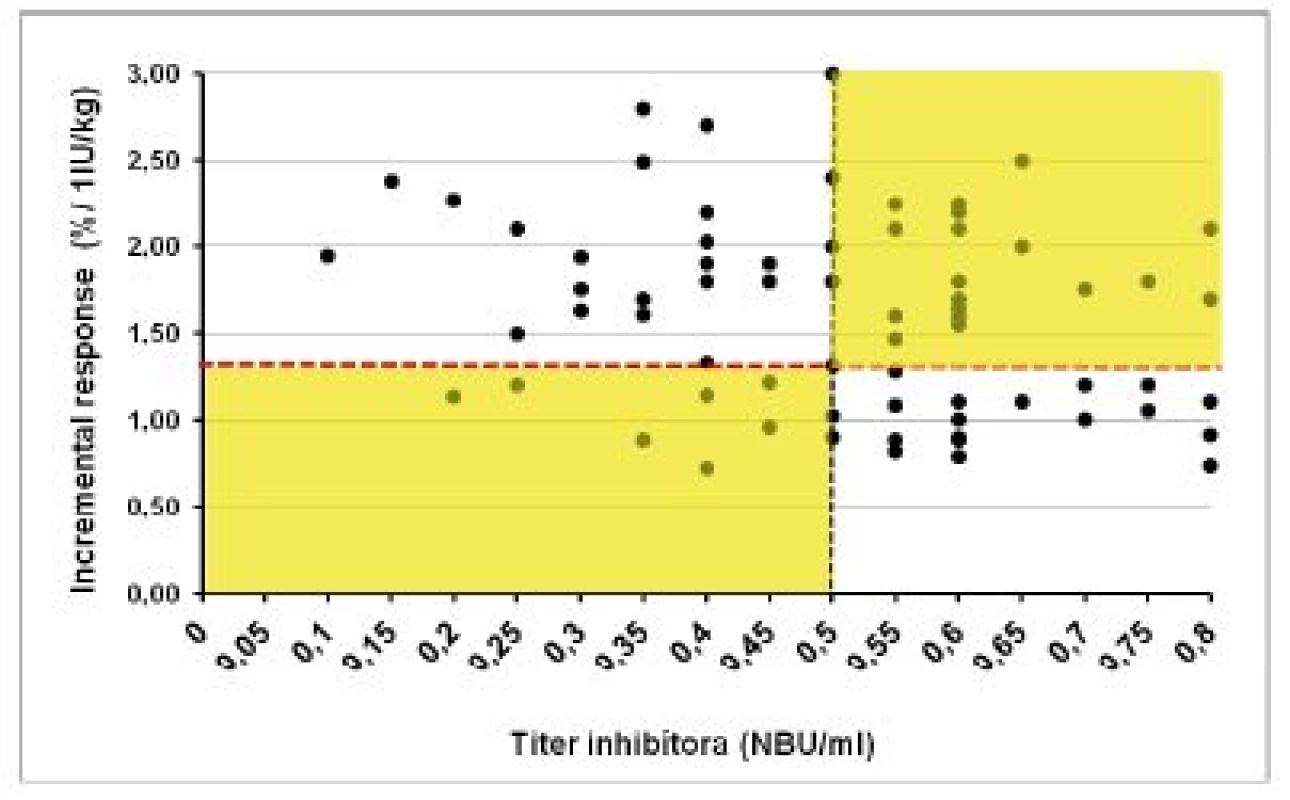
Kompletné vyšetrenie farmakokinetiky sme vykonali u 20 pacientov s negatívnou anamnézou inhibítora a u 13 pacientov s ITT po dosiahnutí negativity inhbítora a IVR > 66 %, na potvrdenie úspechu ITT pomocou stanovenia T1/2. Napriek predpokladanej remisii boli u pacietov s ITT signifikantné rozdiely vo všetkých hodnotených parametroch farmakokinetiky aj farmakodynamiky oproti pacientom bez anamnézy inhibítora (tab. 4). Požadovanú hodnotu T1/2 > 6 hod. sme zistili v 21 z 26 (81 %) vyšetrení farmakokinetiky, ale pri komplexnom hodnotení všetkých troch parametrov úspechu ITT spĺňalo kritériá kompletnej remisie 15/26 (58 %) vyšetrení, parciálnu remisiu sme potvrdili v 7 vyšetreniach (27 %), v 4 vyšetreniach sa znovu objavila prechodná hraničná pozitivita inhibítora (0,55–0,7 NBU/ml), ktorá zatiaľ vylučovala kompletný úspech ITT. Ako ukazuje obrázok 5, hodnota T1/2 nekorelovala vždy s aktuálnym titrom inhibítora, v 4 prípadoch bol T1/2 skrátený aj pri negatívnom titri inhibítora, a naopak v 2 zo 4 prípadov hraničnej pozitivity inhibítora bol T1/2 v norme (12,8 a 15,4 hod.). Až 11/26 (42 %) vyšetrení farmakokinetiky sme zaznamenali zvýšený klírens FVIII nad 6,5 ml/kg/h, a to aj v 4 prípadoch, ktoré spĺňali kritériá úspechu ITT.
4. Výsledky vyšetrenia farmakodynamiky a farmakokinetiky u 20 pacientov bez anamnézy inhibítora a u 13 pacientov po ITT s predpokladaným úspechom liečby 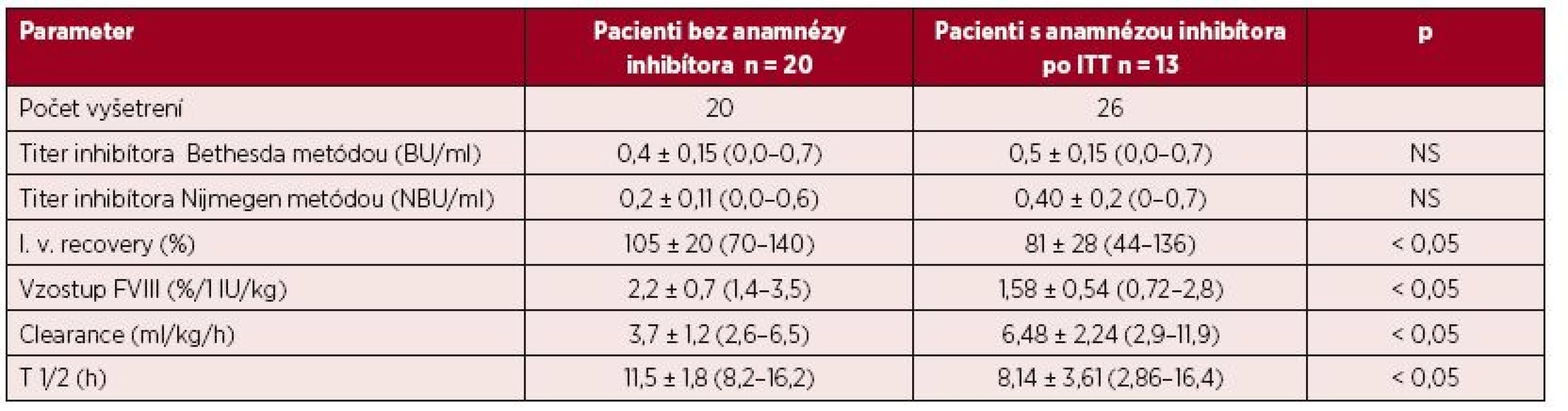
Hodnoty uvedené ako x ± SD (rozptyl) NS = rozdiel nesignifikantný 5. Biologický polčas (T1/2) a aktuálny titer inhibítora FVIII v čase vyšetrenia farmakokinetiky u 13 pacientov po imunotolerančnej liečbe (n = 26 vyšetrení) 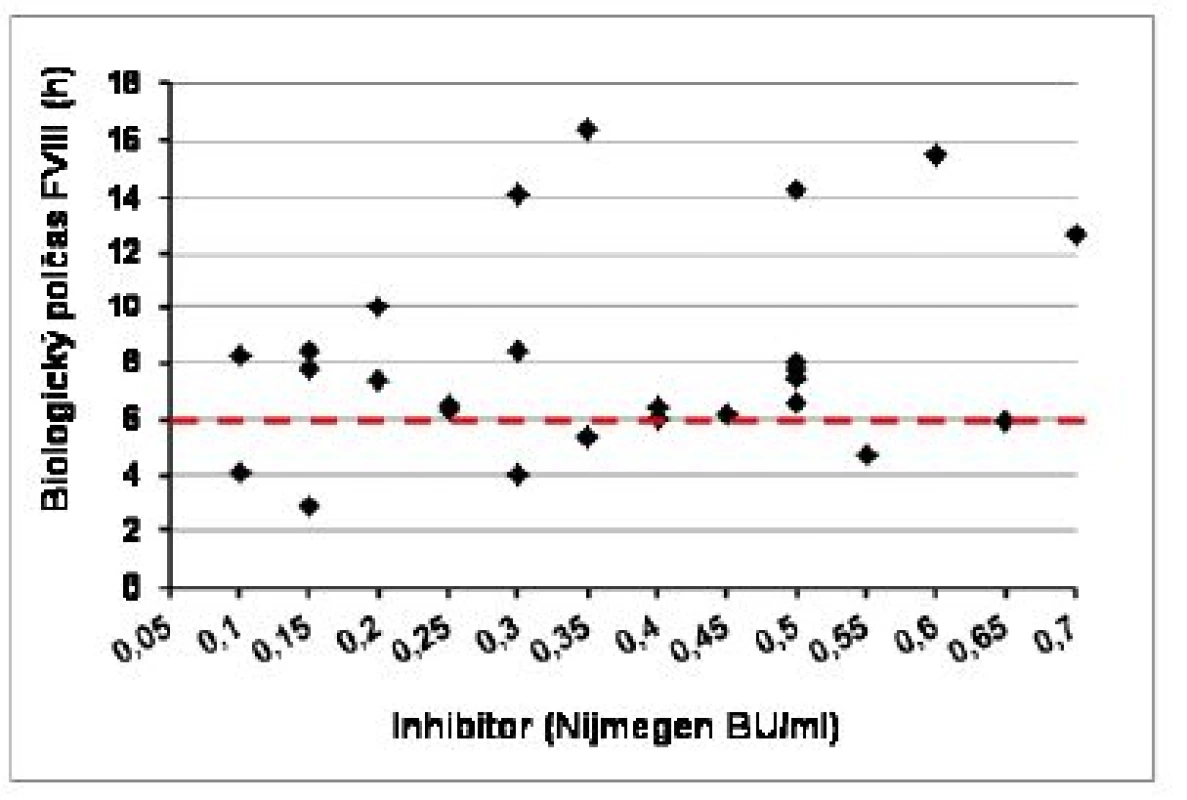
DISKUSIA
Prítomnosť inhibítora, ktorý vedie k neúčinnosti liečby hemofílie, predstavuje závažnú komplikáciu liečby hemofílie. Od spoľahlivej identifikácie inhibítora a jeho kvantitatívneho stanovenia závisí ďalšia stratégia liečby pacientov. Inhibítory postihujú najčastejšie malé deti vo veku do 2–3 rokov, keďže k ich vzniku dochádza v priebehu prvých 30–50 expozičných dní s mediánom 15 ED [16]. Medzinárodné štandardy pre liečbu hemofílie odporúčajú pravidelné vyšetrenie inhibítorov po každom 3.–5. ED až do prvých 20 dávok FVIII, neskôr po každom 10. ED do prvých 50 dní substitučnej liečby a po každom 20. ED až do 75–100 ED [2, 3, 5, 17]. Pri klasickej Bethesda metóde vyšetrenia inhibítora nastáva zmena pH v priebehu inkubácie vyšetrovanej zmesi, ktorá spôsobuje falošnú pozitivitu testu pri nízkych titroch inhibítora [8]. Aj my sme pri tejto metóde potvrdili zmenu pH vo vyšetrovanej zmesi zo 7,6 na 8,5, pričom v kontrolnej zmesi bol posun pH minimálny zo 7,6 na 7,8 [11]. Z tohto dôvodu na sledovanie nízkych titrov inhibítorov používame Nijmegen modifikáciu testu s kontrolnou plazmou s adjustovaným pH 7,4 [7]. Aj pri modifikovanej metóde je však známa pomerne vysoká inter-, ale aj intralaboratórna variabilita výsledkov. Okrem nepresností pri práci (nedodržanie teploty, dĺžky inkubácie) môžu byť rozdiely spôsobené aj ďalšími faktormi. Jednou z príčin je typ inhibítora (aloprotilátka/autoprotilátka), ktorý určuje jeho správanie sa vo vyšetrovanej zmesi (kinetika I. alebo II. typu). Príčinou môže byť aj rôzna kvalita komerčnej FVIII deficitnej plazmy a obsah von Willebrandovho faktora (vWF), ktorý stabilizuje FVIII. Absencia vWF môže spôsobiť falošné zvýšenie titra inhibítora až o 20–30 % [18]. Výsledok môžu ovplyvňovať aj stopy FVIII v deficitnej plazme, kontaminácia protilátkami proti FVIII v imunodepletovanej plazme alebo kontaminácia defektnej plazmy aktivovaným faktorom V (päť) pri chemickej deplécii FVIII. V neposlednom rade môže výsledok ovplyvniť aj prítomnosť protilátok lupus antikoagulant [19, 20]. Otvorenou ostáva aj otázka hranice pozitivity inhibítora. V literatúre sa udáva rôzna hodnota cut-off pri klasickej Bethesda metóde aj pri Nijmegen modifikácii [2, 3, 6, 8, 21, 22]. Giles et al. uvádzajú 0,5 BU/ml ako hodnotu mimo tzv. „šedej zóny“ Bethesda metódy, s najmenším podielom falošne pozitívnych výsledkov [23]. Nejednotnosť kritérií pre pozitivitu inhibítorov je aj jednou z príčin značnej variability výsledkov štúdií zameraných na sledovanie kumulatívnej incidencie inhibítorov u pacientov s hemofíliou [21, 22, 24–26].
Analýzou paralelného vyšetrenia 265 vzoriek Bethesda aj Nijmegen metódou sme potvrdili, že v intervale titrov inhibítora 0,51–1,0 BU/ml sú priemerné hodnoty výsledkov získaných Nijmegen metódou signifikantne nižšie (viď tab. 1) ako priemerné hodnoty pri BM, pričom až do úrovne 0,8 BU/ml pri Bethesda metóde nedosahovali paralelné titre Nijmegen metódy cut-off pre pozitivitu inhibítora. V intervale medzi 1,0–2,0 BU/ml už rozdiely titrov neboli štatisticky významné. Štatistickými metódami sme potvrdili dobrú koreláciu cut-off hodnoty 0,7 BU/ml a 0,5 NBU/ml ako hranice negativity inhibítora (viď tab. 2 a obr. 5). Naše pozorovania sú v zhode s výsledkami štúdie porovnávajúcej titer inhibítora u 588 pacientov s negatívnou a 122 pacientov s pozitívnou anamnézou inhibítora, ktorá stanovila za cut-off hodnotu pre pozitivitu inhibítora titer nad 0,5 NBU/ml [28]. Na základe našich pozorovaní, súhlasne s odporučením subkomisie ISTH pre testovanie inhibítora [23] považujeme Nijmegen modifikáciu za preferovanú metódu skríningu a vyšetrenia nízkych titrov inibítorov.
V literatúre chýbajú relevantné štúdie, ktoré by sledovali, či stanovené hodnoty pre negativitu inibítora nemajú vplyv na terapeutickú odpoveď, prípadne aký je vplyv hraničných a nízkych titrov inhibítora na farmakodynamiku a kinetiku FVIII najmä u pacientov s inhibítormi, ktorí po ITT dosiahli kompletnú alebo parciálnu remisiu [10, 27]. Klinický význam hraničných titrov inhibítora sme sledovali na základe hodnotenia farmakodynamiky a farmakokinetiky FVIII. Porovnanie parametrov farmakodynamiky, t.j. odpovede na podanú dávku FVIII u pacientov s negatívnou anamnézou inhibítora (120 vyšetrení) a u pacientov parciálnym alebo kompletným úspechom ITT (72 vyšetrení) ukázalo signifikantne vyššie hodnoty IVR a IR u pacientov bez anamnézy inhibítora. Najnižšie hodnoty IVR a IR boli podľa očakávania pri hraničných a nízkych titroch inhibítora. Pozorovali sme však aj paradoxné výsledky, t.j. nízke hodnoty IVR a IR pri negatívnom titri inhibítora a naopak, napriek hraničnej pozitivite inhibítora častý nález normálnych hodnôt IVR (63 % vyšetrení ) aj IR (v 51,4 % vyšetrení). Tieto výsledky potvrdzujú značné individuálne rozdiely pri dosahovaní laboratórnych kritérií efektívnej ITT [29, 30].
Vyšetrenie farmakokinetiky sme vykonali u 13 pacientov s predpokladanou kompletnou remisiou po ITT s cieľom potvrdiť normálnu hodnotu T1/2, ako posledného kritéria úspešnej ITT. Na rozdiel od kontrolnej skupiny 20 pacientov bez anamnézy inhibítora sme u pacientov po ITT napriek predpokladanej remisii pozorovali značnú variabilitu výsledkov, často bez korelácie s negatívnym alebo hraničným titrom inhibítora. Hodnota cut-off pre negativitu inhibítora u pacientov s ITT neodráža vždy jeho skutočný klinický význam [29]. V súlade s literatúrou sme potvrdili, že kritériá úspechu ITT sa nedosiahnu súčasne vo všetkých parametroch a môžu značne varírovať [9, 27, 29, 30]. Nie je jasné, prečo aj napriek potvrdenej absencii inhibítora u časti pacientov pomerne dlho pretrváva patologický výsledok IVR alebo veľmi krátky biologický polčas a naopak, prečo majú niektorí pacienti normálny T1/2 alebo IVR aj napriek hraničnej pozitivite inhibítora. Za dôležité možno považovať naše pozorovanie, že až v 11 z 26 (42 %) vyšetrení farmakokinetiky bol zvýšený klírens FVIII, a to aj v 8 prípadoch s negatívnym titrom inhibítora a v 6 prípadoch normálneho výsledku biologického polčasu. Plauzibilným sa javí vysvetlenie o perzistencii nedetegovateľného inhibibítora, ktorý urýchľuje klírens FVIII. V priebehu ITT v rámci zmeny imunologickej odpovede by mohlo dôjsť aj k zmene vlastností pôvodného inhibítora s jeho nižšou detegovateľnosťou klasickými metódami. Dardikh et al. [27] zistili, že nízke titre inhibítora, nedetegovateľné Nijmegen metódou môžu skracovať T1/2 u pacientov po ITT. Naopak, Mondorf et al. [9] vylučujú možnosť, že nedostatočná in vivo recovery u pacientov bez inhibítora je spôsobená protilátkami proti FVIII nedetegovateľnými Bethesda metódou. U pacientov s hemofíliou môžu byť okrem inhibítorov prítomné aj neinhibične pôsobiace protilátky, ktoré sa viažu na nefunkčné epitopy molekuly s tvorbou imunokomplexov odstraňovaných z cirkulácie mononukleárnym fagocytujúcim systémom. Aj tieto protilátky môžu urýchľovať klírens a prípadne skracovať biologický polčas FVIII a tým znižovať účinnosť substitučnej liečby. Tieto protilátky nie sú detekovateľné funkčnými ale len imunoprecipitačnými a ELISA metódami [9, 10].
Na základe našich pozorovaní sa domnievame, že pri posudzovaní definitívneho úspechu ITT je okrem štandardných kritérií, ako sú negativita inhibítora, in vivo recovery a biologický polčas FVIII, vhodné zohľadniť aj ďalšie farmakokinetické ukazovatele. Komplexné vyšetrenie umožní lepšie rozhodovanie o intenzite a dĺžke trvania ITT, inými slovami, môže predísť neadekvátnej redukcii dávok FVIII alebo predčasnému ukončeniu ITT. Po dosiahnutí úspechu ITT pre potreby bežnej profylaxie alebo liečby bežného krvácania postačuje monitorovanie farmakodynamiky FVIII. Ak je potrebná dlhodobejšia normalizácia hemostázy alebo operácia, okrem vyšetrenia inhibítora a farmakodynamiky vykonávame u týchto pacientov vždy aj komplexné vyšetrenie farmakokinetiky a pri voľbe optimálneho spôsobu substitučnej liečby zohľadňujeme aktuálne výsledky T1/2 ale aj klírensu FVIII. Pri bolusovej substitučnej liečbe tieto hodnoty umožňujú individualizované dávkovanie a voľbu optimálneho intervalu podávania FVIII. Pri zrýchlenom klírense FVIII volíme kontinuálnu infúziu FVIII s adjustáciou udržiavajúcej dávky podľa aktuálnych hodnôt klírensu FVIII [31].
Limitovaný počet našich pozorovaní zatiaľ nedovoľuje urobiť jednoznačné závery, či izolovaný pozitívny nález hraničného titra inhibítora alebo niektorého z ukazovateľov farmakodynamiky alebo farmakokinetiky bez korelácie s ostatnými parametrami môže u pacientov po ITT signalizovať len prechodný úspech ITT, prípadne pravdepodobnosť relapsu inhibítora alebo svedčiť pre reziduálnu aktivitu imunologického systému s tvorbou štandardnými metódami nedetegovateľného inhibítora.
ZÁVER
Naše pozorovania potvrdzujú, že Nijmegen metóda vyšetrenia inhibítorov zlepšuje špecificitu vyšetrenia a pomáha vylúčiť falošnú pozitivitu výsledkov Bethesda metódy najmä v rozpätí titrov 0,5–0,9 BU/ml. Hodnotenie 530 vyšetrení (265 paralelných vyšetrení) potvrdilo dobrú koreláciu hodnôt cut-off pre pozitivitu inhibítora nad 0,7 BU/ml a 0,5 NBU/ml, preto odporúčame používať Nijmegen metódu ako referenčnú. Sledovanie klinického významu hraničných a nízkych titrov inhibítorov medzi 0,55–0,8 NBU/ml u pacientov s anamnézou inhibítorov po ITT neukázalo jednoznačnú koreláciu s farmakodynamickými a farmakokinetickými ukazovateľmi. Aj pri nízkom titri inhibítora môžu mať pacienti normálny iv recovery, odpoveď na podaný FVIII a biologický polčas FVIII a naopak, malý počet pacientov vykazuje subnormálne výsledky uvedených ukazovateľov napriek negativite inhibítora. Tieto pozorovania vyvolávajú potrebu ďalšieho sledovania a citlivejších vyšetrovacích metód, ktoré by pomohli lepšie definovať efekt a najmä klinický význam hraničných titrov inhibítorov.
Podiel autorov na práci
AM a AB – navrhli štúdiu, zozbierali a vyhodnotili údaje.
AM – napísala rukopis.
AB – doplnila rukopis.
AB, DJ, MM – revidovali rukopis a potvrdili finálnu verziu.
AM, AB, DJ, TP – participovali na štúdii, vykonávali sledovanie pacientov, menažovali imunotolerančnú liečbu a vykonávali vyšetrenie farmakodynamiky a farmakokinetiky FVIII.
EK – realizovala laboratórne vyšetrenie inhibítorov.
MS – validovala výsledky vyšetrení.
IW – štatisticky vyhodnotila výsledky.
Prehlásenie autorov
Autor práce prehlasuje, že v súvislosti s témou, vznikom a publikáciou tohto článku nie je v strete záujmov, a vznik ani publikácia článku neboli podporené žiadnou farmaceutickou firmou. Toto prehlásenie sa týka aj všetkých spoluautorov.
Doručeno do redakce dne 12. 5. 2016.
Přijato po recenzi dne 8. 6. 2016.
MUDr. Anna Morongová
Klinika hematológie a transfuziológie LF UK, SZU UNB
Nemocnica sv. Cyrila a Metoda
Antolská 11
851 07 Bratislava 5
Slovenská republika
e-mail: annamorong@gmail.com
Sources
1. Hay CR, Palmer B, Chalmers E, et al. Incidence of factor VIII inhibitors throughout life in severe hemophilia A in the United Kingdom. Blood 2011; 117 : 6367 – 6370.
2. Collins P, Chalmers E, Hart D, et al. Diagnosis and management of acquired coagulation inhibitor: a guideline from UKHCDO. British Journal of Haematology 2013; 162 : 758–773.
3. Valentino LA, Kempton CL, Kruse – Jarres R, et al. US Guidelines for immune tolerance induction in patients with haemophilia and an inhibitors. Haemophilia 2015; 21 : 559–567
4. Astermark J, Altisent C, Batorova A, Diniz MJ, Gringeri A, Holme PA. Non – genetic risk factors and the development of inhibitors in haemophila: a comprehensive review and consensus report. Haemophilia 2010; 16 : 747–766.
5. Bátorová A, Jankovičová D, Žarnovičanová M, et al. Národné štandardné postupy pre liečbu hemofílie a iných vrodených koagulopatii na Slovensku. Lekársky obzor 2008; 7–8 : 330–340.
6. Kasper CK, Aledort LM, Counts RB, Edson JR, et al. A more uniform measurements of Factor VIII inhibitors. Thromb Diath Hemorh 1975; 34 : 869–872.
7. Verbruggen B, Novakova I, Wessels H, et al. The Nijmegen modification of the Bethesda assay for factor VIII:C inhibitor: improved specifi-city and reliability. Throm Haemost 1995; 73 : 247–251.
8. Verbrugen B. Diagnosis and quantification od factor VIII inhibitors. Haemophilia 2010; 16 : 20–24.
9. Mondorf W, Klinge J, Luban NLC, et al. Low factor VIII recovery in haemophilia A patients without inhibitor titre is not due to the pre-sence of anti-factor VIII antibodies undetectable by the Bethesda assay. Haemophilia 2001; 7 : 13–19.
10. Kempton CL, Meeks SL, Harvey RD, Abshire TC. Evaluation of factor VIII pharmacokinetics and anti – factor VIII antibodies in four boys with haemophilia A and a poor clinical response to factor VIII. Haemophilia 2011; 17 : 155–156.
11. Filová A, Lysá Z, Bátorová A, Balážová E. Vyšetrovanie inhibítorov FVIII:C Nijmegen modifikáciou Bethesda metódy. Hematológia a Transfuziológia 2000; 4 : 173–177.
12. Favaloro EJ Bonar R, Kershaw G, et al. Laboratory identification of factor VIII inhibitors in the real world: the experience from Australasia. Haemophilia 2010; 16 : 662–670.
13. Bátorová A. Fyziológia a hemostázy. In: Sakalová A, Bátorová A, Hrubiško M, Mistrík M, et al. Klinická hematológia. Osveta, Martin 2010; 155–180 (ISBN 9788080633240).
14. Morfini M, Lee M, Messori A. The design and analysis of half-life and recovery studies for factor VIII and factor IX. Factor VIII/Factor IX Scientific and Standardization Commitee of the International Society for Thrombosis and Haemoastasis. Thromb Haemost 1991; 66 (3): 384–386.
15. Messori A, Longo G, Mattucci M, Morfini M, Ferrini PL. Clinical pharmacokinetics of factor VIII in patients with classical haemophilia. Clin Pharmacokinet 1987; 13 : 365–380.
16. Kurnik K, Bidlingmaier C, Engl W, Chehadeh H, Reipert B, Auerswald G. New early prophylaxis regimen that avoids immunological danger signals can reduce FVIII inhibitor development. Haematologia 2010; 16 : 256–262.
17. Hay CR, Brown S, Collins PW, et al. The diagnosis and management of factor VIII and IX inhibitirs: a guideline from United Kingdom Haemophilia Centre Doctors Organisation. Brithis Journal of Haematology 2006; 133 : 591–605.
18. Verbruggen B, Giles A, Samis J, et al. The type of factor VIII deficient plasma used influences the performance of the Nijmegen modification of the Bethesda assay for factor VIII inhibitors. Throm Haemost 2001; 86 : 1435–1439.
19 Verbruggen B, van Heerde WL, Laros-van Gorkom B. Improvements in factor VIII inhibitor detection: from Bethesda to Nijmegen. Throm Haemost 2009; 35 : 752–759.
20. Tripodi A, Mancuso ME, Chantarangkul V, et al. Lupus antikoagulants and their relationship with the inhibitors against coagulation factor VIII: considerations on the differentiation between the 2 circulating anticoagulants. Clin Chem 2005; 51 : 1883–1885.
21. Calvez T, Chambost H, Claeyssens-Donadel S. Recombinant factor VIII products and inhibitor development in previously untreated boys with severe hemophilia A. Blood 2014; 124 : 3398–3408.
22. Gouw SC, van der Bom JG, Lyiung R, et al. for the PedNet and RODIN Study Group. Factor VIII products and inhibitor development in severe hemophilia A. N Engl J Med 2013; 368 : 231–239.
23. Giles AR, Verbruggen B, Rivard GE, et al. A detailed comparison of the performance of the standard versus The Nijmegen modification of the Bethesda assay in detecting factor VIII:C inhibitors in the haemophilia A population of Canada. Thromb Haemost 1998; 79 : 872–875.
24. Fischer K, Lassila R, Peyvandi F, et al. EUHASS participants. Inhibitor development in haemophilia according to concentrate. Four-year results from the European Haemophilia Safety Surveillance (EUHASS) project. Thromb Haemost 2015; 113(5): 968–975.
25. Peyvandi F, Mannucci PM, Garagiola I, et al. A randomized trial of FVIII and neutralizing antibodies in hemophilia A. N Engl J Med 2016; 374 : 2054–2064.
26. Iorio A, Halimeh S, Holzhauer S, et al. Rate of inhibitor development in previously untreated hemophilia A patients treated with plasma – derived or recombinant factor VIII concentrates: a systematic review. Journal of Thrombosis and Haemostasis 2010; 8 : 1256–1265.
27. Dardikh M, Albert T, Masereeuw R, et al. Low titre inhibitors, undetectable by the Nijmegen assay, reduce factor VIII half – life after immune tolerance induction. J Throm Haemost 2012; 10 : 706–708.
28. Miller CH, Platt SJ, Rice AS, et al. Validation of Nijmegen-Bethesda assay modifications to allow inhibitor measurement during replacement therapy and facilitate inhibitor surveillance. Journal of Thrombosis and Haemostasis 2012; 10 : 1055–1061.
29. Batorova A, Jankovicova D, Morongova A, et al. Inhibitors in Severe Hemophilia A: 25-Year Experience in Slovakia. Semin Thromb Hemost 2016 May 28. [Epub ahead of print].
30. Kreuz W, Escuriola Ettingshausen C, Vdovin, et al. First prospective report on immune tolerance in poor risk haemophilia A inhibitor patients with a single factor VIII/von Willebrand factor concentrate in an observational immune tolerance induction study. Haemophilia 2015; 22: 87–95.
31. Batorova A, Martinowitz U. Continuous Infusion of Coagulation Products in Hemophilia, Chapter 29. In: Lee ChA, Berntorp EE, Hoots WK (Eds). Textbook of Hemophilia, 3rd Edition 2014, Wiley-Blackwell: 204–212.
Labels
Haematology Internal medicine Clinical oncology
Article was published inTransfusion and Haematology Today

2016 Issue 3-
All articles in this issue
- Immunogenetic factors influencing red blood cell alloimmunization
- Routine use of thromboelastometry (ROTEM) for coagulation evaluation (adoption of ,,new“ paradigm of coagulation evaluation) in the intensive care unit leads to a significant reduction in the administration of blood plasma
- Correlation analysis of standard Bethesda method versus modified Nijmegen assay in detecting factor VIII inhibitors, and impact of marginal titer inhibitors on FVIII pharmacodynamics and pharmacokinetics by patients with hemophilia A
- Analysis of variant number of signals in the determination of translocation t(4;14)(p16.3;q32.3) using FICTION method in patients with multiple myeloma
- Diagnosis and prognostic factors in mantle cell lymphoma
- Alpha-thalassemia in 45 Czech and 37 immigrant families: review of the literature and molecular diagnosis
- Alternative sources of haematopoietic cells including cord blood today and tomorrow. The outlook for cord blood banks – conclusions of the Panel of Experts
- Transfusion and Haematology Today
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Alpha-thalassemia in 45 Czech and 37 immigrant families: review of the literature and molecular diagnosis
- Diagnosis and prognostic factors in mantle cell lymphoma
- Immunogenetic factors influencing red blood cell alloimmunization
- Correlation analysis of standard Bethesda method versus modified Nijmegen assay in detecting factor VIII inhibitors, and impact of marginal titer inhibitors on FVIII pharmacodynamics and pharmacokinetics by patients with hemophilia A
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

