-
Medical journals
- Career
Diagnostika a prognostické faktory lymfomu z buněk pláště
: A. Obr 1; M. Mikešová 1; M. Jarošová 1; V. Procházka 1; B. Tessoulin 2; T. Papajík 1
: Université de Nantes et INSERM Centre Régional de Recherche en Cancérologie Nantes/Angers Unite Mixte de Recherche 892, Nantes, France ; Hemato-onkologická klinika LF UP a Fakultní nemocnice Olomouc 1; CHU de Nantes, Hématologie Clinique, Centre d'Investigation Clinique en Cancérologie, Nantes, France 2
: Transfuze Hematol. dnes,22, 2016, No. 3, p. 190-200.
: Comprehensive Reports, Original Papers, Case Reports
Lymfom z buněk pláště (mantle cell lymphoma, MCL) byl poprvé popsán jako samostatná diagnostická jednotka v R.E.A.L. klasifikaci (Revised European-American Classification of Lymphoid Neoplasms) z roku 1994. MCL představuje maligní onemocnění vycházející z B-lymfocytů, které se vyznačuje zvýšenou expresí cyklinu D1 a přítomností chromozomové translokace t(11;14)(q13;q32). Místem původu nádorových buněk je vnitřní plášť lymfatických folikulů. Svou morfologickou charakteristikou a biologickou povahou je MCL značně heterogenním onemocněním. Klinický průběh může být pozvolný u indolentních forem nemoci nebo naopak velmi rychlý u agresivních forem MCL. Vzhledem k této biologické a klinické různorodosti je u pacientů s tímto lymfomem nutná přesná diagnostika a pečlivé zhodnocení prediktivních ukazatelů.
KLÍČOVÁ SLOVA:
lymfom z buněk pláště – imunofenotyp – cytogenetické změny – pozitronová emisní tomografie – prognózaÚVOD
Lymfom z buněk pláště (mantle cell lymphoma, MCL) je stále poměrně mladou diagnostickou jednotkou ve spektru nehodgkinových lymfomů (NHL). Od jeho prvního popisu Raffeldem a Banksem uplynulo jen něco přes 25 let. Ti použili pojmenování „lymfom z buněk pláště“, aby popsali klinicky i biologicky variabilní podtyp lymfomu z malých lymfocytů se specifickou translokací t(11;14)(q13;q32) [1–4]. Od této doby prochází náhled na toto onemocnění nepřetržitým vývojem a na poli predikce osudu nemocného se každým rokem objeví množství nových informací. Vzhledem k různorodosti biologické povahy a klinického chování MCL je v době diagnózy poměrně těžké předpovídat vývoj choroby a prognózu nemocného.
EPIDEMIOLOGIE
MCL tvoří 5–9 % všech NHL. Incidence MCL má v zemích „západního světa“ vzestupný charakter. Počet nových případů za rok je 1–2/100 000 obyvatel [5]. Medián věku v době diagnózy je kolem 60 let. Častěji jsou nemocnými muži, poměr k ženám činí 2–3 : 1.
Dosud nebyly jasně identifikovány žádné rizikové faktory specificky zodpovídající za vznik MCL. Nebyl popsán jednoznačný vliv virů (Epstein-Barrové, nebo lidského T-cell leukemia/lymphoma viru – TCLV) na patogenezi MCL. Schollkopf et al. popsali možný vliv infekce Borrelia burgdorferi na riziko rozvoje MCL [6]. Tato analýza však byla založena jen na sérologických testech a epidemiologických datech, bez využití molekulárních vyšetřovacích metod. Na rozdíl od ostatních maligních lymfomů nebyl nalezen žádný vztah mezi vznikem MCL a získaným imunodeficitem nebo jinými nemocemi imunitního systému [7]. Obecně může řada chemických látek iniciovat rozvoj nehodgkinových lymfomů včetně MCL. Zde je nutno zmínit zejména chemická rozpouštědla či pesticidy [8, 9]. Nelze opomenout ani kouření nebo nadměrné pití alkoholu jako možné etiologické faktory vzniku NHL [10]. Výskyt MCL (podobně jako jiných NHL) byl popsán u rodinných příslušníků jedné příbuzenské linie (rodiče-děti). U potomků rodičů, kteří onemocněli lymfomem, bylo častěji pozorováno toto nádorové onemocnění než u jedinců bez rodinné zátěže, což by mohlo vysvětlovat genetickou predispozici k rozvoji lymfoidní neoplazie. Tort et al. dokonce popisují případ rodiny, kde byla otci ve věku 77 let diagnostikována chronická lymfocytární leukemie (CLL), která byla později podle morfologických rysů překlasifikována na MCL. Jeho dcera se od 43 let léčila s B-buněčnou lymfoproliferací. Po opakovaných relapsech byla v této nádorové populaci prokázána přítomnost t(11;14), která je základním diagnostickým kritériem MCL. Našli se i klinické záznamy, podle kterých babička této pacientky (matka otce) mohla mít CLL [11].
MORFOLOGIE
MCL obvykle tvoří monomorfní populace patologicky změněných lymfocytů. Nádorové buňky mívají chudou cytoplazmu a často nepravidelné nebo „rozštíplé“ jádro s jemným chromatinem. Podle struktury a velikosti buněk rozlišujeme několik cytologických variant lymfomu.
U „klasické varianty“ MCL je nádorový klon tvořen uniformní populací buněk malé až střední velikosti s nepravidelným jádrem a nenápadným jadérkem. „Malobuněčnou variantu“ tvoří malé lymfocyty s hustým chromatinem, podobně jako je tomu u buněk chronické lymfocytární leukemie a lymfomu z malých lymfocytů (CLL/SLL). Tato varianta je nejčastěji přítomna u pacientů s leukemickým obrazem v periferní krvi, splenomegalií a absencí významnějšího zvětšení lymfatických uzlin. Průběh onemocnění je v tomto případě obvykle pozvolný jako u jiných indolentních lymfoproliferací [12]. Další varianta je tvořena buňkami připomínajícími lymfocyty marginální zóny se světlou bohatou cytoplazmou. Méně často buňky připomínají lymfoblasty, odkud i název „blastická varianta“ MCL (obr. 1). Její buňky mají velké jádro s disperzním chromatinem a vysokou proliferační aktivitou. „Pleomorfní varianta“ je tvořená heterogenní populací větších buněk s vyšší proliferační aktivitou. Ta ale nedosahuje hodnot blastické varianty MCL. Poslední dvě jmenované jsou spojené s významně horší prognózou choroby [13, 14]. Je nutné podotknout, že jednotlivé cytologické subtypy MCL se mohou vzájemně prolínat, a vytvářejí tak heterogenní neoplastickou populaci s velmi variabilním a obtížně odhadnutelným klinickým chováním.
1. Patologické lymfocyty blastické varianty MCL (označeny šipkami) v nátěrech periferní krve 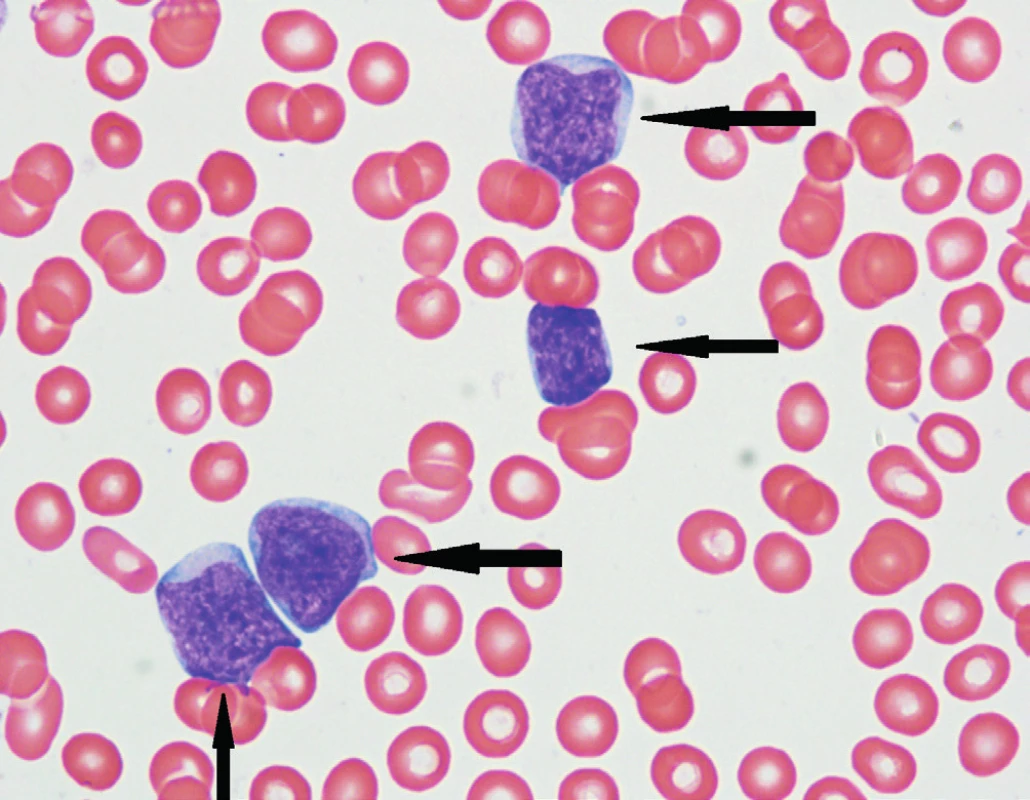
(Zdroj: laboratoř krevních obrazů a cytomorfologie Hemato-onkologické kliniky Lékařské fakulty Univerzity Palackého a Fakultní nemocnice Olomouc) Změny struktury nádorové lymfatické uzliny odpovídají pokročilosti infiltrace tkáně lymfomem. Podle těchto změn rozlišujeme tři základní typy MCL. Znakem časné infiltrace tkáně je zvětšená plášťová zóna lymfatického folikulu (26 % případů), kde nádorové buňky obklopují obvykle atrofovaná germinální centra. Následuje nodulární typ infiltrace (13 % případů), kde nádorové buňky tvoří nejednoznačně ohraničené „uzly“ v lymfatické tkáni. Nejčastější histologickou variantou je difuzní typ MCL (61 % případů), charakterizovaný rovnoměrnou infiltrací lymfatické uzliny monomorfními buňkami podobnými centrocytům. Lymfatická uzlina zde má obvykle zcela setřelou strukturou. Nově je k těmto morfologickým subtypům přidáno i šíření MCL „in situ“, které je typické jen minimálním zvětšením plášťové zóny lymfatické uzliny [12–15].
IMUNOFENOTYP NÁDOROVÝCH BUNĚK
Nádorová populace vychází z B-lymfocytů, čemuž odpovídá i imunofenotyp s přítomností typických znaků jako CD19, CD20, CD22, CD79a a CD79b. Buňky MCL na svém povrchu dále exprimují imunoglobuliny třídy IgM a IgD. Negativní bývají CD3, CD11c, CD10. Nepřítomnost CD23 a CD200 má diferenciálně diagnostický význam a pomáhá k odlišení MCL od CLL. U blastické nebo pleomorfní varianty často nacházíme méně obvyklý imunofenotyp patologických lymfocytů. Ve 12 % případů je nepřítomen znak CD5. Naopak přítomny bývají znaky CD10 (8 %), CD23 (21 %) a MUM1 (35 %) [16, 17]. Pro buňky MCL je charakteristická jaderná pozitivita cyklinu D1, která bývá přítomna u většiny variant choroby včetně těch s negativitou CD5. U cyklin-D1 negativních případů mohou být specifickými diagnostickými ukazateli pozitivita cyklinu D2, cyklinu D3 anebo SOX-11 [18].
GENETICKÉ A MOLEKULÁRNĚ BIOLOGICKÉ ZMĚNY
Klíčovou genetickou změnou v patogenezi MCL je translokace t(11;14)(q13;q32). Vyskytuje se až u 99 % nemocných s MCL. Při vzniku této translokace dochází ke zlomu v blízkosti genu pro cyklin D1 (CCND1; syn. BCL1, PRAD1) v oblasti chromozomu 11q13 a jeho přemístění do variabilní oblasti genu pro těžké řetězce imunoglobulinu (IGVH) na chromozomu 14q32 (obr. 2). Zlomové místo genu BCL1 se v 50–70 % případů nachází v oblasti zvané MTC (major translocation cluster), existuje ale řada dalších zlomových míst nazývaných mtr (minor translocation regions) [19]. Pomocí molekulárně biologických metod založených na polymerázové řetězcové reakci (PCR) lze prokázat přítomnost t(11;14)(q13;q32), pouze pokud dojde ke zlomu v MTC oblasti. Pro určení translokace a fuze genů nezávisle na lokalizaci zlomu je využívaná metoda fluorescenční in situ hybridizace (FISH) (obr. 3). Tato cytogenetická metoda využívá komerčně připravené sondy pokrývající celé geny BCL1 i IGH a umožňuje určit translokaci bez závislosti na místě zlomů. Vzácně se vyskytují i variantní translokace zahrnující geny pro lehké řetězce imunoglobulinu kappa t(2;11)(p11;q13) nebo lambda t(22;11)(q11;q13) [20, 21].
2. Schéma t(11;14)(q13;q32) a její vliv na patogenezi MCL Translokace t(11;14)(q13;q32) vede k tvorbě derivovaného chromozomu 11, který je výrazně kratší než normální chromozom 11, a derivovaného chromozomu 14, který je naopak výrazně delší. V důsledku translokace dochází k přemístění genu CCND1 na chromozomu 11 v pruhu q13 pod zesilovač transkripce těžkých řetězců imunoglobulinových genů (IgH) na chromozom 14 v pruhu q32. Na derivovaném chromozomu 14 vzniká fuzní gen IgH/CCND1. V normálních lymfocytech expresi cyklinu D1 detekovat nelze, ovšem následkem t(11;14), respektive t(2;11)/t(11;22) je gen CCND1 konstitutivně přepisován a jeho hladina zůstává v buňkách MCL vysoká. Cyklin D1 funguje jako spouštěč buněčného cyklu, vazbou s cyklin- ependentní kinázou 4 a 6 (CDK4, CDK6) vytváří komplex, který fosforyluje Rb1 protein a dochází k aktivaci řady transkripčních faktorů, které umožní vstup do další fáze buněčného cyklu. 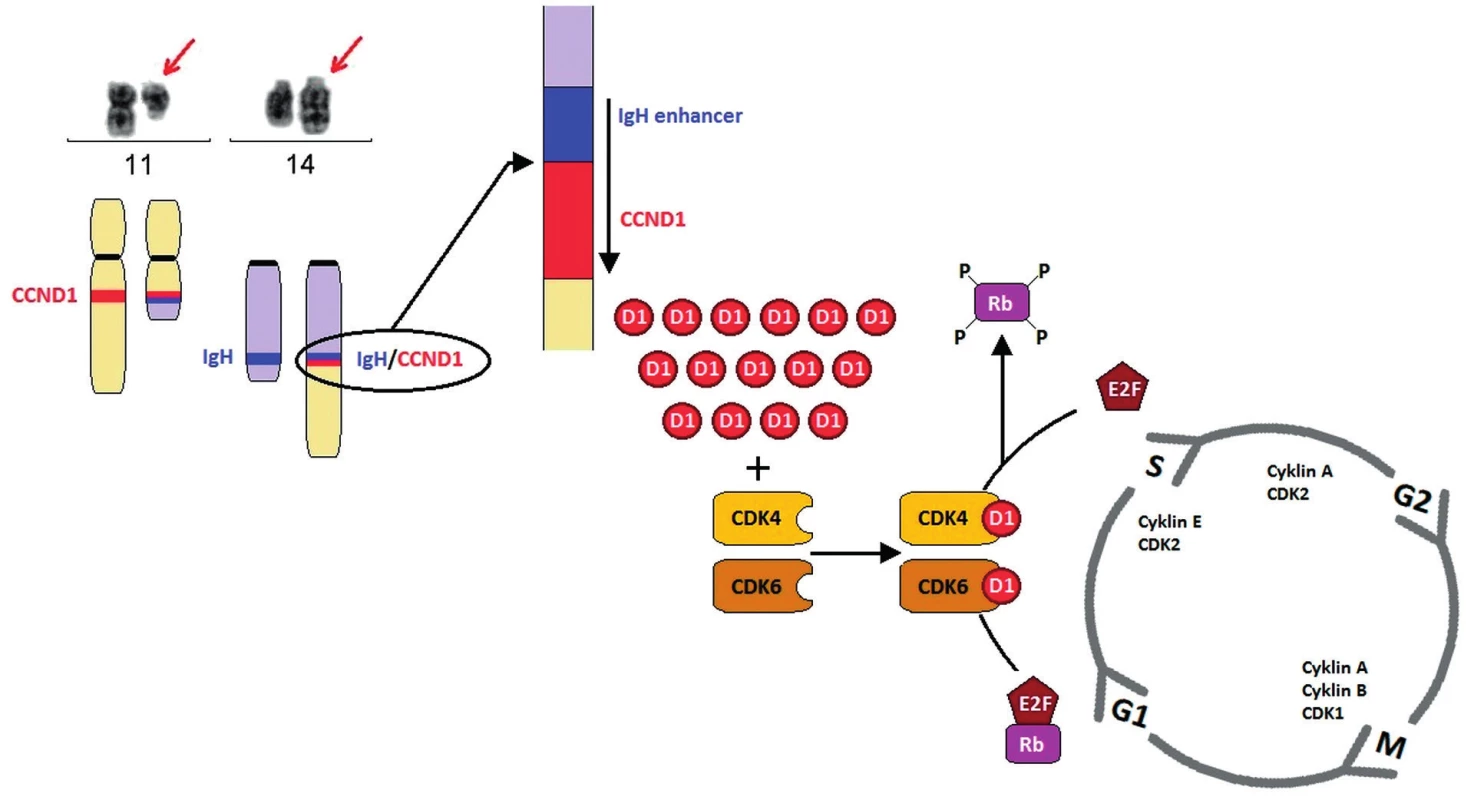
3. Detekce t(11;14)(q13;q32) fluorescenčně značenou genovou sondou A – negativní nález, B – pozitivní nález (označeny šipkami) 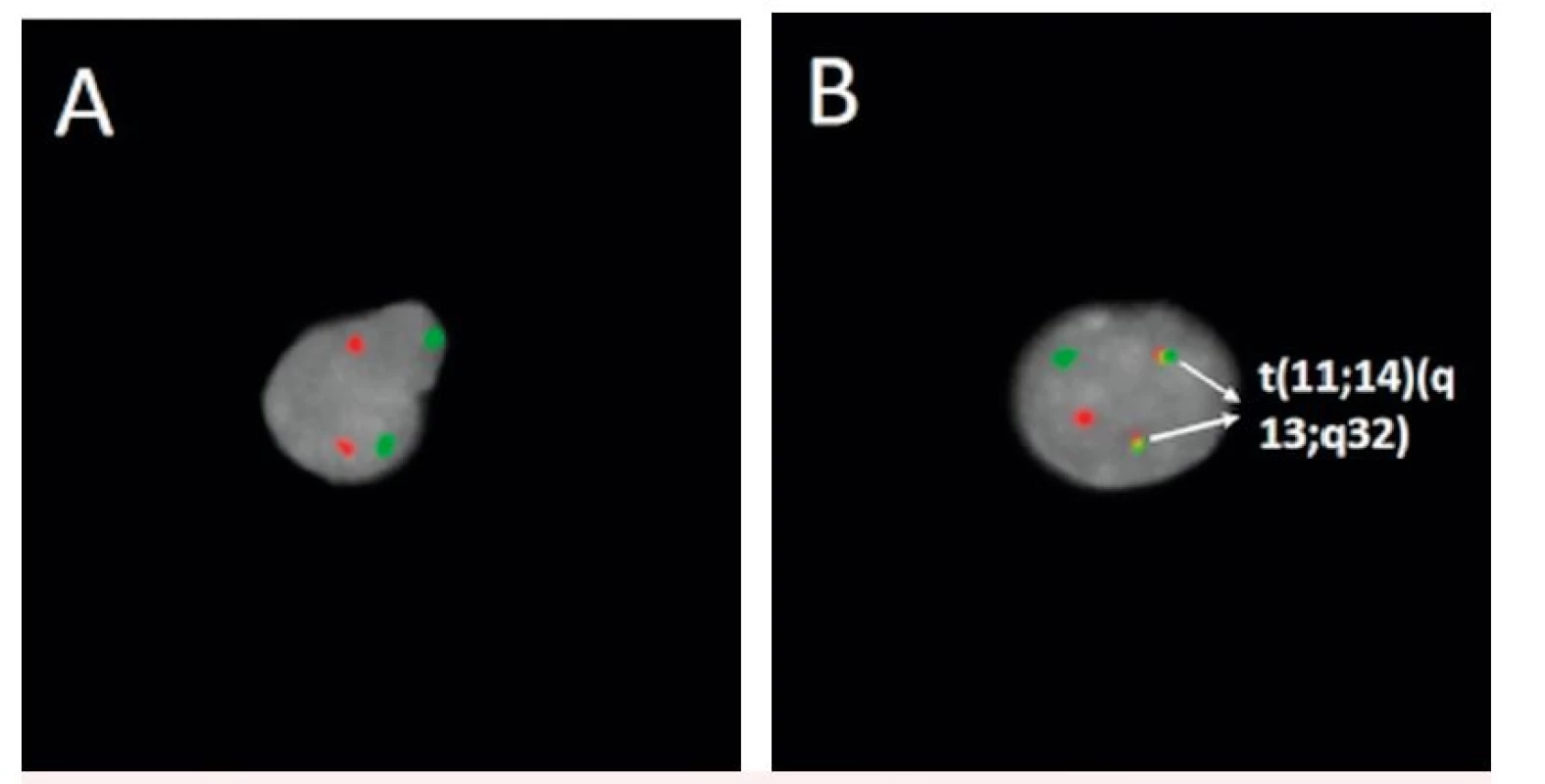
(Zdroj: cytogenetická laboratoř Hemato-onkologické kliniky Lékařské fakulty Univerzity Palackého a Fakultní nemocnice Olomouc) Výsledkem genových přestaveb je zvýšená exprese cyklinu D1. Zvýšenou expresi cyklinu D1 je možné stanovit pomocí imunohistochemických nebo molekulárně biologických metod. U pacientů, kteří jsou cyklin D1 negativní může být přítomna vysoká exprese cyklinu D2 nebo cyklinu D3. Vysoká exprese těchto cyklinů může být výsledkem translokace genů s těžkými nebo lehkými řetězci imunoglobulinů. Přítomnost zvýšené exprese cyklinu D2 a D3 není zcela specifická a byla pozorována také u jiných typů lymfoproliferací, jako je Burkittův lymfom (BL) nebo lymfoblastický lymfom (LBL) [22–25]. Za specifický diagnostický a prognostický biomarker MCL lze považovat nadměrnou expresi transkripčního faktoru SOX11, která byla pozorována až v 95 % případů tohoto lymfomu, a to jak v případech cyklin D1 pozitivních, tak i negativních [26–30].
DIFERENCIÁLNÍ DIAGNOSTIKA
Neoplastickou populaci MCL je nutno odlišit od jiných lymfoproliferativních onemocnění, jako jsou CLL/SLL, lymfom marginální zóny (MZL), lymfoplazmocytární lymfom (LPL), LBL a BL. Jak již bylo uvedeno výše, zásadním prvkem diagnostiky je u MCL molekulárně genetické vyšetření s průkazem přítomnosti t(11;14)(q13;q32), popř. vyšetření zvýšené exprese cyklinu D1 imunohistochemicky či molekulárně biologicky. Nejčastěji působí diferenciálně diagnostické problémy odlišení MCL od CLL/SLL. Pro imunofenotyp MCL je ve srovnání s CLL/SLL typická negativita znaků CD23 a CD200. Naopak u MCL bývá silně exprimován cyklin D1, který je u CLL/SLL negativní. Pro buňky LPL jsou typická pravidelná jádra, negativita znaku CD5 a chybějící exprese cyklinu D1. Pro MZL může být ve srovnání s MCL přítomné rozšíření marginální i plášťové zóny lymfatické uzliny, polymorfní buněčná populace, negativita CD5 i cyklinu D1. U MZL bývá slabě exprimován znak CD43, který se u MCL nachází ve většině případů. Pro FL je typická intaktní síť folikulů, jejichž struktura bývá u MCL často změněná. U FL je negativní znak CD5, cyklin D1 není exprimován, naopak CD10 bývá přítomen. Rozdíl mezi LBL a MCL je zejména ve věku v době diagnózy. LBL bývá nově diagnostikován zejména u mladších nemocných (15–25 let). U blastického MCL je věk v čase diagnózy nižší než u klasického typu MCL, ale nedosahuje tak nízkých hodnot jako u LBL. Zásadní rozdíl je v původu nádorových buněk, jejich fenotypu a genetických změnách. U BL chybí negativní znak CD5 a není přítomna exprese cyklinu D1. Naopak jsou přítomny CD10 a translokace zahrnující gen MYC. A nakonec je nutné v některých případech odlišit MCL od neklonání reaktivní lymfocytární hyperplazie. Tu tvoří smíšená populace malých kulatých lymfocytů bez klonální přestavby, obvykle bez koexprese CD43 a CD5, t(11;14)(q13;q32) ani zvýšená exprese cyklinu D1 nejsou přítomny. Základní diferenciálně diagnostické znaky jsou shrnuty v tabulce 1.
1. Základní diferenciálně diagnostické znaky lymfomu z buněk pláště a dalších vybraných lymfoproliferativních onemocnění 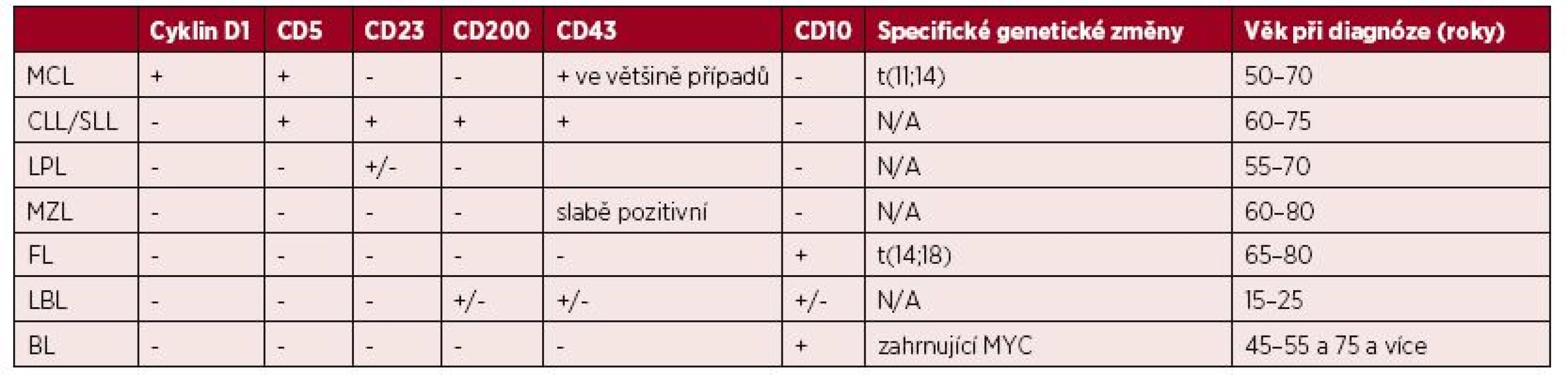
MCL – lymfom z buněk pláště, CLL/SLL – chronická lymfocytární leukemie/lymfom z malých lymfocytů, LPL – lymfoplazmocytární lymfom, MZL – lymfom marginální zóny, FL – folikulární lymfom, LBL – lymfoblastický lymfom, BL – Burkittův lymfom + znak přítomen, - znak nepřítomen KLINICKÝ PRŮBĚH A STANOVENÍ ROZSAHU ONEMOCNĚNÍ
Pacienti s novou diagnózou MCL jsou nejčastěji muži ve věku kolem 60 let. Ve většině případů bývá nemoc zjištěna již v pokročilém stadiu. Primární manifestací choroby jsou u velké části pacientů zvětšené lymfatické uzliny (75 % pacientů), u zbylých 25 % nemocných je prvotním projevem postižení extranodální lokality [31]. Typickými lokalitami vstupního postižení lymfomem jsou Waldeyerův okruh, gastrointestinální trakt či kostní dřeň. Zejména u indolentních forem MCL bývají hlavním příznakem choroby splenomegalie a/nebo leukocytóza v periferní krvi. Postižení centrálního nervového systému v době diagnózy bývá přítomno v méně než 5 % případů [32]. K popisu rozsahu nemoci je používán stážovací systém podle doporučení z Ann Arbor, respektive rozšířená Ann Arbor klasifikace při infiltraci lymfatického systému (lymfatické uzliny, Waldeyerův okruh, slezina, thymus, apendix a Peyerovy plaky) [33–35].
Nejcitlivějším zobrazovacím vyšetřením k určení stadia choroby je pozitronová emisní tomografie kombinovaná s výpočetní tomografií (PET/CT), které v sobě slučuje vyhodnocení jak metabolické aktivity choroby pomocí PET s použitím fluorodeoxyglukózy značené izotopem 18F (18F-FDG), tak přesné anatomické lokalizace postižení pomocí CT (obr 4). Indikace PET/CT je doporučena zejména u nemocných s limitovaným stadiem MCL (I/II) v rámci iniciálního vyšetření [5] nebo u nemocných s extranodálním postižením. Toto vyšetření je dobře využitelné k diagnostické cílené biopsii z nádorové masy [36]. Metodami volby zobrazovacího vyšetření rozsahu onemocnění mohou být CT, sonografické vyšetření či RTG. Endoskopické vyšetřovací metody mají své místo zejména v případech mnohočetné lymfomatózní polypózy u MCL primárně infiltrujících GIT. Kromě stanovení rozsahu choroby slouží i jako diagnostické vyšetření. Součástí stážovacích vyšetření jsou i odběry kostní dřeně – aspirace i trepanobiopsie. Součástí zhodnocení aspirátu je morfologické vyšetření nátěrů kostní dřeně. Dále by mněl být aspirát odeslán k vyšetření průtokovou cytometrií, molekulárně biologickému a cytogenetickému vyšetření. Při vyšetření vzorku z trepanobiopsie je nutno při vyhodnocovaní imunohistochemických parametrů brát ohled i na možnou, ne zcela raritní, atypii profilu MCL. Při podezření na leukemizující MCL je možné flowcytometrické vyšetření punktátu periferní krve. Lumbální punkce se iniciálně rutinně neprovádí. Výjimkou jsou případy se vstupní neurologickou symptomatologií při podezření na infiltraci CNS anebo u vysoce rizikových nemocných. Týká se to zejména blastických forem MCL.
4. Vyšetření 18F-FDG PET/CT k zhodnocení rozsahu nádorového postižení (nádorová infiltrace označena šipkami) Vstupní snímky pacienta s novou diagnózou lymfomu z buněk pláště původně došetřovaného pro dyspepsie a hmotnostní úbytek 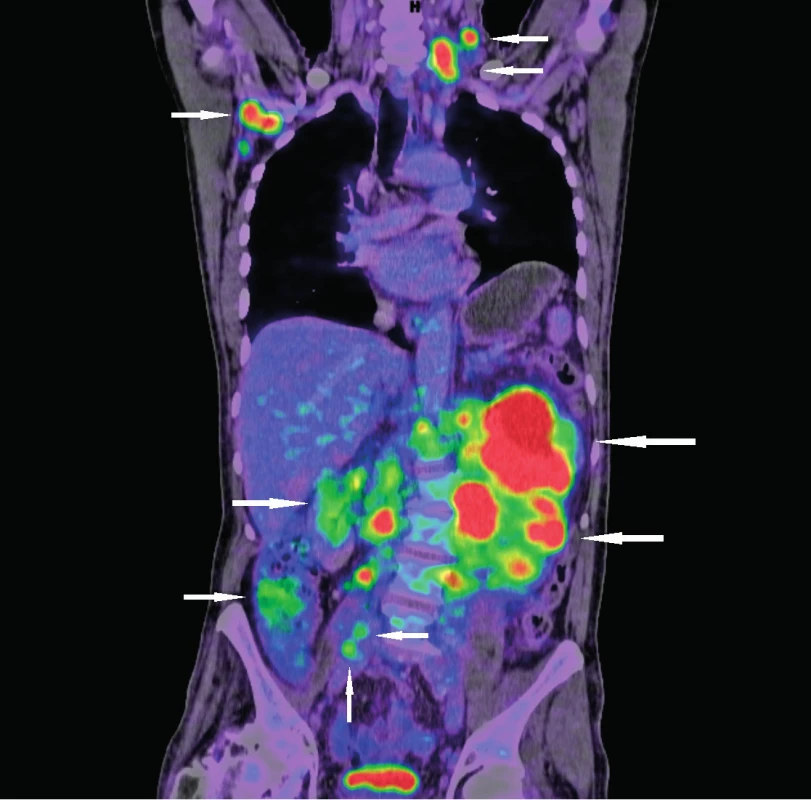
(Zdroj: Klinika nukleární medicíny Lékařské fakulty Univerzity Palackého a Fakultní nemocnice Olomouc) PROGNOSTICKÉ FAKTORY
Prognóza nemocných s MCL je velmi heterogenní. Asi u 30 % nemocných je popisován indolentní průběh choroby [37, 38]. Na druhé straně může dynamika průběhu nemoci připomínat chování agresivních rychle proliferujících lymfoidních malignit. K odhadu vyhlídek je nutná co možná nejpreciznější prognostická stratifikace.
Pracovní skupina European MCL Network (EMCLN) stanovila MIPI (MCL international prognostic index) jako první specifický prognostický index pro nemocné s MCL [39]. Zohledňuje věk, stav tělesné kondice podle Eastern Cooperative Oncology Group Performance (ECOG), hladinu laktát-dehydrogenázy (LDH) a celkový počet bílých krvinek v periferní krvi. MIPI rozděluje nemocné podle dosaženého skóre do tří prognostických skupin – s nízkým, středním a vysokým rizikem (tab. 2). Jako zásadní prognostický ukazatel byla popsána intenzita proliferace nádorových buněk hodnocená pomocí antigenu Ki-67 [40]. Index Ki-67 je definován jako procentuální poměr dělících se buněk v hodnotitelných polích tkáňového řezu histopatologického vzorku. Hodnota indexu se podle doporučení EMCLN počítá ze dvou zorných polí po 100 buňkách [41]. Vysoká hodnota proliferačního indexu Ki-67 silně koreluje s horší prognózou choroby. Jako nezávislý ukazatel je dokonce silnějším prediktor prognózy než cytologický obraz (blastická vs. „ne-blastická“ varianta MCL) nebo charakter růstu MCL (difuzní vs. „ne-difuzní“ růst). Jeho význam je zohledněn i ve specifičtějším prognostickém indexu pro MCL – MIPIb (kombinovaný biologický MIPI). MIPIb rozděluje pacienty do tří rizikových skupin, podobně jako tomu je u MIPI. Výsledné skóre získáme ze složitého výpočtu [39]. Ke zjednodušení výpočtu je dostačující jedna z více online dostupných aplikací [42, 43]. Výše popsané prognostické indexy se vážou na období diagnózy před zahájením terapie. Validita MIPI a prognostického významu indexu Ki-67 byly potvrzeny i analýzou dat 235 neselektovaných nemocných s MCL v prostředí české populace [44]. Výpovědní hodnota MIPI ale může klesat v období relapsu nebo progrese choroby. Sekundární MIPI (sec MIPI), na rozdíl od výše popsaných prognostických indexů, vyhodnocuje prognózu v období relapsu nemoci. Rozděluje pacienty podle rizika do tří skupin (nízké, střední a vysoké riziko) se signifikantně rozdílnou prognózou [45]. U starších nemocných může k celkovému hodnocení fyzických možností dopomoci určení indexu fragility (frailty index). Pro běžnou klinickou praxi by mohla být postačující jeho zjednodušená 9stupňová škála [46].
2. Rozdělení pacientů do 3 rizikových skupin podle dosaženého skóre mezinárodního prognostického indexu pro lymfom z buněk pláště (MIPI) 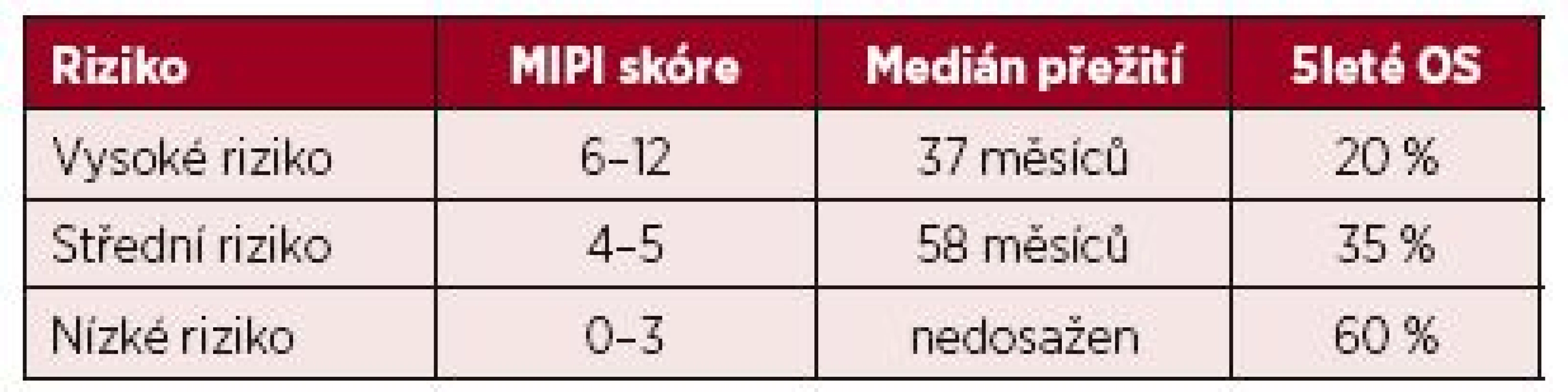
OS – celkové přežití Monocytomakrofágový buněčný systém pravděpodobně ovlivňuje mikroprostředí lymfomu ve smyslu potenciace buněčného růstu a přežití. Je proto snaha o určení významu vlivu počtu monocytů na průběh MCL. Absolutní počet monocytů (AMC) periferní krve v čase diagnózy byl popsán jako nezávislý prediktor prognózy. Vyšší počet monocytů je spojen s kratším celkovým přežitím (OS) i přežitím pacientů bez známek progrese MCL [47]. K validaci významu tohoto poměrně jednoduchého potencionálně prognostického ukazatele jsou ale nutné další robustní randomizované studie.
V buňkách MCL byla popsána řada sekundárních genetických změn, které mohou souviset s konkrétní morfologickou variantou lymfomu a/nebo mít prognostický význam. Klasická varianta MCL je spojována s menším množstvím chromozomových změn a mírnějším průběhem onemocnění. Zatímco agresivnější blastoidní/pleomorfní varianty jsou charakterizovány velkým počtem změn s častým zmnožením v oblastech 3q, 7p, 8q24 (gen MYC) a 12q13 (geny CDK4 a MDM2) a delecí v oblastech 1p, 9q21 (gen CDKN2A) a 17p13 (gen TP53). Výskyt těchto změn je spojován se špatnou prognózou onemocnění [48–51]. Vzácně se objevuje t(11;14) společně s přestavbou genu MYC. Téměř ve všech popsaných případech je tento nález spojen s blastoidní variantou lymfomu a výrazně kratším přežitím pacientů [52, 53]. Podobně jako delece, tak i mutace genu TP53 (asi 15–26 % případů) je spojována s horší prognózou [54, 55]. Delece/mutace genu ATM (ataxia telangiectasia mutated) v oblasti 11q23 jsou častým nálezem u MCL (cca 56 % případů). Prognostický význam alterací genu ATM, který byl popsán u CLL, u MCL jeho nezávislý prognostický význam prokázán nebyl [55]. Nicméně výskyt alterací genu ATM je často pozorován společně s komplexním karyotypem u pacientů s kratším celkovým přežitím [56, 57]. Leukemické formy MCL jsou často asociovány s delecí oblasti 8p, a to až v 79 % případů. Delece je navíc nezřídka doprovázena i amplifikací genu MYC a agresivním průběhem nemoci [58]. Mezi nepříznivé prognostické faktory se řadí také mutace genů NOTCH1 a NOTCH2, které byly v nedávné době popsány jako rekurentní změny vyskytující se přibližně v 5–12 % případů MCL [59, 60]. Recentní práce zabývající se výskytem klonální heterogenity a jejím dopadem na prognózu onemocnění u jednotlivých NHL prokázala, že přítomnost klonální heterogenity u pacientů s MCL je spojena se špatnou prognózou a může být posuzována dokonce jako nezávislý prognostický faktor [61].
Význam detekce SOX11 jako ukazatele prognózy zůstává stále diskutabilní. Některé práce dávají přítomnost transkripčního faktoru SOX11 do souvislosti s nepříznivou, některé naopak s lepší prognózou [62, 63]. Validace významu tohoto potenciálního prognostického markeru bude ještě vyžadovat další zhodnocení výsledků multicentrických studií.
O reálné prognóze nemocných přímo vypovídá dosažená léčebná odpověď na podanou protinádorovou terapii. Díky PET/CT vyšetření jsme schopni velmi přesně zhodnotit rozsah a metabolické aktivity lymfomu. Srovnáním PET/CT scanů během protinádorové terapie a po ní by nám tedy mohlo podat informaci o léčebné odpovědi. I přes téměř 100% 18F-FDG aviditu MCL zůstává přínos tohoto vyšetření v rámci zhodnocení léčebné odpovědi věcí diskuse. Kedmi et al. ve své poměrně recentní práci považují význam hodnocení PET pozitivity či negativity v rámci interim i finálního hodnocení léčebné odpovědi přinejmenším za sporný. Nutno ale podotknout, že analyzovaní pacienti byli všichni léčeni režimem R-CHOP nebo podobným režimem. Autologní transplantaci periferních kmenových buněk podstoupilo 42 % pacientů z hodnoceného souboru [64]. K obecně přijatelnému konsenzu na téma významu použití PET/CT jako prediktoru prognózy jsou ale potřebné další robustnější analýzy.
I u MCL je snaha o správnou interpretaci významu sledování minimální reziduální nemoci (minimal residual disease, MRD) v periferní krvi nebo kostní dřeni. Její hodnota odráží počet zbytkových nádorových buněk po proběhlé protinádorové terapii. Stav MRD po indukční terapii byl popsán jako jeden z nejsilnějších nezávislých prognostických ukazatelů [65, 66]. Standardem monitorování MRD u MCL je real-time kvantitativní polymerázová řetězová reakce (RQ-PCR). Metodou volby je vyšetření přítomnosti MRD pomocí průtokové cytometrie. Její provedení je ve srovnání s RQ-PCR rychlejší a méně nákladné. Nevýhodou tohoto typu monitorování MRD je menší citlivost. Standardem k optimálnímu zhodnocení stavu MRD by se v budoucnu mohla stát kombinace 8barevné průtokové cytometrie a RQ-PCR [67]. Kromě prognostické stratifikace by mohl být stav minimální zbytkové nemoci využíván i ke zhodnocení či zahájení preemptivní terapie [68]. K tomuto účelu je doporučeno pravidelné sledování stavu MRD v periferní krvi co 3 měsíce [67]. Ani tento přístup nám ale nezaručí falešně negativní výsledky. A to zejména v případech klonálního vývoje nebo čistě uzlinového relapsu nemoci. Ke správnému došetření jsou nutné histologická a molekulární analýza nádorové tkáně.
ZÁVĚR
Lymfom z buněk pláště zůstává spíše raritní lymfoproliferací i přes jeho stoupající incidenci. Stanovení diagnózy bývá někdy obtížné. Vzhledem k časté atypii cytomorfologického, antigenního a genetického profilu MCL je nutné vést pečlivou diferenciálně-diagnostickou rozvahu před uzavřením definitivní diagnózy. Při své biologické i klinické variabilitě zůstává MCL konvenční imunochemoterapií nevyléčitelným onemocněním. Skóre MIPI či jiné významné prognostické ukazatele nemají, i přes svou spolehlivou stratifikaci nemocných podle rizika, významný vliv na zvolenou léčebnou strategii. Pochopení procesů u MCL na subcelulární úrovni a studium jeho mikroprostředí nám snad v nejbližších letech pomohou lépe pochopit patologické procesy provázející růst tohoto lymfomu. Detailnější informace o biologii tohoto onemocnění umožní ještě cílenější terapii novými šetrnými molekulami s lepšími vyhlídkami na dosažení dlouhodobé remise nebo dokonce úplného vyléčení. Snad bude časem možné léčebně ovlivnit jenom postižené regulační mechanismy buněčného růstu či buněčného přežití, a eliminovat tak toxické účinky polychemoterapie.
Podíl autorů na přípravě rukopisu
AO – hlavní autor.
MM – spoluautorka, autorka textu a obrazové přílohy věnovaným cytogenetice u MCL.
JM – odborná korekce textu věnovaného významu cytogenetických změn u MCL.
VP – odborná a jazyková korekce rukopisu.
TP – odborná a jazyková korekce rukopisu.
BT – spoluautor textu.
Poděkování
Podpořeno granty IGA_LF_2016_001 a IGA-MZ NT/13072.
Čestné prohlášení autorů
Autor textu prohlašuje, že v souvislosti s tématem a vznikem tohoto článku není ve střetu zájmů. Vznik a publikace tohoto článku nebyly podpořeny žádnou farmaceutickou firmou. Toto prohlášení se týká i ostatních spoluautorů.
Doručeno do redakce dne 1. 2. 2016.
Přijato po recenzi dne 16. 5. 2016.
MUDr. Aleš Obr
Hemato-onkologická klinika LF UP a FN Olomouc
I. P. Pavlova 6,
779 00 Olomouc
e-mail: ales.obr@fnol.cz
Sources
1. Harris NL, Jaffe ES, Stein H, et al. A revised European-American classification of lymphoid neoplasms: a proposal from the International Lymphoma Study Group. Blood 1994; 84 : 1361–1392.
2. Swerdlow SH, Campo E, Harris NL, et al., eds. WHO Classification of Tumours of Haematopoietic and Lymphoid Tissues. Lyon: IARC 2008 : 229–232.
3. Raffeld M, Jaffe ES. bcl-1, t(11;14), and mantle cell-derived lymphomas. Blood 1991; 78 : 259–263.
4. Banks PM, Chan J, Cleary ML, et al. Mantle cell lymphoma. A proposal for unification of morphologic, immunologic, and molecular data. Am J Surg Pathol 1992; 16 : 637–640.
5. Dreyling M, Geisler C, Hermine O, et al. Newly Diagnosed and Relapsed Mantle Cell Lymphoma: ESMO Clinical Practice Guidelines. Ann Oncol 2014; 25 (suppl 3): iii83–iii92.
6. Schollkopf C, Melbye M, Munksgaard L, et al. Borrelia infection and risk of non-Hodgkin lymphoma. Blood 2008.
7. Cortelazzo S, Ponzoni M, Ferreri AJ, Dreyling M. Mantle cell lymphoma. Critical Reviews in Oncology/Hematology 2012; 82(1): 78–101.
8. Clapp RW, Jacobs MM, Loechler EL. Environmental and occupational causes of cancer: new evidence 2005–2007. Rev Environ Health 2008; 23 : 1–37.
9. Eriksson M, Hardell L, Carlberg M, Akerman M. Pesticide exposure as risk factor for non-Hodgkin lymphoma including histopathological subgroup analysis. Int J Cancer 2008; 123 : 1657–1663.
10. Zhang Y, Dai Y, Zheng T, Ma S. Risk factors of Non-Hodgkin lymphoma. Expert Opinion on Medical Diagnostics 2011; 5 : 539–550.
11. Tort F, Camacho E, Bosch F, Harris NL, Montserrat E, Campo E. Familial lymphoid neoplasms in patients with mantle cell lymphoma. Haematologica 2004; 89(3): 314–319.
12. Ondrejka SL, Lai R, Kumar N, Smith SD, Hsi ED. Indolent mantle cell leukemia: clinicopathological variant characterized by isolated lymphocytosis, interstitial bone marrow involvement, κ light chain restriction, and good prognosis. Haematologica 2011; 96 : 1221–1227.
13. Vogt N, Klapper W. Variability in morphology and cell proliferation in sequential biopsies of mantle cell lymphoma at diagnosis and relapse: clinical correlation and insights into disease progression. Histopathology 2013; 62(2): 334–342.
14. Bernard M, Gressin R, Lefrère F, et al. Blastic variant of mantle cell lymphoma: a rare but highly aggressive subtype. Leukemia 2001; 15(11): 1785–1791.
15. Duggan MJ, Weisenburger DD, Ye YL, et al. Mantle zone lymphoma. A clinicopathologic study of 22 cases. Cancer 1990; 66 : 522–529.
16. Swerdlow SH, Habeshaw JA, Murray LJ, et al. Centrocytic lymphoma: a distinct clinicopathologic and immunologic entity. A multiparameter study of 18 cases at diagnosis and relapse. AmJ Pathol 1983; 113 : 181–197.
17. Weisenburger DD, Kim H, Rappaport H. Mantle-zone lymphoma: a follicular variant of intermediate lymphocytic lymphoma. Cancer 1982; 49 : 1429–1438.
18. Aqel N, Barker F, Patel K, Naresh KN. In-situ mantle cell lymphoma – a report of two cases. Histopathology 2008; 52 : 256–260.
19. Gao J, Peterson L, Nelson B, Goolsby C, Chen YH. Immunophenotypic variations in mantle cell lymphoma. Am J Clin Pathol 2009; 132 : 699–706.
20. Gualco G, Weiss LM, Harrington WJ Jr, Bacchi CE. BCL6, MUM1, and CD10 expression in mantle cell lymphoma. Appl Immunohistochem Mol Morphol 2010; 18 : 103–108.
21. Fu K, Weisenburger DD, Greiner TC, et al. Cyclin D1-negative mantle cell lymphoma: a clinicopathologic study based on gene expression profıling. Blood 2005; 106 : 4315–4321.
22. Rimokh R, Berger F, Delsol G, et al. Detection of the chromosomal translocation t(11;14) by polymerase chain reaction in mantle cell lymphomas. Blood 1994; 83 : 1871–1875.
23. Wlodarska I, Meeus P, Stul M, et al. Variant t(2;11)(p11;q13) associated with the IgK-CCND1 rearrangement is a recurrent translocation in leukemic small-cell B-non-Hodgkin lymphoma. Leukemia 2004; 18(10): 1705–1710.
24. Rocha CK, Praulich I, Gehrke I, Hallek M, and Kreuzer KA. A rare case of t(11;22) in a mantle cell lymphoma like B-cell neoplasia resulting in a fusion of IGL and CCND1: case report. Mol Cytogenet 2011; 4(1): 8.
25. Fu K, Weisenburger DD, Greiner TC, et al. Cyclin D1-negative mantle cell lymphoma: a clinicopathologic study based on gene expression profıling. Blood 2005; 106 : 4315–4321.
26. Salaverria I, Royo C, Carvajal-Cuenca A, et al. CCND2 rearrangements are the most frequent genetic events in cyclin D1(-) mantle cell lymphoma. Blood 2013; 121(8): 1394–1402.
27. Wlodarska I, Dierickx D, Vanhentenrijk V, et al. Translocations targeting CCND2, CCND3, and MYCN do occur in t(11;14)-negative mantle cell lymphomas. Blood 2008; 111(12): 5683–5690.
28. Dictor M, Ek S, Sundberg M, et al. Strong lymphoid nuclear expression of SOX11 transcription factor defines lymphoblastic neoplasms, mantle cell lymphoma and Burkitt’s lymphoma. Haematologica 2009; 94(11): 1563–1568.
29. Mozos A, Royo C, Hartmann E, et al. SOX11 expression is highly specific for mantle cell lymphoma and identifies the cyclin D1-negative subtype. Haematologica 2009; 94(11): 1555–1562.
30. Narurkar R, Alkayem M, Liu D. SOX11 is a biomarker for cyclin D1-negative mantle cell lymphoma. Biomark Res 2016; 4 : 6. Review.
31. Argatoff LH, Connors JM, Klasa RJ, et al. Mantle cell lymphoma: a clinicopathologic study of 80 cases. Blood 1997; 89 : 2067.
32. Cheah CY, George A, Giné E, et al. Central nervous system involvement in mantle cell lymphoma: clinical features, prognostic factors and outcomes from the European Mantle Cell Lymphoma Network. Ann Oncol 2013; 24 : 2119.
33. American Joint Committee on Cancer. Lymphoid neoplasms. AJCC Cancer Staging Manual. 6th ed. New York: Springer 2002 : 393–406
34. Lister TA, Crowther D, Sutcliffe SB et al. Report of a commitee convened to discuss the evaluation and staging of patients with Hodgkin’s disease: Cotswolds Meeting. J Clin Oncol 1989; 7(11): 1630–1636.
35. Sýkorová A, Belada D, Smolej L, et al. Určování rozsahu onemocnění u non-Hodgkinových lymfomů – doporučení Kooperativní lymfomové skupiny. Klin Onkol 2010; 23(3): 146–154.
36. Barrington SF, Mikhaeel NG, Kostakoglu L, et al. Role of Imaging in the Staging and Response Assessment of Lymphoma: Consensus of the International Conference on Malignant Lymphomas Imaging Working Group. JCO 2014; 32 (27): 3048–3058.
37. Martin P, Chadburn A, Christos P, et al. Outcome of deferred initial therapy in mantle-cell lymphoma. J Clin Oncol 2009; 27 : 1209–1213.
38. Martin P, Leonard J. Is there a role for “watch and wait” in patients with mantle cell lymphoma? Semin Hematol 2011; 48(3): 189–193.
39. Hoster E, Dreyling M, Klapper W, et al. A new prognostic index (MIPI) for patients with advanced-stage mantle cell lymphoma. Blood 2008; 111 : 558.
40. Klapper W, Hoster E, Determann O, et al. European MCL Network. Ki-67 as a prognostic marker in mantle cell lymphoma-consensus guidelines of the pathology panel of the European MCL Network. J Hematol 2009; 2 : 103–111.
41. Dreyling M, Ferrero S, Vogt N, Klapper W, European MCL Network. New Paradigms in MCL: Is It Time to Risk-Stratify Treatment Based on the Proliferative Signature? Clin Cancer Res 2014; 20 : 5194.
42. http://www.european-mcl.net/en/clinical_mipi.php
43. https://www.qxmd.com/calculate/calculator_149/mipi-mantle-cell-lymphoma-prognosis
44. Salek D, Vesela P, Boudova L, et al. Retrospective analysis of 235 unselected patients with mantle cell lymphoma confirms prognostic relevance of Mantle Cell Lymphoma International Prognostic Index and Ki-67 in the era of rituximab: long-term data from the Czech Lymphoma Project Database. Leuk Lymphoma 2014; 55(4): 802–810.
45. Trněný M, Klener P, Campr V, et al. The Outcome of Mantle Cell Lymphoma patients after Treatment Failure and Prognostic value of Secondary Mantle Cell International Prognostic Index (sec MIPI). Oral and Poster Abstracts ASH 2014.
46. Rockwood K, Song X, MacKnight C, et al. A global clinical measure of fitness and frailty in elderly people. CMAJ 2005; 173 : 489–495.
47. Porrata LF, Ristow K, Markovic SN. Absolute monocyte count at diagnosis and survival in mantle cell lymphoma. Br J Haematol 2013; 163(4): 545–547.
48. Beà S, Ribas M, Hernández JM, et al. Increased number of chromosomal imbalances and high-level DNA amplifications in mantle cell lymphoma are associated with blastoid variants. Blood 1999; 93(12): 4365–4374.
49. Pinyol M, Hernandez L, Cazorla M, et al. Deletions and loss of expression of p16INK4a and p21Waf1 genes are associated with aggressive variants of mantle cell lymphomas. Blood 1997; 89(1): 272–280.
50. Espinet B, Salaverria I, Beà S, et al. Incidence and prognostic impact of secondary cytogenetic aberrations in a series of 145 patients with mantle cell lymphoma. Genes Chromosomes Cancer 2010; 49(5): 439–451.
51. Hernández L, Beà S, Pinyol M, et al. CDK4 and MDM2 gene alterations mainly occur in highly proliferative and aggressive mantle cell lymphomas with wild-type INK4a/ARF locus. Cancer Res 2005; 65(6): 2199–2206.
52. Hao S, Sanger W, Onciu M, Lai R, Schlette EJ, Medeiros LJ. Mantle cell lymphoma with 8q24 chromosomal abnormalities: a report of 5 cases with blastoid features. Mod Pathol 2002; 15(12): 1266–1272.
53. Michaux L, Wlodarska I, Theate I, et al. Coexistence of BCL1/CCND1 and CMYC aberrations in blastoid mantle cell lymphoma: a rare finding associated with very poor outcome. Ann Hematol 2004; 83(9): 578–583.
54. Greiner TC, Moynihan MJ, Chan WC, et al. p53 mutations in mantle cell lymphoma are associated with variant cytology and predict a poor prognosis. Blood 1996; 87(10): 4302–4310.
55. Greiner TC, Dasgupta C, Ho VV, et al. Mutation and genomic deletion status of ataxia telangiectasia mutated (ATM) and p53 confer specific gene expression profiles in mantle cell lymphoma. Proceedings of the National Academy of Sciences of the United States of America 2006; 103(7): 2352–2357.
56. Hartmann EM, Campo E, Wright G, et al. Pathway discovery in mantle cell lymphoma by integrated analysis of high-resolution gene expression and copy number profiling. Blood 2010; 116(6): 953–961.
57. Kohlhammer H, Schwaenen C, Wessendorf S, et al. Genomic DNA-chip hybridization in t(11;14)-positive mantle cell lymphomas shows a high frequency of aberrations and allows a refined characterization of consensus regions. Blood 2004; 104(3): 795–801.
58. Martinez-Climent JA, Vizcarra E, Sanchez D, et al. Loss of a novel tumor suppressor gene locus at chromosome 8p is associated with leukemic mantle cell lymphoma. Blood 2001; 98(12): 3479–3482.
59. Kridel R, Meissner B, Rogic S, et al. Whole transcriptome sequencing reveals recurrent NOTCH1 mutations in mantle cell lymphoma. Blood 2012; 119(9): 1963–1971.
60. Beà S, Valdés-Mas R, Navarro A, et al. Landscape of somatic mutations and clonal evolution in mantle cell lymphoma. Proc Natl Acad Sci USA 2013; 110(45): 18250–18255.
61. Suguro M, Yoshida N, Umino A, et al. Clonal heterogeneity of lymphoid malignancies correlates with poor prognosis. Cancer Sci 2014; 105(7): 897–904.
62. Fernàndez V, Salamero O, Espinet B, et al. Genomic and gene expression profiling defines indolent forms of mantle cell lymphoma. Cancer Res 2010; 70(4): 1408–1418.
63. Nordström L, Sernbo S, Eden P, et al. SOX11 and TP53 add prognostic information to MIPI in a homogenously treated cohort of mantle cell lymphoma – a Nordic Lymphoma Group study. Br J Haematol 2014; 166(1): 98–108.
64. Meirav Kedmi, Irit Avivi, Ribakovsky E, et al. Is there a role for therapy response assessment with 2-[fluorine-18] fluoro-2-deoxy-D-glucose-positron emission tomography/computed tomography in mantle cell lymphoma? Leuk Lymphoma 2014; 55 : 2484–2489.
65. Pott C, Hoster E, Delfau-Larue M-H, et al. Molecular remission is an independent predictor of clinical outcome in patients with mantle cell lymphoma after combined immunochemotherapy: a European MCL intergroup study. Blood 2010; 115(16): 3215–3223.
66. Hermine O, Hoster E, Walewski J, et al. Alternating courses of 3xCHOP and 3xDHAP plus rituximab followed by a high dose ARA-C containing myeloablative regimen and autologous stem cell transplantation increases overall survival when compared to 6 courses of CHOP plus rituximab followed by myeloablative radiochemotherapy and ASCT in mantle cell lymphoma: final analysis of the MCL Younger Trial of the European mantle cell lymphoma Network. Hematol Oncol 2012: abstract 151. Presented at: ASH Annual Meeting, Atlanta, GA, USA, 8–11 December 2012.
67. Cheminant M, Derrieux C, Touzart A, et al. Minimal residual disease monitoring by 8-color flow cytometry in mantle cell lymphoma: an EU-MCL and LYSA study. Haematologica 2016; 101(3): 336–345.
68. Andersen NS, Pedersen LB, Laurell A, et al. Pre-emptive treatment with rituximab of molecular relapse after autologous stem cell transplantation in mantle cell lymphoma. J Clin Oncol 2009; 27(26): 4365–4370.
Labels
Haematology Internal medicine Clinical oncology
Article was published inTransfusion and Haematology Today

2016 Issue 3-
All articles in this issue
- Immunogenetic factors influencing red blood cell alloimmunization
- Routine use of thromboelastometry (ROTEM) for coagulation evaluation (adoption of ,,new“ paradigm of coagulation evaluation) in the intensive care unit leads to a significant reduction in the administration of blood plasma
- Correlation analysis of standard Bethesda method versus modified Nijmegen assay in detecting factor VIII inhibitors, and impact of marginal titer inhibitors on FVIII pharmacodynamics and pharmacokinetics by patients with hemophilia A
- Analysis of variant number of signals in the determination of translocation t(4;14)(p16.3;q32.3) using FICTION method in patients with multiple myeloma
- Diagnosis and prognostic factors in mantle cell lymphoma
- Alpha-thalassemia in 45 Czech and 37 immigrant families: review of the literature and molecular diagnosis
- Alternative sources of haematopoietic cells including cord blood today and tomorrow. The outlook for cord blood banks – conclusions of the Panel of Experts
- Transfusion and Haematology Today
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Alpha-thalassemia in 45 Czech and 37 immigrant families: review of the literature and molecular diagnosis
- Diagnosis and prognostic factors in mantle cell lymphoma
- Immunogenetic factors influencing red blood cell alloimmunization
- Correlation analysis of standard Bethesda method versus modified Nijmegen assay in detecting factor VIII inhibitors, and impact of marginal titer inhibitors on FVIII pharmacodynamics and pharmacokinetics by patients with hemophilia A
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

