-
Medical journals
- Career
Význam stanovení sérových hladin volných lehkých řetězců imunoglobulinu u AL amyloidózy
: T. Pika 1; P. Lochman 2; J. Minařík 1; J. Bačovský 1; V. Ščudla 1
: III. interní klinika – nefrologická, revmatologická, endokrinologická, LF UP a FN Olomouc 1; Oddělení klinické biochemie, FN Olomouc 2
: Transfuze Hematol. dnes,19, 2013, No. 3, p. 134-138.
: Comprehensive Reports, Original Papers, Case Reports
Úvod.
Systémová AL amyloidóza je vzácné onemocnění patřící do skupiny monoklonálních gamapatií, přičemž podkladem choroby je extracelulární depozice insolubilních fibril tvořených fragmenty nebo kompletními molekulami monoklonálních lehkých řetězců imunoglobulinů produkovaných klonálními plazmocyty. Identifikace plazmocytového klonu, resp. jeho bílkovinného produktu – monoklonálního imunoglobulinu (MIg), představuje jeden ze stěžejních aspektů v diagnostice a sledování nemocných s AL amyloidózou. V posledních letech je již zcela běžně prováděno stanovení sérových hladin volných lehkých řetězců imunoglobulinu (VLŘ), což významně rozšířilo možnosti analýzy MIg u monoklonálních gamapatií. Náplní předloženého sdělení jsou vlastní zkušenosti se stanovením sérových hladin volných lehkých řetězců u pacientů s AL amyloidózou.Soubor a metody.
Soubor čítal 19 nemocných s biopticky verifikovanou systémovou AL amyloidózou, věkový medián činil 62 let (48–92 let), poměr mužů a žen činil 16 : 3, zastoupení sekrece kappa : lambda bylo 3 : 16. Sérové hladiny volných lehkých řetězců byly stanovovány systémem FreeLiteTM. Normální rozmezí sérových hladin bylo 3,3–19,4 mg/l v případě lehkého řetězce kappa (κ), v případě lambda (λ) pak 5,7–26,3 mg/l. Vzájemný poměr lehkých řetězců kappa/lambda (index κ/λ) byl určen výpočtem s normálním rozmezím 0,26–1,65, v případě renální nedostatečnosti pak 0,37–3,1.Výsledky.
Hladiny MIg byly prokázány v séru u 12/18 (63 %) nemocných, přičemž medián hladin činil 1,69 g/l (0–9,8 g/l). Typizačně se jednalo ve 4 případech o kompletní molekuly izotypu IgG (2x IgG-κ, 2x IgG-λ), ve 3 případech IgA-λ a u jednoho nemocného byl zjištěn izotyp IgD-λ. U 4 nemocných byla v séru zjištěna přítomnost pouze lehkých řetězců λ. Při proteinové analýze moči byla exkrece Bence-Jonesovy bílkoviny zjištěna u 11 nemocných, ve všech případech v kvantitě nad 200 mg/24 hodin, přičemž u 2 nemocných byla navíc prokázána přítomnost kompletních molekul MIg v moči (1x IgA-λ, 1x IgG-λ). Analýza sérových hladin volných lehkých řetězců prokázala u všech nemocných abnormální hodnoty s mediánem 399 mg/l (54,4 – 2385 mg/l), přičemž patologie indexu κ/λ byla zjištěna u 17 nemocných (90 %). Ze 17 nemocných s abnormálními hladinami VLŘ a současně s patologií indexu κ/λ mělo 16 nemocných hladiny dVLŘ (dVLŘ – rozdíl hladin dominantního a alternativního VLŘ) > 50 mg/l. U 16 z 19 nemocných (84 %) tedy stanovení VLŘ umožňuje pravidelné sledování průběhu onemocnění.Závěr.
Stanovení sérových hladin volných lehkých řetězců v současnosti představuje klíčový laboratorní parametr nejen v diagnostice a sledování průběhu onemocnění, ale zejména v hodnocení účinnosti podávané terapie. Kombinace standardních technik detekce MIg spolu se stanovením hladin VLŘ umožňuje monitorování naprosté většiny nemocných s AL amyloidózou.Klíčová slova:
AL amyloidóza, volné lehké řetězce imunoglobulinu, sledování onemocněníÚVOD
AL amyloidóza (light chain amyloidosis) je systémové nebo orgánově limitované onemocnění patřící do skupiny monoklonálních gamapatií, resp. plazmocelulárních dyskrazií (1–4). Incidence představuje přibližně 5–12 nemocných na milion obyvatel za rok a přibližně v 10–20 % případů bývá asociováno s mnohočetným myelomem nebo Waldenströmovou makroglobulinemií (5). Onemocnění je charakterizované extracelulární depozicí insolubilních fibril tvořených fragmenty nebo kompletními molekulami monoklonálních lehkých řetězců imunoglobulinů produkovaných klonálními plazmocyty, což ve svém důsledku vede k následné tkáňové dezorganizaci a poruše funkce postižených orgánů – nejčastěji ledvin, srdce, jater a periferního nervového systému (6, 7). Identifikace plazmocytového klonu, resp. jeho bílkovinného produktu – monoklonálního imunoglobulinu, představuje jeden ze stěžejních aspektů v diagnostice a sledování nemocných s AL amyloidózou (3). V posledních letech je již zcela běžně k dispozici test umožňující stanovení sérových hladin volných lehkých řetězců imunoglobulinu (systém FreeLiteTM), který významně rozšířil možnosti analýzy MIg u monoklonálních gamapatií (8). Náplní předloženého sdělení jsou vlastní zkušenosti se stanovením sérových hladin volných lehkých řetězců u pacientů s AL amyloidózou.
SOUBOR A METODY
Sledovaný soubor zahrnoval 19 nemocných s biopticky verifikovanou systémovou AL amyloidózou, kdy amyloidóza nebyla asociována s jiným hematologickým onemocněním (mnohočetný myelom, Waldenströmova makroglobulinemie) a kteří byli sledováni a léčeni na III. interní klinice v letech 2004–2012. Věkový medián činil 62 let (48–92 let), poměr mužů a žen činil 16 : 3, zastoupení sekrece kappa : lambda bylo 3 : 16. Sérové hladiny volných lehkých řetězců byly stanovovány systémem FreeLiteTM (The Binding Site) s užitím platformy nefelometru Radim Delta (Radim Diagnostics) a od roku 2010 turbidimetru SPAplus (The Binding Site). Normální rozmezí sérových hladin bylo 3,3–19,4 mg/l v případě lehkého řetězce kappa (κ), v případě lambda (λ) pak 5,7–26,3 mg/l. Vzájemný poměr lehkých řetězců kappa/lambda (index κ/λ) byl určen výpočtem s normálním rozmezím 0,26–1,65, v případě renální nedostatečnosti pak 0,37–3,1. Stanovení hladin M-proteinu bylo prováděno elektroforeticky na přístroji Sebia Hydrasys s užitím souprav Sebia Hydragel 30 Protein(e) s následnou denzitometrickou kvantifikací monoklonálního gradientu pomocí skeneru Epson 1680 Pro a softwarového vybavení Phoresis. Pro typizaci imunofixační analýzou byly užity soupravy Hydragel 4 IF na témže zařízení. K detekci a kvantifikaci odpadu monoklonálního imunoglobulinu, resp. Bence-Jonesovy bílkoviny v moči, bylo použito stejného vyšetřovacího postupu a souprav, kdy byla moč pacienta vyšetřena pomocí elektroforézy s následnou imunofixací paralelně s jeho sérem. Hodnoty celkových bílkovin v séru, resp. v moči, pro výpočet kvantitativního zastoupení frakcí se stanovily na analytické lince Cobas 8000 firmy Roche pomocí souprav TP2, resp. TPUC3.
VÝSLEDKY
Elektroforetické a imunofixační vyšetření séra prokázalo hladiny MIg v séru u 12/19 (63 %) nemocných, přičemž medián hladin činil 1,69 g/l (0–9,8 g/l). Typizačně se jednalo ve 4 případech o kompletní molekuly izotypu IgG (2x IgG-κ, 2x IgG-λ), ve 3 případech IgA-λ a u jednoho nemocného byl zjištěn izotyp IgD-λ. U 4 nemocných byla v séru zjištěna přítomnost pouze lehkých řetězců λ. Při proteinové analýze moči byla exkrece Bence-Jonesovy bílkoviny zjištěna u 11 nemocných, ve všech případech v kvantitě nad 200 mg/24 hodin, přičemž u 2 nemocných byla navíc prokázána přítomnost kompletních molekul MIg v moči (1x IgA-λ, 1x IgG-λ). Analýza sérových hladin volných lehkých řetězců prokázala u všech nemocných abnormální hodnoty s mediánem 399 mg/l (54,4–2385 mg/l), přičemž patologie indexu κ/λ byla zjištěna u 17 nemocných (90 %) – graf 1. Je nutné dodat, že 2 nemocní s normálními hodnotami indexu κ/λ, vykazovali současně elevaci obou lehkých řetězců při pokročilé renální nedostatečnosti. Ze 17 nemocných s abnormálními hladinami VLŘ a současně s patologií indexu κ/λ mělo 16 nemocných hladiny dVLŘ (dVLŘ – rozdíl hladin dominantního a alternativního VLŘ) > 50 mg/l, což je v současnosti všeobecně akceptovaný limit definující měřitelné onemocnění. U 16 z 19 nemocných (84 %) tedy stanovení VLŘ umožňuje pravidelné sledování průběhu onemocnění (graf 2).
1. Sérové hladiny volných lehkých řetězců u nemocných s AL amyloidózou (n = 19). 
2. Změny v sérových hladinách volných lehkých řetězců reflektující míru dosažené hematologické léčebné odpovědi. CR – kompletní remise, PR – parciální remise, NR – bez dosažené léčebné odpovědi 
DISKUSE
Detekce přítomnosti, typizace a kvantifikace monoklonálního imunoglobulinu nebo jeho podjednotek (tj. lehkých a těžkých řetězců) patří k nezbytným základním vyšetřením v diagnostickém algoritmu u nemocných s AL amyloidózou (3, 9). Ještě donedávna bylo standardním přístupem stanovení a monitorování kvantity MIg pomocí agarózové/kapilární elektroforézy séra a následné denzitometrie elektroforetické stopy s určením typu imunoglobulinu imunofixací a/nebo průkaz Bence-Jonesovy bílkoviny v moči s určením jejího typu pomocí imunofixace zahuštěné moči z 24hodinového sběru. Tato kombinace vyšetření umožňovala detekci MIg u ~ 94 % nemocných s AL (9, 10, 11, 12). Je nutno podotknout, že u velké části nemocných však získané výsledky nedovolovaly zcela účinně hodnotit míru léčebné, tzv. hematologické odpovědi, z důvodu obvykle velmi nízkých hladin MIg v séru (> 10 g/l) či moči (> 200 mg/den) či jen pouhé imunofixační pozitivity, což bylo patrné i u podstatné části našich nemocných, přičemž hladiny MIg nepřesahovaly 10 g/l u žádného nemocného. Sledování průběhu onemocnění a zejména pak hodnocení efektu terapie bylo tedy velmi obtížné. V posledních letech je již zcela běžně dostupné stanovení sérových hladin volných lehkých řetězců (VLŘ) se vzájemným výpočtem poměru obou řetězců – tzv. κ/λ index, poskytující informaci o míře klonální produkce VLŘ. Samotné stanovení VLŘ bývá pozitivní u 88 až 92 % nemocných s AL a při kombinaci s výše uvedenými standardními technikami detekce paraproteinu dochází k pozitivnímu záchytu MIg až u 98 % nemocných s AL (9–12). Nespornou výhodou stanovení VLŘ je právě zisk měřitelného parametru u velké části nemocných s oligosekrečním onemocněním či jen pouhou imunofixační pozitivitou, umožňující pravidelné sledování nemocných a hodnocení efektu terapie. V našem případě bylo využito pravidelného stanovení sérových hladin VLŘ u 84 % nemocných, v případě zbývajících nemocných bylo užito k hodnocení efektu terapie pravidelné elektroforetické vyšetření séra a stanovení odpadu Bence--Jonesovy bílkoviny v moči. V současnosti platí revidovaná IMWG (International Myeloma Working Group) a ISA (International Society for Amyloidosis) kritéria, kdy za měřitelné onemocnění je pokládán stav s absolutní hodnotou rozdílu dominantního-alternativního VLŘ (dVLŘ) > 50 mg/l, přičemž dosažení parciální remise odpovídá > 50% redukci vstupních hodnot, velmi dobrá parciální remise je definována jako absolutní hodnota dVLŘ < 40 mg/l, a naopak progresi stavu definuje nárůst VLŘ o > 50 % (a to alespoň > 100 mg/l) – tabulka 1 (13–16). Kompletní remise je definována jako negativní imunofixační elektroforéza séra i moči, absence klonálních plazmocytů v kostní dřeni a normalizace hladin VLŘ včetně indexu κ/λ. Vzhledem k výše uvedenému je hodnocení léčebné odpovědi pomocí stanovení VLŘ preferováno a pouze u nemocných s absencí patologických hladin či velmi nízkými hladinami VLŘ by se mělo užít klasického hodnocení pomocí elektroforézy séra a/nebo moči. V případě hodnocení efektu terapie pak VLŘ lépe reflektují dosaženou hematologickou odpověď než stanovení kompletních molekul MIg a je známo, že redukce vstupních hladin VLŘ o > 90 % představuje příznivý faktor pro další vývoj nemoci i pro nemocné, u kterých nelze nebo není možné usilovat o dosažení kompletní hematologické remise, např. pro výrazné orgánové postižení či komorbidity (17). Sérové hladiny VLŘ korelují s tíží a počtem postižených orgánů, a stejně tak korelují s hladinami kardiálních ukazatelů – troponinů a natriuretických peptidů. Jsou užívány jako prognostický faktor, a to i v kombinaci s dalšími ukazateli, jako jsou právě srdeční enzymy a proteiny (18, 19).
1. Kritéria pro hodnocení hematologické léčebné odpovědi o nemocných s AL amyloidózou. 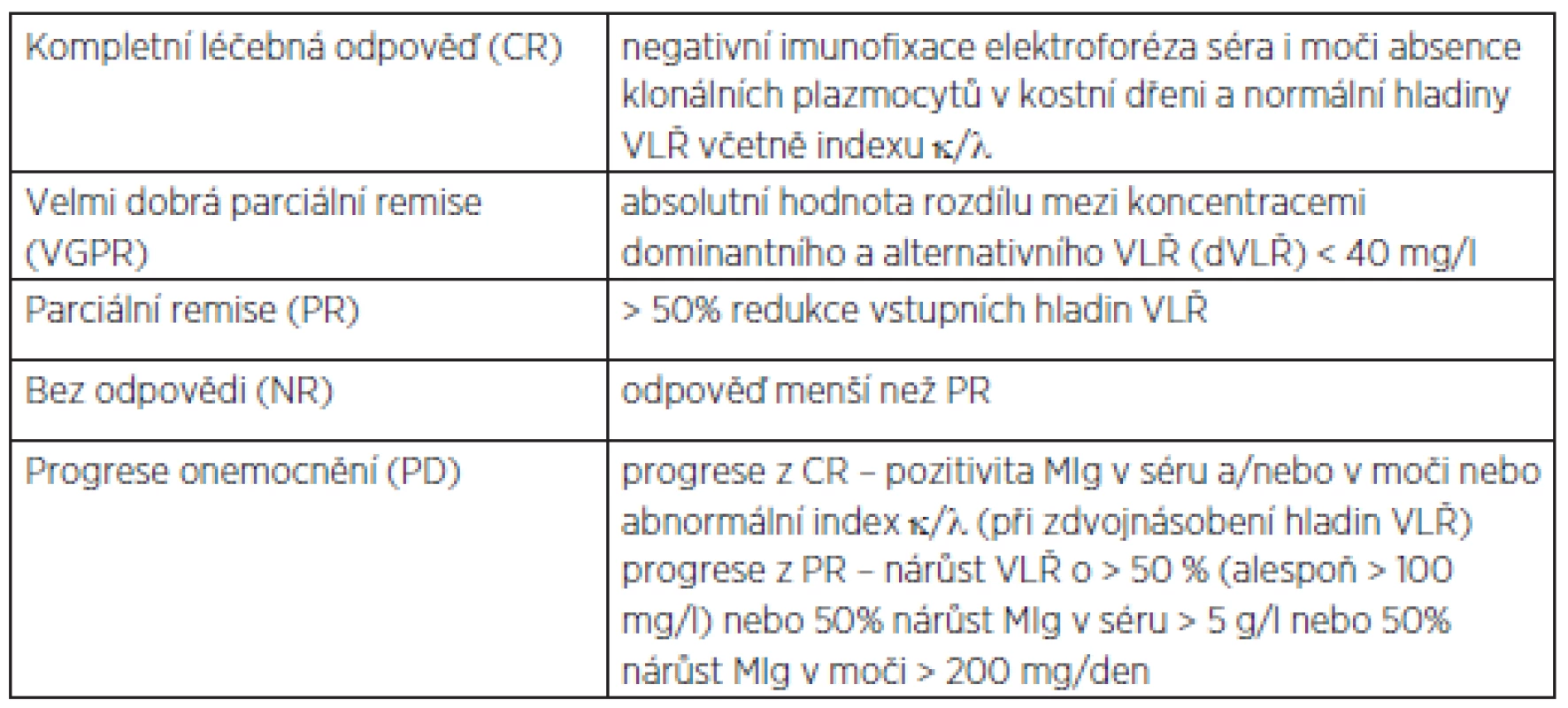
VLŘ – volné lehké řetězce imunoglobulinu v séru, MIg – monoklonální imunoglobulin, paraprotein (16) ZÁVĚR
Stanovení sérových hladin volných lehkých řetězců v současnosti představuje klíčový laboratorní parametr nejen v diagnostice a sledování průběhu onemocnění, ale zejména v hodnocení účinnosti podávané terapie. Kombinace standardních technik detekce MIg spolu se stanovením hladin VLŘ umožňuje monitorování naprosté většiny nemocných s AL amyloidózou. Vzhledem k mnohdy obtížné interpretaci výsledků vyšetření je těsná spolupráce ošetřujícího lékaře a laboratorních expertů nezbytná.
Poděkování: S podporou grantu NT 12451/5, NT 14400.
Podíl autorů na přípravě rukopisu
T. Pika – příprava a zpracování rukopisu
P. Lochman – laboratorní analýza, schválení finální verze
J. Minařík – připomínkování rukopisu
J. Bačovský – připomínkování rukopisu
V. Ščudla – připomínkování rukopisu
Doručeno do redakce: 14. 4. 2013
Přijato po recenzi: 17. 5. 2013
MUDr. Tomáš Pika, Ph.D.
III. interní klinika – NRE, Fakultní nemocnice Olomouc
I. P. Pavlova 6, 775 20, Olomouc
e-mail: tomas.pika@seznam.cz
Sources
1. Ščudla V, Pika T. Současné možnosti diagnostiky a léčby systémové AL-amyloidózy. Vnitř Lék 2009; 55 : 77-87.
2. Sipe JD, Benson MD, Buxbaum JN, et al. Amyloid fibril protein nomenclature: 2010 recommendations from the nomenclature committee of International Society of Amyloidosis. Amyloid 2010; 17 : 101-104.
3. Bird J, Cavenagh J, Hawkins P, et al. Guidelines on the diagnosis and management of AL amyloidosis. Brit J Hematol 2004; 125 : 681-700.
4. Gertz MA. Immunoglobulin light chain amyloidosis: 2011 update on diagnosis, risk-stratification, and management. Am J Hematol 2011; 86 : 181-186.
5. Sanchorawala V, Blanchard E, Seldin DC, O’Hara C, Skinner M, Wright DG. AL amyloidosis associated with B-cell lymphoproliferative disorders: frequency and treatment outcomes. Am J Hematol 2006; 81 : 692-695.
6. Merlini G, Bellotti V. Molecular mechanisms of amyloidosis. N Engl J Med 2003; 349 : 583-596.
7. Merlini G, Seldin DC, Gertz MA. Amyloidosis: pathogenesis and new therapeutic options. J Clin Oncol 2011; 29 : 1924-1933.
8. Bradwell AR. Serum free light chain measurements move to center stage. Clin Chem 2005; 51 : 805-807.
9. Katzmann JA, Kyle RA, Benson J et al. Screening panels for detection of monoclonal gammopathies. Clin Chem 2009; 55 : 1517-22.
10. Abraham RS, Katzmann JA, Clark RJ, Bradwell AR, Kyle RA, Gertz MA Quantitative analysis of serum free light chains. A new marker for the diagnostic evaluation of primary systemic amyloidosis. Am J Clin Pathol 2003; 119 : 274-278.
11. Palladini G, Russo P, Bosoni T, et al. Identification of amyloidogenic light chains requires the combination of serum-free light chain assay with immunofixation of serum and urine. Clin Chem 2009; 55 : 499-504.
12. Akar H, Seldin DC, Magnani B, et al. Quantitative serum free light chain assay in the diagnostic evaluation of AL amyloidosis. Amyloid 2005; 12 : 210-215.
13. Dispenzieri A, Kyle RA, Merlini G, et al. International Myeloma Working Group guidelines for serum-free light chain analysis in multiple myeloma and related disorders. Leukemia 2009; 23 : 215-224.
14. Gertz MA, Comenzo R, Falk RH, et al. Definition of organ involvement and treatment response in immunoglobulin light chain amyloidosis (AL): a consensus opinion from the 10th International Symposium on Amyloid and Amyloidosis. Am J Hematol 2005; 79 : 319-328.
15. Gertz MA, Merlini G. Definition of organ involvement and response to treatment in AL amyloidosis: an updated consensus opinion. Amyloid 2010; 17 : 48-49.
16. Comenzo RL, Reece D, Palladini G, et al. Consensus guidelines for the conduct and reporting of clinical trials in systemic light-chain amyloidosis. Leukemia 2012; 26 : 2317-2325.
17. Kumar S, Dispenzieri A, Lacy MQ, et al. Changes in serum-free light chain rather than intact monoclonal immunoglobulin levels predicts outcome following therapy in primary amyloidosis. Am J Hematol 2011; 86 : 251-255.
18. Kumar S, Dispenzieri A, Katzmann JA, et al. Serum immunoglobulin free light-chain measurement in primary amyloidosis: prognostic value and correlations with clinical features. Blood 2010; 116 : 5126-5129.
19. Kumar S, Dispenzieri A, Lacy MQ, et al. Revised prognostic staging system for light chain amyloidosis incorporating cardiac biomarkers and serum free light chain measurements. J Clin Oncol 2012; 30 : 989-995.
Labels
Haematology Internal medicine Clinical oncology
Article was published inTransfusion and Haematology Today

2013 Issue 3-
All articles in this issue
- Initial experience of Czech MDS Group with 5-azacytidine in patients with high risk myelodysplastic syndromes (IPSS intermediate II and high), acute myeloid leukaemia with less than 30% myeloblasts and chronic myelomonocytic leukaemia II
- The importance of serum immunoglobulin free light chain assay in AL amyloidosis
- Lymphomas of gastrointestinal tract – clinico-pathological review
- Plasma cell leukaemia
- Current treatment of myelofibrosis based on risk stratification of patients
- Acquired thrombophilias as a cause of early pregnancy losses
- Microbiological control for processing of blood
- Transfusion and Haematology Today
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Current treatment of myelofibrosis based on risk stratification of patients
- Lymphomas of gastrointestinal tract – clinico-pathological review
- The importance of serum immunoglobulin free light chain assay in AL amyloidosis
- Plasma cell leukaemia
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

