-
Medical journals
- Career
Lymfomy gastrointestinálního traktu – klinicko-patologický přehled
: A. Janíková 2; I. Zambo 1; A. Baumeisterová 2; M. Hermanová 1; J. Mayer 2
: Patologický ústav FN U svaté Anny Brno a LF MU Brno 1; Interní hematologická a onkologická klinika FN Brno a LF MU Brno 2
: Transfuze Hematol. dnes,19, 2013, No. 3, p. 140-151.
: Comprehensive Reports, Original Papers, Case Reports
Primárně extranodální lymfomy (tzn. lymfomy vyrůstající z mimouzlinových orgánů) tvoří asi 30 % všech nehodgkinských lymfomů (NHL), z nich asi 40 % je diagnostikováno právě v gastrointestinálním traktu (GIT). Primární lymfomy gastrointestinálního traktu tedy tvoří asi 5–10 % ze všech NHL. Jejich výskyt oproti karcinomům je sice výrazně nižší, nicméně lymfom je druhý nejčastější nádor žaludku a střeva. Místem postižení bývá zejména žaludek (v cca 60–75 % případů) a tenké střevo, v ileu, céku a rektu se lymfom objevuje méně. Pokud jde o typy lymfomů, nejčastěji bývá diagnostikován difuzní velkobuněčný B-lymfom (DLBCL) a MALT lymfom (MALT = mucosa associated lymphatic tissue), následován ostatními zralými B a T lymfoproliferacemi. Některé typy NHL primárně se vyskytujících v GIT bývají asociovány s chronickou zánětlivou reakcí v důsledku infekčních agens (Helicobacter pylori, Campylobacter jejuni, EBV), nebo glutenové enteropatie, jako je tomu v případě T-lymfomu sdruženého s enteropatií. Zatímco primární či sekundární postižení GIT u NHL je časté, Hodgkinův lymfom se v této oblasti nachází raritně.
Důležitým nástrojem v diagnostice a stanovení rozsahu postižení (stagingu) primárních lymfomů horního GIT je endoskopická ultrasonografie. Strategie léčby závisí na typu lymfomu, rozsahu choroby a etiologii. V případě lokalizovaného MALT lymfomu sdruženého s infekcí Helicobacterem pylori je indikována antibiotická eradikace, která může navodit remisi. Radioterapie je obecně vhodná pro lokalizovaná stadia lymfomů, zejména tam, kde nelze použít antibiotika nebo po selhání antibiotické terapie. V případě pokročilých nebo agresivních lymfomů je indikována imunoterapie, respektive imunochemoterapie. Chirurgická léčba se uplatňuje dominantně v rámci diagnostiky, její místo v léčbě lymfomů GIT je velmi specifické a limitované.Klíčová slova:
extranodální lymfomy, nádory GITÚVOD
Lymfoproliferativní onemocnění se mohou přirozeně vyskytovat v gastrointestinálním traktu (GIT). Jejich výskyt oproti karcinomům je výrazně nižší a tvoří cca 5 % všech nádorů v závislosti na lokalizaci, nicméně lymfom je druhý nejčastěji se vyskytující nádor žaludku a střeva (1, 2). Infiltrace žaludku či střeva se může objevit u lymfoproliferací jako příznak pokročilé choroby, nebo se v GIT manifestuje prvotně. I když se v GIT může objevit prakticky kterákoli jednotka lymfoproliferativních chorob, nejčastěji zastoupenou skupinou jsou bezesporu lymfomy. Primárně extranodální lymfomy tvoří asi 30 % všech nehodkinských lymfomů (NHL), z nich asi 40 % je primárních lymfomů právě GIT. Místem postižení bývá nejčastěji žaludek (cca 60 až 75 % lymfomů GIT), dále pak střevo (cca 40 %) s nejčastějším postižením v oblasti ileocékálního přechodu (asi 20–30 %), tlusté střevo bývá postiženo lymfomy méně často – asi v 10–17 % (3-6). Lymfomy se v principu rozdělují na dvě velké podskupiny: Hodgkinův lymfom a NHL, v rámci NHL rozlišujeme pak B - a T-lymfomy. Z praktického hlediska je důležité rozdělení na lymfomy agresivní a indolentní (nízce maligní). B-lymfomy jsou zastiženy v GIT podstatně častěji (cca v 90 % případů) než T-lymfomy (4–6). Pokud jde o typy lymfomů, nejčastěji bývá diagnostikován difuzní velkobuněčný lymfom (DLBCL, cca 60 %) a MALT lymfom (cca 10 až 20 %), následovány ostatními zralými B a T lymfoproliferacemi. Některé typy NHL primárně se vyskytujících v GIT bývají asociovány s chronickou zánětlivou reakcí v důsledku infekčních agens (Helicobacter pylori, Campylobacter jejuni, EBV), nebo glutenové enteropatie apod. (7). Zatímco primární či sekundární postižení GIT u NHL je celkem častým jevem, Hodgkinův lymfom se v této oblasti nachází poměrně vzácně.
Prognóza lymfomů je globálně dána především diagnostickým typem, rozsahem postižení a celkovým stavem nemocného, v rámci téže diagnózy lymfomu závisí však často i na postižené lokalitě. Lze s určitým omezením říci, že v případě primárních lymfomů GIT jde o lokalitu obvykle s příznivějším průběhem a prognózou než u odpovídajících nodálních či jiných extranodálních forem.
KLINICKÝ OBRAZ
Příznaky bývají rozmanité a mohou zahrnovat různou kombinaci u konkrétního pacienta. Nejčastěji bývají vidět různé typy dyspepsie, pocity tlaku a bolestí v epigastriu, různě intenzivní bolesti břicha, nauzea, zvracení, průjmy nebo naopak zácpa. Prvním příznakem také může být hemateméza, meléna, ileózní stav nebo perforace s peritonitidou. Z celkových příznaků mohou být pozorovány: malabsorpční syndrom, anémie, nechutenství a tzv. B-symptomy (noční pocení, teploty bez příznaků infekce a hmotnostní úbytek).
DIAGNOSTIKA
Suverénní metodou diagnostiky lymfomů žaludku je gastrofibroskopie s mnohonásobným odběrem vzorků z každé etáže žaludku, duodena, gastroezofageální junkce a všech makroskopických lézí (8, 9). V případně postižení střeva je indikována endoskopie (enteroskopie) či kolonoskopie. Diagnostika lymfomů, natož pak jejich klasifikace z maličkých vzorků slizničních biopsií, je nezřídka velmi obtížná. Při podezření na lymfoproliferaci je proto důležité odebrat alespoň 8–10 kvalitních vzorků (8).
Při endoskopickém vyšetření jsou zpravidla makroskopicky viditelné nodularity, ulcerace, hyperplazie sliznice, infiltrující léze nebo polypovité útvary. Nádorový infiltrát se ze sliznice a submukózy kontinuálně šíří přes muscularis propria na serózu a dále do okolních měkkých tkání či orgánů. Cestou regionálních lymfatických uzlin dochází k lymfogenní propagaci, postupně jsou infiltrovány i uzliny mimo spádovou oblast. Při extranodální diseminaci mohou být postiženy vzdálené úseky GIT i jakékoli jiné tkáně či orgány včetně kostní dřeně.
„STAGING“ U LYMFOMŮ GASTROINTESTINÁLNÍHO TRAKTU
Endoskopická sonografie je suverénní metodou identifikující nádor či jinou lézi v oblasti stěny žaludku či duodena a také metodou určující lokální rozsah postižení stěny GIT a případně infiltraci nejbližšího okolí. Vstupní určení klinického stadia (stagingu) zahrnuje dále vyšetření počítačovou tomografií (CT) s kontrastní látkou v rozsahu krk, hrudník, břicho a pánev a provedení biopsie kostní dřeně (8, 10). PET (pozitronová emisní tomografie) má podobný význam jako CT, u Hodgkinova lymfomu a agresivních NHL je použití PET doporučováno především v hodnocení léčebné odpovědi. Názory na využití PET ve „stagingu“ lymfomů GIT nejsou jednotné, ve specifických případech může být však vyšetření PET přínosné. Z laboratorních vyšetření se doporučuje kromě odečtení krevního obrazu a biochemické analýzy séra také imunofixace sérových bílkovin a sérologická vyšetření na viry hepa-titidy B, C a HIV (8).
Rozsah nemoci obecně se u NHL stanovuje podle modifikované Ann Arbor klasifikace, která však není dobře použitelná pro primárně extranodální NHL. Proto byla pro gastrointestinální NHL vytvořena zvláštní klasifikace tzv. Lugano – tabulka 1 (11) a klasifikace tzv. Pařížská – tabulka 2 (12). V literatuře jsou používány obě, avšak v současné době se přece více využívá klasifikace „Lugano“, které se budeme držet i v dalším textu. V některých případech, zejména značně pokročilých lymfomů, může být problém s klasifikací, zda jde o lymfom primárně nodální s infiltrací mimo jiné GIT nebo o lymfom primárně vycházející z GIT s generalizací do vzdálených uzlin či kostní dřeně.
1. Modifikovaná klasifikace z r. 1994 pro gastrointestinální NHL (11). 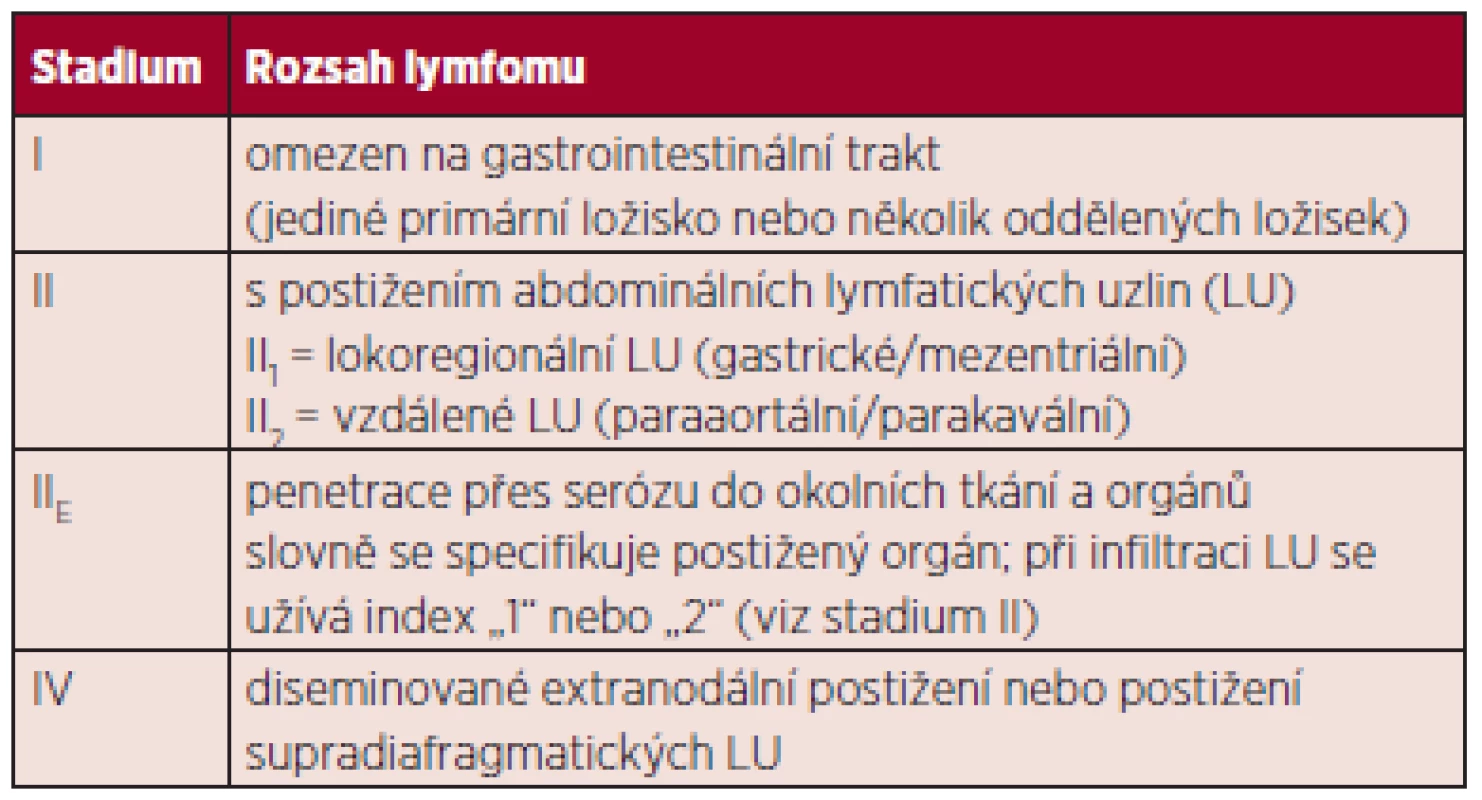
2. Pařížská klasifikace z r. 2003 pro gastrointestinální NHL (12). 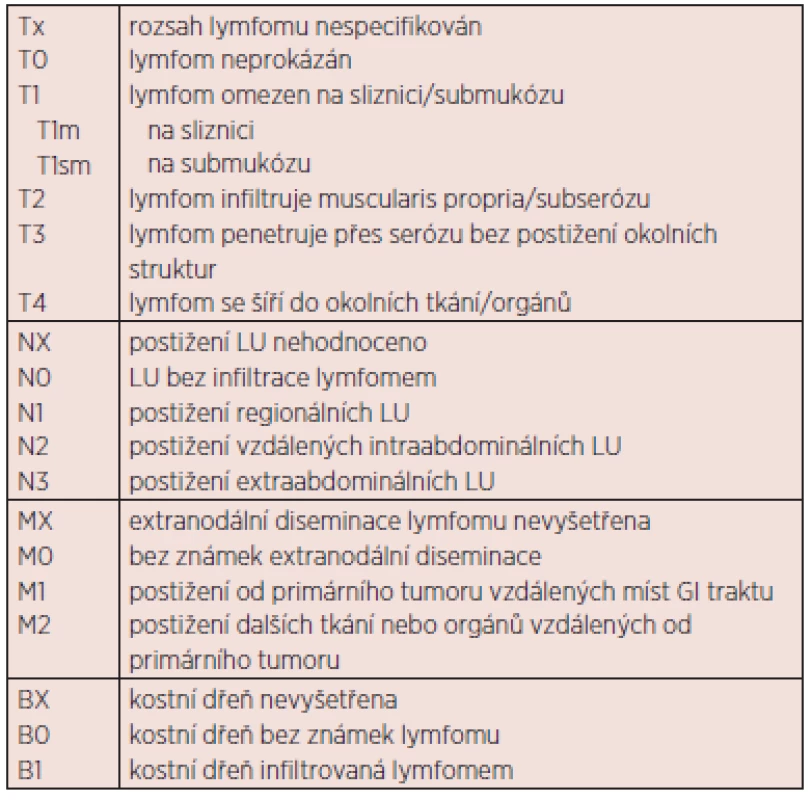
NEJČASTĚJŠÍ B-BUNĚČNÉ LYMFOMY GASTROINTESTINÁLNÍHO TRAKTU
Extranodální B-lymfom marginální zóny (malt-mucosa associated lymphoid tissue)
MALT lymfomy tvoří 50 % všech primárně gastrických NHL a vyskytují se hlavně u osob starších 50 let s převahou postižení u mužů (1,5 : 1). Klinicky se obvykle projevují jako gastritida či peptický vřed. V endoskopickém obraze jsou vidět erytematózní a hyperplastické řasy s rozesetými povrchovými lézemi. I v případě nové diagnózy lze zastihnout již transformaci do DLBCL. Nejčastěji se MALT lymfom vyskytuje v žaludku (cca třetina všech lymfomů marginální zóny a zhruba 70 % z MALT lymfomů GIT), méně často v tenkém střevě, tlusté střevo bývá postiženo raritně (13, 14). Variantou MALT lymfomu je onemocnění z alfa těžkých řetězců a nazývá se imunoproliferativní onemocnění tenkého střeva (IPSID = immunoproliferative small intestinal disease). Je časté zejména na Středním východě a v Africe, kde tvoří až třetinu lymfomů střeva a postihuje především mladé lidi mezi 20. a 30. rokem věku (15). Neléčený IPSID může vyústit v lymfoplazmablastický či imunoblastický lymfom. IPSID sdílí klinické, morfologické a molekulární znaky společné s MALT lymfomy, lymfoblastickým lymfomem a plazmacelulárními neoplaziemi (16).
Patogeneze
Vzniku MALT lymfomu většinou předchází chronický zánět způsobený Helicobacterem pylori. Asociace mezi H. pylori a MALT lymfomem žaludku je pozorována v 80 – 90 % případů. Chronická infekce H. pylori vede ke stimulaci a proliferaci lymfoidních buněk. H. pylori exprimuje tzv. s cytotoxinem asociovaný gen A (CagA), odpovídající protein nese T-buněčný epitop histokompatibilního komplexu MHC II. Proliferace nádorových buněk je stimulovaná přítomností T-lymfocytů aktivovaných antigeny této bakterie. Eradikace H. pylori vede u 60 – 100 % pacientů k dosažení celkové remise (1, 17). Vztah H. pylori a MALT lymfomu žaludku se zdá být velmi těsný, avšak pouze u malé části infikovaných lidí se lymfom nakonec vyvine. Z toho plyne, že na vývoji MALT lymfomu se uplatňují další vlivy jak ze strany „hostitele“ (mikroprostředí imunitního systému), tak z exogenního prostředí a patrně i vlastností mikrobiálního kmene.
K vývoji lymfomu však může dojít i nezávisle na infekci H. pylori, a sice v důsledku genových přestaveb. Nejčastěji nalezeným typem translokace je t(11;18) BIRC3-MALT1, která bývá prokazována v 10–50 %, především gastrických MALT lymfomů. Chromozomální translokace vede k aktivaci jaderného transkripčního faktoru NF-κB, který hraje centrální úlohu v regulaci apoptotických genů a zánětlivé reakce (18).
V případě IPSID je v etiopatogenezi podezřelá rovněž chronická bakteriální infekce – Campylobacter jejuni (15, 16). C. jejuni může přežívat v Peyerských placích a mezenteriálních uzlinách a je schopen vyvolat silnou IgA odpověď na sliznicích. Přeléčení antibiotiky navodí remisi asi v 30–70 % (16). I v případě IPSID lze najít klonální přestavbu zahrnující imunoglobulinové řetězce, t(9;14) zahrnuje Ig molekulu a gen pro PAX5 (15).
Histopatologický nález a imunofenotyp
MALT lymfom primárně vyrůstá v marginální zóně lymfatických foliklů a postupně vytváří splývající plochy překrývající původní struktury extranodální lymfoidní tkáně. Nádorový infiltrát je tvořený směsicí centrocytoidních buněk (obr. 1). Velmi typické pro MALT lymfom jsou tzv. lymfoepiteliální léze – obrázek 2 (1). Plazmocytoidní diferenciace bývá identifikována u přibližně třetiny gastrických MALT lymfomů a je nápadným morfologickým znakem u IPSID. Nádorové buňky exprimují antigeny B-buněk marginální zóny: CD20, CD79a, BCL2, IgM a variabilně CD43 a CD11c, typická je restrikce lehkých řetězců imunoglobulinů a absence CD5, CD10 a cyklinu D1. U IPSID nádorové buňky exprimují těžké řetězce alfa při současné absenci lehkých řetězců (1, 2).
Obr. 1a–c MALT lymfom žaludku (hematoxylin-eosin, různá zvětšení). 
Obr. 2a, b MALT lymfom žaludku, lymfoepiteliální léze (barvení na CD20). 
Prognóza a léčba
Prognóza MALT lymfomů je dána rozsahem v době diagnózy. Ke „stagingovým“ vyšetřením patří navíc v případě gastrického MALT lymfomu průkaz H. pylori a vyšetření na t(11;18). MALT lymfomy mají globálně velmi dobrou prognózu s mediánem přežití v 5 letech kolem 85 %. Asi 10 % MALT lymfomů transformuje do agresivního typu lymfomu. Léčbu MALT lymfomů GIT upravuje aktuální doporučení ESMO následujícím způsobem (8):
- Gastrické MALT lymfomy stadia I+II/1 H. pylori pozitivní: základem léčby je eradikace H. pylori antibiotickou kombinací (omeprazol 2 x 20 mg + clarithromycin 2x 500 mg + amoxycilin 2 x 1 g/metronidazol po dobu 14 dní), s cílem eradikovat H. pylori. Eradikace H. pylori se kontroluje minimálně 6 týdnů po ukončení antibiotik a aspoň 2 týdny po ukončení inhibitorů protonové pumpy. Přičemž lze předpokládat, že t(11;18) pozitivní nádory budou odpovídat hůře.
- Non-gastrické MALT lymfomy, gastrické lymfomy vyššího stadia (II/2 a více) a gastrické MALT lymfomy nereagující na eradikaci H. pylori/H. pylori negativní:
- a) V případě lokalizovaného postižení (I–II) je indikována radioterapie IF (involved field) v dávce kolem 25 Gy.
- b) Pacienti s postižením uzlin a generalizovaným postižením jsou zpravidla léčeni systémovou léčbou (imunochemoterapií) obsahující protilátku anti--CD20 (rituximab). Rituximab lze podat v kombinaci s režimem COP, fludarabinem, ale účinný je i samostatně (9, 19). Nutno zmínit, že nádory t(11;18) pozitivní hůře reagují na alkylační látky.
Protinádorová léčba by měla být vždy doplněna o antibiotickou léčbu, a to i v případech, kde H. pylori nebyl prokázán (20). Chirurgická léčba je indikována pouze při život ohrožujících komplikacích (krvácení, perforace, obstrukce apod.), její aplikace za standardní situace není indikována a může spíše nemocného poškodit (14, 21). Na druhou stranu nutno říci, že gastrektomie má ve stadiu IEA kurativní potenciál (21, 22). I po úspěšné léčbě a dlouhotrvající remisi je pacienty s MALT lymfomem žaludku vhodné dále sledovat (včetně gastroskopie za 1–2 roky). K progresi lokální či vzdálené dochází vcelku výjimečně, avšak tito pacienti mají několikanásobně vyšší riziko vzniku karcinomu žaludku (23).
Difuzní velkobuněčný B-lymfom
Difuzní velkobuněčný B-lymfom (DLBCL; Diffuse Large B-cell Lymphoma) je agresivní neoplazie, která může vznikat de novo nebo vzácněji transformací z preexistujícího „low-grade“ B-lymfomu, typicky MALT lymfomu. V tenkém a tlustém střevě je DLBCL nejčastěji diagnostikovaným lymfomem a tvoří cca 40–70 % lymfomů žaludku (obr. 3, 4). Nemocnými jsou obvykle muži ve věku 50–60 let (24). I když nebyl jednoznačně nalezen rizikový faktor pro primární DLBCL GIT, byla pozorována asociace DLBCL a atrofické gastritidy zvláště u imunodeficientních stavů. V těchto případech bývá DLBCL téměř vždy asociovaný s virem Epstein-Barrové (EBV) a vyznačuje se velmi agresivním chováním. EBV-DLBCL vznikají po infekci či reaktivaci EBV u imunokompromitovaných nemocných (po transplantacích spojených s dlouhodobou imunosupresí, u osob s primárním či sekundárním imunodeficitem) nebo starších osob, které zřejmě vykazují jistý typ imunodeficience v důsledku stárnutí (25–27).
1. Infiltrace tlustého střeva – muscularis propria – DLBCL (hematoxylin-eosin, zvětšení 100x). 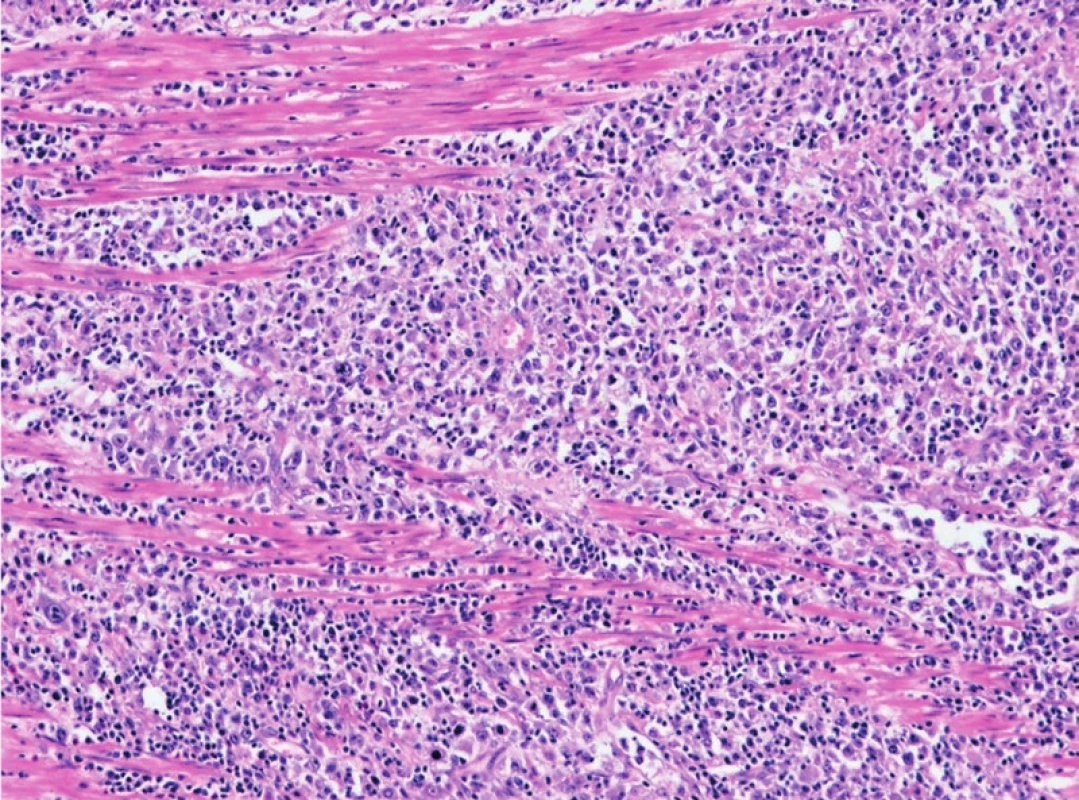
2. DLBCL ve stěně tlustého střeva, difuzní infiltrace sliznice a submukózy objemnými lymfoidními buňkami (hematoxylineosin, zvětšení 100x). 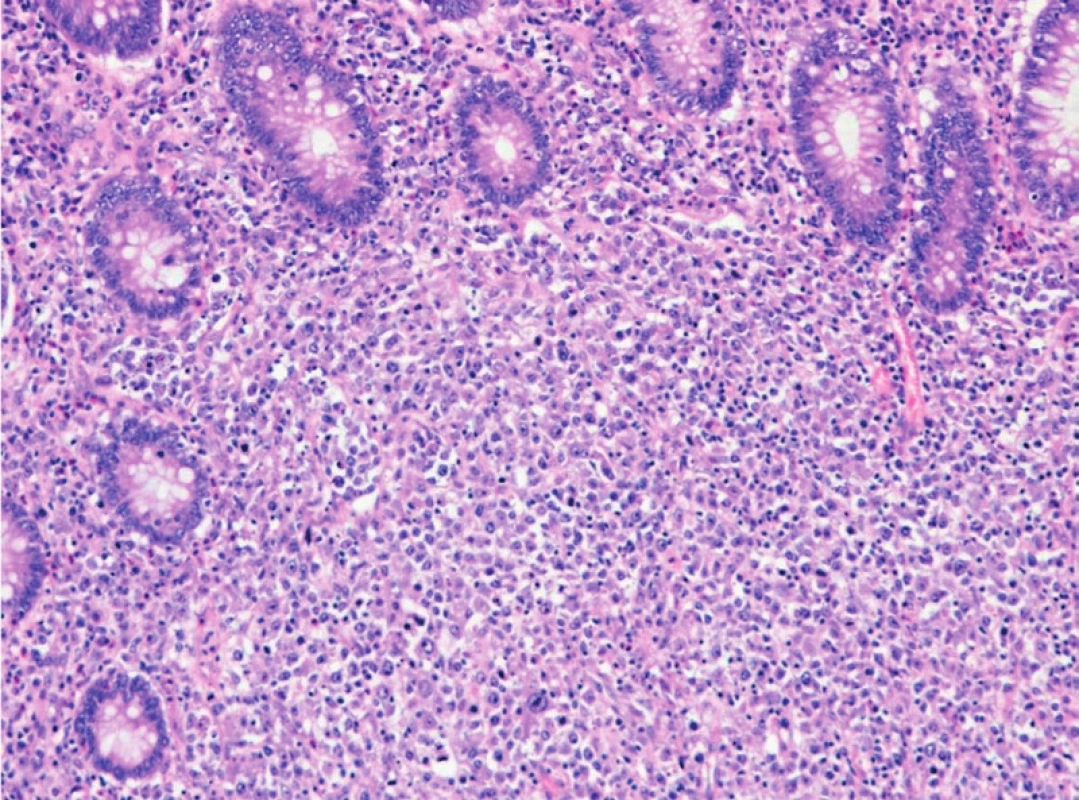
Histopatologický nález a imunofenotyp
DLBCL je charakteristický infiltrací středně velkými až velkými lymfoidními elementy, které difuzně infiltrují a destruují glandulární formace ve sliznici GIT. Fenotyp: CD19+CD20+CD22+CD79a+, CD10+ a bcl2+ bývá u DLBCL původem z germinálního centra, bcl6+ a IRF4/MUM1 jsou naopak znakem tzv. původu z aktivovaných B-buněk (ABC). Morfologicky rozeznáváme tři varianty DLBCL: centroblastickou, imunoblastickou a anaplastickou, které jsou však bez zásadního klinického významu. V přibližně 30–50 % primárně gastrických DLBCL je zastižen preexistující MALT lymfom, který může v některých případech dominovat. Pokud jsou identifikovány shluky či plochy blastických buněk, měl by být lymfom vždy klasifikován jako DLBCL s MALT-lymfomovou komponentou (1, 2).
Prognóza a léčba
DLBCL primárně lokalizovaný v žaludku má 5leté přežití přibližně 80%, oproti nodálnímu DLBCL téže histologie (globální 5leté přežití asi 60%) nebo extranodálního primárně rostoucího ve varleti či mozku s 5letým přežitím necelých 20 % (10).
Prognóza je však tak, jako u nodálních forem DLBCL odvislá od klinického stadia, věku, celkového stavu a patrně i genového profilu. Analýzou genové exprese (GEP = gene expression profiling) byly v rámci DLBCL definovány prognosticky významné podtypy: tzv. ABC (activated B-cell) CD10-, MUM1+, bcl2 - odvozené od naivních aktivovaných B-buněk s horší prognózou a GCB (germinal center B-cell) odvozené od B-buněk germinálního centra s příznivější prognózou (28). Podle ojedinělých prací (29, 30) se zdá, že v primárně gastrointestinálních lymfomech mírně převažuje fenotyp non-GCB. Obecně lze však říci, že aplikace GEP v běžné klinické praxi zatím není doporučena (8), neboť je provázena řadou technických limitací spojených především s analýzou a zpracováním nativních vzorků včetně standardizace GEP. Zjednodušené postupy nahrazující GEP založené na imunohistochemii zatím neprokázaly dostatečnou spolehlivost (31).
Léčba primárních DLBCL žaludku se řídí v principu stejnými pravidly jako nodálních protějšků a spočívá v podání systémové imunochemoterapie (R-CHOP = rituximab, cyklofosfamid, doxorubicin, vinkristin, prednizon). Doporučená léčba sestává z 6 cyklů režimu R-CHOP v 21denních intervalech, tzv. R-CHOP21 (8). U pacientů nad 80 let je možno podat s dobrým efektem redukovaný tzv. R-miniCHOP (32). Léčbu DLBCL s MALT komponentou by mělo provázet vždy vyšetření na Helicobacter pylori a jeho eradikace. V poslední době se objevují důkazy vysoké účinnosti samotné eradikační léčby antibiotiky i u gastrického DLBCL (de novo i MALT/DLBCL) stadia IE/IIE1 (33).
Stručně zmíníme léčbu DLBCL asociovaného s EBV u imunokompromitovaných nemocných (zpravidla tzv. posttransplantační lymfoproliferace, PTLD), která je poněkud odlišná. Jako první krok se snižuje imunosupresivní léčba a léčbou volby je podání rituximabu v monoterapii, při neúspěchu se přidává chemoterapie, CHOP (25).
Komplikace léčby
DLBCL je nejčastěji diagnostikovaným primárním lymfomem žaludku a současně agresivním nádorem. V souvislosti s tím bychom rádi zmínili riziko akutních vážných komplikací (krvácení nebo perforace) provázející podání systémové léčby (chemoterapie respektive imunochemoterapie). Zdá se, že obecné riziko akutních komplikací vyžadujících chirurgické řešení je relativně nízké a pohybuje se kolem 5 %. Krvácení nebo perforace se objevuje zpravidla po 5. dni od zahájení léčby (34, 35). Ochranná hospitalizace je indikována podle aktuálního individuálního rizika (např. stávající krvácení apod.). Pokud jde o pozdní následky chemoterapie ve smyslu striktur nebo stenóz, jsou relativně raritní, poněkud častěji se objevují po podání radioterapie (36, 37).
Folikulární lymfom
Folikulární lymfom (FL) je nejčastěji diagnostikovaný nízce maligní NHL. Primárně extranodální FL v GIT jako primární lokalizaci poměrně vzácný (méně než 7 % všech GIT lymfomů), nejčastějším místem postižení bývá duodenum vzácněji jejunum a ileum, v žaludku se vyskytuje raritně (38, 39). V době diagnózy se většinou primární střevní FL projevuje jako lokalizovaná choroba bez tendence k extraintestinální propagaci. Stěna střeva však bývá postižena mnohem častěji sekundárně při progresi primárního nodálního FL z mezenterických lymfatických uzlin. V těchto případech nádorový infiltrát tvoří různě objemnou masu, vykazuje agresivnější klinické chování a někdy může být zachycena transformace do DLBCL (40, 41). FL je radio - i chemosenzitivní, avšak po úspěšné léčbě pravidelně relabuje. Celková prognóza onemocnění je však vcelku dobrá s mediánem přežití více než 12 let (42, 43, 44).
Histopatologický nález a imunofenotyp
Nádorovou populaci tvoří směsice centrocytů a centroblastů uspořádaných folikulárně nebo difuzně. Lamina propria je hustě prostoupena lymfoidním infiltrátem uspořádaným folikulárně případně splývajícím do difuzních ploch. Podle zastoupení centroblastů v jednom zorném poli velkého zvětšení je u FL užíván třístupňový gradingový systém: gradus 1–3B. Grady 1–3A jsou považovány za nízce maligní lymfomy, gradus 3B má již charakter agresivního lymfomu typu DLBCL (1). Imunohistochemicky a cytogeneticky prokazujeme koexpresi CD10, BCL2 a BCL6, při negativitě CD5 a CD43, intestinální FL exprimuje na rozdíl od nodálního IgA (45). Pro FL je typická nízká frakce proliferujících nádorových buněk. FL je silně asociován s translokací t(14;18)(q34;q21) (46).
Prognóza a léčba
Primární gastrointestinální FL na rozdíl od nodálních forem mívají velmi indolentní průběh bez tendence k diseminaci a většinou jde o grade 1 nebo 2 (45). Lokalizované formy FL jsou indikovány k „involved field“ radioterapii (IF RT) obvyklá dávka je 24 Gy, avšak u asymptomatických nemocných lze zvážit i strategii pečlivého sledování tzv. „watch and wait“ (45, 47). I v případě FL se zdá, že intestinální forma má mnohem lepší prognózu než jeho nodální protějšek. Stěna zažívací trubice je však častěji postižena sekundárně při diseminaci nodálního FL. U pokročilých FL grade 1–3A je u asymptomatických nemocných s malou masou nádoru indikován přístup „watch and wait“ (pouze sledování), u symptomatických pacientů je indikována systémová léčba kombinovanou imunochemoterapií (R-CHOP = rituximab, cyklofosfamid, doxorubicin, vinkristin, prednizon) následovaný udržovací léčbou rituximabem á 2 měsíce po dobu 2 let (48–50).
Lymfom z plášťových buněk (mantle cell lymfom)
Mantle cell lymfom (MCL) tvoří zhruba 3–10 % všech NHL, typicky se vyskytuje po 60. roku věku, dominantně u mužů a je obvykle diagnostikován v pokročilé fázi choroby s infiltrací uzlin, sleziny, kostní dřeně a extranodálních orgánů. Onemocnění se obvykle vyznačuje agresivním chováním. V gastrointestinálním traktu vytváří MCL buď izolovanou nádorovou masu, nebo mnohočetné polypy v rámci tzv. mnohočetné lymfomatózní polypózy (51). Většina postižení GIT bývá v rámci pokročilého onemocnění a uvádí se, že bývá přítomna až v 80 % případů MCL (1). Primární MCL v gastrointestinálním traktu je naopak poměrně vzácný (cca 8 % všech MCL a asi 5 % všech lymfomů GIT), nejčastěji postihuje tenké a tlusté střevo (52).
Histopatologický nález a imunofenotyp
Mantle cell lymfom je obvykle tvořen monomorfní populací malých až středně velkých B-lymfoidních buněk, typický a pro diagnózu MCL zásadní je průkaz přestavby t(11;14)(q13;q32), zahrnující gen pro těžký imunoglobulinový řetězec a cyklin D1 (53). MCL vytváří difuzní, méně často nodulární či plášťové infiltráty a morfologicky může mít různorodý obraz. Morfologicky rozeznáváme varianty MCL: klasický, malobuněčný, MZL-like a blastoidní či pleomorfní – poslední dva typy jsou sdruženy s agresivnějším chováním a horší prognózou. Nádorové buňky exprimují CD19, CD20 a CD79a a slabě koexprimují CD5 a CD43. Většinou lze prokázat restrikci lehkých řetězců (častěji lambda) a expresi povrchových imunoglobulinů IgM a IgD. Průkaz C10 a CD11c je negativní (1).
Prognóza a léčba
MCL celkově má špatnou prognózu s mediánem přežití 3–5 let. Medián přežití primárního MCL GIT, který se pohybuje kolem 4 let, má mít podle ojedinělých údajů o něco příznivější prognózu oproti nodální formě (52). Průběh onemocnění může však být individuálně velmi variabilní a určitá malá část MCL vykazuje vysloveně indolentní průběh (54). Hlavními prognostickými faktory je proliferační index, dále MIPI index (zahrnuje: věk, celkový stav, aktivitu laktátdehydrogenázy, leukocytózu) (55). V léčbě naprosté většiny MCL (včetně primárních MCL GIT) se uplatňuje systémová léčba imunochemoterapií založená na vysokých dávkách cytostatik s rituximabem a cytosin-arabinosidem a konsolidace vysokodávkovanou léčbou s autologní podporou periferních kmenových buněk (8, 56, 57). Starší nemocní (nad 60–65 let) jsou obvykle limitováni tolerancí léčby, a proto je léčbou volby režim založený na rituximabu a chemoterapii (CHOP, bendamustin), s následnou udržovací léčbou rituximabem u pacientů, kteří dosáhli remise (8). Alogenní transplantace kostní dřeně je rezervována pro relabující mladší nemocné (8).
Burkittův lymfom
Burkittův lymfom (BL) je vysoce agresivní lymfoproliferace, která často roste extranodálně. Primárně může postihnout také GIT, nejčastěji bývá zastižen v terminálním ileu, vzácněji v žaludku či jiných částech střeva (58, 59). Morfologicky se neliší od BL vyskytujícího se v jakékoli jiné lokalizaci. V rámci této diagnózy se rozlišují tři klinické varianty: endemická varianta asociovaná s EBV infekcí, sporadická varianta a BL imunokompromitovaných nemocných (60). Zejména sporadická varianta BL, která se vyskytuje u mladších pacientů, se často manifestuje střevní obstrukcí v důsledku expanze v ileocékální oblasti (61).
Histopatologický nález a imunofenotyp
Architektonika postižené sliznice GIT je zcela setřená difuzní infiltrací středně velkými buňkami s oválnými či okrouhlými jádry, dvěma až pěti drobnými zřetelnými nukleoly a úzkým lemem sytě bazofilní cytoplazmy. Při přehledném zvětšení infiltrát bazofilních buněk a fagocytujících makrofágů připomíná hvězdné nebe („starry sky“). Nádorové buňky kromě B-buněčných markerů (CD19, CD20) koexprimují CD10 a BCL6, ale nikoli BCL2, CD5 a CD23. Proliferační index bývá zpravidla extrémně vysoký kolem 100 % (1, 58). Pro diagnózu BL je důležitý průkaz translokace t(8;14)(q24;q32), při které dochází k repozici MYC z 8. chromozomu (59). EBER (EBV encoded RNA) bývá zastižen s různou frekvencí u všech podtypů BL. Předpokládá se, že EBV infekce představuje důležitý kofaktor v mnohastupňovém procesu onkogeneze BL. Zásadní roli však hrají genetické abnormity postihující MYC gen na chromozomu 8q24 (59). U některých případů BL žaludku byl popsán výskyt H. pylori, jehož eradikace vedla rovněž k regresi nádoru (58, 62).
Prognóza a léčba
BL je agresivní, ale dobře chemosenzitivní, a tudíž potenciálně vyléčitelný lymfom. Zejména se zavedením vysoce intenzivních protokolů bylo dosaženo vysokého procenta kompletních remisí s trvalým efektem (61). Léčba je založena na kombinované chemoterapii, kde jsou důležité vysoké dávky metotrexátu a AraC (režim R-CODOX-M R-IVAC), vzhledem k pozitivitě CD20 je do léčebné kombinace přidán i rituximab (protilátka anti CD20). Postižení kostní dřeně a centrálního nervového systému, neresekovaný tumor přesahující velikost 10 cm a vysoké hladiny sérové laktátdehydrogenázy (LDH) jsou považovány za nepříznivé prognostické faktory (63, 64). BL v GIT je léčen podle stejných pravidel jako jeho „nodální“ protějšek.
T-buněčné lymfomy gastrointestinálního traktu
Primární T-lymfomy žaludku a tlustého střeva jsou vzácné a heterogenní, většinou s endemickým výskytem ve východní Asii, vzácně mohou být zastiženy u pacientů s enteropatií. V tenkém střevě jsou primární T-lymfomy odvozeny od intraepiteliálních T-lymfocytů a zahrnují dvě jednotky: s enteropatií asociovaný intestinální T-lymfom (EATL; Entheropathy-Associated Intestinal T-cell Lymphoma), který je diagnostikován až u 90 % pacientů; ve zbývajících případech se jedná o monomorfní CD56+ intestinální T-lymfom (1).
Intestinální T-lymfom asociovaný s enteropatií (EATL)
EATL je intestinální intraepiteliálně rostoucí T lymfoproliferace, která se nejčastěji objevuje v jejunu či ileu. Onemocnění je relativně časté v severní Evropě, typicky vzniká na podkladě celiakie, která zde má vysokou prevalenci. Manifestuje se nejčastěji mezi 50. a 65. rokem věku s predominancí u mužů. Endoskopický obraz ukazuje mnohočetné ulcerované slizniční uzlíky, méně často exofyticky rostoucí infiltrát. V rámci EATL rozlišujeme dva podtypy, EATL typ I asociovaný s celiakií a méně častý typ II bez celiakie s monomorfní infiltrací CD56+ buněk (65).
Patogeneze/prekurzorové léze
Typicky EATL vzniká v terénu tzv. refrakterní celiakie (RCD; Refractory Coeliac Disease), která je dvojího typu. IEL (intraepitelální lymfocyty) u RCD I. typu vykazují normální imunofenotyp a jsou polyklonální, velmi vzácně transformují a progredují do EATL. RCD II. typu je charakterizovaná přítomností IEL s aberantním imunofenotypem (CD8-/+ a CD4-), obvykle jsou také monoklonální s přestavbou TCR genu a ziskem chromozomu 1q (66, 67). RCD II s výše popsaným imunofenotypem a genetickými změnami mohou být označeny jako EATL in situ nebo intraepiteliální T-lymfom. Podle literárních údajů u přibližně 40 % pacientů s RCD II dojde během 5 let k progresi do EATL (65).
Histopatologický nález a imunofenotyp
Populace lymfomových buněk obvykle tvoří prominující mnohočetné ulcerované infiltráty, někdy exofyticky rostoucí masu. Nádorové buňky jsou středně velké či objemné s okrouhlými nebo zprohýbanými jádry. Pro EATL je typická nenádorová příměs četných histiocytů a eozinofilů. V blízkosti destruktivně rostoucího lymfomu lze většinou identifikovat enteropatii charakterizovanou nadlimitním počtem intraepiteliálních lymfocytů atrofií klků, hyperplazií krypt a zvýšenou lymfoplazmocelulární zánětlivou celulizací proprie (1). Nádorové buňky jsou typicky CD3+, CD5-, CD7+, CD8-/+, CD4-, CD103+, TCRβ+/ - a obsahují cytotoxická granula (TIA1, granzym B a perforin). EATL I je negativní při průkazu CD56 (1).
EATL II je intestinální lymfom tvořený malými až středně velkými monomorfními cytotoxickými T-lymfocyty, které většinou exprimují CD56 a typicky postihuje distální úseky tenkého střeva, nejčastěji oblast ileocékální chlopně (1). Pro EATL je typická klonální přestavba TCRβ a TCRγ. Stejně jako u celiakie, bývá u pacientů s EATL prokazován genotyp HLA-DQ8 a HLA-DQ2 nebo HLA-DQB1. Cytogeneticky se EATL typ II od typu I liší negativním průkazem zisku chromozomu 1q (1, 65, 67).
Prognóza a léčba
Prognóza EATL obou typů je obecně nepříznivá, pacienti léčení kombinací s antracykliny (tzv. CHOP „like“ režimy) většinou umírají s mediánem přežití kolem 7–10 měsíců, 5leté přežití nedosahuje ani 20 %. Příčinou úmrtí bývá progresivní malabsorpce či perforace střeva. Nové léčebné strategie založené na agresivní kombinaci chemoterapie (metotrexát, etopozid, ifosfamid a epirubicin) s vysokodávkovanou léčbou a autologní podporou kmenovými buňkami přinášejí lepší výsledky s celkovým přežitím 60 % v 5 letech (68).
Extranodální nk/t lymfom, nazální typ (ENKTL)
Nazální NK/T lymfom je agresivní lymfoproliferace, která se primárně manifestuje v nosní dutině, paranazálních dutinách a nosohltanu. Nicméně velmi často diseminuje a velmi často jej lze nalézt i v trávicím traktu, kde tvoří ulcerace nebo perforuje stěnu střevní. Onemocnění je vzácné, relativně často je však vidět u Asiatů, Mexičanů, původních obyvatel Střední a Jižní Ameriky, především u mužské části populace. Téměř vždy je tento nádor sdružen s EBV infekcí (65, 69, 70).
Morfologie a imunofenotyp
NK/T nazální lymfom je charakteristický angiocentrickým a angiodestruktivním růstem. Infiltráty jsou složeny z velkých pleiomorfních granulárních lymfoid-ních buněk s nepravidelným zprohýbaným jádrem a nerozpoznatelnými jadérky. Příměsí nádoru jsou histiocyty, plazmatické buňky, malé lymfocyty, často jsou přítomna ložiska nekróz. Nádorové buňky jsou CD2+, CD3-, CD56+, CD57-, CD4-, CD8-, CD16 - exprimují také některé cytotoxické molekuly, např. Granzym B, perforin… (1).
Prognóza a léčba
ENKTL je agresivní onemocnění s poměrně špatnou prognózou. Za prognostický faktor i parametr monitorování aktivity choroby se v posledních letech považuje nálož EBV-DNA v krvi. Současná doporučení pro léčbu lokalizovaných stadií (I–II) indikují současné podání radioterapie (50 Gy) s kombinovanou chemoterapií. Pokročilá stadia ENKTL by měla být léčena agresivní chemoterapií s L-asparaginázou, metotrexátem, etoposidem a dexametazonem (71).
Ostatní lymfomy
Plazmablastický lymfom je vzácný nádor mající afinitu ke sliznicím. Lze jej diagnostikovat především u nemocných s imunodeficitem, zvláště u HIVpozitivních osob. Buňky vykazují pozitivitu typickou pro plazmacelulární antigeny (CD138, CD38, MUM-1), B-pancelulární antigeny chybějí (CD20, PAX5). Plazmablastický lymfom je bez ohledu na lokalizaci velmi agresivní choroba se špatnou prognózou, většina nemocných nepřežívá déle než 1 rok (1, 72, 73).
Primární Hodgkinův lymfom (HL) postihující gastrointestinální trakt je extrémně vzácný. Častěji bývá stěna zažívací trubice infiltrována sekundárně při progresi nodálního HL. Primární HL je nejčastěji nalezen v žaludku, velmi často klinicky i radiologicky imituje nespecifický střevní zánět (74, 75).
Ve sliznici GIT, speciálně ve střevě, se vzácně vyskytuje také primárně extramedulární plazmocytom (76). Střevo bývá také místem postižení amyloidózou, zejména případy AL-amyloidózy souvisí s produkcí lehkých řetězců v důsledku onemocnění plazmatických buněk (77).
ZÁVĚR
V GIT se může vyskytnout prakticky jakýkoli typ lymfoproliferativního onemocnění a sice jak v podobě primárního postižení, tak v rámci pokročilé choroby. Primárně extranodální lymfomy lokalizované v GIT mají obvykle celkově lepší prognózu. Nejčastějšími lymfomy diagnostikovanými v GIT jsou difuzní velkobuněčný B-lymfom a MALT lymfom, které jsou často sdruženy s chronickou infekcí. Antibiotická léčba může vyléčit lokalizovaná stadia a je součástí systémové léčby i pokročilých stadií. Zatímco prognóza dvou nejčastějších primárních extranodálních B-lymfomů je obecně velmi dobrá, T-lymfomy v primární lokalizaci v GIT se chovají obvykle agresivně a jejich prognóza zůstává vzdor zavedení novějších léčebných přístupů nepříznivá.
Doručeno do redakce: 11. 3. 2013
Přijato po recenzi: 25. 7. 2013
Doc. MUDr. Andrea Janíková, Ph.D.
Interní hematologická a onkologická klinika
Fakultní nemocnice Brno a Lékařská fakulta Masarykovy univerzity Brno
Jihlavská 20
625 00 Brno
e-mail: ajanikova@fnbrno.cz
Sources
1. Swerdlow S, Campo E, Harris NL, et al. WHO Classification of Tumours of Haematopoietic and Lymphoid Tissues. 4th ed. Lyon: IARC, 2008. 439 p.
2. Greenson JK, Lamps LW, Montogomery EA, et al. Diagnostic pathology: Gastrointestinal. 1st ed. Utah: Amirsys, 2010, s. 2/70-2/83.
3. Arora N, Manipadam MT, Pulimood A, et al. Gastrointestinal lymphomas: pattern of distribution and histological subtypes: 10 years experience in a tertiary centre in South India. Indian J Pathol Microbiol 2011; 54 : 712-9.
4. Howell JM, Auer-Grzesiak I, Zhang J, et al. Increasing incidence rates, distribution and histological characteristics of primary gastrointestinal non-Hodgkin lymphoma in a North American population. Can J Gastroenterol 2012; 26 : 452-6.
5. Song LN, Cen XN, Ou JP, et al. Clinical and prognostic analysis of 101 cases of primary gastrointestinal Non-Hodgkin‘s lymphoma. Zhongguo Shi Yan Xue Ye Xue Za Zhi 2013; 21 : 387-91.
6. Kim SJ, Choi CW, Mun YC, et al. Multicenter retrospective analysis of 581 patients with primary intestinal non-Hodgkin lymphoma from the Consortium for Improving Survival of Lymphoma (CISL). BMC Cancer 2011; 11 : 321.
7. Psyrri A, Papageorgiou S, Economopoulos T. Primary extranodal lymphomas of stomach: clinical presentation, diagnostic pitfalls and management. Ann Oncol 2008; 19 : 1992-9.
8. Dreyling M, Thieblemont C, Gallamini A, et al. ESMO consensus konference: guidelines on malignant lymphoma. part 2: marginal zone lymphoma, mantle cell lymphoma, peripheral T-cell lymphoma. Ann Oncol 2013; 24 : 857-77.
9. Zucca E, Conconi A, Laszlo D, et al. Addition of rituximab to chlorambucil produces superior event-free survival in the treatment of pa-tients with extranodal marginal-zone B-cell lymphoma: 5-year analysis of the IELSG-19 Randomized Study. J Clin Oncol 2013; 10 : 31 : 565-72.
10. Zucca E, Gregorini A, Cavalli F. Management of non-Hodgkin lymphomas arising at extranodal sites. Therapeutische Umschau 2010; 67: DOI 10.1024/0040-5930/a000088.
11. Rohatiner A, d‘Amore F, Coiffier B, et al. Report on workshop convened to discuss the pathological and staging classification of gastrointestinal tract lymphoma. Ann Oncol 1994; 5 : 397-400.
12. Ruskone-Fourmestraux A, Dragosics B, Morgner A, et al. Paris staging system for primary gastrointestinal lymphomas. Gut 2003; 52 : 912-916.
13. Mazloom A, Medeiros LJ, McLaughlin PW, et al. Marginal zone lymphomas. Factors that affect the final outcome. Cancer 2010; 116 : 4291-8.
14. Zinzani PL. The many faces of marginal zone lymphoma. Hematology Am Soc Hematology Educ Program 2012; 2012 : 426-32.
15. Lecuit M, Abachin E, Martin A, et al. Immunoproliferative small intestinal disease associated with Campylobacter jejuni. N Engl J Med 2004; 350 : 239-48.
16. Al-Saleem T, Al-Mondhiry H. Immunoproliferative small intestinal disease (IPSID): a model for mature B-cell neoplazma. Blood 2005; 105 : 2274-80.
17. Stolte M, Bayerdörffer E, Morgner A, et al. Helicobacter and gastric MALT lymphoma. Gut 2002; 50 : 19-24.
18. Farinha P, Gascoyne RD. Molecular pathogenesis of mucosa-associated lymphoid tissue lymphoma. J Clin Oncol 2005; 23 : 6370-8.
19. Olszewski AJ, Castillo JJ. Comparative outcome of oncologic therapy in gastric extranodal marginal zone (MALT) lymphoma: analysis of the SEER – Medicare database. Ann Oncol 2013; 24 : 1352-9.
20. Nakamura T, Seto M, Tajika M, et al. Clinical features and prognosis of gastric MALT lymphoma with special reference to responsiveness to H. pylori eradication and API2/MALT1. Am J Gastroenterol 2008; 103 : 62-70.
21. Fischbach W, Schramm S, Goebeler E. Outcome and quality of life favour a conservative treatment of patients with primary gastric lymphoma. Z Gastroenterol 2011; 49 : 430-5.
22. Caronna R, Cardi M, Martelli M, et al. Systematic radical gastrectomy and D2 lymphadenectomy in primary gastric B cell lymphoma: impact on diagnosis, classification and long term results. A prospective study. J Chemother 2004; Suppl 5 : 26-9.
23. Wündisch T, Dieckhoff P, Greene B, et al. Second cancers and residual disease in patients treated for gastric mucosa-associated lymphoid tissue lymphoma by Helicobacter pylori eradication and followed for 10 years. Gastroenterology 2012; 143 : 936-42.
24. Fererri AJ, Montalban C. Primary difuse large B-cell lymphoma of the stomach. Crit Rev Oncol Hematol 2007; 63 : 65-71.
25. Heslop HE. How I treat EBV lymphoproliferation. Blood 2009; 114 : 4002-4008.
26. Ok CY, Papathomas TG, Medeiros LJ Young KH. EBV-positive diffuse large B-cell lymphoma of the elderly. Blood 2013; 122 : 328-40.
27. Wong HH, Wang J. Epstein-Barr virus positive diffuse large B-cell lymphoma of the elderly. Leuk Lymphoma 2009; 50 : 335-40.
28. Lenz G, Wright GW, Emre NC, et al. Molecular subtypes of diffuse large B-cell lymphoma arise by distinct genetic pathways. Proc Natl Acad Sci U S A 2008; 105 : 13520-5.
29. Lin L, Min M, Bi CF, et al. Primary gastrointestinal diffuse large B-cell lymphoma: an immunohistochemical and prognostic study of 90 cases. Zonghua Bing Li Xue Za Zhi 2011; 10 : 220-6.
30. Zhang Z, Shen Y, Shen D, Ni X. Immunophenotype classification and therapeutic outcome of Chinese primary gastrointestinal diffuse large B-cell lymphoma. BMC Gastroenterol 2012; 12 : 77.
31. De Jong D, Rosenwald A, Chhanabhai M, et al. Immunohistochemical prognostic markers in diffuse large B-cell lymphoma: validation of tissue microarray as a prerequisite for broad clinical applications – a study from Lunenburg Lymphoma Biomarker Consortium. J Clin Oncol 2007; 25 : 805-12.
32. Peyrade F, Jardin F,Thieblemont C, et al. Attenuated immunochemotherapy regimen (R-mini-CHOP) in elderly patients older than 80 years with diffuse large B-cell lymphoma: a multicentre, single-arm, phase 2 trial. Lancet Oncol 2011; 12 : 460-8.
33. Kuo SH, Yeh KH, Wu MS, et al. Helicobacter pylori eradication therapy is effective in the treatment of early-stage H. pylori-positive gastric diffuse large B-cell lymphomas. Blood 2012; 119 : 4838-44.
34. Maisey N, Norman A, Prior Y, Cunningham D. Chemotherapy for primary gastric lymphoma: does in-patient observation prevent complications? Clin Oncol (R Coll Radiol) 2004; 16 : 48-52.
35. Spectre G, Libster D, Grisariu S, et al. Bleeding, obstruction, and perforation in a series of patients with aggressive gastric lymphoma treated with primary chemotherapy. Ann Surg Oncol 2006; 13 : 1372-8.
36. Gupta G, Agarwala S, Thulkar S, et al. Jejunal stricture: a rare complication of chemotherapy in pediatric gastrointestinal B-cell non--Hodgkin lymphoma. J Pediatr Hematol Oncol 2011; 33: e69-71.
37. Kerr JP, Turner M, Ashton-Key M, et al. Intestinal strictures: a new complication of treatment for primary gastrointestinal diffuse large B-cell lymphoma. Br J Haematol 2008; 140 : 712-14.
38. Misdraji J, Harris NL, Hasserjian RP, et al. Primary follicular lymphoma of the gastrointestinal tract. Am J Surg Pathol 2011; 35 : 1255-63.
39. Shia J, Teruya-Feldstein J, Pan D, et al. Primary follicular lymphoma of the gastrointestinal tract: a clinical and pathologic study of 26 cases. Am J Surg Pathol 2002; 26 : 216-24.
40. Montoto S, Davies AJ, Matthews J, et al. Risk and clinical implica-tions of transformation of follicular lymphoma to diffuse large B-cell lymphoma. J Clin Oncol 2007; 25 : 2426-33.
41. Al-Tourah AJ, Gill KK, Chhanabhai M, et al. Population-based analysis of incidence and outcome of transformed non-Hodgkin’s lymphoma. J Clin Oncol 2008; 26 : 5165-9.
42. Horning SJ. Follicular lymphoma, survival, and rituximab: is it time to declare victory? J Clin Oncol 2008; 26 : 4537-8.
43. Liu Q, Fayad L, Cabanillas F, et al. Improvement of overall and failure-free survival in stage IV follicular lymphoma: 25 years of treatment experience at The University of Texas M.D. Anderson Cancer Center. J Clin Oncol 2006; 24 : 1582-9.
44. Tan D, Rosenberg SA, Levy R, et al. Survival in follicular lymphoma: The Standford experience, 1960-2003. Blood 2007; 110 (Suppl): abstract No 3428.
45. Schmatz AI, Streubel B, Kretschmer-Chott E, et al. Primary follicular lymphoma of the duodenum is a distinct mucosa/submucosal variant of follicular lymphoma: a retrospective study of 63 cases. J Clin Oncol 2011; 29 : 1445-51.
46. Meijerink JPP, Raemaerkers JMM, Mensink EJBM. New type of t(14;18) in a non-Hodgkin´s lymphoma provides insight in molecular events in early B-cell differentiation. Br J Heamatol 1995; 91 : 630-9.
47. Lowry L, Smith P, Qian W, et al. Reduced dose radiotherapy for local control in non-Hodgkin lymphoma: a randomised phase III trial. Radiother Oncol 2011; 100 : 86-92.
48. Salles G, Seymour JF, Offner F, et al. Rituximab maintenance for 2 years in patients with high tumour burden follicular lymphoma responding to rituximab plus chemotherapy (PRIMA): a phase 3, randomised controlled trial. Lancet 2011; 377(9759): 42-51.
49. McNamara C, Davies J, Dyer M et al. Guidelines on the investigation and management of follicular lymphoma. Br J Haematol 2012; 156 : 446-67.
50. Ghielmini M, Vitolo U, Kimby E, et al. ESMO Guidelines consensus conference on malignant lymphoma 2011 part 1: diffuse large B-cell lymphoma (DLBCL), follicular lymphoma (FL) and chronic lymphocytic leukemia (CLL). Ann Oncol 2013; 24 : 561-76.
51. Nguyen V, Nguyen B, Petris GD, et al. Education and imaging. Gastrointestinal: gastrointestinal involvement of mantle cell lymphoma. J Gastroenterol Hepatol 2012; 27 : 617.
52. Ambinder AJ, Shenoy PJ, Nastoupil LJ, Flowers CR. Using primary site as a predictor of survival in mantle cell lymphoma. Cancer 2013; 119 : 1570-7.
53. Welzel N, Le T, Marculescu R, et al. Templated nucleotide addition and immunoglobulin JH-gene utilization in t(11;14) junctions: implications for the mechanism of translocation and the origin of mantle cell lymphoma. Cancer Res 2001; 61 : 1629-36.
54. Navarro A, Royo C, Hernandez L, et al. Molecular pathogenesis of mantle cell lymphoma: new perspectives and chalenges with clinical implications. Semin Hematol 2011; 48 : 155-65.
55. Schaffel R, Hedvat CV, Teruya-Feldstein J, at al. Prognostic impact of proliferative index determined by quantitative image analysis and the International Prognostic Index in patients with mantle cell lymphoma. Ann Oncol 2010; 21 : 133-9.
56. Martin P, Chadburn A, Christos P, et al. Intensive treatment strategies may not provide superior outcome in mantle cell lymphoma: overall survival exceeding 7 years with standard therapies. Ann Oncol 2008; 19 : 1327-30.
57. Reddy N, Greer JP, Goodman S, et al. Consolidative therapy with stem cell transplantation improves survival of patients with mantle cell lymphoma after any induction regimen. Exp Hematol 2012; 40 : 359-66.
58. Baumgaertner I, Copie-Bergman C, Levy M, et al. Complete remission of gastric Burkitt´s lymphoma after eradication of Helicobacter pylori. World J Gastroenterol 2009; 15 : 5746-50.
59. Choi SY, Kim SJ, Kim WS, et al. Aggressive B cell lymphoma of the gastrointestinal tract: clinicopathologic and genetic analysis. Virchows Arch 2011; 459 : 495-502.
60. Pagano L, Caira M, Valentini CG, et al. Clinical aspects and therapy of sporadic Burkitt lymphoma. Mediterr J Hematol Infect Dis 2009; 1: e 2009030.
61. Sagaert X, Tousseyn T, Yantiss RK. Gastrointestinal B-cell lymphomas: From understanding B-cell physiology to classification and molecular pathology. World J Gastrointest Oncol 2012; 15 : 238-49.
62. Colovic N, Radovanovic N, Vidovic A, et al. Primary Burkitt´s lymphoma of the stomach. Srp Arh Celok Lek 2011; 139 : 523-6.
63. Wästerlid T, Jonsson B, Hagberg H, Jerkeman M. Population based study of prognostic factors and treatment in adult Burkitt lymphoma: a Swedish Lymphoma Registry study. Leuk Lymphoma 2011; 52 : 2090-6.
64. Barnes JA, Lacasce AS, Feng Y, et al. Evaluation of the addition of rituximab to CODOX-M/IVAC for Burkitt’s lymphoma: a retrospective analysis. Ann Oncol 2011; 22 : 1859-64.
65. De Leval L, Gaulard P. Pathology and biology of peripheral T-cell lymphomas. Histopathology 2011; 58 : 49-68.
66. Ashton-Key M, Diss TC, Pan L, Du MQ, Isaacson PG. Molecular analysis of T-cell clonality in ulcerative jejunitis and enteropathy-associated T-cell lymphoma. Am J Pathol 1997; 151 : 493-8.
67. Verkarre V, Romana SP, Cellier C, et al. Recurrent partial trisomy 1q22-q44 in clonal intraepitelial lymphocytes in refractory celiac sprue. Gastroenterology 2003; 125 : 40-46.
68. Sieniawski M, Angamuthu N, Boyd K, et al. Evaluation of enteropathy-associated T-cell lymphoma comparing standard therapies with novel regiment including autologous stem cell transplantation. Blood 2010; 115 : 3664-70.
69. Wang ZY, Liu QF, Wang H, et al. Clinical implications of plasma Epstein-Barr virus DNA in early-stage extranodal nasal-type NK/T--cell lymphoma patients receiving primary radiotherapy. Blood 2012; 120 : 2003-10.
70. Motsch N, Alles J, Imig J, et al. MicroRNA profilig of Epstein-Barr virus-associated NK/T-cell lymphomas by deep sequencing. PloS One 2012; 7 : 42193.
71. Yamaguchi M. Current and future management of NK/T-cell lymphoma based on clinical trials. Int J Hematol 2012; 96 : 562-71.
72. Dong HY, Scadden DT, de Leval L, et al. Plasmablastic lymphoma in HIV-positive patients: an aggressive Epstein-Barr virus-associated extramedullary plasmacytic neoplasm. Am J Surg Pathol 2005; 29 : 1633-41.
73. Montes-Moreno S, Montalban C, Piris MA. Large B-cell lymphomas with plasmablastic differentiation: a biological and therapeutic challenge. Leuk Lymphoma 2012; 53 : 185-94.
74. Kashi MR, Belayev L, Parker A. Primary extranodal Hodgkin lymphoma of the colon masquerading as new diagnosis of Crohn‘s disease. Clin Gastroenterol Hepatol 2010; 8: A20.
75. Gandhi JS, Mehta A, Sharma A, et al. Primary Hodgkin lymphoma of the ileum. J Cancer Res Ther 2010; 6 : 342-3.
76. Kakati BR, Krishna K, Krishna SG, et al. Extensive extramedulary disease involving the colon in multiple myeloma: a case report and review of literature. J Gastrointestinal Cancer 2012; 43 : 379-81.
77. Ebert EC, Nagar M. Gastrointestinal manifestations of amyloidosis. Am J Gastroenterol 2008; 103 : 776-87.
Labels
Haematology Internal medicine Clinical oncology
Article was published inTransfusion and Haematology Today

2013 Issue 3-
All articles in this issue
- Initial experience of Czech MDS Group with 5-azacytidine in patients with high risk myelodysplastic syndromes (IPSS intermediate II and high), acute myeloid leukaemia with less than 30% myeloblasts and chronic myelomonocytic leukaemia II
- The importance of serum immunoglobulin free light chain assay in AL amyloidosis
- Lymphomas of gastrointestinal tract – clinico-pathological review
- Plasma cell leukaemia
- Current treatment of myelofibrosis based on risk stratification of patients
- Acquired thrombophilias as a cause of early pregnancy losses
- Microbiological control for processing of blood
- Transfusion and Haematology Today
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Current treatment of myelofibrosis based on risk stratification of patients
- Lymphomas of gastrointestinal tract – clinico-pathological review
- The importance of serum immunoglobulin free light chain assay in AL amyloidosis
- Plasma cell leukaemia
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career




