-
Medical journals
- Career
Nežádoucí reakce při odběru hemopoetických kmenových buněk u nepříbuzných dárců – desetiletá zkušenost Českého národního registru dárců dřeně (ČNRDD)
Authors: Lysák D.ihash2ihash4ihash6ihash8ihash10 1 1 1 1 1,2 1,2
Authors‘ workplace: Hematologicko-onkologické oddělení FN Plzeň, Český národní registr dárců dřeně 1
Published in: Transfuze Hematol. dnes,17, 2011, No. 3, p. 130-136.
Category: Comprehensive Reports, Original Papers, Case Reports
Overview
Analyzovali jsme retrospektivně soubor 339 nepříbuzných dárců, kteří podstoupili odběr kostní dřeně (n = 169) nebo periferních kmenových buněk (n = 170) v období 1999–2009. Požadovaná dávka hemopoetických kmenových buněk byla odebrána u 60 % procedur, bez signifikantního rozdílu mezi muži a ženami. Suboptimální transplantát byl získán u 2 % odběrů kostní dřeně a 5 % odběrů periferních kmenových buněk. Frekvence výskytu nežádoucích reakcí byla 55 % (51 % odběrů kostní dřeně a 59 % odběrů periferních kmenových buněk). Nejčastějšími reakcemi byly u dárců kostní dřeně nauzea a zvracení po celkové anestezii a bolest v místě aspirace. Odběry periferních kmenových buněk byly nejčastěji spojené s výskytem leukopenie a trombocytopenie. Vyšší výskyt nežádoucích reakcí byl zaznamenán u žen. Během sledovaného období nedošlo k rozvoji žádné závažné nežádoucí události nebo k úmrtí dárce v souvislosti s odběrem. Studie prokázala, že odběr hemopoetických kmenových buněk od zdravých dárců je bezpečná procedura s nízkým rizikem komplikací. Registr dárců má stanovené postupy pro výběr dárce, vyšetření před odběrem i pro péči o dárce během odběru a po jeho ukončení. Dodržování těchto pravidel v kombinaci s vysokou odbornou zdatností všech zúčastněních zdravotnických pracovníků snižuje pravděpodobnost vzniku závažných nebo neočekávaných komplikací při darování.
Klíčová slova:
kmenové buňky, alogenní, dárce, registr, nežádoucí reakce, CD34+Úvod
Alogenní transplantace hemopoetických kmenových buněk je více než dvě desetiletí standardní léčebnou procedurou pro řadu maligních hematologických i jiných nenádorových onemocnění. Evropská transplantační centra provádějí ročně přes 12 000 alogenních transplantací. Nadpoloviční množství transplantací je nepříbuzenských, tedy s použitím transplantátu odebraného od nepříbuzného dárce (1). Registry dobrovolných dárců evidují celosvětově k začátku roku 2011 přes 17 milionů zdravých dobrovolníků a počet odběrů ročně přesahuje 10 000 (www.worldmarrow.org).
Odběr hemopoetických kmenových buněk provedený z kostní dřeně (BM) nebo po mobilizaci z periferní krve (PBSC) je vždy doprovázen určitým nepohodlím pro dárce. Nežádoucí reakce před, v průběhu a po odběru jsou časté, ovšem většinou se jedná o komplikace nezávažné a přechodné, které nemají dlouhodobý dopad na zdraví dárce. Výskyt reakcí ohrožujících zdraví nebo život dárce je velmi vzácný, nicméně reálný (2, 3). Dárci jsou poučeni a jsou si vědomi, že darování má svá rizika, ovšem zodpovědnost za minimalizaci rizik leží především na registrech dárců a jejich odběrových centrech. Pečlivý výběr, posouzení zdravotní způsobilosti a kvalitní informovanost dárců jsou předpokladem bezpečného dárcovství.
Komplikace při odběru kostní dřeně vyplývají především z celkové anestezie nebo se týkají lokálních změn v místě aspirace kostní dřeně. Při mobilizaci a odběru periferních kmenových buněk jsou komplikace způsobeny jednak toxicitou filgrastimu používaného k mobilizaci, a jednak vlastní aferetickou procedurou. Krátkodobé účinky podávání filgrastimu zdravému jedinci jsou dostatečně známé. Je popsán jeho vliv na parametry krevního obrazu a koagulace, na hladiny některých cytokinů či kostní metabolismus (4, 5). Diskuse o bezpečnosti filgrastimu se tak v posledních letech dotýká spíše jeho dlouhodobé bezpečnosti. Potenciální zvýšené riziko vzniku hematologických malignit po aplikaci filgrastimu, zejména u příbuzných dárců, je předmětem sledování, epigenetických a dlouhodobých epidemiologických studií (6, 7).
V naší studii jsme retrospektivně vyhodnotili soubor nepříbuzných dárců hemopoetických kmenových buněk, kteří byli odebráni v průběhu desetiletého období. Cílem analýzy bylo sumarizovat kvalitu odebraných transplantátů a zejména výskyt nežádoucích reakcí vzniklých v době odběru a v časném období po odběru a vyhodnotit tak bezpečnost dárcovství kmenových buněk pro účely alogenní transplantace. Studie se nevěnovala dlouhodobým komplikacím odběrů, které jsou sledovány v rámci dlouhodobé dispenzarizace dárců.
Soubor dárců
Analyzovali jsme retrospektivně soubor dobrovolných nepříbuzných dárců hemopoetických kmenových buněk, kteří byli odebráni v rozmezí let 1999–2009 v odběrovém centru Českého národního registru dárců dřeně (ČNRDD). Celkem bylo hodnoceno 339 dárců, kteří darovali kostní dřeň (169 dárců) nebo periferní kmenové buňky (170 dárců). Všichni dárci podstoupili přibližně 3 týdny před odběrem předodběrové vyšetření za účelem posouzení jejich zdravotní způsobilosti k odběru v souladu s aktuální platnou legislativou. Dárcům kostní dřeně byl zároveň proveden jeden odběr autologní krve. Dárci periferních kmenových buněk (PBSC) byli mobilizováni růstovým faktorem granulopoézy (filgrastim, G-CSF, Neupogen, Amgen, USA) v dávce ~ 10 μg/kg/den po dobu 4–5 dnů. Dárci byli poučeni o metodách a možných komplikacích odběru a na základě těchto informací si zvolili preferovaný způsob odběru. Všichni dárci podepsali informovaný souhlas s odběrem a s anonymním zpracováním dat. Péče o dárce při předodběrovém vyšetření, v době odběru a při následné dispenzarizaci se řídila standardy ČNRDD resp. WMDA (World Marrow Donor Association).
Medián věku dárců byl 31 let (20–55 let), pouze 7 dárců bylo ve věku nad 50 let. Muži (71 % odběrů) byli odebíráni častěji než ženy (29 % odběrů). Základní demografická data dárců jsou uvedena v tabulce 1, vývoj zastoupení dárců dle pohlaví a dle věkových skupin ve sledovaném období pak v grafech 1 a 2. Všichni dárci byli zdraví, ojediněle se vyskytly komorbidity (13 dárců, 4 %), které byly vyhodnoceny jako nezávažné a které nebránily provedení odběru (tab. 2). Nejčastěji se jednalo o mírnou elevaci bilirubinu v rámci M. Gilbert (3 muži) a o stabilizovanou hypotyreózu (3 ženy).
Table 1. Charakteristika dárců. 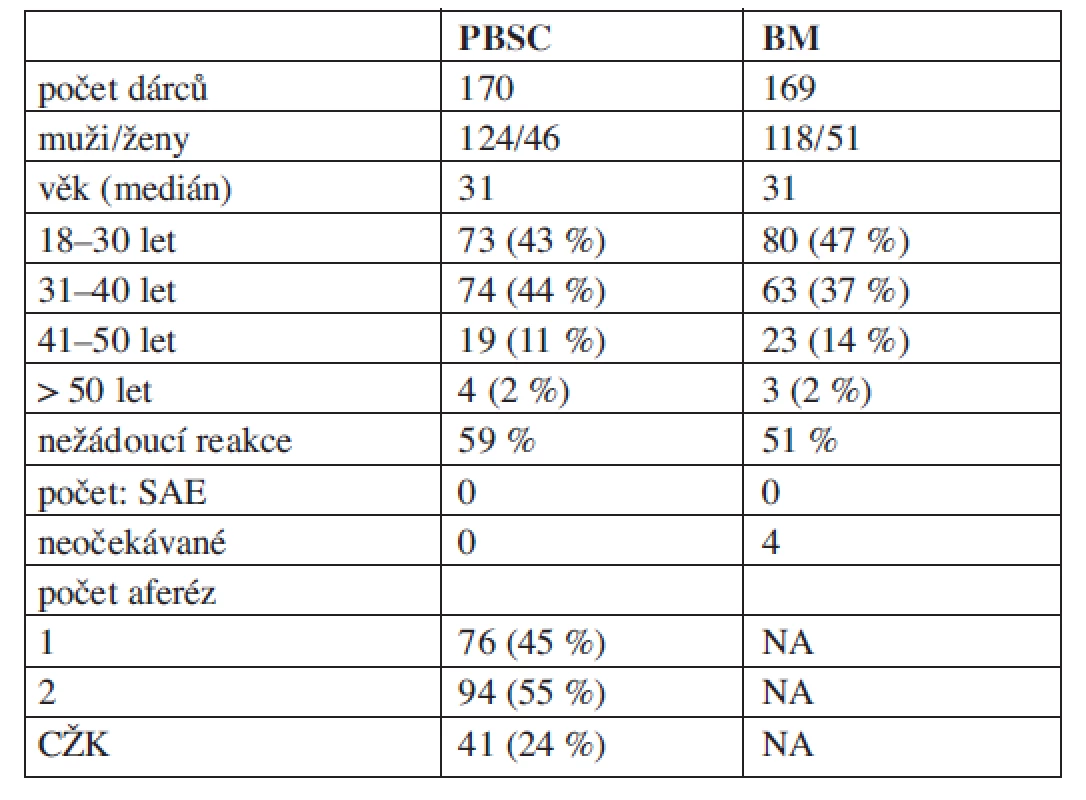
SAE – závažná nežádoucí reakce Table 2. Komorbidity dárců. 
VAS – vertebrogenní algický syndrom Graph 1. Vývoj zastoupení dárců dle pohlaví 1999–2009. Změny zastoupení dárců a dárkyň v jednotlivých časových obdobích. 
Graph 2. Vývoj zastoupení dárců dle věku 1999–2009. Věk dárců a jeho vývoj v jednotlivých časových obdobích, mediány. 
Informace o zdravotních komplikacích vzniklých v souvislosti s odběrem byly získány ze zdravotní dokumentace dárců vedené odběrovým a koordinačním centrem registru. Za závažné nežádoucí reakce (SAE) byly v souladu se standardy registru považovány komplikace, které (a) fatálně ohrožují život dárce, (b) mají trvalé následky na zdraví dárce, nebo (c) vyžadují okamžitou medicínskou intervenci u dárce. Neočekávané nežádoucí reakce představují atypické zdravotní problémy v průběhu odběru u dárce, které nelze předpokládat. Na monitorování nežádoucích reakcí v průběhu odběru navazuje plynule dispenzarizace dárce, která sleduje dlouhodobé komplikace po dobu 4 let po provedení odběru.
Odběr kostní dřeně byl prováděn na operačním sále za aseptických podmínek opakovanými aspiracemi ze spina iliaca posterior superior. Jako antikoagulant byl použit ACD-A (Baxter, USA) v poměru 1 : 10 ke kostní dřeni, doplněný eventuálně o heparin (Zentiva, ČR) v množství požadovaném transplantačním centrem. Maximální objem kostní dřeně nesměl překročit 20 ml/kg hmotnosti dárce, maximálně však 1500 ml včetně antikoagulantu. Kostní dřeň byla ještě na operačním sále filtrována systémem filtrů (Bone Marrow Collection Kit, Fenwal, USA) k odstranění kostních fragmentů a tukových partikulí. Periferní kmenové buňky byly odebírány metodou velkoobjemové leukocytaferézy se zpracováním 3–4 krevních objemů dárce. Odběry byly zahajovány v den +5 aplikace filgrastimu. U všech dárců byly provedeny maximálně dvě aferézy s mediánem doby trvání výkonu 243 minut (156–278). Antikoagulace v mimotělním oběhu byla zajišťována ACD-A v poměru 1 : 10–1 : 14 k plné krvi. Rychlost podávání ACD-A dosahovala maximálně 1,0 ml/min/litr krve dárce. Celkové množství antikoagulantu podaného dárci odpovídalo 1088 ml (738–1308). Jako prevence citrátové toxicity byla prováděna suplementace kalcia do návratové linky (10–20 ml Ca chloratum frakcionovaně nebo kontinuálně). Odběry byly uskutečněny na kontinuálních separátorech COBE Spectra (Caridian BCT, USA). Jako žilní přístup byly preferenčně využívány kontralaterální periferní žíly na předloktí, pouze 24 % dárců muselo podstoupit zavedení dialyzačního katétru do femorální žíly (ve 100 % se jednalo o ženy). Minimální množství buněk, které by mělo být odebráno bez ohledu na požadavek transplantačního centra, je dle standardů registru 3,0 x 106 CD34+ buněk/kg v případě odběru PBSC, respektive 2,0 x 108 jaderných buněk (NC)/kg hmotnosti příjemce u odběru kostní dřeně. Nižší hodnoty indikují suboptimální štěp. Selhání mobilizace bylo definováno jako neschopnost dosáhnout více než 10,0 cirkulujících CD34+ buněk/μl periferní krve.
Statistické hodnocení a porovnání odběrů mezi muži a ženami bylo provedeno Fischerovým testem. Hodnota p < 0,05 byla považována za statisticky signifikantní. Analýza byla provedena v software GraphPad In Stat (GraphPad Software Inc., USA).
Výsledky
Na souboru 339 dárců hemopoetických kmenových buněk jsme hodnotili výskyt nežádoucích reakcí u dárce v průběhu odběru a v časném poodběrovém období. Zdrojem kmenových buněk byla přibližně u poloviny dárců kostní dřeň a u poloviny periferní kmenové buňky (169 a 170 dárců). Ve sledovaném období deseti let (1999–2009) se měnilo zastoupení obou typů transplantátů. Zpočátku dominovaly odběry kostní dřeně, od roku 2002 začaly převažovat naopak PBSC a nakonec od roku 2008 byla opět větší část odběrů provedena z kostní dřeně. Vývoj počtu a struktury transplantátů graf 3 (komentář trendu viz diskuse).
Graph 3. Zdroj hemopoetických kmenových buněk v období 1999 – 2009. Zastoupení jednotlivých typů odběrů (kostní dřeň vs. PBSC) a vývoj jejich vzájemného poměru v letech 1999–2009 (blíže viz text). 
Při odběrech kostní dřeně byl požadavek transplantačních center na množství NC v transplantátu 4,0 x 108 (medián; 2,0–10,0)/kg hmotnosti příjemce. Požadavek byl naplněn u 62 % dárců (4,0; 1,5–23,8 x 108/kg NC) a u 54 % dárkyň (3,6; 2,1–11,9 x 108/kg NC; ns). V případě odběrů periferních kmenových buněk bylo požadováno 5,0 x 106 (medián, 2,0–15,0) CD34+ buněk/kg. Cílové dávky bylo dosaženo u 68 % dárců (6,1; 2,0–32,7 x 106 CD34+/kg) a u 52 % dárkyň (5,8; 1,4–13,3 x 106 CD34+/kg; p = 0,0736). Mezi kvalitou štěpů odebraných od mužů či žen nebyl statisticky signifikantní rozdíl, přestože byl patrný trend k menšímu množství buněk v transplantátech odebraných od dárkyň. Rozdělení odběrů podle dosažených výtěžků (viz graf 4). Suboptimální transplantát byl získán u 2 % odběrů kostní dřeně a u 5 % odběrů PBSC, opět bez ohledu na pohlaví dárce. Ani u jednoho dárce nebylo konstatováno selhání mobilizace. Druhé darování kmenových buněk bylo požadováno celkem u osmi dárců, s výjimkou jediného dárce se jednalo o odběr pro stejného příjemce z důvodu rejekce štěpu nebo retransplantace.
Graph 4. Odebrané množství jaderných a CD34+ buněk. Množství odebraných jaderných buněk (x 108/kg, odběry kostní dřeně) a CD34+ buněk (x 106/kg, odběry PBSC), rozdělení dárců do podskupin podle výtěžku odběru. 
Nežádoucí reakce u dárce v souvislosti s odběrem byly zaznamenány celkem u 55 % dárců, z toho u 51 % dárců kostní dřeně a 59 % dárců PBSC. Při hodnocení výskytu reakcí jsme brali do úvahy pohlaví dárců, vliv věku nebyl zohledňován pro predominanci mladých dárců v souboru. Odběry kostní dřeně byly nejčastěji doprovázeny nauzeou či zvracením po celkové anestezii (27 % dárců) a bolestmi v místě aspirace (11 % dárců). Ostatní komplikace se vyskytovaly s pravděpodobností do 5 % (tab. 3). Nenalezli jsme rozdíl ve výskytu komplikací mezi muži a ženami. Odběr kostní dřeně vedl k poklesu hladiny hemoglobinu o cca 20–25 g/l. Hladina hemoglobinu před odběrem a po odběru byla u mužů 148 (121–173) g/l v.s. 126 (101–158) g/l a u žen 130 (110–152) g/l v.s. 105 (77–139) g/l. Všem dárcům s výjimkou čtyř byl podán autologní erytrocytový transfuzní přípravek k doplnění krevní ztráty. Dárkyně častěji dosáhly poklesu hladiny hemoglobinu pod 90 g/l (10 % v.s. 0 %, ns).
Table 3. Nežádoucí reakce dárců BM. 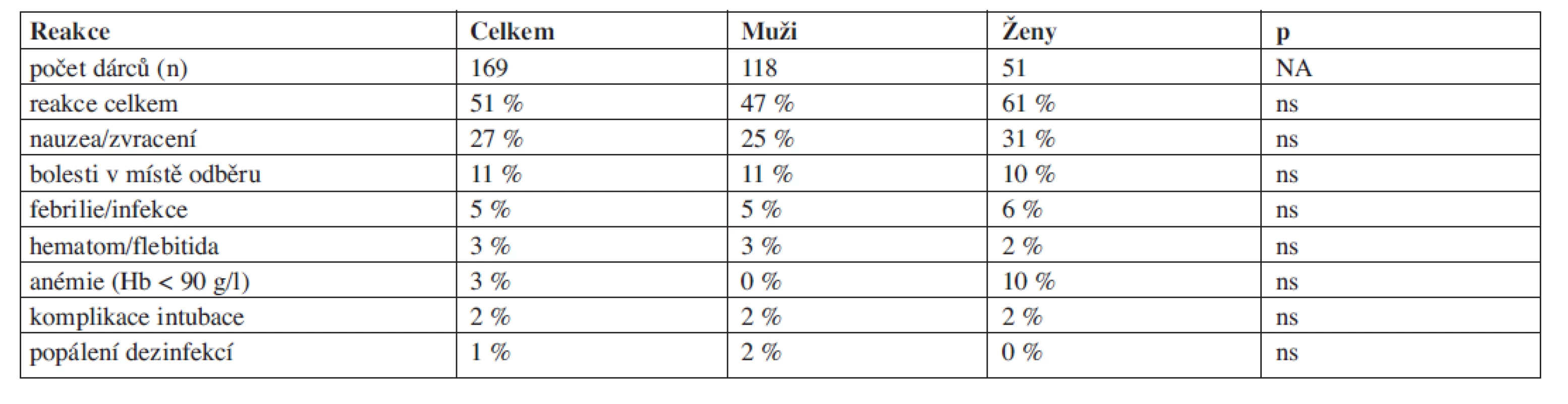
Při odběrech periferních kmenových buněk byly nejčastěji zaznamenávanými komplikacemi pokles hladiny leukocytů po ukončené mobilizaci filgrastimem (27 % dárců) a trombocytopenie po aferéze (8 % dárců). Při vyloučení změn v krevním obraze byla frekvence nežádoucích reakcí celé skupiny dárců PBSC pouze 19 %, více reakcí bylo pozorováno u žen (30 % v.s. 15 %, p = 0,0264).
Medián hladiny leukocytů před mobilizací byl 6,05 (3,1–13,6) x 109/l, maximální hladiny bylo dosaženo v den +5 mobilizace 35,3 (12,7–95,2) x 109/l. Leukocytóza nad 50 x 109/l byla v době mobilizace zaznamenána u 19 % dárců, nad 70 x 109/l vystoupaly leukocyty u 2 % dárců. Naopak největší pokles leukocytů nastal jeden týden po odběru – 4,5 (medián; 1,6–10,5) x 109/l. K poklesu leukocytů pod hodnotu 4,0 x 109/l došlo u 27 % dárců, k poklesu pod 3,0 x 109/l u 13 % dárců a to nejčastěji při kontrolním vyšetření krevního obrazu za týden nebo dva týdny po odběru. Hladina leukocytů se normalizovala do šesti měsíců od odběru u všech dárců s výjimkou jednoho. Kinetiku leukocytů sumarizuje graf 5.
Graph 5. Vývoj hladiny leukocytů u dárců po odběru PBSC. Hodnoty před mobilizací až do 12 měsíců od odběru; mediány; hodnoceno 139 dárců. Hladina leukocytů před mobilizací 6,05 (3,1–13,6) x 109/l, maximální hladina v den +5 mobilizace 35,3 (12,7–95,2) x 109/l, největší pokles týden po odběru 4,5 (1,6–10,5) x 109/l. 
Ostatní nežádoucí reakce se vyskytovaly s frekvencí do 5 % (tab. 4) a jejich výskyt nebyl ovlivněn pohlavím dárce, přestože jsme pozorovali určitý trend k častějšímu výskytu některých komplikací u žen (zejména citrátová toxicita, flu-like syndrom nebo bolesti skeletu). Frekvence komplikací spojených s použitím centrálního žilního katétru byla velmi nízká (1,8 %) a jednalo se zejména o hematom v místě zavedení katétru.
Table 4. Nežádoucí reakce dárců PBSC. 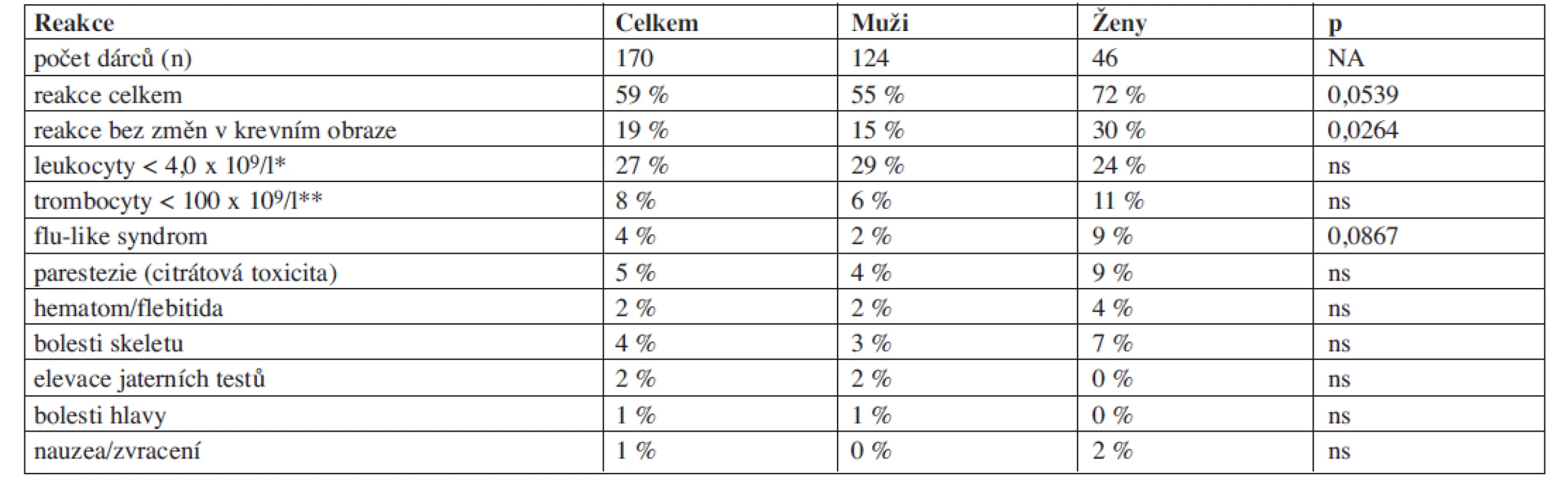
* hodnoceno po dobu 4 týdnů od odběru (n = 139); ** hodnoceno den po poslední aferéze Za celé sledované období nebyla zaznamenána jediná reakce, která by naplnila kritéria závažné nežádoucí reakce. Celkem u čtyř dárců kostní dřeně se objevila neočekávaná komplikace: 2 x popálení kůže skrota dezinfekcí na operačním sále, 2 x infekce v časové koincidenci avšak bez zjevné příčinné souvislosti s odběrem (salmonelóza, infekce horních cest dýchacích).
Diskuse
Kostní dřeň nebo PBSC odebrané od nepříbuzných dárců jsou stále častějším zdrojem hemopoetických kmenových buněk pro účely alogenní transplantace. Provedli jsme analýzu 339 darování u nepříbuzných dárců z Českého národního registru dárců dřeně se zaměřením na nežádoucí reakce vzniklé v souvislosti s odběrem. Polovina dárců podstoupila odběr kostní dřeně v celkové anestezii, polovině dárců byly odebrány periferní kmenové buňky metodou aferézy po mobilizaci filgrastimem.
Množství kmenových buněk je důležitým parametrem určujícím kvalitu odebraného transplantátu. Naplnění určitých minimálních hodnot je jedním ze základních předpokladů bezproblémové přihojení a podaná dávka CD34+ buněk ovlivňuje dokonce parametry přežití po transplantaci (8). V našem souboru bylo cílové dávky požadované transplantačním centrem dosaženo u 60 % dárců. Suboptimální transplantáty (PBSC < 3,0 x 106 CD34+ buněk/kg; BM < 2,0 x 108 jaderných buněk/kg hmotnosti příjemce) byly odebrány u 2 % odběrů BM a 5 % odběrů PBSC. Podobnou zkušenost při odběru PBSC měli i jiní autoři s 2 % výskytem suboptimálních odběrů při maximálním počtu 3 aferéz (5). Množství odebraných buněk může být ovlivněno věkem či pohlavím dárce. Zejména v případě aferéz bývá nižších výtěžků dosahováno u starších dárců a u žen (9, 10). Určitý, i když statisticky nevýznamný, trend k nižšímu obsahu kmenových buněk v transplantátech odebraných od dárkyň jsme pozorovali také v našem souboru pravděpodobně v souvislosti s nižší hmotností žen.
Dominující zdroj kmenových buněk doznal v posledním desetiletí určitý vývoj. Ještě na přelomu tisíciletí byla odebírána nepříbuzným dárcům téměř výhradně kostní dřeň. Poté začala být mobilizace G-CSF akceptována registry dárců a počet odběrů PBSC postupně překonal odběry kostní dřeně v letech 2002–2003. V celosvětovém měřítku nadále mírně převažují odběry PBSC, zatímco v ČNRDD se poměr od roku 2008 opět obrátil ve prospěch kostní dřeně (11). Vysvětlením může být častější požadavek transplantačního centra na odběr kostní dřeně pro příjemce s nízce rizikovými malignitami či dřeňovými útlumy a také preference dárců samotných častěji směřující k volbě této metody odběru. Svůj podíl na tomto trendu mohou mít probíhající diskuse o dlouhodobé bezpečnosti a eventuálním leukemogenním potenciálu G-CSF u zdravých dárců, které snižují počet dárců ochotných podstoupit mobilizaci filgrastimem (12).
Nejčastějším problémem, který uvádějí dárci po odběru kostní dřeně, jsou bolesti v místě odběru, bolesti v krku po intubaci nebo nauzea po celkové anestezii. U dárců PBSC jsou nejvíce nepříjemné bolesti kostí, svalů či hlavy a flu-like symptomy po aplikaci G-CSF nebo únava a parestezie při aferéze (9, 13, 14). Výskyt nežádoucích reakcí udávaný v literatuře kolísá mezi 20–80 % v závislosti na definici nežádoucí reakce, charakteristice souboru a studie (10, 13 - 16). Frekvence komplikací v naší analýze byla 55 %. Některá z nežádoucích reakcí se objevila u 51 % dárců kostní dřeně a 59 % dárců PBSC. Vyloučení změn v krevním obraze u dárců PBSC z analýzy by snížilo počet zaznamenaných nežádoucích reakcí v porovnání s dárci kostní dřeně (19 % v.s. 51 %). Navíc v případě dárců podstupujících mobilizaci je část komplikací v době odběru dána spíše působením filgrastimu než vlastní aferetickou procedurou. Více komplikací po odběrech kostní dřeně uvádějí i jiní autoři (17, 18). Naopak odběry PBSC jsou ve srovnání s darováním kostní dřeně spojeny podle některých studií s menší únavou a dopadem na kvalitu života dárce bezprostředně po odběru (17, 19).
Hledali jsme rozdíly ve výskytu nežádoucích reakcí s ohledem na pohlaví dárce. Mezi dárci BM i PBSC byl patrný vyšší výskyt reakcí u žen, statisticky signifikantně však pouze pro odběry PBSC. Tento rozdíl byl patrný i v jiných studiích (13, 20).
Nezaznamenali jsme žádnou závažnou nežádoucí reakci, která by si vyžádala prodloužení hospitalizace nebo ohrožovala zdraví či život dárce. Také ve velkých studiích byly život ohrožující komplikace extrémně vzácné a jejich výskyt se pohyboval do 1 % všech odběrů v závislosti na velikosti souboru (2, 5, 15, 20, 21).
Centrální žilní katétr (CŽK) bylo nutné zavádět asi u čtvrtiny odběrů PBSC. Některé studie uvádějí podstatně nižší potřebu zavedení centrálního žilního přístupu, kolem 1–5 % (5, 13, 22), jindy je počet dárců s centrálním žilním katétrem podobný, kolem 20 % (21, 23). Odběr u žen vyžaduje častěji zavedení centrálního žilního katétru (14). Podle naší zkušenosti se nutnost zavedení CŽK týkala výhradně žen. Pravděpodobnost zavedení katétru je ovlivněna zastoupením žen a zvyklostmi odběrového centra. Frekvence komplikací souvisejících s CŽK byla velmi nízká (1,8 %) a odpovídala literárním údajům, které uvádějí výskyt těchto komplikací u 1–9 % dárců v závislosti na lokalizaci žilního přístupu (22). Z důvodu minimalizace rizika je vhodné preferovat pro zavedení dialyzačního katétru femorální žílu, u které je pravděpodobnost vzniku komplikací nižší a omezuje se především na hematom po zavedení nebo odstranění katétru. Jiné komplikace (trombóza, krvácení) jsme nepozorovali. Pro prevenci žilní trombózy je však nezbytné dodržet některá opatření, jakými jsou bandáže dolních končetin, co nejčasnější odstranění katétru, případně podání profylaktické dávky nízkomolekulárního heparinu při potřebě ponechat katétr déle než 12 hodin. Některé práce uvádějí zvýšené riziko komplikací u dárců s CŽK (14, 21), my jsme tuto souvislost nepozorovali. Lze spekulovat, že ve zkušených odběrových centrech nezvyšuje zavedení CŽK zásadně celkové riziko nežádoucí reakce u dárce.
Řada autorů popsala změny koagulace při mobilizaci a schopnost G-CSF navozovat hyperkoagulační stav (4, 24, 25). V některých souborech dárců PBSC se vyskytly vzácně kardiovaskulární komplikace jako trombózy (s nebo bez souvislosti s katétrem) nebo dokonce koronární ischemie (2, 21). V našem souboru se tato komplikace neobjevila, což je nepochybně vedle preventivních opatření ovlivněno také faktem, že byli odebírání především mladí, předodběrově vyšetření dárci bez predisponujících faktorů.
Odběr hemopoetických kmenových buněk je spojen také se změnami v krevním obraze dárců. Mobilizace PBSC filgrastimem vyvolává požadovanou přechodnou leukocytózu. Méně očekávaným nálezem je pokles hladiny leukocytů proti hladině před mobilizací, který lze pozorovat u větší části dárců 4 týdny po mobilizaci a odběru. Snížení hladiny leukocytů bývá protrahované a může přetrvávat po dobu 2–5 let (2, 9, 14, 26, 27). Hladina leukocytů u odběrů PBSC v našem souboru poklesla asi u čtvrtiny dárců pod normální hodnoty a k jejich normalizaci došlo do šesti měsíců od odběru. Při odběru periferních kmenových buněk je známým fenoménem také pokles hladiny trombocytů, který je dán jednak přechodnou supresí trombopoezy filgrastimem, přechodnou splenomegalií a zejména deplecí trombocytů při aferéze. Řada studií popisuje až 30–50 % absolutní úbytek trombocytů (15, 28). Pokles trombocytů pod 100 x 109/l jsme zaznamenali pouze u 8 % dárců, většinou po ukončení druhé aferézy.
Všechny odběry kostní dřeně v naší analýze byly provedeny v celkové anestezii. Existuje jen velmi málo studií porovnávajících výhody použití celkové nebo regionální anestezie při odběrech kostní dřeně. Celková incidence komplikací je u obou metod anestezie porovnatelná. Celková anestezie bývá spojena s vyšším výskytem nauzey a zvracení po odběru, naopak u epidurální anestezie existuje vyšší riziko respiračních komplikací (29, 30). Ani jednu z metod anestezie nelze označit za jednoznačně výhodnější pro odběry kostní dřeně. Je možné, že se rozdíly mezi oběma typy anestezie nemohou na souborech zdravých a zpravidla mladých alogenních dárců ani dostatečně projevit. Volba typu anestezie tedy závisí především na lokálních zvyklostech odběrového centra a preferencích anesteziologa nebo dárce a konsensus v této oblasti mohou přinést až budoucí studie.
Závěr
Odběr hemopoetických kmenových buněk od zdravých dárců je bezpečná procedura s nízkým rizikem komplikací. Vhodným výběrem dárce, jeho pečlivým předodběrovým vyšetřením a správným provedením odběru ve specializovaných odběrových centrech za pomoci vysoce vyškoleného a zkušeného personálu je možné potencionální rizika vyplývající z odběru minimalizovat. Registry informují dárce o možných nežádoucích reakcích při darování a mají vypracované systémy pro dispenzarizaci dárců. Dárce podstupuje odběr kmenových buněk v zájmu anonymního nemocného. Registry dárců musí proto postupovat tak, aby nedošlo především k poškození zdraví dárce, a musí zohledňovat nejen medicínské ale i etické aspekty celého procesu darování.
MUDr. Daniel Lysák, PhD
Hematologicko-onkologické oddělení
Fakultní nemocnice Plzeň
Alej Svobody 80
304 60 Plzeň
email: lysak@fnplzen.cz
Doručeno do redakce: 19. 6. 2011
Přijato po recenzi: 27. 7. 2011
Sources
1. Baldomero H, Gratwohl M, Gratwohl A, et al. The EBMT activity survey 2009: trends over the past 5 years. Bone Marrow Transplant 2011; 46 : 485-501.
2. Halter J, Kodera Y, Urbano Ispizua A, et al. Severe events in donors after allogeneic hematopoietic stem cell donation. Haematologica 2009; 94 : 94-101.
3. Favre G, Beksac M, Bacigalupo A, et al. Differences between graft product and donor side effects following bone marrow or stem cell donation. Bone Marrow Transplant 2003; 32 : 873-880.
4. Anderlini P, Champlin RE. Biologic and molecular effects of granulocyte colony-stimulating factor in healthy individuals: recent findings and current challenges. Blood 2008; 111 : 1767-1772.
5. Anderlini P, Donato M, Chan KW, et al. Allogeneic blood progenitor cell collection in normal donors after mobilization with filgrastim: the M.D. Anderson Cancer Center experience. Transfusion 1999; 39 : 555-560.
6. Nagler A, Korenstein-Ilan A, Amiel A, Avivi L. Granulocyte colony-stimulating factor generates epigenetic and genetic alterations in lymphocytes of normal volunteer donor of stem cells. Exp Hematol 2004; 32 : 122-130.
7. Amariglio N, Jacob-Hirsch J, Shimoni A, Leiba M, Rechavi G, Nagler A. Changes in gene expression pattern following granulocyte colony-stimulating factor administration to normal stem cell sibling donors. Acta Haematol 2007; 117 : 68-73.
8. Pulsipher MA, Chitphakdithai P, Logan BR, et al. Donor, recipient, and transplant characteristics as risk factors after unrelated donor PBSC transplantation: beneficial effects of higher CD34+ cell dose. Blood 2009; 114 : 2606-2616.
9. Hölig K, Kramer M, Kroschinsky F, et al. Safety and efficacy of hematopoietic stem cell collection from mobilized peripheral blood unrelated volunteers: 12 years of single-center experience in 3928 donors. Blood 2009; 114 : 3757-3763.
10. Leitner GC, Baumgartner K, Kalhs P, et al. Regeneration, health status and quality of life after rhG-CSF-stimulated stem cell collection in healthy donors: a cross-sectional study. Bone Marrow Transplant 2009; 43 : 357-363.
11. Foeken LM, Green A, Hurley CK, Marry E, Wiegand T, Oudshoorn M. Monitoring the international use of unrelated donors for transplantation: the WMDA annual reports. Bone Marrow Transplant 2010; 45 : 811-818.
12. Lannert H, Able T, Becker S, et al. Optimizing BM harvesting from normal adult donors. Bone Marrow Transplant 2008; 42 : 443-447.
13. Machaczka M, Kalaitzakis E, Eleborg L, Ljungman P, Hägglund H. Comparison of general vs regional anaesthesia for BM harvesting: a retrospective study of anaesthesia-related complications. Bone Marrow Transplant 2010; 45 : 53-61.
14. Pulsipher MA, Chiphakdithai P, Miller JP, et al. Adverse events among 2408 unrelated donors of peripheral blood stem cells: results of prospective trial from the National Marrow Donor Program. Blood 2009; 113 : 3604-3611.
15. Miller JP, Perry EH, Price TH, et al. Recovery and safety profiles of marrow and PBSC donors: experience of the National Marrow Donor Program. Biol Blood Marrow Transplant 2008; 14 : 29-36.
16. Stroncek DF, Holland PV, Bartch G, et al. Experiences of the first 493 unrelated marrow donors in the National Marrow Donor Program. Blood 1993; 81 : 1940-1946.
17. Bredeson C, Leger C, Couban S, et al. An Evaluation of the donor experience in the Canadian multicenter randomized trial of bone marrow versus peripheral blood allografting. Biol Blood Marrow Transplant 2004; 10 : 405-414.
18. Siddiq S, Pamphilon D, Brunskill S, Doree C, Hyde C, Stanworth S. Bone marrow harvest versus peripheral stem cell collection for haematopoietic stem cell donation in healthy donors. The Cochrane Library 2009; 1.
19. Rowley SD, Donaldson G, Lilleby K, Bensinger WI, Appelbaum FR. Experiences of donors enrolled in a randomized study of allogeneic bone marrow or peripheral blood stem cell transplantation. Blood 2001; 97 : 2541-2548.
20. Yuan S, Ziman A, Smeltzer B, Lu Q, Goldfinger D. Moderate and severe adverse events associated with apheresis donations: incidence and risk factors. Transfusion 2010; 50 : 478-486.
21. Anderlini P, Rizzo JD, Nugent ML, Schmitz N, Champlin RE, Horowitz MM. Peripheral blood stem cell donation: an analysis from the International Bone Marrow Transplant Registry (IBMTR) and European Group for Blood and Marrow Transplant (EBMT) databases. Bone Marrow Transplant 2001; 27 : 689-692.
22. Ruesch S, Walter B, Tramer MR. Complications of central venous catheters: internal jugular versus subclavian access – a systematic review. Crit Care Med 2002; 30 : 454-460.
23. Rhodes B, Anderlini P. Allogeneic peripheral blood stem cell collections as of 2008. Transfus Aphes Sci 2008; 38 : 219-227.
24. Falanga A, Marchetti M, Evangelista V, et al. Neutrophil activation and hemostatic changes in healthy donors receiving granulocyte colony-stimulating factor. Blood 1999; 93 : 2506-2514.
25. Kuroiwa M, Okamura T, Kanaji T, Okamura S, Harada M, Niho Y. Effects of granulocyte colony-stimulating factor on the hemostatic system in healthy volunteers. Int J Hematol 1996; 63 : 311-316.
26. Martino M, Console G, Dattola A, et al. Short and long-term safety of lenograstim administration in healthy peripheral haematopoietic progenitor cell donors: a single centre experience. Bone Marrow Transplant 2009; 44 : 163-168.
27. de la Rubia J, de Arriba F, Arbona C, et al. Follow-up of healthy donors receiving granulocyte colony-stimulating factor for peripheral blood progenitor cell mobilization and collection. Results of the Spanish Donor Registry. Haematologica 2008; 93 : 735-740.
28. Tassi C, Tazzari PL, Bonifazi F, et al. Short - and long-term haematological surveillance of healthy donors of allogeneic peripheral haematopoietic progenitors mobilized with G-CSF: a single institution prospective study. Bone Marrow Transplant 2005; 36 : 289-294.
29. Burmeister MA, Standl T, Brauer P, et al. Safety and efficacy of spinal vs general anaesthesia in bone marrow harvesting. Bone Marrow Transplant 1998 : 21 : 1145-1148.
30. Machaczka M, Kalaitzakis E, Eleborg L, et al. Comparison of general vs regional anaesthesia for BM harvesting: a retrospective study of anaesthesia-related complications. Bone Marrow Transplant 2010; 45 : 53-61.
Labels
Haematology Internal medicine Clinical oncology
Article was published inTransfusion and Haematology Today

2011 Issue 3-
All articles in this issue
- Léčebná studie Relapsed AML 2001/01, 02 pro děti s relapsem akutní myeloidní leukemie nebo primárně rezistentní nemocí zlepšila jejich naději na vyléčení
- Úloha alogenní transplantace buněk krvetvorby v léčbě získané aplastické anémie u dětí – zkušenost v České republice v letech 1991–2007
- Nežádoucí reakce při odběru hemopoetických kmenových buněk u nepříbuzných dárců – desetiletá zkušenost Českého národního registru dárců dřeně (ČNRDD)
- Transformace folikulárního lymfomu – výjimka nebo pravidlo? Přehledný článek a vlastní výsledky
- Symptomatický myeloidný sarkóm uteru v čase diagnózy akútnej myeloblastovej leukémie – kazuistika
- Kazuistika závažné pancytopenie s dominující megaloblastovou anémií malnutriční etiologie
- Transfusion and Haematology Today
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Nežádoucí reakce při odběru hemopoetických kmenových buněk u nepříbuzných dárců – desetiletá zkušenost Českého národního registru dárců dřeně (ČNRDD)
- Kazuistika závažné pancytopenie s dominující megaloblastovou anémií malnutriční etiologie
- Transformace folikulárního lymfomu – výjimka nebo pravidlo? Přehledný článek a vlastní výsledky
- Symptomatický myeloidný sarkóm uteru v čase diagnózy akútnej myeloblastovej leukémie – kazuistika
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

