-
Medical journals
- Career
Molekulárně cytogenetická analýza plazmatických buněk u pacientů s mnohočetným myelomem
: J. Balcárková 1; K. Procházková 1; V. Ščudla 2; M. Holzerová 1; J. Bačovský 2; M. Zemanová 2; H. Pospíšilová 1; J. Hanzlíková 1; J. Kropáčková 1; I. Prekopová 1; T. Pika 2; J. Minařík 2; K. Indrák 1; M. Jarošová 1
: Hemato-onkologická klinika FN a LF UP Olomouc 1; III. interní klinika FN a LF UP Olomouc 2
: Transfuze Hematol. dnes,13, 2007, No. 4, p. 176-182.
: Comprehensive Reports, Original Papers, Case Reports
Mnohočetný myelom (MM) je zhoubné B-buněčné onemocnění charakterizované proliferací a akumulací klonálně změněných plazmatických (myelomových) buněk především v kostní dřeni. Přesto, že příčiny vzniku a vývoje MM nejsou zcela jasné, genetické studie ukázaly, že chromozomové aberace hrají v patogenezi a prognóze pacientů s MM klíčovou roli. Práce ukazuje výsledky cytogenetické a molekulárně cytogenetické analýzy souboru 100 pacientů s MM. Pomocí klasického cytogenetického vyšetření byly odhaleny změny u 23 (23 %) pacientů, z toho u 8 pacientů byl nalezen komplexní karyotyp. Doplnění klasické cytogenetiky metodou FICTION odhalilo genetické změny u 97 (97 %) pacientů. Nejčastěji byla pozorována delece RB1 genu nalezená u 53 (53 %) pacientů, translokace zahrnující IgH gen byla zjištěna u 30 (30 %) pacientů a trizomie byly prokázány u 25 (25 %) pacientů. Trizomie postihovaly nejčastěji chromozomy 15 a 9. Cytogenetická a molekulárně cytogenetická analýza souboru 100 pacientů s MM potvrdila vysoký výskyt chromozomových změn a jejich vztah k vyšším stadiím onemocnění. Prognostický význam jednotlivých genetických změn pro celkové přežití zatím nelze hodnotit vzhledem ke krátké době sledování souboru, ale byla prokázána nepříznivá prognóza pacientů s komplexním karyotypem.
Klíčová slova:
mnohočetný myelom, metoda FICTION, delece RB1 genu, přestavby IgH genu, trizomieÚvod
Mnohočetný myelom (MM) je zhoubné onemocnění zralých B-lymfocytů charakterizované akumulací neoplasticky transformovaných plazmatických (myelomových) buněk s převahou v kostní dřeni. Proliferace a akumulace myelomových buněk v kostní dřeni je provázena produkcí monoklonálních imunoglobulinů a mnoha cytokinů, které se podílejí na velké variabilitě onemocnění. V současné době zůstává MM nemocí se širokým spektrem klinických příznaků, odlišných léčebných odpovědí a s různou délkou celkového přežití pacientů.
Plazmatické buňky jsou buňky imunitního systému, které produkují značné množství protilátek. Diferencují se z B lymfocytů, které v germinálním centru podstupují modifikaci DNA imunoglobulinových genů (Ig) cestou somatické hypermutace, antigenové selekce a rekombinací v genech pro těžké řetězce imunoglobulinů (IgH). Buňky postgerminálního centra pak mohou tvořit plazmoblasty, které mají dokončenou somatickou hypermutaci a IgH rekombinaci ještě před migrací do kostní dřeně, kde stromální buňky umožňují terminální diferenciaci do dlouho žijících plazmatických buněk (1).
Akumulace transformovaných plazmoblastů a plazmatických buněk na mnoha místech kostní dřeně necharakterizuje jen MM, ale také monoklonální gamapatii nejistého významu (MGUS), která je považována za benigní onemocnění, ale může transformovat do MM (2). U více než jedné třetiny pacientů dochází k rozvoji MM z MGUS (3).
Téměř u všech pacientů s MM jsou dnes pozorovány chromozomální abnormality, přestože klasická cytogenetická analýza bývá málokdy úspěšná vzhledem k nízkému počtu myelomových buněk v kostní dřeni, jejich nízké mitotické aktivitě a mikroskopicky nehodnotitelné morfologii chromozomů v metafázích. Úspěšná klasická cytogenetická analýza karyotypu bývá spojena s agresivním průběhem nebo pokročilejším stadiem onemocnění a je pozorována až u 40 % pacientů (4, 5).
Pokrok ve studiu chromozomových změn přinesl rozvoj molekulárně cytogenetických metod, zejména fluorescenční in situ hybridizace (FISH) a její kombinace s metodou imunofluorescenční detekce lehkých řetězců monoklonálních imunoglobulinů v cytoplazmě myelomových buněk, kterou označujeme jako metodu FICTION (6). Kombinace těchto metod umožňuje cílenou detekci chromozomových změn v myelomových buňkách (6, 7).
Na základě recentních poznatků, získaných z cytogenetických a molekulárně genetických studií včetně studií exprese genů čipovými technologiemi, se dnes předpokládá existence dvou hlavních patogenetických cest vývoje tohoto onemocnění: jedna je spojena s hyperdiploidií, druhá je charakterizována translokacemi zahrnujícími gen pro těžký řetězec imunoglobulinu (IgH). Hyperdiploidie se vyskytují asi u 50 % pacientů s MM a jsou nejčastěji spojeny s trizomiemi chromozomů 3, 5, 7, 9, 11, 15, 19 a 21, přičemž nebývá pozorována trizomie chromozomu 13 (8). U hyperdiploidních pacientů se méně často vyskytují IgH translokace a delece RB1 genu nebo monozomie chromozomu 13. Trizomie stejných chromozomů se vyskytují i u premaligní MGUS (9).
Translokace zahrnující IgH gen se vyskytují až u 60 % pacientů, přičemž partnerské geny v translokacích nejsou náhodné a zahrnující lokusy: 11q13 (gen pro cyklin D1) v 15 %, 4p16 (geny pro receptor fibroblastového růstového faktoru 3-FGFR3 a MultipleMyeloma Set Domain-MMSET) v 15 %, 16q23 (gen pro c-maf) v 5 % a 6p21 (gen pro cyklin D3) ve 3 % (10). Tyto translokace jsou většinou způsobeny chybami při VDJ rekombinaci (vytvoření jedinečné kombinace subgenů je jedním ze zdrojů variability protilátek) během vyzrávání B buněk v germinálních centrech a vedou k deregulované expresi partnerského genu tím, že partnerský gen je přemístěn do blízkosti zesilovačů transkripce IgH genu (10, 11, 12). Obecně jsou translokace zahrnující IgH lokus na chromozomu 14q32 považovány za nepříznivý prognostický faktor (13). Výjimkou je t(11;14)(q13;q32), která je v poslední době považována za změnu spojenou s příznivou prognózou, zejména u pacientů léčených vysokodávkovanou chemoterapií (14). Delece RB1 genu vyskytující se až u 63 % nemocných (15), bývá spojena se středně příznivou prognózou, pokud se vyskytuje samostatně, výskyt další chromozomové změny, zejména translokace zahrnujících IgH gen, prognózu zhoršuje (14, 16). Hyperdiploidní varianta MM bývá spojena s příznivější prognózou a delší dobou přežití (6).
Cílem předložené práce bylo určit:
- frekvenci a typ chromozomových změn metodou klasické cytogenetické analýzy a metodou FICTION
- vztah mezi námi nalezenými změnami, klinickým stadiem onemocnění a délkou přežívání pacientů s jednotlivými typy změn.
Materiál a metody
Soubor pacientů
Analyzovaný soubor tvořilo 100 pacientů z období let 2003 až 2006, kteří byli sledováni na III. interní klinice FN a LF UP v Olomouci a cytogeneticky vyšetřeni v cytogenetické laboratoři Hemato-onkologické kliniky FN a LF UP v Olomouci. Do souboru byli zařazeni jen pacienti s nově diagnostikovaným onemocněním a jednalo se o 58 mužů a 42 žen ve věku od 44 do 82 let s mediánem věku 61 let. Klinická stadia byla stanovena podle Durie a Salmona. U všech pacientů byla vyšetřena kostní dřen. U pacientů v klinickém stadiu I bylo v kostní dřeni nalezeno 1,2–16 % plazmatických buněk (medián 8 %), u pacientů ve stadiu II 4,4 – 58 % (medián 22 %), u pacientů ve stadiu III 3,6–82 % (medián 31,3 %). Charakteristika souboru pacientů je uvedena v tabulce 1.
1. Klinická charakteristika souboru 100 pacientů s MM. 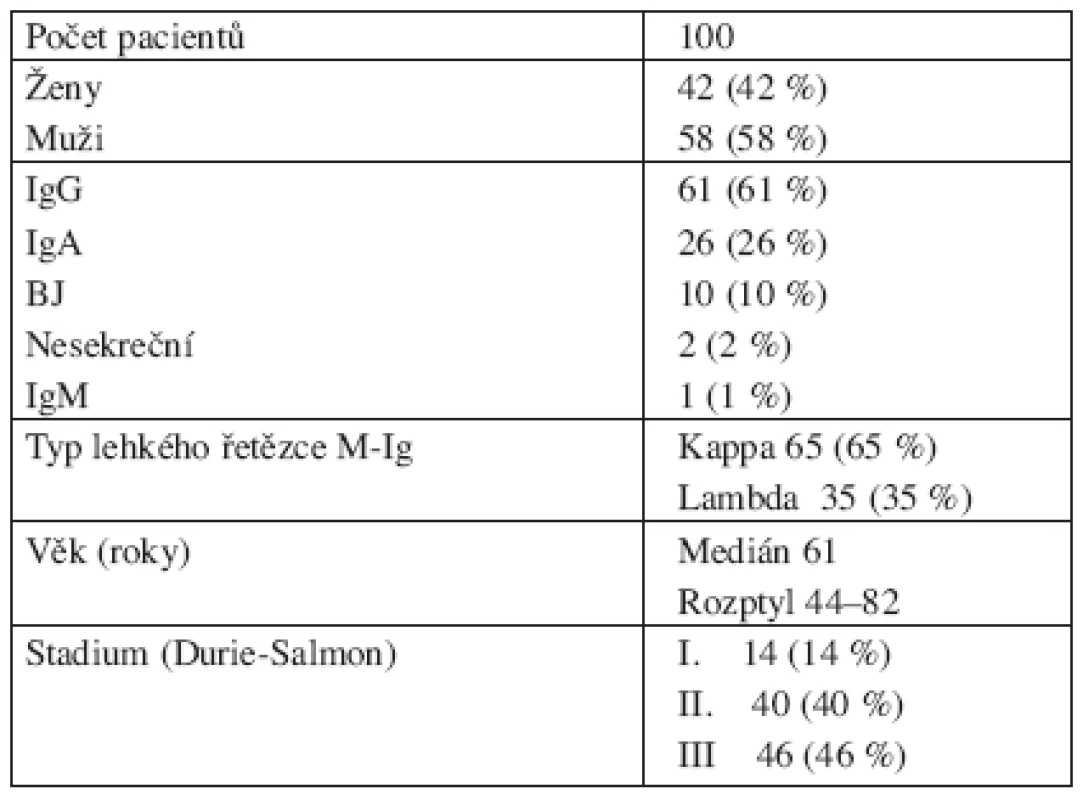
Materiál
Odebrané 2 ml kostní dřeně do RPMI media s 20 % inaktivního bovinního fetálního séra byly rozděleny na 2 poloviny: pro přímé zpracování a pro 24hodinovou kultivaci při teplotě 37 °C v prostředí 5% CO2. Kultury byly dále zpracovány podle standardních cytogenetických postupů (17).
Klasická cytogenetická analýza
Bylo hodnoceno nejméně 20 metafází, z toho 10 karyotypováno. Chromozomy byly hodnoceny podle kritérií ISCN 2005 (18). Za abnormální klon byl označen nález dvou a více metafází se stejnou strukturní abnormalitou nebo se stejnými nadpočetnými chromozomy a nález tří a více metafází s delecí nebo chyběním stejného chromozomu.
Metoda FICTION
Buněčná suspenze kostní dřeně fixovaná v metanol: octové kyselině (3 : 1) byla převedena do fixace 96% etanolu následujícím postupem. Suspenze byla centrifugována, supernatant byl odstraněn, pelet byl převrstven 96% etanolem a následně fixován 15 minut při pokojové teplotě. Suspenze buněk byla znovu centrifugována a byl zopakován postup fixace. Takto upravené suspenze buněk byly nakapány na skla, která byla následně obarvena za účelem rozlišení populace klonálních plazmatických buněk pomocí protilátky proti lehkým řetězcům monoklonálního imunoglobulinu (anti-human kappa nebo lambda chain) konjugované s 7-amino-4-metalkumarin-3-octovou kyselinou (AMCA) (Vector Laboratories Burlingame, CA). Fluorescenční signál byl zesílen protilátkou (anti-goat) konjugovanou s AMCA (Vector Laboratories Burlingame, CA). Preparáty byly následně omyty v PBS pufru (fosfátový balancovaný roztok) a dehydratovány vzestupnou alkoholovou řadou (70 %, 80 %, 90 %, 96 % etanol) (4, 7).
Pro vyšetření metodou FISH byly použity centromerické a genové sondy (Abbot-Vysis Inc. Downers Grove, IL, USA). Pro určení delece v oblasti 13q14, kde je lokalizován RB1 gen, byla použita sonda LSI D13S25 SO (SO = sonda značená fluorochromem SpectrumOrange). Přestavby IgH genu byly vyšetřeny sondou LSI IgH Dual Color, Break Apart Rearrangement a po zjištění přestavby byly pro identifikaci partnerských genů použity následující sondy: LSI IgH/CCND1 Dual Color Dual fusion, IgH/FGFR3 Dual Color Dual Fusion, LSI IgH/MAF Dual Color Dual Fusion. K určení nejčastějších trisomií byly použity centromerické sondy: Cep 7 SO, Cep 9 SG, (SG = sonda značená fluorochromem SpectrumGreen), Cep 11 SG, Cep 15(satelite III) SG a Cep 17 SG.
Hybridizace byla provedena podle návodu výrobce sondy a preparáty byly hybridizovány při 37 °C přes noc. Po omytí skel v sérii mycích roztoků byla suchá skla zamontována do roztoku Antifade (QBiogene, MP Biomedicals, CA) a následně hodnocena pomocí fluorescenčního mikroskopu vybaveného příslušnými fluorescenčními filtry a CCD kamerou a analyzována pomocí softwaru ISIS (MetaSystems Althusheim, Německo). U každého pacienta bylo hodnoceno 50 imunofluorescenčně značených plazmatických buněk. Hraniční hodnota pozitivity použitých sond (cut-off level) byla stanovena na 20 %.
Metoda mnohobarevné FISH (M-FISH)
Metoda M-FISH (18) byla použita pro přesné určení chromozomových změn u nemocných s komplexním karyotypem. Preparáty byly hybridizovány 72 hodin s kitem 24XCyte DNA Probe (MetaSystems Althusheim, Německo) podle návodu výrobce.
Cytogenetická a molekulárně cytogenetická vyšetření byla prováděna na základě vyšetřovacího algoritmu, uvedeného na obrázku 1.
1. Schéma postupu vyšetření kostní dřeně u pacientů s MM. Vysvětlivky k obrázku 1 CG - klasická cytogenetická analýza, FISH - fluorescenční in situ hybridizace M-FISH – Mnohobarevná fluorescenční in situ hybridizace 
Výsledky
Klasická cytogenetická analýza
Klasickou cytogenetickou analýzou pomocí G-pruhování byly odhaleny změny u 23 pacientů (23 %). Hyperdiploidie a polyploidie byly nalezeny u 4 pacientů, komplexní přestavby u 8 pacientů a u 11 pacientů byly zjištěny jiné změny v karyotypu, nejčastěji se jednalo o ztrátu části nebo celého chromozomu. Výsledky klasické cytogenetické analýzy pacientů s komplexními přestavbami jsou uvedeny v tabulce 2. Změny v karyotypu byly nalezeny pouze u pacientů ve stadiu II a III. Normální karyotyp byl nalezen u 48 pacientů (48 %). U 29 pacientů (29 %) nebyla klasická cytogenetická analýza úspěšná. Hodnocení prognostického významu ukázalo nepříznivou prognózu pacientů s komplexním karyotypem, jejichž medián přežívání je 9,5 měsíce. Graf 1 zobrazuje statisticky významný rozdíl v celkovém přežívání souboru pacientů s normálním a komplexním karyotypem.
1. Kaplan-Mayerova křivka přežívání pacientů s normálním a komplexním karyotypem. 
Metoda M-FISH
Výsledky metody M-FISH u pacientů s komplexním karyotypem jsou uvedeny v tabulce 2.
2. Výsledky klasické cytogenetické analýzy a metody M-FISH u pacientů s komplexním karyotypem. 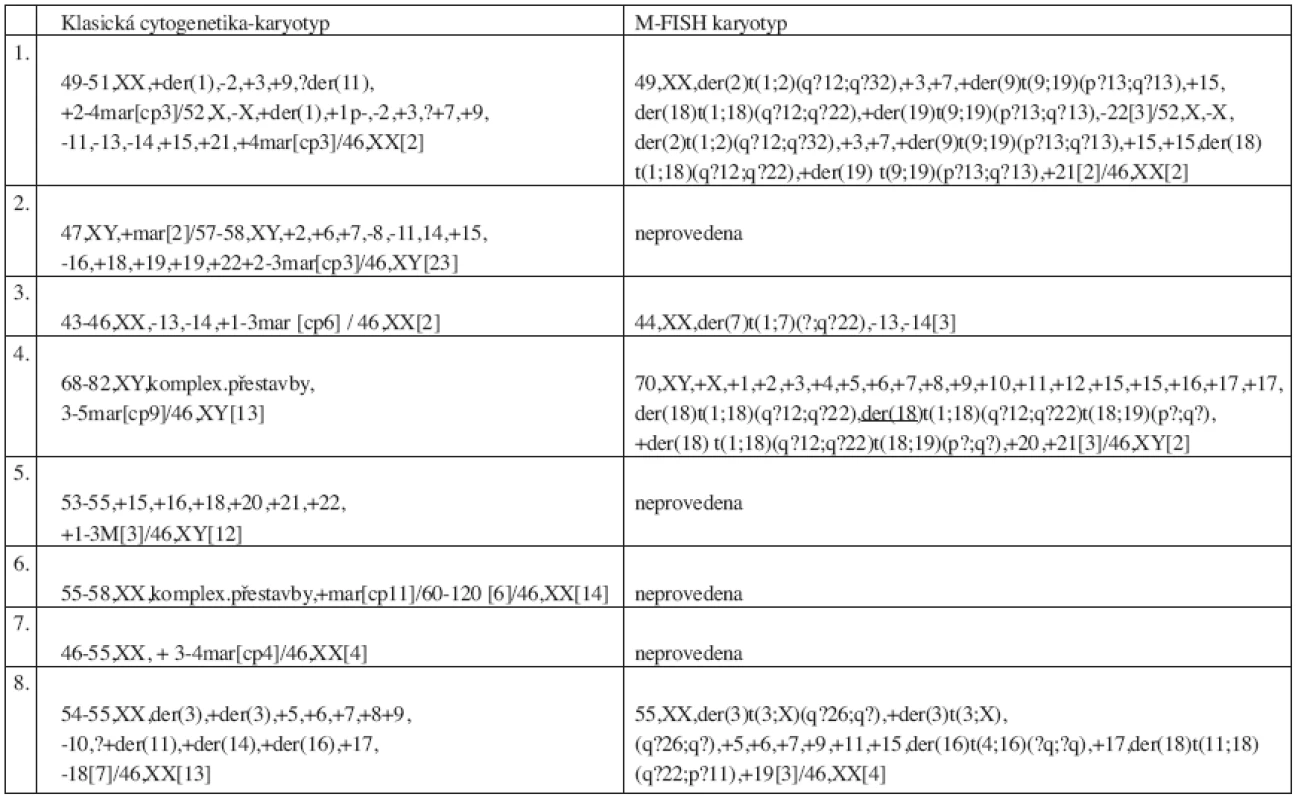
Metoda FICTION
Delece RB1 genu (13q14)
Delece 13q14 byla nalezena u 53 pacientů (53 %). U 18 pacientů byla nalezena tato delece jako samostatná změna. U 16 pacientů byla nalezena delece RB1 genu společně s parciální delecí nebo delecí celé jedné kopie IgH genu. Pacienti s delecemi těchto genů byli ve všech stadiích: ve stadiu III – 7 pacientů, ve stadiu II – 5 a ve stadiu I – 4 pacienti.
U 19 pacientů byla nalezena delece RB1 genu společně s přestavbou nebo s přestavbou a dalšími změnami v IgH genu. Podrobněji se o této skupině pacientů zmíníme v části věnované popisu změn v IgH genu.
Procentuálně byla delece RB1 genu zastoupena v myelomových buňkách v rozmezí 20–100 % (medián 83 %).
Změny IgH genu (14q32)
Změny v IgH genu byly zjištěny u 53 pacientů (53 %). U 18 pacientů byly zjištěny pouze změny v IgH genu a u 35 pacientů byly změny v IgH genu nalezeny současně s delecí RB1 genu. Přestavba IgH genu byla zjištěna u 30 pacientů. U některých pacientů byly nalezeny i další změny v tomto genu, které jsou uvedeny v tabulce 3. Procentuálně byla delece IgH genu zastoupena v myelomových buňkách v rozmezí 20–100 % (medián 83 %).
3. Výsledky metody FICTION se specifickou LSI IGH sondou. 
Pacienti s přestavbou IgH genu byli dále vyšetřováni s cílem identifikovat partnerský gen zahrnutý do translokace. U 13 pacientů byla zjištěna t(11;14), t(4;14) byla nalezena u 12 a t(14;16) u 4 pacientů. U 1 pacienta se nepodařilo partnerský gen určit. Mezi pacienty s t(11;14) byli 4 pacienti, u kterých jsme tuto translokaci nalezli společně s delecí RB1 genu. Tito pacienti byli ve stadiích I–III dle Durie-Salmona. Pacienti s t(4;14) byli převážně ve vyšším stadiu choroby (stadium II – 3 pacienti a stadium III – 8 pacientů a 1 pacient byl ve stadiu I). U 9 ze 12 pacientů byla tato translokace nalezena současně s delecí RB1 genu. U 4 pacientů byla nalezena t(14; 16). Tito pacienti byli ve stadiích III (3 pacienti) a II (1 pacient). U všech byla t(14; 16) nalezena společně s delecí RB1 genu.
U 10 nemocných byly zjištěny parciální delece IgH genu (3ę konce u 7 a 5ę konce u 3 pacientů). U 7 pacientů byla zjištěna parciální delece IgH genu v kombinaci s delecí RB1 genu. Tito pacienti již nebyli dále vyšetřováni. Parciální delece byla zjištěna u pacientů ve všech stadiích MM.
Početní změny IgH genu byly nalezeny u 12 pacientů (12 %). U 10 pacientů byla zjištěna delece celé jedné kopie IgH genu a ve 2 případech byl naopak prokázán výskyt 3 kopií IgH genu. U 9 z 10 pacientů s delecí celé jedné kopie IgH genu byla současně nalezena také delece RB1 genu. Početní změny IgH genu byly nalezeny u pacientů ve všech stadiích MM.
Trisomie
U 28 (28 %) pacientů jsme nenalezli deleci RB1 genu ani změny v IgH genu. Tyto pacienty a další 2 pacienty se 3 kopiemi IgH genu jsme dále vyšetřovali na přítomnost trizomií chromozomů 7, 9, 11, 15 a 17. Alespoň jeden trizomický chromozom jsme nalezli u 25 pacientů. Nejčastěji byly nalezeny trizomie chromozomů 15 a 9, méně často trizomie chromozomů 7, 11 a 17. Nejvíce pacientů mělo trizomii dvou chromozomů. Zastoupení jednotlivých trizomií je vyobrazeno v grafu 2 a 3. U 2 pacientů byla nalezena monozomie jednoho z vyšetřovaných chromozomů (chromozom 15, resp. 17). U 3 pacientů nebyla nalezena trizomie žádného chromozomu a u těchto pacientů se nepodařilo prokázat ani výskyt žádné jiné z vyšetřovaných změn. Z těchto pacientů byli 2 ve stadiu III a 1 ve stadiu II.
2. Zastoupení nejčastějších trizomií chromozomů v souboru 100 pacientů s MM. 
3. Zastoupení počtu chromozomů s trizomií v souboru 100 pacientů s MM. 
Hodnocení chromozomových změn a klinických dat
Nalezené chromozomové změny jsme hodnotili z hlediska stadia onemocnění a typu secernovaného M-Ig. Výsledky ukázaly, že nejvíce změn bylo nalezeno u nemocných ve vyšších stadiích, kdy byly odhaleny i chromozomové změny pomocí klasické cytogenetické analýzy. U pacientů ve stadiu II byly nalezeny změny u 34 (94 %) ze 36 pacientů. U pacientů ve stadiu III byly nalezeny změny u 44 (96 %) ze 46 pacientů. Výsledky ve vztahu ke stadiu choroby jsou shrnuty v tabulce 4. Zastoupení změn podle typu secernovaného M-Ig bylo rovnoměrné. Změny byly nalezeny i u pacienta s IgM typem M-Ig a u pacientů s B-J proteinem a nesekreční formou MM. U pacientů s IgG proteinem byly změny prokázány u 58 (97 %) z 60 pacientů a u jedinců s IgA proteinem byly změny nalezeny u 24 (96 %) z 25 pacientů.
4. Zastoupení studovaných chromozomových změn v jednotlivých stadiích onemocnění MM. 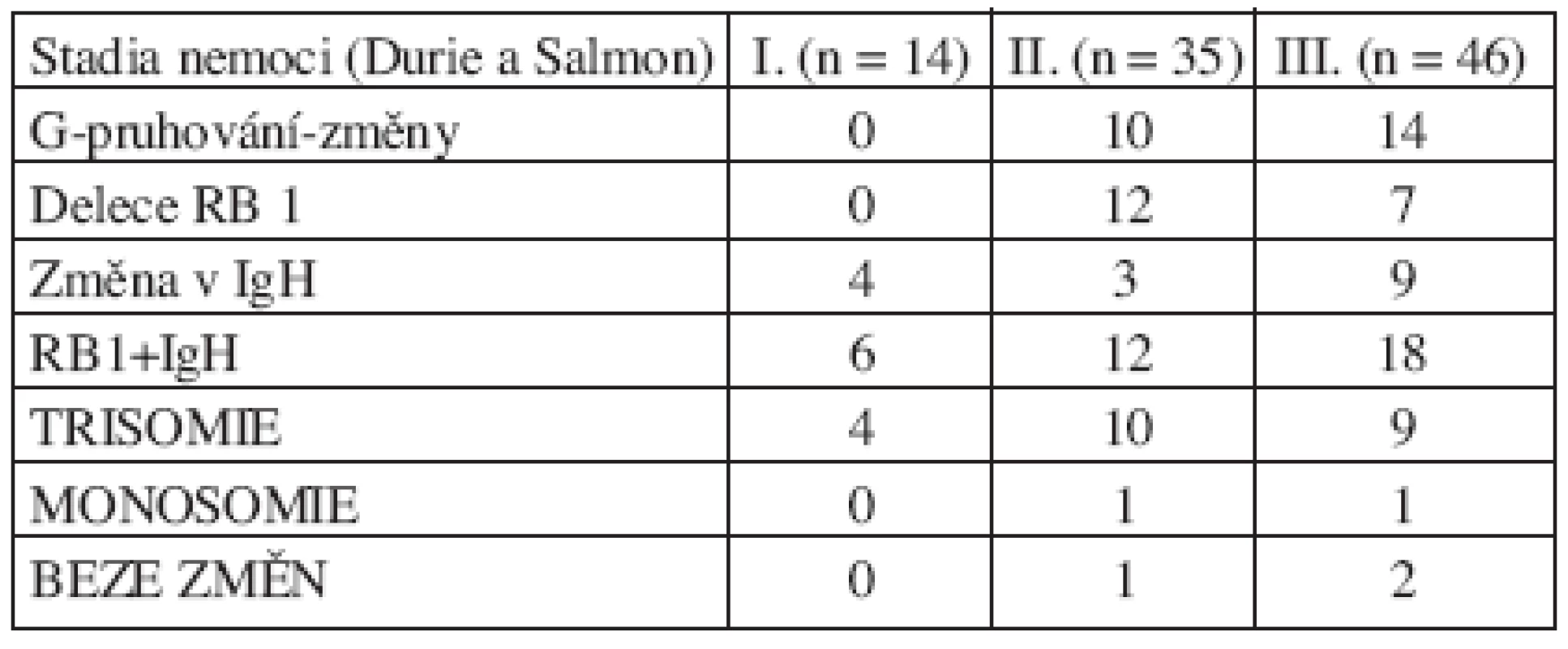
Prognostický význam jednotlivých genetických změn pro celkové přežití zatím hodnotit nelze, vzhledem ke krátké době sledování souboru. Jednoznačně byl potvrzen vysoce prognosticky nepříznivý význam nálezu komplexního karyotypu.
Diskuse
Cytogenetická a molekulárně cytogenetická analýza souboru 100 pacientů s MM odhalila u 97 % nemocných výskyt chromozomových změn. Výsledky uvedené v této práci jsou shodné s výsledky dalších autorů, kteří se věnují studiu chromozomových změn u nemocných s MM (6, 10, 19).
Klasickou cytogenetickou analýzou byly změny nalezeny u 23 % pacientů. Literatura uvádí, že klasickou cytogenetickou analýzou je možné detekovat změny v karyotypu u 30–50 % pacientů s MM (14). Debes-Marun et al. (6) dokonce uvádí úspěšnost klasické cytogenetické analýzy u pacientů s MM ještě nižší a to v rozmezí od 18 do 35 %.
MM patří do skupiny lymfoproliferativních nemocí, u kterých je velmi obtížné získat dostatečný počet kvalitních metafází pro cytogenetickou analýzu pomocí G-pruhování. Pomocí G-pruhování jsou nejvíce detekovatelné aneuploidie, z translokací zahrnujících IgH lokus je možné rozpoznat pouze t(11;14). Ostatní translokace jsou pomocí klasické cytogenetické analýzy nepoznatelné především proto, že zahrnují telomerické oblasti obou partnerských chromozomů (20, 21).
K přesnější analýze cytogenetických změn u pacientů s MM jsme použili FISH v kombinaci s imunofluorescenčním značením myelomových buněk (FICTION). Touto metodou jsme analyzovali výskyt nejčastějších chromozomových změn jen v myelomových buňkách (delece RB1 genu, změny v IgH genu a trizomie).
Delece RB1 genujako samostatná změna byla pozorována u 18 % nemocných, celkově byla metodou FICTION určena delece RB1 v 53 % případů. Tyto nálezy jsou ve shodě s nálezy dalších autorů, kteří určili tuto deleci u 42 % (22) a 38 % pacientů (19). Byl ale pozorován i vyšší výskyt této chromozomové změny, např. nález delece RB1 genu u 63 % pacientů (14). Delece RB1 genu je spojena se středně příznivou prognózou, pokud se vyskytuje samostatně, výskyt další chromozomové změny, zejména translokací zahrnujících IgH gen prognózu zhoršuje (15, 16).
Literatura uvádí, že delece RB1 genu má středně příznivý prognostický význam, pokud se vyskytuje jako samostatná změna. Naopak, nález další změny zhoršuje prognózu pacientů (14, 16). V našem souboru žije 12 z 18 pacientů, u kterých byla nalezena pouze delece RB1 genu a pouze polovina pacientů (8/16), u kterých byla nalezena delece RB1 genu společně s delecí IgH genu.
Protože metoda FICTION dovoluje určit změny přímo v plazmatických buňkách, využili jsme ji i k hodnocení procentuálního zastoupení delece RB1genu v myelomových buňkách. To se pohybovalo v rozmezí mezi 20–100 % s mediánem 83 %. Podobné výsledky hodnocení zastoupení delece RB1 genu v myelomových buňkách uvádí i další autoři (22) a to v rozmezí 34–99 % (medián 82 %).
Další chromozomové změny, které byly cílem našich analýz, byly změny IgH genu. Nejčastější změnou jsou chromozomové translokace, které vedou k deregulaci partnerského genu přemístěného do blízkosti zesilovačů transkripce (11). Do translokace s IgH lokusem vstupuje řada partnerských chromozomů, avšak u MM mezi nejvíce zastoupené partnerské geny patří: CCND1 (11q13), FGFR3 a MMSET (4p16), C-MAF (16q23) a CCND3 (6p21)(22). Obecně jsou tyto translokace zahrnující IgH gen považovány za nepříznivý prognostický faktor (13). Výjimku tvoří t(11;14)(q13;q32), která je v poslední době spojována s příznivou prognózou především u pacientů léčených vysokodávkovanou chemoterapií (15, 16). Translokace t(11;14), jejíž výsledkem je fúze genů IgH/CCND1 byla v našem souboru nalezena u 13 (13 %) pacientů, z toho u 4 pacientů v kombinaci s delecí RB1 genu. Spojení t(11;14) s delecí RB1 je v literatuře udáváno jako málo časté. Uvádí se, že mezi pacienty s delecí nebo monozomií chromozomu 13 je 19 % pacientů s t(11;14) (9). Z 13 pacientů, u kterých byla prokázána t(11;14), žije v době analýzy souboru 10 pacientů. Mezi pacienty s t(11;14) byli 4 pacienti, kteří měli t(11;14) dohromady s delecí RB1 genu, všichni tito pacienti žijí.
Druhou nejčastější translokací je t(4;14), která byla potvrzena lokus specifickou sondou u 12 (12 %) pacientů, u 9 (9 %) pacientů byla také zjištěna přítomnost delece RB1 genu. Koexistence t(4;14) a delece RB1 genu se uvádí téměř u všech pacientů s t(4;14) (3), což souhlasí s nálezem v našem souboru. Dále jsme potvrdili nepříznivou prognózu této translokace: v našem souboru žije jen polovina z 12 pacientů. Poslední studovaná translokace t(14;16) byla nalezena u 4 (4 %) nemocných, ve všech případech s koexistencí delece RB1 genu. Tento nález potvrzuje i studie dalších autorů (7). Výsledky výskytu posledních dvou translokací v našem souboru jsou ve shodě s dalšími pracemi (16), které potvrdily výskyt těchto translokací vždy společně s delecí RB1 genu. U 1 (1 %) pacienta se nám nepodařilo určit partnerský gen zahrnutý v IgH translokaci, avšak přestavba IgH genu metodou FICTION byla nalezena.
U IgH genu jsme neidentifikovali jen přestavby tohoto genu, ale i různě rozsáhlé delece a početní změny. Parciální delece 5ę konce IgH genu byla zjištěna u 3 (3 %) pacientů. Obecně je tato delece považována za fyziologický jev, který může vzniknout během přeskupování subgenů. Parciální delece 3ę konce byla nalezena v 7 (7 %) případech. Význam této delece je stále nejasný (24).
U pacientů, u nichž byl nalezen pouze jeden signál pro IgH gen se může jednat o monozomii chromozomu 14. Tato změna byla nalezena u 10 (10 %) pacientů. Často bývá monozomie chromozomu 14 spojena s monozomií chromozomu 13. Obě monozomie pak bývají asociovány s hypodiploidním MM. Hypodiploidní MM je spojován s monozomiemi více chromozomů a také s kratší dobou přežití. Uvádí se až 28% četnost monozomie chromozomu 14 (6). V našem souboru se u všech pacientů vyskytovala delece celé jedné kopie IgH genu vždy s delecí RB1 genu, z čehož můžeme usuzovat i možný výskyt monozomie obou chromozomů.
U 2 (2 %) pacientů byly nalezeny 3 kopie IgH genu, což může znamenat i trizomii chromozomu 14, jejíž 3% četnost je uváděna v literatuře (6).
Pacienti, u kterých nebyla nalezena změna v IgH genu ani delece RB1 a další 2 pacienti se 3 kopiemi IgH genu, byli dále vyšetřováni na přítomnost trizomií chromozomů 7, 9, 11, 15 a 17. Tyto chromozomy jsou v literatuře nejčastěji považovány za trizomické (9, 23). Jejich trizomie jsou spojovány s hyperdiploidní variantou MM, která je charakterizována množstvím trizomií a nízkým výskytem IgH translokací a delecí RB1 genu (6, 10). Trizomie jsme nalezli u 25 (25 %) pacientů, což je mírně nižší výskyt než v jiných studiích. Další autoři uvádí nález trizomií u 31 % (6) a 39 % pacientů (25). Byl však také pozorován výskyt trizomií téměř u poloviny pacientů (23).
Cytogenetické a molekulárně cytogenetické vyšetření souboru 100 nemocných s MM potvrdilo vysoký výskyt chromozomových změn nalezených u 97 % pacientů. V souboru pacientů byl pozorován vysoký výskyt chromozomových změn zejména ve vyšších stadiích onemocnění. Prognostický význam jednotlivých genetických změn pro celkové přežití zatím nelze hodnotit vzhledem ke krátké době sledování souboru. Jednoznačně byl potvrzen vysoce prognosticky nepříznivý význam komplexního karyotypu.
Výsledky naší cytogenetické a molekulárně cytogenetické analýzy souboru 100 pacientů stále více naznačují, že cytogenetické abnormality u MM by mohly sloužit k bližší charakterizaci jednotlivých subtypů MM a mohly by být využity i při rozhodování o volbě vhodného léčebného postupu zejména při využití nových léků s biologickým účinkem jako je bortezomib nebo talidomid. Pro takové využití jsou nutné další komplexní studie, které by ukázaly jak klinický význam sledování významných prognostických faktorů (26, 27), tak nejnovější data cytogenetických a molekulárně cytogenetických studií, včetně výsledků analýz čipovými technologiemi.
Práce je podporována grantem NR-8183-4, MSM 6198959205
Mgr. Jana Balcárková
Hemato-onkologická klinika LF a FN Olomouc
I. P. Pavlova 6
775 20 Olomouc
e-mail: j.balcarkova@seznam.cz
Sources
1. Kuehl M, Bergsagel PL. Multiple myeloma. Evolving genetic events and host interactions. Nature Reviews 2002; 2 : 175–187.
2. Kyle AR, Therneau TM, Rajkumar V, et al. A long-term study of prognosis in monoclonal gammopathy of undetermined significance. NEJM 2002; 346 : 564–569.
3. Avet-Loiseau H, Facon T, Grosbois B, et al. Oncogenesis of multiple myeloma: 14q32 and 13q chromozomal abnormalities are not randomly distributed, but correlate with natural history, immunological features and clinical presentation. Blood 2002; 99 : 2185–2191.
4. Debes-Marun CS, Dewald GW, Bryant S, et al. Chromozome abnormalities clustering and its implication for pathogenesis and prognosis in multiple myeloma. Leukemia 2003; 17 : 427–36.
5. Ho PJ, Campbell LJ, Gibson J, Brown R, Joshua D. The biology and cytogenetics of multiple myeloma. Rev Clin Exp Hematol 2002; 63 : 276–300.
6. Ahmann GJ, Jalal SM, Juneau AL, et al. A novel three-color, clone-specific fluorescence in situ hybridization procedure for monoclonal gammopathies. Cancer Genet Cytogenet 1998; 101 : 7–11.
7. Fonseca R, Bailey RJ, Ahman GJ, et al. Genomic abnormalities in monoclonal gammopathy of undetermined significance. Blood 2002; 100 : 1417–1424.
8. Bergsagel PL, Kuehl WM. Molecular pathogenesis and a consequent classification of multiple myeloma. J Clin Oncol 2005; 23 : 6333–6338.
9. Fonseca R, Debes-Marun CS, Picken E. The recurrent IgH translocation associated with nonhyperdiploid variant multiple myeloma. Blood 2003; 102 : 2562–2567.
10. Hideshima T, Bergsagel PL, Kuehl MW, Anderson KC. Advantages in biology of multiple myeloma: clinical applications. Blood 2004; 104 : 607–615.
11. Janssen JW, Vaandrager JW, Heuser T, et al. Concurrent activation of a novel putative transforming gene, myeov, and cyclin D1 in a subset of multiple myeloma cell lines with t(1114)(q13q32). Blood 2000; 95 : 2691–2698.
12. Shaugnessy Jr J, Gabrea A, Qi Y, et al. Cyclin D3 at 6p21 is dysregulated by recurrent chromozomal translocations to immunoglobulin loci in multiple myeloma. Blood 2001; 98 : 217–223.
13. Smadja NV, Bastard Ch, Brigaudeau Ch, et al. Hypodiploidy is a major prognostic factor in multiple myeloma. Blood 2001; 98 : 2229–2238.
14. Fonseca R, Blood E, Rue M, et al. Clinical and biological implications of recurrent genomic aberrations in myeloma. Blood 2003; 101 : 4569–4575.
15. Nilsson T, Hoglund M, Turesson I, et al. High frequencies of chromozomal aberrations in multiple myeloma and monoclonal gammopathy of undetermined significance in direct chromozomal preparation. Br J Haematol 2004; 126 : 487–494.
16. Dewald G, Therneau T, Larson D, et al. Relationship of patients survival and chromozome anomalies detected in metaphase and/or interphase cells at diagnosis of myeloma. Blood 2005; 106 : 3553–3558.
17. Jarosova M, Holzerova M, Mihal V, et al. Complex karyotypes in chidhood acute lymphoblastic leukemia: cytogenetic and molecular cytogenetic study of 21 cases. Cancer Genet Cytogenet 2003; 145 : 161–168.
18. Shaffer LG, Tommerup N, Karger S. ISCN: An international system for human cytogenetic nomenclature. Basel 2005.
19. Facon T, Avet-Loiseau H, Guillerm G, et al. Chromozome 13 abnormalities identified by FISH analysis and serum β2 microglobulin produce a powerful myeloma staging system for patients receiving high – dose therapy. Blood 2001; 97 : 1566–15.
20. Finelli P, Fabris S, Zagano S, et al. Detection of t(414)(p16.3q32) chromozomal translocation in multiple myeloma by double color fluorescent in situ hybridization. Blood 1999; 94 : 724–732.
21. Chesi M, Bergsagel PL Shonukan OO, et al. Frequent dysregulation of c-maf protooncogene at 16q23 by translocation to an Ig locus in multiple myeloma. Blood 1998; 91 : 4457–4463.
22. Avet-Loiseau H, Daviet A, Saunier S, et al. Chromozome 13 abnormalities in multiple myeloma are mostly monosomy 13. Br J Haematol 2000; 111 : 116–1117.
23. Bergsagel P, Kuehl M, Zhan F, et al. Cyclin D dysregulation: an early and unifying pathogenic event in multiple myeloma. Blood 2005; 106 : 296–303.
24. Wlodarska I, Matthews EV, Pospisilova H, et al. Telomeric IgH losses detectable by fluorescence in situ hybridization in chronic lymphocytic leukemia reflect somatic VH recombination events. J Mol Diagnostics 2007; 9 : 47–54.
25. Nilsson T, Lenhoff S, Rylander L. A pooled analysis of karyotypic patterns, breakpoints and imbalances in 783 cytogenetically abnormal multiple myelomas reveals frequently involved chromozome segments as well as significant age - and sex-related differences. Br J Haematol 2003; 120 : 960–969.
26. Ščudla V, Adam Z. pohled na diagnostiku a prognostické faktory u mnohočetného myelomu. Transfuze a hematologie dnes, 2005; 11(Suppl 2): 24–26.
27. Ščudla V, Pika T, Budíková M, Ordeltová M, Minařík J, Zemanová M, Bačovský J, Srovnalík K. Česká myelomová skupina. Příspěvek k hodnocení vztahu angiogenních cytokinů a vybraných biologických ukazatelů k prognostickým faktorům mnohočetného myelomu. Čas Lék čes 2006; 45 : 929–935.
Labels
Haematology Internal medicine Clinical oncology
Article was published inTransfusion and Haematology Today

2007 Issue 4-
All articles in this issue
- Molecular cytogenic analysis of plasma cells in patients with multiple myeloma
- Platelet tests – concise overview
- Steroid-refractory acute graft-versus-host disease (GVHD)
- The impact of the various blood collection methods and the leukodepletion on the quality of the cryopreserved red blood cells
- Rituximab immunotherapy combined with dexamethasone followed by 90Y-ibritumomab tiuxetan radioimmunotherapy in pretreated patients with relapsed follicular lymphoma
- Transfusion and Haematology Today
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Steroid-refractory acute graft-versus-host disease (GVHD)
- Platelet tests – concise overview
- The impact of the various blood collection methods and the leukodepletion on the quality of the cryopreserved red blood cells
- Molecular cytogenic analysis of plasma cells in patients with multiple myeloma
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

