-
Medical journals
- Career
Intrahepatálna cholestáza gravidných – vybrané perinatologické ukazovatele
: P. Kaščák; M. Hlaváčik; M. Korbeľ
: Gynekologicko-pôrodnícka klinika, FN Trenčín, I. gynekologicko-pôrodnícka klinika, LF UK a FNsP Bratislava
: Prakt Gyn 2010; 14(1): 36-41
: Original Article
Cieľ štúdie:
Porovnanie manažmentu, liečby a perinatálnych výsledkov pacientiek s intrahepatálnou cholestázou gravidných (ICP) pred zavedením kyseliny ursodeoxycholovej (UDCA) do liečby a po ňom v intermediárnom centre NsP Trenčín. Klinický súbor a metodika: Retrospektívna analýza 79 pôrodov žien s ICP v rokoch 1992 – 1996, kedy pacientky neboli liečené UDCA (skupina 1) a v rokoch 1997 – 2004, kedy bola UDCA v dávke 500 – 750 mg denne per os liekom prvej voľby (skupina 2). Diagnóza ICP bola stanovená na základe prítomnosti pruritu a podporená eleváciou hladiny ALT alebo ALP. Analyzovaný bol týždeň záchytu ochorenia, pôrodu, pôrodná hmotnosť novorodenca, Apgarovej skóre v 1. a 5. minúte, hladina ALT a bilirubínu v čase stanovenia diagnózy a počas pôrodu, spôsob pôrodu a výskyt viacplodovej tehotnosti u postihnutých žien. Výsledky: Frekvencia ICP bola rovnaká v oboch skupinách. Liečba UDCA signifikantne znižovala hladiny ALT (p = 0,013), bilirubínu (p = 0,008), zlepšila subjektívny stav postihnutých žien, predĺžila sa tehotnosť, zvýšila pôrodná hmotnosť novorodencov (p = 0,005) a znížila frekvenciu cisárskeho rezu. V žiadnej skupine žien s ICP nebol zaznamenaný zvýšený výskyt vrodených vývojových chýb a nežiadúcich účinkov liečby. Záver: UDCA možno považovať za bezpečný liek prvej voľby u žien s ICP s pozitívnym vplyvom na subjektívne ťažkosti matky a niektoré perinatologické ukazovatele.Kľúčové slová:
intrahepatálna cholestáza gravidných – ursodeoxycholová kyselina – tehotnosťÚvod
Po vírusových hepatitídach druhou najčastejšou príčinou žltačky u tehotných je intrahepatálna cholestáza gravidných (ICP). Ochorenie zvyčajne začína v III., zriedkavo už v II. trimestri tehotnosti. Typickým príznakom je svrbenie kože. Niektoré prípady sa manifestujú až krátko pred pôrodom. Mnohé ľahšie formy sa pravdepodobne nezistia vôbec [1–2]. Diagnózu ICP možno postaviť po vylúčení iných príčin vzniku pruritu, ikteru, prípadne zvýšených hladín hepatálnych enzýmov v tehotnosti, pretože neexistuje špecifický test na jej odhalenie. ICP sa všeobecne považuje za benígne ochorenie s dobrou prognózou pre matku, i keď ťažkosti pacientky počas gravidity bývajú často veľmi výrazné [3–5]. Perinatálna morbidita i mortalita sú však signifikantne zvýšené. Akútna anoxia plodu je výraznou hrozbou, pretože nekoreluje so stupňom postihnutia ženy a je ťažko predvídateľná konvenčným antepartálnym monitorovaním [6]. Nedávno boli publikované dva kazuistické prípady pacientiek s ICP, kde napriek adekvátnej liečbe a monitoringu došlo k intrauterinnému odumretiu dieťaťa [7]. Nezistená a neliečená ICP môže byť príčinou až polovice nevyjasnených intrauterinných odumretí plodov vo Veľkej Británii [8].
Najčastejšie používanými preparátmi v liečbe ICP sú S-adenosyl-L-methionín (SAMe) a ursodeoxycholová kyselina (UDCA). Nevýhodou liečby SAMe je limitovaná účinnosť na ľahké formy ICP a dlhodobé parenterálne podávanie. Perorálna liečba je považovaná za neúčinnú [9]. Zatiaľ najvyššiu účinnosť v liečbe pacientiek s ICP má UDCA, a to bez nežiadúcich účinkov na matku a plod. UDCA normalizuje, resp. znižuje hladiny hepatálnych enzýmov, priaznivo ovplyvňuje subjektívne ťažkosti pacientky a znižuje riziko postihnutia plodu. Znižuje hladiny žlčových kyselín v pupočníkovej krvi, plodovej vode i v kolostre [10–14]. UDCA chráni kardiomyocyty pred arytmiou spôsobenou zvýšenými hladinami žlčových kyselín [15].
Aj keď je liečba ICP relatívne účinná a vedie k zníženiu rizika intrauterinnej smrti plodu, nemala by sa u postihnutých žien pripustiť postmaturita. Vzhľadom k riziku postihnutia plodu je odporúčané prísne monitorovanie plodu a funkcie fetoplacentárnej jednotky, ktoré ale nemusí signalizovať ohrozenie plodu [16]. Po dosiahnutí pľúcnej zrelosti sa preto niektorí autori prikláňajú k indukciu pôrodu [4,17–18]. Pôrod by mal byť indukovaný v 38.–39. týždni tehotnosti [4,18].
Materiál a metodika
Retrospektívne bola analyzovaná populácia žien s diagnózou ICP v dvoch časových obdobiach. Rozčlenenie súboru bolo limitované modernými možnosťami sledovania intrauterinného stavu plodu, ktoré sa stali dostupnými v Trenčíne od roku 1992 a zavedením UDCA do liečby ICP v roku 1997.
V skupine 1 (bez liečby UDCA) boli pacientky liečené hepatoprotektívami, diétnymi a režimovými opatreniami, antihistaminikami (obdobie rokov 1992–1996).
V skupine 2 boli pacientky liečené UDCA – hepatoprotektíva a antihistaminiká neboli podávané (obdobie rokov 1997–2004). UDCA bola podávaná v dávke 500–750mg denne per os podľa hmotnosti pacientky a odozvy na liečbu. Vyššia dávka ako 750mg denne nebola aplikovaná u žiadnej pacientky.
Diagnózu ICP stanovoval hepatológ. Za hodnotiace kritérium ochorenia bola považovaná prítomnosť pruritu podporená eleváciou hladiny alanín aminotransferázy (ALT) alebo alkalickej fosfatázy (ALP). V sledovanom časovom období nebolo možné u nás vyšetrovať sérové hladiny žlčových kyselín. Do súboru boli zaradené len ženy s aktívnou liečbou ICP a kontrolovanými hladinami hepatálnych enzýmov. Do súboru neboli zaradené pacientky, u ktorých mohla byť suponovaná ICP, ale porodili bez diagnostického a liečebného procesu. Všetky pacientky boli vyšetrené gastroenterológom, resp. hepatológom a u väčšiny z nich bolo realizované ultrazvukové vyšetrenie heparu a cholecysty. Takisto bola vykonaná diferenciálna diagnostika prípadných iných ochorení so zvýšeným ALT. U žiadnej ženy nebola dokázaná vírusová hepatitída. Pacientky boli poučené hepatológom i pôrodníkom o povahe a prognóze ochorenia. Z biochemických parametrov bola sledovaná hladina ALT a bilirubínu na prístrojoch firmy Abbott v čase diagnostikovania ochorenia a v čase pôrodu. Intervaly krvných odberov na jednotlivé vyšetrenia hepatálnych enzýmov, ale i ostatných sledovaných parametrov u postihnutých žien boli vždy individuálne prispôsobené dynamike ochorenia. Stav plodu všetkých tehotných bol intenzívne sledovaný pomocou ultrazvukového vyšetrenia (Toshiba – Sonolayer-U-SAL-38D s 3,75 MHz konvexnou abdominálnou sondou a ATL-HDI 3 500 s multifrekvenčnou konvexnou abdominálnou sondou), vo vyšších gestačných týždňoch i kardiotokografickým vyšetrením (CTG) podľa kritérií FIGO z roku 1986 prístrojmi firmy Hewlett Packard a Philips – series 50A a sledovaním prietoku krvi v umbilikálnej artérii, prípadne v ďalších cievach plodu. Predčasný pôrod bol hodnotený podľa kritérií Svetovej zdravotníckej organizácie ako pôrod pred ukončeným 37. gestačným týždňom.
V oboch skupinách bol analyzovaný týždeň záchytu ochorenia, týždeň pôrodu, pôrodná hmotnosť novorodenca, Apgarovej skóre (AS) v 1. a 5. minúte, hladina ALT v čase stanovenia diagnózy a počas pôrodu, hladina bilirubínu v čase stanovenia diagnózy a počas pôrodu, spôsob pôrodu a výskyt viacplodovej tehotnosti u postihnutých žien.
V súbore sa pracovalo vždy s celou populáciou žien postihnutých ICP, preto bolo potrebné z matematického hľadiska vykonať tzv. cenzus a populáciu spracovať vo vyjadrení percentuálnom s analýzou priemeru, mediánu a štandardnej odchýlky. Každý rozdiel v uvedených výsledkoch je potom považovaný za významný. To platí aj v prípade porovnania spôsobu pôrodu žien s ICP s celkovým vývojom incidencie cisárskeho rezu a porovnania výskytu ICP u gemín s celkovou incidenciou gemín v sledovanom období v našej nemocnici. Súbor bol podrobený i štatistickej analýze významnosti vzťahu dvoch kategorických premenných chí-kvadrát testom nezávislosti. Vzťah medzi číselnou a kategorickou premennou bol analyzovaný testom ANOVA.
Výsledky
Retrospektívny súbor pacientiek s ICP v sledovanom časovom období zahŕňa spolu 79 gravidít, u ktorých bola stanovená diagnóza ICP. V 1. skupine bolo analyzovaných 36 gravidít v časovom období rokov 1992–1996 a v 2. skupine 43 gravidít v časovom období rokov 1997–2004. V prvej skupine sa gemini vyskytli 3× a v druhej skupine 2×. Základné charakteristiky súboru v zmysle výskytu ochorenia a výskytu viacplodovej tehotnosti sú uvedené v tab. 1.
1. Charakteristika súboru s ICP. 
Tab. 2 zobrazuje týždeň tehotnosti v čase diagnostiky ochorenia. Do roku 1996 bola ICP diagnostikovaná priemerne v 35. týždni tehotnosti, od roku 1997 to bolo o 2 týždne skôr – v 33. týždni.
2. Týždeň tehotnosti v čase diagnózy ICP. 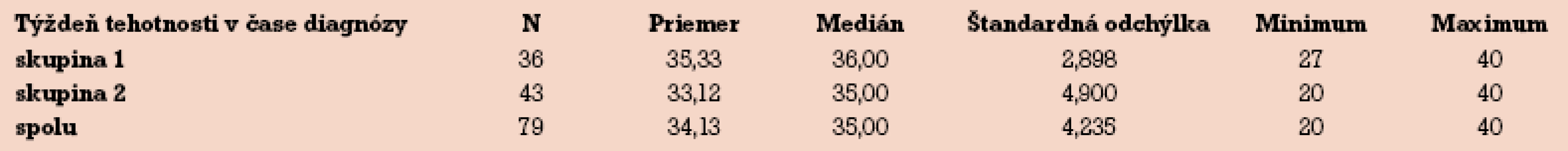
Tab. 3 zobrazuje týždeň tehotnosti v čase pôrodu. V prvom aj druhom období bola gravidita v priemere ukončovaná v 39. gestačnom týždni s rozdielom len niekoľkých dní. Medián pôrodu je však o týždeň vyšší v druhej skupine analyzovaného súboru.
3. Týždeň tehotnosti v čase pôrodu. 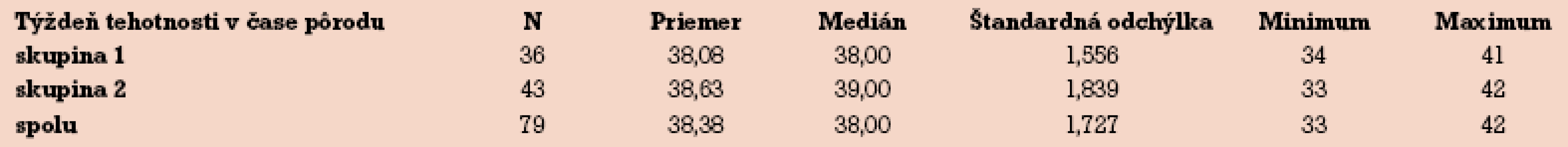
Hmotnosť plodu pri narodení je uvedená v tab. 4. Kým do roku 1996 bola priemerná hmotnosť novorodenca približne 3 000g, od roku 1997 sa zvýšila o viac ako 300g. Rozdiel je ešte výraznejší v prípade mediánu.
Priemerné Apgarovej skóre (AS) v 1. minúte bolo do r. 1996 o 0,57 bodu nižšie ako v skupine od r. 1997. V 5. minúte bol rozdiel v AS už menší – len 0,23 bodu (tab. 5).
5. Apgarovej skóre v 1. a 5. minúte. 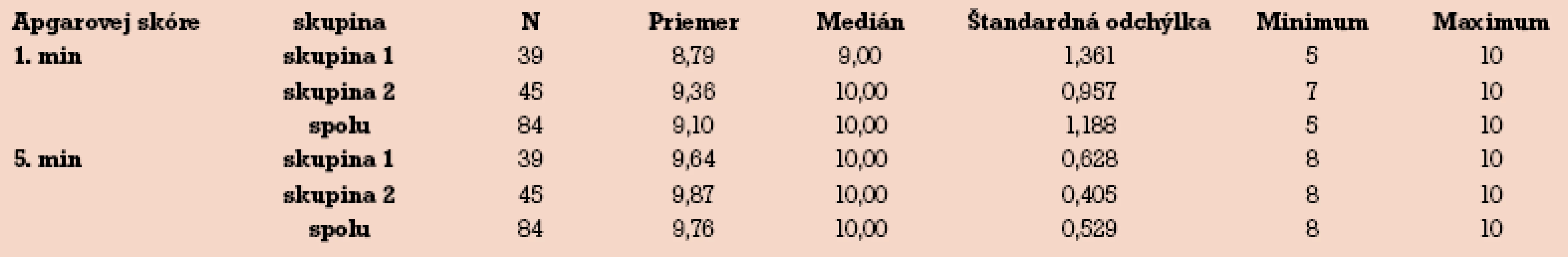
Priemerné hodnoty ALT v čase stanovenia diagnózy ICP v súbore neliečenom UDCA boli 2,5 µkat/l. V súbore liečenom UDCA boli podstatne vyššie – v priemere 4,2 µkat/l. V prípade mediánu rozdiel nie je natoľko významný (tab. 6).
6. ALT v čase stanovenia diagnózy. 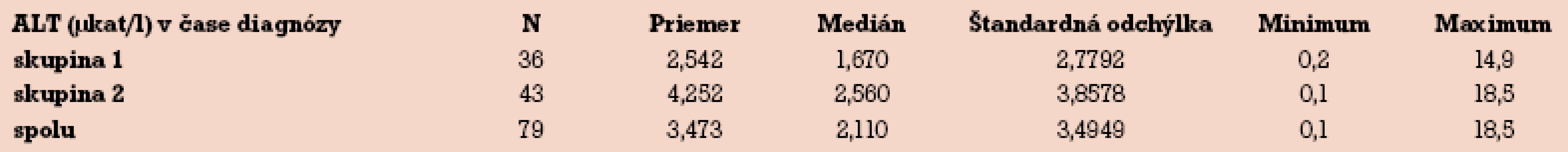
Priemerné hodnoty ALT v čase pôrodu v skupine neliečenej UDCA boli okolo 4 µkat/l. V skupine liečenej UDCA nedosahovalo ALT v priemere ani polovičnú hodnotu (1,8 µkat/l). Rovnaká situácia platí aj pre medián hladín ALT (tab. 7).
Dynamika ALT (graf 1) v skupine neliečenej UDCA vykazovala progresívne zvyšovanie od diagnózy k pôrodu, zatiaľ čo v skupine liečenej UDCA sa hladiny ALT od stanovenia diagnózy k pôrodu progresívne znižovali.
1. Zmena hladín ALT (μkat/l) od stanovenia diagnózy po pôrod. 
V skupine neliečenej UDCA sú priemerné hodnoty bilirubínu v čase stanovenia diagnózy ICP nižšie ako v skupine liečenej UDCA. V čase pôrodu sú hladiny bilirubínu v oboch skupinách v opačnom pomere. Kým pri liečbe hepatoprotektívami hladina bilirubínu k pôrodu stúpa, v skupine liečenej UDCA hladina bilirubínu v čase pôrodu výrazne klesá (tab. 8).
8. Hladina bilirubínu v čase diagnózy a v čase pôrodu. 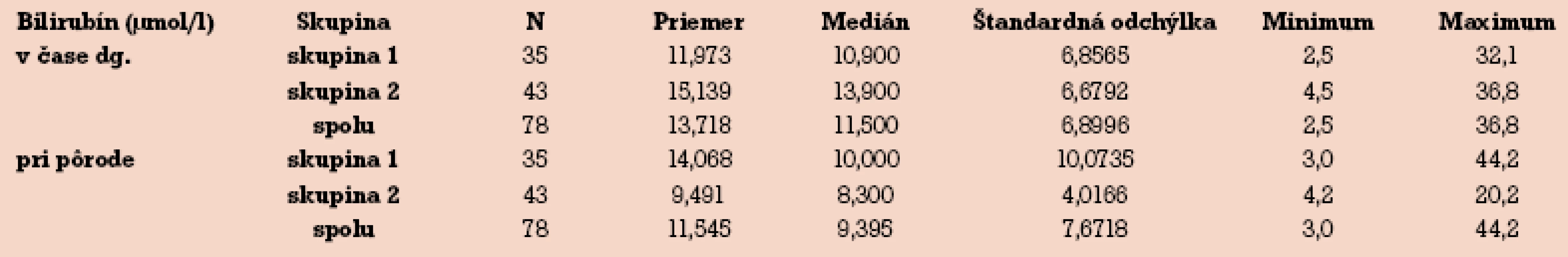
V skupine liečenej hepatoprotektívami bolo 50% pôrodov vedených spontánne, v skupine liečenej UDCA to bolo len 37% (tab. 9). V tejto skupine však stúpla frekvencia indukovaných pôrodov na 35% oproti 25% v skupine neliečenej UDCA. Významný je takmer štvornásobný pokles frekvencie cisárskeho rezu v skupine liečenej UDCA (2,3%) oproti liečenej hepatoprotektívami (8,3%). Naproti tomu však stúpa frekvencia cisárskeho rezu v skupine liečenej UDCA z inej indikácie ako je ICP takmer o 9 percent oproti skupine neliečenej UDCA. Kým frekvencia cisárskeho rezu v sledovanom období vo všeobecnej populácii stúpla o 6% (z 8% na 14%), u žien s ICP bol tento vzostup len o 3% (z 25% na 28%). Frekvencia predčasného pôrodu je podľa očakávania vyššia o 7% v skupine žien neliečených UDCA (27,8%) oproti skupine liečených UDCA (20,9%).
Diskusia
Frekvencia ICP v našom súbore je identická s literárnymi údajmi pre strednú Európu. V zhode s literárnymi údajmi sa v našom súbore vyskytuje takmer 6× častejšie viacplodová tehotnosť v porovnaní s celou populáciou rodiacich žien v uvedenom časovom období [4,6,19].
Očakávali sme približne rovnaký týždeň záchytu ochorenia. Zistili sme však štatistickú významnosť v týždni diagnostiky ochorenia (p = 0,019). Pri analýze (tab. 2) je zrejmé, že i keď priemer záchytu ICP sa líši až o dva týždne, je ovplyvnený extrémnymi hodnotami záchytu v 2. skupine. O skoršom záchyte, a teda možnej lepšej informovanosti a skoršom odoslaní pacientky k diagnostike a liečbe však svedčí medián, kedy boli pacientky v druhej skupine diagnostikované o týždeň skôr. Možným vysvetlením je zlepšené povedomie o ochorení v primárnej gynekologickej starostlivosti nášho regiónu. Pacientky s pruritom bez kožných eflorescencií sú už odoslané priamo k hepatológovi alebo na konziliárnu ambulanciu oddelenia.
Pri adekvátnom sledovaní plodu je nižšie riziko ohrozenia dieťaťa a gravidita môže často pokračovať do vyšších gestačných týždňov [20]. Pri ukončovaní tehotnosti (tab. 3) sme očakávali rozdiely, lebo úspešná liečba pomocou UDCA vedie k ústupu subjektívnych ťažkostí a objektívnemu poklesu hodnôt pečeňových testov. Nami predpokladané pokračovanie do vyšších gestačných týždňov sa tak naplnilo – priemer i medián pôrodu sú v skupine 2 vyššie (rozdiel je však štatisticky nevýznamný – p = 0,164). Niektoré ženy pri dobrom subjektívnom stave, zlepšených laboratórnych parametroch a ambulantnom manažmente sa k odporučenej indukcii pôrodu nedostavili a rodili aj po vypočítanom termíne. Vzhľadom na súčasné odporučené postupy rôznych spoločností [18,21–22] sa snažíme prenášaniu v posledných rokoch vyhnúť.
Naše výsledky, v zhode s literárnymi údajmi [15,20,23], jednoznačne potvrdzujú priaznivé ovplyvnenie hmotnosti plodu liečbou UDCA (tab. 4).
Adekvátnym manažmentom pacientiek s ICP sa dajú dosiahnuť výsledky porovnateľné so všeobecnou populáciou [15,24]. Potvrdili to aj naše výsledky – rozdiely v Apgarovej skóre v 1. a 5. minúte boli nevýznamné a žiadne dieťa nezomrelo ani intrauterine, ani do 7 dní.
Hodnota ALT informuje o ochorení len nepriamo, nie vždy musí byť zvýšená. V diagnostike ICP v minulosti hralo u nás stanovenie ALT významnú úlohu. Moderným diagnostickým testom je stanovenie hladiny žlčových kyselín, ktoré je dostupné v Trenčíne až od roku 2009. Náš predpoklad štatistickej nevýznamnosti ALT v čase stanovenia diagnózy ICP sa nepotvrdil (tab. 6). Priemer, medián i vypočítané p = 0,029 sú významné, ALT bolo výrazne vyššie v 2. skupine. Hodnota minimálnych, maximálnych hodnôt a mediánu sú však v zhode s literárnymi údajmi [4,25].
ALT v čase pôrodu je jeden z najdôležitejších hodnotených parametrov. Na rozdiel od skupiny 1, kde pri liečbe hepatoprotektívami väčšinou dochádza k vzostupu ALT, pri liečbe UDCA hladina ALT podľa literárnych údajov klesá [20,25–26]. Náš predpoklad výrazného ovplyvnenia ALT liečbou UDCA sa v zhode s literárnymi údajmi potvrdil. Hodnoty priemeru, mediánu i p = 0,013 sú štatisticky významné. Na rozdiel od skupiny 1, kedy napriek liečbe hepatoprotektívami dochádzalo k vzostupu ALT, v skupine 2 zavedením UDCA do liečby ALT klesalo (tab. 7, graf 1).
Hladina bilirubínu nie je vhodným markerom k diagnostike a sledovaniu účinnosti liečby ICP. V našom súbore sú pre bilirubín matematické rozdiely priemeru a mediánu významné, v čase diagnózy je hladina p = 0,043 a v čase pôrodu je p = 0,008 (tab. 8). Väčšina hodnôt bilirubínu v súbore však spadá do fyziologického rozmedzia normálnych hodnôt zdravej populácie. Nami zistený rozdiel nie je z biologického hľadiska významný a dôležitý. Podobne ako v prípade ALT liečba UDCA znižovala hladiny bilirubínu v 2. skupine pacientiek na rozdiel od 1. skupiny, kde priemerné hodnoty stúpali. Zvýšené hladiny bilirubínu v našom súbore sú nižšie ako udáva literatúra. Ovplyvnenie hodnôt liečbou UDCA je však v zhode s publikovanými údajmi [20,25–26].
V skupine 2 sme očakávali viac indukovaných pôrodov, lebo jedným z parametrov zmeny manažmentu v starostlivosti o ženu s ICP je plánovaná indukcia pôrodu. V skupine 1 sme očakávali viac cisárskych rezov, hlavne z indikácie samotnej ICP. V skupine 2, liečenej UDCA, by hypoteticky pri vhodnej indukcii pôrodu malo dôjsť napriek všeobecnému vzostupu frekvencie cisárskeho rezu v populácii k jeho poklesu (tab. 9). Aj keď hladina p = 0,321 nie je štatisticky významná, z hľadiska populácie je zrejmé, že prístup k pôrodu u pacientiek skupiny 1 a 2 sa zmenil. V zhode s literatúrou [4,18,27] je indukcia v skupine 2 častejšia o 10% a napriek vzostupu cisárskeho rezu vo všeobecnej populácii ostáva percento sekcií v oboch skupinách stabilné. Pri bližšej analýze je samotná ICP indikáciou k cisárskemu rezu len v 2% v skupine 2, kým v predchádzajúcom časovom období malo až 8% žien ako jedinú indikáciu k sekcii ICP. Je teda zrejmé, že zavedením UDCA do liečby došlo k priaznivému ovplyvneniu spôsobu ukončenia tehotnosti u pacientiek s ICP. Potvrdilo sa ale, že tehotná s ICP má vyššiu pravdepodobnosť ukončenia tehotnosti cisárskym rezom, resp. že pôrod bude indukovaný.
Podľa literárnych údajov je u žien s ICP vyšší výskyt predčasného pôrodu. Liečba UDCA v našom súbore v zhode s literatúrou [15,20] priaznivo ovplyvnila tento sledovaný parameter. Štatistická významnosť však dosiahnutá nebola (p = 0,478). ICP je napriek liečbe významným faktorom, ktorý naďalej zvyšuje pravdepodobnosť predčasného pôrodu u postihnutej tehotnej ženy. Frekvencia predčasného pôrodu v rôznych štúdiách je síce rozdielna, ale vždy vyššia ako vo všeobecnej populácii [23,28–29]. Aj v našom súbore žien s ICP bol výskyt 4× vyšší, ako bola celková frekvencia predčasného pôrodu v nemocnici.
Záver
Manažment pacientky s ICP sa výrazne zmenil zavedením UDCA do liečby, ktorú považujeme za liek prvej voľby. Liečba UDCA znižovala hladiny ALT a bilirubínu, zlepšovala subjektívny stav postihnutých žien a bola veľmi dobre tolerovaná. Nevyskytli sa žiadne závažné vedľajšie účinky a liek nemusel byť nikdy vysadený. Došlo k priaznivému ovplyvneniu spôsobu ukončenia tehotnosti (častejšia indukcia) a stavu plodu v zmysle predĺženia tehotnosti a vyššej pôrodnej hmotnosti detí matiek liečených UDCA. Frekvencia ochorenia bola rovnaká v oboch skupinách postihnutých žien.
MUDr. Peter Kaščák1
MUDr. Martin Hlaváčik1
doc. MUDr. Miroslav Korbeľ, CSc.2
1 Gynekologicko-pôrodnícka klinika,
FN Trenčín
2 I. gynekologicko-pôrodnícka klinika,
LF UK a FNsP Bratislava
pkascak@gmail.com
Sources
1. Milkiewicz P, Elias E, Williamson C et al. Obstetric cholestasis. Br Med J 2002; 324(7330): 123 – 124.
2. Kupčová V, Turecký L, Plank K. Intrahepatálna cholestáza gravidných a liečba kyselinou ursodeochycholovou – predbežné výsledky. Prakt Gynek 2008; 15(4): 187 – 194.
3. Reyes H. The enigma of intrahepatic cholestasis of pregnancy: lesons from Chile. Hepatology 1982; 2(1): 87 – 96.
4. Palmer DG, Eads J. Intrahepatic cholestasis of pregnancy: a critical review. J Perinat Neonatal Nurs 2000; 14(1): 39 – 51.
5. Kondrackiene J, Kupcinskas L. Intrahepatic cholestasis of pregnancy – current achievements and unsolved problems. World J Gastroenterol 2008; 14(38): 5781 – 5788.
6. Williamson C, Hems LM, Goulis DG et al. Clinical outcome in a series of cases of obstetric cholestasis identified via a patient support group. Br J Obstet Gynaecol 2004; 111(7): 676 – 681.
7. Lee RH, Incerpi MH, Miller DA et al. Sudden fetal death in intrahepatic cholestasis of pregnancy. Obstet Gynecol 2009; 113(2 Pt 2): 528 – 531.
8. Scheuer P, Chambers J, Rogers A. Intrahepatic cholestasis of pregnancy. Br Med J 1995; 310(6974): 260.
9. Binder T, Salaj P, Zima T et al. Kyselina ursodeoxycholová, S - adenosyl - L - metionin a jejich kombinace v léčbě těhotenské intrahepatální cholestázy (ICP). Čes Gynek 2006; 71(2): 92 – 98.
10. Meng LJ, Reyes H, Palma J et al. Effects of ursodeoxycholic acid on conjugated bile acids and progesterone metabolites in serum and urine of patients with intrahepatic cholestasis of pregnancy. J Hepatol 1997; 27(6): 1029 – 1040.
11. Brites D, Rodrigues CM. Elevated levels of bile acids in colostrum of patients with cholestasis of pregnancy are decreased following ursodeoxycholic acid therapy. J Hepatol 1998; 29(5): 743 – 751.
12. Brites D, Rodrigues CM, Oliveira N et al. Correction of maternal serum bile acid profile during ursodeoxycholic acid therapy in cholestasis of pregnancy. J Hepatol 1998; 28(1): 91 – 98.
13. Serrano MA, Brites D, Larena MG et al. Beneficial effect of ursodeoxycholic acid on alterations induced by cholestasis of pregnancy in bile acid transport across the human placenta. J Hepatol 1998; 28(5): 829 – 839.
14. Paumgartner G, Beuers U. Ursodeoxycholic acid in cholestatic liver disease: mechanisms of action and therapeutic use revisited. Hepatology 2002; 36(3): 525 – 531.
15. Geenes V, Williamson C. Intrahepatic cholestasis of pregnancy. World J Gastroenterol 2009; 15(17): 2049 – 2066.
16. Mullally BA, Hansen WF. Intrahepatic cholestasis of pregnancy: review of the literature. Obstet Gynecol Surv 2002; 57(1): 47 – 52.
17. Fagan EA. Intrahepatic cholestasis of pregnancy. Br Med J 1994; 309(6964): 1243 – 1244.
18. Binder T. Těhotenská cholestatická hepatóza – doporučený postup. Čes Gynek 2009; 74 (Suppl. 1): 27 – 28.
19. Gonzalez MC, Reyes H, Arrese M et al. Intrahepatic cholestasis of pregnancy in twin pregnancies. J Hepatol 1989; 9(1): 84 – 90.
20. Zapata R, Sandoval L, Palma J et al. Ursodeoxycholic acid in the treatment of intrahepatic cholestasis of pregnancy. A 12‑year experience. Liver Int 2005; 25(3): 548 – 554.
21. Royal College of Obstetricians and Gynaecologists. Obstetric Cholestasis. Green Top Guideline 46. London 2006. Dostupné z: www.rcog.org.uk.
22. European Association for the Study of the Liver. EASL Clinical Practice Guidelines: management of cholestatic liver diseases. J Hepatol 2009; 51(2): 237 – 267.
23. Heinonen S, Kirkinen P. Pregnancy outcome with intrahepatic cholestasis. Obstet Gynecol 1999; 94(2): 189 – 193.
24. Savonius H, Riikonen S, Gylling H et al. Pregnancy outcome with intrahepatic cholestasis. Acta Obstet Gynecol Scand 2000; 79(4): 323 – 325.
25. Binder T, Zima T, Vitek L. Biochemické aspekty těhotenské cholestatické hepatózy. Čes Gynek 2007; 72(2): 90 – 94.
26. Laifer SA, Stiller RJ, Siddiqui DS et al. Ursodeoxycholic acid for the treatment of intrahepatic cholestasis of pregnancy. J Matern Fetal Med 2001; 10(2): 131 – 135.
27. Mozurkewich E, Chilimigras J, Koepke E et al. Indications for induction of labour: a best - evidence review. Br J Obstet Gynaecol 2009; 116(5): 626 – 636.
28. Bacq Y, Sapey T, Bréchot MC et al. Intrahepatic cholestasis of pregnancy: a French prospective study. Hepatology 1997; 26(2): 358 – 364.
29. Kondrackiene J, Beuers U, Zalinkevicius R et al. Predictors of premature delivery in patients with intrahepatic cholestasis of pregnancy. World J Gastroenetrol 2007; 13(46): 6226 – 6230.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicine
Article was published inPractical Gynecology

2010 Issue 1-
All articles in this issue
- Margin status of conizations with histological finding carcinoma in situ
- Selected immunohistochemical prognostic factors of endometrial cancer
- ICTP marker and breast cancer with bone metastases – our experience
- Therapeutic options for assisted reproduction in patients with impaired ovarian reserve
- Intrahepatic cholestasis of pregnancy – selected perinatal outcomes.
- Perimenopausal obesity and how to approach it
- The effect of docosahexaenoic acid on antenatal foetal development and postnatal child development
- Practical Gynecology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Margin status of conizations with histological finding carcinoma in situ
- ICTP marker and breast cancer with bone metastases – our experience
- Intrahepatic cholestasis of pregnancy – selected perinatal outcomes.
- Therapeutic options for assisted reproduction in patients with impaired ovarian reserve
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career




