-
Medical journals
- Career
Molekulovo - genetická analýza tumorsupresorových génov PTEN a TP53 u pacientky s karcinómom endometria
Authors: E. Radzo 1; V. Šišovský 2; P. Sýkora 1; Vanda Repiská 1
Authors‘ workplace: Univerzita Komenského v Bratislave, Lekárska fakulta, Ústav lekárskej biológie a genetiky 1; Univerzita Komenského v Bratislave, Lekárska fakulta, Ústav patologickej anatómie 2
Published in: Prakt Gyn 2009; 13(4): 225-227
Overview
Karcinóm endometria je najčastejší malígny nádor ženských pohlavných orgánov v rozvinutých krajinách. V súčasnom období boli objasnené niektoré gény, ktoré prispievajú k vývoju karcinómu endometria a medzi tieto gény patria TP53, KRAS, b - catenin a PTEN. PTEN bol označený ako tumorsupresorový gén, ktorého mutácie opisuje viacero štúdií pri rôznych typoch nádorových ochorení. Bol identifikovaný v roku 1997 na chromozóme 10 (10q23.3) a kóduje tyrozínovú fosfatázu. Tumorsupresorový gén TP53 (17p13.1, kódujúca oblasť 2 629 bp) kóduje proteín z 393 aminokyselín, pričom ako funkčný proteín pôsobí v podobe tetraméru. V skúmanom tkanive endometria sme identifikovali mutáciu v géne PTEN a polymorfizmus v géne TP53.
Kľúčové slová:
karcinóm endometria – tumorsupresorový gén – mutácia génu – polymorfizmus génuÚvod
Karcinóm endometria (CaE) je najčastejší malígny nádor ženských pohlavných orgánov v rozvinutých krajinách [1]. V súčasnom období boli objasnené niektoré gény, ktoré prispievajú k vývoju karcinómu endometria a medzi tieto gény patria TP53, KRAS, b - catenin a PTEN [2 – 7].
Tumorsupresorový gén PTEN (phosphatase and tensin homolog deleted on chromosome 10), tiež nazývaný MMAC1 (mutated in multiple advanced cancers 1) alebo TEP1 (TGFb - regulated and epithelial - cell - enriched phosphatase) bol identifikovaný v roku 1997 na chromozóme 10 (10q23.3) [8 – 9]. Kóduje tyrozínovú fosfatázu (403 AK), ktorá defosforyluje fosfatidylinozitol - 3,4,5 - trifosfát (PIP3), produkt reakcie katalyzovanej fosfatidylinozitol - 3 - kinázou (PI3K), na fosfatidylinozitol - 4,5 - bisfosfát (PIP2), a tým sa významne podieľa na regulácii aktivácie AKT/ PKB (protein kinase B) signálnej dráhy. PTEN bol označený ako tumorsupresorový gén, ktorého mutácie opisuje viacero štúdií pri rôznych typoch nádorových ochorení. Mnohé mutácie sa týkali kódujúcej sekvencie génu PTEN, z ktorých väčšina mala za následok inaktiváciu fosfatázovej aktivity tejto tyrozínovej fosfatázy. Je známe, že mutácie typu „frameshift“, príp. „nonsense“ mutácie v rámci fosfatázovej domény (AK 15 – 186) katalytickej jednotky tohto proteínu výrazne menia fosfatázovú aktivitu, čím sa tieto zmeny na úrovni DNA do istej miery podieľajú na procese malígnej transformácie bunky [10 – 11]. Okrem toho strata funkcie PTEN proteínu je pravdepodobne skorou genetickou alteráciou pri vzniku nádorov endometria, o čom svedčí jej výskyt v prekanceróznych léziách (55 %) a vo viac ako 83 % endometrioidných karcinómoch [12 – 13].
Tumorsupresorový gén TP53 (17p13.1, kódujúca oblasť 2 629 bp) kóduje proteín z 393 aminokyselín, pričom ako funkčný proteín pôsobí v podobe tetraméru. Po poškodení DNA sa p53 hromadí v jadre a spôsobuje zastavenie bunkového cyklu tým, že ako transkripčný faktor zvýši expresiu proteínu p21 [14], ktorý ako člen CIP/ KIP proteínovej rodiny inhibuje komplexy cyklín D/ CDK4 a cyklín D/ CDK6, čím zabráni hyperfosforylácii proteínu rb1 a disociácii E2F rodiny transkripčných faktorov, vďaka ktorej bunka vstupuje do S - fázy bunkového cyklu. Pri mutácii génu TP53 je výsledkom hromadenie nefunkčného proteínu v bunke, ktorý pôsobí ako dvojito - negatívny inhibítor funkčného (wild type) p53, čo vedie k množeniu poškodených buniek – nádorovému procesu [15]. Mutácie TP53 boli identifikované približne v 15 % CaE, pričom 75 % mutácií TP53 sa nachádzalo v endometriálnej intraepitaliálnej neoplázii, ktorá sa pokladá za prekurzor serózneho karcinómu (SC) [16 – 17]. V roku 1981 Lauchlan opísal sériu ôsmich CaE, päť takých, ktoré boli morfologicky čisté, a autor ich označil ako serózne karcinómy, pričom uviedol, že pri porovnaní s endometrioidnými karcinómami je prognóza pre SC karcinómy výrazne horšia, pričom mnoho pacientok zomrie v dôsledku rozsiahleho metastázovania SC so žiadnou alebo iba minimálnou inváziou do myometria [18].
Materiál a metódy
Molekulovo - genetickej analýze bolo podrobené nádorovo zmenené tkanivo endometria 66ročnej pacientky. Na základe histologického nálezu sa jednalo o endometrioidný adenokarcinóm uteru (typ I, estrogén dependentný endometrioidný karcinóm endometria – EEC), Grade II, s infiltráciou do ½ hrúbky myometria.
DNA sme izolovali z 25 mg odobratého tkaniva použitím komerčného kitu QIAamp DNA Mini Kit (Qiagen). Sledované exóny génov PTEN (exóny 1 – 9) a TP53 (exóny 2 – 11) sme amplifikovali využitím polymerázovej reťazovej reakcie (PCR) – tab.1. Jednotlivé PCR produkty sme následne sekvenovali na genetickom analyzátore ABI PRISM TM310 Genetic Analyzer s využitím ABI TM DNA sequencing kitu (Applied Biosystems).
Table 1. Protokol polymerázovej reťazovej reakcie (PCR). 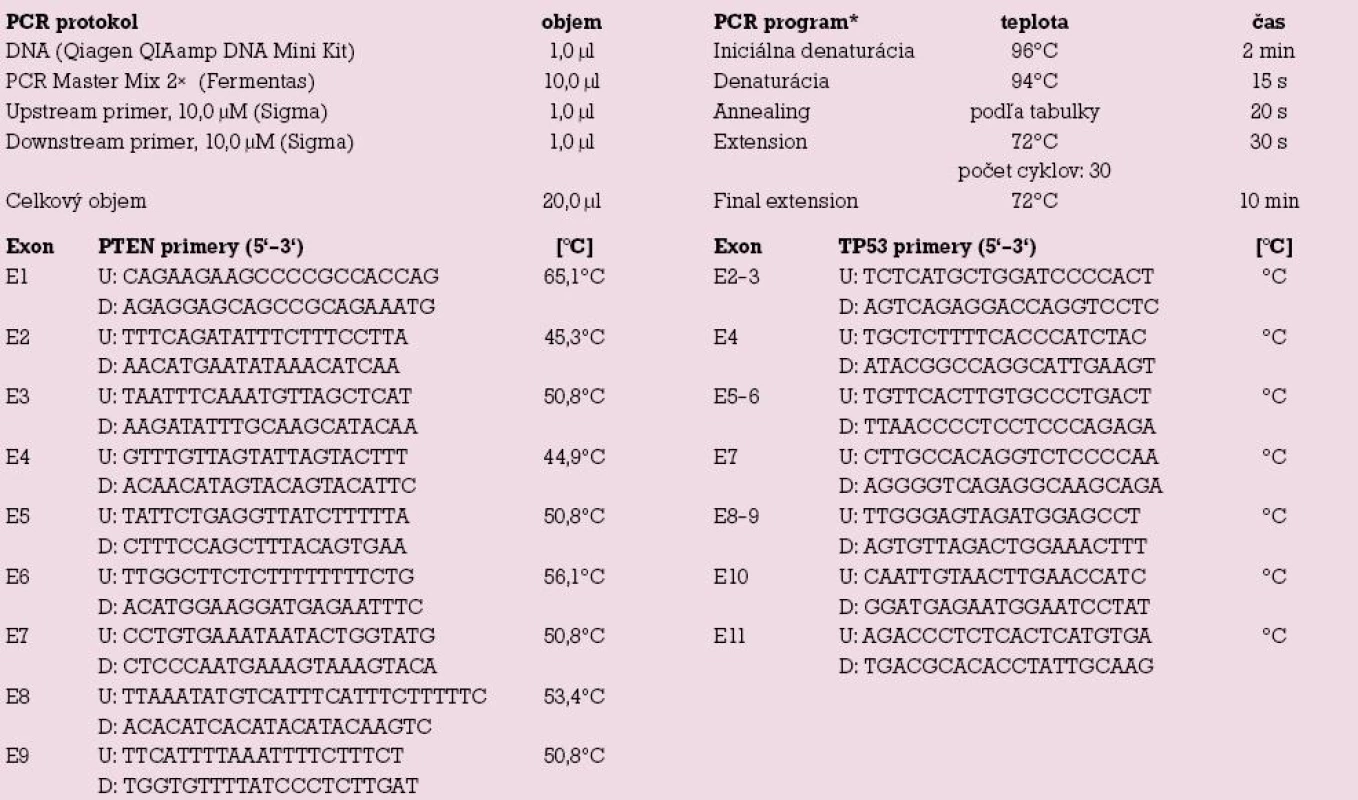
* Eppendorf Mastercycler EPgradient, U – upstream primer, D – downstream primer Výsledky a diskuzia
Priamym sekvenovaním PCR produktov sme v 5. exóne génu PTEN indentifikovali mutáciu typu „nonsense“, pričom išlo o heterozygotnú substitúciu GAA/ TAA v kodóne 157 (1 alela bola „wild type“, obr. 1). Uvedená zmena genetickej informácie vedie k predčasnému vytvoreniu „STOP“ kodónu v pozícii 157, čím sa PTEN proteín v priebehu translácie skráti o 246 AK, čo v konečnom dôsledku môže viesť k funkčnej alterácii tohto proteínu.
V 4. exóne génu TP53 sme priamym sekvenovaním PCR produktu identifikovali heterozygotný polymorfizmus (SNP) CCC/ CGC (obr. 2) v kodóne 72. Dôsledkom zmeny nukleotidov dochádza k substitúcii neutrálnej, nepolárnej a hydrofóbnej aminokyseliny prolín za zásaditú, polárnu a hydrofilnú aminokyselinu arginín. To môže viesť k zmene sekundárnej i terciárnej štruktúry proteínu p53, a tým k zmene jeho väzbovej aktivity na DNA.
Na základe vyššie uvedeného nálezu v rámci genetickej analýzy tumorsupresorových génov PTEN a TP53 môžeme konštatovať, že v skúmanom tkanive sa môže nachádzať viac histologických typov CaE, čo môže znamenať aj odlišnú prognózu tohto ochorenia.
Liu hodnotí mnohé nádory endometria ako výnimky v rámci dualistického modelu endometriálnej karcinogenézy. Tieto nádory sú v „šedej zóne“ s prekrývajúcimi sa klinickými, morfologickými, imunohistochemickými a molekulárnymi rysmi z oboch typov CaE [19].
Karcinómy endometria, endometriálne stromálne nádory a zmiešané malígne mezodermálne nádory (ZMMN) sa rozvíjajú osobitnými molekulárno - genetickými cestami. Lax vo svojej práci ďalej opisuje, že v ZMMN, ktoré sa považujú za metaplastické karcinómy, sa objavuje alterácia p53 na začiatku, ešte pred expanziou a získaním genetickej rozmanitosti počas ich progresie [20].
Kurihara et al pri skúmaní sarkómov vyššieho stupňa so signifikantnou atypiou jadra opisujú akumuláciu p53 v jadre a „missense“ mutácie v géne TP53 iba v nediferencovaných endometriálnych sarkómoch s jadrovým pleomorfizmom [21].
V rámci karcinogenézy môžeme uvažovať aj o zníženej odolnosti voči chemickému, medikamentóznemu poškodeniu tkaniva endometria. Zeng et al zistili, že aktivácia p53 zohráva esenciálnu úlohu v signálnej ceste od opravy chýb v DNA k autofágmi pôsobiacej apoptóze po chemickom poškodení DNA – 6 - thioguaninom [22].
Naďalej bude potrebné sledovať genetické alterácie v CaE, pričom výsledky genetickej analýzy môžu pomôcť porozumieť procesu karcinogenézy z hľadiska molekulárno - biologickej podstaty.
MUDr. Edward Radzo1
MUDr. Vladimir Sisovsky, PhD.2
Pavel Sykora1
Doc. RNDr. Vanda Repiska, PhD.1
1 Univerzita Komenského v Bratislave, Lekárska fakulta, Ústav lekárskej biológie a genetiky
2 Univerzita Komenského v Bratislave, Lekárska fakulta, Ústav patologickej anatómie
mudr.edwardradzo@gmail.com
Sources
1. Djordjević B, Stanojević Z. Endometrial carcinoma and precursor lesions. Srp Arh Celok Lek. 2007; 135(3 – 4): 230 – 234.
2. Okamoto A, Sameshima Y, Yamada Y et al. Allelic loss on chromosome 17p and p53 mutations in human endometrial carcinoma of the uterus. Cancer Res 1991; 51(20): 5632 – 5635.
3. Enomoto T, Inoue M, Perantoni AO et al. K - ras activation in neoplasms of the human female reproductive tract. Cancer Res 1990; 50(19): 6139 – 6145.
4. Fukuchi T, Sakamoto M, Tsuda H et al. Catenin mutation in carcinoma of the uterine endometrium. Cancer Res 1998; 58 : 3526 – 3528.
5. Tashiro H, Blazes MS, Wu R et al. Mutations in PTEN are frequentin endometrial carcinoma but rare in other common gynecological malignancies. Cancer Res 1997; 57 : 3935 – 3940.
6. Risinger JI, Hayes AK, Berchuck A et al. PTEN/ MMAC1 mutations in endometrial cancers. Cancer Res 1997; 57(21): 4736 – 4738.
7. Kong D, Suzuki A, Zou TT et al. PTEN is frequently mutated in primary endometrial carcinomas. Nat Genet 1997; 17(2): 143 – 144.
8. Yamada KM, Araki M. Tumor suppressor PTEN: modulator of cell signaling, growth, migration and apoptosis. J Cell Sci 2001; 114, 2375 – 2382.
9. Tamguney T, Stokoe D. New insights into PTEN. J Cell Sci 2007; 120, 4071 – 4079.
10. Leslie NR, Downes PC. PTEN function: how normal cells control it and tumour cells lose it. Biochem J 2004; 382, 1 – 11.
11. Goberdhan DCI, Wilson C. PTEN: tumour suppressor, multifunctional growth regulator and more. Hum Mol Genet 2003; 12 : 239 – 248.
12. Maxwell GL, Risinger JI, Gumbs C et al. Mutation of the PTEN tumor suppressor gene in endometrial hyperplasias. Cancer Res 1998; 58(12): 2500 – 2503.
13. Mutter GL, Lin MC, Fitzgerald JT et al. Altered PTEN expression as a diagnostic marker for the earliest endometrial precancers. J Natl Cancer Inst 2000; 92(11): 924 – 930.
14. Doll A, Abal M, Rigau M et al. Novel molecular profiles of endometrial cancer - new light through old windows. J Steroid Biochem Mol Biol 2008; 108(3 – 5): 221 – 229.
15. Bansal N, Yendluri V, Wenham RM. The molecular biology of endometrial cancers and the implications for pathogenesis, classification, and targeted therapies Cancer Control 2009; 16(1):8 – 13.
16. Lax SF, Kendall B, Tashiro H et al. The frequency of p53, K - ras mutations, and microsatellite instability differs in uterine endometrioid and serous carcinoma: evidence of distinct molecular genetic pathway. Cancer 2000; 88 : 814 – 824.
17. Tashiro H, Isacson C, Levine R et al. p53 gene mutations are common in uterine serous carcinoma and occur early in their pathogenesis. Am J Pathol 1997; 150(1): 177 – 185.
18. Lauchlan SC. Tubal (serous) carcinoma of the endometrium. Arch Pathol Lab Med 1981; 105(11): 615 – 618.
19. Liu FS. Molecular carcinogenesis of endometrial cancer. Taiwan J Obstet Gynecol. 2007; 46(1): 26 – 32.
20. Lax SF. Molecular genetic changes in epithelial, stromal and mixed neoplasms of the endometrium. Pathology 2007; 39(1): 46 – 54.
21. Kurihara S, Oda Y, Ohishi Y et al. Endometrial stromal sarcomas and related high‑grade sarcomas: immunohistochemical and molecular genetic study of 31 cases. Am J Surg Patol 2008; 32(8): 1228 – 1238.
22. Zeng X, Yan T, Schupp JE et al. DNA mismatch repair initiates 6 - thioguanine - ‑induced autophagy through p53 activation in human tumor cells. Clin Cancer Res 2007; 13(4): 1315 – 1321.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicine
Article was published inPractical Gynecology

2009 Issue 4-
All articles in this issue
- Kontrastní ultrazvuk (CEUS) nehmatných lézí prsu
- Dopplerometrie ductus venosus
- Prognóza žen s mikrometastázou karcinomu prsu v sentinelové uzlině
- Molekulovo- genetická analýza tumorsupresorových génov PTEN a TP53 u pacientky s karcinómom endometria
- Biologická léčba karcinomu prsu
- Tradiční peruánská medicína v léčbě neplodnosti
- Rýchla prenatálna diagnostika chromozómových aneuploidií
- Mikrobiologické vlastnosti kmenů endogenní vaginální flóry asymptomatických žen reprodukčního věku
- Practical Gynecology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Dopplerometrie ductus venosus
- Prognóza žen s mikrometastázou karcinomu prsu v sentinelové uzlině
- Kontrastní ultrazvuk (CEUS) nehmatných lézí prsu
- Mikrobiologické vlastnosti kmenů endogenní vaginální flóry asymptomatických žen reprodukčního věku
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

