-
Medical journals
- Career
Kontrastní ultrazvuk (CEUS) nehmatných lézí prsu
Authors: K. Dvořák; V. Válek; J. Patera; M. Třináctá; E. Jandáková; Z. Pačovský; M. Kuzárová; R. Jakubcová; J. Foukal
Authors‘ workplace: Fakultní nemocnice Brno, Česká republika
Published in: Prakt Gyn 2009; 13(4): 202-212
Overview
Cíl:
Hlavním cílem této pilotní práce bylo stanovení přínosu a zhodnocení senzitivity/ specificity kontrastního ultrazvuku s použitím kontrastní látky 2. generace SONOVUE® v detekci nehmatných lézí prsu s referencí mammografie, nativního ultrazvuku s dopplerovským vyšetřením a histologickou verifikací lézí [6 – 10]. Dalším cílem bylo zhodnocení významu CEUS při monitorování výsledků podávané neodajuvantní chemoterapie (skupina 15 pacientek s karcinomem mléčné žlázy).Metodika:
Celkové množství 2,4 ml kontrastní látky SONOVUE® s následným 5ml proplachem fyziologickým roztokem bylo aplikováno 126 pacientkám (63 maligních a 63 benigních lézí) s histologickým vyšetřením v obou skupinách žen. Sonografická vyšetření byla provedena na přístroji iU22 Philips lineární sondou L 9 – 3 MHz v harmonickém režimu s využitím mikrovaskulárního zobrazení a QLAB® softwaru. Použitý nízký mechanický index 0,07 byl užitý jednak pro předčasnou destrukci mikrobublin a pro získání optimální obrazové kvality. Cévní znaky, mikrovaskulární architektonika, počet cév [1 – 5], stupeň enhancement, time intensity curve (křivky), společně s area under curve (AUC), time to peak (TTP), in‑flow gradient (IFG), peak enhancement (PE) a out ‑ flow gradient (OFG – wash out time, vymytí kontrastu) byly získány QLAB softwarem s ROI 5 mm (region of interest) umístěným v centru léze a 1 cm od léze v intaktním parenchymu. Získané výsledky CEUS byly statisticky zpracovány společně se všemi diagnostickými zobrazovacími metodami.Výsledky:
Získané výsledky statisticky signifikantně rozlišují benigní a maligní léze. Senzitivita CEUS ve skupině maligních lézí byla 98 %, specificita 92 %, ve skupině benigních lézí byla senzitivita 89 % a specificita 82 %.Klíčová slova:
contrast enhanced ultrasound – CEUS – kontrastní ultrazvuk – dopplerovské vyšetření – SonoVue® – harmonické zobrazení – QLAB – mammografie – histologieMetodika
Předkládáme soubor 126 pacientek rozdělených do dvou skupin: maligní (n = 63) a benigní (n = 63). Maligní skupina: 50 žen ve věku 34 – 64 let, (medián = 47,4 let) s prokázaným invazivním karcinomem, 8 žen s prokázaným karcinomem in situ ve věku 31 – 51 let, (medián = 43 let) a 5 žen s lokální recidivou karcinomu mléčné žlázy ve věku 43 – 64 let, (medián = 50,2 let). Benigní skupina: 63 žen ve věku 24 – 57 let, (medián = 34,9 let). Skupina malignit je složena ze dvou podskupin: 22 žen ve věku 29 – 45 let a dále z podskupiny 41 žen ve věku 45 – 65 let (screeningová skupina = 65,1 %). Pouze 3 karcinomy posledně jmenované podskupiny je možno označit jako intervalové karcinomy.
Maligní nálezy byly verifikovány core biopsií a následně kompletní excizí (parciální mastektomií). Benigní léze byly verifikovány lumpektomií/ core biopticky. V případě karcinomu mléčné žlázy bylo provedeno označení a kompletní histologické zpracování sentinelové uzliny. U pacientek s karcinomem mléčné žlázy byl volený tailored léčebný plán. Informovaný souhlas se všemi vyšetřovacími modalitami/ léčebnými postupy byl nezbytnou podmínkou.
Vyloučení žen ze studie:
- bilaterální léze v obou skupinách žen
- velikost léze > 2 cm
- nesouhlas pacientky
Ženy byly vyšetřeny na ultrazvukovém přístroji iU22 Phillips 9,3 MHz a QLAB® softwarem. Kompletní nativní ultrazvukové vyšetření včetně dopplerovského vyšetření/ mapování (jak detekované léze, tak i axilárních uzlin) předcházelo kontrastnímu sonografickému vyšetření. Vyšetření byla hodnocena nezávisle dvěma radiology s praxí 22 a 7 let. Celkové množství aplikovaného kontrastu – SONOVUE® BRACO (lyophilizovaný prášek) bylo 2,4 ml u všech žen. Mléčná suspenze SONOVUE® byla získána po přidání 5 ml fyziologického roztoku do 25 mg práškové substance. Každé pacientce byl aplikován bolus 2,4 ml SONOVUE® suspenze cestou antekubitální žíly 20G katétrem s následným proplachem 5 ml fyziologického roztoku. Nežádoucí/ vedlejší účinky po aplikaci SONOVUE® nebyl pozorovány.
Studované parametry CEUS (kontrastního ultrazvuku) byly následující:
Mikrovaskularní architektura (MVI = Microvascular Imaging – součást softwaru QLAB), počet cév, stupeň enhancement, number of blood vessels, degree of enhancement, time intensity křivky, area under curve (AUC), time to peak (TTP), in flow gradient (IFG), peak enhancement (PE) a out flow gradient (OFG – wash out time) byly získány QLAB® softwarem měřením ROI 5 mm (oblast zájmu), který byl umístěn do centrální části léze a 1 cm od léze v „intaktním“ parenchymu mléčné žlázy.
Po ukončení ultrazvukových vyšetření bylo doplněno mammografické vyšetření.
Definice
ROI = region of interest – oblast zájmu = 5 mm2, (software of QLAB®), TTP = time to peak = (time at peak) – (time at inflow), AUC = area under curve = (echo 2 + echo 1) * (time 2 – time 1)/ 2, IFG = in flow gradient = graph fit straight line over contrast inflow, PE = peak enhancement = (peak echo) – (background echo), WOT = wash out time = decrease in intensity at double time compared to the intensity at peak time, peripheral = 1 cm od okraje léze, centrální = centrum léze (problematické ve skupině ložisek ≤ 5 mm).
Statistika
Výsledky byly testovány Fisherovým testem a Mantel – Haenszel χ2 testem.
Výsledky
I. Mammografie
Mammografická vyšetření byla provedena na přístroji NOVA 3000 Siemens. Autoři uvádějí nejen pro úplnost i výsledky mammografických vyšetření, a to především ke stanovení velikostí lézí a typu mléčné žlázy.
29 karcinomů mléčné žlázy bylo prokázáno vpravo a 31 karcinomů vlevo (54 %).
Většina karcinomů byla prokázána v zevním horním kvadrantu (45,5 %), nejčastější velikost karcinomů se pohybovala mezi > 10 mm < 15 mm (40 %).
Kalcifikace v karcinomech (intratumorální) byly hodnoceny pouze jako maligní typ. Intratumorální kalcifikace byly prokázány u 21 z 55 karcinomů (38,2 %), intratumorální a extratumorální kalcifikace byly zaznamenány u 5 karcinomů (9,1 %).
Pouze mikrokalcifikace bez jádrového stínu byly zaznamenány u 3 případů karcinomu in situ (4,76 %).
Maligní typ kalcifikací v případě lokální recidivy karcinomu mléčné žlázy byl zaznamenán ve dvou případech (40 %).
Nejčastějším mammografickým vzhledem karcinomů byla nepravidelná neostře ohraničená léze. Nejčastější mammografický vzhled karcinomů mléčné žlázy je uveden na obr. 1 a obr. 2.
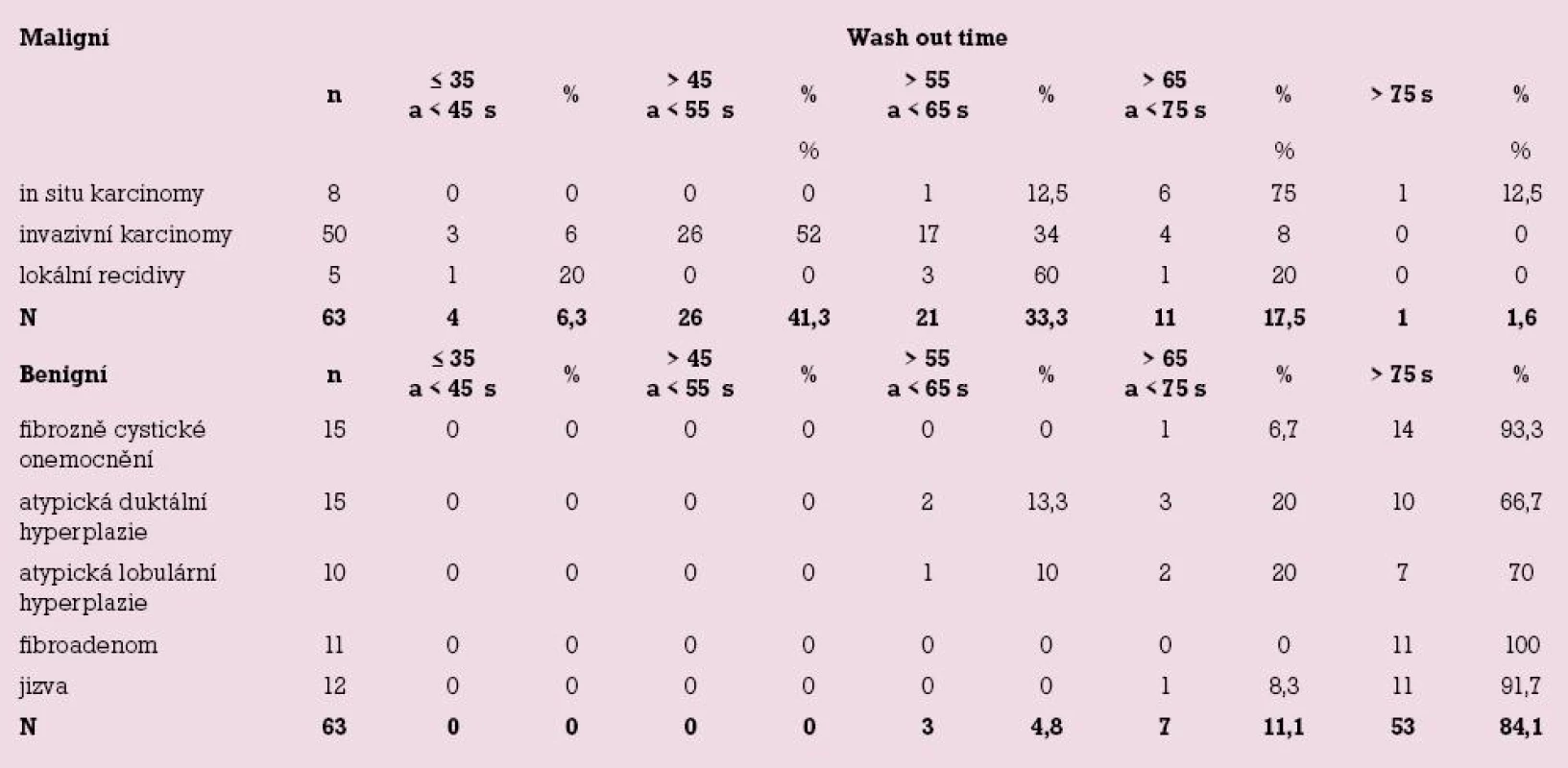
Image 1. Detail maligního typu mikrokalcifikací komedonového typu bez jádrového stínu. Histologicky DCIS grade 3, steroidní status negativní. 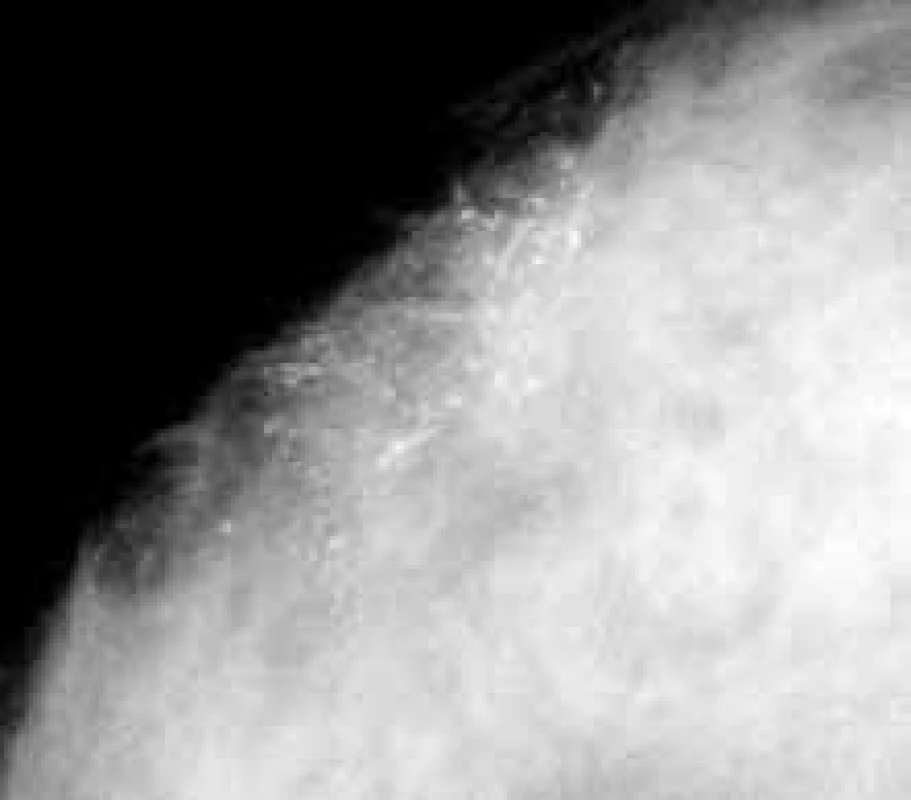
Image 2. Detail neostře ohraničené plošné opacity bez obsahu mikrokalcifikací. Histologicky invazivní duktální a lobulární karcinom, grade 2, oba steroidní receptory vysoce pozitivní. 
Přibližně 42 % karcinomů bylo prokázáno v typu mléčné žlázy klasifikované jako Tabár 2.
47 (94 %) karcinomů mléčné žlázy, 4 lokální recidivy karcinomu z 5 (80 %) a 7 duktálních karcinomů in situ z 8 (87,5 %) byly v BIRADS klasifikaci označeny jako BIRADS 4/ 5.
Falešná negativita mammografie byla zaznamenaná v jednom případě invazivního karcinomu – jednalo se o dobře ohraničenou lézi bez obsahu kalcifikací, léze de novo, velikost 6 mm, histologicky se jednalo o papilární invazivní karcinom, grade 1.
Falešná negativita mammografie ve skupině in situ karcinomů byla zaznamenaná v 1 z 8 karcinomů (12,5 %) v typu mléčné žlázy Tabár 4, velikost léze byla 5 mm, bez obsahu kalcifikací. Celkem v jednom případě ze všech maligních obrazů byla užita klasifikace BIRADS 0 v případě lokální recidivy karcinomu mléčné žlázy.
Nejčastějším mammografickým nálezem ve skupině benigních lézí byl nález: v zevním horním kvadrantu > 50 % , velikosti > 70 % mezi > 5 mm < 10 mm, výjimku tvořil nález fibrozně cystické arey (67 % mimo hranici > 10 mm < 15 mm).
Benigní typ kalcifikací v benigních lézích byl u 22 případů (34,9 %).
Nejčastější mammografický vzhled benigních lézí byl nepravidelný tvar 80 %, ohraničení fibrozně cystické struktury bylo v 93 %, atypické duktální hyperplazie v 53 % a atypické lobulární hyperplazie v 40 % nepravidelné.
Fibrozně cystická dysplazie byla typická: nálezem v zevním horním kvadrantu nebo centrálně, špatně ohraničená area obsahující kalcifikace.
Atypická duktální hyperplazie stejně jako jizva se prezentovaly jako nepravidelná, špatně ohraničená léze s kalcifikacemi.
Atypická lobulární hyperplazie byla průkazná jako nepravidelná, mikrolobulární area s prachovitými mikrokalcifikacemi.
Velikost maligních lézí byla zaznamenaná v těchto hranicích: < 5 mm 7/ 63 (11,1 %), > 5 mm < 10 mm 18/ 63 (28,6 %), > 10 mm < 15 mm 29/ 63 (46 %), > 15 mm < 19 mm 9/ 63 (14,3 %).
II. Histologie
Invazivní duktální karcinom NOS (not other way specified) byl zaznamenán ve 48 % (24/ 50), invazivní papilární karcinom v 10 % (5/ 50), invazivní kribriformní karcinom ve 4 % (2/ 50), invazivní tubulární karcinom v 6 % (3/ 50), apokrinní (juvenilní) karcinom ve 2 % (1/ 50) a invazivní lobulární karcinom ve 20 % (10/ 50).
Histologicky verifikovaná lokální recidiva byla zaznamenaná u 5 pacientek – 7,9 % (5/ 63 karcinomů). Tři (60 %) lokální recidivy karcinomu mléčné žlázy byly zaznamenány jako recidiva invazivního duktálního karcinomu NOS, grade 1, 2 a 3 rovnoměrně. Lokální recidiva lobulárního invazivního karcinomu byla průkazná v jednom případě (20 %), grade 1. Lokální recidiva papilárního invazivního karcinomu byla zaznamenána v jednom případě (20 %), grade 3.
Duktální karcinom in situ byl pozorován u 8 pacientek – 12,7 % (8/ 63 malignit). 4 duktální karcinomy in situ byly low grade (50 %), 2 duktální karcinomy in situ byly high grade [comedo] (25 %) a u 2 pacientek byl zaznamenán duktální a lobulární karcinom in situ.
TNM klasifikace nádorů:
pTis NX M0 8 (12,7 %)
pT1a pN 0 M0 1 (1,6 %)
pT1b pN0 M0 8 (12,7 %)
pT1c pN0 M0 32 (50,8 %)
pT1c pN1a M0 8 (12,7%)
pT2a pN0 M0 2 (3,2 %)
pT2a pN1a M0 4 (6,3 %)Postižení axilárních uzlin bylo průkazné u 14 pacientek (22,2 %).
Grade 1 byl zaznamenán ve 41,3 %, grade 2 v 25,4 % a grade 3 ve 33,3 %.
Negativní steroidní status byl průkazný ve 12,7 %. Pozitivní oba steroidní receptory byly u 33 karcinomů (52,4 %), pozitivita pouze estrogenního receptoru u 17 karcinomů (27 %) a pozitivita pouze progesteronového receptoru u 3 karcinomů (4,8 %). Her 2 pozitivita byla stanovena u 19 karcinomů (30,2 %) a Fish pozitivita u 7 karcinomů (11,1 %). Triple negativita: negativní steroidní receptory [estrogen a progesteron] a negative Her 2 byla zaznamenaná u 4 karcinomů (6,3 %). Duktální karcinom in situ v těsném sousedství invazivního karcinomu byl zaznamenán u 11 karcinomů z 50 (22 %).
Komplexnost histologických stavů karcinomů mléčné žlázy je uvedena na obr. 3 a obr. 4.
Image 3. Histologický vzhled duktálního karcinomu in situ, grade 2, steroidní receptory oba vysoce pozitivní, který byl průkazný jak v centru invazivního karcinomu, tak i na jeho periferii. 
Image 4. Identický případ, histologicky se jedná o mucinózní karcinom a invazivní duktální karcinom NOS varianta, grade 3, estrogenní receptory 50 %, progesteronový receptor negativní. 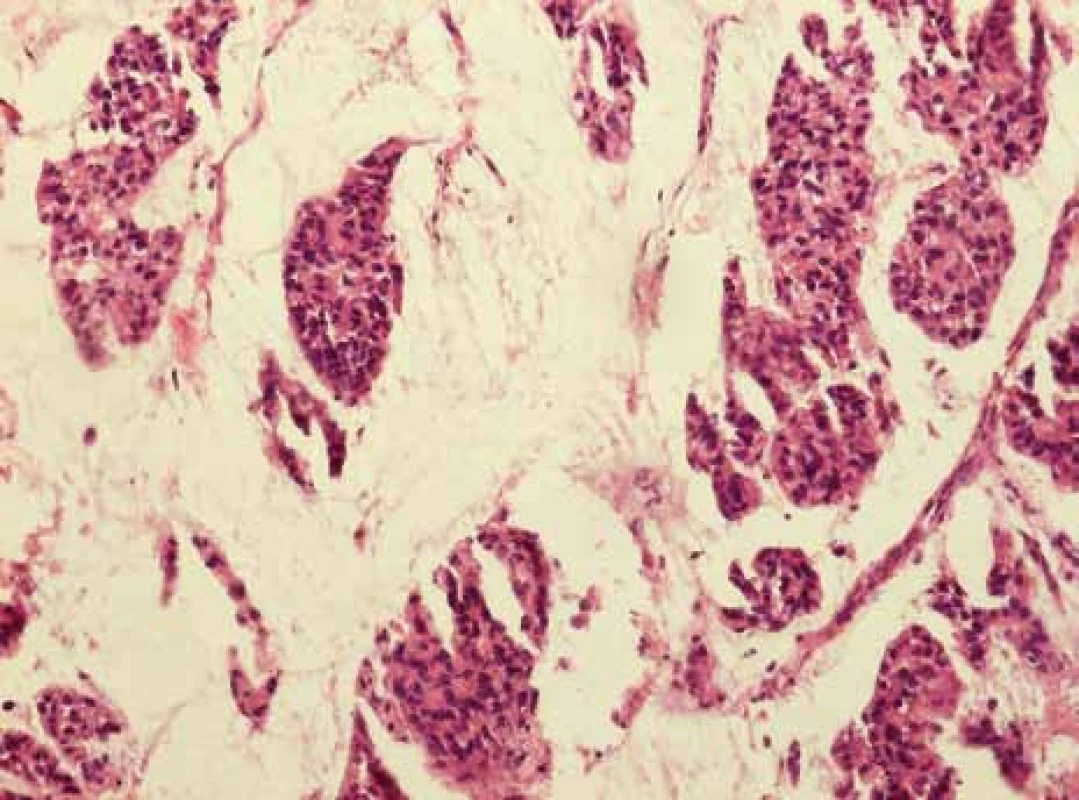
III. Nativní ultrazvuk
Všechna vyšetření byla provedena na přístroji iU22 Phillips, lineární sondou L 9 – 3 MHz, nízký mechanický index 0,06.
Typický obraz karcinomů in situ mléčné žlázy (n = 8): lobulární, širší než vyšší, špatně ohraničené, lehce hypoechogenní a heterogenní, bez akustického stínu léze bez pseudokapsuly. Velikost byla u 50 % < 5 mm. Celkově 75 % (n = 6) neinvazivních karcinomů bylo hodnoceno BIRADS 4 a 5, dva karcinomy in situ pak BIRADS 3.
Typický vzhled invazivních karcinomů mléčné žlázy (n = 50) nepravidelný, vyšší než širší, špatně ohraničený, výrazně hypoechogenní léze s akustickým stínem bez pseudokapsuly. Velikost karcinomů byla ve 46 % (n = 23) > 10 a < 15 mm a ve 36 % (n = 10) > 15 a < 19 mm. 46 karcinomů bylo klasifikováno BIRADS 4 a 5 (92 %), 3 karcinomy BIRADS 3 (6 %) a pouze jeden karcinom jako BIRADS 2 (benigní = 2 %). Jejich vzhled je uveden na obr. 7.
Image 5. Neostře ohraničené ložisko výrazně hypoechogenní s jemným akustickým stínem – histologicky invazivní duktální karcinom grade 3. 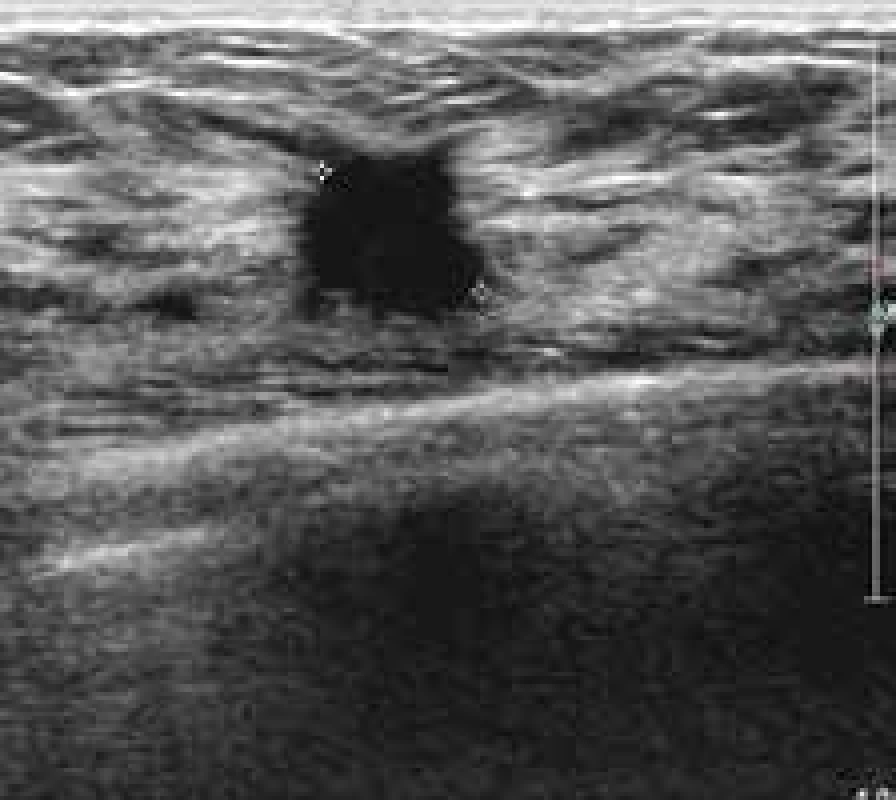
Lokální recidiva karcinomu (n = 5) mléčné žlázy byla typicky průkazná jako nepravidelná, vyšší než širší, heterogenní léze s akustickým stínem bez průkazu pseudokapsuly. Velikost lokálních recidiv byla zaznamenaná v 80 % mezi 5 – 15 mm. Hodnoceny byly BIRADS 4/ 5 ve všech případech. Vzhled recidivy v nativním ultrazvuku je uveden na obr. 8.
Image 6. Nepravidelná nehomogenní area s mohutným akustickým stínem v pravé části obrazu. Vlevo oválné, poměrně dobře ohraničené ložisko – histologicky recidiva karcinomu. 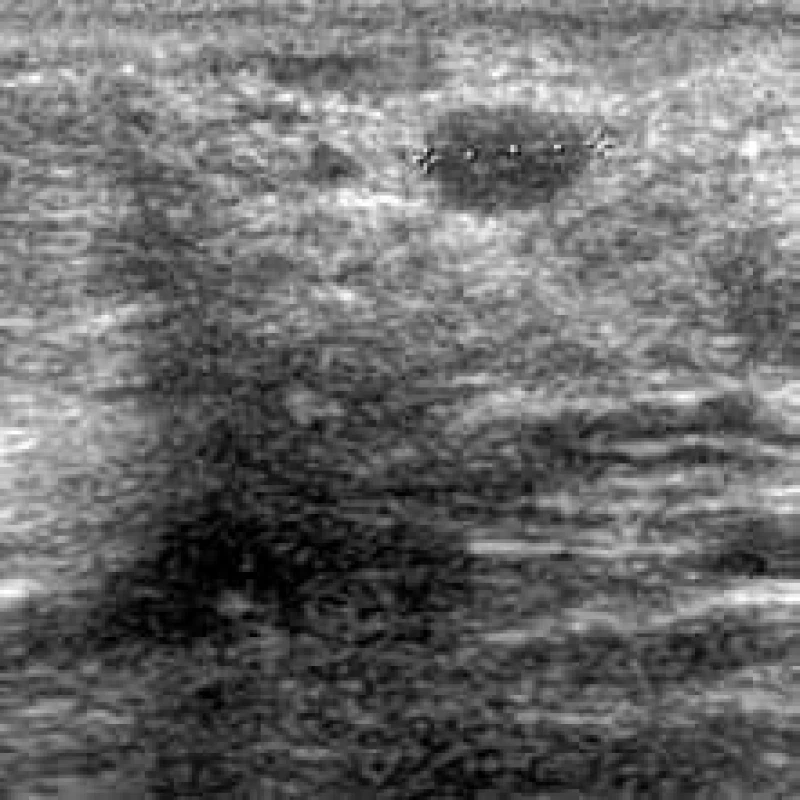
Vzhled fibrozně cystického onemocnění (n = 15) v nativním ultrazvukovém obrazu byl nejčastější: laločnatá, širší než vyšší léze mikrolobulární nebo dobře ohraničená, lehce hypoechogenní, heterogenní bez akustického stínu či pseudokapsuly. Velikost byla zaznamenaná v 60 % v hranici > 10 do < 15 mm. Pět nálezů bylo hodnoceno BIRADS 2 (33,3 %), 9 nálezů BIRADS 3 (60 %) a 1 hodnocení BIRADS 4.
Atypická duktální hyperplazie (n = 15) byla průkazná jako lobulární/ nepravidelná, vyšší než širší léze, špatně ohraničená, lehce hypoechogenní bez průkazu pseudokapsuly. Velikost v hranici > 5 do < 10 mm byla zaznamenaná v 73,3 %. BIRADS 2 klasifikace v 1 případě (6,7 %), BIRADS 3 ve 12 (80 %), BIRADS 4 v 1 (6,7 %) a BIRADS 0 v 1 případě (6,7 %).
Atypická lobulární hyperplazie byla typická (n = 10): oválná/ kulatá, vyšší než širší léze, mikrolobulární, lehce hypoechogenní, heterogenní s akustickým stínem a bez průkazu pseudokaspuly. Velikost mezi > 5 do < 15 mm byla průkazná ve všech případech100 %. Hodnocení BIRADS 2 ve dvou případech (20 %), BIRADS 3 v 70 % a BIRADS 4 v jednom případě (10 %).
Fibroadenom (n = 11) byl typický jako: oválná/ kulatá léze širší než vyšší, iso/ lehce hypoechogenní heterogenní bez akustického stínu. Velikost > 5 do < 10 byla průkazná v 54, 4 %. BIRADS 2 klasifikace u 10 nálezů, BIRADS 3 v jednom (9,1 %). Vzhled uveden na obr. 5.
Image 7. Oválná hypoechogenní ohraničená léze s jemným akustickým stínem na okrajích - fibroadenom. 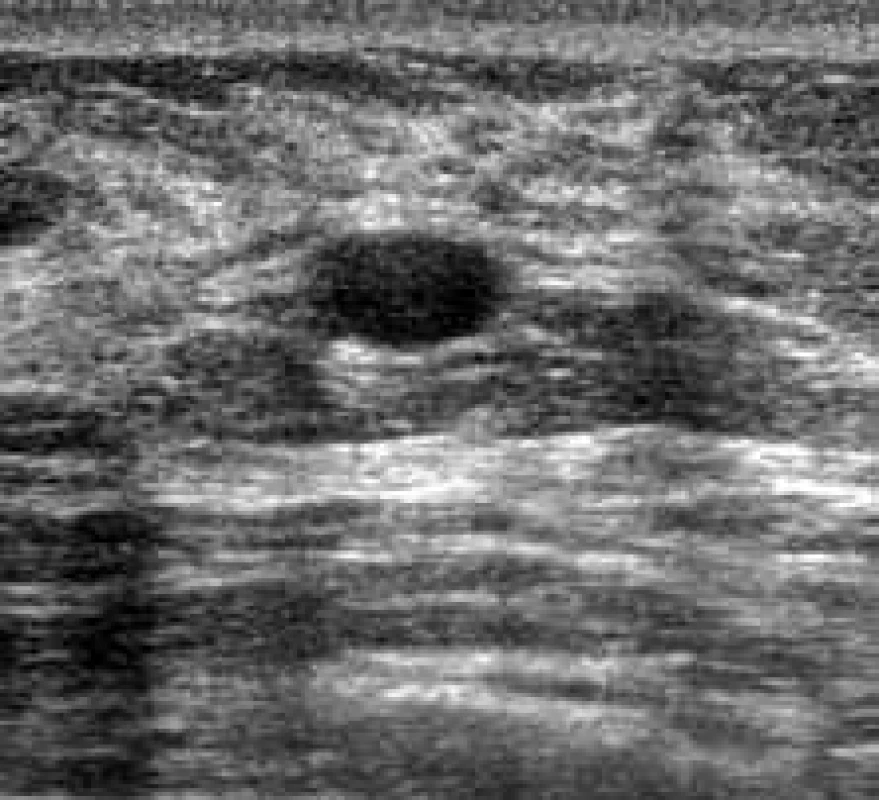
Jizva (n = 12) byla typicky v nativním ultrazvuku jako lobulární/ nepravidelná léze, vyšší než širší, špatně ohraničená, výrazně hypoechogenní, heterogenní s akustickým stínem a bez průkazu pseudokapsuly. Velikost v hranici > 15 do < 19 mm byla u 9 nálezů (75 %). BIRADS 2 klasifikace 2 případy (33,3 %), BIRADS 3 u 6 (50 %) a BIRADS 4 ve dvou případech (16,7 %). Typický vzhled uveden na obr. 6.
Image 8. Nepravidelná nehomogenní area s mohutným akustickým stínem. Porušení podkoží, zesílení Coopperových ligament – jizva. 
Velikost maligních lézí byla zaznamenaná: < 5 mm 8/ 63 (12,7 %), > 5 mm 10 mm 19/ 63 (30,2 %), > 10 mm < 15 mm 26/ 63 (41,3 %) a > 15 mm < 19 mm 10/ 63 (15,9 %).
IV. Natiní dopplerovské vyšetření
Před dopplerovským vyšetřením prsu byly všechny ženy vyšetřeny nativním ultrazvukem – lokalizace léze. Vyšetření byla provedena na přístroji iU22 Phillips, lineární sondou L 9 – 3 MHz, s nízkým mechanickým indexem 0,06, nízkou mechanickou kompresí (bez tlaku na sondu) tak, aby bylo zabráněno obliteraci drobných cév (low pressure). Color box byl individuálně upraven tak, aby byla léze snímána s okolní tkání v rozsahu minimálně 1 cm [11 – 12].
V nativním power doppler sonografickém obrazu bylo 12 karcinomů mléčné žlázy hypervaskulárních (19,1 %), 30 karcinomů hypovaskulárních (47,6 %) a 21 karcinomů bylo avaskulárních (33,1 %).
3 benigní léze byly hypervaskulární (4,8 %), 13 lézí hypovaskulárních (20,6 %) a 47 benigních lézí (74,6 %) bylo avaskulárních.
Distribuce cév (nativní ultrazvuk) u maligních lézí:
- marginální cévy 38 karcinomů (60,3 %)
- penetrující cévy u 23 karcinomů (36,5 %)
- centrální cévy u 14 karcinomů (22,2 %)
Typické obrazy uvedeny na obr. 9. a obr. 10.
Image 9. Maligní typ vaskularizace průkazný u ložisek velikosti do 7 mm. 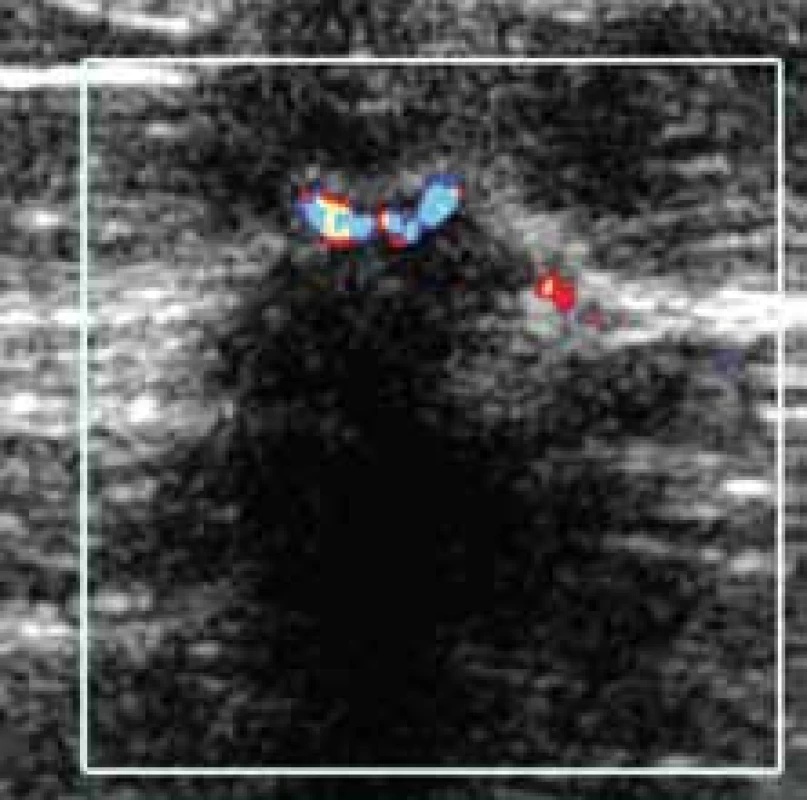
Image 10. Maligní typ vaskularizace průkazný u ložisek velikosti do 7 mm. 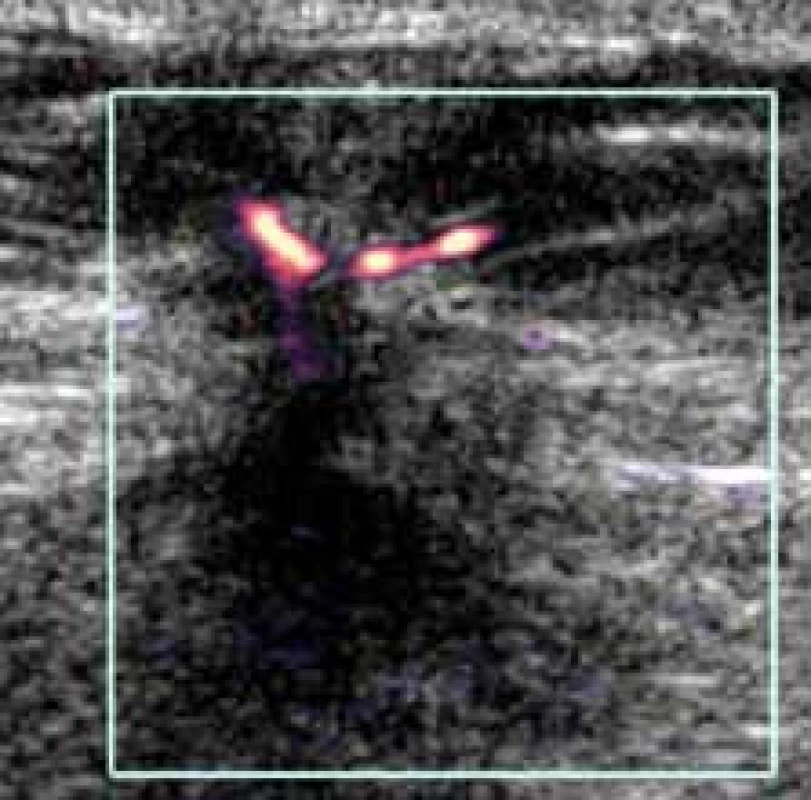
Distribuce cév při kontrastním vyšetření u maligních lézí: (CEUS-SONOVUE®)
- marginální cévy u 60 karcinomů (95,2 %)
- penetrující cévy u 61 karcinomů (96,8 %)
- centrální cévy u 49 karcinomů (77,8 %)
Typické obrazy uvedeny na obr. 11 a obr. 12.
Image 11. Maligní typ vaskularizace při kontrastním dopplerovském vyšetření. Průkazné jak periferní, tak centrální i penetrující cévy. 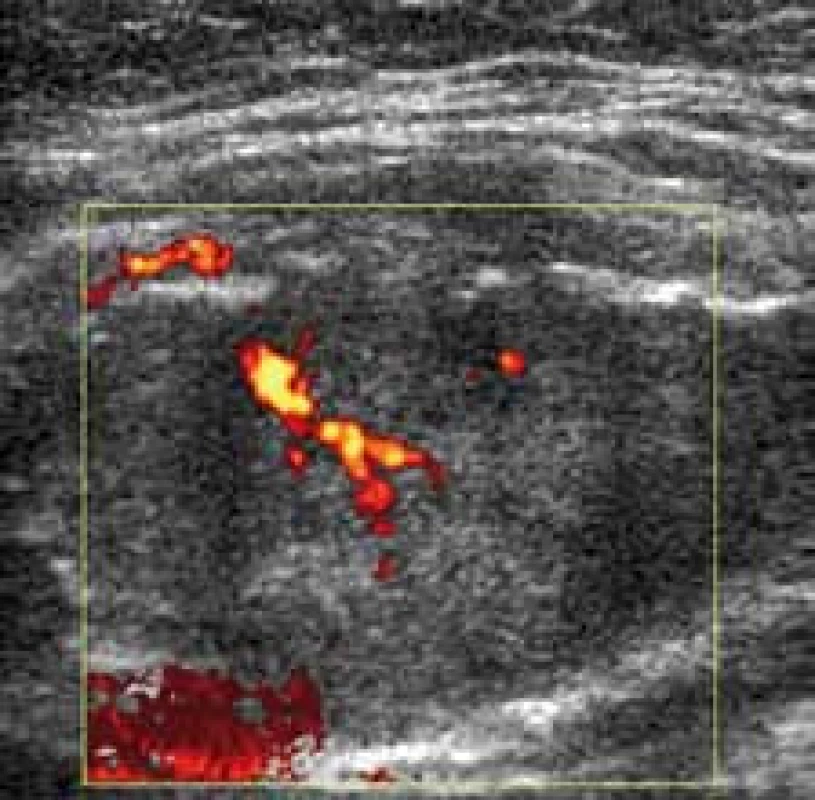
Image 12. Maligní typ vaskularizace při kontrastním dopplerovském vyšetření. Průkazné jak periferní, tak centrální i penetrující cévy. 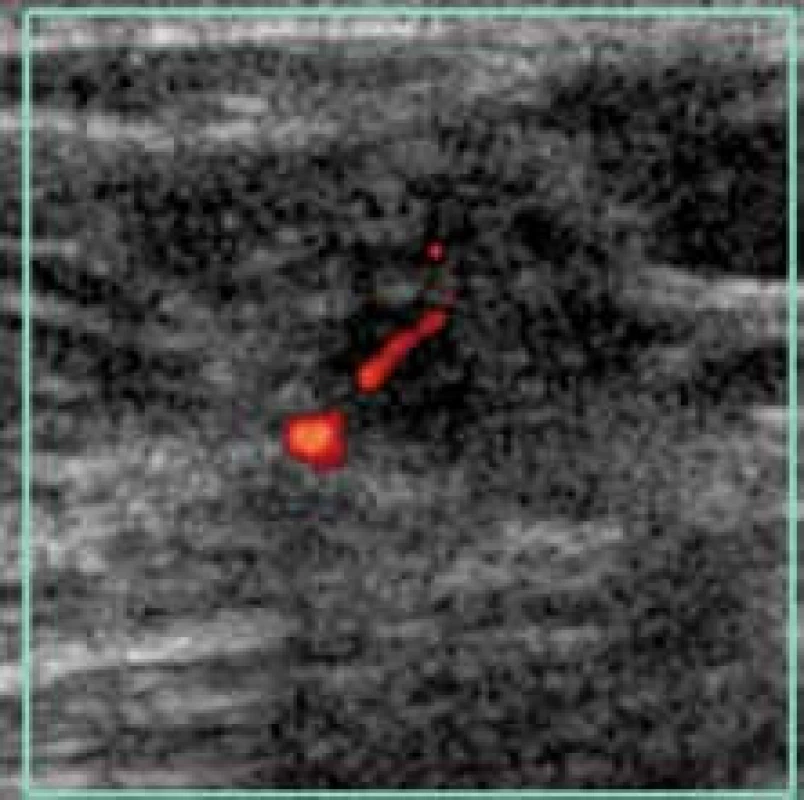
Distribuce cév (nativní ultrazvuk) u benigních lézí:
- marginální cévy u 19 lézí (30,2 %)
- penetrující cévy u 7 lézí (11,1 %)
- centrální cévy u jedné léze (1,6 %)
Distribuce cév při kontrastním vyšetření u benigních lézí: (CEUS SONOVUE®)
- marginální cévy u 51 lézí (81 %)
- penetrující cévy u 24 lézí (38,1 %)
- centrální cévy u 2 lézí (3,2 %)
Rozdíl typu vaskularity (CEUS SONOVUE®) mezi benigními a maligními ložisky je statisticky signifikantní < 0,001. Většina karcinomů mléčné žlázy při CEUS byla hypervaskulárních 51/ 63 (81 %), pouze 4 karcinomy byly vaskulární [13 – 21].
Naopak pouze 3 z 63 benigních lézí byly hypervaskulární a 47 benigních lézí bylo avaskulární. Tento rozdíl je hodnocen jako statisticky signifikantní < 0,001.
Kongesce kontrastu na periferii lézí (peripheral rim) byl pozorován pouze u karcinomů. Tento znak je statisticky signifikantní 53/ 63 (84,1 %) < 0,001.
Difuzní enhancement u karcinomů v pozdní fázi byl pozorován u 53/ 63 karcinomů (84,1 %), < 0,001.
Detailní analýza je uvedena v tab. 1 a tab. 2.
Table 1. Vaskularita 63 maligních a 63 benigních lézí mléčné žlázy. 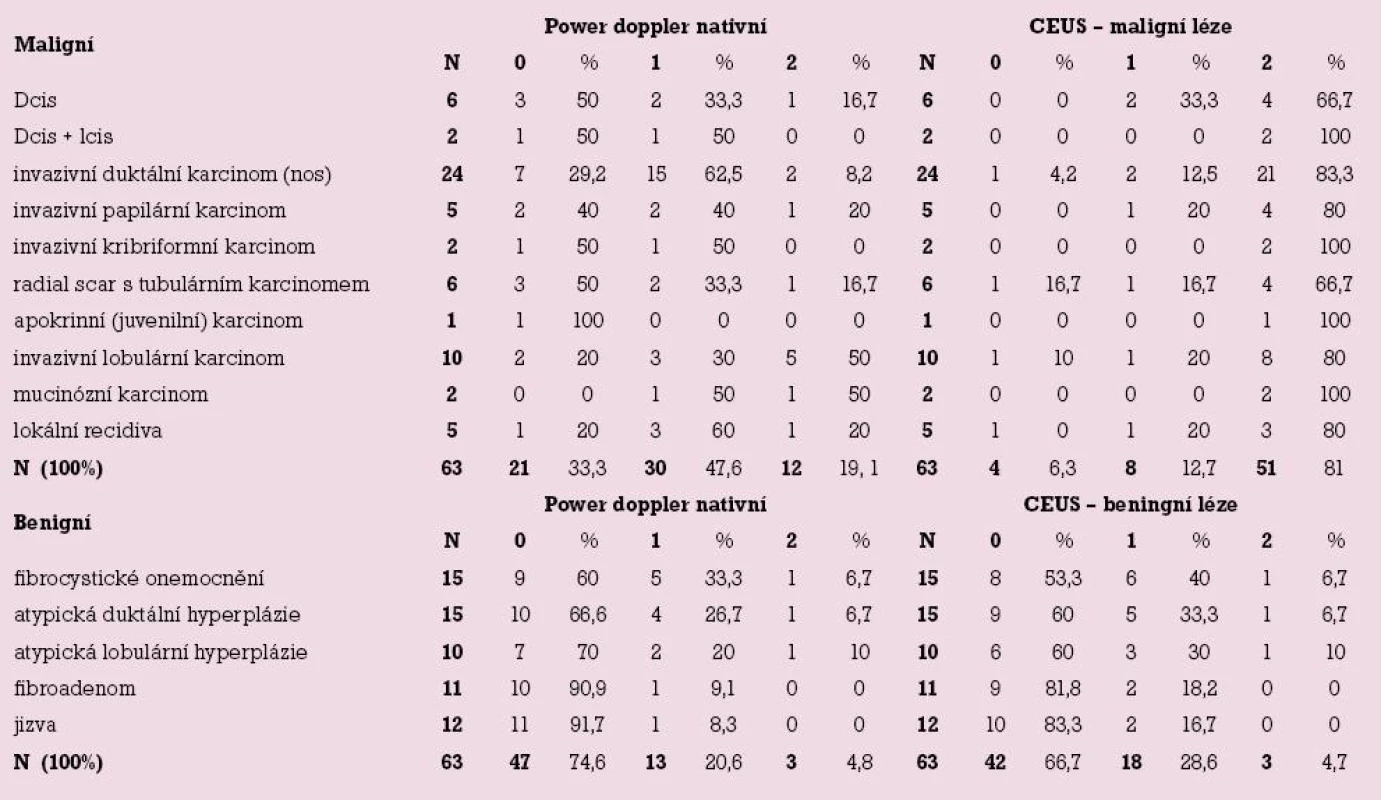
Table 2. Typ vaskularity 126 nehmatných lézí mléčné žlázy. 
Ve skupině maligních nálezů v mléčné žláze (n = 63) je průkazný vyšší počet cév, jedinečná cévní morfologie a cévní toky nádorových cév. Senzitivita vyšetření byla 98 % a specificita 96 % (p < 0,001).
Velikost nádoru
Velikost nádorů (benigních a maligních) získaná při mammografickém, nativním sonografickém a CEUS vyšetření byla srovnána s definitivní velikostí stanovenou patologem (největší rozměr).
Mammografie podhodnotila velikost karcinomů mléčné žlázy u 27 ze 63 karcinomů (42,9 %), nativní ultrazvuk u 39 karcinomů (61,9 %) a CEUS u 9 karcinomů [3 karcinomy této skupiny se prezentovaly pouze výskytem maligního typu mikrokalcifikací bez jádrového stínu (33,3 %)] (14,3 %) z celkového počtu 63 karcinomů.
Velikost maligních lézí při CEUS byla minimálně o 30 % větší než při nativním ultrazvukovém vyšetření a tato změna velikosti byla pozorovaná u 56 karcinomů (88,8 %). Naopak u benigních lézí taková změna velikosti nebyla pozorovaná.
CEUS byl signifikantně (p < 0,001) nejpřesnější metodou ke stanovení velikosti maligní léze, a poskytuje tak validní informace nutné pro TNM klasifikaci.
Názorný příklad je uveden na obr. 13.
Image 13. Již ve třetí sekundě po aplikaci kontrastní látky (SONOVUE) je průkazný výrazný cévní kmen - na obrázku vlevo nahoře. 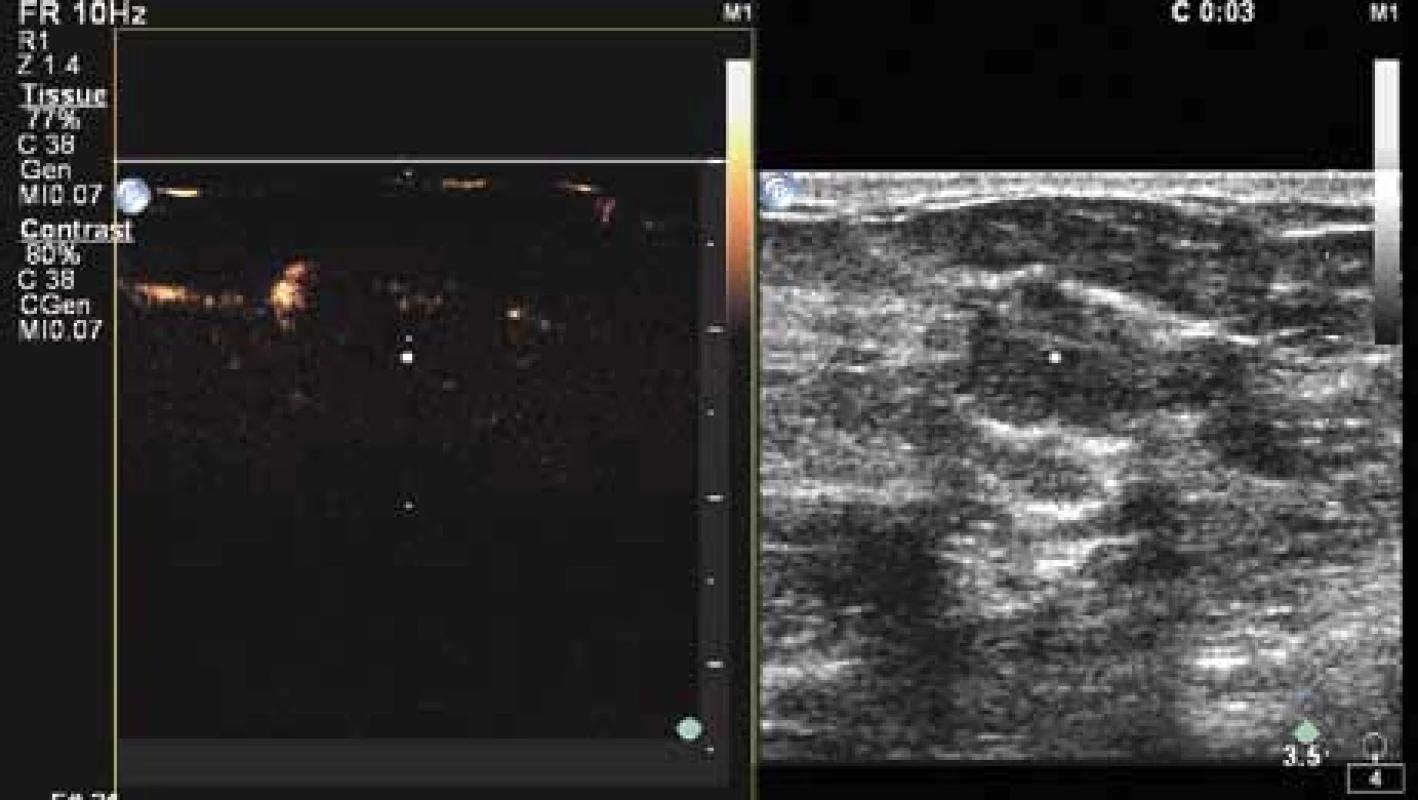
V. Contrast enhanced ultrasound (CEUS – kontrastní ultrazvuk)
Celkově 2,4 ml kontrastu SONOVUE® s proplachem 5 ml fyziologického roztoku bylo aplikováno 126 pacientkám (63 maligních a 63 benigních ) s následným histologickým vyšetřením v obou skupinách žen. Kontrastní harmonické vyšetření bylo provedeno na přístroji iU22 Phillips lineární sondou L 9 – 3 MHz s microvascular imaging software a QLAB® softwarem [22 – 28]. QLAB kvantifikační automatizovaný software zaručuje spolehlivě objektivizaci vyšetření. Nízký mechanický index (MI) 0,07 byl užíván, aby bylo zabráněno časné destrukci mikrobublin a získání optimální kvality obrazu. Vzhledem k fyziologii vidění (čípky retiny) byl užíván oranžový filtr při CEUS.
Definice: ROI (the region of interest) zaručuje konzistenci a hodnověrnost akustických měření a snižuje náročnost obsluhy přístroje manuálně. V této studii byl ROI = 5 mm2 (automatická velikost) umístěný na okraj a centrum léze a dále 1 cm od okraje léze – referenční měření, což bylo problematické ve skupině lézí ≅ 5 mm.
Microvascular imaging (MVI) je post procesingová softwarová mapa sloužící k vyznačení průběhu/ přibývání kontrastu. Tyto změny jsou zpracovány obraz po obraze s potlačením pozadí, což vede k dramaticky přehlednějšímu zviditelnění cév.
Bylo obtížné dodržení podmínek této studie v případě multifokálního karcinomu in situ mléčné žlázy v 1/ 8 (12,5 %) a u dvou případů invazivního lobulárního karcinomu (2/ 10).
Průběh vyšetření maligního ložiska mléčné žlázy je uveden na obr. 13 – 16.
Image 14. V šesté sekundě již dobře patrné penetrující cévy v karcinomu. Dobře patrný nepoměr velikosti karcinomu nativně (pravý obrázek) a po aplikaci kontrastu. 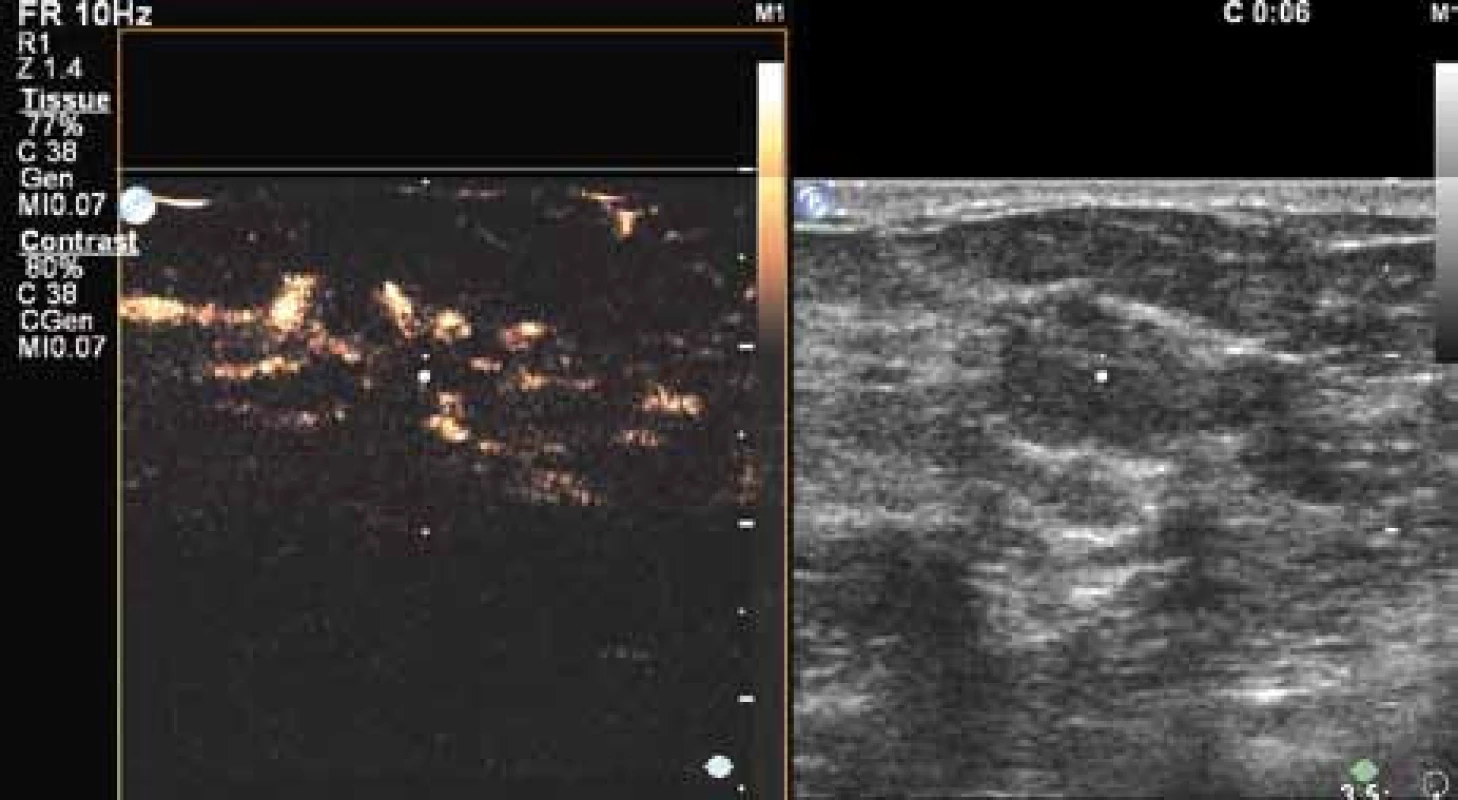
Image 15. Desátá sekunda vyšetření. Velmi dobře patrné marginální, centrální i penetrující cévy v karcinomu. Současně však dochází k rychlému vymývání kontrastní látky (wash out), což je typické pro karcinomy. 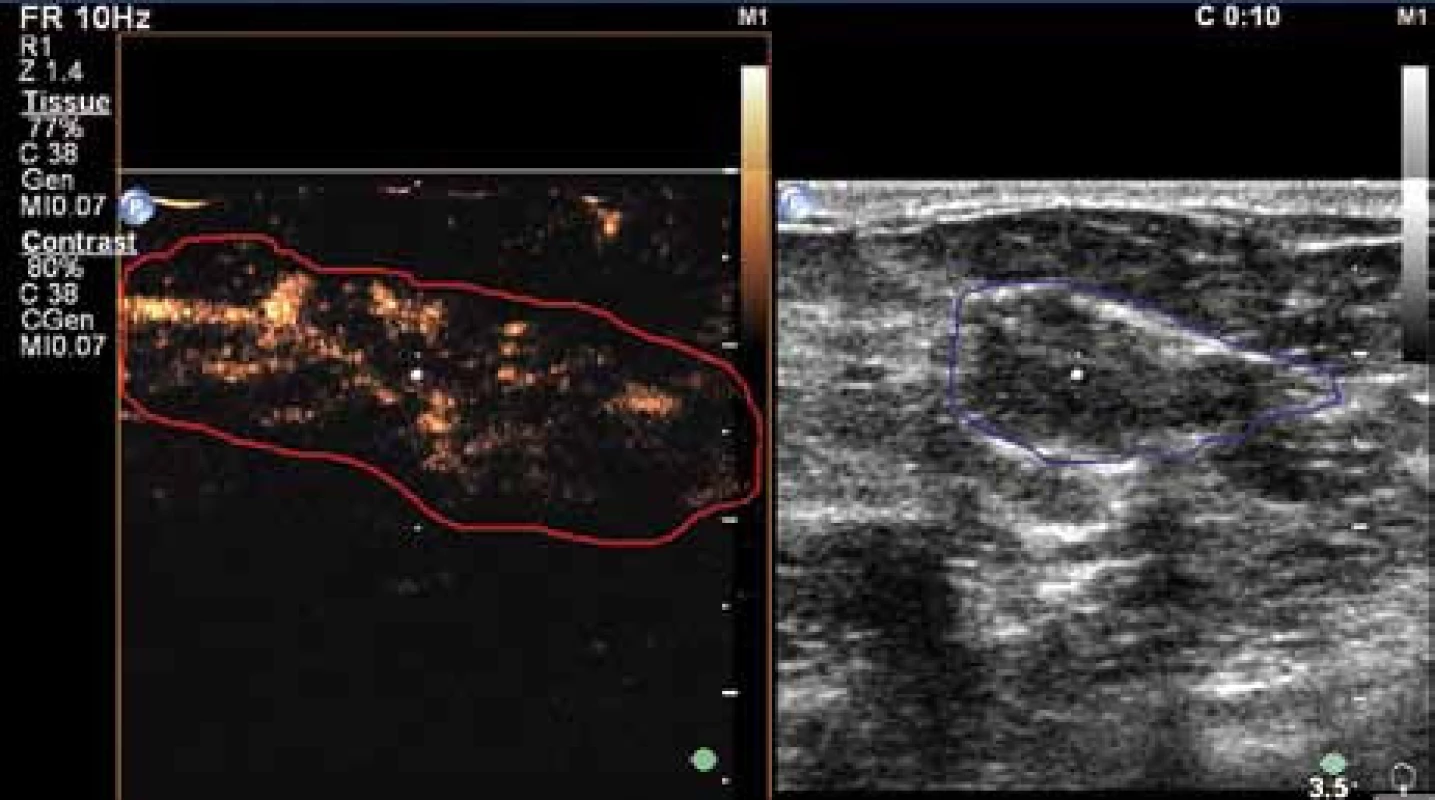
Image 16. Perfuze karcinomu ve 23. sekundě vyšetření. Karcinom již vykazuje difuzní enhancement. Nadále velmi dobře patrný výrazný cévní kmen (na obrázku vlevo nahoře). 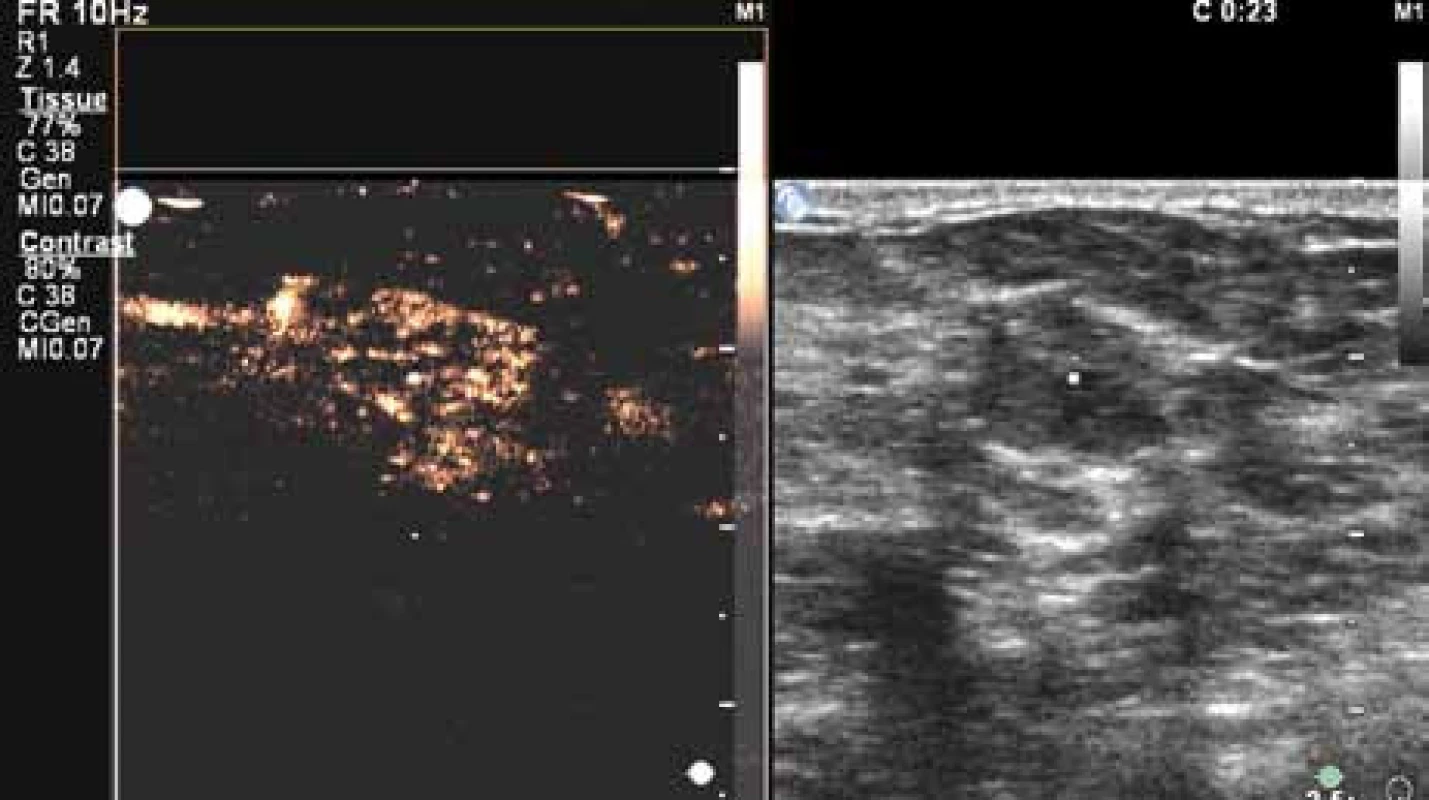
QLAB výsledky, testy a zhodnocení
Srovnání nádorové a normální tkáně mléčné žlázy – periferní a centrální cévy jsou uvedeny v tab. 3.
Table 3. Výsledky QLAB<sup>®</sup> měření. 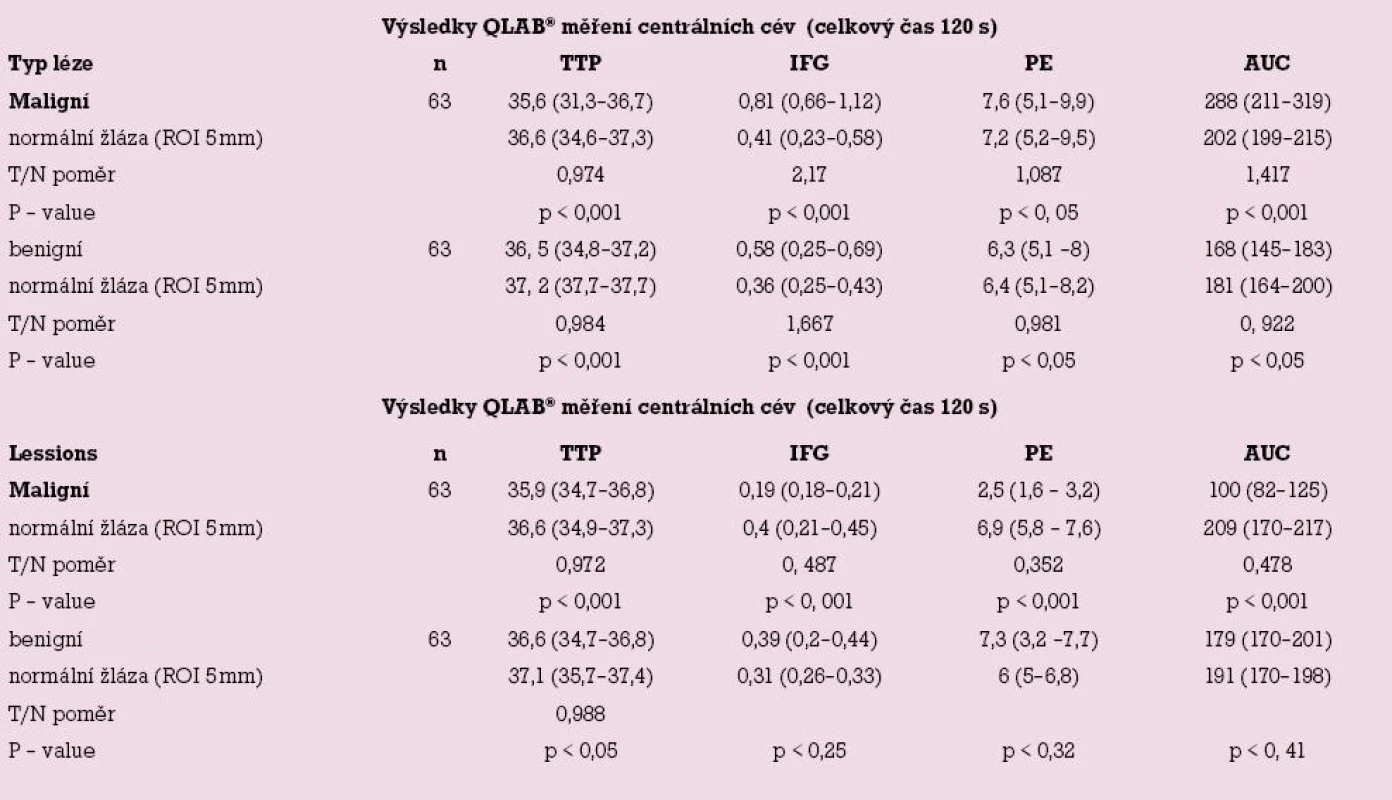
Ukázka hodnocení získaných výsledků je uvedena na obr. 17 – 18.
Image 17. Typický obraz karcinomu: překotné sycení, vysoký peak enhancement, nápadně rychlý wash out time. 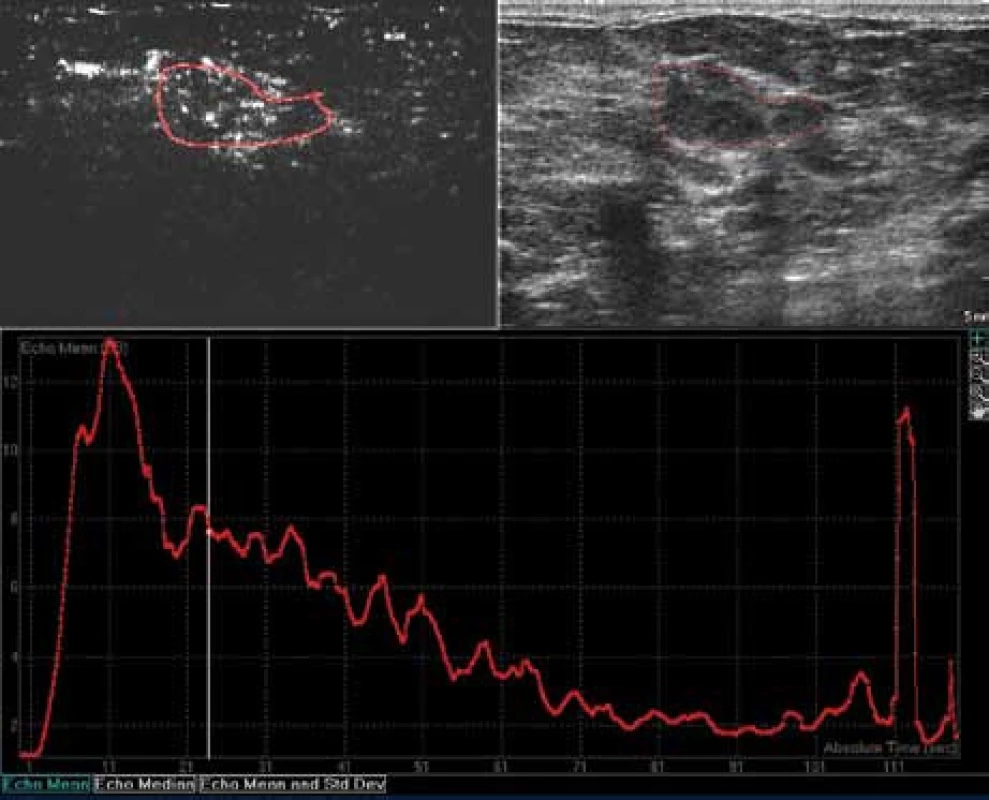
Image 18. Maligní křivka zobrazena červeně, normální tkáň mléčné žlázy žlutě. Je možná objektivizace vyšetření - karcinomy mléčné žlázy mají peak enhancement v hodnotě vždy vyšší než 9 dB. 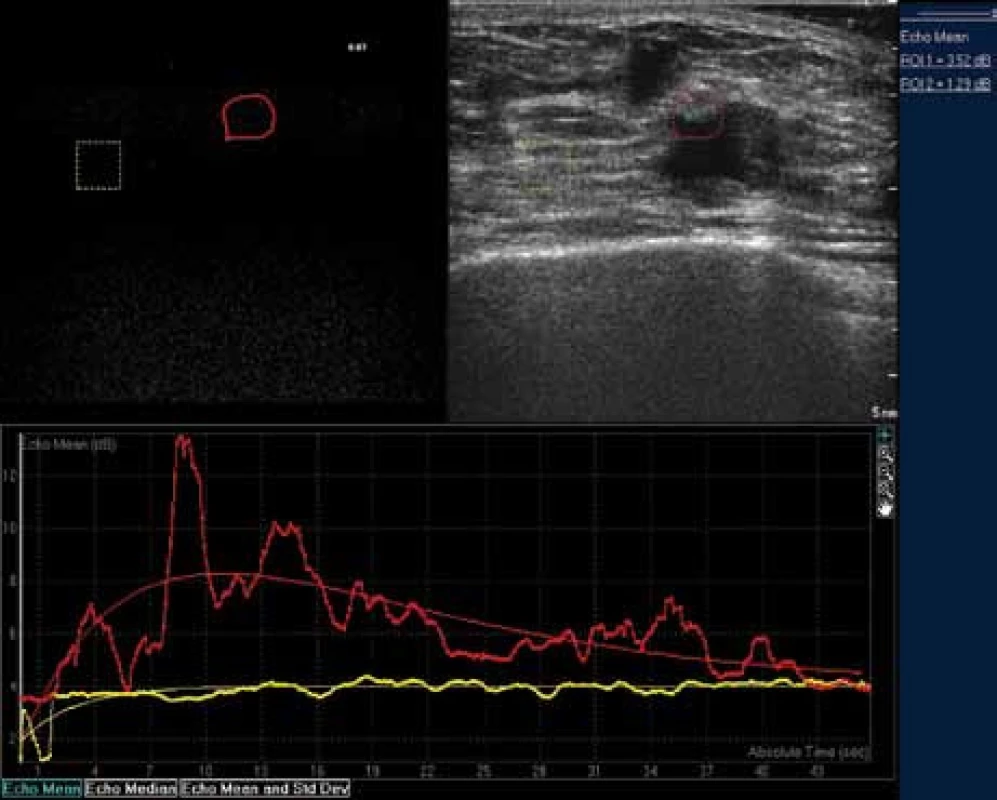
1. Periferní cévy
Time to Peak (TTP) maligních nádorů byl signfikantně redukovaný a Area Under Curve (AUC) a In flow Gradient (IFG) byly signifikantně zvýšeny v porovnání s normální tkání mléčné žlázy – 1 cm od okraje léze (< 0,001). Peak Enhancement byl na hladině významnosti < 0,005 zvýšený v porovnání s okolní tkání.
U benigních tumorů byl time to peak signifikantně snížený a in flow gradient signifikantně zvýšený. peak enhancement společně s area under curve byly snížené v porovnání s okolní tkáni na hladině významnosti p < 0,05.
2. Centrální cévy
U maligních tumorů byly time to peak, in flow gradient, area under curve a peak enhancement signifikantně snížené (< 0,001) v porovnání s okolní tkání.
U benigních tumorů byl time to peak a area under curve signifikantně snížené(< 0,005), in flow gradient a peak enhancement byly mimo hranici signifikance vzhledem k okolní tkáni mléčné žlázy.
3. Wash out time (WOT), out flow time
Wash out time je definovaný jako snížení intenzity na polovinu v závislosti na čase od dosažení peak enhancement. Vyšší (rychlý) wash out kontrastu byl typický pro maligní léze (p < 0,001).
Výsledky měření jsou uvedeny v tab. 4.
Velmi rychlý wash out time je pravděpodobně způsobený přítomnými A V zkraty. Velmi rychlý wash out time (< 45 s po aplikaci SONOVUE®) byl zaznamenán u 4 ze 63 maligních lézí mléčné žlázy (6,3 %). Wash out time v hranicích > 45 a < 55 s byl zaznamenán u 26 malignit (41,3 %), v hranicích > 55 a < 65 s u 21 karcinomů (33,3 %), v hranicích > 65 a < 75 s u 11 malignit (17,5 %) a v hranicích > než 75 s u 1 ze 63 malignit (1,6 % – neinvazivní karcinom mléčné žlázy, grade 1).
Naopak, u 53 ze 63 benigních lézí mléčné žlázy vykazovalo wash out time > 75 s (84,1 %). Pouze ve 3 případech duktální a lobulární atypické hyperplazie byl wash out time zaznamenán v hranicích > 55 a < 65 s (4,8 %), dále v jednom případě fibrozně cystického onemocnění, 3 případech duktální atypické hyperplazie a 2 případech lobulární atypické hyperplazie byl wash out time zaznamenán v hranicích > 65 a < 75 s (11,1 %).
Rozdíl jak mezi benigní/ maligní lézí, tak i normálním parenchymem byl statisticky významný (p < 0,001).
4. Srovnání maligních a benigních nálezů
Statisticky významné rozdíly na hladině (p < 0,001) u maligních lézí byly zaznamenány u:
- typ vaskularity.
- hypervaskularizace při CEUS.
- difuzní enhancement v pozdní fázi.
- non homogenní nádorová perfuze typická u karcinomů > 18 mm a léčené karcinomy.
- MVI (microvascular imaging) dokonale zobrazuje mosaic patterns a typicky a jedinečně kongesci kontrastu na periferii karcinomů. (Neoangiogeneze je typická a charakteristická pouze na periferii maligních lézí mléčné žlázy). Jeho význam v diagnostice na obr. 19.
- velikost při CEUS (nápadně větší než při nativním ultrazvukovém vyšetření).
- zvýšený in flow gradient (IFG) (periferně).
- area under curve (AUC) větší (periferně).
- snížený time to peak (TTP) (periferně).
- zvýšený in flow gradient (IFG) (periferně).
- u centrálních cév byly snížené IFG, AUC a peak enhancement vzhledem k normální tkáni.
- wash out time je (WOT/ out flow) velmi rychlý.
- in situ karcinomy mají delší plateau než invazivní karcinomy.
- u karcinomů in situ a low grade invazivních karcinomů mléčné žlázy byl pozorován lehce zvýšený TTP.
- všechna měření jsou závislá na věku, histologickém typu karcinomu a grade, stejně jako na přítomnosti hormonálních receptorů (p < 0, 005).
Image 19. Zdánlivě drobné ložisko maligní vizáže (na obrázku vlevo nahoře), MVI prokazuje minimálně trojnásobnou velikost. 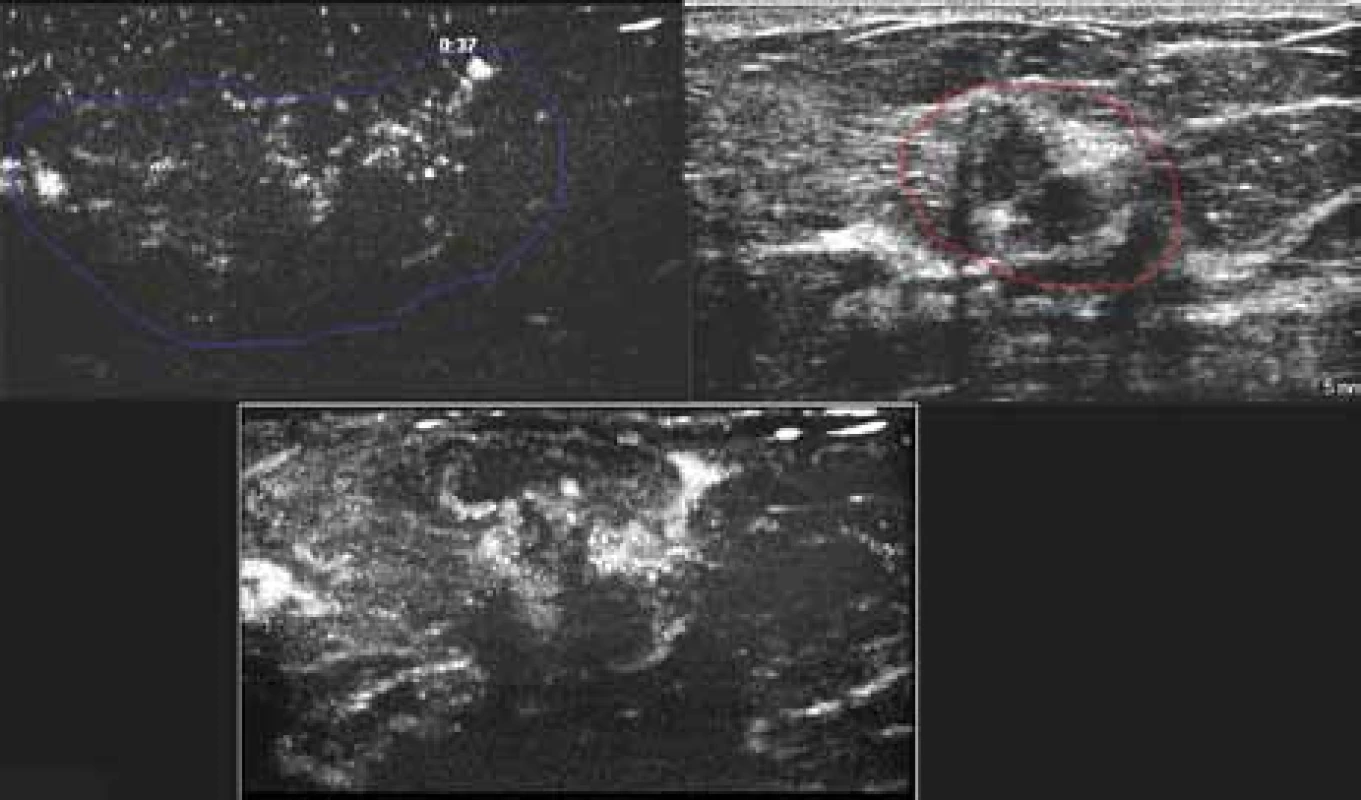
Statisticky významné rozdíly na hladině (p < 0,001) u benigních lézí byly zaznamenány u:
- fibroadenomy jsou přesným opakem karcinomů mléčné žlázy (zvýšený IFG a AUC v centrální části).
- většina fibroadenomů měla pouze periferní perfuzní lem.
- pouze u jednoho fibroadenomu bylo zaznamenáno difuzní enhancement v pozdní fázi > 180 s.
- fibróza, tuková nekróza a jizva jsou typicky avaskulární léze, mají snížený AUC.
- fibrocystické onemocnění (zvláště se zvýšeným rizikem vzniku karcinomu mléčné žlázy) zvyšuje hodnoty cévních toků, což může být ovlivněno hormonálním statusem ženy a také často přítomnou zánětlivou složkou u tohoto onemocnění mléčné žlázy.
- atypická duktální hyperplazie, atypická lobulární hyperplazie nevykazují vnitřní perfuzi.
- time to peak je delší (longer range).
- typické je delší fáze plateau.
- méně příkrý gradient mezi časnou a pozdní fází wash out.
5. Limitace studie
- analýza CEUS byla provedena po nativním sonografickém vyšetření (lokalizace léze, její charakterizace...).
- mammografie byla provedena před sonografickým vyšetřením u žen > 40 let.
- v případě průkazu ložiskové léze detekované nativním ultrazvukovým vyšetřením byla doplněna mammografie + CEUS – ve skupině žen < 40 let.
- rozdíly mezi tumory a normální tkání mléčné žlázy jsou velmi jemné, ale rozdíly jsou signifikantní. Je nutno počítat s faktem, že maligní nádory ovlivňují cévní architektoniku celé mléčné žlázy (měření normální tkáně!).
- všechny uvedené malignity této studie představují inkoherentní skupinu vzhledem k věku, uložení karcinomu, histologii, steroidnímu statusu a grade.
- benigní léze uvedené ve studii jsou směsicí nesouvisejících onemocnění mléčné žlázy.
- diagnostická diferenciace mezi benigní/ maligní lézí byla svízelná u malých lézí (≤ 5 mm), dále v případě tukové nekrózy se semimaligními mikrokalcifikacemi a v případě jizvy (po léčbě karcinomu) s postaktinickou fibrózou.
Závěr
Předložené výsledky studie potvrzují možnost rozlišení benigní a maligní léze mléčné žlázy (cíl studie); senzitivita byla 98 % a specificita 92 %.
Výsledky prokazují, že SONOVUE® CEUS s harmonickým zobrazovacím modem a QLAB softwarem signifikantně zlepšují možnost charakterizace fokálních lézí mléčné žlázy a CEUS může být implementován do klinické praxe, což by vedlo ke snížení počtu nákladných dalších diagnostických kroků v mammodiagnostice.
S největší pravděpodobností bude CEUS jedinečnou technikou schopnou včasného zhodnocení efektu neoadjuvantní chemoterapie.
MUDr. Karel Dvořák, CSc.1
prof. MUDr. Vlastimil Válek, CSc., MBA2
MUDr. Josef Patera5
MUDr. Martina Třináctá1
MUDr. Eva Jandáková3
doc. MUDr. Zdeněk Pačovský, CSc.4
MUDr. Marie Kuzárová 1
MUDr. Radka Jakubcová1
MUDr. Jakub Foukal1
Fakultní nemocnice Brno, Česká republika
1 Mammodiagnostické oddělení radiologické kliniky
2 Radiologické oddělení Fakultní nemocnice
3 Oddělení patologie Fakultní nemocnice
4 Chirurgické oddělení Fakultní nemocnice
5 Soukromé mammologické centrum
Sources
1. Passe TJ, Bluemke DA, Siegelman SS. Tumor angiogenesis: tutorial on implications for imaging. Radiology 1997; 203(3): 593 – 600.
2. Cosgrove D. Angiogenesis imaging ultrasound. Br J Radiol 2003; 76 : 43 – 49.
3. Casparini G, Hariss AL. Clinical importance of the determination of tumor angiogenesis in breast carcinoma: much more than a new prognostic tool. J Clin Oncol 1995; 13(3): 765 – 782.
4. Dilantha B, Ellegala, Howard Leong‑Poi, Joan E Carpenter et al. Imaging Tumor Angiogenesis with Contrast Ultrasound and Microbubbles Targeted to avb3. circ. ahajournals.org/ cgi/ 2003;108/ 3/ 336.
5. Gosgrove DO, Kedar RP, Bamber JC et al. Breast diseases: Color Doppler US in differential diagnosis. Radiology 1993; 189(1): 99 – 104.
6. Madjar H, Prömpeler HJ, SauerbreiW et al. Color Doppler flow criteria of breast lesions. Ultrasound Med Biol 1994; 20(9): 849 – 858.
7. van Esser S, Veldhuis WB, van Hillegersberg R et al. Accuracy of contrast ‑ enhanced breast ultrasound for pre‑operative tumor. Cancer Imaging 2007; 7 : 63 – 68.
8. Kolb TM, Lichy J, Newhouse JH. Comparison of the performance of screening mammography, physical examination, and breast US and evaluation of factors that influence them: an analysis of 27,825 patient evaluations. Radiology 2002; 225(1): 165 – 175.
9. Alamo I, Fischer U. Contrast ‑ enhanced color Doppler ultrasound characteristics in hypervascular breast tumors: comparison with MRI. Eur Radiol 2001; 11(6): 970 – 977.
10. Reinikainen H, Rissanen T, Paivansalo M. B ‑ mode, power Doppler and contrastenhanced power Doppler ultrasonography in the diagnosis of breast tumors. Acta Radiol 2001; 42(1): 106 – 113.
11. Milz P, Lienemann A, Kessler M et al. Evaluation of breast lesions by power Doppler sonography. Eur Radiol 2001; 11(4): 547 – 554.
12. Stuhrmann M, Aronius R, Schietzel M. Tumor vascularity of breast lesions: potentials and limits of contrast enhanced Doppler sonography. AJR Am J Roentgenol 2000; 175(6): 1585 – 1589.
13. Moon WK, Im JG, Noh DY et al. Nonpalpable breast lesions: evaluation with power Doppler US and a microbubble contrast agent – initial experience. Radiology 2000; 217(1): 240 – 246.
14. Kedar RP, Cosgrove D, McCready VR et al. Microbubble contrast agent for color Doppler US:effect on breast masses – work in progress. Radiology 1996; 198(3): 679 – 686.
15. Aichinger U, Schulz ‑ Wendtland R, Krämer S. Scar or recurrence – comparison of MRI and color ‑ coded ultrasound with echo signal amplifiers. RöFo Fortschr Röntgenstr 2002; 174(11): 1395 – 1401.
16. Pudszuhn A, Marx Ch, Malich A et al. Prospective analysis of quantification of contrast media enhanced power Doppler sonography of equivocal breast lesions. RöFo Fortschr Röntgenstr 2003; 175(4): 495 – 501.
17. Schroeder RJ, Bostanjoglo M, Rademaker J et al. Role of power Doppler techniques and ultrasound contrast enhancement in the differential diagnosis of focal breast lesions. Eur Radiol 2003; 13(1): 68 – 79.
18. Wible JH, Wojdyla JK, Hughes MS et al. Effects of transducer frequency and output power on the ultrasonographic contrast produced by Optison using fundamental and harmonic imaging techniques. J Ultrasound Med 1999; 18(11): 753 – 762.
19. Huber S, Delorme S, Zuna I. Dynamic assessment of contrast medium enhancement in Doppler ultrasound imaging, Current status. Radiology 1998; 38(5): 390 – 393.
20. Baz E, Madjar H, Reuss C et al. The role of enhanced Doppler ultrasound in differentiation of benign vs. malignant scar lesion after breast surgery for malignancy. Ultrasound Obstet Gynecol 2000; 15(5): 377 – 382.
21. Moon WK, Im JG, Noh DY. Nonpalpable Breast Lesions: Evaluation with Power Doppler US and a Microbubble Contras Agent – Initial Experience. Radiology 2000; 217(1): 240 – 246.
22. Milz P, Lienemann A, Kessler M. Evaluation of Brest lesions by power Doppler sonography. Eur Radiol 2001; 11(4): 547 – 554.
23. Kook SH, Park HW, Lee YR et al. Evaluation of solid Brest lesions with power Doppler sonography. J Clin Ultrasound 1999, 27(5): 231 – 237.
24. Birdwell RL, Ikeda DM, Jeffrey SS. Preliminary experience with power Doppler imaging of solid breast masses. Am J Roentgenol 1997; 169(3): 703 – 707.
25. Gökhan AKBAŞ, Ayşe MURAT AYDIN, Hakan ARTAŞ, Erkin OĞUR: Evaluation of Solid Breast Masses With Power Doppler Sonography, 2008, Cilt 13, Sayı 2, Sayfa(lar) 102 – 106.
26. Sarraco A, Aspelin P, Leifland K et al. Real time contrast enhanced ultrasound harmonic imaging on characterizing breast lesions. Röntgenveckan 2008, Abstract 032, Uppsala.
27. Barnard S, Leen E, Cooke T. A contrast ‑ enhanced ultrasound of benign and malignant breast tissue. S Afr Med J 2008; 98(5): 386 – 391.
28. Mankoff DA, Dunnwald LK, Gralow JR. Blood Flow and Metabolism in Locally Advanced Breast Cancer: Relationship to Response to Therapy. J Nucl Med 2002; 43(4): 500 – 509.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicine
Article was published inPractical Gynecology

2009 Issue 4-
All articles in this issue
- Kontrastní ultrazvuk (CEUS) nehmatných lézí prsu
- Dopplerometrie ductus venosus
- Prognóza žen s mikrometastázou karcinomu prsu v sentinelové uzlině
- Molekulovo- genetická analýza tumorsupresorových génov PTEN a TP53 u pacientky s karcinómom endometria
- Biologická léčba karcinomu prsu
- Tradiční peruánská medicína v léčbě neplodnosti
- Rýchla prenatálna diagnostika chromozómových aneuploidií
- Mikrobiologické vlastnosti kmenů endogenní vaginální flóry asymptomatických žen reprodukčního věku
- Practical Gynecology
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Dopplerometrie ductus venosus
- Prognóza žen s mikrometastázou karcinomu prsu v sentinelové uzlině
- Kontrastní ultrazvuk (CEUS) nehmatných lézí prsu
- Mikrobiologické vlastnosti kmenů endogenní vaginální flóry asymptomatických žen reprodukčního věku
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career