-
Medical journals
- Career
Uskřinutá metastáza jako první manifestace vzácného sarkomu
Authors: M. Pekař 1,2; Z. Janda 3; K. Franková 4
Authors‘ workplace: Centrum cévní a miniinvazivní chirurgie, Nemocnice AGEL Třinec-Podlesí 1; Fyziologický ústav, Lékařská fakulta, Masarykova Univerzita, Brno 2; Chirurgie, Nemocnice AGEL Ostrava-Vítkovice 3; Patologie, Nemocnice AGEL Nový Jičín 4
Published in: Rozhl. Chir., 2023, roč. 102, č. 1, s. 28-31.
Category: Case Report
doi: https://doi.org/10.33699/PIS.2023.102.1.28–31Overview
Desmoplastický tumor z malých okrouhlých buněk je podskupinou měkkotkáňových sarkomů. Jedná se o raritní onemocnění, kdy od jeho objevení v roce 1989 byly v literatuře popsány jenom stovky případů. Vzhledem k ojedinělé incidenci tumoru zůstává toto onemocnění neznámým v běžné praxi. Vyskytuje se nejčastěji u mužů v mladém věku. Jeho prognóza je závažná a průměrné přežití pacientů se pohybuje od 1,5 do 2,5 roku. Možností léčení je chirurgická resekce, chemo-, radio - a cílená terapie. Naše práce prezentuje kazuistiku 40letého pacienta, u kterého byla první manifestací onemocnění uskřinutá epigastrická kýla, jejímž obsahem bylo omentum s metastázou sarkomu. Byla provedena resekce uskřinuté části omenta s metastázou a biopsie z dalšího ložiska intraabdominálně. Vzorky z biopsie byly odeslány k histopatologickému hodnocení. Pro generalizaci onemocnění nebyl další chirurgický výkon indikován a byla zvolena systémová paliativní chemoterapie v režimu VDC-IE. V čase odevzdání rukopisu přežívá pacient 6 měsíců od operace.
Klíčová slova:
kýla – metastáza – sarkom – desmoplastický tumor z malých okrouhlých buněk
ÚVOD
Desmoplastický tumor z malých okrouhlých buněk (anglicky – desmoplastic small round cell tumor – DSRCT) je vzácným neoplastickým onemocněním s velmi agresivním chováním. Poprvé bylo popsáno v roce 1989 Williamem L. Geraldem a Juanem Rosaiem, kteří ho pak v roce 1991 i formálně pojmenovali [1]. Nejčastěji roste v dutině břišní a malé pánvi, může být ale vzácně přítomen i extraabdominálně, například v ledvině, ováriu, testes, krční lymfatické uzlině, subkutánně, játrech, intraspinálně, příušní žláze, submaxilární žláze a jinde [2]. Incidence se pohybuje mezi 0,2 a 0,74 případu na milion lidí za rok [3−5]. Nejčastěji postihuje mladé dospělé ve věku 20 až 30 let [6] s predominancí mužů k ženám 4 : 1 [7]. Nejsou známy žádné rizikové faktory vztahující se ke vzniku tohoto onemocnění a patogeneze onemocnění zůstává nejasná. Tumor je charakterizován translokací chromozomů t (11;22) (p13; q12), která vede k fúzi genů EWS a WT1. Výsledkem je ztráta regulace tzv. zinkových prstů s aktivací transkripce cílových genů, jako je receptor růstového faktoru, destičky derivující růstový faktor, receptor pro inzulinu podobný růstový faktor a receptor pro epidermální růstový faktor [8−9]. Tento stav vede následně ke tkáňové diferenciaci, proliferaci, adhezi a metastázování nádorových buněk.
KAZUISTIKA
40letý muž, s gastroezofageální refluxní chorobou na terapii inhibitorem protonové pumpy, byl ošetřen v naší chirurgické ambulanci pro bolestivou rezistenci na břiše. Udával, že si již před delší dobou všiml vyklenutí na břichu, nyní pociťoval dva měsíce zatvrdnutí a bolesti v oblasti rezistence, hlavně při kýchnutí, byl bez poruchy střevní pasáže, bez dalších symptomů. Klinicky byla v oblasti epigastria hmatná nereponibilní, tvrdá rezistence charakteru uskřinuté liparokély velikosti 8×6×5 cm. Na pohmat byla rezistence bolestivá, zbytek břicha byl prohmatný, měkký, nebolestivý, bez peritoneálního dráždění.
Klinicky bylo tedy vysloveno podezření na uskřinutou kýlu. Laboratorně nebyla přítomná elevace leukocytů ani CRP. Z paraklinických vyšetření byl proveden rtg nativ břicha bez pozoruhodností a ultrazvuk břicha, na kterém byla popsaná uskřinutá kýla s obsahem připomínajícím tenkou kličku s volnou tekutinou a hypoechogenním útvarem nejasné etiologie. Pacient byl indikován akutně na sál k operační revizi.
Peroperačně byl vypreparován kýlní vak s překvapivým nálezem po jeho otevření. Obsahem kýlního vaku bylo uskřinuté omentum, které mělo v sobě bílou elastickou rezistenci ovoidního tvaru velikosti 3×2×2 cm. Bylo vysloveno podezření na metastatický nádorový proces. Po nastřihnutí kýlní branky jsme se rozhodli pokračovat v rozšíření operační rány ve smyslu explorativní horní střední laparotomie. Celé omentum bylo poseto bílými metastázami velikosti à 2 cm (Obr. 1), dále byly metastázy velikosti à 1,5 cm i po celém retroperitoneu, v malé pánvi, na játrech i na peritoneu přední stěny břišní. Větší tumorózní hmota se nacházela na mesoappendixu a na části colon ascendens. Střeva byla kolabována, peristaltika pří tomná, bez známek stenotizace lumen střev. Četné rezistence byly hmatné i v játrech. Provedli jsme resekci uskřinuté části omenta s metastázou a dále biopsii z dalšího ložiska intraabdominálně. Vzorky z biopsie byly odeslány k histopatologickému hodnocení. Pro generalizaci onemocnění nebyl nyní další výkon indikován.
Image 1. Peroperační nález Omentum poseto metastázami (zelené šipky).
Fig. 1. Intraoperative finding Omentum covered with metastases (green arrows).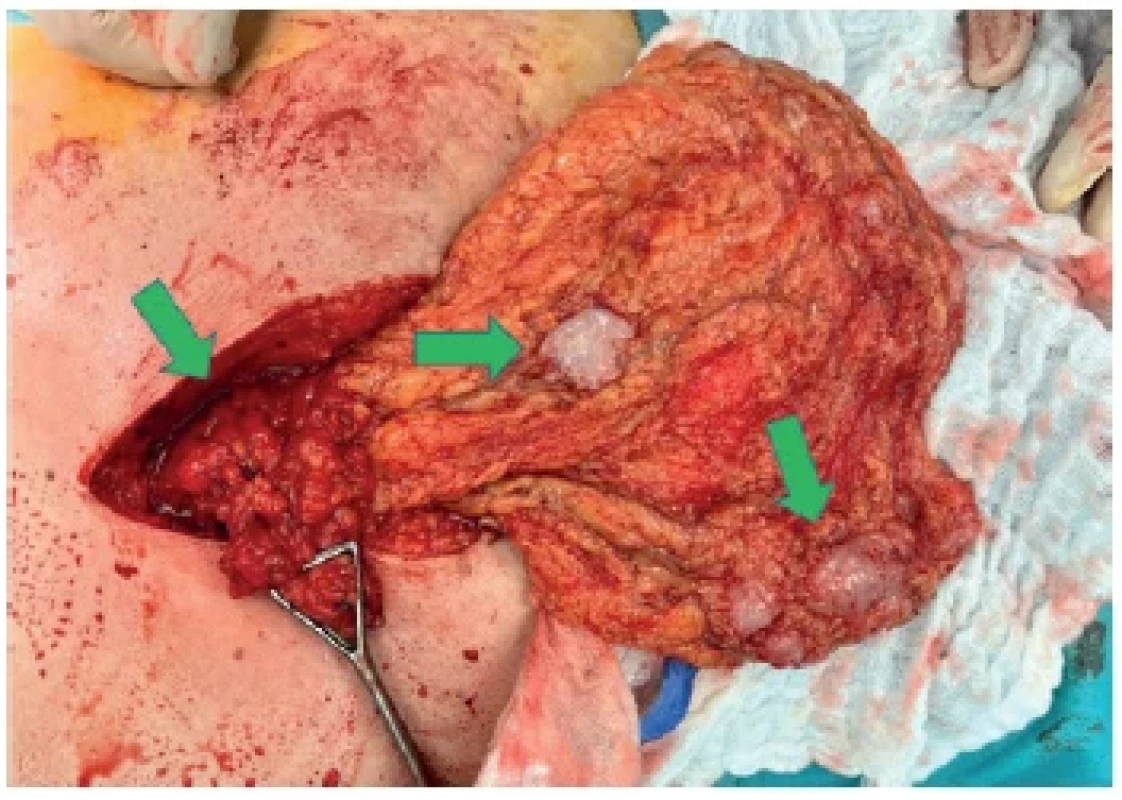
Pooperačně měl pacient standardní hojení rány a byl v klinicky stabilizovaném stavu propuštěn do ambulantní péče 7. pooperační den. Bylo doplněno akutně CT břicha a malé pánve s nálezem odpovídajícím peroperačnímu nálezu s masivním tumorem colon ascendens, četnými metastázami jater, omenta, peritonea (Obr. 2 a 3). Onkomarkery Ca19-9 a CEA byly negativní.
Image 2. Stagingové CT vyšetření, předozadní rekonstrukce Největší tumorozní masa je v oblasti colon ascendens (zelená šipka).
Fig. 2. Staging CT examination, anteroposterior reconstruction The largest tumorous mass is situated in the area of the colon ascendens (green arrow).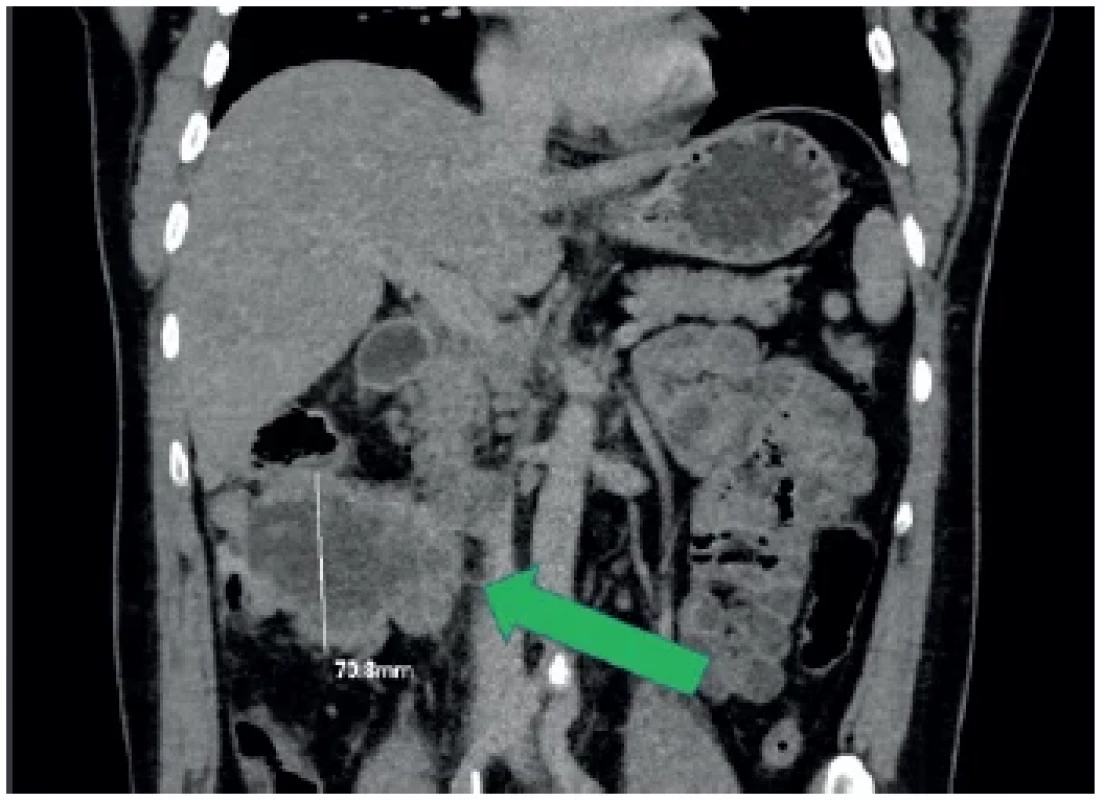
Image 3. Stagingové CT vyšetření, boční rekonstrukce Viditelné metastázy jater a tumorózní masa v oblasti colon ascendens (zelené šipky).
Fig. 3. Staging CT scan, lateral reconstruction Visible liver metastases and tumor mass in the area of the colon ascendens (green arrows).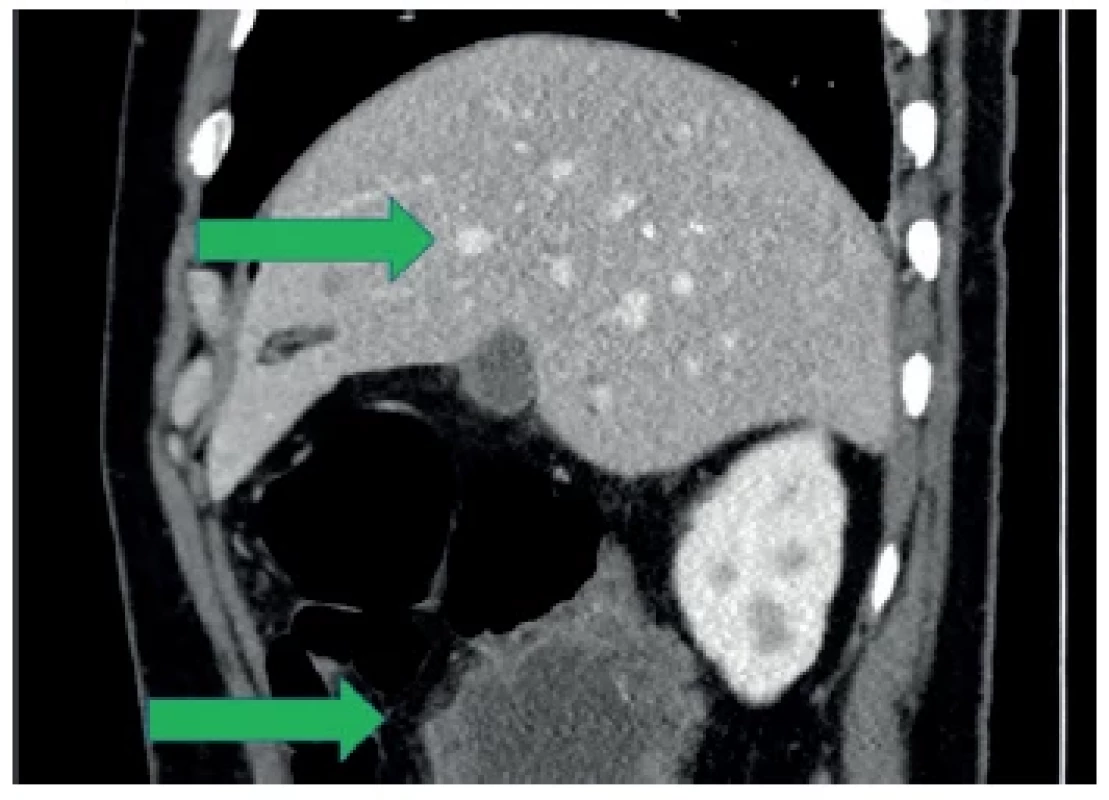
Klinický předpoklad generalizovaného tumoru kolorekta se nepotvrdil. Histologie ukázala, že se jedná o raritní typ měkkotkáňového sarkomu – DSRCT. Druhé čtení bylo zcela ve shodě s prvním. Metodou FISH byla prokázaná přestavba genu EWS-WT1, což spolu s morfologií tumoru a imunofenotypem dostačovalo pro stanovení diagnózy.
Nález byl konzultován se sarkomovým centrem a pacient byl předán do péče onkologa. Vzhledem k rozsahu postižení s infaustní prognózou a celkovým možným přežitím cca 1−1,5 roku byla indikována paliativní chemoterapie, po 3 měsících restaging a dle efektu další terapie. Byla zvolena systémová chemoterapie v režimu VDC-IE s alternací co 2 týdny (vincristin, doxorubicin, cyklofosfamid, ifosfamid a etoposid), což je kombinace užívaná při léčbě i jiných sarkomů (například Ewingův sarkom). V čase odevzdání rukopisu pacient přežívá 6 měsíců od operace, neubývá na hmotnosti a má občasné bolesti břicha. Dle restagingového CT vyšetření je zaznamenána minimální regrese tumoru.
DISKUZE
Sarkomy tvoří různorodou skupinu zhoubných nádorů vyvíjejících se z pojivové tkáně. Původ mají v mezenchymálních buňkách, které se normálně diferencují v buňky svalové, tukové, cévní, kostní, vazivové či buňky chrupavky. Nejčastěji vznikají měkkotkáňové sarkomy (liposarkom, rhabdomyosarkom, leiomyosarkom, fibrosarkom a další), méně často z kostí (osteosarkom, chondrosarkom, Ewingův sarkom) [10−11]. V České republice je ročně diagnostikováno přibližně 600 měkkotkáňových sarkomů a asi 100 nádorů kostí a kloubní chrupavky. DSRCT je podskupinou měkkotkáňových sarkomů s ojedinělým výskytem.
Onemocnění bývá poddiagnostikováno, často se manifestuje jen nespecifickými příznaky, a to až v pozdním stadiu. Symptomy závisejí na postižené oblasti. Pro nejčastější intraabdominální lokalizaci jsou to nespecifické tupé bolesti břicha, poruchy střevní pasáže a jiné.
Mezi terapeutické možnosti patří chirurgická resekce, chemo-, radio - a cílená terapie. Úplná chirurgická resekce většinou není možná pro přítomnost vícečetných neoplastických nodulů a velkou schopnost tumoru metastázovat. U větších tumorů se většinou provádí po 3 až 4 cyklech chemoterapie. V některých případech se peritoneální nádorové masy odstraňují pomocí techniky tangenciální disekce. Další důležitou úlohou chirurgie je odstranění některých symptomů, jako je například neprůchodnost střeva, která vzniká až u poloviny pacientů. V případě úspěšné resekce tumoru následuje adjuvantní radioterapie s externí dávkou pro břicho a malou pánev 30 Gy. Chemoterapie je doporučována u všech pacientů včetně vyšších a inoperabilních stadií, jakož i v paliativní terapii, protože tumor vykazuje vysokou chemosenzitivitu, i když jen s krátce trvajícím efektem. Konkrétní protokol není doporučen, používají se chemoterapeutika jako vincristin, doxorubicin, cyklofosfamid, ifosfamid a etoposid. Další možností terapie je hypertermická intraperitoneální chemoterapie (HIPEC) s použitím doxorubicinu a cisplatiny. HIPEC je zvažována u extenzivních intraabdominálních metastáz, ale její úloha zůstává kontroverzní. Mezi cílenou terapii patří použití inhibitoru destičky derivujícího růstového faktoru (Pazopanib, Sunitinib a další), inhibitoru androgenového receptoru (např. Enzalutamid), protilátek proti imunomodulační molekule B7H3 (Enoblituzumab) a jiným [12].
Průměrné přežití pacientů se pohybuje od 1,5 do 2,5 roku a 15 % přežívá více než 5 let. Kombinace úspěšné chirurgické resekce s adjuvantní chemoterapií dosahuje 3leté přežití v 58 % případů [13]. Jiní autoři uvádějí medián přežití 34 u operabilních a 14 měsíců u inoperabilních nálezů [14].
V uvedené kazuistice lze nalézt společné rysy s popsaným chováním DSRCT. Jednalo se o muže mladšího věku, u kterého bylo onemocnění dlouho asymptomatické. Šlo o intraabdominální formu s mnohočetnými metastázami bez poruchy střevní pasáže. Nález byl tak překvapivý, že i zkušenému radiologovi připomínal ultrazvukový obraz obsahu kýlního vaku uskřinutou tenkou kličku, přičemž peroperačně bylo nalezeno uskřinuté omentum s přítomnou metastázou. V úvodu do anestezie mohlo dojít ke spontánní repozici tenké kličky, ale ta byla cíleně provedena bez myorelaxace a všechny kličky byly při revizi vitální. Histologicky byly zachyceny nádorové struktury s desmoplastickým stromatem, které bylo prostoupeno pruhy a čepy malých hyperchromních buněk s modrými jádry, v nichž byly pouze ojediněle patrné nukleoly, s nekrózou fokálně v centru nádorových čepů (Obr. 4). Na několika místech byla zastižena lymfovaskulární propagace tumoru. K přesné diagnostice onemocnění byla prokázána přestavba genu EWS-WT1 [15]. Pro toto onemocnění nejsou známé žádné rizikové faktory ani specifické onkomarkry. DSRCT není vhodný k plošnému screeningu. Vzhledem k rychlosti metastázování je šance na jeho odhalení v počátečních stadiích s možností R0 resekce velmi malá. To vše přispívá k nízkému přežívání pacientů.
Image 4. Histologický preparát Barvení hematoxylin/eozin, zachyceny nádorové struktury s desmoplastickým stromatem, malé hyperchromní buňky s modrými jádry s pouze ojediněle patrnými nukleoly. V červeném kroužku označen okrsek nekrózy.
Fig. 4. Histological sample Hematoxylin/eosin, captured tumor structures with desmoplastic stroma, small hyperchromic cells with blue nuclei with only rarely visible nucleoli. Necrosis in the red circle.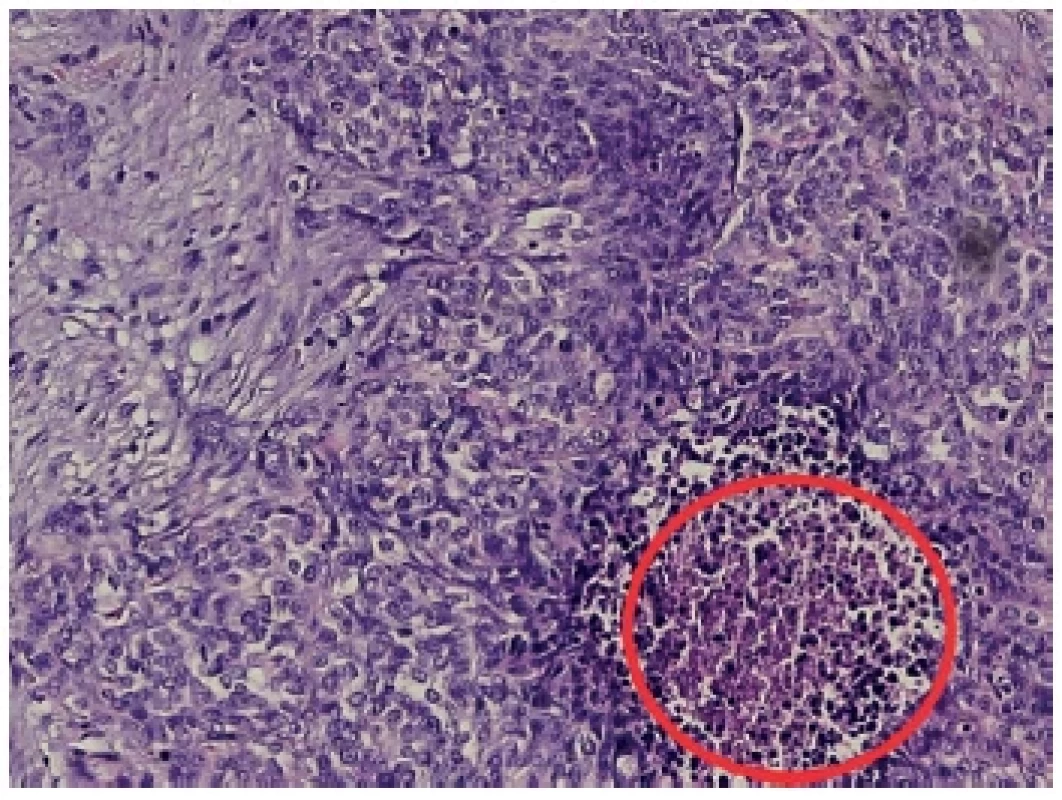
ZÁVĚR
DSRCT je raritním měkkotkáňovým sarkomem, který pro svůj ojedinělý výskyt zůstává neznámým v běžné lékařské praxi. Tumor se vyskytuje častěji u mužů mladšího věku. Příznaky onemocnění bývají nespecifické a sarkom je často poddiagnostikován, což přispívá ke krátkému přežívání pacientů s tímto nádorem.
V naší práci prezentujeme kazuistiku pacienta, u kterého byla první manifestací onemocnění uskřinutá ventrální kýla, jejímž obsahem bylo omentum s přítomnou metastázou. Vzhledem ke generalizaci tumoru byla sarkomovým centrem indikována paliativní chemoterapie.
Poděkování: Práce byla podpořena specifickým výzkumem Masarykovy univerzity MUNI/A/1343/2022.
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise, s výjimkou kongresových abstrakt a doporučených postupů.
MUDr. Matej Pekař, Ph.D., MBA
Centrum cévní a miniinvazivní chirurgie
Nemocnice AGEL Třinec-Podlesí
Konská 453
739 61 Třinec
e-mail: matej.pekar@npo.agel.cz
ORCID:0000-0001-6238-2276
Rozhl Chir. 2023;102 : 28–31
Sources
1. Gerald WL, Rosai J. Case 2. Desmoplastic small cell tumor with divergent differentiation. Pediatr Pathol. 1989;9(2):177 – 183. doi:10.3109/15513818909022347.
2. Li X, Yu J, Fang S, et al. Desmoplastic small round cell tumor: a case report and review of the literature. World J Surg Oncol. 2014;12(1):9. doi:10.1186/1477-7819-12-9.
3. Lettieri CK, Garcia-Filion P, Hingorani P. Incidence and outcomes of desmoplastic small round cell tumor: results from the surveillance, epidemiology, and end results database. J Cancer Epidemiol. 2014 : 680126. doi:10.1155/2014/680126.
4. Subbiah V, Lamhamedi-Cherradi S-E, Cuglievan B, et al. Multimodality treatment of desmoplastic small round cell tumor: Chemotherapy and complete cytoreductive surgery improve patient survival. Clin Cancer Res. 2018;24(19):4865–4873. doi:10.1158/1078-0432.CCR-18-0202.
5. Honoré C, Delhorme JB, Nassif E, et al. Can we cure patients with abdominal desmoplastic small round cell tumor? Results of a retrospective multicentric study on 100 patients. Surg Oncol. 2019;29 : 107–112. doi:10.1016/j.suronc.2019.04.002.
6. Hendricks A, Boerner K, Germer CT, et al. Desmoplastic small round cell tumors: A review with focus on clinical management and therapeutic options. Cancer Treat Rev. 2021;93 : 102140. doi:10.1016/j. ctrv.2020.102140.
7. Livaditi E, Mavridis G, Soutis M, et al. Diffuse intraabdominal desmoplastic small round cell tumor: a ten-year experience. Eur J Pediatr Surg. 2006;16(6):423–427. doi:10.1055/s-2006-924736.
8. Bulbul A, Noel Fahy B, Xiu J, et al. Desmoplastic small round blue cell tumor: A review of treatment and potential therapeutic genomic alterations. Sarcoma 2017 : 1278268. doi:10.1155/2017/1278268.
9. Loktev A, Shipley JM. Desmoplastic small round cell tumor (DSRCT): emerging therapeutic targets and future directions for potential therapies. Expert Opin Ther Targets 2020;24(4):281–285. doi:10.1080/ 14728222.2020.1738392.
10. Anderson WJ, Doyle LA. Updates from the 2020 World Health Organization classification of soft tissue and bone tumours. Histopathology 2021;78(5):644 – 657. doi:10.1111/his.14265.
11. Adámková Krákorová D. Systémová léčba sarkomů měkkých tkání dospělých vyjma GIST. Onkologie 2010;4(5):308–310.
12. Wei G, Shu X, Zhou Y, et al. Intra-abdominal desmoplastic small round cell tumor: current treatment options and perspectives. Front Oncol. 2021;11 : 705760. doi:10.3389/fonc.2021.705760.
13. Lal DR, Su WT, Wolden SL, et al. Results of multimodal treatment for desmoplastic small round cell tumors. J Pediatr Surg. 2005;40(1):251–255. doi:10.1016/j.jpedsurg. 2004.09.046.
14. Biswas G et al. Desmoplastic small round cell tumor: Extra abdominal and abdominal presentations and the results of treatment. Indian J Cancer 2005;42(2):78. doi: 10.4103/0019-509X.16696.
15. Veselý K. Histopatologická diagnostika nádorů měkkých tkání. Onkologie 2010;4(5):293–296.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2023 Issue 1-
All articles in this issue
- Centralizace a praxe
- Nádory appendixu a pseudomyxom peritonea: současná doporučení pro klinickou praxi
- Nativní nefrektomie u pacientů s autozomálně dominantní polycystickou nemocí ledvin v programu transplantací ledvin – retrospektivní výsledky z jednoho centra mezi roky 2000–2020
- Incidence pooperačních komplikací u pacientek s karcinomem prsu v závislosti na typu drénu
- Intrapulmonálna sekvestrácia s deštruktívnou pneumóniou a život ohrozujúcim hemoptoe u dospelého pacienta: prípad z praxe
- Uskřinutá metastáza jako první manifestace vzácného sarkomu
- Divertikulitida ilea s krytou perforací současně komplikovaná plicní embolií – kazuistika
- Retroperitoneálny absces po urgentnej resekcii žalúdka u geriatrického pacienta riešený chirurgickým extraperitoneálnym prístupom – kazuistika
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Nádory appendixu a pseudomyxom peritonea: současná doporučení pro klinickou praxi
- Incidence pooperačních komplikací u pacientek s karcinomem prsu v závislosti na typu drénu
- Intrapulmonálna sekvestrácia s deštruktívnou pneumóniou a život ohrozujúcim hemoptoe u dospelého pacienta: prípad z praxe
- Divertikulitida ilea s krytou perforací současně komplikovaná plicní embolií – kazuistika
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

