-
Medical journals
- Career
Intrapulmonálna sekvestrácia s deštruktívnou pneumóniou a život ohrozujúcim hemoptoe u dospelého pacienta: prípad z praxe
Authors: J. Muri 1,2; B. Durcová 3; A. Garchar 2; P. Makovický 1; A. Vrbenská 4; V. Kamarád 1
Authors‘ workplace: Ústav histologie a embryologie, Lékařská fakulta, Ostravská univerzita, Ostrava 1; Centrum hrudníkovej chirurgie Národný ústav tuberkulózy, pľúcnych chorôb a hrudníkovej chirurgie Vyšné Hágy, Vysoké Tatry 2; 2. Oddelenie pneumológie a ftizeológie, Národný ústav tuberkulózy, pľúcnych chorôb a hrudníkovej chirurgie, Vyšné Hágy, Vysoké Tatry 3; Oddelenie patológie, Národný ústav tuberkulózy, pľúcnych chorôb a hrudníkovej chirurgie Vyšné Hágy, Vysoké, Tatry 4
Published in: Rozhl. Chir., 2023, roč. 102, č. 1, s. 23-27.
Category: Case Report
doi: https://doi.org/10.33699/PIS.2023.102.1.23–27Overview
Súhrn Článok referuje prípad pacienta s bronchopulmonálnou sekvestráciou komplikovanou deštruktívnym aktinomykotickým zápalom vedúcim k život ohrozujúcemu hemoptoe. Išlo o dospelého pacienta s anamnézou opakovaných pravostranných zápalov pľúc, ktorých komplexná príčina nebola v minulosti bližšie vyšetrovaná. K bližšiemu vyšetrovaniu pozadia zápalov pľúc viedla až hemoptýza, ktorá sa objavila ako komplikácia. CT vyšetrenie hrudníka odhalilo léziu stredného laloka pravých pľúc s anomálnou vaskularizáciou – obraz kompatibilný s intralobárnou pľúcnou sekvestráciou. Spádové pracovisko, kde bol pacient zachytený, začalo konzervatívnu antibiotickú liečbu zápalu pľúc. Pre pretrvávanie vykašliavania krvi bola indikovaná embolizácia aferentných ciev sekvestra, ktorá viedla k redukcii jeho prekrvenia, čo bolo preukázané kontrolným CT vyšetrením hrudníka. Klinicky došlo k ústupu hemoptýzy. Neskôr, s odstupom troch týždňov, nastala recidíva hemoptýzy. Pacient bol akútne hospitalizovaný na špecializovanom pracovisku hrudníkovej chirurgie, kde krátko po prijatí došlo k progresii hemoptýzy do život ohrozujúceho hemoptoe. Pacient, za účelom sanácie zdroja krvácania, urgentne podstúpil strednú lobektómiu pravých pľúc cestou torakotómie.
Prípad poukazuje na nerozpoznanú bronchopulmonálnu sekvestráciu ako na možnú príčinu recidivujúcich ipsilaterálnych zápalov pľúc v dospelosti, zdôrazňuje možné riziká spojené s patologicky zmeneným tkanivovým mikroprostredím pľúcneho sekvestra a akcentuje potrebu chirurgického riešenia vo všetkých indikovaných prípadoch.
Klíčová slova:
hemoptýza – Pneumonia – bronchopulmonálna sekvestrácia – hemoptoe
ÚVOD
Pľúcna sekvestrácia patrí medzi bronchopulmonálne malformácie predného čreva. Jej najčastejšími komplikáciami sú perzistujúce alebo rekurentné infekcie, hemoptýza, hemoptoe, hemotorax, hemoperitoneom či dokonca zvýšené riziko vzniku malignity [1−13].
Podrobnú referenciu o pľúcnej sekvestrácii podal v minulosti v časopise Rozhledy v chirurgii autorský kolektív Vernerová a spol. [14].
V našom článku popisujeme prípad intralobárnej sekvestrácie v oblasti stredného laloka pravých pľúc u pacienta s anamnézou opakovaných pravostranných lobárnych pneumónií. Pľúcna sekvestrácia bola rozpoznaná až v dospelosti na základe hemoptýzy. Pre nečakanú progresiu hemoptýzy do hemoptoe, napriek predchádzajúcej liečbe pneumónie a embolizácii, musel pacient podstúpiť urgentný chirurgický zákrok – strednú lobektómiu pravých pľúc cestou torakotómie.
KAZUISTIKA
Predmetom kazuistiky je štyridsaťosem ročný pacient, ktorý bol prijatý spádovým pneumologickým oddelením pre pravostrannú lobárnu bronchopneumóniu v oblasti stredného laloka sprevádzanú hemoptýzou. Pacient uvádzal, že recidivujúce pravostranné zápaly pľúc mal aj v minulosti. Žiadne iné závažné ochorenia neudával.
V laboratórnom náleze, v čase prijatia spádovým pneumologickým oddelením, dominovala elevácia zápalových parametrov svedčiaca pre bakteriálny zápal – vysoké CRP (>200 mg/l), leukocytóza (>17*109) s neutrofíliu (>80 %) a lymfopéniou (<20 %). Bola prítomná mierna normocytová normochrómna anémia (HGB 133g/l, HCT 0,39 arb.j.).
CT vyšetrenie hrudníka zobrazilo léziu stredného laloka pravých pľúc s anomálnou vaskularizáciou (Obr. 1). Na základe daného obrazu bola suponovaná intralobárna sekvestrácia s mnohopočetnými aferentnými cievami sekvestra vychádzajúcimi, v čase diagnózy, z blízkych interkostálnych artérií.
Image 1. Lézia stredného laloka pravých pľúc s kontrastne zvýraznenými aferentnými cievami (červená šípka) a sprievodnými zápalovými zmenami (CT pracovisko NÚTPCHaHCH Vyšné Hágy, Vysoké Tatry)
Fig. 1. Lesion of the middle lobe of the right lung with contrast-enhanced afferent vessels (red arrow) and accompanying inflammatory changes (CT department, NUTPCHaHCH Vysne Hagy, Vysoke Tatry)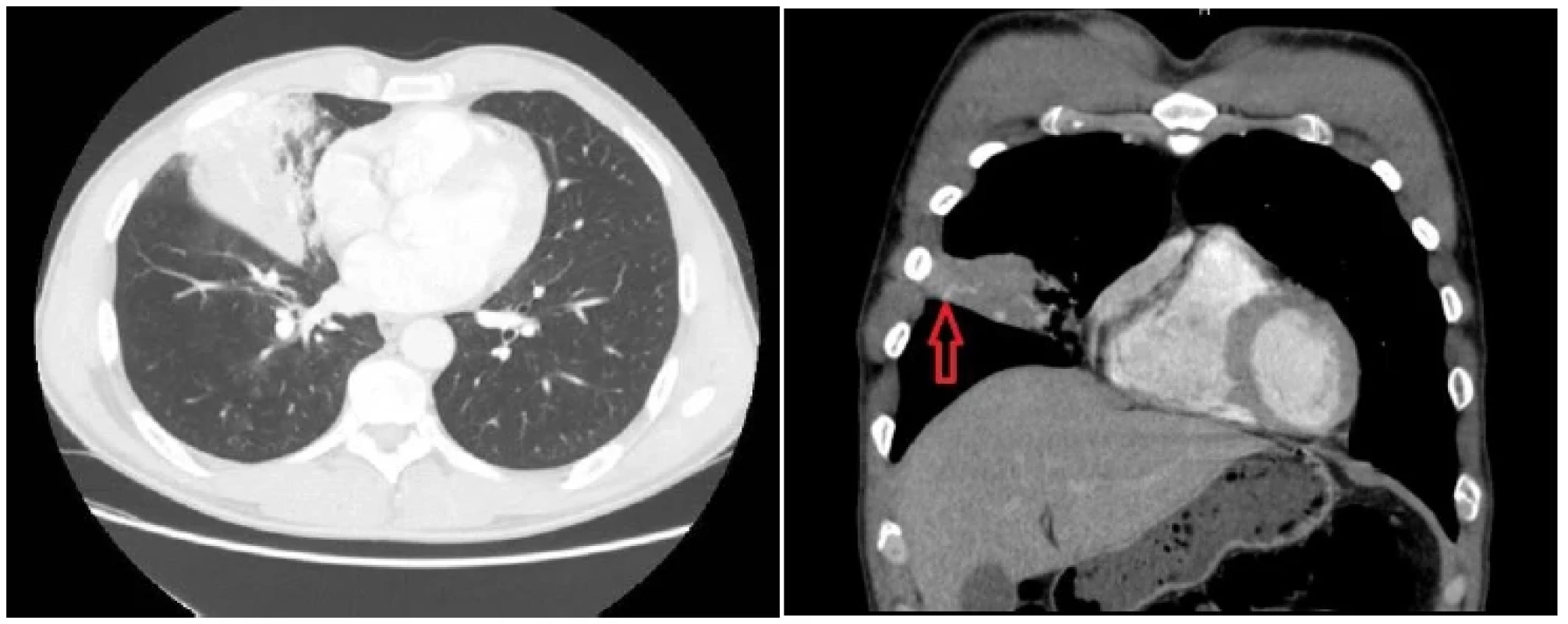
Pacient bol vstupne liečený konzervatívne. Empirickou farmakologickou liečbou bakteriálnej bronchopneumónie sa dosiahlo zlepšenie zápalových parametrov, vykašliavanie krvi však neprestávalo. Pre pretrvávanie hemoptýzy bola v spáde indikovaná embolizácia aferentných ciev pľúcneho sekvestra s cieľom redukovať jeho prekrvenie. Redukcia aferentných ciev sekvestra a sprievodných zápalových zmien v jeho okolí bola verifikovaná kontrolným CT vyšetrením (Obr. 2). Po embolizácii došlo k prechodnej regresii hemoptýzy.
Image 2. Redukcia zápalových zmien a anomálnych ciev po predchádzajúcej antibiotickej liečbe a embolizácii (CT pracovisko NÚTPCHaHCH Vyšné Hágy)
Fig. 2. Reduction of inflammatory changes and anomalous vessels after previous antibiotic treatment and embolization (CT department, NUTPCHaHCH Vysne Hagy, Vysoke Tatry)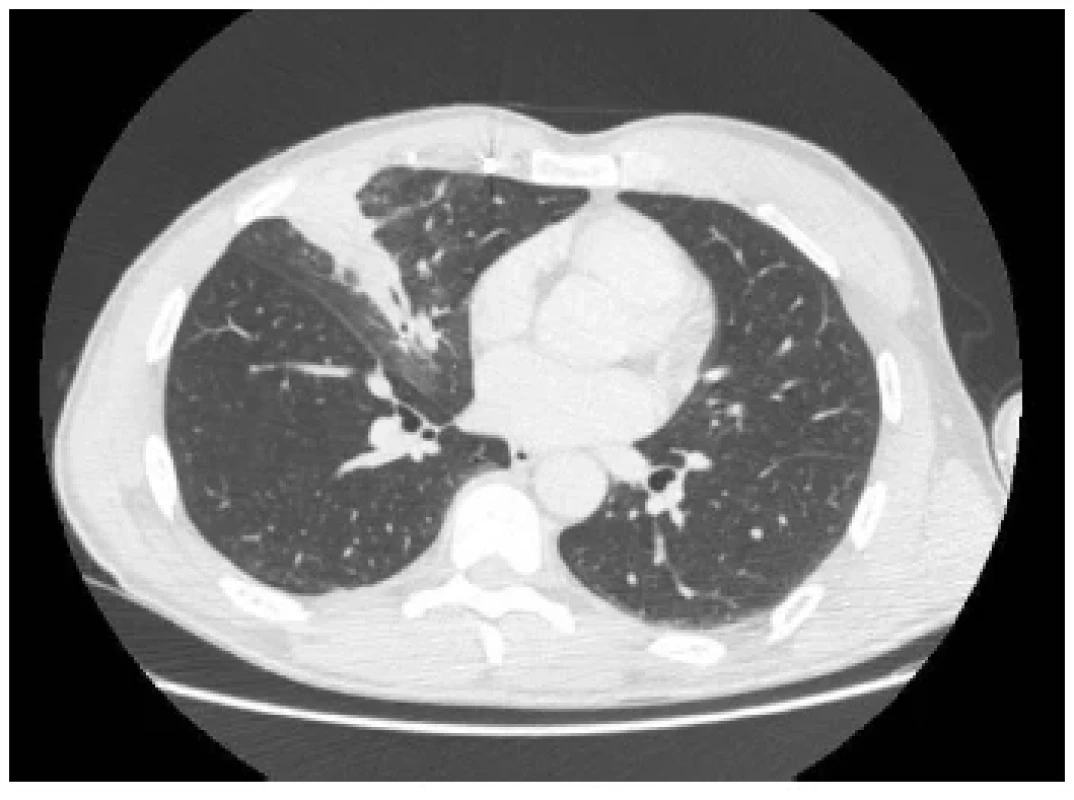
Tri týždne po embolizácii, napriek pokračujúcej liečbe antibiotikami a hemostyptikami, nastala u pacienta opätovná hemoptýza. Pacient bol urgentne prevezený do Národného ústavu tuberkulózy, pľúcnych chorôb a hrudníkovej chirurgie vo Vyšných Hágoch, kde bol prijatý priamo na Kliniku anesteziológie a intenzívnej medicíny.
V čase prijatia bol pacient v klinicky dobrom stave. Krátko po prijatí však došlo k hemoptoe, ktoré si vynútilo urgentné zabezpečenie dýchacích ciest a selektívnu ventiláciu ľavých pľúc. Hemoptoe znemožňovalo bronchoskopické vyšetrenie na lôžku. Pacient bol prevezený na operačnú sálu za účelom urgentnej chirurgickej sanácie zdroja krvácania. Bola indikovaná a uskutočnená stredná lobektómia pravých pľúc cestou torakotómie. Počas operácie bola vizuálne a palpačne zjavná alterácia stredného laloka pravých pľúc. Lalok bol hyperemický, presiaknutý, difúzne výrazne tuhšej konzistencie s početnými nepresne ohraničenými tumoriformnými ložiskami. K stene hrudníka ho fixovali blanité, bohato vaskularizované adhézie, resp. pleurálne duplikatúry. Tepny prebiehajúce v uvedených adhéziách boli vetvami interkostálnych artérií a smerovali do patologicky zmeneného stredného laloka. Viaceré z nich mali lúmen veľkosti bežnej interkostálnej tepny. Horný a dolný lalok pravých pľúc boli vizuálne a palpačne v norme.
V priebehu lobektómie sme identifikovali prítok hornej pľúcnej žily zo stredného laloka (ramus lobi medii) a lobárny bronchus stredného laloka (bronchus lobaris medius dexter). Následne sme zistili absenciu vetiev pľúcnej tepny pre stredný lalok pravých pľúc.
Rekonštrukcia torakotómie bola spojená s drenážou pravej pohrudnicovej dutiny dvoma hrudníkovými drénmi a drenážou medzisvalovej vrstvy a podkožia Redonovým drénom. Do piateho pooperačného dňa bol pacient postupne zbavený Redonovho aj oboch hrudníkových drénov. Pooperačný priebeh bol komplikovaný vytvorením výpotku v pravej pleurálnej dutine a infekciou v rane po torakotómii. Obe komplikácie boli adekvátne zvládnuté drenážou hrudníka, antibiotickou liečbou a V.A.C. liečbou s následnou re-sutúrou rany.
Resekát pľúc bol zaslaný na histopatologické vyšetrenie, ktorého výsledkom bol nález hemoragicko hnisavého zápalu (Obr. 3). V preparáte dominovali prevažne kolabované zakrvácané pľúca, ktoré boli tvorené početnými komprimovanými, inde nápadne rozvoľnenými alveolami s viditeľnými disproporčnými rozdielmi v kalibre. Uvedené zmeny predstavovali prakticky až do 70 % plochy z celého materiálu. Menšia časť alveolov mala potrhané alveolárne septá. Prítomné boli aj zhrubnuté kolagén pozitívne (Masson trichrome, Bammed, s.r.o., Česká republika) alveolárne septá a zmnožené pľúcne interstícium. V lúmene alveolov boli, v dôsledku krvácania do parenchýmu pri hemoptoe, masy erytrocytov a niekoľko skupiniek buniek charakteru makrofágov. Miestami bol viditeľný koncentrovanejší intraalveolárne lokalizovaný cudzorodý PAS pozitívny (PAS, Bammed, s.r.o., Česká republika) materiál charakteru kolónií aktinomycét a vetvičky plesní. Zachytených bolo niekoľko variabilne veľkých, roztiahnutých bronchov, lemovaných respiračným epitelom so superficiálne lokalizovanou tenkou PAS pozitívnou (PAS, Bammed, s.r.o., Česká republika) vrstvičkou materiálu. Prítomné bronchy boli vystlané viacradovým cylindrickým epitelom s riasinkami. Bronchioly boli vystlané viacradovým kubickým až plochým epitelom. V oblastiach respiračného oddielu boli masy erytrocytov a neveľké množstvo kondenzujúceho sa serózneho materiálu. Prítomné cievy mali miestami hypertrofovanú intímu, endoluminálne boli masy kompaktných, ale aj rozpadávajúcich sa erytrocytov a prítomné boli tiež zrejúce až úplne vyzreté tromby. V celom materiály bol edém a sprievodný guľatobunkový infiltrát.
Image 3. Pohľad na časť pľúc s nálezom hemoragicko hnisavého zápalu so zmnoženým pľúcnym interstíciom (žlté šípky), s masami kompaktných erytrocytov v lúmene alveolov (čierne šípky) a početnými skupinkami aktinomycét (červené šípky)
Fig. 3. A view of part of the lung showing hemorrhagic hissing inflammation with increased pulmonary interstitium (yellow arrows), with masses of compact erythrocytes in the lumen of the alveoli (black arrows) and numerous groups of actinomycetes (red arrows)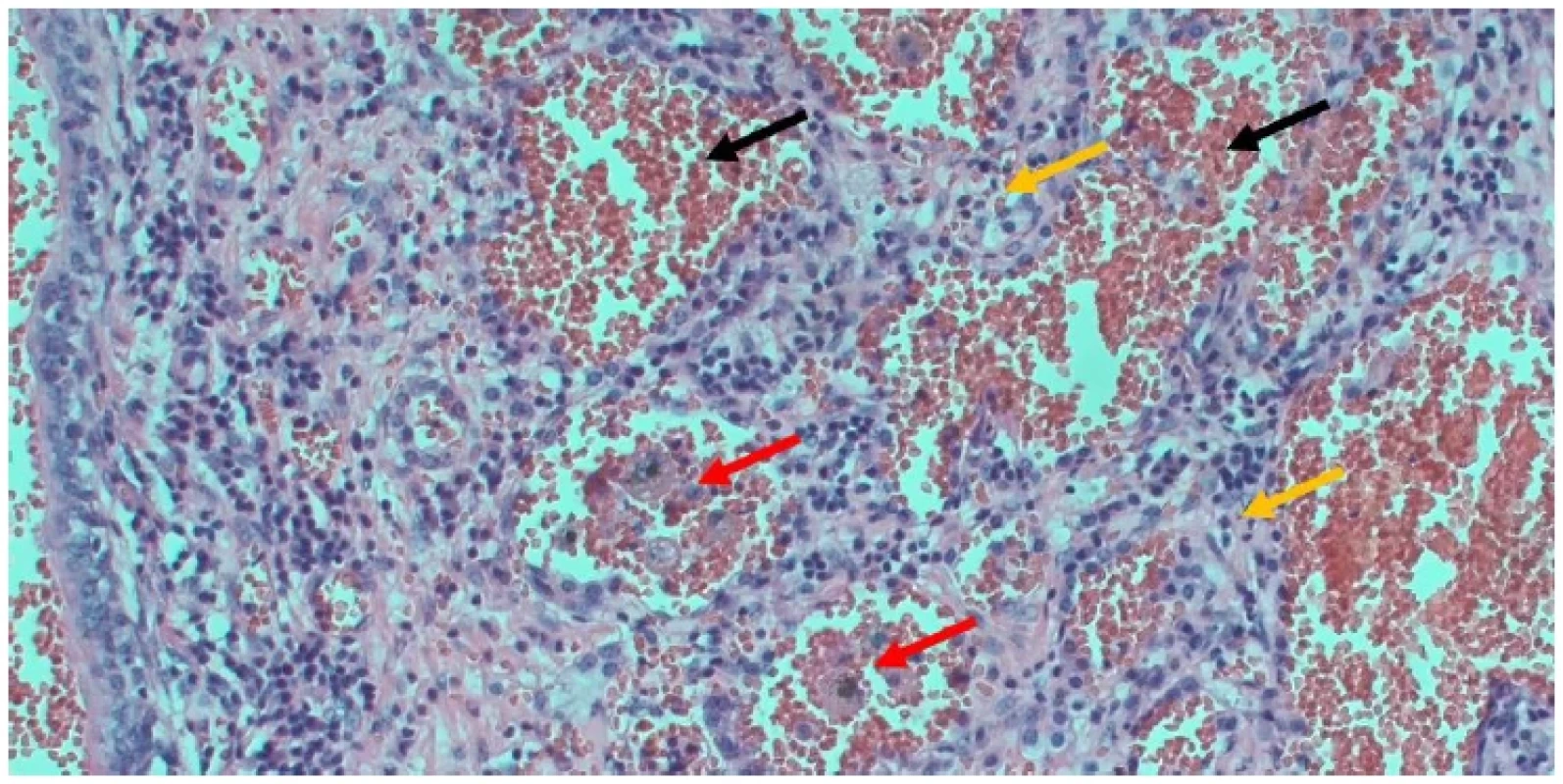
Mikrobiologické vyšetrenia spúta v pooperačnom období boli negatívne. Od prijatia boli pacientovi podávané penicilínové antibiotiká. Celková dĺžka hospitalizácie v našom zariadení bola 27 dní, po ktorých bol pacient vo veľmi dobrom stave prepustený do ambulantnej starostlivosti s odporúčaním protrahovanej antibiotickej liečby a pneumologickej dispenzarizácie.
DISKUSIA
Nami referovaný prípad sekvestrácie pľúc je zaujímavý z klinického aj morfologického hľadiska. V súlade s dostupnou literatúrou, aj v našom prípade, boli dôsledkom intralobárnej sekvestrácie rekurentné infekcie pľúc [1−11]. Morfologicky je zaujímavou kombinácia intralobárnej pľúcnej sekvestrácie v strednom laloku pravých pľúc so súčasnou absenciou segmentálnych vetiev pľúcnej tepny pre tento lalok. Stredný lalok pravých pľúc nebol adekvátne zapojený do funkčného obehu pľúc. Nebolo zistené žiadne spojenie ani komunikácia sekvestra s pažerákom, ktorý je derivátom predného čreva, podobne ako aberantný pľúcny pupeň, z ktorého sekvester pravdepodobne vznikol. Uvedené skutočnosti potvrdzujú, že opakované pneumónie, obzvlášť v dolných lalokoch pľúc, vyžadujú včasné CT angiografické vyšetrenie pľúcneho cievneho zásobenia.
Cievy sekvestra vytvárali anomálny okruh medzi ľavou komorou a ľavou predsieňou, v ktorom bola krv z vysokotlakového systémového arteriálneho riečiska vháňaná vetvami interkostálnych tepien do alterovaných ciev v sekvestri a okolitom pľúcnom parenchýme. Krv sa spätne vracala cestou pľúcnych žíl (ramus lobi medii hornej pľúcnej žily) do ľavej predsiene. Objemové a tlakové pomery v tomto okruhu boli určite významným faktorom prispievajúcim k závažnosti hemoptoe. Abnormálna vaskularizácia sekvestrov významne prispieva ku vzniku krvácavých komplikácií týchto malformácií [11]. Počas chirurgického riešenia je nutné myslieť na širokú paletu možností odstupu tepien pre pľúcny sekvester. Obzvlášť dôležité sú prípady odstupu týchto tepien z brušnej aorty, kedy pri ich nepoznanom prerušení môže dôjsť k retrakcii kýpťa cievy pod bránicu, čo pacienta ohrozuje masívnym krvácaním do brušnej dutiny. Histopatologické vyšetrenie resekovaného stredného laloka pravých pľúc popísalo hemoragicko hnisavý zápal s kolóniami aktinomycét v okolí cudzorodého materiálu. Podľa nás išlo o endogénnu infekciu, pri ktorej bol vstupnou bránou tracheobronchiálny strom, pričom tkanivo sekvestra predstavovalo vhodné prostredie pre rozvoj a progresiu tejto infekcie. Proces sa pritom šíril parenchýmom laloka a sekvestra ako chronický zápal. Samotný zápal bol neskôr spojený s lokálnou fibroprodukciou a tvorbou granulačného, bohato kapilarizovaného tkaniva, čo sme verifikovali aj histologicky a čo je pre aktinomykózu príznačné [12]. Súčasne však, v rámci neho, dochádzalo k hnisavej kolikvácii, deštrukcii a rozpadu. Rozpadom kolikvovaných ložísk vznikali dutinky s tendenciou k vzájomnému splývaniu a prevaleniu sa do bronchov. Uvedené patologické zmeny viedli k samotnej hemoptýze. Aktinomycéty boli zistené až v pľúcnom resekáte. V prípadoch, keď postihnutý jedinec vykašliava aktinomycéty v podobe tzv. aktinomykotických drúz, je možný ich dôkaz mikroskopickým vyšetrením spúta. Aktinomycéty sú mikroaerofilné až anaeróbne kapnofilné mikroorganizmy, ktoré rastú pomaly na špeciálnych pôdach za anaeróbnych podmienok. Ich dôkaz je náročný a vyžaduje prísne podmienky odberu biologického materiálu a kultivácie [12]. To vysvetľuje skutočnosť, že neboli zachytené pri vyšetreniach spúta a zistili sa až v resekáte.
Klinicky najdôležitejšou otázkou bola úloha embolizácie v manažmente referovaného pacienta. Pľúcna sekvestrácia u dospelého jedinca s adekvátnou funkčnou rezervou je indikáciou na operačné riešenie [11]. V prípade infekčných komplikácií pľúcneho sekvestra je na mieste, pri absencii iných závažných sprievodných komplikácií, snaha o sanáciu infektu. Ideálnym prípadom je debacilizácia spúta pred plánovanou pľúcnou resekciou. V našom prípade bolo operačné riešenie od začiatku urgované hemoptýzou. Hemoptýza je v takomto prípade dôvodom na hospitalizáciu pacienta v špecializovanom zariadení, ktoré disponuje možnosťami endobronchiálnych intervencií a má pneumochirurgické zázemie. Alterácia cirkulácie v rámci sekvestra v kombinácii s aktinomyktickým zápalom viedli k závažnému hemoptoe. Embolizácia vstupne zredukovala riečisko sekvestra a zmiernila aj hemoptýzu. Tromby boli popísané aj v histopatologickom vyšetrení resekátu pľúcneho laloka. Pľúcna aktinomykóza je však chronické ochorenie progredientého charakteru, následkom čoho bola recidíva hemoptýzy s progresiou do závažného hemoptoe. Naviac aktinomykóza prebiehala okultne a bola dokázaná až histologickým vyšetrením resekátu. Chirurgické odstránenie zdroja krvácania preto v takýchto prípadoch netreba odkladať. Z dostupnej literatúry a aj z našich skúseností je zrejmé, že operačné riešenie pľúcnych sekvestrov má veľmi dobré výsledky. Najčastejšími operačnými výkonmi sú lobektómie a segmentálne resekcie pľúc, pri ktorých sa v indikovaných prípadoch stále viac uplatňuje miniinvazívna operačná technika - videotorakoskopická či videoasistovaná [13−15].
ZÁVER
Sekvestrácia pľúc je v dospelosti zriedkavo zisťovanou vrodenou vývojovou chybou, ktorá však môže byť spojená s vážnymi komplikáciami. V našom článku referujeme prípad intralobárnej sekvestrácie v oblasti stredného laloka pravých pľúc s deštruktívnym aktinomykotickým zápalom, ktorý bol komplikovaný život ohrozujúcim hemoptoe. Stav si vynútil urgentnú operáciu - strednú lobektómiu pravých pľúc cestou torakotómie a ku komplexnému zhodnoteniu všetkých príčin vedúcich k hemoptoe viedlo až histopatologické vyšetrenie resekátu pľúc.
Konflikt záujmov
Autori článku vyhlasujú, že nie sú v súvislosti so vznikom tohto článku v konflikte záujmov a že tento článok nebol publikovaný v žiadnom inom časopise, s výnimkou kongresových abstrakt a klinických odporúčaných postupov.
MUDr. Jozef Muri
Ružová 15
05401 Levoča
e-mail: muri.jozef@gmail.comRozhl Chir. 2023;102 : 23–27
Sources
1. Corbett HJ, Humphrey GM. Pulmonary sequestration. Paediatr Respir Rev. 2004;5(1):59−68. doi:10.1016/j. prrv.2003.09.009.
2. Alizadeh E, Suliman H. Intralobular pulmonary sequestration. JBR-BTR. 2013; 96(4):208–209. doi: org/10.5334/jbr-btr. 277.
3. Belchis D, Cowan M, Mortman K, et al. Adenocarcinoma arising in an extralobar sequestration: a case report and review of the literature. Lung Cancer 2014;84(1):92−95. doi.org/10.1016/j. lungcan.2014.01.025.
4. Chakraborty RK, Modi P, Sharma S. Pulmonary sequestration. 2022 May 1. In: StatPearls [Internet]. Treasure Island (FL), StatPearls Publishing 2022 Jan.
5. Chatelain S, Comp RA, Grace RR, et al. Cardiomyopathy induced by pulmonary sequestration in a 50-year-old man. Tex Heart Inst J. 2015;42(1):63−65. doi: 10.14503/THIJ-13-3728.
6. Gustafson RA, Murray GF, Warden HE, et al. Intralobar sequestration a missed diagnosis. Ann Thorac Surg. 1989;47(6):841−847. doi: 10.1016/0003 - 4975(89)90016-7.
7. Hofman FN, Pasker HG, Speekenbrink RGH. Hemoptysis and massive hemothorax as presentation of intralobar sequestration. Ann Thorac Surg. 2005; 80(6):2343−2344. doi: 10.1016/j.athoracsur. 2004.06.061.
8. Ikezoe J, Murayama S, Godwin JD, et al. Bronchopulmonary sequestration: CT assessment. Radiology 1990; 176(2):375−379. doi: 10.1148/radiology. 176.2.2367650.
9. Illiás L, Pálffy G, Szónyi P, et al. Masszív haemothoraxot okozó intralobaris tüdósequestratio esete. Orv Hetil. 1996;137 (23):1263−1265.
10. Laje P, Martinez-Ferro M, Grisoni E, et al. Intraabdominal pulmonary sequestration. A case series and review of the literature. J Pediatr Surg. 2006;41(7):1309−1312. doi: 10.1016/j.jpedsurg.2006.03.049.
11. Sun X, Xiao Y. Pulmonary sequestration in adult patients: a retrospective study. Eur J Cardio-Thorac. 2015;48(2):279−282. doi: 10.1093/ejcts/ezu397.
12. Könönen E, Wade WG. Actinomyces and related organisms in human infections. Clinical microbiology reviews 2015;28(2):419−442. https://doi. org/10.1128/CMR.00100-14.
13. Li X, Du H, Rehman MU, et al. Intralobar pulmonary sequestration originating from the intercostal arteries treated with surgical resection. Thorac Cancer 2018;9(7):877−880. doi: 10.1111/1759-7714.12642.
14. Vernerová A, Konopa Z, Horažďovský P, et al. Plicní sekvestrace jako náhodný nález v dospělém věku a její operační terapie. Rozhl Chir. 2007;86(3):126–130.
15. Krákorová G, Břízová Š, Šafránek J, et al. Plicní sekvestrace. Stud Pneumol Phthiseol. 2018;78(2):56−60.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2023 Issue 1-
All articles in this issue
- Centralizace a praxe
- Appendiceal tumors and pseudomyxoma peritonei: current recommendations for clinical practice
- Native nephrectomy in patients with autosomal dominant polycystic kidney disease in the kidney transplant program – single-center retrospective results of 2000−2020
- Incidence of postoperative complications in patients with breast cancer depending on the type of drain
- Intrapulmonary sequestration with destructive pneumonia and life-threatening hemoptysis in an adult patient: a case report
- Incarcerated metastasis as the first manifestation of a rare sarcoma
- Case report Ileal diverticulitis with covered perforation complicated by pulmonary embolism – case report
- Retroperitoneal abscess after urgent resection of the stomach in a geriatric patient treated with a surgical extraperitoneal approach – case report
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Appendiceal tumors and pseudomyxoma peritonei: current recommendations for clinical practice
- Incidence of postoperative complications in patients with breast cancer depending on the type of drain
- Intrapulmonary sequestration with destructive pneumonia and life-threatening hemoptysis in an adult patient: a case report
- Case report Ileal diverticulitis with covered perforation complicated by pulmonary embolism – case report
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

