-
Medical journals
- Career
Možnosti využití mezenchymálních kmenových buněk v léčbě nespecifických střevních zánětů − systematický přehled literatury
Authors: M. Lengálová 1; O. Ryska 2; A. Tremerová 1; P. Zusková 1; Z. Šerclová 1
Authors‘ workplace: Chirurgické oddělení NH Hospital, a. s., Hořovice 1; Royal Lancaster Infirmary, University Hospitals of Mocerambe Bay NHS Foundation Trust, Lancaster, UK 2
Published in: Rozhl. Chir., 2022, roč. 101, č. 4, s. 154-162.
Category: Review
doi: https://doi.org/10.33699/PIS.2022.101.4.154–162Overview
Úvod: Idiopatické střevní záněty jsou onemocnění, jejichž incidence celosvětově stoupá. Navzdory pokroku v konzervativní i chirurgické léčbě významná část pacientů nedosáhne kompletní remise a musí podstoupit opakované operace. Léčba kmenovými buňkami (MSC) představuje novou alternativu imunomodulační léčby.
Metody: Provedli jsme systematický přehled literatury zabývající se použitím mezenchymálních kmenových buněk k léčbě IBD. K jejich vyhledávání byla použita databáze PubMed, zařazeny byly původní studie publikované mezi lety 2015 a 2021.
Výsledky: Nalezeno bylo celkem 80 citací, z nich po výběru bylo do přehledu zahrnuto 21 klinických studií a 47 experimentálních studií.
Závěr: Účinnost MSC v léčbě perianální Crohnovy choroby je přinejmenším srovnatelná se současnými léčebnými metodami. Pozitivní efekt byl rovněž prokázán na zvířecích modelech luminální choroby nebo enterokutánní píštěle. Výsledky po systémovém podání u IBD pacientů jsou zatím nejednoznačné.
Klíčová slova:
léčba – mezenchymální kmenové buňky – idiopatické střevní záněty – píštěl
ÚVOD
Idiopatické střevní záněty (IBD) jsou chronická relabující onemocnění projevující se klinicky především průjmy a bolestmi břicha. Řadíme mezi ně ulcerózní kolitidu, Crohnovu chorobu a neklasifikovanou kolitidu, u níž nelze určit, ke kterému z předcházejících dvou typů patří [1].
Incidence idiopatických střevních zánětů celosvětově stoupá, což bývá přičítáno industrializaci a přechodu směrem k západnímu stylu života včetně stravovacích návyků. Z analýzy dat ÚZIS z let 2007 až 2013 vyplývá, že prevalence Crohnovy choroby v ČR je 22,7/100 000, v případě ulcerózní kolitidy je to 27,9/100 000. Celkem je v ČR vedeno asi 46 608 rodných čísel s diagnózou IBD [2].
V etiopatogenezi onemocnění se mimo jiné uplatňuje nepřiměřená imunitní odpověď, kde klíčovou roli nejspíše sehrává dysbalance mezi prozánětlivě působícími Th1/Th17 lymfocyty a regulačně působícími Treg, která vede k následné aktivaci makrofágů a B lymfocytů a infiltraci cirkulujících leukocytů do střevní stěny. Pro vznik onemocnění je pravděpodobně důležitá kombinace genetické predispozice, dysregulace imunitní odpovědi a faktorů zevního prostředí. Podíl má zřejmě i střevní mikrobiom [3,4].
Navzdory veškerému pokroku v konzervativní terapii část pacientů nedosáhne dlouhodobé remise a v průběhu 10 let od diagnózy podstoupí operaci téměř 50 % pacientů s Crohnovou chorobou. V případě ulcerózní kolitidy je to zhruba 15 %. Až polovina pacientů operovaných pro Crohnovou chorobu vyžaduje jednu či více reoperací [5−7].
Jednou z možností konzervativní a minimálně invazivní terapie by mohla být systémová, respektive lokální aplikace mezenchymálních kmenových buněk (mesenchymal stem cells, MSC). MSC jsou multipotentní buňky schopné diferencovat se do buněk tkání pocházejících z mezodermu. MSC lze izolovat například z tukové tkáně, kostní dřeně, pupečníku či placenty. K jejich vlastnostem patří kromě regeneračních také imunomodulační schopnosti, čehož je využíváno právě u chorob, jako jsou IBD, reakce štěpu proti hostiteli (GVHD), roztroušená skleróza, revmatická onemocnění či autoimunitní diabetes mellitus [8,9].
V experimentálních studiích bylo prokázáno, že MSC pozitivně ovlivňují průběh akutní i chronické kolitidy ve smyslu nižší ztráty hmotnosti subjektu a snížení frekvence krvavých stolic [10−14,22]. Hlodavci léčení kmenovými buňkami mají po usmrcení delší tračník, což odpovídá menší míře fibrózy střevní stěny [10,11,15]. V mikroskopickém obraze pak nalézáme menší zánětlivý infiltrát, méně fibrotické tkáně, vyšší vaskularitu [10,11,14,15]. Z molekulárních studií vyplývá, že ve srovnání s kontrolou dochází k upregulaci protizánětlivých cytokinů (IL-10, TGF-β, IGF-1) [11,16,17,22], downregulaci prozánětlivých a profibrogenních cytokinů (TNF-α, IL-12, IL-6, IL-23, IL-2, IL-13, IL-1-beta) [11,15,22], downregulaci TGF-beta/Smad kaskády podílející se na fibrotických změnách, down regulaci epitelo-mezenchymální tranzice jakožto významného faktoru fibrózy a tvorby píštělí [15] a ke snížení oxidačního stresu, kterému jsou tkáně v akutním zánětu vystaveny [18]. Dále také dochází k normalizaci mikrobiomu [19].
Systémově podané MSC jsou nejvíce detekovatelné v plicích, ve slezině, méně pak v lymfatických uzlinách. V zánětlivé sliznici střeva je jejich výskyt minimální, proto se nabízí myšlenka, že cesta jejich působení je hlavně parakrinní [19−21].
Cílem tohoto sdělení je předložit čtenářům systematický souhrn výsledků hodnocení účinnosti aplikace MSC v léčbě IBD.
METODY
K vyhledávání článků byla použita databáze Pub - Med za užití klíčových slov MSC, stem cells, colitis, ulcerative colitis, Crohn, IBD a vyhledávacích operátorů AND a OR. Zařazeny byly studie publikované v anglickém jazyce mezi lety 2015 a 2021 splňující následující kritéria: pacienti s diagnózou IBD či běžně užívané zvířecí modely těchto onemocnění, využití MSC či z nich derivovaných substancí. Vyřazena byla souhrnná sdělení.
VÝSLEDKY
Vyhledáváním v databázi bylo po iniciálním výběru získáno 80 citací. Vyřazeno bylo 10 systematických přehledů, dále 2 články publikované pouze v ruském jazyce. Do přehledu bylo finálně zařazeno celkem 21 klinických studií a 47 experimentálních studií.
Využití MSC u perianální Crohnovy choroby
Nejvíce zkušeností s použitím kmenových buněk je u perianální Crohnovy choroby (PACD), odtud také pocházejí nejrobustnější data o jejich klinickém použití.
Výsledky studií získané vyhledáváním jsou shrnuty v Tab. 1. K léčbě komplexních píštělí byly MSC použity v 11 klinických studiích, z toho pouze 2 studie jsou dvojitě zaslepené a placebem kontrolované.
Table 1. MSC v léčbě perianální Crohnovy choroby
Tab. 1: MSC in the treatment of perianal Crohn’s disease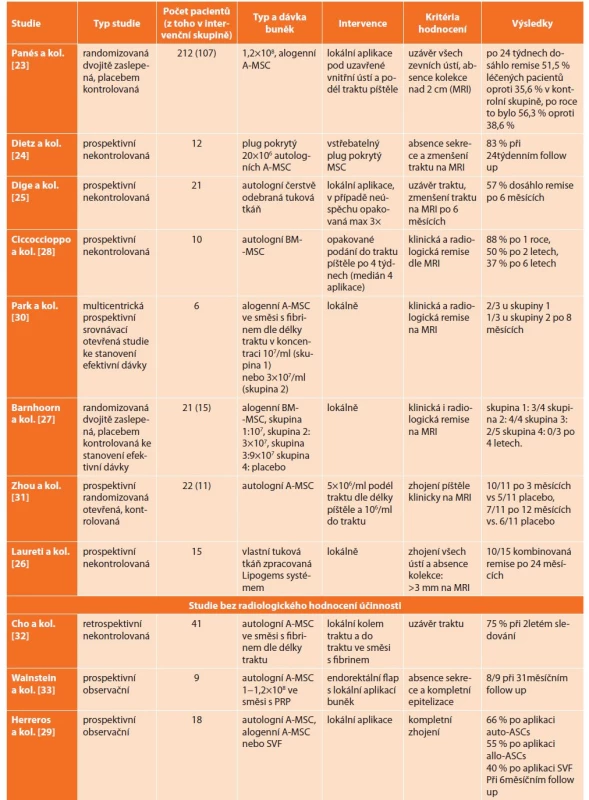
Vysvětlivky: A-MSC − adipose-derived mesenchymal stem cells (mesenchymální kmenové buňky z tukové tkáně), BM-MSC − bone marrow mesenchymal stem cells (mesenchymální kmenové buňky z kostní dřeně), SVF − stromal vascular fraction (stromální vaskulární frakce), PRP − platelet rich plasma (plazma bohatá na destičky) Table 2. MSC v léčbě rektovaginálních píštělí při Crohnově chorobě
Tab. 2: MSC in the treatment of rectovaginal fistulae in Crohn‘s disease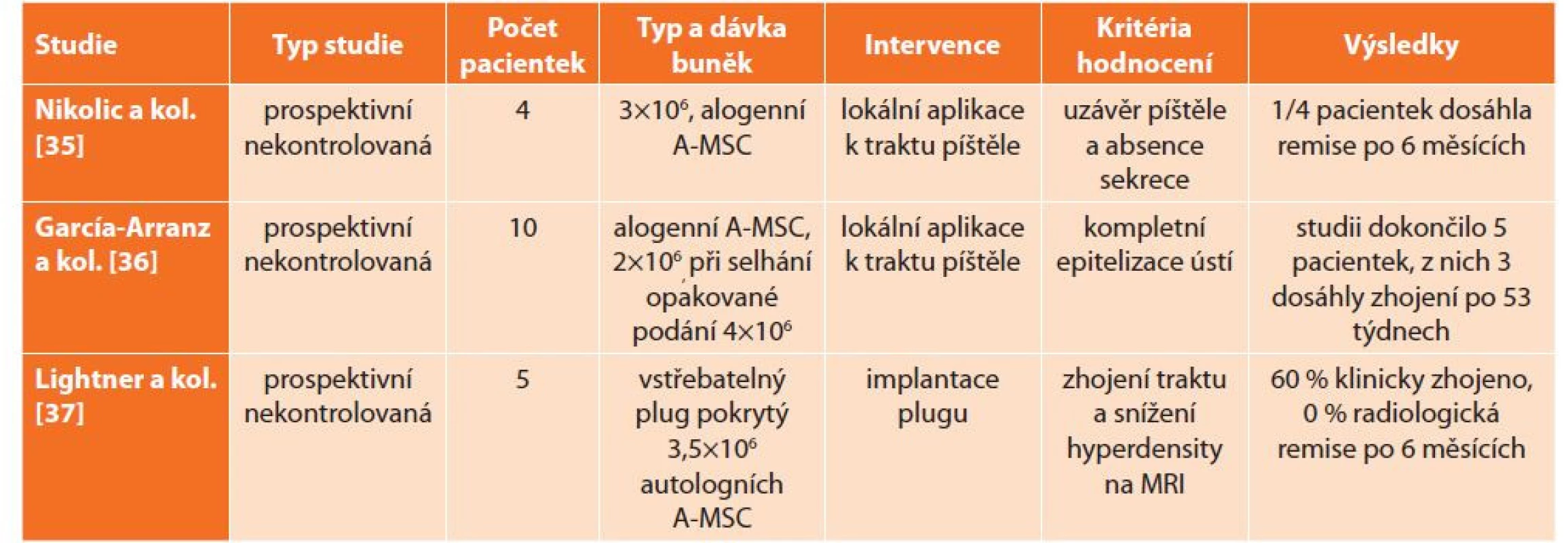
Vysvětlivky: A-MSC − adipose-derived mesenchymal stem cells (mesenchymální kmenové buňky z tukové tkáně) V roce 2018 schválila Evropská léková agentura k léčbě PACD užití alogenních kmenových buněk izolovaných z tukové tkáně. První komerční podání Darvadstrocelu (Alofisel®, Takeda Pharma, Dánsko) v ČR se uskutečnilo v roce 2019. Základním argumentem ke schválení byly výsledky mezinárodní multicentrické randomizované studie ADMIRE-CD publikované v roce 2018 [23]. Do studie bylo zařazeno 212 pacientů. Odpovědi dosáhlo po 24 týdnech 51,5 % léčených pacientů oproti 35,6 % nemocných z kontrolní skupiny. Po jednom roce se klinická odpověď zvýšila na 56,3 % oproti 38,6 %. Pacientky s rektovaginální píštělí byly ze studie vyřazeny.
Další studie se nyní zabývají možnostmi, jak zvýšit účinnost podání kmenových buněk. Dietz a kol. [24] publikovali práci, ve které při léčbě použili kolagenovou zátku (plug) pokrytou 20x106 autologních kmenových buněk z tukové tkáně, remise dosáhlo 83 % pacientů.
Ve snaze zjednodušit a zlevnit terapii kmenovými buňkami použili Dige a kol. [25] čerstvě odebranou autologní tukovou tkáň v množství dle rozsahu postižení (průměrně 46 ml). Odběr i aplikace probíhaly během jedné operace v celkové anestezii. Po první aplikaci dosáhlo remise 43 % z 21 zahrnutých pacientů. V případě selhání bylo přistoupeno k opakovanému podání − maximálně 3 aplikace. Celkem poté dosáhlo remise 57 % pacientů. Studie s aplikací čistých kmenových buněk mají však po první aplikaci úspěšnost vyšší. Čerstvě odebranou tukovou tkáň použili i Laureti a kol. [26], remise dosáhlo 10 z 15 pacientů.
Kmenové buňky z kostní dřeně využili Barnhoorn a kol. [27] a Ciccoccioppo a kol. [28] ve studiích s relativně malým počtem pacientů a heterogenními výsledky v závislosti na aplikovaném množství − účinnost se pohybuje mezi 0 a 100 % při čtyřletém sledování v případě první studie. V případě druhé studie potom výrazně poklesne z 88 % na 37 % v průběhu šesti let.
Herreros a kol. [29] srovnali účinnost alogenních a autologních kmenových buněk z tukové tkáně na malém souboru pacientů. Nebylo dosaženo signifikantního rozdílu mezi těmito dvěma typy buněk.
Rektovaginální píštěle při Crohnově chorobě
Rektovaginální (RV) píštěle jsou zvláště obtížně léčitelné a konvenční terapeutické techniky u nich selhávají častěji než u píštělí jiných lokalizací [34].
Darvadstrocel k léčbě RV píštělí použili v malé pilotní studii Nikolic a kol. [35] Ústí píštěle byla z rektální i vaginální strany překryta slizničním lalokem, buňky byly poté aplikovány do blízkosti píštěle. Ke zhojení došlo pouze u jedné pacientky ze čtyř zahrnutých.
I další dvě studie pracují s malým souborem pacientek. García-Arranz a kol. [36] provedli podobnou studii s alogenními kmenovými buňkami izolovanými z tukové tkáně. Follow-up dokončilo jen 5 pacientek, z nich 3 byly po 53 týdnech zhojeny. Lightner a kol. aplikovali pacientkám do píštěle biodegradabilní plug pokrytý autologními buňkami derivovanými z tukové tkáně. Ke klinické remisi došlo u 60 % pacientek, hyperdenzita viditelná v místě píštěle na MRI však přetrvávala i po 6 měsících u všech.
Luminální choroba
Experimentální studie
Mezi lety 2015 a 2021 bylo publikováno 47 studií zabývajících se podáním kmenových buněk u experimentálního modelu kolitidy. Všechny byly provedeny na malém laboratorním zvířeti. Kolitida byla indukována chemicky, kdy laboratorním zvířatům byla podávána kyselina trinitrobenzensulfonová (TNBS) rektálně nebo opakovaně perorálně dextran sulfát sodný (DSS). TNBS spouští buněčnou imunitní odpověď zprostředkovanou T lymfocyty, zároveň dochází k expresi Th2 cytokinů, které bývají přítomny u ulcerózní kolitidy [12]. DSS indukované postižení střeva spouští infiltraci polymorfonukleárů do stěny střevní a reakce je zprostředkována především vrozenou imunitou, čímž se od IBD postižení liší [10].
Ve většině studií byly MSC aplikovány systémově nitrožilně nebo intraperitoneálně v dávce řádově 106. Tři studie hodnotily lokální podání endoskopicky.
V Tab. 3 jsou shrnuty klinické, endoskopické, histopatologické a molekulární nálezy včetně exprese nejčastěji sledovaných interleukinů. Z výsledků je zřejmý pozitivní vliv MSC u modelu IBD kolitidy včetně snížení exprese prozánětlivých (IFN-γ, TNF-α, IL-12, IL-17, IL-beta) a naopak zvýšení exprese protizánětlivých (TGF-β, IL-10, IL-4) cytokinů [10,11,13,14,16,17,19,21,22,38−74].
Table 3. Účinky MSC v experimentálním modelu IBD kolitidy
Tab. 3: The effects of MSC in an experimental model of IBD colitis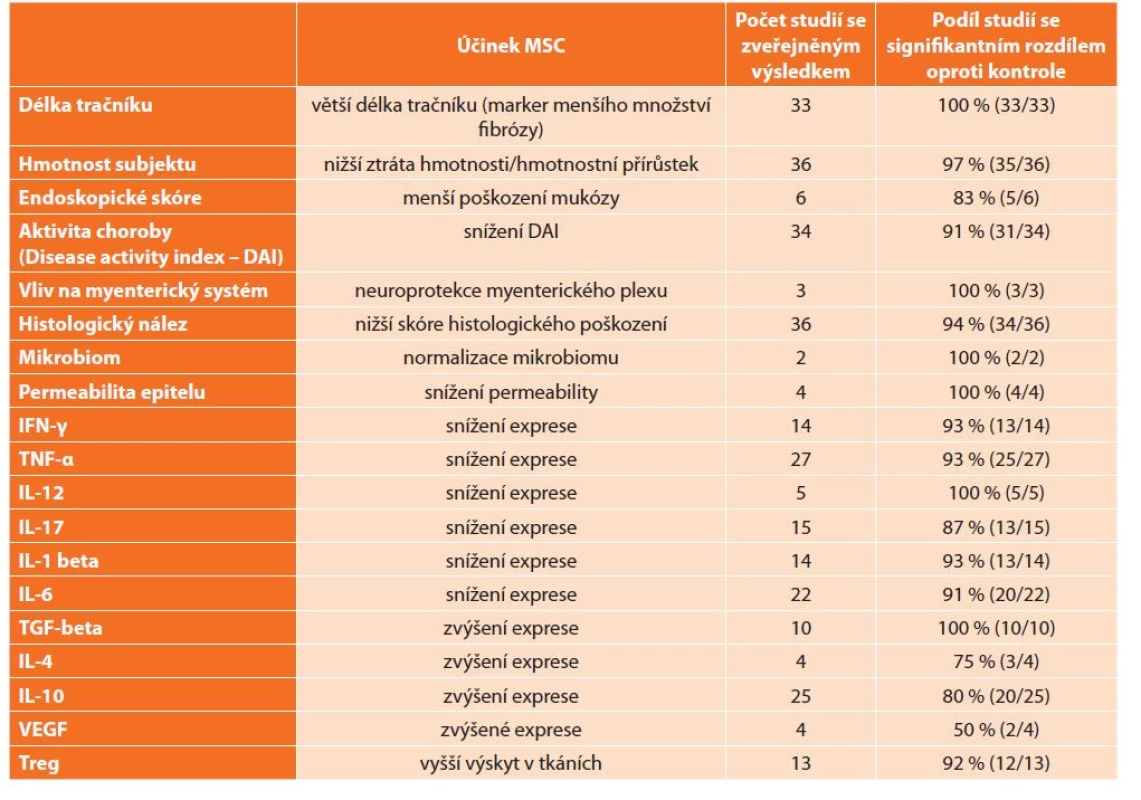
Klinické studie
Zadaná kritéria splňovalo 5 klinických studií zabývajících se systémovým podáním kmenových buněk u pacientů s luminální chorobou. Výsledky jsou shrnuty v Tab. 4.
Table 4. MSC v léčbě luminální choroby
Tab. 4: MSC in the treatment of luminal disease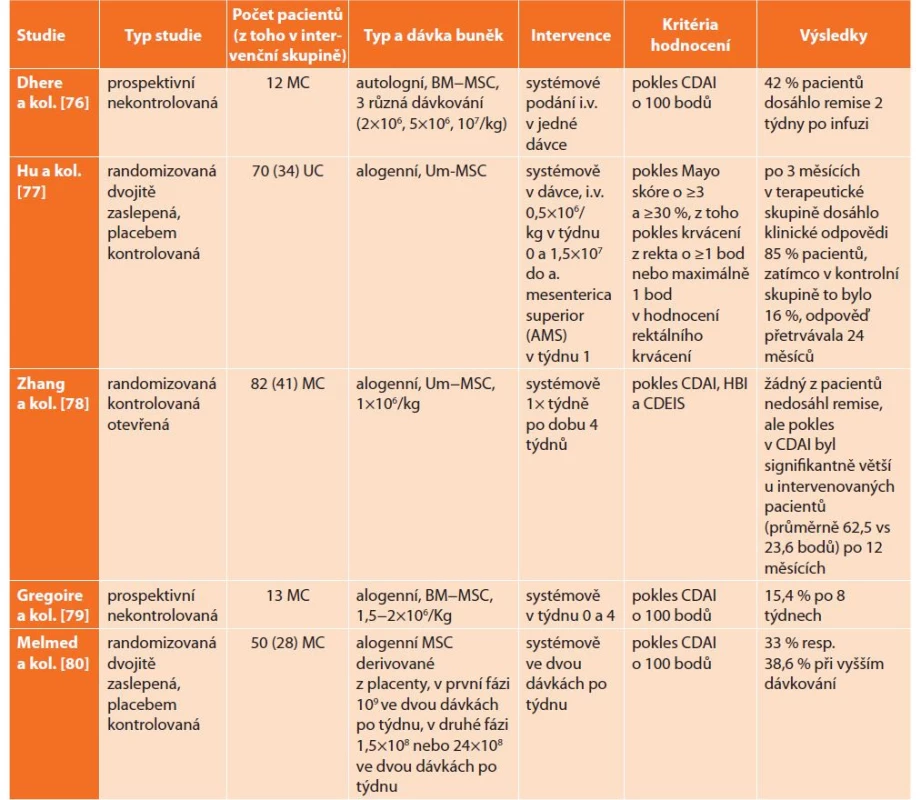
Vysvětlivky: BM-MSC −bone marrow mesenchymal stem cells (mesenchymální kmenové buňky z kostní dřeně), Um-MSC− umbilical cord mesenchymal stem cells (mesenchymální kmenové buňky z pupečníku) Poměrně krátký, dvoutýdenní, follow-up měla studie publikovaná Dhere a kol. [75], ve které dosáhlo remise 42 % pacientů (N=12) se středně těžkou Crohnovou chorobou, u nichž selhala konvenční léčba. Zároveň byly u 7 z 12 pacientů hlášeny závažné nežádoucí účinky, z toho pět bylo hospitalizovaných pro exacerbaci Crohnovy choroby. Tu však autoři nepřisuzují infuzi s kmenovými buňkami. U jednoho pacienta byla diagnostikována akutní apendicitida a jeden pacient onemocněl klostridiovou kolitidou.
Celkem 34 pacientů s refrakterní středně těžkou až těžkou ulcerózní kolitidou randomizovali Hu a kol. [76]. Po 3 měsících dosáhlo klinické odpovědi 85 % pacientů v terapeutické skupině oproti 16 % ve skupině kontrolní. Remise přetrvávala až do ukončení 24měsíčního sledování. Maximálního efektu bylo dosaženo 6 měsíců po aplikaci. Nebyly hlášeny žádné nežádoucí účinky. V průběhu sledování byly hodnoceny i plazmatické hladiny cytokinů TNF-α, IL-6 a IFN-γ, ale nebyl zaznamenán signifikantní rozdíl v jejich hladině.
Zhang a kol. [77] publikovali prospektivní randomizovanou studii u pacientů se středně těžkou až těžkou kortikodependentní Crohnovou chorobou (N=41). Žádný z pacientů během jednoletého sledování nedosáhl remise, nicméně v terapeutické skupině měli pacienti významnější pokles Crohn‘s Disease Activity Index (CDAI) i Crohn‘s Disease Endoscopic Index of Severity (CDEIS) oproti kontrole. Z nežádoucích účinků byla hlášena horečka ve čtyřech případech, 7 případů infekce močových cest. Závažný nežádoucí účinek nebyl hlášen žádný.
Gregoire a kol. [78] publikovali výsledky podání MSC u 13 pacientů s těžkou Crohnovou chorobou. Pouze jeden pacient dosáhl remise definované jako CDAI <150, dva pacienti dosáhli poklesu CDAI o 100 bodů. Nebyly hlášeny žádné nežádoucí účinky, kromě jednoho případu lehkého infektu horních cest dýchacích.
Pokusy s podáním mezenchymálních buněk derivovaných z placenty provedli Melmed a kol. [79]. Zahrnuti byli pacienti se středně těžkou až těžkou Crohnovou chorobou. U 10 z 28 pacientů byla zaznamenána klinická odpověď, čehož nedosáhl žádný z pacientů v kontrolní skupině. Celkem 4 pacienti dosáhli klinické remise definované jako CDAI <150. Na druhou stranu byl zaznamenán poměrně vysoký výskyt nežádoucích účinků − nejčastěji horečka, erytém, bolesti hlavy; u 3 pacientů byly zachyceny závažné události (alergická reakce, perforace žaludečního vředu, karcinom anu). Do jaké míry komplikace souvisely s aplikací MSC, není jasné. Toto koreluje i s výsledky jiných studií s podáním buněk derivovaných z placenty (tromboembolie, infarkt myokardu), studie byla proto předčasně zastavena.
Enterokutánní píštěle
Experimentální studie
Všechny publikované experimentální práce používají jako model enterokutánní píštěle hlodavčí cékostomii, jak ji publikoval v roce 1998 Bültmann [80]. Práce se shodují, že lokální aplikace MSC má pozitivní vliv na hojení píštěle ve smyslu snížení výdeje i zmírnění klinických projevů. Výsledky jsou shrnuty v Tab. 5.
Table 5. MSC v experimentálním modelu enterokutánní píštěle
Tab. 5: MSC in an experimental model of enterocutaneous fistula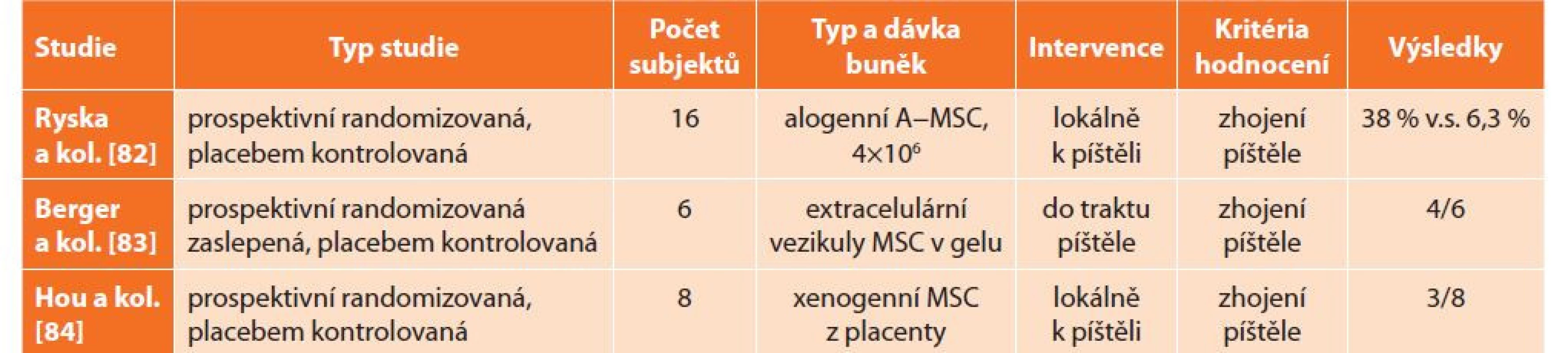
Vysvětlivky: A-MSC − adipose-derived mesenchymal stem cells (mesenchymální kmenové buňky z tukové tkáně) Ryska a kol. [81] použili výše uvedený model enterokutánní píštěle k hodnocení lokální aplikace kmenových buněk derivovaných z tukové tkáně u krys. Po dokončení 30denního sledování bylo dosaženo kompletního zhojení u 38 % intervenovaných zvířat oproti 6,3 % v kontrolní skupině, které bylo aplikováno placebo.
Berger a kol. [82] provedli výzkum s lokální aplikací extracelulárních vezikul z kmenových buněk jako necelulární alternativy s předpokladem nižší imunogenicity. Substance byla aplikována v termoresponzivním gelu přímo do píštěle opakovaně jedenkrát týdně v průběhu 60 dnů. Léčené krysy měly signifikantně menší průměr i výdej píštěle a zhojení píštěle bylo dosaženo u 4 krys ze 6.
Kromě pozitivního vlivu na píštěl samotnou se účinek projevuje i menší ztrátou hmotnosti a nižší mortalitou. V tkáních byla pozorována vyšší míra exprese angiogenních faktorů [83].
Klinické studie
Mizushima a kol. [84] provedli studii hodnotící lokální aplikaci autologních kmenových buněk z tukové tkáně u pooperačních enterokutánních píštělí. Do studie bylo zahrnuto celkem 6 pacientů, u nichž selhala konvenční terapie. Soubor pacientů je z hlediska etiologie píštělí značně heterogenní: zařazení byli 4 pacienti s diagnózou ulcerózní kolitidy − 3 z nich měli enterokutánní píštěl jako komplikaci v ileopouchanální anastomóze, jeden pacient jako komplikaci v anastomóze po nízké přední resekci pro karcinoid rekta v terénu UC. Dva pacienti s diagnózou Crohnovy choroby a enterokutánní píštělí v ráně po drénu po ileocékální resekci. Celkem 5 ze 6 pacientů mělo ileostomii.
Pacientům bylo lokálně aplikováno mezi 9,60x106 a 1,42x108 autologních kmenových buněk z tukové tkáně. Část z nich byla aplikována injekčně kolem traktu píštěle, část byla aplikována endoskopicky submukózně k vnitřnímu ústí píštěle, zbytek byl smíchán s trombinem a fibrinem a aplikován přímo do traktu píštěle. Poté byla provedena sutura kůže nad píštělí. Odběr tukové tkáně i následná aplikace probíhaly v rámci jedné celkové anestezie, aplikované buňky nebyly pasážovány ani kultivovány. Po 4 týdnech došlo u 5 ze 6 pacientů k vymizení sekrece z píštěle. Po 24 týdnech byla úspěšnost terapie, definovaná jako absence sekrece a recidivy abscesu, stoprocentní. Ve spojitosti s aplikací MSC nebyly hlášeny žádné závažně nežádoucí účinky.
DISKUZE
Využití kmenových buněk v klinické medicíně je aktuální téma. V letech 2015 a 2021 bylo publikováno zhruba 500 klinických studií zabývajících se touto problematikou, přičemž spektrum indikací je široké a zahrnuje kromě autoimunitních chorob například i onemocnění pohybového aparátu nebo infekční choroby. Přestože první studie hodnotící tuto metodu byly publikovány před více než 20 lety, teprve nyní se začíná aplikace kmenových buněk dostávat do klinické praxe.
Experimentálních studií s aplikací MSC u IBD je velké množství s celkem jednoznačnými výsledky podporujícími jejich pozitivní vliv na průběh onemocnění. Úskalím těchto prací je limitace zvířecího modelu. Biologická povaha chemicky navozené kolitidy je z podstaty jiná než u IBD, nedochází k relapsu, zároveň zvířecí MSC mají jiné vlastnosti než lidské [9]. Studie vykazují značnou variabilitu jak v typu modelu, tak v původu použitých buněk a způsobu jejich podání. Proto jsou práce navzájem obtížně porovnatelné.
Nejvíce klinických studií hodnotilo účinnost léčby u perianální Crohnovy choroby. Důvodem může být i to, že kmenové buňky jsou pro toto užití již komerčně dostupné, a to včetně ČR, kde byly aplikovány několika desítkám pacientů. Účinnost se v různých studiích pohybuje v rozmezí mezi 0 až 100 %, což jen potvrzuje, že skupiny pacientů jsou většinou malé a heterogenní. Ve větších souborech bylo dosaženo účinnosti kolem 60 % [23,41]. Existuje velká variabilita ve způsobu získání a zpracování kmenových buněk, a tím i ve vlastnostech aplikovaného léčiva včetně předpokládaného obsahu MSC, kvůli čemuž jsou jednotlivé studie mezi sebou obtížně porovnatelné. Výsledky je také třeba vždy interpretovat s ohledem na metodu hodnocení. Pokud se za úspěšnou léčbu považovala nejen klinická remise, ale tzv. kombinovaná remise (klinické zhojení a negativní MR nález), byly výsledky horší. Pro pacienta má pravděpodobně větší význam zlepšení klinického nálezu, respektive kvality života než změny pozorované na zobrazovacích vyšetřeních. Na druhé straně, z dat některých studií vyplývá, že píštěle klasifikované jako zhojené na základě MRI mají nižší riziko recidivy [85]. Nejúčinnější léčbou perianální choroby je v současné době kombinace imunomodulační léčby s drenáží a následnou chirurgickou eradikací. Stran rizika inkontinence jsou nejbezpečnější sfinkter šetřící techniky (endorektální advancement flap, eventuálně podvaz intersfinkterického traktu − LIFT). Jejich účinnost se pohybuje mezi 48−87 % opět v závislosti na zvolené metodě hodnocení [34, 87, 88]. Lokální aplikace MSC se na rozdíl od těchto operací zdá být zatížena nižším rizikem možných komplikací a kratší rekonvalescencí. Kmenové buňky se dají použít jako alternativa v případě, kdy jiné metody nejsou vhodné nebo selhaly.
V ostatních indikacích není zatím míra účinnosti MSC zcela jasná. Studií hodnotících jejich efekt u luminální choroby je málo, a ačkoliv některé naznačují, že efekt MSC by mohl být pozitivní i při systémovém podání, rozmezí udávané úspěšnosti je velmi široké (15−80 %) a do značné míry opět ovlivněné způsobem hodnocení [75−79]. Chybějí studie s dostatečně velkým souborem pacientů, které by i přes značnou variabilitu fenotypů onemocnění zaručily určitou homogenitu sledované kohorty.
Nezodpovězené zatím zůstávají i otázky týkající se nejvhodnějšího typu buňek, ať už z hlediska účinnosti, nebo bezpečnosti. Není jasné, jaké je ideální množství podané při jedné aplikaci, zda je nutné aplikace opakovat a v jakých intervalech.
V případě lokální aplikace do enterokutánní píštěle jsou výsledky z experimentálních prací poměrně slibné. Data z relevantního klinického hodnocení u této indikace však zatím chybějí [82−85]. Většina zařazených pacientů měla totiž píštěl vzniklou jako důsledek pooperačních komplikací, nikoliv jako projev fistulující Crohnovy choroby.
Před širším zavedením do klinické praxe bude třeba dalšího výzkumu. V současné době probíhá 24 klinických studií zaměřených na léčbu Crohnovy choroby pomocí kmenových buněk. Většina z nich se opět zabývá lokální aplikací u pacientů s perianální chorobou, případně modifikacemi již zavedené léčby nebo rozšířením indikací o pediatrické pacienty, rektovaginální píštěle či píštěle v ileálním pouchi [88−90].
ZÁVĚR
Idiopatické střevní záněty jsou onemocnění, jejichž incidence celosvětově stoupá, a navzdory pokroku v konzervativní i chirurgické léčbě významná část pacientů nedosáhne kompletní remise a musí podstoupit opakované chirurgické zákroky. Léčba kmenovými buňkami je novou alternativou imunomodulační léčby. Její účinnost v léčbě perianální Crohnovy choroby je přinejmenším srovnatelná se současnými léčebnými metodami. Pozitivní efekt aplikace MSC byl opakovaně prokázán na zvířecích modelech luminální choroby nebo enterokutánní píštěle. Výsledky po systémovém podání u IBD pacientů jsou nejednoznačné a vycházejí pouze z malých sestav. Při zvažování této léčby je třeba zohlednit nezanedbatelný výskyt nežádoucích účinků.
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise, s výjimkou kongresových abstrakt a doporučených postupů.
Další odkazy Literatury na webových stránkách Rozhledy v chirurgii www.perspinsurg.com.
Markéta Lengálová
Stochovská 64
161 00 Praha 6
e-mail: lengalova@nemocnice-horovice.cz
Sources
1. Lukáš K, Hoch J, a kol. Nemoci střev Praha, Grada Publishing 2018.
2. Jarkovský J, Benešová K, Hejduk K, et al. Epidemiology, hospitalization and migration of patients with IBD under specialized care in the Czech Republic. Gastroenterologie a hepatologie 2017;71(6):501–509. doi:10.14735/ amgh2017501.
3. Glassner KL, Abraham BP, Quigley EMM. The microbiome and inflammatory bowel disease. J Allergy Clin Immunol. 2020 Jan;145(1):16−27. doi:10.1016/j. jaci.2019.11.003.
4. MacDonald TT, Monteleone I, Fantini MC, et al. Regulation of homeostasis and inflammation in the intestine. Gastroenterology 2011;140(6):1768–1775 doi:10.1053/j.gastro.2011.02.047.
5. Li Ch, Juemmerle JF. Mechanisms that mediate the development of fibrosis in patients with Crohn‘s disease. Inflammatory Bowel Diseases 2014;20(7):1250–1258. doi:10.1097/MIB.0000000000000043.
6. Louis E, Collard A, Oger AF, et al. Behaviour of Crohn‘s disease according to the Vienna classification: changing pattern over the course of the disease. Gut 2001;49(6):777–782. doi:10.1136/ gut.49.6.777.
7. Frolkis AD, Dykeman J, Negrón ME, et al. Risk of surgery for inflammatory bowel diseases has decreased over time: a systematic review and meta-analysis of population - based studies. Gastroenterology 2013;145(5):996–1006. doi:10.1053/j.gastro. 2013.07.041.
8. Dave M, Mehta K, Luther J, et al. Mesenchymal stem cell therapy for inflammatory bowel disease: A systematic review and meta-analysis. Inflammatory Bowel Diseases 2015;21(11):2696. doi:10.1097/ MIB.0000000000000543.
9. Chinnadurai R, Ng S, Velu V, et al. Challenges in animal modelling of mesenchymal stromal cell therapy for inflammatory bowel disease. WJG 2015;21(16):4779 – 4787 doi:10.3748/wjg.v21.i16.4779.
10. Li Y, Ma K, Zhang L, et al. Human umbilical cord blood derived-mesenchymal stem cells alleviate dextran sulfate sodium - induced colitis by increasing regulatory T cells in mice. Front Cell Dev Biol. 2020 Nov 24;8 : 604021. doi:10.3389/ fcell.2020.604021.
11. Chao K, Zhang S, Qiu Y, et al. Human umbilical cord-derived mesenchymal stem cells protect against experimental colitis via CD5+ B regulatory cells. Stem Cell Research & Therapy 2016;7(1):109. doi:10.1186/s13287-016-0376-2.
12. Randhawa PK, Singh K, Singh N, et al. A review on chemical-induced inflammatory bowel disease models in rodents. Korean J Physiol Pharmacol. 2014 Aug;18(4):279−288. doi:10.4196/ kjpp.2014.18.4.279. Epub 2014 Aug 13. PMID: 25177159; PMCID: PMC4146629.
13. Martín Arranz E, Martín Arranz MD, Robredo T, et al. Endoscopic submucosal injection of adipose-derived mesenchymal stem cells ameliorates TNBS-induced colitis in rats and prevents stenosis. Stem Cell Research & Therapy 1915;9(1):95. doi:10.1186/s13287-018-0837-x.
14. Stavely R, Robinson AM, Miller S, et al. Allogeneic guinea pig mesenchymal stem cells ameliorate neurological changes in experimental colitis. Stem Cell Res Ther. 2015 Dec 30;6 : 263. doi:10.1186/s13287 - 015-0254-3.
15. Lian L, Huang Q, Zhang L, et al. Anti-fibrogenic potential of mesenchymal stromal cells in treating fibrosis in Crohn’s disease. Digestive Diseases and Sciences 2018;63(7):1821–1834. doi:10.1007/ s10620-018-5082-8.
16. Xu J, Wang X, Chen J, et al. Embryonic stem cell-derived mesenchymal stem cells promote colon epithelial integrity and regeneration by elevating circulating IGF-1 in colitis mice. Theranostics 2020;10(26):12204–12222. doi:10.7150/ thno.47683.
17. Barnhoorn M, de Jonge-Muller E, Molendijk I, et al. Endoscopic administration of mesenchymal stromal cells reduces inflammation in experimental colitis. Inflamm Bowel Dis. 2018 Jul 12;24(8):1755 – 1767. doi:10.1093/ibd/izy130.
18. Hou H, Zhang L, Duan L, et al. Spatio-temporal metabolokinetics and efficacy of human placenta-derived mesenchymal stem/stromal cells on mice with refractory Crohn’s-like enterocutaneous fistula. Stem Cell Reviews and Reports 2020;16(6):1292–1304. doi:10.1007/ s12015-020-10053-2.
19. Soontararak S, Chow L, Johnson V, et al. Mesenchymal stem cells (MSC) derived from induced pluripotent stem cells (IPSC) equivalent to adipose-derived MSC in promoting intestinal healing and microbiome normalization in mouse inflammatory bowel disease model. Stem Cells Translational Medicine 2018;7(6):456–467. doi:10.1002/sctm.17 - 0305.
20. Park JS, Yi TG, Park JM, et al. Therapeutic effects of mouse bone marrow-derived clonal mesenchymal stem cells in a mouse model of inflammatory bowel disease. J Clin Biochem Nutr. 2015 Nov;57(3):192−203 doi:10.3164/jcbn.15 - 56.
21. Sala E, Genua M, Petti L, et al. Mesenchymal stem cells reduce colitis in mice via release of TSG6 independently of their localization to the intestine. Gastroenterology 2015 Jul;149(1):163−176.e20. doi:10.1053/j.gastro.2015.03.013.
22. Heidari N, Abbasi-Kenarsari H, Namaki S, et al. Adipose-derived mesenchymal stem cell-secreted exosome alleviates dextran sulfate sodium-induced acute colitis by Treg cell induction and inflammatory cytokine reduction. J Cell Physiol. 2021 Aug;236(8):5906−5920. doi:10.1002/jcp.30275.
23. Panés J, García-Olmo D, Assche GV, et al. Long-term efficacy and safety of stem cell therapy (Cx601) for complex perianal fistulas in patients with Crohn’s disease. Gastroenterology 2018 Apr;154(5):1334−1342.e4. doi:10.1053/j. gastro.2017.12.020.
24. Dietz AB, Dozois EJ, Fletcher JG, et al. Autologous mesenchymal stem cells, applied in a bioabsorbable matrix, for treatment of perianal fistulas in patients with Crohn’s disease. Gastroenterology 2017 Jul;153(1):59−62.e2. doi:10.1053/j. gastro.2017.04.001.
25. Dige A, Hougaard HT, Agnholt J, et al. Efficacy of injection of freshly collected autologous adipose tissue into perianal fistulas in patients with Crohn’s disease. Gastroenterology 2019;156(8):2208−2216.e1. doi:10.1053/j. gastro.2019.02.005.
26. Laureti S, Gionchetti P, Cappelli A, et al. Refractory complex Crohn’s perianal fistulas: A role for autologous microfragmented adipose tissue injection. Inflamm Bowel Dis. 2020 Jan 6;26(2):321–330, doi:10.1093/ibd/izz051.
27. Barnhoorn MC, Wasser MNJM, Roelofs H, et al. Long-term evaluation of allogeneic bone marrow-derived mesenchymal stromal cell therapy for Crohn’s disease perianal fistulas. J Crohns Colitis 2020 Jan 1;14(1):64–70. doi:10.1093/ecco-jcc/ jjz116.
28. Ciccocioppo R, Gallia A, Sgarella A, et al. Long-term follow-up of Crohn disease fistulas after local injections of bone marrow – derived mesenchymal stem cells. Mayo Clin Proc. 2015 Jun;90(6):747–755. doi:10.1016/j.mayocp.2015.03.023.
29. Herreros MD, Garcia-Olmo D, Guadalajara H, et al. Stem cell therapy: A compassionate use program in perianal fistula. Stem Cells Int. 2019 May 5;2019 : 6132340. doi:10.1155/2019/6132340.
30. Park KJ, Ryoo SB, Kim JS, et al. Allogeneic adipose-derived stem cells for the treatment of perianal fistula in Crohn‘s disease: a pilot clinical trial. Colorectal Disease 2016;18(5):468–476. doi:10.1111/ codi.13223.
31. Zhou Ch, Li M, Zhang Y, et al. Autologous adipose-derived stem cells for the treatment of Crohn’s fistula-in-ano: an open-label, controlled trial. Stem Cell Research & Therapy 2020. doi:10.1186/ s13287-020-01636-4.
32. Cho YB, Park KJ, Yoon SN, et al. Longterm results of adipose-derived stem cell therapy for the treatment of Crohn‘s fistula. Stem Cells Transl Med. 2015 May;4(5):532−537. doi:10.5966/ sctm.2014-0199.
33. Wainstein C, Quera R, Fluxá D, et al. Stem cell therapy in refractory perineal Crohn‘s disease: long-term follow-up. Colorectal Disease 2018. doi:10.1111/ codi.14002.
34. Šerclová Z, Ryska O, Bortlík M, et al. Eradikace perianálních píštělí u IBD nemocných pomocí metody Advancement Flap a rizikové faktory neúspěšného hojení. Gastroenterologie a hepatologie 2015;69(1):25–28. doi:10.14735/ amgh201512.
35. Nikolic M, Stift A, Reinisch W, et al. Allogeneic expanded adipose-derived stem cells in the treatment of rectovaginal fistulas in Crohn’s disease. Colorectal Disease 2021;23(1):153–158. doi. org/10.1111/codi.15324.
36. García-Arranz M, Herreros MD, González-Gómez C, et al. Treatment of Crohn‘s‐related rectovaginal fistula with allogeneic expanded‐adipose derived stem cells: A phase I–IIa clinical trial. Stem Cells Translational Medicine 2016;5(11):1441–1446. doi:10.5966/ sctm.2015-0356.
37. Lightner AL, Dozois EJ, Dietz AB, et al. Matrix-delivered autologous mesenchymal stem cell therapy for refractory rectovaginal Crohn’s fistulas. Inflammatory Bowel Diseases 2020;26(5):670–677. doi:10.1093/ibd/izz215.
38. da Costa Gonçalves F, Grings M, Schneider Nunes N, et al. Antioxidant properties of mesenchymal stem cells against oxidative stress in a murine model of colitis. Biotechnol Lett. 2017 Apr;39(4):613−622. doi:10.1007/s10529-016-2272-3.
39. Zheng XB, He XW, Zhang LJ, et al. Bone marrow-derived CXCR4-overexpressing MSCs display increased homing to intestine and ameliorate colitis-associated tumorigenesis in mice. Gastroenterol Rep (Oxf) 2019 Apr;7(2):127−138. doi:10.1093/gastro/goy017.
40. Lopez-Santalla M, Hervas-Salcedo R, Fernandez-Garcia M, et al. Cell therapy with mesenchymal stem cells induces an innate immune memory response that attenuates experimental colitis in the long term. Journal of Crohn’s and Colitis 2020;14(10):1424–1435. doi:10.1093/ecco - jcc/jjaa079.
41. Kawata Y, Tsuchiya A, Seino S, et al. Early injection of human adipose tissue - derived mesenchymal stem cell after inflammation ameliorates dextran sulfate sodium-induced colitis in mice through the induction of M2 macrophages and regulatory T cells. Cell and Tissue Research 2019;376(2):257–271. doi:10.1007/s00441-018-02981-w.
42. Ikarashi S, Tsuchiya A, Kawata Y, et al. Effects of human adipose tissue-derived and umbilical cord tissue-derived mesenchymal stem cells in a dextran sulfate sodium-induced mouse model. BioResearch Open Access 2019;8,(1):185–199. doi:10.1089/biores.2019.0022.
43. Liu H, Liang Z, Wang F, et al. Exosomes from mesenchymal stromal cells reduce murine colonic inflammation via a macrophage-dependent mechanism. JCI Insight. 2019 Dec 19;4(24):e131273. doi:10.1172/jci.insight.131273.
44. Nishikawa T, Maeda K, Nakamura M, et al. Filtrated adipose tissue-derived mesenchymal stem cell lysate ameliorates experimental acute colitis in mice. Digestive Diseases and Sciences 2021;66(4): 1034 – 1044. doi:10.1007/s10620-020-06359-3.
45. Regmi S, Seo Y, Ahn JS, et al. Heterospheroid formation improves therapeutic efficacy of mesenchymal stem cells in murine colitis through immunomodulation and epithelial regeneration. Biomaterials 2021;271 : 120752. doi:10.1016/j.biomaterials. 2021.120752.
46. Stavely R, Robinson AM, Miller S, et al. Human adult stem cells derived from adipose tissue and bone marrow attenuate enteric neuropathy in the guinea-pig model of acute colitis. Stem Cell Research & Therapy 2015;6(1):244. doi:10.1186/ s13287-015-0231-x.
47. Dorian Forte, et al. Human cord blood-derived platelet lysate enhances the therapeutic activity of adipose-derived mesenchymal stromal cells isolated from Crohn’s disease patients in a mouse model of colitis. Stem Cell Research & Therapy 2015;6(1)5):170. doi:10.1186/ s13287-015-0166-2.
48. Yang H, Feng R, Fuet Q, et al. Human induced pluripotent stem cell-derived mesenchymal stem cells promote healing via TNF-α-stimulated gene-6 in inflammatory bowel disease models. Cell Death & Disease 2019;10(10):1–16. doi:10.1038/ s41419-019-1957-7.
49. Yang R, Huang H, Cui S, et al. IFN-γ promoted exosomes from mesenchymal stem cells to attenuate colitis via MiR - 125a and MiR-125b. Cell Death & Disease 2020;11(7):1–12. doi:10.1038/s41419 - 020-02788-0.
50. Cao X, Duan L, Hou H, et al. IGF-1C hydrogel improves the therapeutic effects of MSCs on colitis in mice through PGE2-mediated M2 macrophage polarization. Theranostics 2020;10(17):7697 – 7709. doi:10.7150/thno.45434.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2022 Issue 4-
All articles in this issue
- Laparoskopická chirurgie v České republice – (dez)informace o stavu?
- Achalasia – position of surgery in current management
- Potential use of mesenchymal stem cells in the treatment of inflammatory bowel disease – a systematic review of the literature
- Partial jejunal diversion (PJD) with jejunocolic anastomosis − preliminary results of a pilot study
- Antibiotic therapy of postoperative bronchopneumonia in patients after lung resections – single-site experience
- Our technique of thoracoscopic first rib resection – case report
- Cryptogenic hepatocellular carcinoma as a cause of hemoperitoneum – a case report
- Ascending aortic aneurysm associated with lymphoplasmacytic thoracic aortitis mimics acute type A intramural hematoma – case report
- 30 let miniinvazivní chirurgie v České republice
- Atestace včera, dnes a zítra
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Our technique of thoracoscopic first rib resection – case report
- Achalasia – position of surgery in current management
- Potential use of mesenchymal stem cells in the treatment of inflammatory bowel disease – a systematic review of the literature
- 30 let miniinvazivní chirurgie v České republice
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

