-
Medical journals
- Career
Problematika plicních metastáz při pseudomyxomu peritonea – kazuistika a přehled literatury
Authors: P. Horák 1; P. Holečková 2; Z. Špůrková 3; J. Marvan 1; F. Antoš 1; J. Fanta 1
Authors‘ workplace: Chirurgická klinika 1. lékařské fakulty Univerzity Karlovy a Nemocnice Na Bulovce, Praha 1; Ústav radiační onkologie, 1. lékařská fakulta Univerzity Karlovy a Nemocnice Na Bulovce, Praha 2; Patologicko-anatomické oddělení, Nemocnice Na Bulovce, Praha 3
Published in: Rozhl. Chir., 2020, roč. 99, č. 10, s. 462-466.
Category: Case Report
Overview
Pseudomyxom peritonea je vzácné onemocnění způsobené diseminací nádoru tvořícího hlen a gelatinózní hmoty v peritoneální dutině. Lokální rekurence jsou časté, šíření mimo peritoneální dutinu naopak vzácné. Postižení hrudníku – pleurální a/nebo plicní metastázy – je v literatuře popisováno ojediněle.
Kazuistika: Předkládáme případ pacientky, kterou jsme operovali pro oboustranné plicní metastázy pseudomyxomu peritonea. Vlevo jsme odstranili 1 metastázu, vpravo celkem 12 ložisek. V dalším průběhu nemoci byla pacientka ve velmi dobrém klinickém stavu. Došlo však k rozvoji dalších plicních ložisek. Recentně byla operována pro metastázu v 2. bederním obratli.
Závěr: Cytoredukční chirurgické výkony pro nitrohrudní postižení při pseudomyxomu peritonea, při postižení pleury doplněné intrapleurální hypertermickou chemoterapií, mohou v indikovaných případech přispět k prodloužení života nemocných.
Klíčová slova:
pseudomyxoma peritonei – pulmonary metastases – cytoreductive surgery – intrapleural hypothermic chemotherapy
Úvod
Pseudomyxom peritonea (PMP) je vzácné onemocnění způsobené diseminací nádoru tvořícího hlen a gelatinózní hmoty v peritoneální dutině. V nejnovější klasifikaci z roku 2016 se dělí na 3 kategorie: low grade, high grade a high grade s výskytem buněk tvaru pečetního prstene [1]. Nejčastější příčinou jsou benigní či maligní tumory apendixu. Na nádorových buňkách pseudomyxomu byla detekována snížená exprese E-cadherinu a zvýšená exprese N-cadherinu a vimentinu. Tento specifický fenotyp zřejmě určuje způsob šíření pseudomyxomu [2]. Lokální rekurence jsou časté, šíření mimo peritoneální dutinu je naopak vzácné. Postižení hrudníku je v literatuře popisováno ojediněle, formou kazuistik či malých souborů pacientů. V našem sdělení předkládáme případ jediné pacientky, která byla operována pro plicní metastázy pseudomyxomu peritonea na našem pracovišti, které je centrem s více než 20letou zkušeností v cytoredukční chirurgii (CRS) a hypertermické intraperitoneální chemoterapii (HIPEC) pro malignity peritonea [3].
Kazuistika
Žena, ročník narození 1966, byla konzultována na našem pracovišti ošetřujícím onkologem poprvé v roce 2013 pro pseudomyxom peritonea. Anamnesticky nikdy vážněji nestonala, uváděla alergii na jodové kontrastní látky, jinak byla její osobní, rodinná i pracovní anamnéza negativní. Přišla recentně po gynekologické operaci v jiné nemocnici, kde byla indikována k výkonu pro suspektní tumor ovaria. Tam byly provedeny hysterektomie, adnexektomie, apendektomie a parciální omentektomie s histologickým nálezem low grade mucinózního adenokarcinomu apendixu s projevy psedomyxomu peritonea. Naším mezioborovým týmem byla indikována k second-look operaci, CRS a HIPEC. V listopadu 2013 podstoupila operaci na našem pracovišti s nálezem tumorózní infiltrace zbytku velkého omenta, sleziny, bránice vlevo, mezocolon a mezenteria. Byla provedena omentektomie, metastazektomie z malého omenta, splenektomie, parciální resekce bránice s primární suturou, maximální cytoredukce mezenteria a mezokola až do oblasti malé pánve, excize umbiliku s aplikací HIPEC. Histologicky byl potvrzen high grade pseudomyxom peritonea. Pooperační průběh byl bez závažných komplikací.
Pacientka následně absolvovala 8 cyklů adjuvantní chemoterapie kapecitabinem. V dalších letech byla sledována bez známek lokální recidivy až do roku 2017. Nově zjištěná ložiska v břišní stěně a v pánvi byla operabilní (Obr. 1), přistoupili jsme proto k další operaci. Při revizi v červnu 2017 byla nalezena ložiska pseudomyxomu v břišní stěně a v levé polovině peritonea pánve. Byla provedena CRS, HIPEC. Histologicky byla potvrzena recidiva pseudomyxomu peritonea (Obr. 2).
Image 1. CT nález – šipky označují ložisko na pánevním peritoneu vlevo
Fig. 1: CT scan – arrows indicate the focus in the left pelvic peritoneum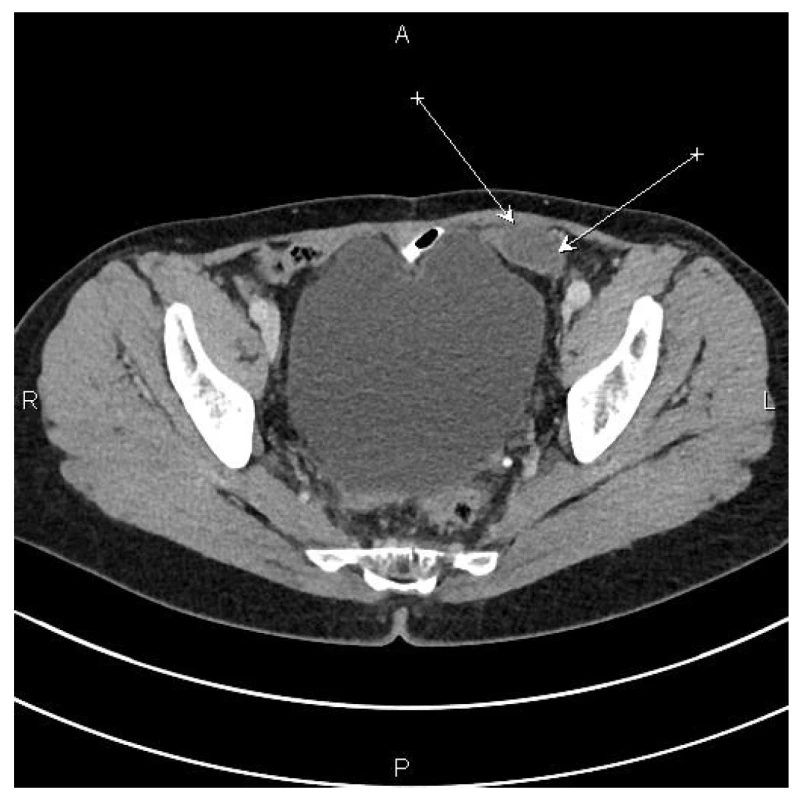
Image 2. Histologický řez, peritoneum, hematoxylin-eosin
Hvězdičky označují ložiska tumoru na peritoneu.
Fig. 2: Biopsy section, peritoneum, HE staining
Stars indicate the peritoneal tumour foci.
Pacientka byla dále dispenzarizována a po roce se objevila na CT nová ložiska v plicích, vlevo v 8. segmentu při interlobiu ložisko 16×18 mm (Obr. 3), další 3 drobná ložiska subpleurálně vpravo v horním a středním laloku a v 6. segmentu. Ložiska byla suspektní z metastatického procesu. Cytologicky se původ procesu nepodařilo prokázat. Indikovali jsme operační revizi s peroperačním vyšetřením ložisek.
Image 3. CT nález – šipky označují ložisko v levé plíci
Fig. 3: CT scan – arrows indicate the focus in the left lung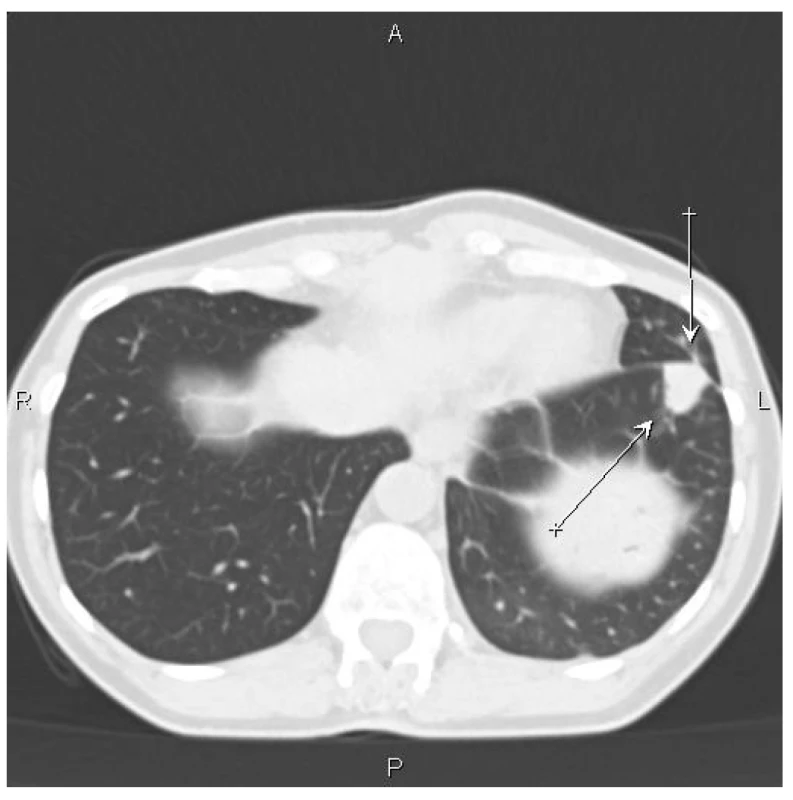
V červenci 2017 byla z levostranné torakotomie klínovitě resekována 2 ložiska a proveden sampling mediastinálních uzlin. Peroperačně byl nález hodnocen jako pravděpodobný adenokarcinom, nešlo však rozlišit, zda jde o primární, či sekundární tumor. S ohledem na anamnézu břišního tumoru a druhostranný plicní nález jsme klínovitou resekci nerozšiřovali. V definitivním histologickém popisu bylo jedno z ložisek benigní plicní hamartom, ložisko v 8. segmentu bylo zhodnoceno jako výrazně hlenotvorný, převážně glandulárně uspořádaný adenokarcinom s metastázou do 2 z 5 uzlin (Obr. 4). Imunohistochemicky byly CK 20, MUC2, MUC5, CDX2 a napsin A pozitivní, CK 7 a TTF1 negativní. Hodnotící lékařka uvedla: „Vzhledem k výsledkům imunohistochemie, mikroskopickému obrazu i přítomnosti metastáz v LN se s vysokou pravděpodobností jedná o primární plicní adenokarcinom, nejspíše intestinální typ. Ovšem ani metastázu při základní dg. karcinomatóza peritonea (pseudomyxoma peritonei) nelze stoprocentně vyloučit.“
Image 4. Histologický řez ložiskem v levé plíci, hematoxylin- eosin
Hvězdičky označují ložiska tumoru.
Fig. 4: Biopsy section of the left lung focus, HE staining
Stars indicate the tumour foci.
V říjnu téhož roku jsme přistoupili k operaci na pravé straně. V tomto případě bylo oproti očekávání nalezeno více, celkem 12 ložisek. Ve všech byla zastižena drobná metastatická ložiska mucinózního adenokarcinomu. Všechny vyšetřené lymfatické uzliny byly bez nádorových struktur. Ložiska byla tvořena strukturami dobře diferencovaného hlenotvorného (mucinózního) adenokarcinomu, extracelulární hlen vytvářel až hlenová jezírka (Obr. 5). Imunohistochemicky byl TTF1 v tumoru zcela negativní a napsin A v tumoru intracelulárně slabě pozitivní. Tento nález hodnotila vyšetřující patoložka následovně: „Vzhledem k anamnéze, kdy jsou u pacientky známy karcinomatóza peritonea (klinicky high grade pseudomyxom peritonea) a tumor levé plíce, kde nebyla jednoznačně primarita určena, nelze jednoznačně ani v této biopsii primaritu určit. Obě léze mohou vykazovat zcela stejný imunoprofil. Dle klinického nálezu bych spíše hodnotila nález jako plicní metastázu tumoru dutiny břišní (i přes pozitivitu plicního markeru napsin A, který může vycházet pozitivně i v metastázách do plic).“ Následně byla v nádoru prokázána mutace genu K-RAS v exonu 2 (c.35G>T, p.Gly 12 Val). Nechali jsme zpětně vyšetřit původní preparát z první operace. V tomto preparátu byla mutace K-RAS negativní.
Image 5. Histologický řez ložiskem v pravé plíci, hematoxylin- eosin
Hvězdičky označují ložiska tumoru.
Fig. 5: Biopsy section of the right lung focus, HE staining
Stars indicate the tumour foci.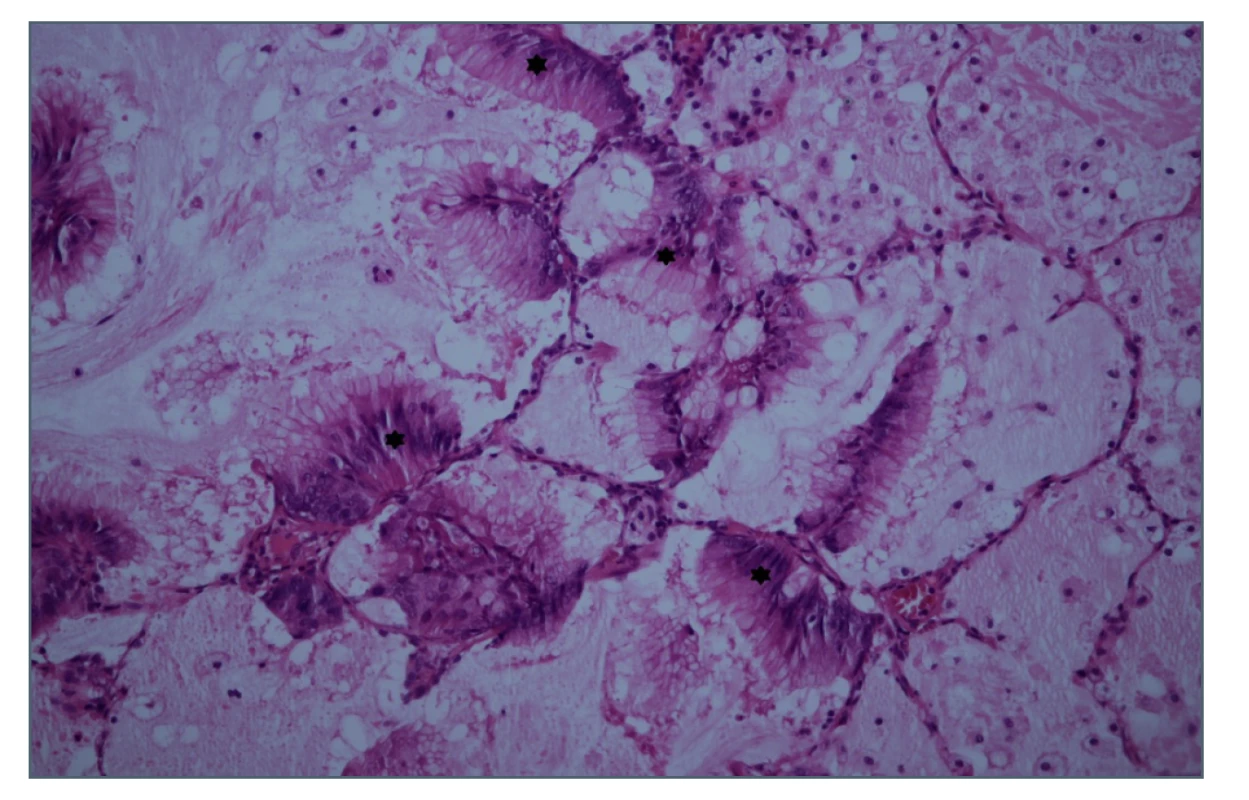
Ačkoli byla klinicky provedena oboustranně R0 resekce, došlo rychle, již po 3 měsících, k dalšímu výsevu plicních ložisek oboustranně. Další průběh byl komplikován obstrukčním ikterem, který se objevil v listopadu 2018. Na CT byly nově patrné změny v játrech suspektní z metastatického procesu. Punkcí pod CT kontrolou však nebyla nádorová infiltrace potvrzena. Ikterus byl řešen cestou perkutánní transhepatické drenáže s následným převedením na vnitřní drenáž. Dle magnetické rezonance jater šlo o jizevnatou stenózu ductus hepaticus dexter et sinister v oblasti junkce, v jaterním hilu žádné nádorové masy nebyly nalezeny. Dále bylo popsáno stacionární ložisko pseudomyxomu při velké kurvatuře žaludku.
Navzdory výše uvedeným nálezům byla pacientka v celkově dobrém stavu, proto podstoupila dalších 9 cyklů chemoterapie oxaliplatinou.
Na kontrolním PET/CT vyšetření koncem roku 2019 byl vidět progredující vícečetný ložiskový proces v plicích, nešlo vyloučit ani postižení pleury vpravo. Proces byl relativně málo FDG avidní, což limitovalo senzitivitu vyšetření. Podbráničně nebyla ložiska patrná, což však nevylučovalo ani relativně extenzivní postižení břišní dutiny.
Z důvodu jaterního postižení pacientce již nebyla podávána další systémová léčba.
Pacientka byla v celkem uspokojivém stavu, hodnocena jako PS 1 dle WHO. Byla nadále sledována a je jí poskytována jen podpůrná léčba. Recentně, v květnu 2020, byla operována pro patologickou zlomeninu obratle L2 s histologicky prokázanou metastázou mucinózního karcinomu.
Diskuze
První práce o chirurgické léčbě plicních a pleurálních metastáz PMP byly publikovány v 90. letech 20. století [4]. Jak již zaznělo v úvodu, šíření pseudomyxomu peritonea mimo peritoneální dutinu je vzácné. Na rozdíl od většiny karcinomů se tato nemoc zřídka šíří lymfatickým systémem či krevní cestou. Nitrohrudní postižení se projevuje plicními metastázami a/nebo pleurálním postižením, které je diagnostikováno vzácně současně s břišním postižením, většinou s odstupem 1−15 let od diagnózy PMP [5].
V diferenciální diagnostice plicních ložisek a postižení pleury u pacientů v PMP je nutno uvažovat o metastázách PMP, o primárních plicních tumorech i o metastázách jiného (i okultního) tumoru, než je PMP. Především je nutno zmínit primární mucinózní cystické neoplázie a koloidní karcinomy plic. Nález celé škály změn od benigních přes různé stupně atypií po zjevně maligní buňky je typický pro primární tumor a nevyskytuje se u většiny metastáz pseudomyxomu. U primárních mucinózních karcinomů plic se nevyskytují cytologicky pozitivní pleurální výpotky. Odlišit mucinózní bronchialveolární karcinom plic a metastázu PMP je snadnější. Bronchioalveolární karcinom vykazuje lepidický růst podél alveolárních sept. Cytologicky může být nerozeznatelný výpotek u primárního mucinózního adenokarcinomu plic a při sekundárním pleurálním postižení u PMP. Dokonce i imunohistochemicky může být velmi obtížné tyto dvě jednotky rozlišit. Dalším primárním plicním tumorem, o kterém je nutno v diferenciální diagnostice uvažovat, je dobře diferencovaný mukoepidermoidní karcinom. Tento karcinom má buňky s různým stupněm skvamózní diferenciace, která se u PMP nevyskytuje [6].
V donedávna největší studii z roku 2000 hodnotili autoři Pestieaeu a kol. výskyt pleurálního postižení u 426 pacientů s pseudomyxomem peritonea. 23 (5,4 %) nemocných mělo sekundární postižení pleury. Z těchto 23 pacientů měli 4 pacienti (17 %) pleurální metastázy diagnostikovány současně s nitrobřišním postižením.
V retrospektivní studii Geisingera a kol. z roku 2007 bylo zařazeno 101 pacientů léčených pro pseudomyxom peritonea apendikálního původu. U 5 se objevily nitrohrudní metastázy. 3 z těchto nemocných měli low grade pseudomyxom. Ve 2 případech šlo o plicní metastázy, třetí z nich měl šíření na pleuru do levého hemithoraxu. 2 pacienti s high grade PMP měli pravostranný pleurální výpotek bez průkazu poranění pleury, cytologicky se jednalo o high grade karcinom v pleurálním výpotku [6].
V práci z roku 2019 Beane a kol. zhodnotili soubor 382 pacientů, kteří podstoupili CRS a HIPEC pro pseudomyxom peritonea apendikálního původu. U 61 (16 %) pacientů se objevila rekurence na pleuře či v plicích [7]. Podíl hrudních metastáz byl tedy podstatně vyšší než u ostatních autorů. Zde však musíme upozornit na fakt, že diagnóza byla určována často jen na základě zobrazovacích metod a bylo operováno jen 5 pacientů s diagnostikovaným nitrohrudním postižením.
Jako rizikové faktory pro rekurenci v hrudníku byly zjištěny nález high grade pseudomyxomu při primární břišní operaci, vyšší krevní ztráta (1605 vs. 1201 ml), výkony na bránici a inkompletní cytoredukce při břišní operaci [7]. Většina autorů se shoduje, že rizikovým faktorem pro šíření do pleurální dutiny jsou výkony na bránici či dokonce otevření pleurální dutiny během primární cytoredukční operace [8,9,10]. Řada center, včetně našeho, proto aplikuje hypertermickou cytostatickou pleuroperitoneální laváž (HITAC) po resekci bránice k prevenci pleurální rekurence [11]. Výkon je sice spojen s vyšší morbiditou [12] a v jedné studii i s vyšší mortalitou [13], ale výrazně snižuje riziko rekurence v hrudníku. Při srovnání uzávěru defektu bránice jen s HIPEC a uzávěru bránice až po kombinované pleuroperitoneální laváži (HITAC) došlo ke snížení pleurální rekurence z 60 na 8 % [11], či dokonce ze 75 % na 6 % [12]. U referované pacientky bohužel laváž tímto způsobem neproběhla navzdory faktu, že u řady pacientů jsme laváž obou dutin současně provedli. Důvod se nám zpětně nepodařilo zjistit. Jako rizikové faktory pro nitrohrudní rekurenci PMP jsou uváděny přímé šíření tumoru, vrozená pleuroperitoneální komunikace, lymfatický či krevní přenos [9,10]. Přínos chirurgického řešení metastáz PMP do plic či na pleuru není dosud dostatečně ověřen [15]. Podobně jako celá problematika má dosud řadu nevyjasněných otázek. Zdá se však, že chirurgické řešení je při splnění indikačních kritérií přínosem pro nemocné a prodlouží jim život i interval bez nemoci [9,15]. Obecnými kritérii pro řešení plicních metastáz je R0 resekce primárního tumoru, vyloučení metastáz v jiné lokalizaci, případně možnost jejich chirurgického řešení a interní a funkční únosnost nemocného k plicní resekci.
V literatuře je referováno celé spektrum výkonů od neanatomických resekcí plicních metastáz až po pleuropneumonektomie s intrapleurální chemoterapií. Již v roce 1995 byla publikována práce o léčbě 3 případů plicních metastáz u pacientů se základní diagnózou pseudomyxomu peritonea s následným bezpříznakovým průběhem 2−8 let po resekci [4]. Kawaguchi a kol. ve své práci hodnotili 17 pacientů s nitrohrudními metastázami PMP [14]. Všichni pacienti podstoupili nitrohrudní CRS závisející na typu postižení – anatomické resekce včetně extrapleurální pneumonektomie, neanatomické plicní resekce, parietální pleurektomie, resekce bránice, exstirpace lézí a kombinace těchto výkonů. Výkony byly dle nálezu doplněny intrapleurální hypertermickou chemoterapií (HITHOC) mitomycinem či kombinací cisplatiny s mitomycinem. Doba pooperačního sledování byla maximálně 69 měsíců, nemocniční mortalita 5,9 %, morbidita 29 %, nejčastější závažnou komplikací byl pleurální empyém (18 %). Medián přežití 45,5 měsíce, 5leté přežití 46 % a relaps free survival 34,9 měsíce. Medián přežití od první nitrobřišní cytoredukční operace byl 93,9 měsíce. I další práce referují o dlouhodobém přežívání po resekci hrudních metastáz [4,8].
Průběh nemoci u naší pacientky s plicními ložisky a anamnézou operací pro PMP se zásadně nelišil od literárních údajů. Problematické bylo histologické hodnocení po první hrudní operaci, kdy nebylo zcela jasné, zda se jedná o ložisko primární, či sekundární. Po dohodě s patoložkami jsme doplnili vyšetření mutace K-ras. Při vyšetření preparátu z první operace v břišní dutině byla mutace K-ras negativní, v plicních ložiscích byla pozitivní. Během vývoje a změn v tumoru může dojít i ke změnám v mutacích K-ras. První hodnocení břišního nálezu bylo low grade pseudomyxom, v dalších výsledcích již byly nálezy hodnoceny jako high grade PMP. Předpokládáme, že změna histologické formy na agresivnější variantu vedla k šíření do hrudníku, a jednalo se tedy o sekundární postižení plíce. Na pravé straně jsme nalezli čtyřnásobný počet ložisek, než bylo patrné z CT vyšetření. Potvrdili jsme si známou skutečnost, že při peroperačním palpačním vyšetření plíce můžeme najít další drobná metastatická ložiska, která jsou pod rozlišovací schopností zobrazovacích metod.
Závěr
Plicní a pleurální metastázy pseudomyxomu peritonea jsou vzácné. Jejich výskyt je znamením vážné prognózy. Cytoredukční chirurgické výkony, při postižení pleury doplněné o intrapleurální hypertermickou chemoterapii, mohou v indikovaných případech přispět k prodloužení života nemocných.
Seznam zkratek:
CDX2 − protilátka důležitá při diferenciální diagnostice adenokarcinomů a karcinoidů
CK − cytokeratin
CRS − cytoredukční chirurgie
CT − výpočetní tomografie
FDG − fluorodeoxyglukóza
HITAC − hypertermická pleuroperitoneální chemoterapie
HITHOC − intrapleurální hypertermická chemoterapie
HIPEC − hypertermická intraperitoneální chemoterapie
LN − lymfatická uzlina
PET/CT − pozitronová emisní tomografie/výpočetní tomografie
PMP − pseudomyxom peritonea
TTF − thyroidální transkripční faktor
WHO − Světová zdravotnická organizace
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise, s výjimkou kongresových abstrakt a doporučených postupů.
MUDr. Pavel Horák
Chirurgická klinika 1. LF UK a Nemocnice Na Bulovce
Budínova 67/2 180 81 Praha 8
e-mail: pavel.horak@bulovka.cz
Sources
- Carr NJ, Cecil TD, Mohamed F, et al. Peritoneal Surface Oncology Group International. A consensus for classification and pathologic reporting of pseudomyxoma peritonei and associated appendiceal neoplasia: The results of the Peritoneal Surface Oncology Group International (PSOGI) Modified Delphi Process. Am J Surg Pathol. 2016;40(1):14−26. doi: 10.1097/PAS.0000000000000535.
- Bibi R, Pranesh N, Saunders MP, et al. A specific cadherin phenotype may characterise the disseminating yet nonmetastatic behaviour of pseudomyxoma peritonei. Br J Cancer 2006;95(9):1258–1264. doi: 10.1038/sj.bjc.6603398.
- Antoš F, Vítek P, Kopic J, et al. Cytoreduktivní chirurgie a hypertermická peroperativní chemoterapie (HIPEC) v léčbě malignit peritoneálních povrchů. Onkologická revue 2018;5(2):62–67.
- Mortman KD, Sugarbaker PA, Shmookler BM, et al. Pulmonary metastases in pseudomyxoma peritonei syndrome. Ann Thorac Surg. 1997;64(5):1434–1436. doi: 10.1016/S0003-4975(97)00806-0.
- Ababneh R, Piso P, Hofmann HS, et al. An invasive treatment of pseudomyxoma peritonei with intrathoracic involvement. MAEDICA – a Journal of Clinical Medicine 2016;11(5):72−75.
- Geisinger KR, Levine EA, Shen P, et al. Pleuropulmonary involvement in pseudomyxoma peritonei. Morphologic assessment and literature review. Am J Clin Pathol. 2007;127 : 135−143. doi: 10.1309/601K2L2T7CR5U7G1.
- Beane JD, Wilson GC, Sutton JM, et al. Pleuropulmonary recurrence following cytoreductive surgery and hyperthermic intraperitoneal chemoperfusion for appendiceal pseudomyxoma peritonei. Ann Surg Oncol. 2019;26 : 1429–1436. https://doi.org/10.1245/s10434-018-07091-z.
- Lee BY, Kim HS, Lee SH, et al. Pseudomyxoma peritonei: extraperitoneal spread to the pleural cavity and lung. J Thorac Imaging. 2004;19(2):123−126. doi: 10.1097/00005382-200404000-00013.
- Pestieau SR, Esquivel J, Sugarbaker PH. Pleural extension of mucinous tumor in patients with pseudomyxoma peritonei syndrome. Ann Surg Oncol. 2000;7 : 199–203. doi: 10.1007/BF02523654.PMID: 10791850.
- Pestieau SR, Wolk R, Sugarbaker PH. Congenital pleuroperitoneal communication in a patient with pseudomyxoma peritonei. Journal of Surgical Oncology 2000;73(3):174–178. doi: 10.1002/(sici)1096-9098(200003)73 : 3<174:aid-jso12>3.0.co;2-u.
- Grotz TE, Mansfield PF, Royal RE, et al. Intrathoracic chemoperfusion decreases recurrences in patients with full-thickness diaphragm involvement with mucinous appendiceal adenocarcinoma. Ann Surg Oncol. 2016;23(9):2914–2919. doi: 10.1245/s10434-016-5209-0.
- Sugarbaker PH, Chang D, Stuart OA. Hyperthermic intraoperative thoracoabdominal chemotherapy. Gastroenterol Res Pract. 2012;623417. doi: 10.1155/2012/623417.
- Ahmed S, Levine EA, Randle RW, et al. Significance of diaphragmatic resections and thoracic chemoperfusion on outcomes of peritoneal surface disease treated with cytoreductive surgery (CRS) and hyperthermic intraperitoneal chemotherapy (HIPEC). Ann Surg Oncol. 2014;21(13):4226–4231. doi: 10.1245/s10434-014-3891-3.
- Kawaguchi Y, Hanaoka J, Ohshio Y, et al. Patient survival after surgical management in intrathoracic pseudomyxoma peritonei. Ann Surg Oncol. 2019;26 : 238–243. doi: 10.1245/s10434-018-6991-7.
- Kawaguchi Y, Hanaoka J. Cytoreductive surgery and hyperthermic chemotherapy for intrathoracic pseudomyxoma peritonei. Ann Thorac Surg. 2020;15:S0003−4975(20)30927–30929. doi: 10.1016/j.athoracsur.2020.04.114.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2020 Issue 10-
All articles in this issue
- Využití mimotělních podpor v hrudní chirurgii
- Pooperační chylothorax − souhrnné sdělení
- Léčba insuficience hrudní anastomózy po Ivor Lewis ezofagektomii
- Maligní onemocnění po transplantaci plic
- Hypertermická peroperační intrapleurální chemoterapie a chirurgická cytoredukce jako součást multimodální léčby maligního mezoteliomu pleury – kazuistika
- Problematika plicních metastáz při pseudomyxomu peritonea – kazuistika a přehled literatury
- Plicní arteriovenózní malformace řešená videoasistovanou torakoskopickou lobektomií
- Minimalizace a maximalizace v hrudní chirurgii
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Pooperační chylothorax − souhrnné sdělení
- Hypertermická peroperační intrapleurální chemoterapie a chirurgická cytoredukce jako součást multimodální léčby maligního mezoteliomu pleury – kazuistika
- Maligní onemocnění po transplantaci plic
- Využití mimotělních podpor v hrudní chirurgii
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

