-
Medical journals
- Career
Pooperační chylothorax − souhrnné sdělení
Authors: M. Szkorupa
Authors‘ workplace: I. chirurgická klinika Fakultní nemocnice Olomouc
Published in: Rozhl. Chir., 2020, roč. 99, č. 10, s. 427-437.
Category: Review
Overview
Spektrum příčin vzniku chylothoraxu je bohaté a jednou z nich je i poranění ductus thoracicus u různých torakochirurgických výkonů, především při operacích jícnu, plic a srdce. Pozdně diagnostikovaný či neadekvátně léčený chylothorax má i v současnosti vysokou míru morbidity a mortality. Souvisí to především s vysokými ztrátami chylu, který je bohatý na minerály, plazmatické bílkoviny, tuky a lymfocyty. Nejzávažnější jsou dopady minerálního rozvratu, malnutrice a imunodeficience. Důležitá je tedy včasná diagnostika, ale také adekvátní terapie, která se řídí typem primárního výkonu, objemem ztrát chylu a délkou trvání.
V souhrnném sdělení předkládají autoři přehled problematiky chylothoraxu od etiologie vzniku, anatomie, fyziologie, patofyziologie, symptomatologie, diagnostiky a terapie.
Klíčová slova:
chylothorax – radiologie – ligace − laparoskopie
Úvod
Pooperační chylothorax patří mezi komplikace nitrohrudních výkonů, které významně zhoršují výsledky morbidity a mortality. Včasná diagnostika, znalost laboratorních diagnostických metod i využití řady radiologických vyšetření k potvrzení chylothoraxu patří, stejně tak jako adekvátní plnohodnotná terapie s pokrytím všech nutričních a metabolických potřeb pacienta, k zásadním prvním krokům k úspěšnému vyřešení této komplikace. Stále nejsou stanovena všeobecná standardizovaná jasná kritéria a pravidla o indikacích ke konzervativnímu či invazivnímu řešení chylothoraxu. Obvykle se vychází ze zkušeností pracoviště, typu předchozího operačního výkonu, kondice pacienta, závažnosti a trvání chylothoraxu, ale i dostupnosti a využití možných intervenčních radiologických metod, mezi které se řadí například embolizace ductus thoracicus. Další otázkou je správné načasování a zvolení typu chirurgického výkonu, event. jiných alternativních metod k zamezení úniku chylu. Souhrnné sdělení o pooperačním chylothoraxu je přehledem a výběrem z literatury o etiologii, anatomii, fyziologii, patofyziologii, symptomatologii, diagnostice a terapii chylothoraxu.
Etiologie
Chylothorax vzniká nahromaděním chylózního výpotku v pleurální dutině. Etiologie chylothoraxu může být kongenitální, obstrukční (nádorová, zánětlivá) nebo traumatická a je způsobena obstrukcí, disrupcí nebo přímým poraněním ductus thoracicus. Kongenitální (primární) chylothorax se vyskytuje velmi vzácně, většinou v souvislosti s vývojovými vadami (Turner syndrom, Down syndrom, Noonan syndrom) [1]. Nejčastější příčinou vzniku chylothoraxu je obstrukce mízovodu při maligním nádoru, typickým příkladem je maligní lymfom, ale také bronchogenní karcinom. Nenádorová obstrukce může vzniknout u řady nemocí, např. při filarióze, tuberkulózní lymfadenitidě, trombóze podklíčkové žíly, sarkoidóze, kongestivním srdečním selhání, lymfangioleiomyomatóze, histoplazmóze, Kaposiho sarkomu, AIDS nebo jako časný či pozdní následek radioterapie [2]. Poraněním ductus thoracicus kdekoliv v jeho průběhu při operacích srdce, plic, hrudní aorty, jícnu, v zadním mediastinu a na krku vzniká chylothorax traumatický. Tento typ chylothoraxu může vzniknout i jako raritní komplikace kanylace centrální žíly či při implantaci kardiostimulátoru. Poraněním v oblasti cisterna chyli může dojít ke vzniku chylózního ascitu s propagací do hrudníku. Vzácně může dojít ke vzniku chylózního výpotku i při tupém nebo penetrujícím poranění hrudníku, spontánní ruptura pak při těžkém zvracení a kašli [3,4] (Schéma 1).
Schéma 1: Etiologie chylothoraxu
Schema 1: Etiology of chylothorax
Anatomieobr
Umístění, průběh a větvení d. thoracicus je poměrně nekonstantní, variabilní. Anatomicky obvykle vzniká soutokem dvou trunci lumbales a truncus intestinalis pod bránicí v retroperitoneálním prostoru, za pravým okrajem aorty, asi ve výši obratlů L1−L2. Při svém začátku bývá vakovitě nebo vřetenovitě rozšířen ve 3–8 cm dlouhou cisterna chyli. Poté probíhá ductus thoracicus kraniálně cestou hiatus aorticus bránice po ventrální straně páteře mezi aortou a vena azygos, kde se může větvit i v několik kmenů. V úrovni 4.−5. hrudního obratle obvykle přebíhá na levou stranu hrudníku, stoupá po zadní straně aortálního oblouku a za podklíčkovou tepnou směrem ke krku přes horní hrudní aperturu. Zde kříží m. scalenus anterior, stáčí se laterálně a distálně a ústí z levé strany do soutoku v. jugularis interna a v. subclavia. Ve svém průběhu vysílá ductus thoracicus množství kolaterál do venózního systému, především v oblasti v. azygos, interkostálních a paravetebrálních žil. Délka mízovodu se pohybuje od 36 do 45 cm a průměr má cca 2−3 mm. Z anatomického průběhu mízovodu vyplývá lateralizace chylothoraxu s ohledem na místo poranění či disrupce. Při poranění kaudálně od pátého hrudního obratle vzniká chylothorax vpravo, kraniálněji pak vlevo, při poranění v oblasti přechodu přes střední čáru mohou vznikat i postižení oboustranná. Zhruba 50 % chylothoraxů je pravostranných, třetina levostranných a zbytek oboustranných [5,6].
Variabilita anatomie d. thoracicus se týká počátku, průběhu, počtu kmenů, větvení, ale i vyústění mízovodu. Bylo klasifikováno až 9 potenciálních typů anatomických variací d. thoracicus v závislosti na embryonálním vývoji, nicméně jen 5 z nich bylo popsáno při radiologických studiích a při autopsiích. Tato skutečnost je důležitá především z hlediska lokalizace možného poranění d. thoracicus a chirurgického ošetření leaku [7], Obr. 1, 2.
Image 1. Schéma hlavních typů variací průběhu ductus thoracicus Převzato z Chen E, Itkin M. Thoracic duct embolization for chylous leaks. In: Seminars in interventional radiology. Thieme Medical Publishers 2011. p. 63.
Fig. 1: Schematic representation of the major anatomic variants of the thoracic duct Reprinted with permission from Chen E, Itkin M. Thoracic duct embolization for chylous leaks. In: Seminars in interventional radiology. Thieme Medical Publishers 2011. p. 63.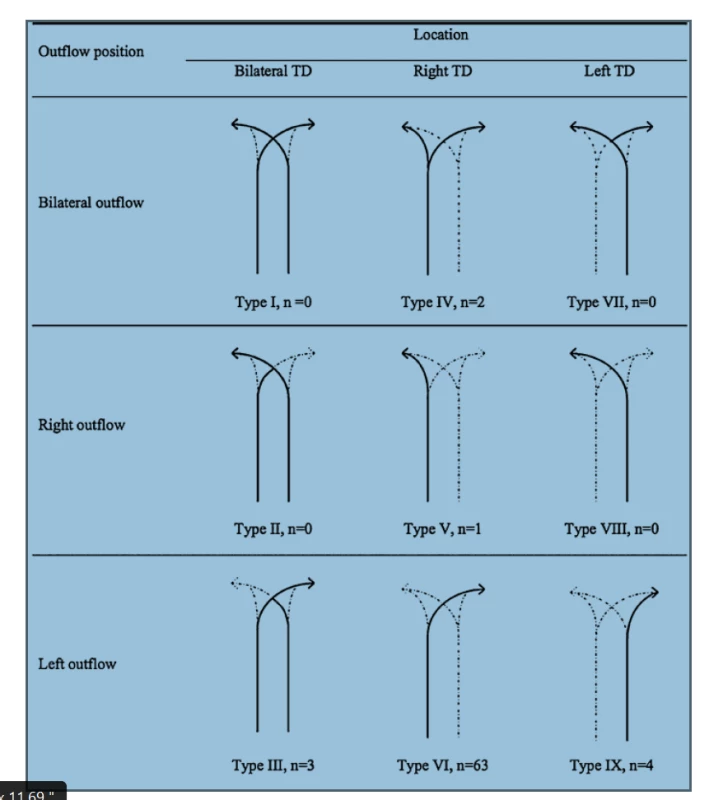
Image 2. Pět anatomických variací průběhu ductus thoracicus prokázaných při autopsiích Převzato z Chen E, Itkin M. Thoracic duct embolization for chylous leaks. In: Seminars in interventional radiology. Thieme Medical Publishers 2011. p. 63.
Fig.2. Five major anatomic variants of the thoracic duct observed in autopsies Reprinted with permission from Chen E, Itkin M. Thoracic duct embolization for chylous leaks. In: Seminars in interventional radiology. Thieme Medical Publishers 2011. p. 63.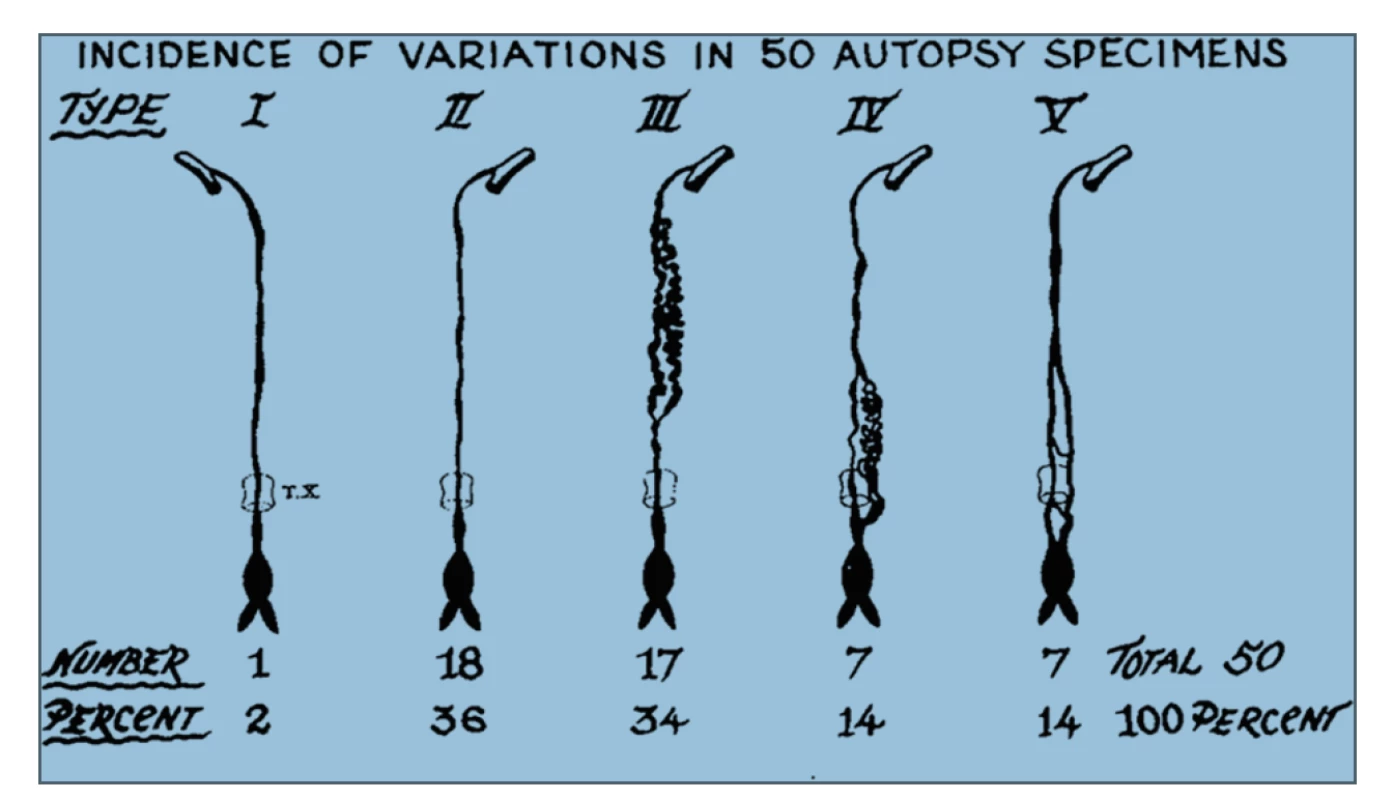
Fyziologie a patofyziologie
D. thoracicus sbírá lymfu z obou dolních končetin, pánve, břicha, levé poloviny hrudníku, levé horní končetiny a z levé poloviny hlavy a krku. Pravá strana hrudníku (plíce, pravá strana srdce a konvexita jater), pravá horní končetina, pravá polovina krku a hlavy je drénována pravostranným mízovodem – ductus lymphaticus dexter, který ústí do soutoku v. jugularis interna a v. subclavia vpravo. Transport lymfy mízovodem je umožněn několika mechanismy. Prvním je gradient mezi negativním inspiračním a pozitivním nitrobřišním tlakem. Tím druhým a důležitějším je činnost hladkého svalstva ve stěně mízovodu, při které dochází každých 10−15 sekund ke svalovým kontrakcím, nezávislým na dechové činnosti. Kontrakce jsou vyvolány stimulací n. vagus, oproti tomu epinefrin (adrenalin) jako sympatomimetikum způsobuje distenzi stěny mízovodu. Dalším mechanismem je Bernoulliho princip dynamiky toku, který umožňuje nasávání lymfy do žilního řečiště pomocí negativního tlaku. Toku lymfy napomáhá i řada chlopní, které usměrňují její tok proximálním směrem. Intraduktální tlak se pohybuje v rozmezí 10−25 cm vodního sloupce a při obstrukci může dosahovat až 50 cm vodního sloupce [5,8].
Funkčně je ductus thoracicus zodpovědný za transport lymfy, která obsahuje především tuky, extravaskulární plazmatické proteiny, elektrolyty a lymfocyty. Tuky jsou v chylu transportovány ve formě neutrálního tuku, cholesterolu, esterů cholesterolu, volných mastných kyselin, sfingomyelinů a fosfolipidů. Celková koncentrace tuků v chylu je 4,0−60 g/l. Triglyceridy ve formě chylomikronů způsobují mléčný, opaleskující vzhled výpotku a jejich obsah v chylu může být 2−8× vyšší, než je jejich plazmatická koncentrace. Hladina triglyceridů nad 1,24 mmol/l je dostatečně průkazná pro chylothorax. Koncentrace proteinů dosahuje více než 3 g/dl a v největším množství se zde vyskytují albumin, globulin, fibrinogen a protrombin. T lymfocyty jsou obsaženy v chylu jako hlavní buněčná složka v koncentraci 400−6800 buněk/mikrolitr. Obsah erytrocytů bývá 50−600 buněk/mikrolitr. Chylus je lehce alkalický a bakteriostatický, velmi bohatý také na vitaminy rozpustné v tucích a obsahuje i pankreatickou amylázu a lipázu. Průměrná produkce chylu bývá cca 1500−2500 ml/den v závislosti na příjmu a složení potravy. Sekrece se výrazně zvyšuje bezprostředně po jídle, a to zejména u tučného jídla s vysokým obsahem mastných kyselin [5,8,9] (Tab. 1).
Table 1. Vlastnosti chylu
Tab. 1: Characteristics of chylothorax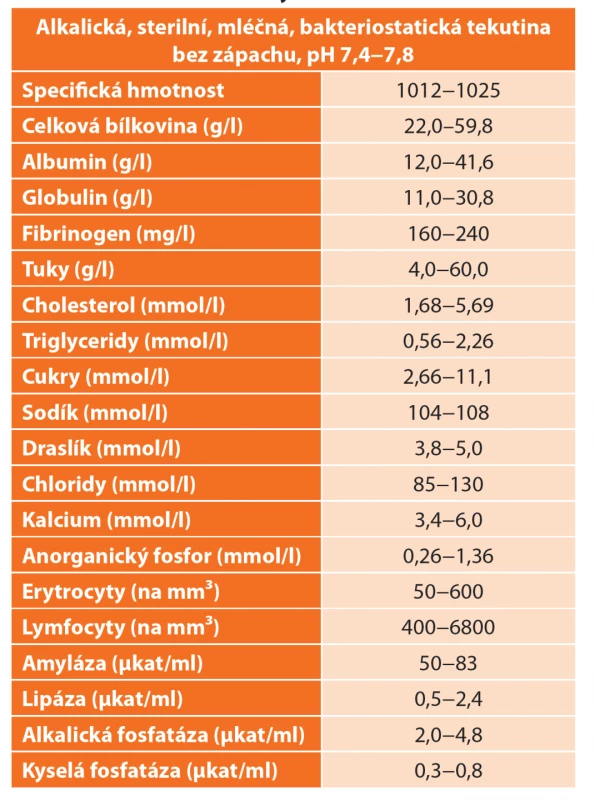
Únik chylu způsobuje významný deficit všech jeho složek se zásadním vlivem na jejich plazmatické koncentrace. V prvé řadě je to minerální rozvrat – hyponatrémie a hypokalcémie. V důsledku ztráty alkalické tekutiny vzniká metabolická acidóza, úbytkem plazmatických proteinů jednak jejich deficit, ale sekundárně i hypovolémie s poklesem onkotického tlaku a také koagulopatie. Ztrátou albuminu a tuků dochází k závažné malnutrici a také k deficitu vitaminů rozpustných v tucích. Úbytek T lymfocytů má za následek alteraci buněčné i humorální imunity a zvýšené riziko vzniku nejen ranných, ale i jiných bakteriálních a virových oportunních infekcí. Naproti tomu k infekci chylózního výpotku nedochází, protože chylus je ve své podstatě bakteriostatický. Nahromadění výpotku v mediastinu může působit i tenzně se snížením srdečního žilního návratu a hemodynamickou instabilitou. Sekundárně mohou být také snížené plazmatické hladiny některých léků (digoxin, amiodaron, cyklosporin) [6,10]. Všechny tyto faktory významně přispívají ke zvýšené morbiditě a mortalitě, která zvláště u pacientů po náročných výkonech, jako jsou operace srdce, jícnu či plic, může dosahovat 30−50 %.
Symptomatologie a diagnostika
Traumatický chylothorax se manifestuje v širokém rozmezí 2–10 dní po traumatu či výkonu. Symptomatologie je dána jednak vyvolávající příčinou a také množstvím výpotku na postižené straně. Malé výpotky bývají klinicky němé. Jinak jsou příznaky shodné pro jakýkoliv pleurální výpotek s výjimkou bolestí hrudníku a teplot, které se obvykle u chylothoraxu nevyskytují. Může to být dáno tím, že chylus má bakteriostatické účinky, nevyvolává iritaci pleury a tím fibroprodukci. V popředí příznaků bývají dušnost, kašel, tachykardie, tachypnoe. Stlačením stejnostranné plíce dochází ke vzniku kompresivní atelektázy s hypoventilací a hypoperfuzí. V případě velkých tenzních výpotků nejsou výjimkou ani závažné hemodynamické změny s navazujícím kardiorespiračním selháním v důsledku přesunu mediastina a komprese kontralaterální plíce [9−12]. Další symptomy chylothoraxu jsou sekundární a vznikají důsledkem deficitu tekutin a všech složek obsažených v chylu. Nejzávažnější jsou dopady minerálního rozvratu, malnutrice a imunodeficience. Důležité jsou také rychlost a objem ztráty tekutin spolu s příčinnou souvislostí vzniku chylothoraxu.
Chylus je mléčně zkalená nažloutlá tekutina. V případě již založené hrudní drenáže je tedy diagnostika chylothoraxu často dána samotným vzhledem výpotku. Nicméně v případě vyloučení perorálního příjmu, jako tomu bývá po operacích jícnu, může být vzhled výpotku i serózní, což bývá až v 50 % nálezů [13]. Sekrece z hrudního drénu dosahuje v závislosti na závažnosti poranění ductus thoracicus a perorálním příjmu i více než 2000 ml/24 hod. Charakter výpotku, jeho množství a vyčeření výpotku po vyloučení perorálního příjmu v řadě případů predikují existenci chylothoraxu jako možné komplikace nitrohrudního výkonu. A naopak, podání smetany perorálně nebo nazogastrickou sondou vede k rychlé absorpci tuků lymfatickým systémem s následnou změnou charakteru výpotku v mléčně zkalený.
Přítomnost výpotku obvykle potvrdí radiologické vyšetření, ať už základním rentgenovým snímkem srdce a plic, nebo specifičtější výpočetní tomografií, která může být nápomocna i v případě určení příčiny vzniku netraumatického chylothoraxu (mediastinální lymfadenopatie, lymfom, lymfangioleiomyomatóza, vaskulární trombóza nebo konstriktivní perikarditida a další). Výpotek bývá nejčastěji jednostranný, vpravo až v 50 %, vlevo v 33,3 % a bilaterálně v 16,6 %. Jeho umístění závisí na výšce poranění duktu, resp. místu úniku lymfy. V případě úniku pod pátým hrudním obratlem je výpotek pravostranný, nad tímto obratlem pak levostranný [14].
Standardní diagnostickou metodou ke stanovení chylothoraxu je vyšetření hladiny triglyceridů ve výpotku (Staats 1980), která by měla být vyšší než 110 mg/dl (1,24 mmol/l), hodnoty pod 50 mg/dl (0,56 mmol/l) pro chylothorax nesvědčí. Nicméně u stavů hladovění a podvýživy může být hladina triglyceridů i nižší než 50 mg/dl. V těchto případech není hladina triglyceridů vypovídající. V případě nejasností je doporučeno provést lipidovou elektroforézu, kdy přítomnost chylomikronů potvrzuje chylózní výpotek. Chylózní výpotek je ve většině případů exsudát, nicméně ani transudativní charakter výpotku chylothorax nevylučuje. Bývá tomu nejčastěji při jaterní cirhóze, nefrotickém syndromu nebo amyloidóze. Diagnózu pomůže potvrdit i poměr koncentrace triacylglyceridů a cholesterolu ve výpotku a séru. Poměr triglycedridů větší než 1 a poměr cholesterolu nižší než 1 svědčí pro chylózní výpotek [9,13,15].
Z jiných typů výpotku se chylothoraxu nejvíce blíží pseudochylothorax (cholesterolový nebo chyliformní výpotek), což je výpotek s vysokým obsahem cholesterolu, cholesterolových krystalů a lecithin-globulinových komplexů. Nejčastější příčinou pseudochylothoraxu je chronický zahuštěný pleurální výpotek (při tuberkulóze, revmatoidní artritidě, chronickém empyému). Za vysoký obsah cholesterolu u těchto výpotků odpovídá nejspíše rozpad sérových lipoproteinů. Na rozdíl od chylothoraxu je hladina triacylglyceidů nízká, hladina cholesterolu naopak vysoká s obsahem cholesterolových krystalů [16].
K přesnější lokalizaci místa úniku chylu, resp. poranění ductus thoracicus mohou dopomoci lymfografie, resp. lymfoscintigrafie. Bipedální lymfografie kombinovaná s výpočetní tomografií (CT) může poměrně spolehlivě lokalizovat místo úniku chylu (nejen u chylothoraxu, ale take u chylózního ascitu nebo lymfatické píštěle) nebo diagnostikovat lymfangiektázie. Standardním postupem u lymfografie je identifikace lymfatické cévy na dorsu nohy po předchozím subkutánním podání barviva (methylenové modři) do meziprstí, a poté její direktní preparace a kanylace. Následně je kanylou aplikována ethiodizovaná olejnatá kontrastní látka (Ethiodol®) a snímkován průběh lymfatické dráhy [17].
Tento invazivní postup lze nahradit intranodální lymfografií, kdy je ultrasonograficky identifikována lymfatická uzlina pod tříslem, punktována a do uzliny je aplikována kontrastní látka. Úspěšnost lymfografie při lokalizaci lymfatického leaku je popisována v 64−78 % případů [17]. A navíc, u menších lymfatických úniků (méně než 500 ml/24 hod) plní i úlohu terapeutickou. Ve své práci Alejandre-Lafont popisuje úspěšnost uzávěru úniku po lymfografii u 70 % pacientů se sekrecí menší než 500 ml/24 hod. U pacientů se sekrecí vyšší než 500 ml/24 hod. byla úspěšnost terapeutické lymfografie u 35 % nemocných. Tato skutečnost vedla také k jejímu využití u terapeutické embolizace ductus thoracicus [18]. Určitým, a ne nevýznamným rizikem lymfografie může být vznik tukové embolie do plic (ale i do mozku, jater nebo ledvin), intraalveolární krvácení, alergická reakce na lipiodol nebo methylenovou modř nebo extravazace lipiodolu. Nicméně morbidita spojená s direktní lymfografií nepřesahuje 5 %. Nejčastějšími lokálními komplikacemi jsou infekce, bolesti a lokální edém. Komplikace souvisejí obvykle s objemem vstřikované látky, který by neměl přesáhnout 10 ml na končetinu nebo celkově 14 ml [19,20].
Lymfoscintigrafie je méně invazivní než lymfografie, u které je standardně nutná direktní aplikace kontrastní látky do lymfatických cév. U lymfoscintigrafie lze využít jednak perorálního podání značeného radiofarmaka I-123 značených mastných kyselin (BMIPP – I-123-beta-methyl-iodophenyl pentadecanoic acid) s následným mapováním radiofarmaka po vstřebání ze zažívacího traktu do lymfatického systému. Tento preparát je však na českém trhu nedostupný. Nebo lze provést aplikaci koloidu značeným techneciem – 99mTc-HSA-DTPA (Technetium-99m human serum albumin diethylenetriaminepentaacetic acid) subkutánně bipedálně s využitím SPECT/CT (jednofotonová emisní výpočetní tomografie spolu s low-dose CT). Právě mapování pomocí SPECT/CT umožňuje přesnější lokalizaci místa úniku lymfy [21−23], Obr. 3.
Image 3. Lymfoscintigrafie u poranění ductus thoracicus v krční oblasti vlevo po revizi při těžké krční fasciitidě
Fig. 3. Lymphoscintigraphy in injuries of the thoracic duct in the left neck area after a revision in severe cervical fasciitis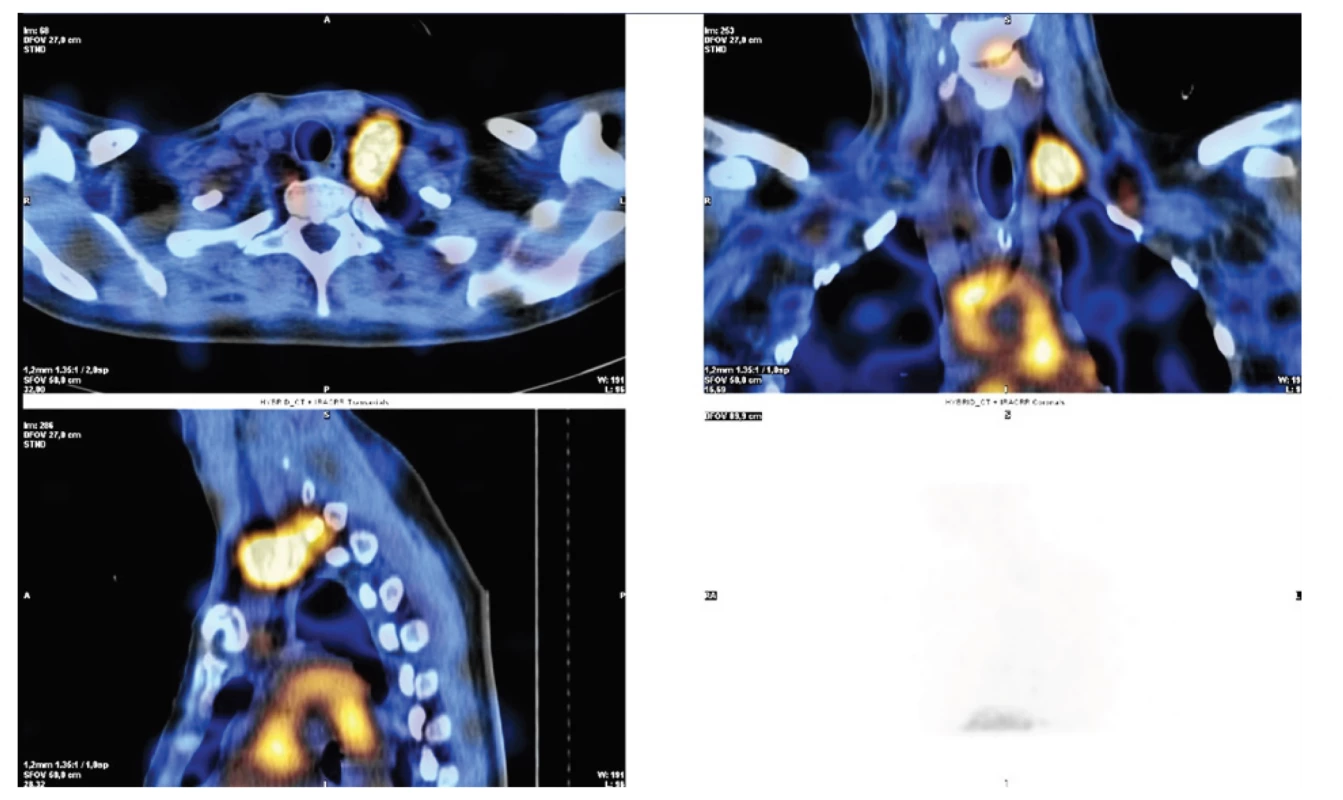
Další možností lokalizace leaku, navíc bez radiační zátěže, je využití třídimenzionální magnetické rezonance (T2W-MRI), která je užitečná i v případech různých anatomických variet průběhu a větvení ductus thoracicus [24].
Terapie
Incidence chylothoraxu po srdečních operacích u dětí se pohybuje kolem 3 %, u dospělých 0,3−1,5 %, po ezofagektomiích je variabilní 1−9 % a po resekčních výkonech na plicích nepřesahuje ve velkých centrech 1 %, nicméně úzce souvisí s technikou a prováděním systematické mediastinální lymfadenektomie a může pak dosahovat až ke 3 % [25−29].
Historicky znamenal chylothorax život ohrožující komplikaci, jejíž mortalita dosahovala až 50 %. Po zavedení chirurgické ligace ductus thoracicus Lampsonem v roce 1948 a posléze i dalších modalit léčby se mortalita i morbidita chylothoraxu výrazně snížila, nicméně i v současnosti představuje závažný problém, zejména při absenci včasné a adekvátní terapie [5].
Stejně jako je rozdílná incidence chylothoraxu u různých typů chirurgických výkonů, je u těchto výkonů rozdílné i spektrum rizikových faktorů vzniku chylothoraxu.
U pediatrických kardiochirurgických výkonů je výskyt chylothoraxu vázán na věk (nejčastější u novorozenců), souvislost s existencí vrozených vývojových vad (převážně u Turnerova syndromu), výskyt žilní trombózy, složitost a kombinaci operačních postupů a vysoký žilní tlak po cavopulmonálních a atriopulmonálních anastomózách [26,30].
U chylothoraxů po ezofagektomiích patří mezi rizikové faktory body mass index – BMI <25, resp. 30, nižší hodnoty sérového albuminu a spinocelulární karcinom jícnu s výskytem ve střední třetině jícnu. Limitací analýzy rizikových faktorů jsou však především malé soubory chylothoraxů v jednotlivých retrospektivních studiích [25,31].
Mezi rizikovými faktory po plicních resekcích je na prvním místě systematická mediastinální lymfadenektomie pro plicní karcinom. Dalším je pak pravostranná resekce, související se standardním topografickým uložením ductus thoracicus a vyšším rizikem jeho poranění [28,29,32].
Pro léčbu chylothoraxu neexistuje univerzální doporučení podpořené EBM (evidence based medicine). Vyplývá to jednak z rozmanité etiologie vzniku chylothoraxu, kdy každá odbornost preferuje poněkud odlišný přístup k terapii. A na druhé straně jsou to literární hodnocení malých, retrospektivních souborů pacientů, hodnocených napříč dlouhým časovým obdobím. Obecně lze rozdělit terapii na konzervativní a intervenční. Terapie by měla zajistit dokonalou reexpanzi plíce a tím obliteraci pleurálního prostoru, redukci tvorby chylu s omezením ztrát, substituci všech důležitých složek lymfy a tím prevenci malnutrice a dehydratace, včetně prevence infekčních komplikací daných imunodeficiencí. A v případě neúspěchu konzervativní terapie ošetření místa píštěle či zamezení úniku lymfy do pleurálního prostoru [33].
Prvním léčebným opatřením bývá hrudní drenáž k diagnostice výpotku, dekompresi a zajištění dokonalé reexpanze plíce. Hrudní drenáž je vhodnější než opakované punkce, umožňuje lepší resuflaci plíce a tím obliteraci pleurálního prostoru a přesnější monitoraci denních ztrát lymfy.
U nevelkých výpotků, resp. odpadů do hrudního drénu (do 1000 ml/den), může být dále dostačující dieta s nízkým obsahem tuků nebo s obsahem triglyceridů se středně dlouhým řetězcem, která je spolu s hrudní drenáží základním léčebným krokem. Triglyceridy se středně dlouhým řetězcem totiž umožňují vstřebávání ze střeva přímo do portálního řečiště a nejsou transportovány chylem [33−35].
V případě trvajících ztrát chylu z hrudního drénu je nutné zavedení totální parenterální výživy (TPN – total parenteral nutrition), která omezí produkci a objem lymfy proudící do ductus thoracicus, musí plně pokrýt energetické a nutriční nároky u často kritických stavů pacientů a zároveň slouží k substituci ztrát minerálů, bílkovin a tuků, jejichž laboratorní hodnoty je nutné monitorovat.
Vhodným doplňkem v konzervativní terapii chylothoraxu je somatostatin a jeho analoga (octreotid). Ve srovnání se somatostatinem má octreotid delší poločas, větší účinnost a možnost subkutánního podání. Somatostatin jako gastrointestinální hormon má inhibiční účinek na řadu gastrointestinálních enzymů a peptidů včetně vazoaktivního intestinálního polypeptidu, růstového hormonu, gastrinu, inzulinu a glukagonu. Snižuje perfuzi splanchnikem a inhibuje lymfatickou drenáž. Sekundárně tím tlumí tvorbu chylu a jeho vstřebávání. Octreotid může výrazně snížit ztráty chylu už do 24 hodin od začátku léčby. Některé práce doporučují zhodnocení efektu octreotidu po 48 hodinách od začátku podání a v závislosti na snížení sekrece chylu pokračování této terapie. Octreotid je podáván intravenózně nebo subkutánně, v pediatrii je doporučeno dávkování 15 µg/kg/hod. intravenózně až 21 dní. U dospělých je obvyklejší subkutánní podávání octreotidu v dávkách 50−250 mikrogramů třikrát denně [33,35−40].
Úspěšnost konzervativní terapie chylothoraxu se pohybuje v širokém rozmezí, a to 20−80 % v závislosti na etiologii vzniku, rozsahu poranění ductus thoracicus, množství denních ztrát, rychlosti diagnostiky, dodržení léčebných principů konzervativní terapie a v neposlední řadě i kondici nemocného [35].
V případě neúspěšné konzervativní terapie je v současnosti možnou alternativou k chirurgické intervenční terapii embolizace ductus thoracicus. První zkušenosti s touto metodou byly referovány v roce 1998 (Cope) [41]. Metodika techniky embolizace spočívá v provedení bipedální lymfografie, která zobrazí umístění cisterna chyli a další průběh hrudních lymfatik s možnými variantami (viz výše). Po lokalizaci je cisterna chyli nebo ductus thoracicus punktován jehlou Chiba needle® (délky 15−20 cm, velikosti 21−22 gauge – odpovídá 0,72−0,65 mm průměru). Poté je touto jehlou zaveden vodicí drát velikosti 0,018 palce (0,45 mm) do ductus thoracicus a následně po něm pak 65 cm dlouhý mikrokatétr s odstraněním vodicího drátu a aplikací vodné jodové kontrastní látky k zobrazení místa úniku lymfy. Po identifikaci extravazace je provedena proximálně embolizace. K embolizaci jsou používány coiling (embolizace pomocí kovových spirálek), tkáňové lepidlo (n-butyl cyanoakrylát), nebo je možná kombinace obou metod. Po zavedení spirálek proximálně k místu úniku lymfy je k tomuto místu aplikováno tkáňové lepidlo se zpožděním polymerace, aby nedošlo k zatuhnutí lepidla uvnitř kanyly. To je umožněno zředěním tkáňového lepidla Ethiodolem®. Do místa vstupu katétru do lymfatické cévy je obvykle také aplikováno tkáňové lepidlo k prevenci vzniku lymfatické píštěle. Alternativou k bipedální lymfografii je výše popisovaná intranodální lymfografie. I samotné provedení lymfografie bez embolizace může vést k uzávěru leaku lymfy. Variantou neúspěšné embolizace coilingem či tkáňovým lepidlem je jehlová disrupce ductus thoracicus, kdy poraněním stěny lymfatik dochází k zakrvácení, vzniku trombů a zánětu, které způsobují uzávěr.
Úspěšnost embolizace ductus thoracicus je na pracovištích se zkušenostmi s touto metodou poměrně vysoká. Cope et al. popsali v první velké řadě 42 pacientů úspěšnost 73,8 %. Itkin et al. dosáhli úspěšnosti embolizace až 90 % (109 pacientů) a klinické úspěšnosti u traumatických chylothoraxů až 71 %. U největší série netraumatických chylothoraxů (34 pacientů) byla klinická úspěšnost 52 %. V souvislosti s metodou embolizace nejsou referovány závažnější komplikace i přes popisovaný transabdominální přístup. Nejčastěji se jednalo o lokální komplikace – lymfedém nebo zánět související s prováděnou lymfografií. Ojediněle pak komplikace celkového rázu − asymptomatická embolie plic, chylózní ascites [7,35,41−43].
Chirurgické řešení léčby chylothoraxu představuje především ligace ductus thoracicus a je obecně doporučována při selhání konzervativních metod terapie trvající déle než 2 týdny, při sekreci chylu 5 dní více než 1000 ml/24 hod. (u dětí 100 ml/den) nebo hrozícím metabolickém rozvratu pacienta či respirační insuficienci. Časnější přístup k chirurgickému řešení je preferován v případě chylothoraxu po jícnových operacích, kde chylothorax významně zhoršuje mortalitu – až o 50 %. Prediktorem indikace k chirurgickému výkonu může být objem ztrát chylu 10 ml/kg/den, resp. 13,5 ml/kg/den, a to třetí až pátý den po zahájení konzervativní terapie, který byl významným prognostickým faktorem selhání konzervativní léčby u nemocných po ezofagektomiích. V souvislosti s tímto zjištěním je doporučováno sledovat objem ztrát hrudním drénem v prvních dnech po operaci a včas reagovat na vyšší objem sekrece prvních 5 dní po operaci s ohledem na diagnostiku případného chylothoraxu [25,31,44].
Na řadě vysokoobjemových pracovišť, která se zabývají jícnovou chirurgií, provádějí profylaktickou ligaci ductus thoracicus jako prevenci vzniku chylothoraxu. V některých retrospektivních a v jedné prospektivní studii (Lai et al. 2011) byl zaznamenán statisticky významný rozdíl ve výskytu chylothoraxu ve skupinách bez a s profylaktickým podvazem ductus thoracicus. Ve skupině s podvazem mízovodu byl výskyt statisticky nižší. Na druhé straně, v retrospektivní studii (Fu et al. 2006) byl naopak vyšší výskyt chylothoraxu ve skupině s podvazem ductus thoracicus a tato skupina vykazovala i vyšší procento pooperačních komplikací, nicméně bez vlivu na dlouhodobé přežívání. V další retrospektivní studii (Hou et al. 2014), která zahrnovala 1804 pacientů s karcinomem jícnu po kompletní resekci, nebyl zaznamenán rozdíl ve výskytu chylothoraxu mezi skupinami bez a s podvazem ductus thoracicus. V nejobsáhlejší systematické review problematiky profylaktického podvazu ductus thoracicus u jícnových resekcí bylo hodnoceno 5254 pacientů v 7 studiích. 2179 pacientů podstoupilo peroperační podvaz ductus thoracicus a 3075 pacientů bylo bez podvazu. Rozdíl ve výskytu chylothoraxu ve skupině bez podvazu byl statisticky významně vyšší. Na základě těchto výsledků tato práce hodnotí profylaktický podvaz ductus jako účinné opatření k redukci výskytu chylothoraxu po ezofagektomiích [45–47].
V případě, že je ligace ductus thoracicus indikována v pooperačním období při prokázaném chylothoraxu a neúspěšné konzervativní léčbě, provádí se obvykle stejným operačním přístupem jako při předchozím výkonu. Standardní chirurgickou cestou je intratorakální přístup – torakoskopický nebo torakotomický. Dalším, méně obvyklým přístupem je laparoskopický, transhiatální.
Chirurgické intervenci by měla předcházet vizualizace průběhu ductus thoracicus, jeho uložení, případné větvení a identifikace místa úniku lymfy. V některých případech může být totiž chirurgický přístup snadnější z kontralaterální strany a stejně jako znalost časného větvení a místa úniku, je důležitý pro úspěch výkonu. Snadnější peroperační identifikaci ductus thoracicus může napomoci stimulace lymfatické sekrece předoperačním podáním tučného jídla, nejčastěji smetany, perorálně či do nasogastrické sondy, v množství je 100–200 ml, a to 30 minut až 1 hodinu před operací. Účinnost může být potencována přimícháním lymfofilního barviva. V případě, že je předoperačně prokázané a jasné místo úniku lymfy, je možné ošetřit selektivně toto místo klipáží, podvazem či aplikací tkáňového lepidla. Vhodnější je však, při intratorakálním přístupu, vyhledání ductus thoracicus v zadním mediastinu nad bráničním hiátem v lokalizaci mezi aortou, jícnem a v. azygos. Pokud je ductus thoracicus jasně zřetelný, pak je tento podvázán a přerušen, případně vytnuta část jeho úseku. Jestliže je identifikace ductus thoracicus nejasná, je doporučováno masivní podvázání veškeré tkáně mezi výše uvedenými strukturami. Výkon je obvykle doplněn dekortikací v podobě chemické nebo mechanické pleurektomie, či aplikací tkáňového lepidla [3,14,28,48−51]. Laparoskopický přístup je vhodnější u chylothoraxu, jehož příčinou je peroperační poranění ductus thoracicus při operaci srdce, velkých cév a plic, a tam, kde může být terén intratorakálně podstatně méně přehledný. U nemocných po operacích jícnu je laparoskopický přístup nevhodný z důvodu předchozího intraabdominálního výkonu a umístění transponátu v bráničním hiátu.
Umístění portů u laparoskopie je obdobné jako u operací pro hiátovou hernii. Po přerušení orální části pars flacida malého omenta je podél pravých krus proniknuto do mediastina mezi jícen a aortu a vyhledán průběh ductus thoracicus. O jeho identifikaci je možno se přesvědčit nástřihem a přítomností chylózní sekrece. Následuje podvaz nebo zaklipování lymfatiku i jeho možných větví. Nevýhodou laparoskopické operace je nemožnost doplnit výkon pleurodézou (Obr. 4−6).
Image 4. Identifikace ductus thoracicus u laparoskopického přístupu v bráničním hiátu
Fig. 4. Identification of the thoracic duct using laparoscopic approach in the diaphragmatic hiatus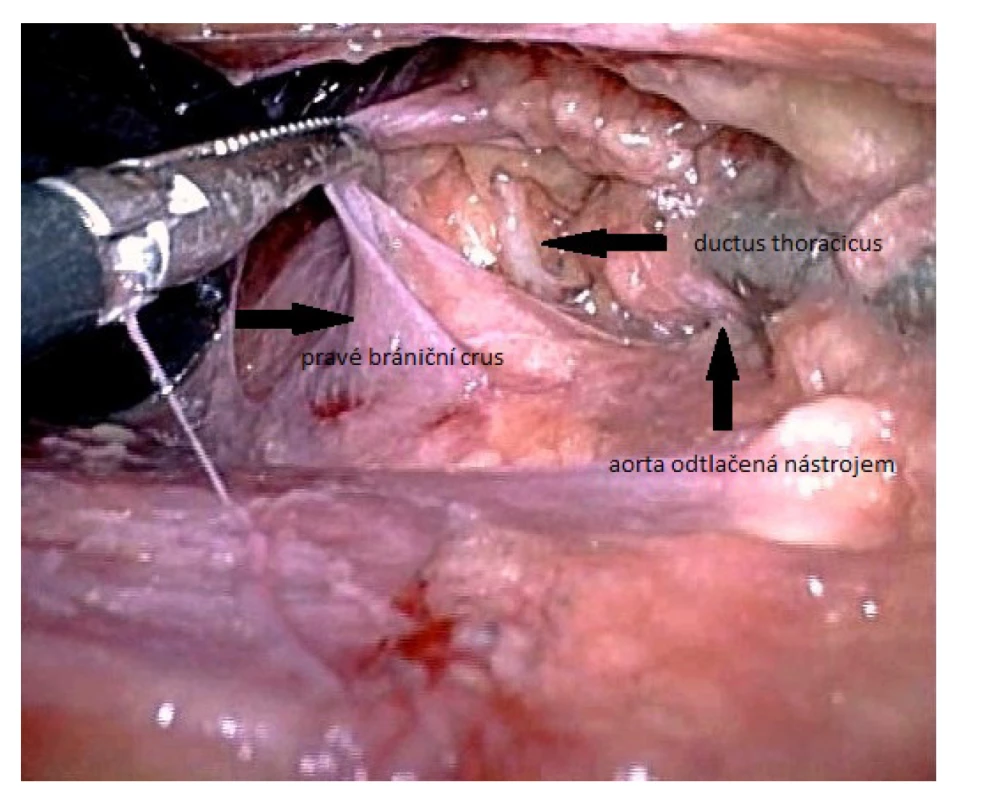
Image 5. Výron chylu po identifikaci a nastřižení ductus thoracicus
Fig. 5. Chyle effusion after identification and cutting of the thoracic duct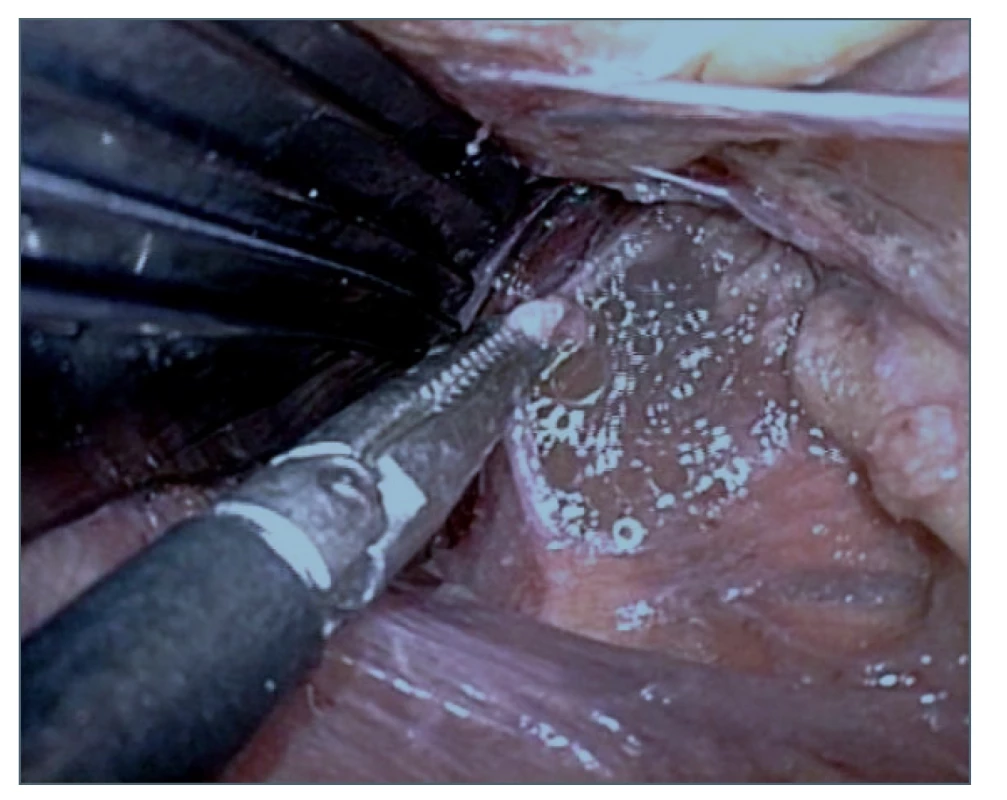
Image 6. Zaklipování ductus thoracicus
Fig. 6: Clipping of the thoracic duct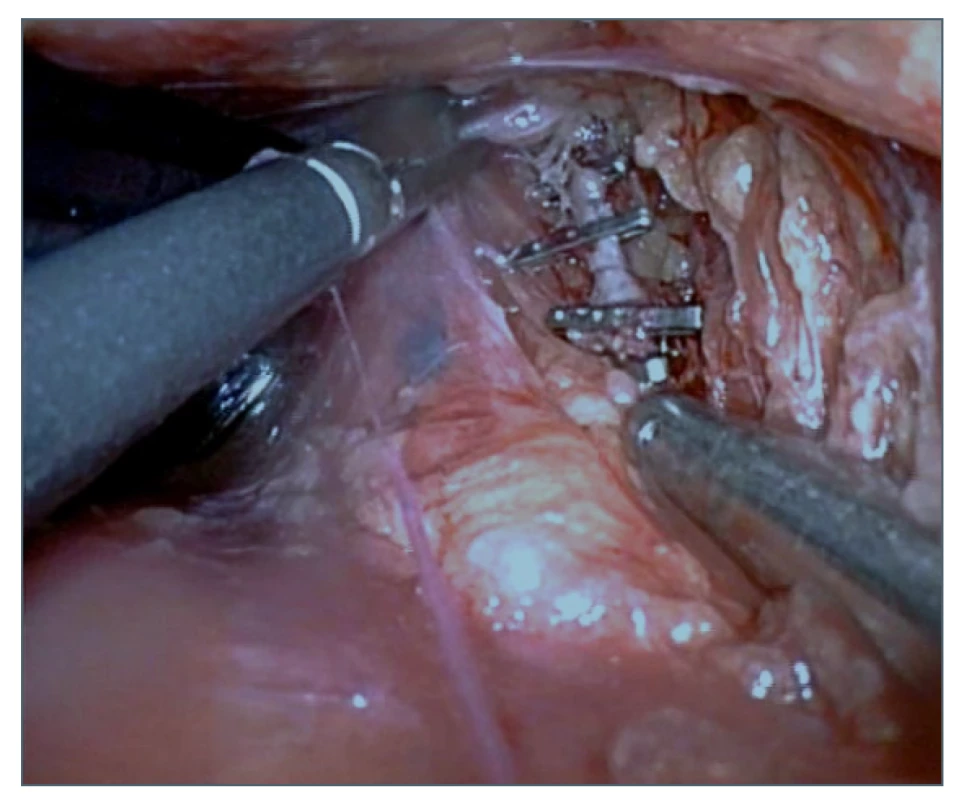
Poměrně raritní je německými autory referovaná retroperitoneoskopická ligace ductus thoracicus. Jde o přístup, který je podobně standardně využívaný při retroperitoneální adrenalektomii. Po založení pravostranného kapnoretroperitonea je protnuta Gerotova fascie, proniknuto do suprarenálního prostoru, identifikováno pravostranné crus bráničního hiátu a vizualizován ductus thoracicus transdiafragmaticky podél hrudní aorty. Následně jsou ductus thoracicus a jeho větve ošetřeny klipy. Případný pleurální výpotek je evakuován po protnutí mediastinální pleury [52].
Pleurektomie nebo chemická pleurodéza je alternativní, ale možnou metodou léčby v případech, kdy není mízovod identifikovatelný. Chemicky jsou využívána různá činidla – tetracyklin, doxycyklin, talek, fibrinové lepidlo, bleomycin, povinon-jod, ethanol či sklerozující činidlo OK-432 (picibanil) s různou mírou účinnosti, ale také nežádoucími účinky lokálního charakteru. Chemickou pleurodézu lze provést i perkutánní drenáží a poté aplikací do hrudního drénu, bez nutnosti operačního řešení. Úspěšnost sklerotizace bývá popisována až v 88−100 % [53]. Raritním sklerotizujícím činidlem je extrakt ze zázvoru (Elemene), kterým byl úspěšně léčen soubor 11 čínských pacientů. Do pleurální dutiny bylo aplikováno někdy i opakovaně 40 ml 0,5 % elemenové emulze a u všech pacientů byla léčba úspěšná [54].
Pleurektomie je standardní chirurgická metoda s odstraněním parietální pleury, směřující k vytvoření plošných adhezí mezi hrudní stěnou a plící a tím obliteraci pleurálního prostoru a zamezení tvorby výpotku.
Pleuroperitoneální shunt může být volbou u pacientů, kteří nejsou vhodní pro operační řešení nebo mají chylothorax způsobený malignitou. Jedná se o vytvoření jednosměrného zkratu mezi pleurální a peritoneální dutinou s čerpadlem, které umožňuje přečerpání chylothoraxu do peritoneální dutiny, kde dochází k jeho vstřebávání bez ztrát důležitých živin. Obvykle bývá k tomuto účelu využíván Denverův shunt (Denver Biomaterials, Inc., Golden, CO). Pleuroperitoneální zkrat je také vhodnou metodou u pediatrických pacientů s refrakterním chylothoraxem různé etiologie, s účinností 75−95 % a s délkou trvání 30−90 dní [6,55−57].
Závěr
Chylothorax je nenápadnou, ale o to závažnější komplikací po řadě torakochirurgických výkonů. Pouze včasná diagnóza a adekvátní terapie mohou u těchto multioborových pacientů po náročných výkonech vést ke zdárnému vyřešení této komplikace.
Seznam zkratek:
CT – výpočetní tomografie
SPECT/CT – jednofotonová emisní výpočetní tomografie spolu s nízce zátěžovou výpočetní tomografií
T2W-MRI – třídimenzionální magnetická rezonance
BMI – body mass index
EBM – evidence based medicine
TPN – total parenteral nutrition
Konflikt zájmů
Autor článku prohlašuje, že není v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise, s výjimkou kongresových abstrakt a doporučených postupů.
MUDr. Marek Szkorupa, Ph.D.
I. chirurgická klinika FN Olomouc
I. P. Pavlova 6
779 00 Olomouc
e-mail: szkorupm@fnol.cz
Sources
- Young S, Dalgleish S, Eccleston A, et al. Severe congenital chylothorax treated with octreotide. Journal of Perinatology 2004;24(3):200−202.
- Doerr CH, Allen MS, Nichols III FC, et al. Etiology of chylothorax in 203 patients. In Mayo Clinic Proceedings, Elsevier 2005;80(7):867–870). doi: 10.4065/80.7.867.
- Cerfolio RJ, Allen MS, Deschamps C, et al. Postoperative chylothorax. The Journal of Thoracic and Cardiovascular Surgery 1996;112(5):1361−1366. doi: 10.1016/S0022-5223(96)70152-6.
- Seitelman E, Arellano JJ, Takabe K, et al. Chylothorax after blunt trauma. Journal of Thoracic Disease 2012;4(3):327. doi: 10.3978/2072-1439.2011.09.03.
- Robinson CLN. The management of chylothorax. The Annals of Thoracic Surgery 1985;39(1):90–95. doi: 10.1016/S0003-4975(10)62531-3.
- Nair SK, Petko M, Hayward MP. Aetiology and management of chylothorax in adults. European Journal of Cardio-Thoracic Surgery 2007;32(2):362−369. doi: 10.1016/j.ejcts.2007.04.024.
- Chen E, Itkin M. Thoracic duct embolization for chylous leaks. In Seminars in interventional radiology © Thieme Medical Publishers 2011;28(1):063−074. doi: 10.1055/s-0031-1273941.
- Heffner JE. Etiology, clinical presentation, and diagnosis of chylothorax. 2015. Available at: www.uptodate.com/contents/etiology-clinicalpresentation-and-diagnosis-of-chylothorax
- Žáčková P, Vašáková M. Chylothorax a pseudochylothorax: diferenciální diagnostika a současné terapeutické možnosti. Prakt Lék. 2008;88.6 : 352−358.
- Chinnock BF. Chylothorax: case report and review of the literature. The Journal of Emergency Medicine 2003;24(3):259−262. doi: 10.1016/S0736-4679(02)00751-5.
- Bessone LN, Ferguson TB, Burford TH. Chylothorax. The Annals of Thoracic Surgery 1971;12(5):527−550. doi: 10.1016/S0003-4975(10)65800-6.
- Schild HH, Strassburg CP, Welz A, et al. Treatment options in patients with chylothorax. Deutsches Ärzteblatt International 2013;110(48):819. doi: 10.3238/arztebl.2013.0819.
- Maldonado F, Hawkins FJ, Daniels CE, et al. Pleural fluid characteristics of chylothorax. In Mayo Clinic Proceedings Elsevier 2009;84(2):129−133. doi: 10.4065/84.2.129.
- McGrath EE, Blades Z, Anderson PB. Chylothorax: aetiology, diagnosis and therapeutic options. Respiratory Medicine 2010;104(1):1−8. doi: 10.1016/j.rmed.2009.08.010.
- Staats BA, Ellefson RD, Budahn LL, et al. The lipoprotein profile of chylous and nonchylous pleural effusions. In Mayo Clinic Proceedings 1980;55(11):700−704.
- Hillerdal G. Chyliform (cholesterol) pleural effusion. Chest 1985;88(3):426−428. doi: 10.1378/chest.88.3.426.
- Lee EW, Shin JH, Ko HK, et al. Lymphangiography to treat postoperative lymphatic leakage: a technical review. Korean Journal of Radiology 2014;15(6):724−732. doi: 10.3348/kjr.2014.15.6.724.
- Lafont JE, Rau W, Krompiec C, et al. Effectiveness of therapeutic lymphography on lymphatic leakage. Acta Radiologica 2011 (Stockholm, Sweden: 1987). doi: 10.1258/ar.2010.090356.
- Deso S, Ludwig B, Kabutey NK, et al. Lymphangiography in the diagnosis and localization of various chyle leaks. Cardiovascular and Interventional Radiology 2012;35(1):117−126. doi: 10.1007/s00270-010-0066-x.
- Guermazi A, Brice P, Hennequin C, et al. Lymphography: an old technique retains its usefulness. Radiographics 2003;23(6):1541−1558. doi: 10.1148/rg.236035704.
- Sugiura K, Tanabe Y, Ogawa T, et al. Localization of chyle leakage site in postoperative chylothorax by oral administration of I-123 BMIPP. Annals of Nuclear Medicine 2005;19(7):597−601. doi: 10.1007/BF02985053.
- Momose M, Kawakami S, Koizumi T, et al. Lymphoscintigraphy using technetium-99m HSA-DTPA with SPECT/CT in chylothorax after childbirth. Radiation Medicine 2008;26(8):508−511. doi: 10.1007/s11604-008-0265-4.
- Ohtsuka A, Inoue Y, Asano Y, et al. Lymphoscintigraphy using dynamic imaging and SPECT/CT in chylothorax. Open Journal of Medical Imaging 2013;3(3). doi: 10.4236/ojmi.2013.33013.
- Chang YC, Yen YT, Chang MC, et al. Localization of thoracic duct using heavily T2W MRI for intractable post-esophagectomy chylothorax—a case report. Journal of Thoracic Disease 2017;9(2): E109. doi: 10.21037/jtd.2017.02.37.
- Shah RD, Luketich, JD, Schuchert MJ, et al. Postesophagectomy chylothorax: incidence, risk factors, and outcomes. The Annals of Thoracic Surgery 2010;93(3):897−904. doi: 10.1016/j.athoracsur.2011.10.060.
- Mery CM, Moffett BS, Khan MS, et al. Incidence and treatment of chylothorax after cardiac surgery in children: analysis of a large multi-institution database. The Journal of Thoracic and Cardiovascular Surgery 2014;147(2):678−686. doi: 10.1016/j.jtcvs.2013.09.068.
- Kilic D, Sahin E, Gulcan O, et al. Octreotide for treating chylothorax after cardiac surgery. Texas Heart Institute Journal 2005;32(3):437.
- Uchida S, Suzuki K, Hattori A, et al. Surgical intervention strategy for postoperative chylothorax after lung resection. Surgery Today 2016;46(2):197−202. doi: 10.1007/s00595-015-1183-6.
- Shimizu K, Yoshida J, Nishimura M, et al. Treatment strategy for chylothorax after pulmonary resection and lymph node dissection for lung cancer. The Journal of Thoracic and Cardiovascular Surgery 2002;124(3):499−502. doi: 10.1067/mtc.2002.124386.
- Buckley JR, Graham EM, Gaies M, et al. Clinical epidemiology and centre variation in chylothorax rates after cardiac surgery in children: a report from the pediatric cardiac critical care consortium. Cardiology in the Young 2017;27(9):1678−1685. doi: 10.1017/S104795111700097X.
- Miao L, Zhang Y, Hu H, et al. Incidence and management of chylothorax after esophagectomy. Thoracic Cancer 2015;6(3):354−358. doi: 10.1111/1759-7714.12240.
- Terzi A, Furlan G, Magnanelli G, et al. Chylothorax after pleuro-pulmonary surgery: a rare but unavoidable complication. The Thoracic and Cardiovascular Surgeon 1994;42(02):81−84. doi: 10.1055/s-2007-1016462.
- Stolz A, Pafko P. Komplikace v plicní chirurgii. Praha, Grada Publishing 2010.
- Valentine VG, Raffin TA. The management of chylothorax. Chest 1992;102(2):586−591. doi: 10.1378/chest.102.2.586.
- Pillay TG, Singh B. A review of traumatic chylothorax. Injury 2016;47(3):545−550. doi: 10.1016/j.injury.2015.12.015.
- Ulíbarri J, Sanz Y, Fuentes C, et al. Reduction of lymphorrhagia from ruptured thoracic duct by somatostatin. The Lancet 1990;336(8709):258. doi: 10.1016/0140-6736(90)91793-a.
- Collard JM, Laterre PF, Boemer F, et al. Conservative treatment of postsurgical lymphatic leaks with somatostatin-14. Chest 2000;117(3):902-905. doi: 10.1378/chest.117.3.902.
- Du Rieu MC, Mabrut JY. Management of postoperative chylothorax. Journal of Visceral Surgery 2011;148(5):e346−e352. doi: 10.1016/j.jviscsurg.2011.09.006.
- Lim KA, Kim SH, Huh J, et al. Somatostatin for postoperative chylothorax after surgery for children with congenital heart disease. Journal of Korean Medical Science 2005;20(6):947–951. doi: 10.3346/jkms.2005.20.6.947.
- Bello SO, Rahamim J. High-dose intravenous octreotide is safe and may be superior to surgery in managing severe postesophagectomy chylothorax in high-risk patients. The Annals of Thoracic Surgery 2015;100(1):297−299. doi: 10.1016/j.athoracsur.2014.08.058.
- Cope C. Diagnosis and treatment of postoperative chyle leakage via percutaneous transabdominal catheterization of the cisterna chyli: a preliminary study. Journal of Vascular and Interventional Radiology 1998;9(5):727−734. doi: 10.1016/s1051-0443(98)70382-3.
- Itkin M, Kucharczuk JC, Kwak A, et al. Nonoperative thoracic duct embolization for traumatic thoracic duct leak: experience in 109 patients. The Journal of Thoracic and Cardiovascular Surgery 2010;139(3):584−590. doi: 10.1016/j.jtcvs.2009.11.025.
- Higgins MC, Park AW, Angle JF. Chylothorax: percutaneous embolization of the thoracic duct. Operative Techniques in Thoracic and Cardiovascular Surgery 2015;20(4):402−412. doi: 10.1053/j.optechstcvs.2016.04.002.
- Dugue L, Sauvanet A, Farges O, et al. Output of chyle as an indicator of treatment for chylothorax complicating oesophagectomy. British Journal of Surgery 1998;85(8):1147−1149. doi: 10.1046/j.1365-2168.1998.00819.x.
- Merigliano S, Molena D, Ruol A, et al. Chylothorax complicating esophagectomy for cancer: a plea for early thoracic duct ligation. The Journal of Thoracic and Cardiovascular Surgery 2000;119(3):453–457. doi: 10.1016/s0022-5223(00)70123-1.
- Hou X, Fu JH, Wang X, et al. Prophylactic thoracic duct ligation has unfavorable impact on overall survival in patients with resectable oesophageal cancer. European Journal of Surgical Oncology (EJSO) 2014;40(12):1756−1762. doi: 10.1016/j.ejso.2014.05.002.
- Choh CT, Khan OA, Rychlik IJ, et al. Does ligation of the thoracic duct during oesophagectomy reduce the incidence of post-operative chylothorax? International Journal of Surgery 2012;10(4):203−205. doi: 10.1016/j.ijsu.2012.03.011.
- Paul S, Altorki NK, Port JL, et al. Surgical management of chylothorax. The Thoracic and Cardiovascular Surgeon 2009;57(04):226−228. doi: 10.1055/s-0029-1185457.
- Hayden JD, Sue-Ling HM, Sarela AI, et al. Minimally invasive management of chylous fistula after esophagectomy. Diseases of the Esophagus 2007;20(3):251−255. doi: 10.1111/j.1442-2050.2007.00644.x.
- Ahmed SU, Sancheti MS, Pickens A. Thoracoscopic thoracic duct ligation. Operative Techniques in Thoracic and Cardiovascular Surgery 2012;17(4):292−301. doi: 10.1053/j.optechstcvs.2012.11.003.
- Vassallo BC, Cavadas D, Beveraggi E, et al. Treatment of postoperative chylothorax through laparoscopic thoracic duct ligation. European Journal of Cardio-Thoracic Surgery 2002;21(3):556–557. doi: 10.1016/s1010-7940(01)01137-x.
- Seeliger B, Alesina PF, Walz MK. Posterior retroperitoneoscopic thoracic duct ligation: a novel surgical approach. Surgical Endoscopy 2018;32(8):3732−3737. doi: 10.1007/s00464-018-6262-5.
- Takuwa T, Yoshida J, Ono S, et al. Low-fat diet management strategy for chylothorax after pulmonary resection and lymph node dissection for primary lung cancer. The Journal of Thoracic and Cardiovascular Surgery 2013;146(3):571−574. doi: 10.1016/j.jtcvs.2013.04.015.
- Jianjun Q, Song Z, Yin L, et al. Treatment of chylothorax with elemene. The Thoracic and Cardiovascular Surgeon 2008;56(02):103−105. doi: 10.1055/s-2007-965708.
- Engum SA, Rescorla FJ, West KW, et al. The use of pleuroperitoneal shunts in the management of persistent chylothorax in infants. Journal of Pediatric Surgery 1999;34(2):286−290. doi: 10.1016/s0022-3468(99)90192-6.
- Wolff AB, Silen ML, Kokoska ER, et al. Treatment of refractory chylothorax with externalized pleuroperitoneal shunts in children. The Annals of Thoracic Surgery 1999;68(3):1053−1057. doi: 10.1016/s0003-4975(99)00880-2.
- Tutor JD. Chylothorax in infants and children. Pediatrics 2014;133(4):722−733. doi: 10.1542/peds.2013-2072.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2020 Issue 10-
All articles in this issue
- Role of extracorporeal life support in thoracic surgery
- Postoperative chylothorax − review
- Treatment of anastomotic leak after Ivor Lewis esophagectomy
- Malignancy after lung transplantation
- Hyperthermic intraoperative intrapleural chemotherapy and surgical cytoreduction as part of multimodal treatment of malignant pleural mesothelioma – case report M. Szkorupa1, D. Klos1, J. Chudacek1, J. Hanuliak1, M. Stasek1, O. Fischer2, R. Lemstrova3
- Pulmonary metastases in pseudomyxoma peritonei – case report and review of the literature
- Pulmonary arteriovenous malformation managed by VATS lobectomy
- Minimalizace a maximalizace v hrudní chirurgii
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Postoperative chylothorax − review
- Hyperthermic intraoperative intrapleural chemotherapy and surgical cytoreduction as part of multimodal treatment of malignant pleural mesothelioma – case report M. Szkorupa1, D. Klos1, J. Chudacek1, J. Hanuliak1, M. Stasek1, O. Fischer2, R. Lemstrova3
- Malignancy after lung transplantation
- Role of extracorporeal life support in thoracic surgery
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

