-
Medical journals
- Career
Fistuloklýza jako metoda zajištění výživy u pacienta s vysokoobjemovou enteroatmosférickou píštělí – kazuistika
Authors: L. Bébarová 1; M. Stašek 1; M. Szkorupa 1; T. Řezáč 1; P. Skalický 1; M. Horáková 2; K. Dostálová 3; M. Loveček 1
Authors‘ workplace: I. Chirurgická klinika Lékařské fakulty Univerzity Palackého a Fakultní nemocnice Olomouc 1; Oddělení intenzivní péče chirurgických oborů lékařské fakulty Univerzity Palackého a Fakultní nemocnice Olomouc 2; Klinika anesteziologie, resuscitace a intenzivní medicíny lékařské fakulty Univerzity Palackého a Fakultní nemocnice Olomouc 3
Published in: Rozhl. Chir., 2019, roč. 98, č. 7, s. 287-290.
Category: Case Report
Overview
Enterální píštěl představuje patologickou komunikaci mezi tenkým střevem a okolními tkáněmi. V případě komunikace s povrchem těla se jedná o píštěl enterokutánní či enteroatmosférickou. Příčiny vzniku enterokutánní/enteroatmosférické píštěle jsou různé. Společným důsledkem je pak malnutrice a orgánová dysfunkce, která vede ke zvýšení morbidity a mortality pacientů. Důležitým parametrem v managementu pacientů s enterokutánní/enteroatmosférickou píštělí je proto adekvátní nutriční podpora. Jednou z možností jejího zajištění je fistuloklýza, tedy aplikace enterální výživy do distálního ústí píštěle. Prezentujeme případ 76letého pacienta s vysokou a vysokoobjemovou enteroatmosférickou píštělí, u něhož bylo pomocí fistuloklýzy dosaženo adekvátního nutričního stavu s následným uzávěrem píštěle.
Klíčová slova:
fistuloklýza – enterální píštěl
Úvod
Enterální píštěl představuje abnormální komunikaci mezi tenkým střevem a okolními tkáněmi. V případě, že píštěl komunikuje s povrchem těla, mluvíme o tzv. enterokutánní píštěli (ECF). ECF mohou být klasifikovány na základě různých kritérií – místa původu (duodenum, jejunum, ileum), anatomie píštělového traktu (jednoduché, komplexní, krátké, dlouhé) či množství odpadu z nich (nízkoobjemové, vysokoobjemové). Zvláštní formou ECF je tzv. enteroatmosférická píštěl (EAF), kdy se ústí píštěle nachází v otevřené ráně, není tedy obklopeno kožním krytem a střevo je vystaveno působení okolní atmosféry [1]. ECF nejčastěji vzniká iatrogenně v důsledku chirurgického výkonu v dutině břišní. Méně častými příčinami jsou malignity či jejich radioterapie, nespecifické střevní záněty, střevní obstrukce, poranění břicha, komplikované nitrobřišní infekce (např. TBC) a divertikulitida. Přítomnost ECF/EAF je vždy spojena s vyšší morbiditou a mortalitou [2,3]. Nejzávažnější komplikací, zejména u vysokých a vysokoobjemových ECF/EAF je perzistující ztráta enterálního obsahu a katabolismus vyúsťující v malnutrici, elektrolytovou dysbalanci a orgánovou dysfunkci. Jednou z možností zajištění výživy u pacientů s ECF/EAF je tzv. fistuloklýza, metoda, kdy se pomocí katétru do distálního ústí píštěle aplikuje kontinuálně či bolusově enterální výživa, případně společně s enterálním obsahem odcházejícím z proximálního ústí píštěle [4,5].
Kazuistika
Prezentujeme případ 76letého pacienta, který byl v květnu 2017 v jiném zdravotnickém zařízení vyšetřen pro náhle vzniklý bezbolestný ikterus. Na ERCP byl prokázán stenozující tumor distálního choledochu, dle CT bez známek generalizace. Pacient byl následně vyšetřen v hepatopankreatobiliární poradně naší kliniky a na základě nálezu byl indikován k resekčnímu výkonu. Pacientovi byla provedena cholecystektomie a pylorus šetřící pravostranná duodenohemipankreatektomie s rekonstrukcí na 1 kličku v pořadí pankreatikojejunoanastomóza (PJA) end to side, hepatikojejunoanastomóza (HJA) end to side a duodenojejunoanastomóza (DJA) end to side. Současně byla pro měkkou rizikovou strukturu pankreatu založena nutritivní jejunostomie. Pacient byl po výkonu přeložen na Oddělení intenzivní péče chirurgických oborů (IPCHO), kde byl přechodně zajištěn Sandostatinem v dávce 0,1 mg 3x denně subkutánně. V pooperačním průběhu došlo k rozvoji paralytického ileu bez možnosti enterální výživy (EV) a těžké bronchopneumonie s nutností umělé plicní ventilace (UPV) a následného založení tracheostomie a dále renálního selhání s nutností hemodialýzy, ke které byl pacient přeložen na Kliniku anesteziologie, resuscitace a intenzivní medicíny (KARIM). 15. pooperační den byla pro enterální sekreci z rány provedena revize dutiny břišní s nálezem perforace tenké kličky asi 25 cm za jejunostomií. Perforace byla přešita a dutina břišní uzavřena dočasným syntetickým krytem. Po sedmi dnech se opět objevila enterální sekrece v dočasném krytí. Při následné revizi byla zjištěna drobná dehiscence původní sutury, kterou již nebylo možno ošetřit přešitím, proto byla v tomto místě tenká klička vyšita jako nástěnná jejunostomie, respektive vysoká enterokutánní píštěl (Obr. 1, 2). Vlivem působení enterální sekrece na okolní kožní kryt došlo postupně k nekróze tkáně v okolí píštěle s rozvojem enteroatmosférické píštěle. Po 17 dnech byl odstraněn dočasný kryt laparostomie a dutina břišní byla uzavřena. 41. den po primární operaci byl pacient přeložen na JIP naší kliniky. Vzhledem k postupně narůstajícím hodnotám alkalické fosfatázy (ALP) a gamaglutamyltransferázy (GGT) vlivem podávání parenterální výživy (PEV) a také počínajícímu rozvoji encefalopatie a současné nutnosti zajištění výživy pacienta jsme se rozhodli pro enterální cestu podávání výživy i při ne úplně optimálně fungujícím trávicím traktu. Zavedení nasojejunální sondy se ukázalo jako nevhodné, jelikož podávaná výživa by odcházela píštělí. Primárně zavedený jejunostomický katétr píštěl překlenoval jen o několik centimetrů, což vedlo k návratu EV do píštěle a jejím ztrátám. Proto byla provedena výměna katétru za delší pod skiaskopickou kontrolou (Obr. 3) a následně byla zahájena modifikovaná metoda fistuloklýzy. Pacientovi byla podávána kontinuálně EV do jejunostomie po dobu 18 hodin denně. Na ústí EAF byl nalepen stomický sáček, který se vypouštěl do sběrné nádoby, a z této bylo injekční stříkačkou podáváno bolusově každou hodinu 50 ml tekuté složky odpadu z EAF do jejunostomie. Takto jsme byli schopni za dobu 30 dnů postupně snížit celkové ztráty z píštěle z původních téměř 3000 ml na 450 ml. S narůstající tolerancí EV bylo možno snižovat i objem podávané PEV. Zároveň došlo k výraznému zlepšení pacienta po stránce laboratorní s poklesem ALP a GGT z hodnot kolem 16 a 12 µkatl/l respektive na 9 a 8 µkat/l respektive, téměř úplnou normalizací hodnot celkové bílkoviny a albuminu (63 a 30 g/l respektive). Rovněž se výrazně zlepšil pacientův neurostatus po stránce kognitivních funkcí. 72 dnů od primární operace byla provedena revize píštěle s úpravou okrajů tenkého střeva, uzavřením píštěle ve dvou vrstvách a ponecháním původní jejunostomie. Po 9 dnech byl pacient v dobrém stavu, bez EAF, bez tracheostomické kanyly a dobře tolerující perorální příjem mleté stravy přeložen na standardní oddělení a odtud byl po celkově 85denní hospitalizaci plně zatížený stravou přeložen do spádového zdravotnického zařízení k doléčení. V definitivním histologickém nálezu se jednalo o adenokarcinom choledochu pT3N1M0. U pacienta byla vzhledem k věku, komorbiditám a prodělaným komplikacím indikována dispenzarizace.
Image 1. Enteroatmosférická píštěl na proximálním jejunu
Fog. 1. Enteroatmospheric fistula on proximal jejunum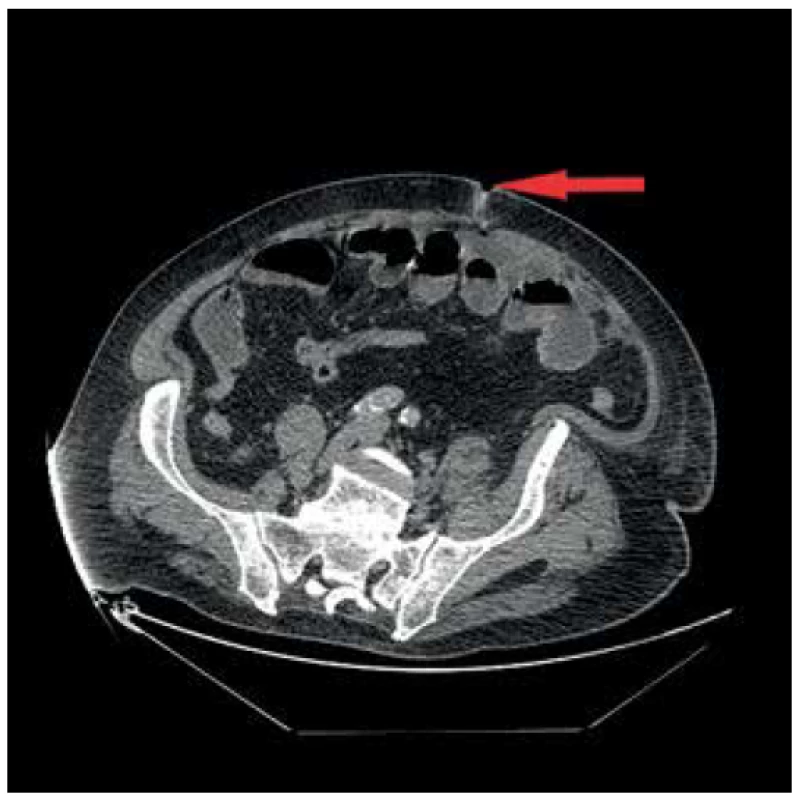
Image 2. Jejunostomický katetr zavedený proximálně od píštěle
Fig. 2. Jejunostomal catheter inserted proximally to the fistula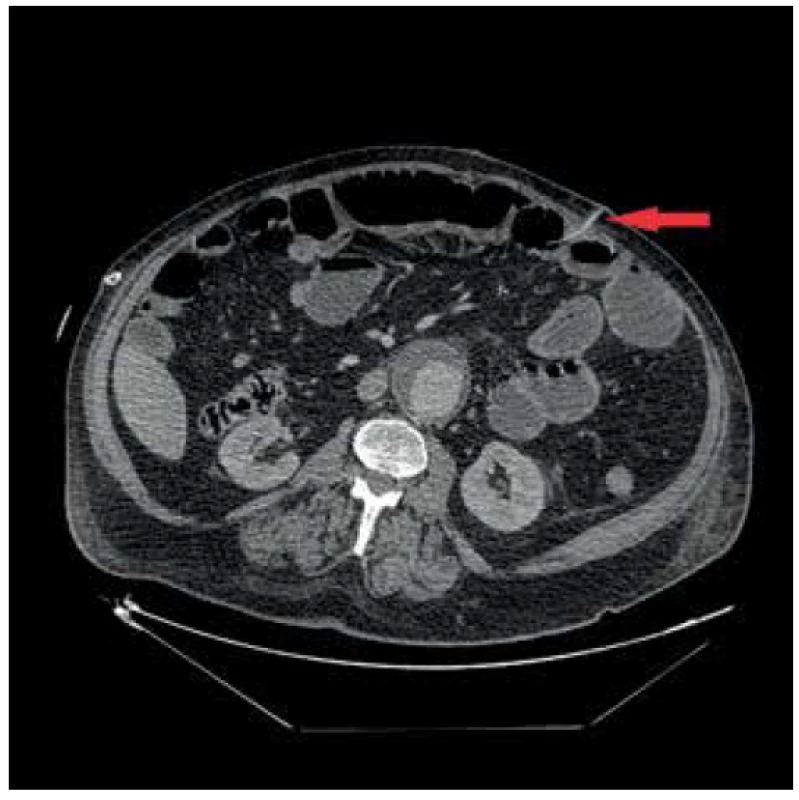
Image 3. Nově zavedený delší jejunostomický katetr (místo píštěle označeno kontrastně)
Fig. 3. Newly inserted longer jejunostomal catheter (fistula position marked with contrast agent)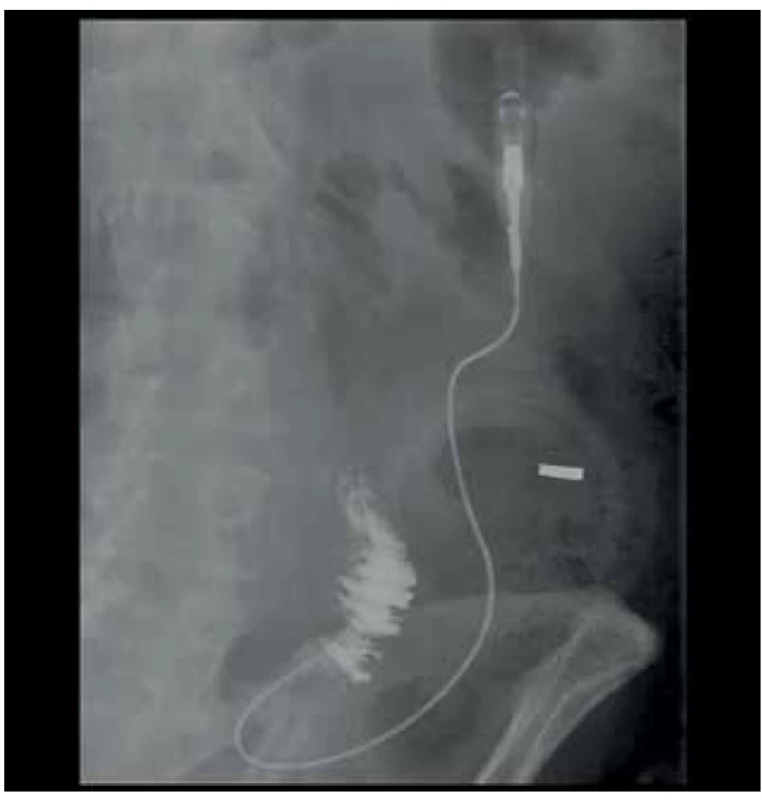
Diskuze
Pooperační ECF/EAF je nejčastějším typem píštěle, a přestože se mortalita spojená s jejím výskytem za posledních 50 let snížila na méně než 15 %, zůstává stále významnou a nepříjemnou komplikací [3,6]. Její závažnost záleží na mnoha faktorech, kromě celkového stavu pacienta hrají značnou roli i lokalizace a charakter píštěle. Jejunální píštěle, nízkoobjemové píštěle (pod 500 ml/24 h), píštěle s drobným střevním defektem (do 1 cm) a píštěle s delším traktem (nad 2 cm) mají větší šanci na spontánní zhojení. Naproti tomu ileální píštěle, vysokoobjemové píštěle (nad 500 ml/24 h), píštěle s větším střevním defektem a píštěle s krátkým traktem obvykle vyžadují další chirurgickou intervenci [1,7,8,9]. Vysokoobjemové píštěle jsou spojeny s velkými ztrátami tekutin a elektrolytů a malnutricí, což vede ke zvýšení morbidity a mortality pacientů [4,10]. Základním předpokladem úspěšné terapie pacientů s ECF/EAF je dostatečná nutriční podpora. Standardním přístupem a obvykle prvním krokem v zajištění výživy je restrikce perorálního příjmu a zahájení PEV. Ta má však řadu nežádoucích účinků, jako poškození jater, atrofii střevní sliznice, hyperglykemii, hypokalemii, katétrovou infekci či Wernickeovu encefalopatii a v neposlední řadě je i finančně náročná. Standardní EV sice zlepšuje funkci střevní sliznice, redukuje poškození jater a brání translokaci bakterií, na druhou stranu však zvyšuje ztráty z ECF/EAF [4,11]. Alternativní metodou zajištění výživy je využití fistuloklýzy. Existují různé metody jejího provedení od prostého sběru enterálního obsahu z proximálního ústí píštěle pomocí na ni nalepeného stomického sáčku a následné bolusové aplikace do distálního ústí pomocí stříkačky přes aplikaci Foleyova katétru do každého ústí až po sofistikované uzavřené systémy s možností kontinuální aplikace [3,12,13]. Bylo prokázáno, že fistuloklýza zlepšuje jaterní funkce lépe než totální EV, poskytuje esenciální enzymy a žlučové kyseliny pro optimální utilizaci EV a snižuje odpad z píštěle více než samotná EV. To vede k rychlejší optimalizaci nutričních parametrů, zkracuje délku hospitalizace, snižuje hospitalizační i celkovou mortalitu pacientů a v některých případech může kompletně nahradit PEV. Navíc je její využití ekonomicky méně náročné. Nejčastější komplikací fistuloklýzy je dislokace katétru navenek, méně často tzv. spolknutý katétr, kdy tento vlivem střevní peristaltiky zapadne do střeva. Jedinou limitací provedení fistuloklýzy je nedostatečná délka střeva nebo obstrukce za distálním ústím píštěle [2,4,14]
Závěr
Fistuloklýza je jednou z možných metod zajištění adekvátní výživy u pacientů s ECF/EAF, ať už samotná, či v kombinaci s PEV nebo EV. Její použití je z pohledu techniky jednoduché, při správném provedení bezpečné a ekonomicky méně náročné než podávání PEV či plné EV.
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise.
Linda Bébarová
I. chirurgická klinika FN Olomouc
I. P. Pavlova 6
779 00 Olomouc
e-mail: linda.bebarova@fnol.cz
Sources
- Kumpf VJ, Aguilar-Nascimento JE, Graf JI D-P, et al. ASPEN-FELANPE clinical guidelines: Nutrition support of adult patients with enterocutaneous fistula. JPEN J Parenter Enteral Nutr. 2017;41 : 104−12. doi: 10.1177/0148607116680792. Epub 2016 Dec 5.
- Badrasawi M, Shahar S, Sagap I. Nutritional management in enterocutaneous fistula. What is the evidence? Malays J Med Sci. 2015;22 : 6−16.
- Polk TM, Schwab CW. Metabolic and nutritional support of the enterocutaneous fistula patient: a three-phase approach. World J Surg. 2012;36 : 524−33. doi: 10.1007/s00268-011-1315-0.
- Wu J, Ren J, Wang G, et al. Fistuloclysis improves liver function and nutritional status in patients with high-output upper enteric fistula. Gastroenterol Res Pract. 2014;2014 : 941514. doi: 10.1155/2014/941514.
- Wright SJ, Daniells S, Keogh GW. Fistuloclysis: a high-calorie, polymeric formula can be successful. JPEN J Parenter Enteral Nutr. 2013;37 : 550−3. doi: 10.1177/0148607112452307. Epub 2012 Jul 2.
- Njeze GE, Achebe UJ. Enterocutaneous fistula: a review of 82 cases. Niger J Clin Pract. 2013;16 : 174−7. doi: 10.4103/1119-3077.110140.
- Galie KL, Whitlow CB. Postoperative enterocutaneous fistula: when to reoperate and how to succeed. Clin Colon Rectal Surg. 2006;19 : 237−46. doi: 10.1055/s-2006-956446.
- Ortiz LA, Zhang B, McCarthy MW. Treatment of enterocutaneous fistulas, then and now. Nutr Clin Pract. 2017;32 : 508−15. doi: 10.1177/0884533617701402.
- Pelák Z, Skála P. Enterální píštěl jako pooperační komplikace – kazuistika. Rozhl Chir. 2009;88 : 334−6.
- Sule EA, Nzegwu MA, Okolo JC, et al. Postoperative enterocutaneous fistula – principles in non-operative approach. Ann Med Surg. (Lond) 2017;24 : 77−81. doi: 10.1016/j.amsu.2017.09.011. eCollection 2017 Dec.
- Bleier JIS, Hedrick T. Metabolic support of the enterocutaneous fistula patient. Clin Colon Rectal Surg. 2010;23 : 142−8. doi: 10.1055/s-0030-1262981.
- Pflug AM, Utiyama EM, Fontes B, et al. Continuous reinfusion of succus entericus associated with fistuloclysis in the management of a complex jejunal fistula on the abdominal wall. Int J Surg Case Rep. 2013;4 : 716−8. doi: 10.1016/j.ijscr.2013.04.041.
- Cawich S, McFarlane M, Mitchell D. Fistuloclysis: a novel approach to the management of enterocutaneous fistulae. The Internet Journal of Surgery 2006;9.
- Farrer K, Lal S, Teubner A. Fistuloclysis and distal enteral feeding in acute intestinal failure. Clin Nutr ESPEN 2015;10:e189. doi: 10.1016/j.clnesp.2015.03.030.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2019 Issue 7-
All articles in this issue
- Klinická výživa v chirurgii a jak dál?
- Operační řešení tříselné kýly z pohledu nejnovějších doporučení
- Srovnání účinnosti nízkoobjemových roztoků v přípravě střeva před kolonoskopií: randomizovaná, prospektivní, odslepená studie
- Fixace sítěk při laparoskopické plastice tříselných kýl
- Fistuloklýza jako metoda zajištění výživy u pacienta s vysokoobjemovou enteroatmosférickou píštělí – kazuistika
- Fournierova gangréna jako komplikace Amyandovy hernie
- Absces sleziny jako vzácný projev mimoplicní tuberkulózy − kazuistika
- Konference SAGES 2019
- Ohlédnutí za mezinárodním kongresem karcinomu žaludku
- Infraglenoidální zlomenina krčku lopatky − skutečnost nebo mýtus?
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Operační řešení tříselné kýly z pohledu nejnovějších doporučení
- Fixace sítěk při laparoskopické plastice tříselných kýl
- Fournierova gangréna jako komplikace Amyandovy hernie
- Fistuloklýza jako metoda zajištění výživy u pacienta s vysokoobjemovou enteroatmosférickou píštělí – kazuistika
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

