-
Medical journals
- Career
Detekce lymfatických uzlin a kvalita mezorektální excize
Authors: M. Grega 1; M. Vjaclovský 2; R. Chmelová 1; F. Pazdírek 2; R. Kodet 1; J. Hoch 2
Authors‘ workplace: Ústav patologie a molekulární medicíny 2. lékařské fakulty Univerzity Karlovy a Fakultní nemocnice Motol 1; Chirurgická klinika 2. lékařské fakulty Univerzity Karlovy a Fakultní nemocnice Motol 2
Published in: Rozhl. Chir., 2019, roč. 98, č. 5, s. 200-206.
Category: Original articles
Overview
Úvod:
Detekce a vyšetření náležitého počtu lymfatických uzlin u pacientů po resekci rekta pro karcinom je důležitá pro další léčbu a péči o pacienty. Minimální počet nalezených uzlin není jednoznačně stanoven, doporučení se shodují na počtu 12 (10 až 14) uzlin. Tento počet je někdy obtížně dosažitelný, především u vyšších věkových skupin pacientů a u pacientů po podání neoadjuvantní léčby, zejména radiační terapie. Možným řešením pro zlepšení výtěžnosti lymfatických uzlin se jeví zavedení definovaných protokolů, které byly původně navrženy k hodnocení kvality mezorektální excize.
Metody:
Do sestavy byli zařazeni pacienti vyšetřováni ve dvou tříletých intervalech, před a po zavedení protokolu. Hodnotili jsme změny v počtu nalezených a vyšetřených lymfatických uzlin celkově i ve vztahu k věku pacientů a pohlaví.
Výsledky:
Průměrný počet nalezených uzlin po zavedení protokolu se zvýšil celkově z 10 na 15 uzlin, ve skupině pacientů po podání neoadjuvantní léčby ze 7 uzlin na téměř 14. Doporučovaných počtů bylo dosaženo ve všech zkoumaných věkových kategoriích. Se zvýšeným počtem nalezených lymfatických uzlin se zvyšuje i potenciální nález metastázy s následným zvýšením stadia nádorového onemocnění, u pacientů po podání neoadjuvantní léčby je to o více než 4 %.
Závěr:
Výsledky ukazují, že vytvoření kooperativní pracovní skupiny (zejména chirurg-patolog), zavedení definovaného protokolu operativy a zpracování resekátů a vyčlenění erudovaných pracovníků má význam pro další léčbu a péči o pacienta s kolorektálním karcinomem.
Klíčová slova:
mezorektální excize – cirkumferenční resekční okraj (CRM) – stadium dle TNM a Dukese – identifikace a vyšetření lymfatických uzlin
ÚVOD
Prognostický význam revize perikolické a perirektální tukové tkáně a identifikace lymfatických uzlin u pacientů s kolorektálním karcinomem je znám více než 100 let a byl posléze zahrnut do celkového hodnocení stadia onemocnění v rámci Dukesovy klasifikace i klasifikace TNM [1]. Kromě prognózy a rizika lokální či celkové recidivy onemocnění je tento fenomén důležitý také pro volbu léčby pacientů (chirugická léčba, neoadjuvantní a adjuvantní léčba, biologická léčba) [2].
Vyhledání a vyšetření co největšího počtu lymfatických uzlin se přikládá velký význam. Řada autorů se snažila stanovit, jaký minimální počet lymfatických uzlin v resekátu střeva s kolorektálním karcinomem lze považovat za dostatečný [3−8]. Minimální počet nalezených lymfatických uzlin je obtížné stanovit. Pohled na tuto problematiku se v průběhu vývoje diagnostiky a léčby mění. Byly publikovány studie a doporučení, které na pozadí rozsáhlých souborů stanovují empirickou hranici minimálního počtu lymfatických uzlin potřebných k určení co nejobjektivnějšího stagingu onemocnění. Většina se shoduje na počtu 12 lymfatických uzlin, variabilně v rozmezí 10−14 uzlin [3−8]. Popsané studie zpracovávají více faktorů. Je to počet nalezených lymfatických uzlin ve vztahu k riziku lokální či celkové recidivy onemocnění u pacientů se stadiem N0 (Dukes B), vliv na celkové 5leté přežití [5,6] a nález pozitivních lymfatických uzlin v závislosti na celkovém počtu nalezených uzlin [1,8]. Doporučení pečlivé revize resekátu a hledání co největšího počtu lymfatických uzlin podporuje také skutečnost, že metastázou adenokarcinomu bývají často postižené makroskopicky spíše menší lymfatické uzliny (pod 5 mm) [1,6,9,10]. Naproti tomu se autoři více studií shodují, že po dosažení určitého počtu nalezených lymfatických uzlin se možnost nálezu metastázy zvyšuje už jen minimálně [1], podobně jako se po dosažení této hranice snižuje vliv na celkové přežití pacienta [5,6]. Počet nalezených lymfatických uzlin v preparátech s kolorektálním karcinomem považují četná pracoviště za určitý indikátor kvality chirurgických výkonů a také kvality zpracování a interpretace resekátů patologem [3,5,6,9].
Méně je v literatuře zmapována problematika u izolované skupiny pacientů s adenokarcinomem rekta [10]. Rektum je specifické z pohledu klinické i topografické anatomie, uložením v malé pánvi a zejména uspořádáním cévního zásobení. Proto pohled na resekci rekta vyžaduje osobitý a specifický přístup multidisciplinárního týmu v čele s chirurgem. Kvalita resekce se zajištěním kompletní mezorektální excize a bezpečného cirkumferenčního resekčního okraje (CRM – circumferential resection margin) hraje významnou roli v intervalech přežití bez recidivy onemocnění i celkového přežití u pacientů s kolorektálním karcinomem. Tento fenomén je znám již několik desítek let a pracoviště napříč celým světem zavádějí protokoly pro hodnocení kvality mezorektální excize [4,9−15]. Naše práce se zabývá pohledem na zvýšení počtu identifikovaných a vyšetřených lymfatických uzlin u resekátů rekta zpracovaných dle protokolu pro hodnocení kvality mezorektální excize. Cílem práce je upozornit na zlepšení v oblasti získání lymfatických uzlin z pararektálních měkkých tkání po zavedení protokolu a význam vytvoření kooperativní skupiny chirurga a patologa, případně dalších odborností. Dalším cílem bylo zjistit vliv různých faktorů na celkovou výtěžnost vyšetřených lymfatických uzlin, a to věku pacientů [7], vlivu pohlaví a samozřejmě vlivu předchozí, zejména radiační terapie.
Kromě absolutního počtu nalezených lymfatických uzlin jsme sledovali, zda při zvýšeném počtu nalezených lymfatických uzlin stoupá pravděpodobnost nalezení metastázy spojená s vyšším stadiem onemocnění (Dukes B vs. Dukes C) [6,8].
METODY
V průběhu roku 2013 jsme na Ústavu patologie a molekulární medicíny 2. LF UK a FN Motol (ÚPMM) v spolupráci s kolorektální pracovní skupinou Chirurgické kliniky 2. LF UK a FN Motol zavedli protokol pro zpracování a hodnocení resekátu rekta a kvality mezorektální excize, včetně bezpečného CRM.
Nerozstřižený preparát resekovaného rekta byl v první době řádně makroskopicky popsán, mezorektální neperitonealizovaný povrch obarven tuší, pořídili jsme fotodokumentaci resekátu a preparát byl ponechán přes noc ve fixační tekutině (10% formol). V druhé době byly pořízeny cirkulární řezy přes nádorové ložisko, které byly opět fotodokumentovány, doplnili a upřesnili jsme makroskopické hodnocení preparátu i nádoru s následným přikrojením pro histologické zpracování. Pak byl preparát přeložen do diferenciačního roztoku k projasnění a identifikaci lymfatických uzlin a v něm ponechán přes noc. Pro tuto proceduru používáme Carnoyův roztok [16]. Následující den jsme resekát opětovně revidovali a vyhledali lymfatické uzliny, které jsme pak histologicky vyšetřili, jejich popis je součástí bioptického výstupu.
K zpracování resekátů rekta dle používaného protokolu jsou na ÚPMM vyčleněni 2 lékaři – patologové, kteří mají zkušenost s protokolem a podíleli se na jeho zavedení, komunikují s operační skupinou v případě nesrovnalostí a účastní se mezioborových a srovnávacích seminářů. Před zavedením protokolu se na vyšetření resekátů rekta podíleli všichni lékaři pracoviště.
Data k předkládané studii jsme získali z bioptických protokolů v databázi ÚPMM. U pacientů z níže uvedených souborů byl vyhledán počet vyšetřených lymfatických uzlin a stanoven jejich průměrný počet a medián. Hodnotili jsme počty nalezených lymfatických uzlin celkově a ve vztahu k neoadjuvantní terapii. Tyto nálezy jsme dále srovnávali a hodnotili ve vztahu k věku a pohlaví.
Sestava pacientů
Hodnotili jsme 2 skupiny pacientů. Do skupiny 1 z let 2010−2012, před zavedením protokolu, bylo zařazeno 108 pacientů. Všichni pacienti podstoupili resekci rekta, mezorektální excize nebyla zvlášť hodnocena. Skupinu tvoří 57 pacientů po resekci rekta bez neoadjuvantní terapie a 51 pacientů po předoperačním podání neoadjuvantní terapie. Do skupiny 2 bylo zařazeno 140 pacientů, u kterých byl resekát rekta zpracován podle definovaného protokolu (pacienti z let 2014−2016). V této skupině je 71 pacientů po resekci rekta bez neoadjuvantní terapie a 69 pacientů s resekcí rekta po podání neoadjuvantní terapie (Tab. 1). Rozdělení souboru z hlediska pohlaví je v Tab. 2.
Table 1. Soubor pacientů a rozdělení do jednotlivých skupin
Tab. 1. Investigated groups of patients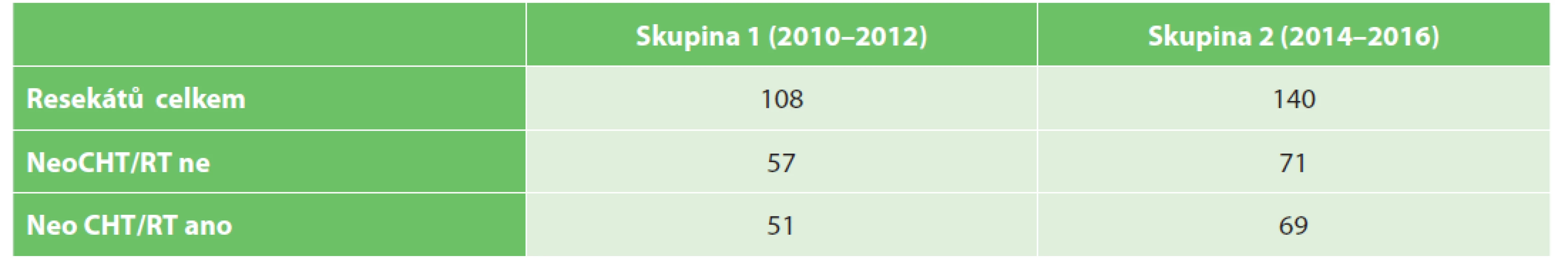
Table 2. Rozdělení souboru dle pohlaví
Tab. 2. Distribution of patient groups according to gender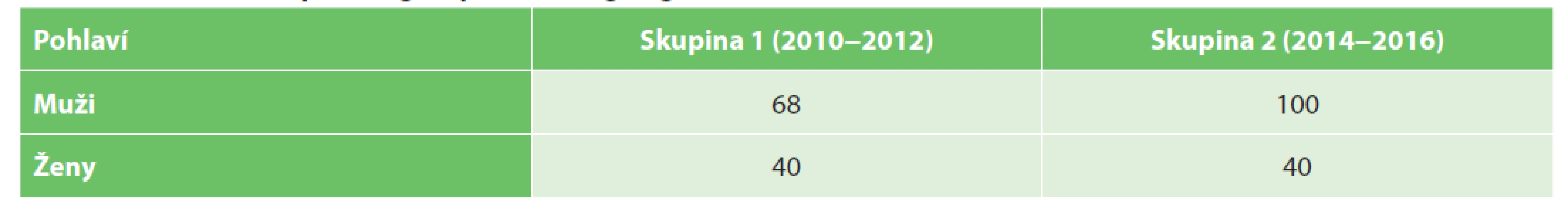
Soubor pacientů byl pro další srovnání rozdělen po věkových skupinách – do 60 let, 60–69 let, 70−79 let, nad 80 let (Tab. 3, Grafy 1).
Table 3. Věkové rozložení porovnávaných souborů
Tab. 3. Distribution of patient groups according to age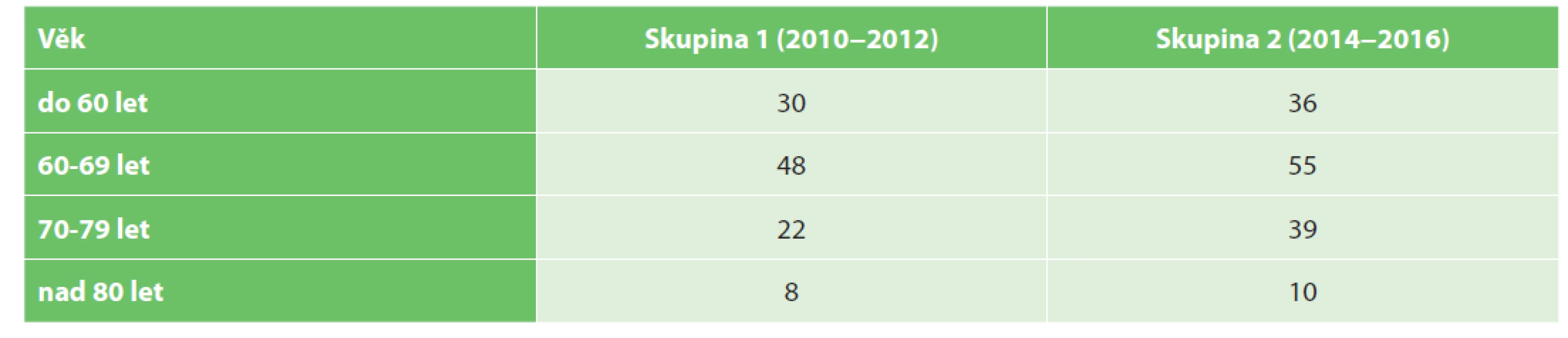
Graph 1. Věkové rozložení porovnávaného souboru
Graphs 1. Distribution of patient groups according to age
Ve srovnávaných skupinách byli vyčleněni pacienti bez uzlinového postižení (pN0, resp. ypN0; Dukes B) a pacienti s uzlinovým postižením (pN1, ypN1 a vyšší; Dukes C) a v závislosti na podání neoadjuvantní terapie (Tab. 4).
Table 4. Rozdělení souboru dle průkazu uzlinové metastázy
Tab. 4. Distribution of patient groups according to presence/absence of lymph node metastasis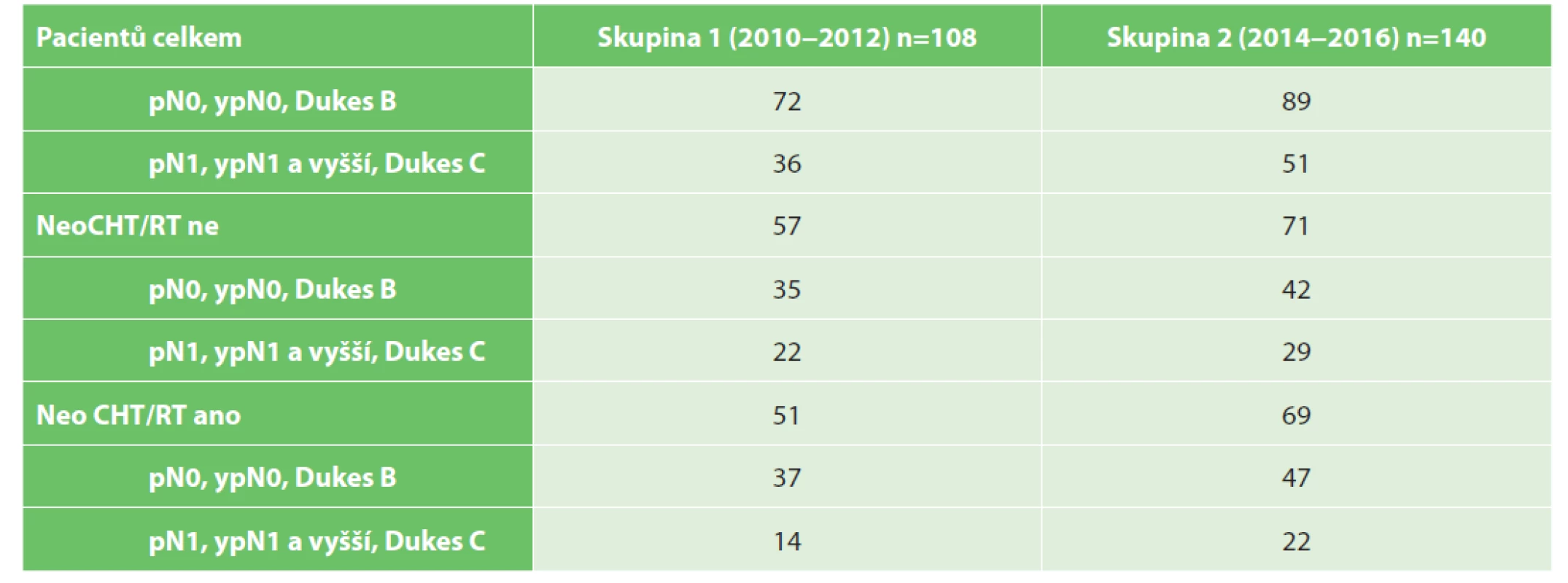
VÝSLEDKY
U pacientů v skupině 1 bylo nalezeno průměrně 9,93 lymfatické uzliny (v rozmezí 0−31 uzlin). U resekcí bez neoCHT/RT 12,75 uzliny (1−31 uzlin), u resekcí po neoadjuvantní terapii 6,76 uzliny (0−29 uzlin).
U pacientů v skupině 2 bylo nalezeno průměrně 15,56 uzliny (1−43 uzlin). U resekcí bez neoCHT/RT 17,37 uzliny (4–43 uzlin), u resekcí po neoadjuvantní terapii 13,71 uzliny (1−38 uzlin, viz Tab. 5 a Graf 2).
Table 5. Počty nalezených lymfatických uzlin u vyšetřovaného souboru pacientů
Tab. 5. Count of harvested and investigated lymph nodes in patient groups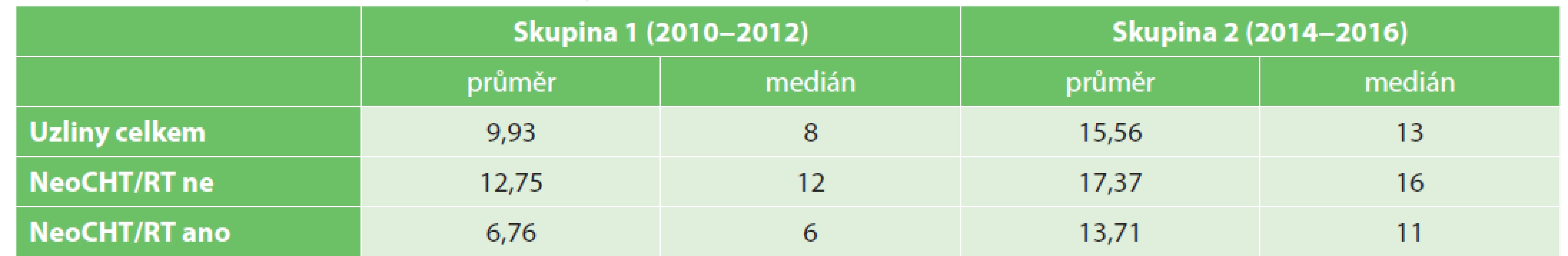
Graph 2. Průměrný počet nalezených lymfatických uzlin
Graph 2. Average count of investigated lymph nodes
Hodnoceno dle pohlaví se počet nalezených lymfatických uzlin v sledované sestavě pacientů nelišil (Tab. 6).
Table 6. Počet nalezených lymfatických uzlin v závislosti na pohlaví
Tab. 6. Number of investigated lymph nodes in relationship to gender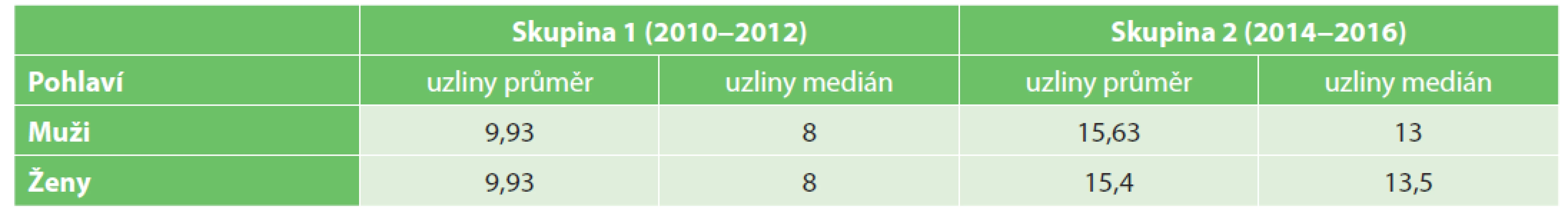
Tab. 7 ukazuje závislost počtu nalezených a vyšetřených lymfatických uzlin dle věkového rozložení sestavy pacientů.
Table 7. Výtěžnost lymfatických uzlin v jednotlivých věkových kategoriích
Tab. 7. Number of investigated lymph nodes in relationship to age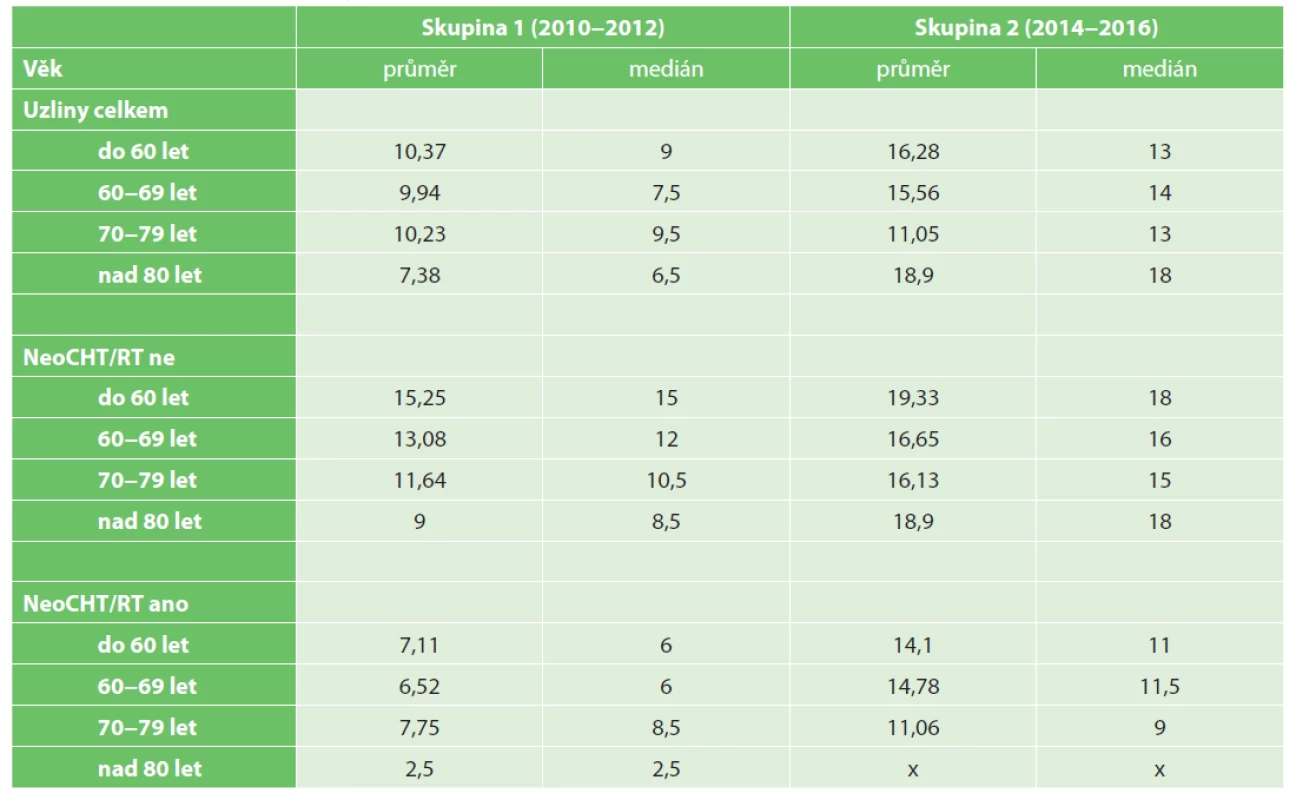
Posledním srovnáním byl potenciální nález uzlinové metastázy v závislosti na počtu vyšetřených lymfatických uzlin. V resekátech bez neoCHT/RT bylo v skupině 1 (57 pacientů) 22 pacientů s uzlinovým postižením (38,6 %) a v skupině 2 (71 pacientů) 29 pacientů s uzlinovým postižením (40,85 %). Po podání neoadjuvantní terapie bylo v skupině 1 (51 pacientů) 14 pacientů s uzlinovým postižením (27,45 %) a v skupině 2 (69 pacientů) 22 pacientů s uzlinovým postižením (31,88 %) (Tab. 8, Graf 3).
Table 8. Pacienti s metastatickým postižením lymfatických uzlin
Tab. 8. Patients with proven lymph node metastasis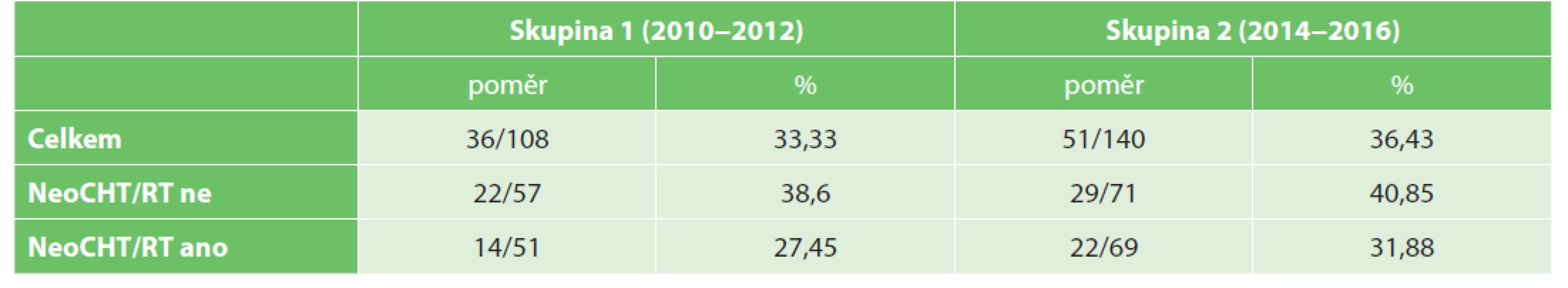
Graph 3. Procentuální zastoupení resekátů s uzlinovým postižením
Graph 3. Patients with proven lymph node metastasis (percentages)
DISKUZE
Adenokarcinom rekta je jedno z nejčastějších onkologických onemocnění v populaci, ročně je v ČR postiženo přibližně 3000 pacientů. Proto má zlepšování jeho léčby zásadní přínos. Možnosti léčby se stále rozvíjejí o nové metody a procedury. Pro správnou a cílenou léčbu je důležité správné zhodnocení nádoru a zejména stadium onemocnění. Nedílnou součástí interpretace nálezu u vyšetřovaného resekátu je také uzlinový status, který začleňuje pacienty do jednotlivých terapeutických skupin [2].
Od celkového počtu nalezených lymfatických uzlin, a to také bez ohledu na přítomnost metastázy, se odvíjí také prognóza onemocnění, celkový interval přežití a interval přežití bez recidivy [5,6,10].
V literatuře je také rozebírána problematika sentinelové lymfatické uzliny u kolorektálního karcinomu. Jedná se však stále o poměrně kontroverzní téma. Samotné určení sentinelové lymfatické uzliny, její označení a odběr není sjednocen. Z hlediska interpretace je popisována poměrně vysoká falešná negativita [6,10,17].
V rámci kooperativní skupiny jsme na našem pracovišti vypracovali a zavedli definovaný protokol pro zpracování resekátů rekta, který byl cílen primárně na kvalitu mezorektální excize. Protokol vychází z doporučení britské Royal College of Pathologists [12] a z upravené verze aplikované kolegy z pracovní skupiny v Hradci Králové [15]. Protokol byl částečně modifikován a upraven v souladu s požadavky chirurgického týmu a s možnostmi pracoviště patologie. Celkově trvá zpracování resekátu rekta o 1 den déle než rutinní zpracování resekátu tlustého střeva s nádorem. Díky tomuto prodloužení je nádorová tkáň i tkáň celého resekátu lépe profixována, což zvyšuje kvalitu dalšího zpracování a histologických preparátů, současně s kvalitnější diferenciací lymfatických uzlin.
Již za poměrně krátkou dobu trvání projektu hodnocení kvality mezorektální excize v rámci našich pracovišť byly publikovány výsledky pojednávající o zlepšení předoperační a předléčebné diagnostiky, vyšetření resekátu patologem a zpětně také kvality chirurgického výkonu [14].
Dalším pozitivním důsledkem zavedení protokolu bylo zlepšení identifikace lymfatických uzlin. V předkládaném sdělení se jedná o zvýšení průměrného počtu nalezených uzlin z 9,93 na 15,56 (nárůst o 56,7 %). Počty lymfatických uzlin se zvýšily i v dílčích podskupinách pacientů s primární chirurgickou léčbou z průměrných 12,75 na 17,37 (o 36,2 %) a nejvíce u pacientů, kteří před resekcí podstoupili neoadjuvantní terapii z průměrných 6,76 na 13,71 (nárůst o 102,8 %). Počet nalezených lymfatických uzlin tedy po zavedení protokolu dosahuje doporučovaných hodnot v publikovaných studiích a doporučených postupech.
Je dlouhodobě známo, že se zvyšujícím se věkem pacientů dochází k redukci lymfatické tkáně, ať na podkladě regresivních změn a jizvení, nebo prostou atrofií lymforetikulární tkáně. Z anatomického pohledu dochází také ke zmenšení lymfatických uzlin a jejich horšímu vyhledávání. Často dochází k záměně lymfatické uzliny za zjizvenou tkáň či stěnu cévy. Zavedením protokolárního zpracovávání resekátů rekta lze zajistit lepší uzlinovou výtěžnost i u vyšších věkových kategorií pacientů a dosáhnout počtů uzlin doporučovaných v literatuře ve všech věkových kategoriích. Tato skutečnost je ještě patrnější při izolovaném pohledu na resekáty rekta u pacientů, kteří podstoupili předoperační neoadjuvantní terapii.
Vzhledem k anatomickým poměrům v oblasti malé pánve muže a ženy lze předpokládat rozdíly v chirurgickém přístupu při resekci rekta. Částečně limitovaná či nedostatečná resekce mezorekta a tím potenciální nález nižšího počtu lymfatických uzlin hrozí v mužské pánvi, která je užší a prostorově omezená. Naproti tomu u žen existuje riziko horší orientace v operačním poli, zejména po předchozích výkonech v oblasti malé pánve a vnitřního genitálu. Výtěžnost lymfatických uzlin v závislosti na pohlaví, stejně jako samotná kvalita mezorektální excize, je tedy do jisté míry vázaná a ovlivnitelná zkušeností a zručností operatéra. Navzdory uvedeným aspektům jsme v našem souboru výraznější rozdíly v počtu nalezených lymfatických uzlin u mužů a žen nezaznamenali.
S vyšším počtem nalezených lymfatických uzlin dochází k lehkému nárůstu počtu pacientů s uzlinovým metastatickým postižením a tím k možnosti nadhodnocení stadia onemocnění. Tento fenomén jsme v naší studii nejvíce pozorovali u kategorie pacientů, kteří podstoupili resekci rekta po předchozí neoadjuvantní terapii (nárůst téměř o 4,5 %).
Uvedené výsledky ukazují, že důraz na pečlivé a kvalitní zpracování resekátů rekta s karcinomem má vliv na počet a kvalitu nalezených lymfatických uzlin. Výsledky v korelaci s publikovanými texty podporují zavádění přesně definovaných protokolů a stanovení podmínek pro zpracování a interpretaci nálezů u pacientů po resekci rekta pro adenokarcinom. Velmi důležitá je mezioborová spolupráce chirurga, onkologa, radiologa a patologa. Z chirurgického hlediska je podstatné, aby byl operatér dostatečně zkušený, zručný a schopný respektovat vypracovanou techniku resekce rekta. Ta je často limitována anatomickými vztahy a změnami, vyplývajícími z předchozí léčby. Na tomto místě lze zmínit možnosti zkvalitnění resekce využitím laparoskopické či robotické chirurgie u indikovaných pacientů. Důležitým momentem je správná manipulace s resekátem včetně jeho náležitého uchování a transportu na pracoviště patologie, společně s řádně vyplněnou průvodní zprávou. Patolog musí získat zkušenost založenou na opakovaném vyšetřování resekátů a vedoucí k jednoznačné interpretaci nálezu v souladu s nastaveným protokolem a také s platnými „lege artis“ postupy. Proto i na našich pracovištích jsou pro popsané procedury vyčleněni řádně proškolení pracovníci.
Závěr
Jednoznačná hranice minimálního počtu nalezených a vyšetřených lymfatických uzlin není oficiálně stanovena. Na základě konsenzu expertů z oblasti gastroenterologie, chirurgie, onkologie a jednotlivých národních odborných společností jsou stanovena doporučení a požadavky. Jako limitní hranice se jeví minimální počet 12 lymfatických uzlin, který by měl být dosažen při vyšetřování resekátu. Tyto limity je někdy obtížné splnit, zejména u pacientů po podání neoadjuvantní terapie, případně u vyšších věkových skupin pacientů.
Důležitým faktorem pro zlepšení získaných výsledků je multidisciplinární spolupráce při péči o pacienty zejména s karcinomem rekta a zavedení definovaných protokolů léčby, operativy a vyšetřování resekátů. Jedná se o náročnou proceduru s vyčleněním jednotlivých pracovníků, nicméně naše srovnání ukazuje, že zavedení tohoto systému má smysl, je funkční a vyplatí se zejména z pohledu na indikaci léčby a na zlepšení kvality života pacientů.
Podpořeno projektem Ministerstva zdravotnictví koncepčního rozvoje výzkumné organizace 00064203 FN MOTOL.
Supported by Ministry of Health, Czech Republic – conceptual development of research organization, Motol University Hospital, Prague, Czech Republic 00064203.
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise.
MUDr. Marek Grega
Ústav patologie a molekulární medicíny
2. LF UK a FN Motol
e-mail: marek.grega@fnmotol.cz
Sources
- Goldstein NS, Sanford W, Coffey M, et al. Lymph node recovery from colorectal resection specimens removed for adenocarcinoma. Am J Clin Pathol. 1996;106 : 209−16.
- Modrá kniha České onkologické společnosti, 23. aktualizace, Masarykův onkologický ústav 2017 : 25−35.
- McDonald JR, Renehan AG, O´Dwyer ST, et al. Lymph node harvest in colon and rectal cancer: Current considerations. World J Gastrointest Surg. 2012;27 : 9−19. doi: 10.4240/wjgs.v4.i1.9.
- Nelson H, Petrelli N, Carlin A, Couture J, et al. Guidelines 2000 for colon and rectal cancer surgery. J Natl Cancer Inst. 2001;18;93 : 583−96.
- Chang GJ, Rodriguez-Bigas MA, Skibber JM, et al. Lymph node evaluation and survival after curative resection of colon cancer: Systematic review. J Natl Cancer Inst. 2007;99 : 433−41. doi: 10.1093/jnci/djk092
- Choi HK, Law WL, Poon JTC. The optimal number of lymph nodes examined in stage II colorectal cancer and its Impact of on outcomes. BMC Cancer 2010;10 : 267. doi: 10.1186/1471-2407-10-267.
- Swanson RS, Compton CC, Stewart AK, et al. The prognosis of T3N0 colon cancer is dependent on the number of lymph nodes examined. Ann Surg Oncol. 2003;10 : 65−71.
- Pheby DFH, Levine DF, Pitcher RW, et al. Node harvests directly influence the staging of colorectal cancer: Evidence from a regional audit. J Clin Pathol. 2004;57 : 43−7.
- Ng IOL, Luk ISC, Yuen ST, et al. Surgical lateral clarence in resected rectal carcinomas. A multivariate analysis of clinicopathologic features. Cancer 1993;71 : 1972−6.
- Tepper JE, O´Connell MJ, Niedzwiecki D, et al. Impact of number of nodes retrieved on outcome in patients with rectal cancer. J Clin Oncol. 2001;19 : 157−63. doi: 10.1200/JCO.2001.19.1.157.
- Garcia-Granero E, Faiz O, Munoz E, et al. Macroscopic assessment of mesorectal excision in rectal cancer: A useful tool for improving quality control in a multidisciplinary team. Cancer 2009;115 : 3400−11. doi: 10.1002/cncr.24387.
- Loughrey MB, Quirke P, Shepherd NA. Standards and datasets for reporting cancers: Dataset for colorectal cancer histopathology reports. Royal Collage of Pathologists 2014.
- Washington MK, Berlin J, Branton P, et al. Protocol for the examinations of specimens from patients with primary carcinoma of the colon and rectum. Arch Pathol Lab Med. 2009;133 : 1539−51.
- Hoch J, Ferko A, Blaha M, et al. Parametrické sledování kvality mezorektální excize a chirurgické léčby karcinomu rekta – výsledky multicentrické studie. Rozhl Chir. 2016;95 : 262−71.
- Hovorková E, Hadži-Nikolov D, Ferko A, et al. Problematika stanovení bezpečných resekčních okrajů u karcinomu rekta. Rozhl Chir. 2014;93 : 92−9.
- Dias AR, Pereira MA, Mello ES, et al. Carnoy´s solution increases the number of examined lymph nodes following gastrectomy for adenocarcinoma: A randomized trial. Gastric Cancer 2016;19 : 136−42. doi: 10.1007/s10120-014-0443-2.
- Bembenek AE, Rosenberg R, Wagler E, et al. Sentinel lymph node biopsy in colon cancer. A prospective multicenter study. Ann Surg. 2007;245 : 858−63. doi: 10.1097/01.sla.0000250428.46656.7e.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2019 Issue 5-
All articles in this issue
- Klinické doporučené postupy – zbytečné obavy
- Profesor Rudolf Tomáš Jedlička – 150. výročí narození
- Vzácné příčiny akutní apendicitidy
- Zhodnocení a zajištění pacientů s termickým úrazem na chirurgickém pracovišti
- Detekce lymfatických uzlin a kvalita mezorektální excize
- Akutní hiátové hernie
- Alternativní metoda chirurgické léčby refrakterního GERD po laparoskopické sleeve gastrektomii
- Absces pečene ako zriedkavá komplikácia PEG
- Prekvapivý nález ablačného katétra pri revízii hrudníka pre “spontánny” hemotorax − kazuistika
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Akutní hiátové hernie
- Alternativní metoda chirurgické léčby refrakterního GERD po laparoskopické sleeve gastrektomii
- Vzácné příčiny akutní apendicitidy
- Zhodnocení a zajištění pacientů s termickým úrazem na chirurgickém pracovišti
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

