-
Medical journals
- Career
Vzácné příčiny akutní apendicitidy
: I. Říha 1; V. Třeška 1; J. Nosek 1; D. Šmíd 2; R. Slunečko 3
: Chirurgická klinika Fakultní nemocnice Plzeň a Lékařská fakulta Univerzity Karlovy v Plzni 1; Anesteziologicko-resuscitační oddělení Fakultní nemocnice Plzeň 2; Šiklův ústav patologie, Univerzita Karlova v Plzni 3
: Rozhl. Chir., 2019, roč. 98, č. 5, s. 189-193.
: Review
Úvod: Klinická diagnóza akutní apendicitidy nemusí vždy znamenat po histopatologickém rozboru pouze nález zánětlivých změn. Nádory apendixu, i když jsou velmi vzácné a tvoří méně než 4 % všech nádorů zažívacího traktu, představují závažná onemocnění vyžadující správnou volbu následné onkochirurgické léčby.
Metody: Od 1. 1. 2008 do 1. 10. 2018 bylo provedeno na Chirurgické klinice v Plzni celkem 1036 apendektomií. Patologických nálezů nádorů apendixu bylo 38 (3,7 %). Autoři prezentují obtížnou primární diagnostiku, současnou léčbu a zásady dispenzární péče u této poměrně vzácné skupiny nemocných.
Závěr: Nádory apendixu jsou vzácná onemocnění. Podle typu nádoru je třeba volit adekvátní onkochirurgickou léčbu a zajistit správnou dispenzární péči.
Klíčová slova:
diagnostika – nádory apendixu – dispenzární péče
ÚVOD
Akutní apendicitida je nejčastější náhlá příhoda břišní, která je ve většině případech stanovena na základě klinického vyšetření, které je podpořeno laboratorním nálezem. Klinická diagnóza akutní apendicitidy zdaleka nemusí vždy znamenat po histopatologickém rozboru pouze nález zánětlivých změn. I když je nález nádorů apendixu velmi vzácný, je třeba na ně pomýšlet a včasně rozhodnout o dalším postupu, zejména v průběhu operace, pokud máme podezření na přítomnost nádoru v apendixu.
METODY
Na chirurgické klinice Fakultní nemocnice Plzeň jsme v období od 1. 1. 2008 do 1. 10. 2018 provedli 1036 apendektomií. Z celkového počtu jsme zaznamenali 998 případů akutní či chronické apendicitidy (96,3 %) a 38 různých nálezů na apendixu (3,7 %), od zcela benigních lézí až po maligní nádory. Téměř ve všech případech byly přítomny klinické i laboratorní známky probíhající akutní apendicitidy, pro kterou byli nemocní indikováni k operaci. V jednom případě klinické známky imitovaly pravostrannou adnexitidu, pro kterou byla nemocná indikována k operačnímu řešení. V druhém případě šlo o náhodný nález na apendixu při triplicitě tumoru rektosigmatu, který se projevil poruchami pasáže. Jen v jednom případě bylo provedeno sonografické vyšetření a ve čtyřech případech jsme provedli CT vyšetření. Na podkladě provedených zobrazovacích metod bylo pouze v jednom případě předoperační podezření na tumor apendixu. V souboru bylo 24 mužů (63,2 %) a 14 žen (36,8 %) s mediánem věku 52,8 (12−85 let). Klinické příznaky akutní apendicitidy v uvedeném souboru byly dle výsledků histopatologického vyšetření způsobeny mucinózní neoplazií (50,0 %), neuroendokrinním tumorem (47,4 %) a gastrointestinálním stromálním tumorem (2,6 %).
Z mucinózních neoplazií jsme u jednoho pacienta diagnostikovali hyperplastický polyp (2,6 % z celkového počtu), v jednom případě apendikální mukokélu (2,6 % z celkového počtu) a taktéž v jednom případě pilovitý (serrated) adenom (2,6 % z celkového počtu). V osmi případech (21,1 % z celkového počtu) se jednalo o benigní mucinózní cystadenom a u osmi pacientů byl histologicky verifikovaný adenokarcinom apendixu (21,1 % z celkového počtu). U benigních nálezů jsme provedli devět apendektomií a pro pokročilost zánětu s infiltrací okolních tkání byla provedena jedna ileocekální resekce. Pro peroperační známky pokročilého zánětlivého postižení apendixu a terminálního ilea s hmatnou tumorózní infiltrací vzestupného tračníku jsme provedli v jednom případě pravostrannou hemikolektomii. V případě adenokarcinomů byly v první době provedeny čtyři apendektomie a dvě ileocekální resekce, z toho jedna spolu s hysterektomií a bilaterální adnexektomií pro suspektní tumor vycházející z adnex infiltrující apendix. Dále byla provedena pravostranná hemikolektomie pro perioperační nález tumorózní infiltrace céka a jedna plánovaná subtotální kolektomie pro triplicitu nádoru apendixu, céka a rektosigmatu. Ve všech čtyřech případech provedených apendektomií byla po obdržení histopatologické diagnózy v druhé době provedena pravostranná hemikolektomie. U jednoho nemocného, který byl operován 36 dní po klasické apendektomii, byla nalezena generalizace základního onemocnění po peritoneu, proto byl indikován k provedení hypertermické intraperitoneální cytoredukce (HIPEC), která byla vykonána v jiném zdravotnickém zařízení. Průměrný počet dnů k provedení sekundární operace po diagnostice maligního nádoru apendixu byl 24,2 dne (7−36). Délka doby od primární operace k realizaci následného chirurgického výkonu byla závislá na délce stanovení histopatologického vyšetření a provedení následného onkologického vyšetření. Na podkladě těchto vyšetření byla chirurgem indikována následná operace, která byla uskutečněna v nejbližším možném termínu. Neoadjuvantní terapie nebyla v žádném z prezentovaných případů indikována. Pouze u výše zmíněného případu provedené ileocekální resekce s hysterektomií a adnexektomií nebyl indikován operační zákrok v druhé době z důvodu generalizace onemocnění. Tato nemocná podstoupila paliativní chemoterapii a po 837 dnech od primární operace byla provedena explorativní laparotomie se založením axiální sigmoideostomie pro poruchy pasáže způsobené generalizací onemocnění. U všech pacientů s mucinózním cystadenomem byla onkologem doporučena dispenzarizace v koloproktologické poradně s ročním intervalem kontrol (kolonoskopie, CT vyšetření, markery). V případě adenokarcinomů byla ve čtyřech případech (50,0 %) podána chemoterapeutická léčba (v režimu FOLFOX a FUFA) a všichni nemocní jsou pravidelně dispenzarizováni. V souboru pacientů jsme zaznamenali od stanovení diagnózy k dnešnímu dni celkové přežití 75,0 %. Medián sledování je 71,2 měsíce (6−120). Jeden pacient byl indikován k HIPEC (viz výše), nadále v onkologické péči, ostatní pacienti jsou zcela bez známek recidivy onemocnění. Dva pacienti (25,0 %) zemřeli do 3 let od prvních příznaků onemocnění, z toho jeden pacient byl již v době stanovení diagnózy v pokročilém stadiu nemoci.
Průkaz neuroendokrinních tumorů (NET) v červovitém přívěsku v námi sledovaném souboru pacientů nebyl ojedinělý. U celkem osmnácti pacientů (47,4 %) byl diagnostikován neuroendokrinní tumor apendixu. V první době bylo provedeno šestnáct apendektomií a dvě ileocekální resekce pro stenózu terminálního ilea. V druhé době vzhledem k velikosti tumoru >2 cm byli tři nemocní indikováni k pravostranné hemikolektomii a jeden k ileocekální resekci. Průměrná doba od primární operace k následnému výkonu byla 95,6 dne (43−148). Délka doby od primární operace k následnému výkonu byla nejvíce ovlivněna dostupností PET/CT vyšetření. PET/CT, octreoscan a další markery jsou nezbytné pro stanovení stagingu onemocnění. Sekundární výkon byl pak indikován multidisciplinárním týmem. Neoadjuvantní terapie nebyla indikována u žádného z nemocných. U jedné pacientky byl sekundární výkon pravostranné hemikolektomie uskutečněn za 148 dnů, na základě opakovaného „restagingu“ onemocnění pomocí PET/CT, octreoscanu a nádorových markerů. Diagnózu neuroendokrinní tumor (NET) stanovil ve všech případech patolog z preparátu. Onkolog následně indikoval u šesti pacientů se zvýšenou expresí somatostatinových receptorů celotělovou scintigrafii, u všech pacientů pak doporučil pravidelnou dispenzarizaci s odběrem nádorových markerů a koloskopickým a CT vyšetřením. Naprostá většina neuroendokrinních tumorů byla pozitivní na synaptofyzin a chromogranin. Několik málo dalších tumorů ještě pak na neuron specifické enolázy, cytokeratiny A 1−3, D2−40, CD 31, 34, 56, serotonin a speciální zobrazení PAS (kyselina jodistá + Schiffovo reagens). Pouze ve dvou případech byla proliferační aktivita buněk (MIB) pod 2 %, ostatní pod 1 % a počet mitóz byl menší než 2/10 mitóz zorných polí velkého zvětšení (HPF). Všichni pacienti v našem souboru jsou pravidelně dispenzarizováni bez známek recidivy onemocnění. Medián sledování je 74,1 měsíce (7−130).
Vzácným nálezem byl gastrointestinální stromální tumor apendixu u jedné nemocné (2,6 %) indikované na základě klinických příznaků k apendektomii s peroperačním makroskopickým nálezem flegmóny. Následné histologické a imunohistochemické vyšetření odhalilo v centrální části apendixu vřetenobuněčné ložisko velikosti 3,1x1,3 mm (Obr. 1). V celém ložisku nebyla zastižena ani jedna mitóza a reakce s protilátkami CD117 a DOG1 byly pozitivní (Obr. 2). Molekulárně-genetické vyšetření neprokázalo mutaci genu c-kit ani PDGFRA (Platelet Derived Growth Factor Receptor). Šestý pooperační den byla pacientka propuštěna do domácí péče s doporučením onkologického vyšetření, ke kterému se však již nedostavila. Následná péče by v tomto případě znamenala pravidelnou dispenzarizaci.
1. GIST v hematoxylin-eosinu je přehledné a detailní zvětšení ohraničené léze s charakteristickým storiformním uspořádáním a blandními buňkami
Fig. 1. GIST in hematoxylin-eosin: a clear and detailed enlargement of lesion with a characteristic storiform pattern and bland cells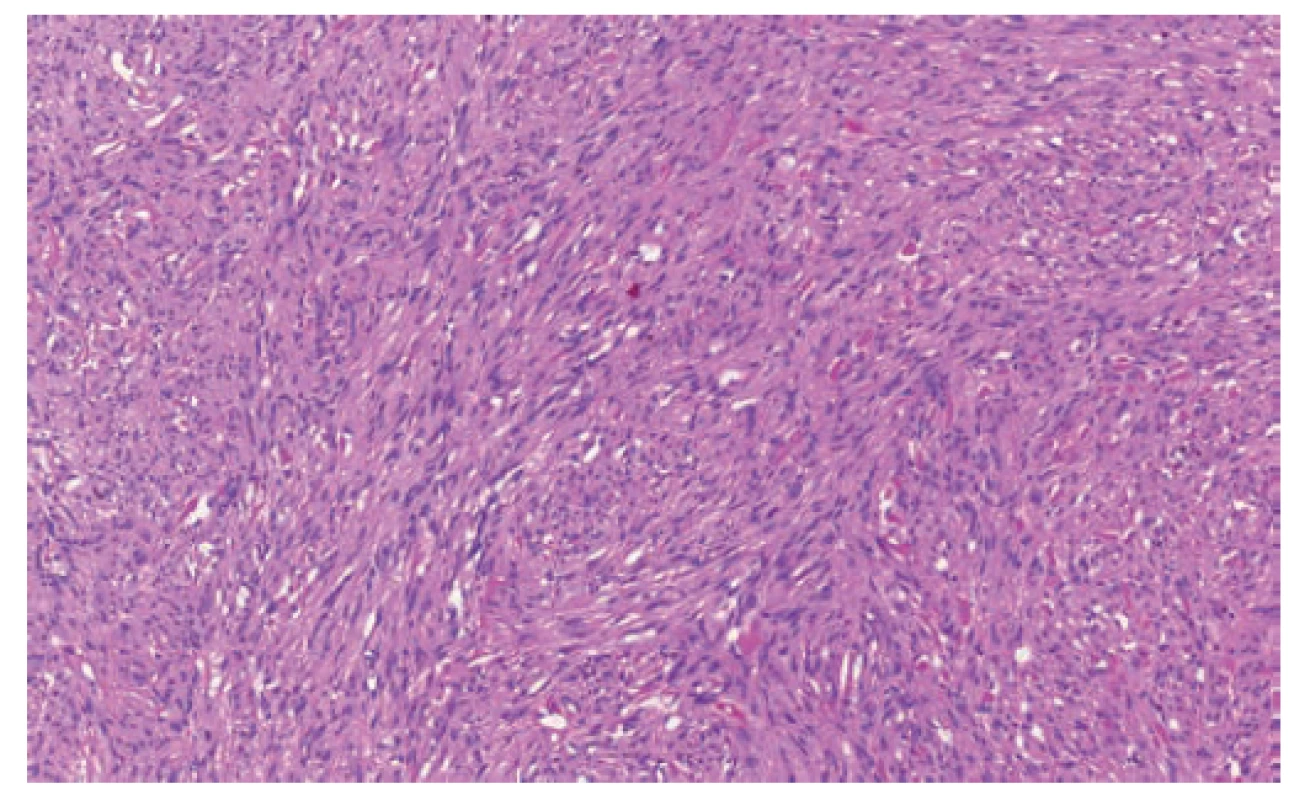
2. GIST pozitivně silně reaguje s protilátkou CD117
Fig. 2. GIST reacts positively with CD117 antibodies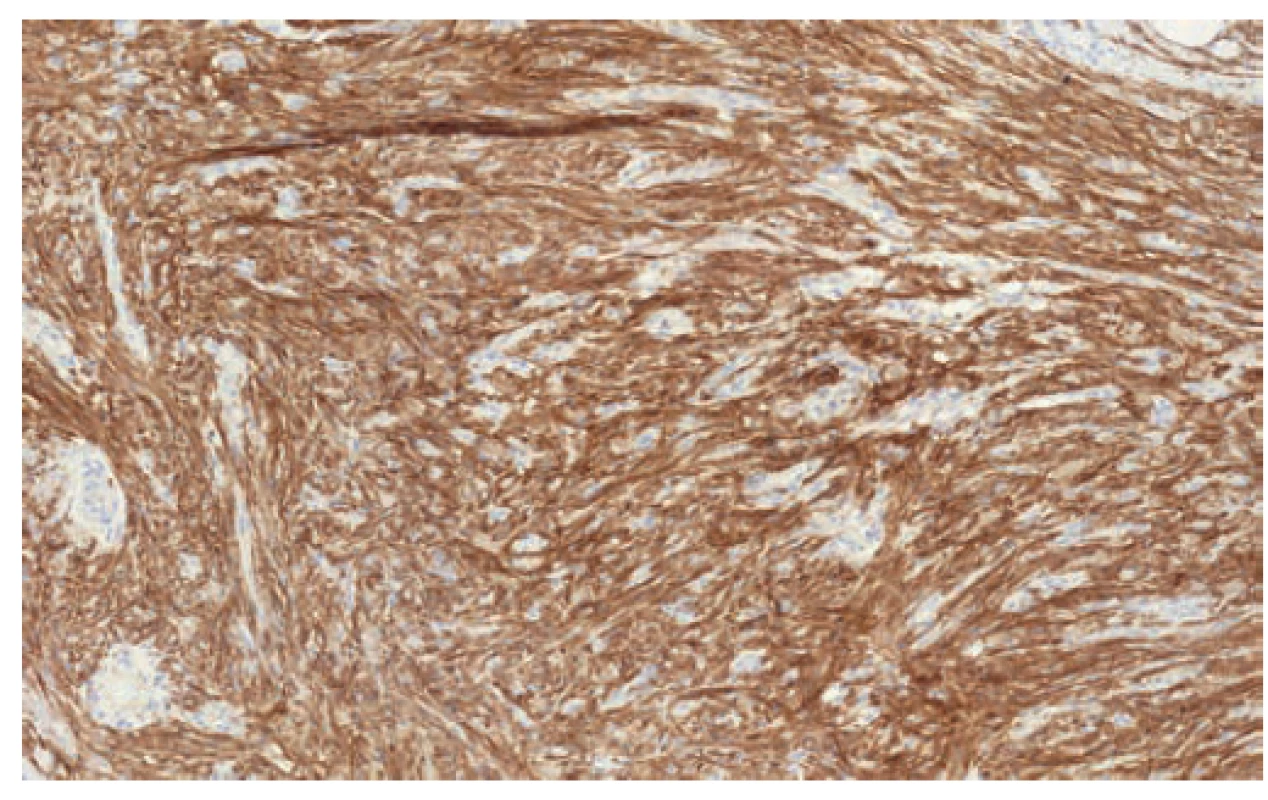
Pětileté přežití pacientů s nádory apendixu v námi sledovaném souboru bylo 92,3 %. Medián sledování v našem souboru činí 68,1 měsíce (4−130). Pouze u jednoho pacienta nedošlo k regresi onemocnění (2,6 %) a je nadále v onkochirurgické péči. Dva pacienti na následky generalizace adenokarcinomu apendixu zemřeli (5,3 %). Ostatní pacienti jsou k dnešnímu dni v remisi onemocnění.
DISKUZE
Nádory apendixu jsou velmi vzácné a v naprosté většině je diagnóza stanovena pooperačně na podkladě histologického vyšetření preparátu apendixu. Dle literárních údajů se udává výskyt 0,1 případu na 100 000 tisíc obyvatel za rok se vzrůstající tendencí [1]. Histopatologická diagnostika je ve strategii chirurgické léčby těchto apendikálních lézí zcela zásadní a určuje rozsah a povahu následné léčby, zejména rozsah sekundárního výkonu. Léčba závisí především na typu nádoru, gradingu a stagingu onemocnění a celkovém stavu pacienta. Prvotní projevy onemocnění velmi často imitují příznaky akutní apendicitidy a v mnoha případech je také přítomna koincidence zánětu. Neexistují zatím žádné známé rizikové faktory pro vznik nádorů v této lokalizaci. K hlavním typům nádorů apendixu patří mucinózní neoplazie, které v našem souboru představují 50,0 % všech nezánětlivých afekcí. Incidence neuroendokrinních nádorů apendixu se uvádí 2−3/100 000 obyvatel za rok (47,4 % v našem souboru) a raritně gastrointestinální stromální tumory (2,6 % našeho souboru). Skutečná incidence v celkovém souboru námi operovaných pro akutní apendicitidu je následující: akutní apendicitida 95,9 %, mucinózní neoplazie 1,8 %, neuroendokrinní tumor 1,7 %, gastrointestinální stromální tumor 0,09 %. Mucinózní neoplazie klasifikujeme od zcela benigních lézí, jako jsou mucinózní adenomy, mukokély či hyperplastické polypy, přes hraniční léze, tzv. low grade neoplazie (mucinózní cystadenom), až po maligní adenokarcinomy. Dle literárních zdrojů je incidence karcinomu apendixu méně než 0,08 % a tvoří méně než 4 % všech nádorů gastrointestinálního traktu a 38 % všech nádorů v apendixu, avšak v našem souboru byl výskyt adenokarcinomu jen 21,1 % (8 případů z 38), v celkovém souboru představují karcinomy apendixu 0,77 % (8 případů z 1036) [2,3]. Klinické projevy korelují se symptomy akutní apendicitidy. Typ následné léčby po apendektomii (pokud není nádor apendixu primárně rozpoznán) závisí na perioperačním nálezu, histopatologickém vyšetření, TNM klasifikaci a celkovém stavu pacienta. Radikalita chirurgické léčby se odvíjí od agresivity tumoru (Schéma 1). Pravostranná hemikolektomie je vyhrazena pro maligní nádory přesahující velikost 2 cm, u nádorů menšího průměru lze zvolit ileocekální resekci s dostatečnou lymfadenektomií, nicméně volba tohoto typu výkonu závisí na histopatologickém gradingu a z vlastních zkušeností doporučujeme volit spíše radikálnější výkon typu pravostranné hemikolektomie. U peritoneální diseminace je nutno zvážit v multioborovém onkotýmu hypertermickou intraperitoneální cytoredukci (HIPEC). Nezbytnou podmínkou u malignit této lokalizace je provedení kompletního stagingu onemocnění zahrnující CT vyšetření hrudníku, břicha a pánve. Pro pacienty s rozsahem onemocnění pT2-T3 je doporučena adjuvantní chemoterapie (5-fluorouracil/leucovorin nebo capecitabin, oxaliplatina). V případě perforace apendixu s nálezem mucinózní neoplazie jsou pravidelné kontroly zahrnující CT vyšetření každých šest měsíců s odběrem nádorových markerů (CEA, CA 19-9) po dobu nejméně pěti let vyžadovány spolu s ročními endoskopickými kontrolami [4].
Schéma 1: Strategie léčby adenokarcinomu apendixu
Schema 1: Algorithm for the management of appendiceal adenocarcinoma
Vysvětlivka:* Doporučeno u žen po menopauze Následující heterogenní skupinou nádorů jsou neuroendokrinní tumory (NET). Stanovit diagnózu NET v oblasti apendixu předoperačně bývá zpravidla nemožné, neboť symptomy neuroendokrinní jsou velmi vzácné. Stejně jako ostatní nádory často při projevech onemocnění imitují akutní apendicitidu. Retrospektivně v našem souboru pacientů můžeme dohledat jen několik málo případů, kdy měl konkrétní pacient opakované bolesti břicha bez jasné příčiny a s brzkým ústupem obtíží při konzervativním postupu. V histopatologické diagnostice je zásadní imunohistochemické vyšetření s detekcí synaptofyzinu, chromograninu, případně serotoninu, cytokeratinů, neuronu specifických enoláz a dalších [5]. Dalším velmi podstatným ukazatelem agresivity tumoru je stanovení proliferačního indexu neboli počtu buněk v buněčném cyklu v oblastech nejvyšší aktivity vyjádřeného v procentuálním zastoupení Ki-67, ev. MIB1. Druhým nápomocným ukazatelem je mitotický index stanovený na 10 HPF (high power field). Díky těmto specifickým parametrům tak můžeme NET klasifikovat do dvou, respektive tří skupin. G1 charakterizuje tumory dobře diferencované, s mitotickým indexem <2/10 HPF a proliferační aktivitou <2 %. Pro G2 dobře diferencované nádory je hranice mitotického indexu 2-20/10 HPF a Ki-67 3−20 %. Špatně diferencované G3 NET vykazují >20/10 HPF s Ki-67 >20 % a můžeme je v literatuře též najít pod označením karcinom či malobuněčný, velkobuněčný NET. Z hlediska následné onkologické dispenzární péče je oblíbenou metodou somatostatinová scintigrafie neboli octreoscan, či vyšetření PET/CT a odběr nádorových markerů v pravidelných intervalech. Pro radikalitu chirurgického výkonu jsou výše uvedená kritéria stejně důležitá. Neuroendokrinní tumory apendixu naštěstí ne vždy dosahují požadované velikosti pro rozšířené operační výkony. U nádorů >2 cm je pravostranná hemikolektomie s lymfadenektomií indikována [6]. Chirurgické odstranění nádorů v první době formou apendektomie u G1 a G2 je zatím bezpochyby dostačující bez nutnosti adjuvantní chemoterapie. Pro nádory G3 existuje celá paleta následné onkologické terapie zahrnující somatostatinová analoga, radioterapeutickou, biologickou, cytotoxickou a cílenou molekulární léčbu [7]. V případě metastatického postižení závisí případná chirurgická a onkologická léčba na rozhodnutí multidisciplinárního týmu.
Gastrointestinální stromální tumory (GIST) jsou vzácným nálezem v oblasti apendixu. Ve světovém písemnictví bylo dosud zaznamenáno pouze šestnáct případů, v našem souboru jsme zaznamenali jeden případ z 38 (2,6 %), v celkovém souboru představuje GIST 0,09 % případů. Jedná se o skupinu tumorů tvořenou mezenchymální tkání nacházející se v zažívacím traktu, mezenteriu a omentu. V naprosté většině případů jsou GIST lokalizovány v žaludku (60 %) a tenkém střevě (30 %), v menším zastoupení pak v jícnu a rektu (<10 %), v apendixu v méně než 0,1 % případů. Klinická diagnóza ve většině případů opět alternuje příznaky zánětlivého postižení červu. V některých případech byla popisována hematochezie, které předcházela difuzní bolest břicha [8]. U pacientů často chybějí zvýšené zánětlivé parametry v laboratorním vyšetření. Histopatologicky a imunohistochemicky je třeba diferenciálně diagnosticky odlišit zejména leiomyom, leiomyosarkom nebo neurofibrom. K detekci slouží především exprese KIT (CD117) a typický DOG1 (discovered on GIST), v mikroskopickém obraze pak ve většině případech dominuje nález nízkého až nulového počtu mitóz [9]. Chirurgická intervence formou apendektomie je považována za dostačující výkon. Pouze v případě vyššího mitotického indexu je ke zvážení adjuvantní terapie imatinibem v režii onkologa [10,11].
ZÁVĚR
Akutní apendicitida je nejčastější náhlá příhoda břišní, která postihuje především mladší nemocné a příznaky onemocnění zpravidla přicházejí z plného zdraví. Peroperační nález je v naprosté většině případů jasný, chirurg popisuje zánět červovitého přívěsku slepého střeva. Jen u několika případů diagnostikujeme pomocí histopatologického nálezu nádory apendixu. Dle typu nádoru je pak indikována následná léčba s dispenzární péčí těchto nemocných.
Práce vznikla s podporou Výzkumného záměru Progres, UK v Praze.
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise.
MUDr. Ivan Říha
Chirurgická klinika FN Plzeň
Alej svobody 80
Plzeň 32300
e-mail: rihai@fnplzen.cz
Sources
- Marmor S, Portschy PR, Tuttle TM, et al. The rise in appendiceal cancer incidence: 2000−2009. J Gastrointest Surg. 2015;19 : 743−50. doi: 10.1007/s11605-014-2726-7
- Ruoff C, Hanna L, Zhi W, et al. Cancers of the appendix: Review of the literatures. ISRN Oncol. 2011;on-line. doi: 10.5402/2011/728579.
- Grubbs EG, Tyler DS. Tumors of the appendix. In: Holland-frei cancer medicine. 6th edition. Editors Kufe DW, Pollock RE, Weichsealbum RR, et al., Hamilton (ON), BC Decker 2003.
- Kelly KJ. Management of appendix cancer. Clin Colon Surg. 2015;28 : 247−55. doi: 10.1055/s-0035-1564433.
- Stinner B, Rothmund M. Neuroendocrine tumours (carcinoids) of the appendix. Best Pract Clin Gastroenterol. 2005;19 : 729−38. doi: 10.1016/j.bpg.2005.06.003.
- Chung TP, Hunt RS. Carcinoid and neuroendocrine tumors of the colon and rectum. Clin Colon Rectal Surg. 2006;19 : 45−8. doi: 10.1055/s-2006-942343.
- Anastasiadis K, Kepertis Ch. Lampropoulos V. carcinoid tumors of the appendix – last decade experience. J Clin Diagn Res. 2014;8:NC01−NC02. doi: 10.7860/JCDR/2014/10694.5151.
- Chun JM, Lim KH. Gastrointestinal stromal tumor of the vermiform appendix mimicking Meckel’s diverticulum: Case report with literature review. Int J Surg Case Rep. 2016;21 : 20−2.
- Lasota J., Miettinen M. KIT and PDGFRA mutations on gastrointestinal stromal tumors (GISTs). Semin Diagn Pathol. 2006;23 : 91−102.
- Miettinen M, Sobin LH. Gastrointestinal stromal tumors in the appendix: a clinicopathologic and immunohistochemical study of four cases. Am J Surg Pathol. 2001;25 : 1433−7.
- Balachandran RP, DeMatteo VP. GIST tumors: Who should get imatinib and for how long? Adv Surg. 2014;48 : 165−83. doi: 10.1016/j.yasu.2014.05.014.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2019 Issue 5-
All articles in this issue
- Klinické doporučené postupy – zbytečné obavy
- Profesor Rudolf Tomáš Jedlička – 150. výročí narození
- Rare causes of acute appendicitis
- Early surgical management in patients with burns
- Lymph nodes detection and the mesorectal excision quality evaluation
- Acute hiatal hernias
- An alternative method of surgical treatment in refractory GERD following laparoscopic sleeve gastrectomy
- Liver abscess as a rare complication of PEG
- Unexpected finding of an ablation catheter during thoracoscopic exploration for a spontaneous hemothorax – case report
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Acute hiatal hernias
- An alternative method of surgical treatment in refractory GERD following laparoscopic sleeve gastrectomy
- Rare causes of acute appendicitis
- Early surgical management in patients with burns
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

