-
Medical journals
- Career
Jednoduchá technika perkutánního podvazu akcesorních žil hemodialyzačních zkratů
Authors: M. Šercl 1; V. Machačka 1; P. Kočí 2; V. Mellanová 1; L. Endrych 1
Authors‘ workplace: RDG oddělení, Krajská nemocnice Liberec, a. s., primář: MUDr. L. Endrych 1; Oddělení hemodialýzy, Krajská nemocnice Liberec, a. s., primář: MUDr. M. Ryba 2
Published in: Rozhl. Chir., 2017, roč. 96, č. 7, s. 296-301.
Category: Original articles
Overview
Úvod:
Špatně maturující hemodialyzační zkrat je často řešeným problémem na pracovištích hemodialýzy. Etiologie bývá různorodá, nedostatečné žilní řečiště, stenóza v anastomóze či na odvodné žíle a v neposlední řadě též přítomnost kolaterálních žil. V současné době běžnými přístupy k redukci žilních kolaterál jsou chirurgické podvazy nebo endovaskulární embolizace, jsou však časově, organizačně i finančně náročné. Alternativou jsou různé typy perkutánních podvazů. Přinášíme popis výkonu jednoduchého perkutánního podvazu akcesorních žil za asistence zobrazovacích metod a analýzu souboru našich pacientů.Metoda:
Retrospektivní analýza prospektivně nabíraných pacientů s nerozvíjejícím se dialyzačním zkratem. Jako kritérium úspěchu bylo stanoveno provedení úspěšné hemodialýzy do 4 týdnů od výkonu.Výsledky:
V průběhu 2 let (březen 2015 – leden 2017) jsme u 7 pacientů provedli 11 podvazů kolaterálních žil, u všech došlo k maturaci zkratu pro potřebu provedení kvalitní hemodialýzy do 2, resp. 3 týdnů.Závěr:
Nová technika je rychlá, levná, s dobrým klinickým i kosmetickým efektem.Klíčová slova:
hemodialyzační zkrat – kolaterální žíly – perkutánní podvazÚVOD
Adekvátní cévní přístup je nezbytnou podmínkou kvalitní hemodialyzační léčby u pacientů s chronickým renálním selháním. Používanými přístupy jsou nativní cévní zkrat, zkrat pomocí umělé cévní protézy a dialyzační katétry. Nativní arteriovenózní zkrat (AVF) je preferovaným hemodialyzačním přístupem zejména pro nízké riziko infekčních komplikací a dobrou životnost [1,2]. Umělé cévní protézy – grafty – jsou zatíženy kratší životností pro vysoké procento okluzí i vyšším výskytem infekčních komplikací [3–6]. Centrální žilní katétry bývají spojené s častým výskytem infekčních komplikací a jsou asociovány se zvýšenou mortalitou chronicky dialyzovaných pacientů [7].
Po vyšití AVF až ve 25–40 % [8–10] dochází k nedostatečnému rozvoji pro potřeby účinné hemodialýzy. Záchrana nematurujícího zkratu je často zásadní pro další osud pacienta.
Spektrum příčin nedostatečného rozvoje zkratu bývá různorodé [2,11], nicméně přítomnost velkého množství žilních kolaterál odvádějících část krevního toku a snižující tak šanci na dostatečnou hypertrofii hlavní odvodné žíly bývá možnou příčinou nedostatečného vyzrání AVF [9,12]. Uzávěrem těchto akcesorních žil můžeme dosáhnout významného navýšení průtoku zkratem, který podpoří jeho maturaci. Optimálně se snažíme dosáhnout průtoku kolem 500 ml/min. [13,14]. Běžně používané metody chirurgického podvazu nebo endovaskulární embolizace jsou časově, organizačně a finančně náročné.
V roce 2002 byla Faiyazem publikována metoda perkutánního podvazu akcesorních žil [9], kdy se přes kůži nakládaly a zevně zauzlily 2 stehy z nevstřebatelného materiálu. Nevýhodou byly diskomfort pacienta, kožní nekróza v místě stehu a časné rekanalizace. V říjnu 2015 kolektiv lékařů kolem Iraniho (Boston, Massachusetts) publikoval metodu perkutánního podvazu za pomoci ultrazvukové navigace, tzv. Iraniho metodu [15]. Spočívá v „in plane“ sonograficky navigovaném zavedení Hawkins-Akins jehly (Cook) pod a nad akcesorní žilní spojkou ze dvou drobných kožních incizí, provléknutím monofilamentního vlákna a zanořením stehu s uzly do podkoží. Tato metoda vzhledem ke kontrolované pasáži jehly podkožím je jistě vhodná v místech, kde se potřebujeme vyhnout anatomicky důležitým strukturám (arterie, kmen fistule, nerv apod.), nicméně ve většině případů je zbytečně složitá.
Na našem pracovišti jsme od března 2015 bez znalosti Iraniho procedury začali používat jednodušší typ podvazu. Rozdíl je v použití běžného vstřebatelného atraumatického stehu a též v tom, že po sonografické verifikaci anatomických poměrů samotné naložení stehu již probíhá bez ultrazvukové navigace.
Popis výkonu perkutánního podvazu
U každého pacienta jsme provedli fistulogafii, detailně zhodnotili přívodnou tepnu, anastomózu, žílu v oblasti kanylačního segmentu i stav centrálních žil a stav kolaterálního žilního systému. Všechny kolaterální žíly, posouzené jako hemodynamicky významné, jsme verifikovali sonograficky a v případě jejich dostupnosti v podkoží byly zakresleny na kůži. Místo plánovaného podvazu bylo ošetřeno infiltrační lokální anestezií (Mezocain 1 %). V blízkosti zakreslené žíly byly z obou stran provedeny drobné incize velikosti cca 2 mm. Poté již bez přítomnosti sono navigace byla jednou incizí zavedena jehla s nití ze vstřebatelného materiálu o síle 2–0 nebo 0 (20 mm, 1/3, tapper cut, Novosyn, B-Braun), podebrána žíla a jehla vypíchnuta druhou incizí (Obr. 1, 2), následně přes stejnou incizi vedena zpět podkožím nad žílou a byla vypíchnuta první incizí (Obr. 3). Na vytvořené kličce kolem žíly byly naloženy 2 chirurgické uzly, těsně zataženy a steh zanořen do podkoží (Obr. 4, Schéma 1). Těsnost uzávěru byla posuzována ihned po naložení stehu sonograficky (Obr. 5–7) nebo fistulografií (Obr. 9–11). V případě nedostatečného uzávěru byl naložen stejným způsobem přes stejné incize druhý podvaz. Kožní incize byly adaptovány, naložen náplasťový steh nebo pouze sterilní krytí (Obr. 8). Po výkonu byli pacienti sledováni na stacionáři oddělení hemodialýzy a po 2 hodinách propuštěni do domácí péče.
Image 1. Zakreslená žíla na kůži, drobné incize, pasáž jehly pod žilou Fig. 1: The vein is marked on the skin, a small incision is made and the needle passes under the vein 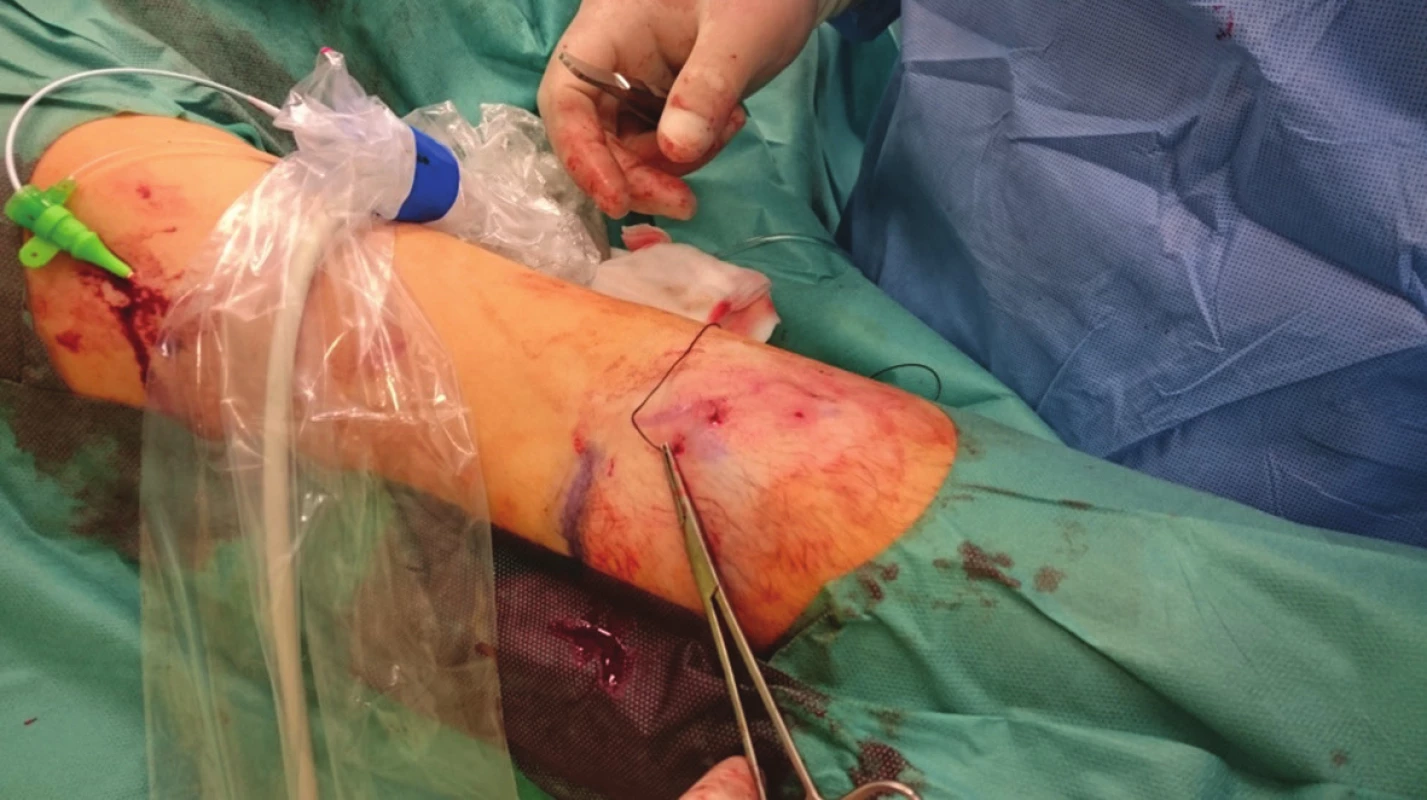
Image 2. Provlečení nitě pod žilou Fig. 2: The suture is drawn under the vein 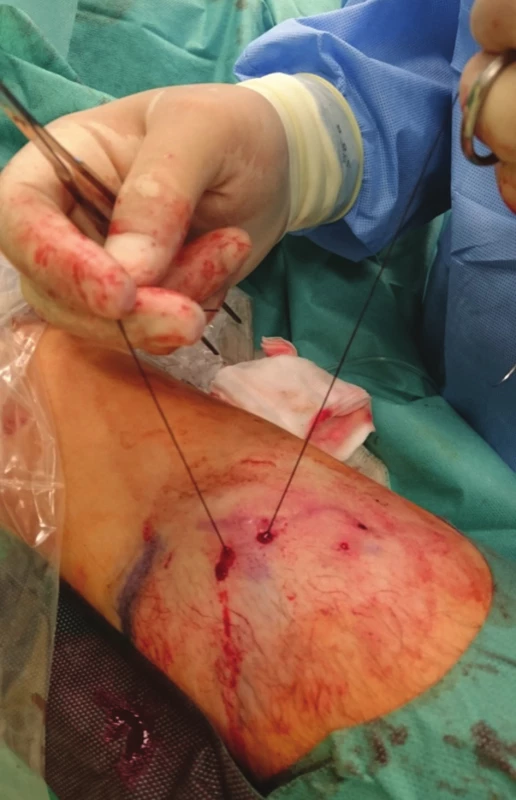
Image 3. Pasáž jehly podkožím zpět nad žilou Fig. 3: The needle crosses back over the vein in the subcutaneous tissue 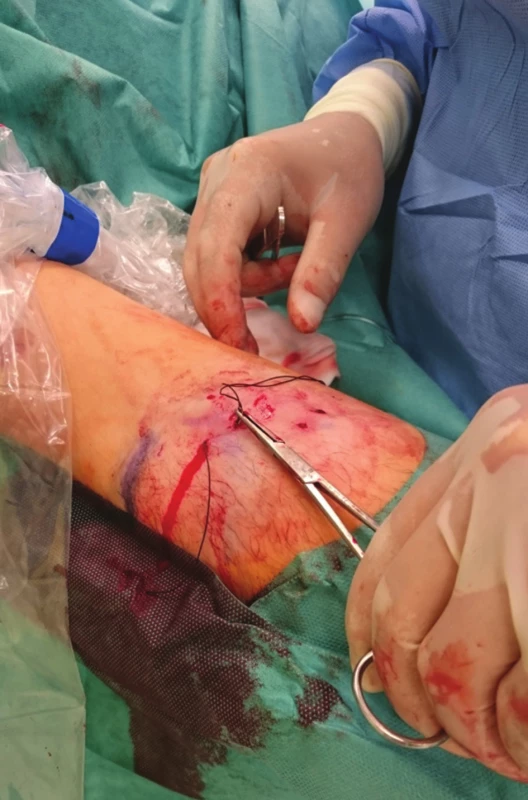
Image 4. Zatažený steh se zanořením Fig. 4: The suture is tightened and buried 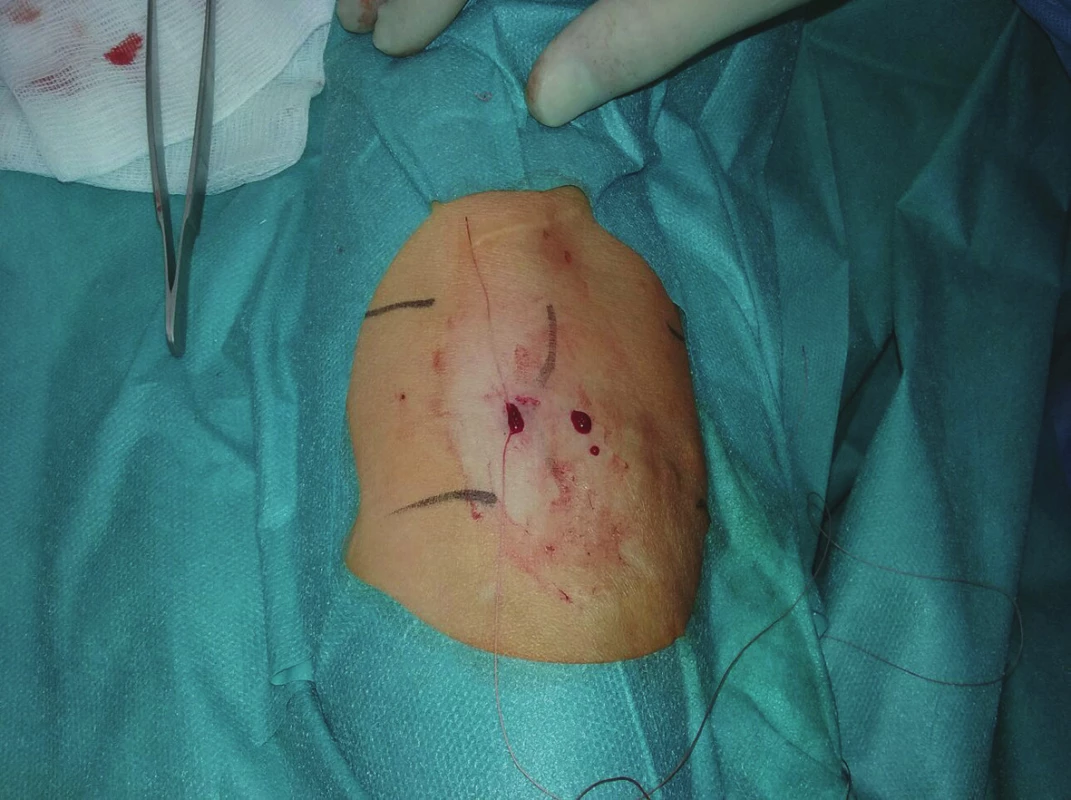
Schéma 1: 1) zavedení jehly první incizí a pasáž pod žilou, 2) vypíchnutí druhou incizí a pasáž zpět nad žilou, 3) vypíchnutí opět první incizí, 4) uvázání uzlu a zanoření do podkoží Scheme 1: 1) The needle is inserted via the first incision and traversed under the vein; 2) The needle exits via the second incision and crosses back over the vein; 3) The needle exits via the first incision; 4) The knot is tied and buried 
Image 5. Ultrazvuková kontrola žíly po prvním podvazu s patrným malým reziduálním průtokem Fig. 5:Ultrasound control of the vein after the first suture shows the presence of mild residual flow 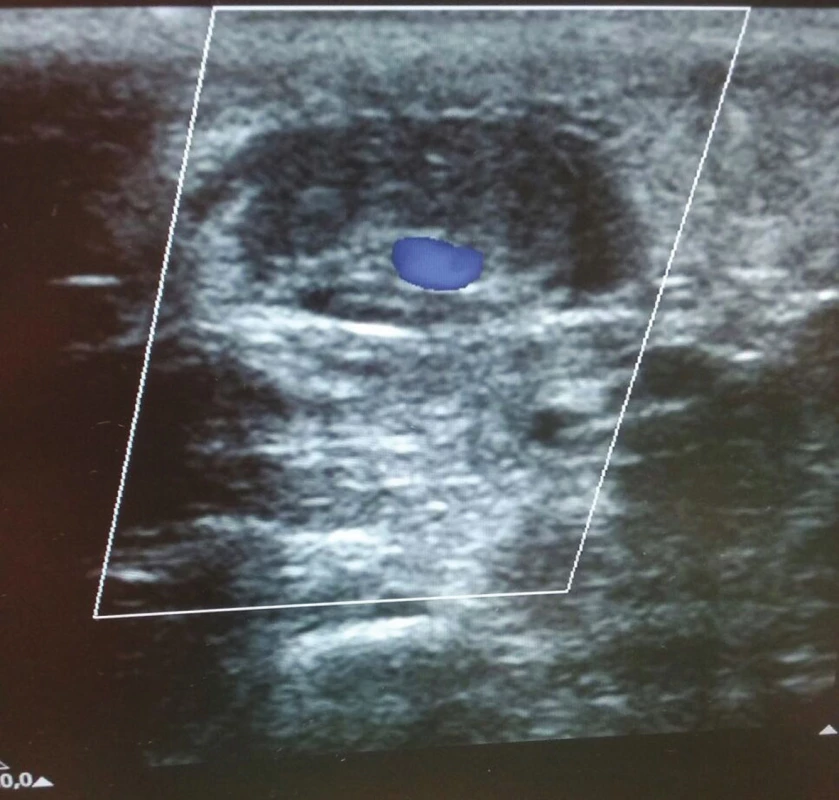
Image 6. Po druhém podvazu, již bez patrného průtoku Fig. 6: After the second suture, there is no residual flow 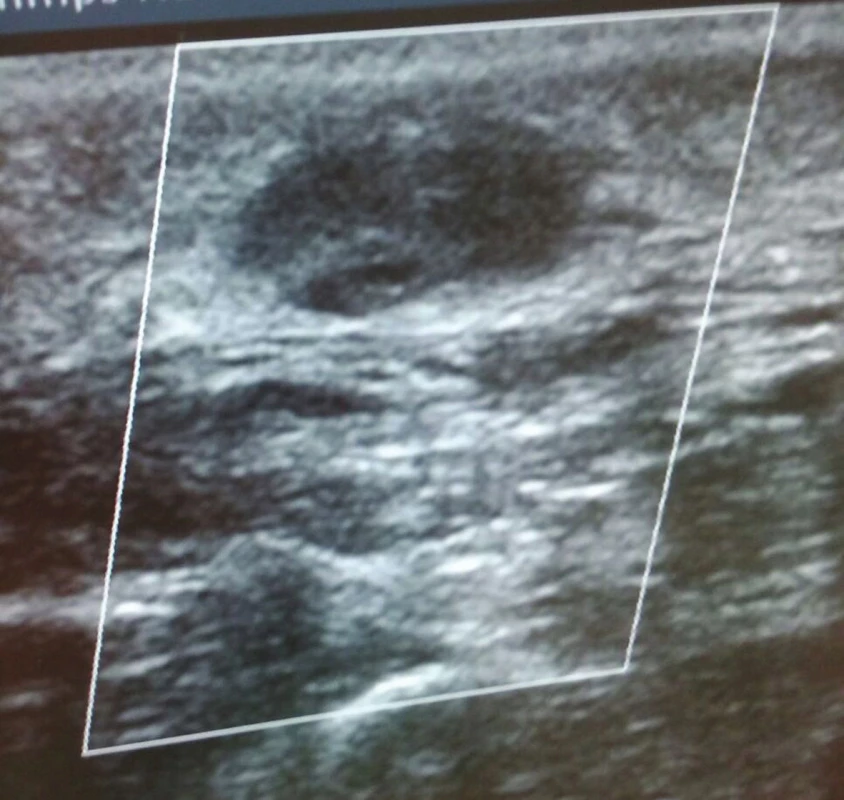
Image 7. Totéž Fig. 7: The same as above 
Image 8. Výsledný stav na předloktí ihned po výkonu Fig. 8: Final outcome in the forearm immediately after the procedure 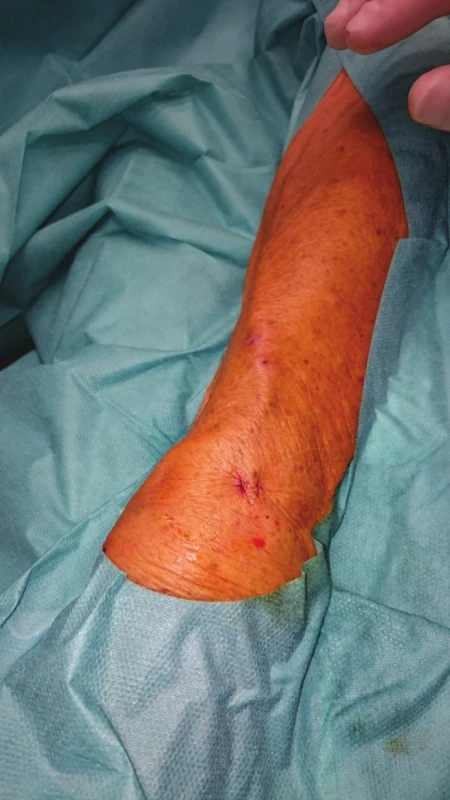
Image 9. Fistulografie s těsnou stenózou na odvodné žíle a přítomnými kolaterálami Fig. 9: Fistulogram showing a tight stenosis in the main vein and the presence of collateral veins 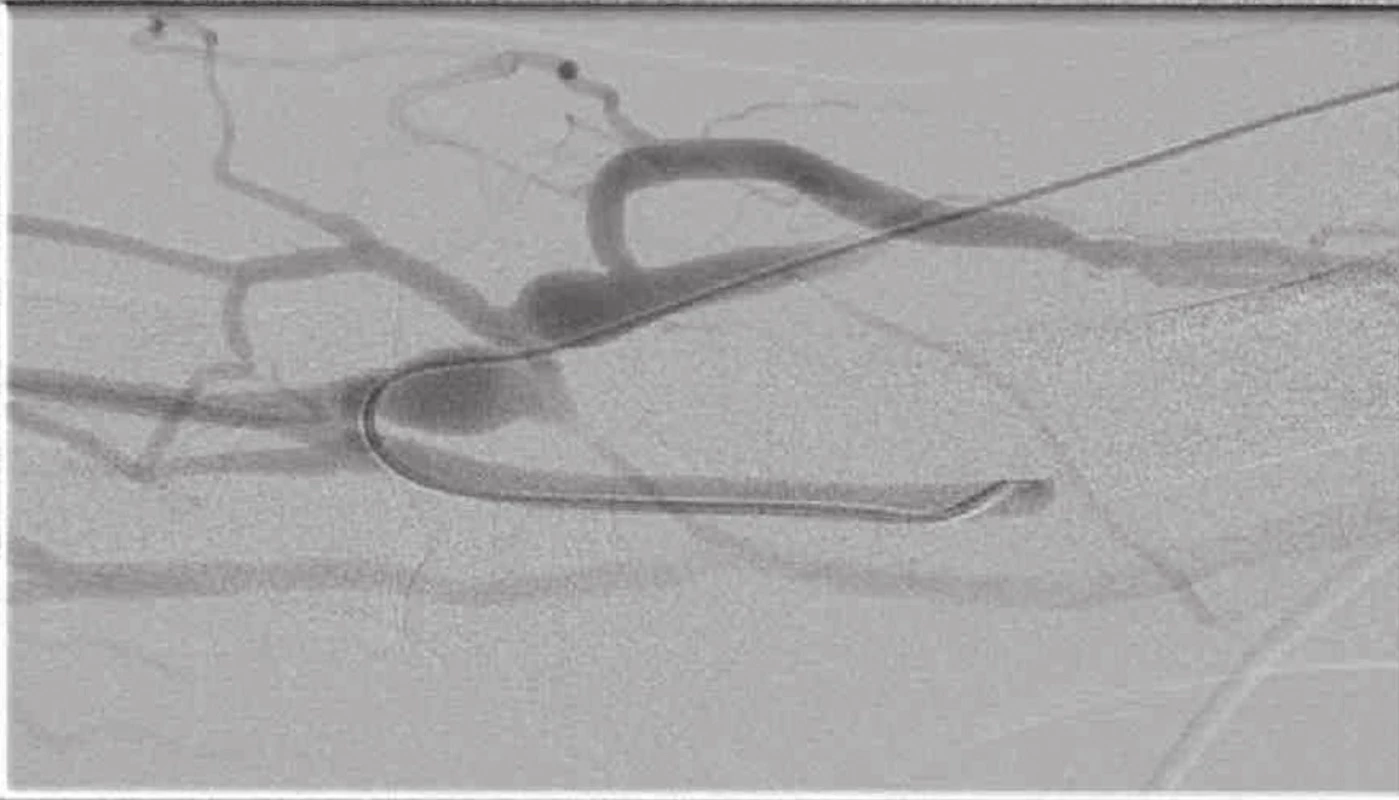
Image 10. Fistulografie po podvazu 3 kolaterálních žil, šipky Fig. 10: Fistulogram after ligation of 3 collateral veins; arrows 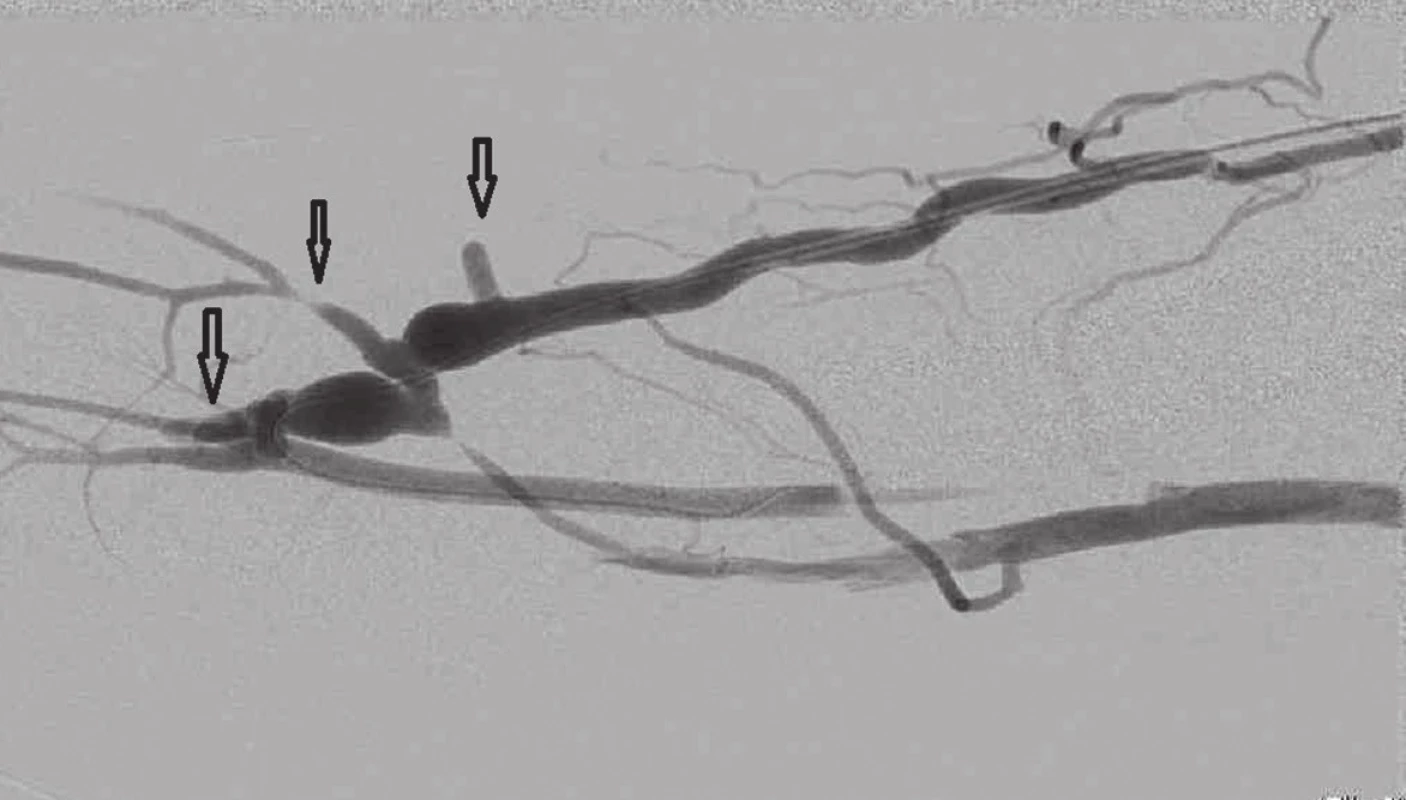
Image 11. Fistulografie po podvazu 2 kolaterálních žil a embolizaci další žíly spirálkami Fig. 11: Fistulogram after ligation of 2 collateral veins and coil embolization of the other vein 
METODA
Cílem naší studie je retrospektivně zhodnotit metodu žilní ligace prováděnou perkutánně za asistence zobrazovacích metod na angiografickém sále nebo sonografické vyšetřovně. Malý soubor pacientů nám nedovolil detailnější statistické zpracování.
Všechny výkony jsme provedli na angiografickém pracovišti v ambulantním režimu. V období březen 2015 až leden 2017 jsme použili techniku perkutánního podvazu se zanořeným stehem u 7 pacientů s dysfunkčním nativním hemodialyzačním zkratem a celkem jsme podvazovali 11 žilních kolaterál. V souboru byli čtyři muži a tři ženy, věk pacientů 23–69 roků (průměr 55,6; SD±18,3) (Tab. 1). Časy od vyšití zkratu do intervence se pohybovaly od 6 týdnů do 5 měsíců v závislosti na míře naléhavosti na zahájení hemodialyzační léčby. Šest pacientů mělo nematurující radiocefalickou fistuli (RC AVF) s množstvím žilních kolaterál na předloktí, jedna pacientka brachiocefalickou fistuli (BC AVF) s poklesem průtoku s epizodami vzniku trombózy částečně na podkladě stenózy zkratu, částečně na podkladě kompetice s vyzrálou kapacitní zlodějskou kolaterálou krátce za anastomózou, opakované perkutánní angioplastiky (PTA) byly bez efektu. Ostatní pacienti měli též stenózu v průběhu zkratu a vždy byla provedena její PTA, nicméně podvazovány byly pouze ty kolaterály, které i po provedené PTA byly subjektivně zhodnoceny jako hemodynamicky významné. Jeden pacient měl podvazovány 3 akcesorní žíly, tři pacienti 2 žíly a tři pacienti po jedné žíle, vše během jednoho sezení, průměrná doba na 1 podvaz byla 10 min. Kvalita podvazu byla posuzována hned po naložení stehu angiograficky či sonograficky. Podvaz byl zhodnocen jako kvalitní při úplné zástavě toku nebo při těsném zúžení s výrazným obleněním toku v kolaterální žíle. U dvou pacientů byly další 2 významné kolaterální žíly embolizovány spirálkami (VortX, Boston Scientific) pro jejich špatnou dostupnost perkutánnímu podvazu (Obr. 11). Pacienti byli nadále sledováni pouze klinicky na pracovišti hemodialýzy. Jako kritérium úspěchu bylo stanoveno provedení kvalitní hemodialýzy do 4 týdnů od provedeného výkonu.
Table 1. Tabulka pacientů Tab. 1: Patients table 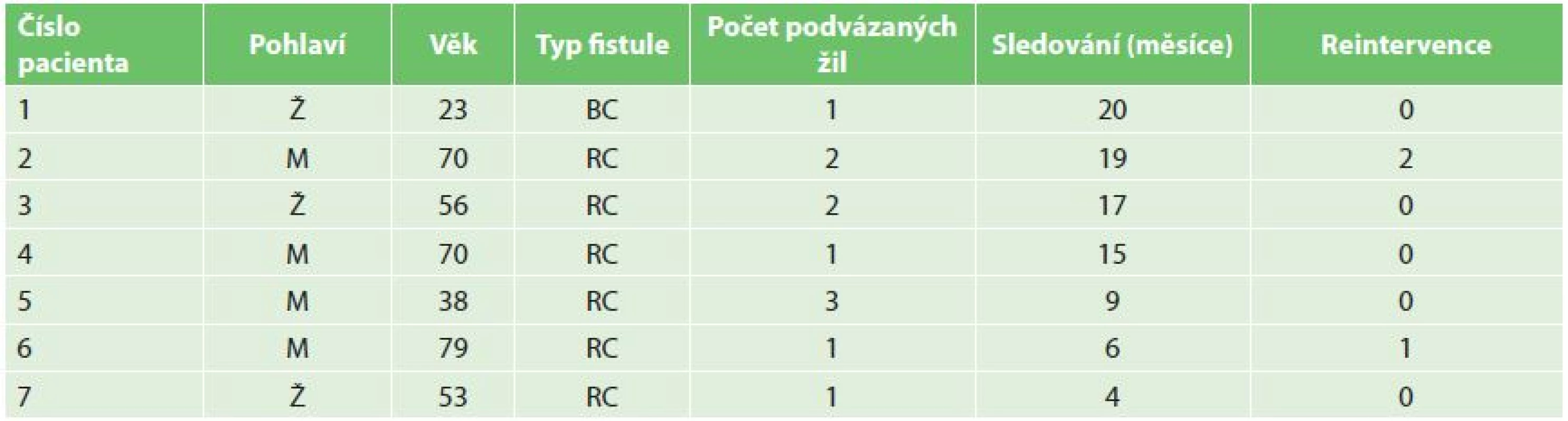
VÝSLEDKY
Všechny RC fistule vyzrály pro potřeby hemodialýzy za 2, respektive za 3 týdny od výkonu, fungují 4–20 měsíců (průměr 12,9; SD± 6,0), v pěti případech bez obtíží, ve dvou případech byla nutná reintervence pro vznik restenózy žilního úseku za anastomózou po 1, respektive po 7 a 19 měsících. Pacientka s recidivujícími trombózami AVF je po provedeném výkonu 17 měsíců bez obtíží. Neobjevily se žádné infekční komplikace, 1x přechodná bolest ruky řešená podáním analgetik. Dvě podvázané akcesorní žíly na kontrolním UZ za 1 měsíc částečně rekanalizovaly bez vlivu na funkčnost AVF. Kosmetický efekt po zhojení byl dobrý u všech pacientů.
DISKUZE
AVF je nejvýhodnější hemodialyzační přístup u pacientů s chronickým renálním selháním vzhledem k nízkému riziku infekčních komplikací a má relativně dlouhou životnost. Bohužel podíl primárně nerozvíjejících se zkratů je velmi vysoký, dle pracovišť 25–40 % [16–18]. Záchrana těchto nematurujících zkratů je zásadní pro prognózu a komfort pacientů. Některé studie ukazují, že akcesorní žilní spojky se podílejí na primárním selhání až ve 40 % [12,18] a eradikace těchto kolaterál podpoří navýšeným průtokem maturaci zkratu [9,18–20].
Obvyklým řešením nadbytečných žilních kmenů je jejich chirurgická ligace nebo embolizace spirálkami. Chirurgický přístup je časově a organizačně náročný. Vyžaduje operační sál, větší tým lidí, větší incizi s nutností preparace. V případě hluboko uložených žil a anatomicky složité situace bývá identifikace akcesorní žíly obtížná nebo bez sonografické či skiaskopické navigace nemožná. Embolizace spirálkami se provádí v rámci diagnostickoterapeutického výkonu na pracovištích intervenční radiologie. Samotná katetrizace žilních kolaterál může být obtížná a časově náročná, embolizace spirálkami je zatížena rizikem dislokace a migrace s nebezpečím uzávěru zkratu, rizikem infekce s tromboflebitidou a kožních erozí nad spirálkou. Další nevýhodou jsou vysoké finanční náklady, zvláště při použití odpoutatelných spirál nebo okluderů [21]. Nicméně tuto metodu považujeme za vhodnou u hluboko uložených žil.
Perkutánní ligace žilních kolaterál [9] provedená prostým podebráním žíly jehlou přes kůži s naložením stehu a uzlením na povrchu je proveditelná u povrchově uložených kolaterál, stehy se ale musejí odstranit za 3–10 dní. Tento přístup je zatížen vyšším rizikem infekce v místě ligace, kosmetickým defektem a velkým procentem rekanalizací.
Iraniho metoda perkutánního podvazu pod ultrazvukovou navigací je metoda jednoduchá, ale též časově náročnější a omezeně umožňuje použití vstřebatelného šicího materiálu. Její uplatnění vidíme v situacích, kde je potřeba se vyhnout jiné důležité anatomické struktuře, např. tepně.
Naše technika perkutánního podvazu je vhodná pro povrchově uložené žíly bez důležitých anatomických struktur v blízkém okolí. Podkožně uložený steh šetří kůži, snižuje riziko infekčních komplikací, velmi drobné incize jsou ošetřené náplasťovým stehem nebo pouze sterilním krytím, tedy bez větších kosmetických defektů. Použitím vstřebatelného materiálu předcházíme možným komplikacím, jako jsou vznik stehového granulomu nebo fistule. Metoda je jednoduchá, nevyžaduje katetrizaci cílové žíly ani její preparaci. Vzhledem k malé časové náročnosti je proveditelná na angiografickém pracovišti při diagnostické fistulografii nebo na sonografických vyšetřovnách při kontrolním vyšetření a nevyžaduje extra sezení. Nevýhodou se může jevit určité procento rekanalizací, kterými jsou ale zatíženy všechny výše popisované techniky. Vycházíme z předpokladu, že není nezbytně nutné dosáhnout absolutní zástavy toku nebo trvalého uzávěru kolaterální žíly. Navýšený průtok je potřeba pouze po dobu nezbytně nutnou pro maturaci AVF, která po provedeném výkonu trvá obvykle 2–3 týdny. Případná rekanalizace podvázané žíly již na funkci vyzrálé AVF nemívá vliv.
Přestože počet pacientů v naší studii je malý, což považujeme za hlavní limitaci naší studie, vidíme tuto metodu jako jednoduchou a vysoce efektivní a jistě ji budeme v budoucnu nadále používat. Věříme, že si najde své místo mezi dalšími intervenčními radiology i mezi lékaři hemodialýzy, kteří běžně využívají ultrazvuk ke kontrolám hemodialyzačních zkratů.
ZÁVĚR
Námi použitá technika perkutánního podvazu nabízí účinnou, minimálně invazivní, časově a finančně nenáročnou metodu eradikace kolaterálních žil.
Konflikt zájmů
Autoři článku prohlašují, že nejsou v souvislosti se vznikem tohoto článku ve střetu zájmů a že tento článek nebyl publikován v žádném jiném časopise.MUDr. Miroslav Šercl
RDG oddělení
Krajská nemocnice Liberec a.s.
Husova 10
460 01 Liberec
e-mail: miroslav.sercl@gmail.com
Sources
1. Hemodialysis Adequacy Work G. Clinical practice guidelines for hemodialysis adequacy, update 2006. Am J Kidney Dis 2006;48 Suppl 1:S2–90.
2. Janoušek L, Baláž P. Hemodialyzační arteriovenózní přístupy. Praha, Grada 2008.
3. Coburn MC, Carney WI, Jr. Comparison of basilic vein and polytetrafluoroethylene for brachial arteriovenous fistula. J Vasc Surg 1994;20 : 896-902; discussion 903–4.
4. Kudlicka J, Malik J, Tuka V, et al. Arteriovenous grafts: early ultrasonography tells their fortune. Am J Nephrol 2015;41 : 420–5.
5. Malik J, Tuka V, Chytilova E, et al. Low-flow polytetrafluoroethylene accesses: ultrasound surveillance and preemptive interventions ensure long-term patency. Kidney Blood Press Res 2010;33 : 181–5.
6. Tuka V, Slavikova M, Krupickova Z, et al. Short-term outcomes of borderline stenoses in vascular accesses with PTFE grafts. Nephrol Dial Transplant 2009;24 : 3193–7.
7. Ravani P, Palmer SC, Oliver MJ, et al. Associations between hemodialysis access type and clinical outcomes: a systematic review. J Am Soc Nephrol 2013;24 : 465–73.
8. Beathard GA, Arnold P, Jackson J, et al. Aggressive treatment of early fistula failure. Kidney Int 2003;64 : 1487–94.
9. Faiyaz R, Abreo K, Zaman F, et al. Salvage of poorly developed arteriovenous fistulae with percutaneous ligation of accessory veins. Am J Kidney Dis 2002;39 : 824–7.
10. Miller PE, Tolwani A, Luscy CP, et al. Predictors of adequacy of arteriovenous fistulas in hemodialysis patients. Kidney Int 1999;56 : 275–80.
11. Mašková J, Komárková J, Kivánek J. Endovascular treatment of central vein stenoses and/or occlusions in hemodialysis patients. Cardiovascular and Interventional Radiology 2003;26 : 27–30.
12. Haq NU, Althaf MM, Lee T. Accessory vein obliteration for early fistula failure: A myth or reality? Adv Chronic Kidney Dis 2015;22 : 438–45.
13. Malik J, Kudlicka J, Novakova L, et al. Surveillance of arteriovenous accesses with the use of duplex Doppler ultrasonography. J Vasc Access. 2014;15 Suppl 7:S28–32.
14. Kudlicka J, Kavan J, Tuka V, et al. More precise diagnosis of access stenosis: ultrasonography versus angiography. J Vasc Access 2012;13 : 310–4.
15. Cui J, Freed R, Liu F, et al. Interrupting rivaling access-flow with nonsurgical image-guided ligation: the “IRANI” procedure. Semin Dial 2015;28:E53–7.
16. Dixon BS. Why don’t fistulas mature? Kidney Int 2006;70 : 1413–22.
17. Feldman HI, Joffe M, Rosas SE, et al. Predictors of successful arteriovenous fistula maturation. Am J Kidney Dis 2003;42 : 1000–12.
18. Lacson E, Jr., Lazarus JM, Himmelfarb J, et al. Balancing fistula first with catheters last. Am J Kidney Dis 2007;50 : 379–95.
19. Beathard GA, Settle SM, Shields MW. Salvage of the nonfunctioning arteriovenous fistula. Am J Kidney Dis 1999;33 : 910–6.
20. Allon M, Lockhart ME, Lilly RZ, et al. Effect of preoperative sonographic mapping on vascular access outcomes in hemodialysis patients. Kidney Int 2001;60 : 2013–20.
21. Ahmed O, Patel M, Ginsburg M, et al. Effectiveness of collateral vein embolization for salvage of immature native arteriovenous fistulas. J Vasc Interv Radiol 2014;25 : 1890–4.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2017 Issue 7-
All articles in this issue
- Primární lymfomy zažívacího traktu z pohledu chirurga
- Miniinvazivní resekce jater
- Duální transplantace ledvin – zkušenosti jednoho centra
- Jednoduchá technika perkutánního podvazu akcesorních žil hemodialyzačních zkratů
- Invaginace u dospělého jako vzácná příčina náhlé příhody břišní – 2 kazuistiky
- Subclavian-steal recovery carotid fenomén − „ old school“ chirurgické řešení
- Volvulus žlučníku
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Invaginace u dospělého jako vzácná příčina náhlé příhody břišní – 2 kazuistiky
- Miniinvazivní resekce jater
- Volvulus žlučníku
- Subclavian-steal recovery carotid fenomén − „ old school“ chirurgické řešení
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

