-
Medical journals
- Career
Biomarkery detekce minimální systémové diseminace u nemocných s karcinomem plic
Authors: A. Benedíková 1; J. Srovnal 1; M. Szkorupa 2; P. Skalický 2; J. Chudáček 2; T. Bohanes 2; J. Škarda 3; Z. Kolář 3; M. Hajdúch 1; J. Klein 4
Authors‘ workplace: Laboratoř experimentální medicíny, Ústav molekulární a translační medicíny LF UP Olomouc, ředitel: Doc. MUDr. Marián Hajdúch, PhD. 1; I. chirurgická klinika LF UP a FN Olomouc, přednosta: doc. MUDr. Čestmír Neoral, CSc. 2; Ústav klinické a molekulární patologie LF UP a FN Olomouc, přednosta: Prof. MUDr. Zdeněk Kolář, CSc. 3; Chirurgické oddělení KNTB, a. s., primář: Prof. MUDr. Jiří Klein, PhD, FETCS 4
Published in: Rozhl. Chir., 2012, roč. 91, č. 4, s. 209-215.
Category: Original articles
Overview
Úvod:
Minimální systémovou nemocí (MSD) rozumíme přítomnost cirkulujících či diseminovaných nádorových buněk ve tkáních pacienta, resp. v jeho mezenchymálních tělesných kompartmentech (tedy v krvi nebo kostní dřeni), kde jsou snáze detekovatelné. Cílem naší pilotní studie bylo identifikovat dostatečně senzitivní markery schopné zachytit nádorové buňky s uspokojivou specificitou na souboru 50 pacientů s karcinomem plic, kteří byli operovaní s kurativním záměrem na I. chirurgické klinice LF UP a FN Olomouc v letech 2009 a 2010.Materiál a metodika:
K danému účelu byla použita kvantitativní reverzně-transkriptázová polymerázová řetězová reakce v reálném čase (quantitative real-time RT-PCR), která hodnotí absolutní expresi genů pro karcinoembryonální antigen (CEA), receptor pro epidermální růstový faktor (EGFR1), plicní specifický X protein (LUNX) a receptor pro hepatocytární růstový faktor (c-met) v periferní krvi, kostní dřeni a v krvi z tumor-drénující plicní žíly.Výsledky:
- Marker LUNX vykazuje vysokou specificitu a senzitivitu pro detekci MSD u nemocných s karcinomem plic.
- MSD pozitivita zjištěná pomocí CEA v kostní dřeni výrazně koreluje s histopatologickým gradingem (GI-GIII).
- U nemocných s hilovou či mediastinální lymfadenopatií byla v krvi z drénující žíly nalezena vysoká exprese CEA a c-met.
- Vyšší exprese markerů MSD koreluje s vyšším stupněm pTNM klasifikace v kostní dřeni pomocí CEA, v periferní krvi za použití c-met a ve vzorcích z tumor-drénující žíly pomocí LUNX.
Závěr:
Detekce minimální systémové nemoci u nemocných s plicní rakovinou je technicky možná, pro tento účel existují dostatečně senzitivní a specifické markery. Zjištění minimální systémové diseminace v době diagnózy či iniciální terapie může být vodítkem další systémové léčby. Tato teorie musí být ověřena na větším souboru a korelována s klinickými daty, zejména s daty přežití.Klíčová slova:
karcinom plic – minimální systémová nemoc – cirkulující nádorové buňky – diseminace
Práce byla podpořena granty MZ ČR NR NS 10285-3/2009 a CZ.1.05/2.1.00/01.0030.ÚVOD
Plicní rakovina je nejčastějším typem zhoubného nádoru v lidské populaci a patří obecně k nádorovým onemocněním s nejvyšší letalitou. V roce 2008 bylo na světě diagnostikováno 1,61 milionu nových případů a konstatováno 1,38 milionu úmrtí na tento novotvar (globocan.iarc.fr). V ČR bylo ve stejném roce hlášeno celkem 6527 případů, (4693 případů, tj. 91,8 případu na 100 tisíc mužů, 1834 případů, tj. 34,5 případu na 100 tisíc žen) (www.uzis.cz). Jedinou léčebnou modalitu s potenciálně kurativním efektem představuje radikální resekce. Operace však dává reálnou šanci na vyléčení pouze menší části nemocných, neboť téměř 80 % karcinomů plic je diagnostikováno lokálně neresekabilních, inoperabilních z jiných důvodů či ve stadiu generalizace. Pro odhad prognózy mají největší význam typ nádoru (malobuněčný versus nemalobuněčný) a TNM stadium. Pětileté přežití se pohybuje i při optimální terapii mezi 57–78 % ve stadiu I, od 39 do 66 % ve stadiu II, v intervalu 23–33 % ve stadiu IIIA, ve stadiu IV je výjimečné (1). Většina recidiv po operaci je systémových, i v I. a II. stadiu je to asi 70 %, ve stadiu III 80 a více procent. Z toho je zřejmé, že u řady nemocných zařazených do nižších stadií musí existovat subklinický, klasickými diagnostickými metodami neprokazatelný hematogenní nebo lymfogenní rozsev, který je zodpovědný za převážnou většinu systémových recidiv. Během procesu metastazování se musí proliferující nádorová buňka uvolnit z primárního nádoru a skrze stroma, bazální membránu a endotel vcestovat do cévy a pak být pomocí krevního nebo lymfatického systému zanesena do cílové tkáně, ve které jsou příhodné podmínky pro vznik sekundárního novotvaru. Tyto volné nádorové buňky jsou jako minimální systémová, resp. po radikální léčbě minimální zbytková nemoc (minimal systemic or residual disease, MSD, MRD) u řady solidních malignit detekovatelné v mezenchymových kompartmentech. V krvi je označujeme jako cirkulující nádorové buňky (circulating tumour cells, CTC), v kostní dřeni jako diseminované nádorové buňky (disseminated tumour cells, DCT) [2]. U některých solidních novotvarů je MSD/MRD považována za negativní prognostický faktor, v dalších sděleních je srovnávána minimální diseminace s uzlinovým postižením, resp. stadiem nemoci, řada dalších prací prognostický význam DCT/CTC zpochybňuje [3, 4, 5, 6, 7]. To však nic nemění na faktu, že uvolnění vitálních nádorových buněk do cirkulace je jednou z nezbytných podmínek migrace potenciálně maligní buněčné populace mimo primární fokus. K vlastnímu průkazu lze použít různých metod, nejvyšší citlivost vykazuje kvantitativní reverzně-transkriptázová polymerázová řetězová reakce v reálném čase (quantitative real-time RT-PCR) zaměřená na expresi specifických nádorových markerů [8, 9].
MATERIÁL A METODIKA
Cílem výzkumu bylo identifikovat spolehlivé markery subklinické diseminace v periferní krvi, v kostní dřeni a v krvi z tumor-drénující plicní žíly u nemalobuněčné plicní rakoviny.
Vzorky nádorové tkáně byly odebírány po operaci do stabilizačního roztoku RNA later, vzorky systémové krve a kostní dřeně ze sterna po uvedení do anestezie, vzorky krve z plicní žíly po provedení torakotomie a kolapsu plíce před zahájením vlastní plicní resekce (do standardních zkumavek s EDTA). Izolace RNA z přibližně 11 milionů jaderných buněk krve a kostní dřeně byla provedena chloroformovou metodou dle Chomczynského. Reverzní transkripce na komplementární cDNA byla prováděna ze 3 μg celkové vyizolované RNA v reakčním objemu 30 μl za pomoci reverzní transkriptázy, náhodných hexamerů a v přítomnosti inhibitoru RNáz (RNAsin). Vlastní real-time RT-PCR analýza genové exprese probíhala na přístroji Rotor Gene 3000. Jako fluorescenční činidlo byla použita sonda typu TaqMan, polymeráza typu hot-start a optimalizované poměry primerů. Pro absolutní kvantifikaci byly připraveny standardy, které v ředění sloužily k sestavení standardizačních křivek. Normalizace exprese byla prováděna vzhledem k celkovému množství izolované RNA.
Pro vyšetření přítomnosti MRD u pacientů s karcinomem plic jsme zvolili metodu RT-PCR v reálném čase za použití karcinoembryonálního antigenu (carcinoembryonic antigen, CEA), receptoru pro epidermální růstový faktor (epidermal growth factor receptor, EGFR), plicního specifického X proteinu (lung-specific X protein, LUNX) a receptoru pro hepatocytární růstový faktor (hepatocyte growth factor receptor, HGFR, c-met) jako markerů nádorových buněk.
V zájmu odclonění pozadí, možné kontaminace a ilegitimní transkripce byla vyhodnocena exprese RNA vybraných markerů u 98 dárců krve a 12 dárců kostní dřeně bez prokázaného hematologického či onkologického onemocnění. Na tomto souboru byly stanoveny mezní (cut-off) hodnoty exprese pro jednotlivé markery v daném kompartmentu na úrovni průměrné exprese zvýšené o dvojnásobek standardní odchylky (předpoklad 97,5% shody). Exprese zvolených markerů byla v krvi, resp. kostní dřeni dárců minimální nebo nulová.
Specificita zvolených markerů byla ověřena na souboru tumorů různého histogenetického původu (124 tumorů kolorekta, plic, prsu, ovaria, pankreatu, mozku, sarkomů), normalizace byla provedena vůči referenčnímu genu glyceraldehyd-fosfát dehydrogenáze (glyceraldehyde phosphatedehydrogenase, GAPDH). U vybraných markerů byla nalezena stabilní exprese v plicních nádorech.
Exprese výše uvedených markerů ve vzorcích periferní krve, krve z tumor-drénující plicní žíly a kostní dřeně byla korelována s klinickým stadiem nemoci, gradingem tumoru a postižením lymfatických uzlin. Vlastní data jsou ze souboru 50 nemocných ve stadiu I-III TNM klasifikace, kteří prodělali kurativní R0 resekci pro nemalobuněčnou plicní rakovinu na I. chirurgické klinice LF UP a FN v Olomouci. Výzkum byl prováděn na základě informovaného souhlasu a po schválení etickou komisí.
Statistická analýza: Pro statistickou analýzu uvedených dat byl použit počítačový program SPSS 7.5 pro freeware Statitica 7, porovnávání exprese jednotlivých markerů bylo hodnoceno neparametricky (Kruskal-Wallis, Mann-Whitney test), k porovnání exprese markerů v podsouborech nemocných byl použit Studentův t-test. Hodnota p < 0,05 byla považována za signifikantní.
VÝSLEDKY
Mezní hodnoty pro vybrané markery byly stanoveny na základě měření jejich exprese ve vzorcích od 98 zdravých dárců krve a 12 dárců kostní dřeně, hodnoty jsou v Tab. 1.
Table 1. Stanovené cut-off hodnoty vybraných markerů Tab. 1: The cut-off values of individual biomarkers 
Výše uvedené markery byly zvoleny z důvodu vysoké a specifické exprese v nádorové tkáni a zároveň minimální či nulové exprese v krvi či kostní dřeni. Velmi vysokou specificitu exprese v tkáni plicních nádorů vykazoval LUNX (Obr. 1), ostatní markery byly méně specificky exprimovány v tkáni zkoumaných nádorů, přičemž exprese pozadí byla uspokojivě nízká.
Image 1. Analýza exprese markeru LUNX v tumorech různého histogenetického původu Fig. 1: The LUNX expression in tumors of different histogenetic origin 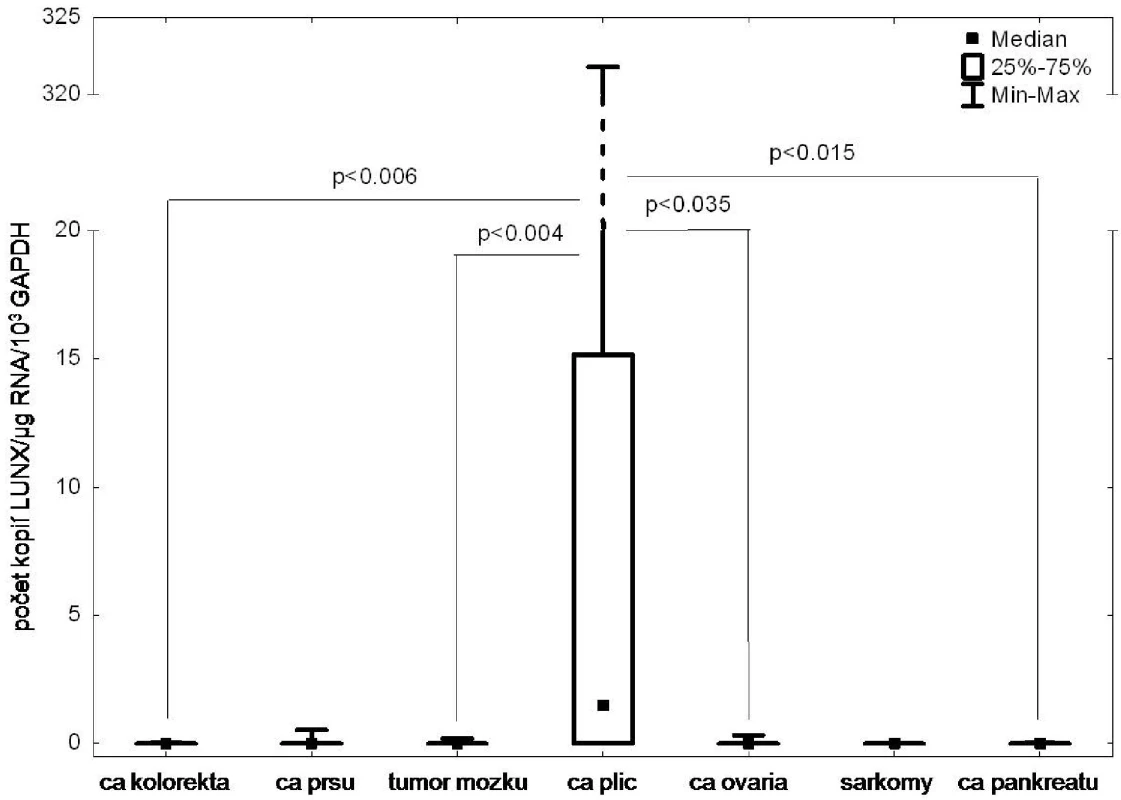
Na souboru 50 nemocných ve stadiu I-III nemalobuněčné plicní rakoviny jsme porovnávali klinické stadium, grading a metastatické postižení lymfatických uzlin s průkazem CTC/DTC pomocí exprese jednotlivých markerů (CEA, c-met, EGFR, LUNX). Charakteristika souboru podle TNM stadia, věku, pohlaví, gradingu a N stagingu je v Tab. 2.
Table 2. Charakteristika souboru podle pohlaví, věku, stadia, gradingu a postižení uzlin Tab. 2: Patients characteristics according to the sex, age, clinical stage, grading and lymph nodes involvement 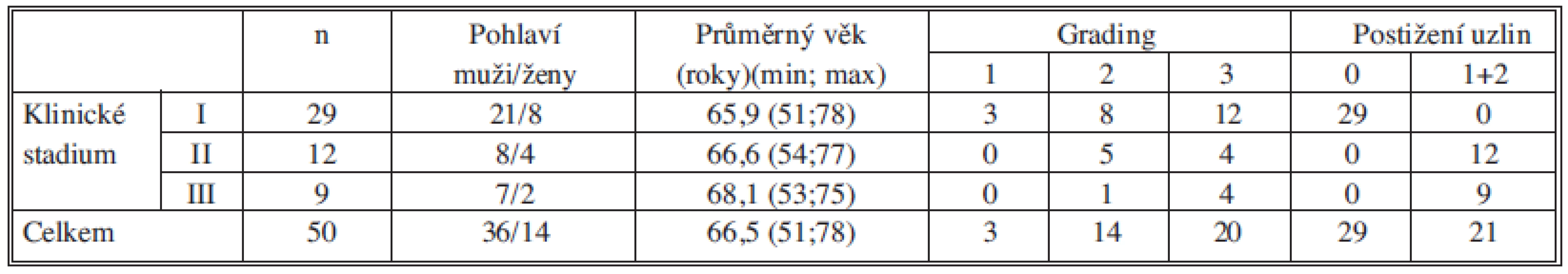
Při průkazu CTC pomocí CEA ve vzorcích krve z plicní žíly byla nalezena korelace mezi uzlinovým postižením a pozitivitou vzorku (Obr. 2), ale pod hladinou statistické významnosti (p=0,1).
Image 2. RT PCR/CEA ve vzorcích krve z drénující plicní žíly versus postižení lymfatických uzlin Fig. 2: CEA expression in the draining pulmonary vein blood samples according to the degree of lymph node affection 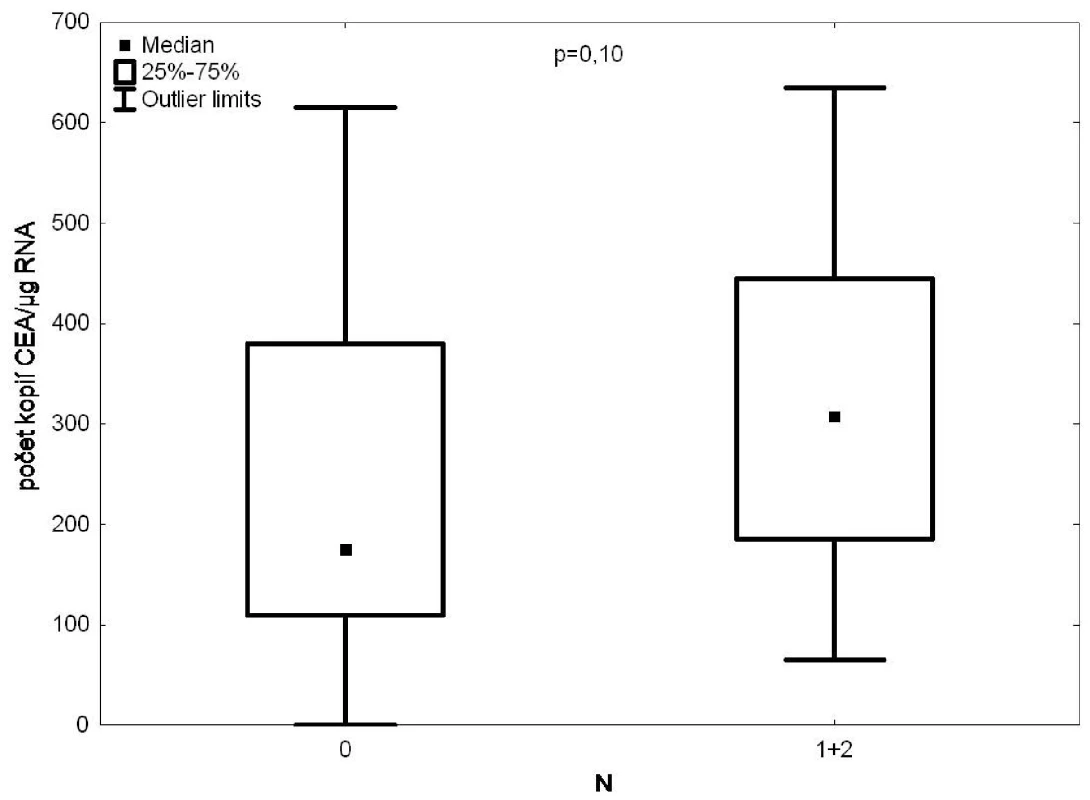
Nález DTC v kostní dřeni exprimujících CEA statisticky nevýznamně (p=0,1) koreloval s TNM stadiem (Obr. 3), statisticky významný (p<0,05) byl vztah mezi pozitivitou vzorku a gradingem nádoru (Obr. 4).
Image 3. RT PCR/CEA ve vzorcích kostní dřeně versus TNM stadium Fig. 3: CEA expression in the bone marrow samples according to the TNM stage 
Image 4. RT PCR/CEA ve vzorcích kostní dřeně versus grading nádoru Fig. 4: CEA expression in the bone marrow samples according to the tumour grading 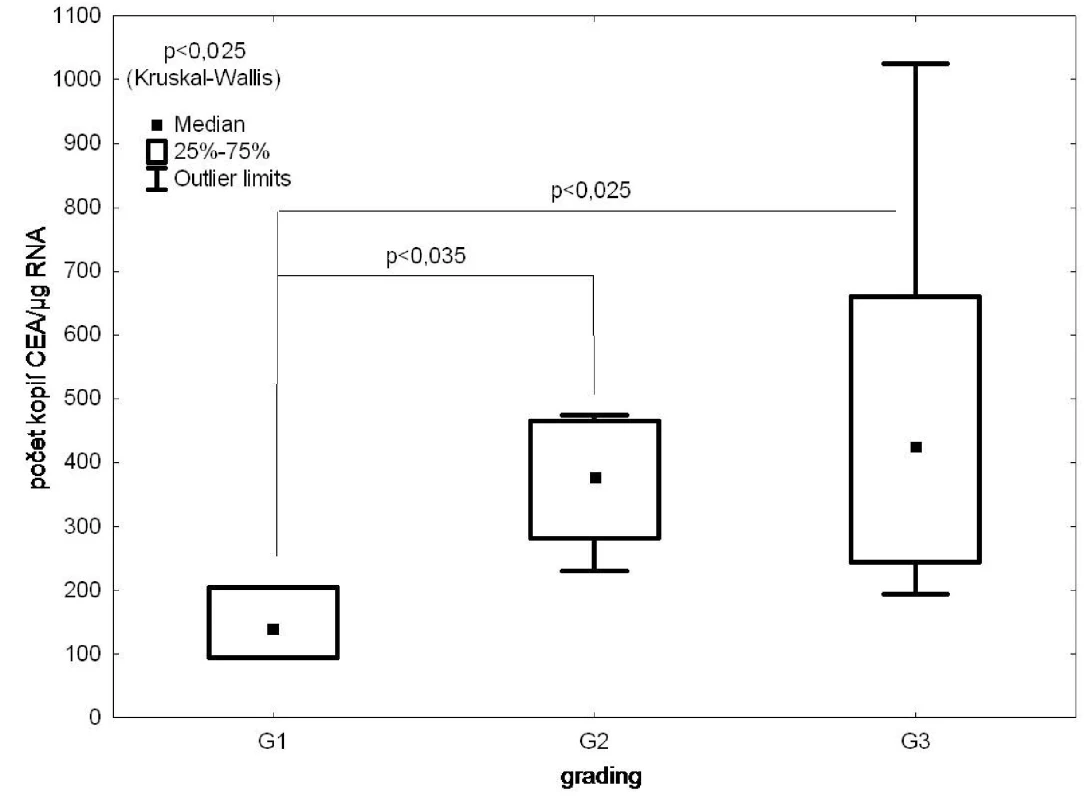
Statisticky významná byla také korelace mezi expresí c-met v krvi drénující plicní žíly a infiltrací lymfatických uzlin (p = 0,02) (Obr. 5).
Image 5. RT PCR/c-met ve vzorcích krve z drénující plicní žíly versus postižení lymfatických uzlin Fig. 5: c-met expression in the tumour-draining pulmonary vein blood samples according to the degree of lymph node affection 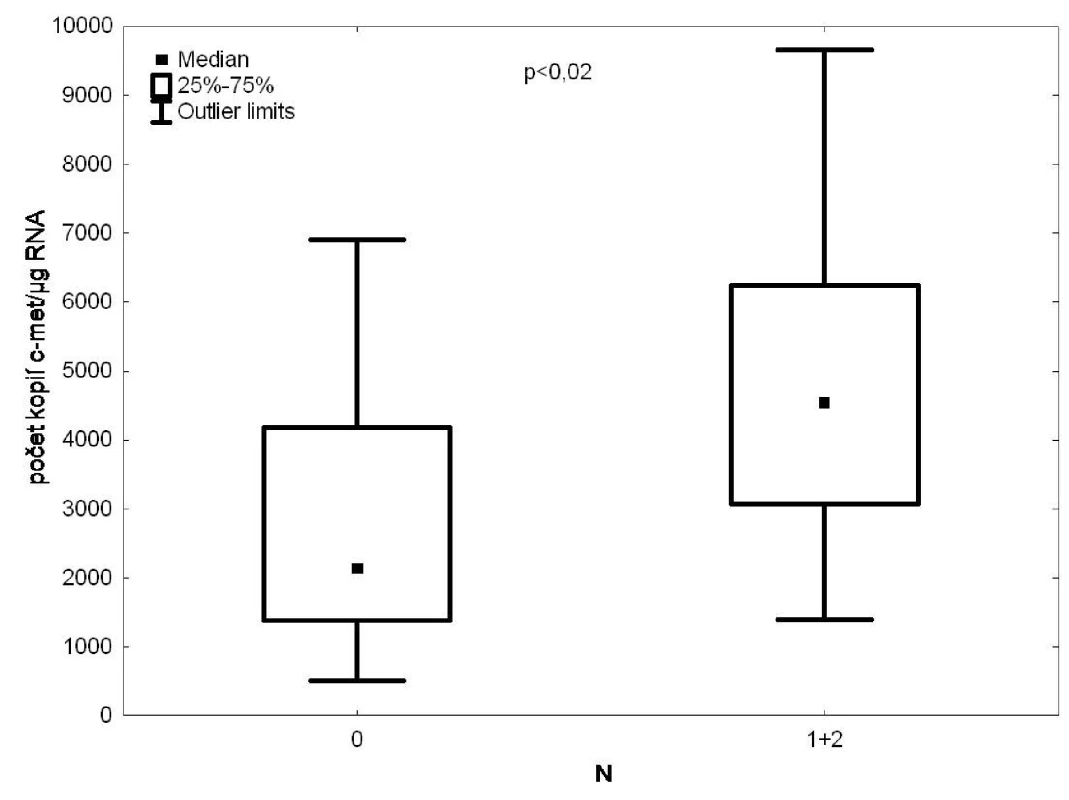
Při analýze procentuálního zastoupení MRD pozitivních vzorků v jednotlivých skupinách pacientů rozdělených dle klinického stadia jsme pozorovali rostoucí pozitivitu CEA v kostní dřeni a c-met v systémové krvi se stoupajícím klinickým stadiem. Marker LUNX vykazoval vyšší pozitivitu v krvi z plicní žíly u pacientů ve vyšších klinických stadiích II a III. Výrazně vyšší byla také celková pozitivita LUNX (pozitivita alespoň v jednom z vyšetřených kompartmentů) u pacientů v klinickém stadiu III (Tab. 3).
Table 3. Procentuální zastoupení MSD pozitivních vzorků ve skupinách pacientů rozdělených dle klinického stadia Tab. 3: The percentage representation of MSD positive samples in individual patient groups according to clinical stage 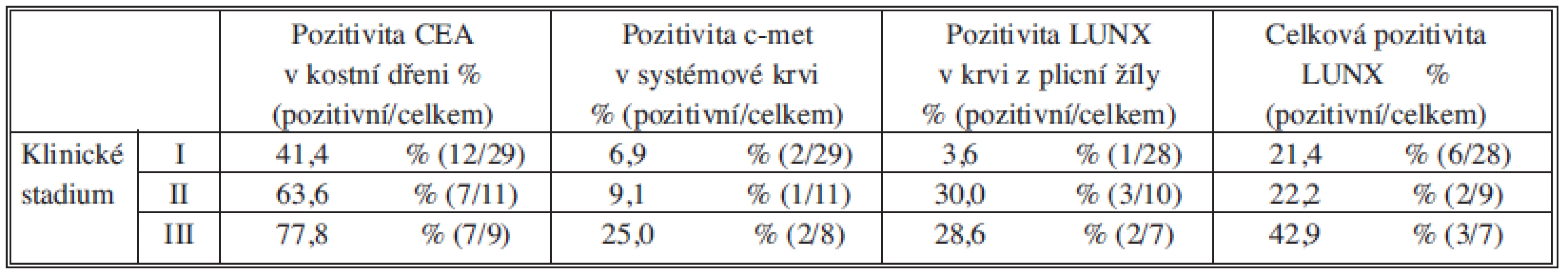
DISKUZE
Problematika minimální reziduální nemoci (minimal residual disease, MRD) byla podrobně propracována pro hematologické malignity [10, 11]. Známkou úspěšné léčby hemoblastóz je dosažení kompletní remise. Pokud je posuzována na klasické úrovni (světelná mikroskopie, radiodiagnostika, laboratoř), hovoříme o klinické kompletní remisi (clinical complete remission, CCR). Časté relapsy u nemocných po dosažení CCR lze vysvětlit přetrváním zbytkové nádorové populace, která je pod úrovní senzitivity klasických diagnostických metod. Tato rezidua ale mohou být prokázána pomocí přesnějších metod – cytometrických či molekulárně-genetických, které dosahují citlivosti 10–5 až 10–7 buněk. Tuto subklinickou zbytkovou diseminaci po proběhlé léčbě označujeme jako minimální reziduální nemoc. Pokud nelze prokázat ani MRD, hovoříme o kompletní molekulární remisi (molecular complete remission, MCR), která je například u lymfoproliferací považována za pozitivní prognostický faktor. Je prokázáno, že také solidní novotvary mají svoji „leukemickou“ fázi [12]. Metastatický rozsev je kromě jiného podmíněn uvolněním nádorových buněk do cirkulace. Předpoklady pro průnik do lymfatické či krevní cévy jsou ztráta intercelulární adheze, zvýšení motility, degradace stromatu a bazálních membrán a schopnost aktivní intravazace. Na modelech bylo vypočteno, že 1 gram vaskularizovaného nádoru je schopen denně uvolnit do oběhu až milion buněk. V lidském organismu panují naprosto odlišné podmínky, ale u řady solidních novotvarů byly prokázány nádorové buňky v kostní dřeni nebo i v cirkulaci už v předminulém století. Na rozdíl od hemoblastóz jsou ale nádorové buňky v krevním oběhu v nepřátelském prostředí, jsou terčem humorálních i buněčných imunitních mechanismů, musejí odolávat zvýšené koncentraci kyslíku a NO, střižným silám, anoikis apod. Mechanismy, které dovolují buňkám setrvat v oběhu, na příhodném místě jej opustit a založit metastázu, se daří objasňovat jen velmi pomalu. Lze parafrázovat Pagetovu teorii „seed and soil“ jako zasít dobré semeno do úrodné půdy, ale procesy, které to umožňují, jsou velmi složité a zatím málo poznané. Ne každá buňka uvolněná do oběhu je vitální, navíc schopná oběh opustit a založit metastázu. Tento jev nazýváme inefektivita metastatického procesu. Mnoho cirkulujících buněk je apoptotických, některé dormantní, další podíl není schopen proteosyntézy, řada je likvidována imunitním systémem či chemicky. Buněk, u kterých převažuje proliferační potenciál nad apoptotickým a jsou schopny adheze k cévní stěně a extravazace v cílovém orgánu, je nepatrná menšina. Navíc musejí proliferovat a indukovat angiogenezi [13]. Přesto si nelze metastazování bez buněk ,,v pohybu“ představit, a proto exponenciálně roste počet prací zabývajících se touto problematikou [14, 15, 16]. Molekulární diagnostika dnes dovoluje monitoraci a trendování cirkulujících nádorových buněk a vzhledem k vysoké citlivosti a selektivitě představuje atraktivní nástroj k tailorování terapie nádorového onemocnění.
V našem výzkumu jsme k monitorování CTC/DTC zvolili metodu kvantitativní real-time RT-PCR z těchto důvodů:
- metoda má vysokou citlivost (10–6 až 10–7),
- problematiku falešných výsledků lze vyřešit kvantitativním přístupem a cut-off hodnotami,
- riziko falešně negativních výsledků lze minimalizovat cestou multimarkerové analýzy,
- metoda je relativně levná a technologicky nenáročná.
V předkládané studii prezentujeme vysokou specificitu markeru LUNX pro nádory plicního původu, což koresponduje s výsledky několika zahraničních studií [17, 18, 19, 20]. Sheu et al, 2006 prokázali vysokou senzitivitu markerů CEA a c-met spolu s CK19 pro detekci MRD v systémové krvi u pacientů s nemalobuněčným karcinomem plic [21]. Vysokou senzitivitu markeru c-met zmiňují také Cheng et al. [22]. Tyto studie však neprováděly stanovení specifity c-met pro plicní karcinomy, kterou jsme v naší práci neprokázali.
Námi pozorovanou stoupající tendenci exprese markeru CEA v kostní dřeni s rostoucím stupněm gradingu pozorovali také Yamashita et al [23]. Dále jsme prokázali podobnou korelaci mezi overexpresí cirkulujícího c-met a postižením lymfatických uzlin jako Cheng et al (22). Výsledky podobné naší analýze exprese markeru LUNX v námi vyšetřovaných kompartmentech nebyly dosud publikovány.
ZÁVĚR
Prokázali jsme dostatečnou senzitivitu a specificitu real-time RT-PCR metodiky pro detekci MRD u pacientů s karcinomem plic.
Marker LUNX je vysoce specificky exprimován v nádorech plicního původu a jeví se jako vhodný marker MRD u pacientů s karcinomem plic v krvi i kostní dřeni. Ke zvýšení senzitivity vyšetření se jeví vhodná multimarkerová analýza za využití LUNX, c-met a CEA.
Stanovení MRD u karcinomu plic je potenciálním prognostickým markerem, prezentované pilotní výsledky je však třeba ověřit delším sledováním většího souboru pacientů.
Práce byla podpořena granty MZ ČR NR NS 10285-3/2009 a CZ.1.05/2.1.00/01.0030.
Prof. MUDr. Jiří Klein, Ph.D. FETCS
Velký Újezd, Tršická 251
783 55 Velký Újezd
e-mail: klein@bnzlin.cz
Sources
1. Depierre A, Milleron B, Moro-Sibilot D, Chevret S, Quoix E, et al. French Thoracic Cooperative Group. Preoperative chemotherapy followed by surgery compared with primary surgery in resectable stage I (except T1N0), II, and IIIa non-small cell lung cancer. J Clin Oncol 2002;20 : 47–53.
2. Pantel K, Von Knebel Doeberitz M. Detection and clinical relevance of micrometastatic cancer cells. Curr Opin Oncol 2000;12 : 95–101.
3. Mori M, Mimori K, Inoue H, et al. Detection of cancer micrometastases in lymph nodes by reverse transcriptase polymerase chain reaction. Cancer Res 1995; 55 : 3417–3420.
4. Benoy IH, Elst H, Philips M, et al. Real-time RT-PCR detection of diseminated tumour cells in bone marrow has superior prognostic significance in comparison with circulating tumour cells in patients with breast cancer. Br J Cancer 2006;94,672–680.
5. Duda M, Vysloužil K, Skalický P, et al. Minimální reziduální choroba u kolorektálního karcinomu – nový prognostický marker v onkochirurgii. Slovenská chirurgie 2006 : 16–22.
6. Wong IHN, Yeo W, Cachn, AT, et al. Quantitative relationship of the circulating tumor burden assessed by reverse transcription-polymerase chain reaction for CK19 mRNA in peripheral blood of colorectal cancer patients with Dukeęs stage, serum CEA level and tumor progression. Cancer Lett 2001;162 : 65–73.
7. Lin Y, Chen S, Hsueh S, et al. Lack of correlation betweeen expression of human mammaglobin mRNA in peripheral blood and known prognostic factors for breast cancer patients. Cancer Sci 2003;1 : 99–102.
8. Bustin SA. Absolute quantification of mRNA using real-time reverse transcription polymerase chain reaction assai. J Mol Endocrinology 2000;25 : 169–193.
9. Bustin SA. Quantification of mRNA using real-time reverse transcription PCR (RT-PCR): trends and problems. J Mol Endocrinology 2002;29 : 23–39.
10. Hagenbeek A. Minimal residual disease in leukemia: state of the art. Leukemia 1992;6 : 12–16.
11. Černý J, et al. Význam minimální reziduální nemoci a metody jejího stanovení u pacientů s některými hematologickými malignitami. Klin Onkol 2003;16 : 41–48.
12. Mocellin S, et al. Circulating tumor cells: the leukemic phase of solid cancers. Trends in Mol Med 2006,12 : 130–139.
13. Rosenberg R, Nekarda H, Thorban S, et al. Minimal residual disease in gastrointestinal tumors: tumor cell detection in bone marrow, blood and lymph nodes. Acta Med Austriaca 2002;29 : 42–53.
14. Srovnal J. Minimální reziduální choroba u solidních nádorů. Disertační práce. UP Olomouc 2009.
15. Uen Y, Lu CH, Tsai H, et al. Persistant presence of postoperative circulating tumor cell is a poor prognostic factor for patients with stage I-III colorectal cancer after curative resection. Ann Surg Oncology 2008;8 : 2120–2128.
16. Thomasson M, Hedman H, Guo D, et al. LRIG1 and epidermal growth factor receptor in renal cell carcinoma: a quantitative RT -PCR and immunohistochemical analysis. Br J Cancer 2003; 89 : 1285–1289.
17. Iwao K, Watanabe T, Fujiwara Y, et al. Isolation of a novel human lung-specific gene, LUNX, a potential molecular marker for detection of micrometastasis in non-small-cell lung cancer. Int J Cancer 2001;91 : 433–437.
18. Wallace MB, Block MI, Gillanders W, et al. Accurate molecular detection of non-small cell lung cancer metastases in mediastinal lymph nodes sampled by endoscopic ultrasound-guided needle aspiration. Chest 2005;127 : 430–437.
19. Cheng M, Chen Y, Yu X, et al. Diagnostic utility of LunX mRNA in peripheral blood and pleural fluid in patients with primary non-small cell lung cancer. BMC Cancer 2008;8 : 156–167.
20. Lv M, Wu M-Z, Zhao Y-J, et al. Expression and clinical significance of lung-specific X protein mRNA in bronchial brushing specimens from patients with or without lung cancer. Respirology 2011;16 : 1076–1080.
21. Sheu Ch-Ch, Chang M-Y, Chang H-Ch et al. Combined detection of CEA, CK-19 and c-met mRNAs in peripheral blood: A highly sensitive panel for potential molecular diagnosis of non-small cell lung cancer. Oncology 2006;70 : 203–211.
22. Cheng T-L, Chang M-Y, Huang S-Y, et al. Overexpression of circulating c-met messenger RNA is significantly correlated with nodal stage and early recurrence in non-small cell lung cancer. Chest 2005;128 : 1453–1460.
23. Yamashita J-I, Matsuo A, Kurusu Y, et al. Preoperative evidence of circulating tumor cells by means of reverse transcriptase-polymerase chain reaction for carcinoembryonic antigen messenger RNA is an independent predictor of survival in non-small cell lung cancer: A prospective study. J Thorac Cardiovasc Surg 2002;124 : 299–305.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2012 Issue 4-
All articles in this issue
- GIST: Novodobé poznatky a léčebné modality
- Kvalita života je důležitým faktorem indikační rozvahy u nemocných s pokročilým karcinomem pankreatu – multicentrická prospektivní studie
- Biomarkery detekce minimální systémové diseminace u nemocných s karcinomem plic
- Prevence parastomální hernie primoimplantací síťky laparoskopicky – první zkušenosti
- Klinické prognostické faktory kolorektálního karcinomu po jeho radikální léčbě
- Laparoskopická adrenalektomie – indikace a selekční kritéria
- Retroperitoneoskopická adrenalektomie dorzálním přístupem
- Extragastrointestinální stromální tumor (EGIST)
- McKittrick-Wheelockov syndróm: Komplikácia mucinózneho adenómu rekta
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- GIST: Novodobé poznatky a léčebné modality
- Laparoskopická adrenalektomie – indikace a selekční kritéria
- Prevence parastomální hernie primoimplantací síťky laparoskopicky – první zkušenosti
- Extragastrointestinální stromální tumor (EGIST)
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

