-
Medical journals
- Career
Rozdílný dopad laparoskopického a laparotomického přístupu na imunitní odpověď navozenou chirurgickým zákrokem
Authors: L. Sákra; H. Lotková *; L. Kohoutek; J. Šiller
Authors‘ workplace: Fakulta zdravotnických studií Univerzity Pardubice, Chirurgická klinika Krajské nemocnice Pardubice a. s., přednosta: doc. MUDr. J. Šiller, Ph. D. ; Ústav fyziologie, Lékařská Fakulta Univerzity Karlovy, Hradec Králové přednostka: prof. MUDr. Z. Červinková, CSc. *
Published in: Rozhl. Chir., 2011, roč. 90, č. 6, s. 324-328.
Category: Monothematic special - Original
Overview
Úvod:
V posledním desetiletí došlo k zavedení laparoskopického přístupu k operacím malignit trávicího ústrojí. Tento postup se stává rutinní metodou. Jsou prokázány lepší krátkodobé výsledky laparoskopického postupu a srovnatelné výsledky dlouhodobé. Též dochází k výzkumu ovlivnění celkové a lokální imunity. V současné době se zdá prokazatelné menší atterace celkové imunitní reakce po laparoskopických výkonech. V oblasti lokální imunity jsou práce zatím pouze experimentální a výsledky nejsou jednotné.Cíl:
Podat literární přehled o vlivu operačního výkonu na systémovou a lokální imunitní odpověď a zaměřit se blíže na srovnání změn imunitní odpovědi po laparoskopickém a laparotomickém výkonu.Review:
Autoři podávají přehled současných znalostí a studií zabývajících se ovlivněním imunity operačním výkonem. Tento přehled je rozdělen na oblast celkové a lokální imunity. Detailně je zpracována role makrofágů v závislosti na typu operačního výkonu. Kriticky jsou rozebrány výsledky uvedených experimentálních prací a jejich eventuální dopad na klinickou praxi.Závěr:
Většina studií podporuje hypotézu, že laparoskopický postup vede k menší systémové imunosupresi, a tudíž menšímu riziku šíření nádorového onemocnění. Jaký je dopad laparoskopie ve srovnání s laparotomickým přístupem na lokální imunitní odpověď však doposud není vyřešeno.Klíčová slova:
peritoneální mikrofágy – lokální imunita – laparoskopieÚVOD
Výhody laparoskopických postupů jsou všeobecně známy(menší spotřeba analgetik, kratší doba hospitalizace, kratší doba trvání pooperačního ileu, dřívější normalizace plicních funkcí), přijímány a potvrzeny mnohými randomizovanými studiemi [1, 2]. Laparotomie a chirurgický výkon obecně je provázen potlačením systémových imunitních reakcí a to nejméně po dobu 5–7 dní po operaci. Závažnost útlumu imunitních funkcí koreluje s rozsahem chirurgického výkonu vyvolávajícím stresovou reakci. Naproti tomu laparoskopie s přítomným kapnoperitoneem je prokazatelně spjata s menší systémovou imunosupresí u experimentálních modelů i u lidí [3, 4].
Incidence maligních onemocnění trávicího ústrojí, zejména malignit tlustého střeva, se zvyšuje. Při léčbě těchto onemocnění je kladen důraz nejenom na prodloužení života pacientů, ale též na zlepšení kvality jejich života. Použití miniinvazivní (laparoskopické) techniky při chirurgické léčbě karcinomu tlustého střeva je vedeno touto snahou zároveň se zachováním požadavku potřebné onkologické radikality. V současné době dochází celosvětově k zavádění miniinvazivních operací nádorů tlustého střeva jako standardního postupu. Nicméně prozatím zůstává nezodpovězeno, zda prevence systémové imunosuprese při použití laparoskopického přístupu může mít až tak významný dopad na rychlost hojení po chirurgickém zákroku a zlepšení dlouhodobých výsledků operací pro nádorová onemocnění. Řada autorů považuje za podpůrný argument pro použití laparoskopického přístupu u nádorových onemocnění prokázaný přímý vztah mezi útlumem imunitní odpovědi a zhoršenými krátkodobými i dlouhodobými výsledky operací u imunosuprimovaných pacientů [5, 6]. U pacientů, kteří dostávali v perioperačním období krevní transfuze, jež snižují buňkami zprostředkovanou imunitní reakci, jsou prokázaně horší dlouhodobé výsledky léčby nádorů trávicího ústrojí [7]. Pochybnosti o vhodnosti laparoskopického přístupu u maligních onemocnění se snaží vyvrátit studie prováděné v USA a v Evropě. Navzdory výše uvedeným výhodám laparoskopických postupů experimentální práce z posledních let však poukazují na to, že lokální imunitní odpověď, prezentovaná především peritoneálními makrofágy, je při laparoskopických operacích více alterována ve srovnání s laparotomickými „klasickými“ postupy. Zatím pouze studie na zvířatech vedou k předpokladu, že existuje přímo úměrný vztah mezi stupněm pooperační celkové a lokální imunosuprese a stupněm progrese tumoru. Lze spekulovat, že pokud by docházelo k útlumu aktivity peritoneálních makrofágů při laparoskopickém přístupu, mohlo by to zhoršovat celkové onkologické výsledky laparoskopicky prováděných operací u malignit zažívacího traktu [4].
CÍL
Podat literární přehled o vlivu operačního výkonu na systémovou a lokální imunitní odpověď a zaměřit se blíže na srovnání změn imunitní odpovědi po laparoskopickém a laparotomickém výkonu.
REVIEW
Systémová imunitní odpověď
– Produkce cytokinů
Chirurgické trauma vyvolává zánětlivou odpověď, která je provázena produkcí cytokinů podporujících zánětlivou reakci (prozánětlivé cytokiny IL1ß, IL-6, IL-8, TNFα aj.). Cytokiny produkované v místě zánětu se při větším rozsahu zánětlivé reakce dostávají do oběhu a stimulují v játrech produkci sérových proteinů akutní fáze, které se podílejí na modulaci imunitní odpovědi. Další cytokiny a mediátory uvolňované během rozsáhlejší reakce působí i na kostní dřeň, kde dochází k vyplavení a novotvorbě dalších leukocytů [8]. Nejspecifičtější zvýšení jako odraz reakce na chirurgické trauma vykazuje IL6 a též CRP (C reaktivní protein). Byla provedena celá řada studií porovnávající úroveň systémové imunitní odpovědi pomocí hladiny cytokinů a CRP po otevřené a laparoskopické cholecystektomii, fundoplikaci a v poslední době i po kolorektálních operacích. V řadě z nich byla zjištěna signifikantně vyšší sérová koncentrace těchto markerů po otevřených operacích [5, 6]. Toto zvýšení ovšem ve většině studií bylo detekovatelné pouze krátkodobě, 1–6 hodin po operaci. Další práce dokonce tyto výsledky popírají a uvádějí, že není žádný statisticky významný rozdíl v sérové hladině markerů systémové zánětlivé odpovědi po jednotlivých typech výkonů včetně kolorektálních resekcí [9, 10]. To může být způsobeno velkou heterogenitou ve skupinách pacientů zařazených do studií. Především délka minilaparotomie u laparoskopického postupu, TNM, grading tumoru, počet krevních transfuzí a postup prováděné operace mají příliš velký rozptyl v porovnávaných skupinách, než aby srovnání laparoskopického a otevřeného postupu mohlo přinést významnější rozdíly.
Hodnocení systémové imunitní odpovědi po laparoskopických a otevřených operacích na základě produkce cytokinů se tak jeví jako diskutabilní, mohou být nalézány prokazatelné rozdíly, ty jsou však přechodné. Navíc zvýšená produkce cytokinů a proteinů akutní fáze sice bývá provázena vyšším výskytem infekčních komplikací a zvyšuje celkovou morbiditu pacientů, avšak nevypovídá o stavu a připravenosti imunitního systému. Proto je v současné době pro hodnocení celkové imunitní reakce po chirurgickém zákroku pozornost spíše upřena na změny v bunečně zprostředkované imunitní odpovědi. Rovněž sledování lokální imunitní reakce v peritoneální dutině by mohlo rozšířit přehled změn v imunitní odpovědi po operačních výkonech [11], neboť produkce cytokinů v oblasti operačního zákroku stoupá výrazněji než produkce systémová.
– Buněčná imunita
Pooperačně v závislosti na rozsahu chirurgického traumatu dochází ke zvýšení počtu leukocytů, neutrofilů a ke snížení počtu lymfocytů [12]. Po otevřených operacích ve srovnání s laparoskopickým postupem byl zaznamenán větší a déle trvající pokles lymfocytů [9, 10]. Funkce lymfocytů posuzovaná na základě jejich stimulace mitogenem byla také snížena [13, 14]. Pokles lymfocytů může být přisuzován snížení počtu T-lymfocytů CD4+ [15].
Buněčné imunitní reakce jsou souborem navazujících a vzájemně se ovlivňujícich reakcí a vztahů jednotlivých typů buněk. Většina CD4+ buněk jsou prekurzory pomocných T-lymfocytů (TH), zatímco CD8+ buňky představují cytotoxické a supresorové T-lymfocyty. TH1 a TH2 lymfocyty patří k CD4+ buňkám a odlišují se na základě hlavních cytokinů, které produkují. TH1 lymfocyty tvoří IL-2, interferon-α a tumor necrosis factor. Hlavní funkcí TH1 buněk je spolupráce s makrofágy. Intracelulární infekce vyžadují aktivaci makrofágů závislou na Th1 buňkách, které následně navozují buněčně zprostředkovanou imunitní odpověď. TH1 buňky mají významnou úlohu v eliminaci nádorových buněk [16]. TH2 buňky produkují IL-4, IL-5, IL-6, IL-10 a IL-13, stimulují proliferaci a diferenciaci B-lymfocytů a indukují tak protilátkovou odpověď. Extracelulární původci infekcí jsou optimálně potlačovány protilátkami, proto je odpověď závislá na Th2 lymfocytech. O tom, zda se prekurzorové TH buňky budou vyvíjet směrem k TH1 nebo TH2, rozhoduje, zda imunitní odpověď začne u makrofágů, které produkují cytokin IL-12, výrazný diferenciační faktor TH1, nebo zda dochází ve větší míře k produkci IL-4 hlavně bazofily a mastocyty a následné diferenciaci TH2. Analogicky s výše popsaným poklesem T-lymfocytů CD4+ dochází pooperačně i k poklesu poměru Th1 a Th2 lymfocytů a k následnému útlumu buněčně zprostředkované imunity [12]. Dysbalance v poměru Th1 a Th2 lymfocytů a cytokinů, které produkují, má významný dopad na rozvoj infekčních aj. onemocnění [17].
Th1 lymfocyty také zprostředkovávají opožděný typ imunitní odpovědi. Vyšetření opožděného typu imunitní reakce se používá k testování buněčně zprostředkované imunitní funkce za použití vhodného antigenu. V současné době je prováděna řada studií, které mapují vliv otevřeného nebo laparoskopického výkonu na tento typ imunitní reakce. I když některé výsledky zatím přesvědčivě neukazují, že by určitý typ operačního výkonu tuto imunitní odpověď ovlivňoval více [18], zdá se, že by laparoskopie mohla vést k mírnějšímu útlumu opožděné imunitní reakce ve srovnání s laparotomickým přístupem. Jako výhoda laparoskopického přístupu se tak jeví menší míra ovlivnění T-lymfocytů [19], která může být příčinou poškození obranných mechanismů proti patogenům a zvýšeného rizika infekcí a septických komplikací v pooperačním období.
Lokální imunitní odpověď
Paralelně se studiem dopadů operačního zákroku na systémovou imunitní reakci je nyní zkoumán i vliv typu operačního výkonu na lokální imunitu v peritoneální oblasti. Intraabdominální chirurgický zákrok navozuje aktivaci peritoneálních makrofágů, které představují hlavní populaci imunitních buněk v peritoneální oblasti. Makrofágy (Obr. 1, 2) hrají velmi důležitou roli v buněčné imunitě. Pomocí exprese hlavního histokompatibilního komplexu aktivují T specifické lymfocyty, mají schopnost fagocytózy, tvorby cytotoxických molekul a lýzi tumorózních buněk. Produkují řadu cytokinů (IL-1, TNFα, IL-6, IFα) a metabolitů (peroxid vodíku, superoxidový anion, NO). Experimentální práce na zvířatech se snaží zodpovědět, zda je lokální imunitní odpovědět alterována spíše laparoskopickým nebo laparotomickým přístupem. Peritoneální makrofágy jsou proto izolovány z abdominální dutiny, kultivovány a jsou hodnoceny parametry, které svědčí pro aktivitu makrofágů (fagocytóza, produkce cytokinů a metabolitů).
Image 1. Soubor makrofágů v mikroskopu s fázovým kontrastem Fig. 1. Population of macrophages in a phase contrast microscope 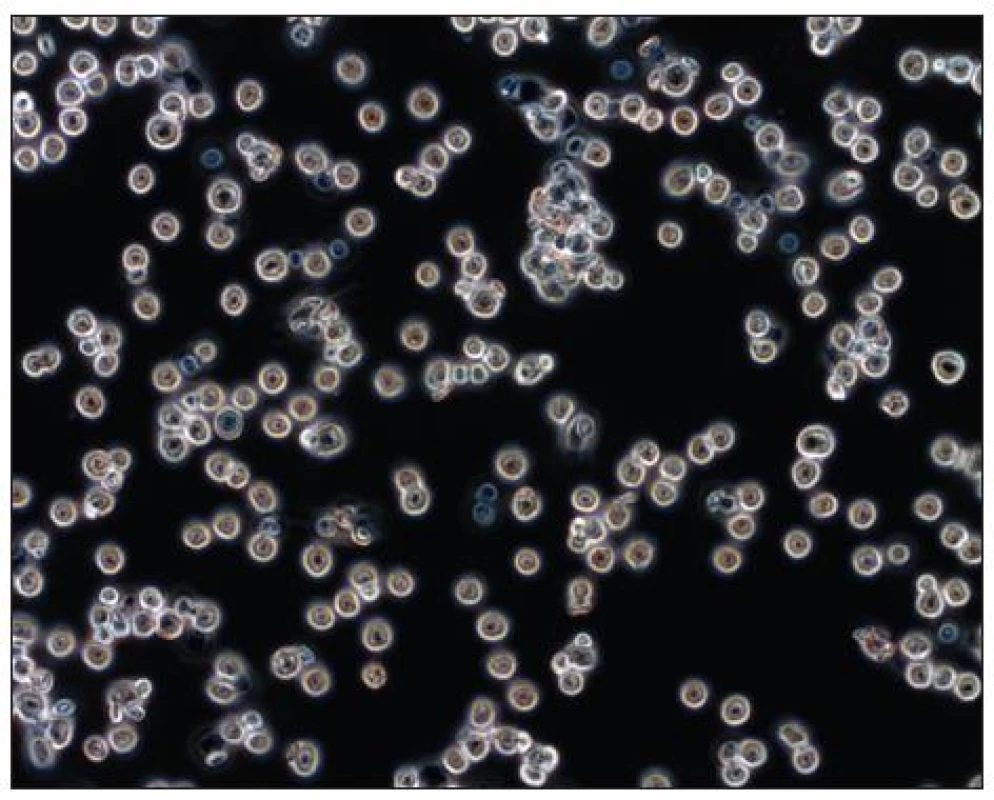
Image 2. Soubor makrofágů v mikroskopu Fig. 2. Population of macrophages in a microscope 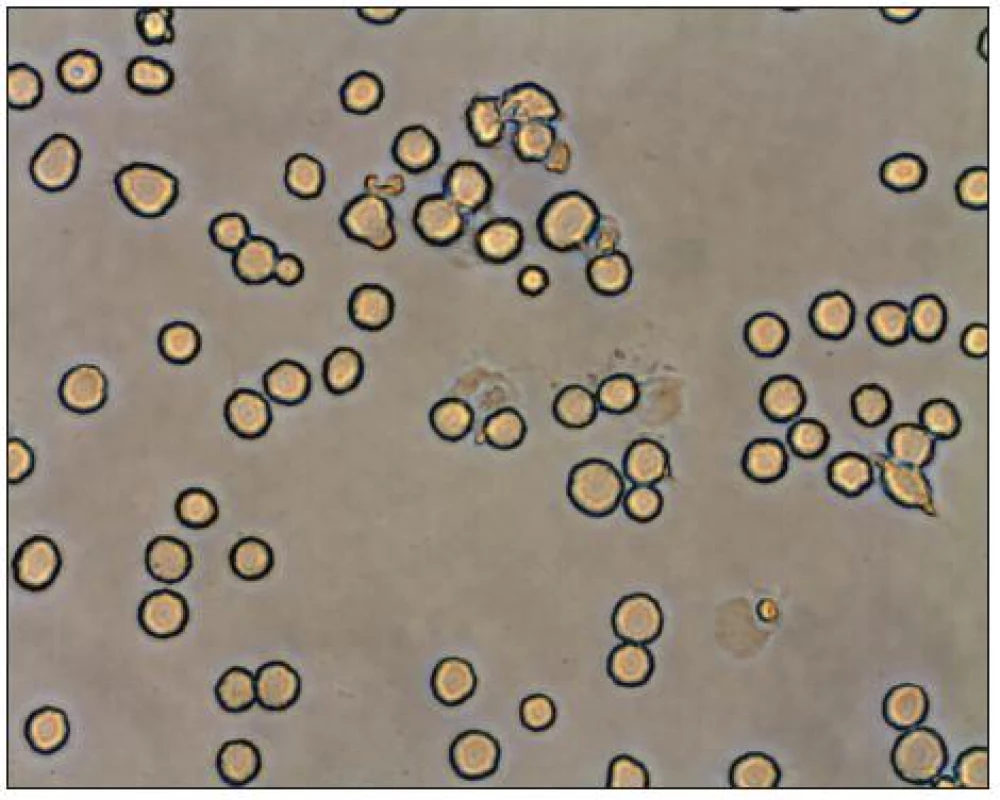
Výsledky prací však často přinášejí nálezy, jejichž interpretace má řadu úskalí.
Fagocytóza
Jen omezené množství prací sledovalo fagocytární aktivitu peritoneálních makrofágů ovlivněných chirurgickým výkonem. Snížení fagocytární aktivity peritoneálních makrofágů bylo prokázáno 1 hodinu po výkonu bez ohledu na chirurgický přístup [20]. 24 hod. po zákroku bylo snížení pozorováno pouze v případě laparotomie [21].
Produkce cytokinů
Více se práce věnují hodnocení produkce cytokinů a metabolitů. Aktivita makrofágů nemusí být měřena pouze za bazálních podmínek, tj. po izolaci z peritoneální dutiny bez následné stimulace, ale také po stimulaci izolovaných makrofágů (velmi často se používá lipopolysacharid – LPS). Lze tak do jisté míry posuzovat v in vitro podmínkách schopnost makrofágů reagovat na imunitní podnět, o čemž bazální sekrece tolik nevypovídá. V případě velmi často sledovaného prozánětlivého cytokinu TNF dochází ke změnám jeho produkce v závislosti na délce intervalu od provedeného zákroku a zda je hodnocena bazální produkce nebo produkce stimulovanými makrofágy. 1 hodinu po výkonu byla jeho tvorba signifikantně zvýšená u laparotomického přístupu, po stimulaci LPS došlo ke zvýšení produkce u skupiny s insuflací CO2 [20]. V dalších intervalech – 4, 12 a 24 hodiny po výkonu byla naopak produkce TNF stimulovanými makrofágy u laparotomie nižší ve srovnání s laparoskopickým přístupem [22]; obdobný nález byl i v případě prozánětlivého IL-6 [22]. Útlum TNF makrofágy stimulovanými LPS je přisuzován účinku CO2, který byl pozorován i v případě IL-1. Inhibiční účinek CO2 na produkci cytokinů byl navíc zaznamenán nejen po laparoskopii, ale i po torakoskopii [22], inhibice měla však pouze přechodný charakter [22]. Útlum produkce cytokinů je vysvětlován acidifikací vlivem CO2. Na kulturách makrofágů bylo však zjištěno, že acidifikace může vést ke zvýšení fagocytární aktivity.
Produkce metabolitů
Experimenty se věnují i hodnocení metabolických markerů aktivity makrofágů. Některé výsledky naznačují snížení metabolické aktivity po laparotomii, nikoli po laparoskopii. U laparotomované skupiny byla pozorována i snížená exprese histokompatibilního komplexu makrofágy, což může omezovat schopnost prezentace antigenu. Může však vznikat rozdíl ve výsledcích, pokud jsou parametry hodnoceny za bazálních podmínek nebo po stimulaci makrofágů. Bazální produkce NO peritoneálními makrofágy se zvýšila za 24 hodin vlivem zákroku oproti neoperované kontrole, mezi laparotomickým a laparoskopickým přístupem se ale signifikantně nelišila nebo byla vyšší po laparoskopii. Pokud byla produkce hodnocena u stimulovaných makrofágů, po laparoskopii bylo zvýšení výrazně omezeno.
Na základě hodnocení některých vybraných parametrů aktivity makrofágů, které práce obsahují, je možné provádět spíše spekulativní úvahy o jejich dopadu na pooperační vývoj imunitní reakce. Pokles produkce cytokinů stimulovanými makrofágy po laparoskopickém zákroku např. vzbuzuje obavy, zda se tím nezvyšuje riziko infekčních komplikací či peritoneálních metastáz. Na druhou stranu pokles produkce prozánětlivých mediátorů stimulovanými makrofágy může být chápán jako výraz určité tolerance vůči bakteriím aj. noxám a zlepšené šance na přežití při septických komplikacích. Nadprodukce některých cytokinů a metabolitů makrofágy totiž nemusí být pouze výrazem zvýšené imunitní pohotovosti, ale může také vést až k lokální imunosupresi a dokonce k poškozování vlastního organismu. K objasnění těchto problémů jsou jistě zapotřebí další studie, které by navíc sledovaly nejen změny v doposud obvyklých 1–24 hodinách, ale i delších časových intervalech.
ZÁVĚR
Uvedené a známé výhody miniinvazivního postupu (menší spotřeba analgetik, nižší výskyt pooperačních komplikací, dřívější obnova plicních funkcí a střevní pasáže) v bezprostředním pooperačním období jsou zřejmé a dnes již zcela nezpochybnitelné. Experimentání i klinická data podporují teorii, že imunitní systém a zejména T-lymfocyty mají velký význam přirozené obranyschopnosti proti tumorům. Zánětlivá odpověď, která doprovází každý chirurgický výkon, může vést k vyčerpání či ovlivnění imunitních zdrojů, a tím i ke zhoršení rezistence organismu k nádorovému bujení. Většina studií podporuje hypotézu, že laparoskopický postup vede k menší systémové imunosupresi, a tudíž menšímu riziku šíření nádorového onemocnění. Jaký je dopad laparoskopie ve srovnání s laparotomickým přístupem na lokální imunitní odpověď však doposud není vyřešeno. Ačkoliv se zdá, že by laparoskopie mohla mít tlumivý efekt na metabolickou aktivitu makrofágů či produkci cytokinů stimulovaných škodlivou noxou, útlum fagocytózy významné pro likvidaci patogenů nebyl potvrzen. Nicméně jedná se o omezené množství experimentálních prací studujících některé vybrané parametry, které prozatím dovolují pouze spekulativní úvahy.
V případě potvrzení předpokladu, že laparoskopie s doprovodným kapnoperitonem může inhibovat aktivitu peritoneálních makrofágů, by bylo vhodné se znovu zamyslet nad možným ovlivněním dlouhodobých výsledků laparoskopického řešení malignit trávicího ústrojí. Míru alterace lokální imunity a její význam pro peritoneální perioperační diseminaci nádoru a jiné možné komplikace navozené laparoskopickým postupem bude nutné ještě ozřejmit v dalších studiích.
Práce je zpracovávána za podpory MZ ČR IGA č. NS9649-3.
MUDr. L. Sákra, Ph.D.
Chirurgická klinika, Krajská nemocnice Pardubice a.s.
Kyjevská 44
532 03 Pardubice
Sources
1. Fleschamn, J. W., Nelson, H., Peters, W. E. Early results of laparoscopic surgery for colorectal cancor. Retrsopective analysis of 372 patients treated by Clinic Outcomes of Surgical Therapy (COST) Study Group. Dis. Colon Rectum, roč. 1996, č. 39 (Suppl. 10), s. 53–58.
2. Lacy, A. M., Garcia-Valdecasas, J. C., Delgado, S. Laparoscopy-assisted colectomy versus opn colectomy for treatment of non-metastatic colon cancer: a randomized trial. Lancet, roč. 2002, č. 359, s. 2224–2229.
3. Lee, S. W., Feingold, D. L., Carter, J. J., Zhai, C., Stapleton, G., Gleason, N., Whelan, R. L. Peritoneal macrophage and blood monocyte functions after open and laparoscopic-assisted cacectomy in rats. Surg. Endosc., roč. 2003, č. 17, s. 1996–2002.
4. Brune, I. B., Wilke, W., Hensler, T., Holzmann, B., Siewert, J. R. Down regulation of T helper type 1 immune response and altered pro-inflammatory and anti-inflammatory T cell cytokine balance following convetional but not laparoscopic surgery. Am. J. Surg., roč. 1999, č. 177, s. 55–60.
5. Sietses, C., Wiesner, M. J., Eijsbouts, Q. A. A prospective randomized study of the systemic immune response after laparoscopic and conventional Nissen Fundoplication. Surgery, roč. 1999, č. 126(1), s. 5–9.
6. Leung, K. L., Lai, P. B., Ho, R. L. Systemic cytokine response after laparoscopic-assisted resection of rectosigmoid carcinoma: a prospective randomized trial. Ann. Surg., roč. 2000, č. 231(4), s. 506–511.
7. Foster, R. S., Costanza, M. C., Foster, J. C. Averse relationship between blood transfusions and surfoval after colectomy for colon cancor. Cancer, roč. 1985, č. 55, s. 1195–1201.
8. Lee, S. W., Whelan, R. Seminars in Colon and Rectal Surgery, roč. 1999, č. 10(2), s. 74–84.
9. Mehigan, B. J., Hartely, J. E., Drew, P. J. Changes in T cell subsets, interleukin-6 and C-reactive protein after laparoscopic and open colorectal resction for malignancy. Surg. Endosc., roč. 2001, č. 15(11), s. 1289–1293.
10. Tang, C. L., Eu, K. W., Tai, B. C. Randomized clinical trial of the effect of open versus laparoscopically assisted colectomy on systemic imunity in patiens with colorectal cancer. Br. J. Surg., roč. 2001, č. 88(6), s. 801–807.
11. Jansson, K., Redler, B., Truedsson, L., Magnuson, A., Matthiessen, P., Andersson, M., Norgren, L. Intraperitoneal cytokine response after major surgery: higher postoperative intraperitoneal versus systemic cytokine levels suggest the gastrointestinal tract As the major source of the postoperative inflammatory reaction. The Am. J. Surg., roč. 2004, č. 18, s. 372–377.
12. Lennard, T. W., Shenton, B. K., Borzotta, A., Donnelly, P. K., White, M., Gerrie, L. M., Proud, G., Taylor, R. M. The influence of surgical operations on components of the human immune system. Br. J. Surg., roč. 1985, č. 72, s. 771–776.
13. Shafir, M., Bekesi, J. G., Papetestas, A., Slater, G., Aufses, A. H. jr. Preoperative and postoperative immunological evaluation of patiens with colorectal cancer. Cancer, roč. 1980, č. 40, s. 700–705.
14. Nakata, Y., Nabeya, K., Hanačka, T., Kaku, C., Komára, O., Kobayashi, H. Influence of surgicala stress of esophageal cancer on cell mediated imunity: comparison with surgical stress of Bystric cancer. Jpn J. Gastroenterol. Surg., roč. 1993, č. 26, s. 1204–1210.
15. Katano, M., Nafuko, F., Yamamoto, H., Hisatsugu, T., Tadano, L. Effect of operation on host cell imunity. Biotherapy, roč. 1993, č. 7, s. 711–713.
16. Gorelik, L., Prokhorova, A., Mokyr, M. B. Low-dose melpharan-induced shift in the production of a Th2-type cytokine to a Th1-type cytokine in mice bearing a large MOPC-315 tumor. Cancer Immunol. Immunother., roč. 1994, č. 39, s. 117–126.
17. Clerici, M., Shearer, G. M. A Th1 to Th2 switch is a critical step in the etiology of HIV infection. Immunol Today, roč. 1992, č. 14, s. 107–111.
18. Mendoza-Sagaon, M., Kutka, M. F., Talamini, M. A. Laparoscopic Nissen fundoplication with carbon dioxide pneumoperitoneum preserves cell-mediated immunity in a immature animal model. J. Pediatr. Surg., roč. 2001, č. 36(10), s. 1564–1568.
19. Brune, I. B., Wilke, W., Hensler, T. Down regulation of T helper type 1 immune response and altered pro-inflamatory and anti-inflammatory T cell cytokine balance following conventional but not laparoscopic surgery. Am. J. Surg., roč. 1999, č. 177(1), s. 55–60.
20. Moehrlen, U., Schwöbel, F., Reichmann, E., Stauffer, U., Gitzelmann, C. A., Hamacher, J. Early peritoneal macrophage function after laparoscopic surgery compared with laparotomy in a mouse model. Surg. Endosc., roč. 2005, č. 19, s. 958–963.
21. Schmelzer, T. M., Heth, J. J., Hope, W. W., Mostafari, A., Novitsky, Y. W., Heniford, B. T. The effect of preoperative corticosteroids on peritoneal macrophage function after laparoscopic and open abdominal surgery in a rat model. AM J. Surg., roč. 2008, č. 196, s. 920–925.
22. Novitsky, Y. W., Czerniach, D. R., Kaban, G. K., Berger, A., Gallagher, K. A., Perugini, R. A., Litin, D. E. M. Surgery, roč. 2006, č. 139, s. 39–45.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2011 Issue 6-
All articles in this issue
- Přínos molekulární biologie v diagnostice a léčbě kolorektálního karcinomu – současnost a budoucnost
- Rozdílný dopad laparoskopického a laparotomického přístupu na imunitní odpověď navozenou chirurgickým zákrokem
- Cholecystoduodenálna fistula ako dôsledok kalkulóznej cholecystitídy pacientky vysokého veku (Kazuistika)
- Minimální uzlinové postižení u karcinomu žaludku – pilotní výsledky multicentrické studie
- Výsledky léčby nemocných s toxickým megakolon
- Prínos vyšetrenia sentinelovej uzliny pri včasnom karcinóme prsníka
- Prediktivní faktory postižení nonsentinelových uzlin u karcinomu prsu – závěry české multicentrické studie sentinelových uzlin
- DCIS a biopsia sentinelovej uzliny
- 55 laparoskopických cholecystektomií jednoincizním laparoskopickým přístupem – iniciální zkušenosti
- Zlomeniny členkovej kosti u detí
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Výsledky léčby nemocných s toxickým megakolon
- DCIS a biopsia sentinelovej uzliny
- Zlomeniny členkovej kosti u detí
- Prínos vyšetrenia sentinelovej uzliny pri včasnom karcinóme prsníka
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

