-
Medical journals
- Career
Pozdní chirurgická konverze po endovaskulární léčbě aneuryzmatu břišní aorty
Authors: R. Janoušek; T. Daněk 1; A. Krajina 2; Miroslav Lojík 2; V. Chovanec 2
Authors‘ workplace: Základna radiodiagnostiky a intervenční radiologie, Institut klinické a experimentální medicíny Praha, přednosta: prof. MUDr. J. H. Peregrin, CSc. ; Chirurgická klinika, Pardubická krajská nemocnice a. s., přednosta: doc. MUDr. J. Šiller, Ph. D. 1; Radiologická klinika, Fakultní nemocnice Hradec Králové, přednosta: prof. MUDr. P. Eliáš, CSc. 2
Published in: Rozhl. Chir., 2011, roč. 90, č. 10, s. 549-553.
Category: Monothematic special - Original
Overview
Autoři předkládají kazuistiku dlouhodobého 14letého sledování 66letého muže s aneuryzmatem subrenální břišní aorty léčeného aortouniiliakálním stentgraftem a zkříženým femorofemorálním bypassem s následným rozvojem endoleaků typu Ia, Ib a III. I přes endovaskulární léčbu těchto komplikací docházelo ke zvětšování vaku výdutě a pacient byl poté úspěšně klasicky operován se založením aortobifemorálního bypassu.
Klíčová slova:
aorta – aneuryzma – endoleak – pozdní konverze – stentgraftÚVOD
Endovaskulární přístup je dnes akceptovanou metodou léčby AAA u rizikových nemocných s vhodnou morfologií aneuryzmatu. Jako každá rozvíjející se metoda je zatížena určitými technickými limitacemi a možností selhání. Vždy je nutný individuální přístup ke každému nemocnému se zvážením všech rizik léčby (chirurgické i endovaskulární). Indikace k endovaskulární léčbě (EVL) aneuryzmatu břišní aorty (AAA) jsou shodné s chirurgickou léčbou.
Dlouhodobě probíhající studie prokazují, že EVL je spojena s významně nižší operační mortalitou u pacientů starších 60 let než chirurgický výkon. Nebyly však prokázány rozdíly v dlouhodobé mortalitě obecné nebo vztažené k aneuryzmatu. EVL je navíc spojena se zvýšeným počtem komplikací a reintervencí, náklady této léčby jsou vyšší [1, 2, 3].
Pro svoji nižší třicetidenní letalitu je endovaskulární výkon především vhodný pro pacienty s vyšším rizikem operačního výkonu ASA III a ASA IV [4]. Hlavní specifickou komplikací EVL je zachovalá perfuze vaku aneuryzmatu (endoleak), při kterém může pokračovat růst aneuryzmatu a hrozí tak jeho ruptura. Výskyt endoleaku po EVL AAA je 10–40 % a jejich léčba spočívá v opakovaných endovaskulárních intervencích. Pokud přesto během EVL dochází k progredujícímu zvětšování výdutě je na místě s vědomím zvýšeného rizika indikace ke klasickému chirurgickému výkonu.
KAZUISTIKA
V listopadu 1997 byl 66letý muž s bolestmi břicha hospitalizován ve Fakultní nemocnici v Hradci Králové. Při výpočetní tomografii (CT) břicha bylo diagnostikováno aneuryzma subrenální břišní aorty s příčným průměrem 70 mm. Nemocný měl v anamnéze arteriální hypertenzi a chronickou obstrukční pulmonální chorobu, kouřit přestal v roce 1985.
Při kalibrační angiografii byl potvrzen přechod aneuryzmatu na obě společné iliakální tepny a proximální dobře definovaný krček výdutě o délce 15 mm (podle klasifikace typu výdutí podle studie EUROSTAR se jednalo o aneuryzma typu C). Vzhledem k vyššímu chirurgickému riziku z přidružených onemocnění byla navržena endovaskulární léčba AAA stentgraftem, pro kterou byla v dané době splněna kritéria.
Během prvního endovaskulárního výkonu v listopadu 1997 došlo při úvodu do celkové anestezie k srdeční zástavě a kardiopulmonální resuscitaci. S odstupem 16 dní byl v epidurální anestezii zaveden z levého třísla aorto-uniiliakální stentgraft velikosti 23/17 x 170 mm (ELLA CS Česká republika), provedena okluze společné iliakální tepny vpravo a vytvořen femorofemorální zkřížený bypass.
Pacient byl v další době pravidelně sledován UZ a CT vyšetřeními břicha. V březnu 1998 byl dle CT prokázán perigraft leak kolem proximální části (endoleak Ia), který byl řešen přestentováním proximálního krčku aneuryzmatu stentgraftem 23 x 90 mm (ELLA CS). Stentgraft byl nekrytou částí kotven nad odstup renálních tepen.
V říjnu 2002 CT vyšetření prokázalo zvětšení výdutě na 87 mm a intersegmentární endoleak (typu III) při netěsnosti mezi dvojicí zavedených stentgraftů . Při angiografii se z místa netěsnosti plnila drobná dutina ve vaku dorzálně vlevo s odtokem do lumbální tepny L2.
Tento nález byl řešen endovaskulární embolizací lumbálních tepen spirálkami (Cook) a embolizací vaku endoleaku akrylátovým lepidlem (Histoacryl, Braun, Německo) a utěsněním stentgraftů pomocí dvou balonexpandibilních stentů Palmaz 5014 a 4014 (Cordis, USA).
V srpnu 2003 byla pro netěsnost iliakální nožičky stentgraftu (endoleak Ib) zavedena distální extenze, tubární stentgraft 24/ 22 x 70 mm (ELLA CS).
V dubnu 2004 došlo k dalšímu zvětšení průměru trombozovaného vaku výdutě na 90 mm, bez prokazatelného endoleaku na CT. Při vyčerpání endovaskulárních možností byla i při vysokém operačním riziku vzhledem k hrozící ruptuře vaku AAA navržena chirurgická konverze.
V červnu 2004 byl pacient operován na chirurgické klinice Krajské nemocnice v Pardubicích. Důležité bylo, že implantované balonexpandibilní stenty byly pro intersegmentární endoleak zavedeny cca 2 cm pod odstupy renálních tepen a tudíž byl možný klamp aorty subrenálně přes samoexpandibilní část graftu. Během výkonu chirurg vypreparoval obě renální artérie a těsně subrenálně klampoval aortu i se zavedenými stentgrafty, po otevření vaku výdutě extrahoval distálněji zavedený stentgraft i s periferněji zavedenými Palmaz stenty tak, že kleštěmi přetnul v pořadí druhý zavedený stentgraft v oblasti krčku výdutě (jeho proximální zbytek kotvený nad renální tepny ponechal vzhledem k riziku silného krvácení při poškození stěny suprarenální aorty nebo renálních tepen s následnou ischemií ledvin). Následně obvyklou inkluzivní technikou end to end našil proximální anastomózu aorto-bifemorální rekonstrukce na proximální krček výdutě. Po vypreparování obou třísel s anastomózami femorofemorálního zkříženého bypassu nejprve resekoval anastomické pseudoaneuryzma v pravém třísle a našil end to end pravé raménko protézy na společný terč povrchové a hluboké femorální tepny s ligací společné femorální tepny centrálněji. Vlevo pak našil levé raménko obvyklou technikou end to side na společnou femorální tepnu se zachováním průtoku levé vnitřní iliakální tepny obráceným tokem z třísla přes zevní iliakální tepnu při dobře zavedeném a funkčním okludoru společné iliakální tepny. Operační výkon trval 3,5 hodiny, byl provázen krevními ztrátami do 1 500 ml. Další pooperační průběh byl bez komplikací a pacient byl propuštěn desátý pooperační den do domácí péče. Nyní je sedm let od operace bez potíží.
Image 1. Angiografický nález bezprostředně po zavedení aorto-uniiliakálního stentgraftu Fig. 1. Angiographic image immediate after implantation of aortouniiliac stentgraft 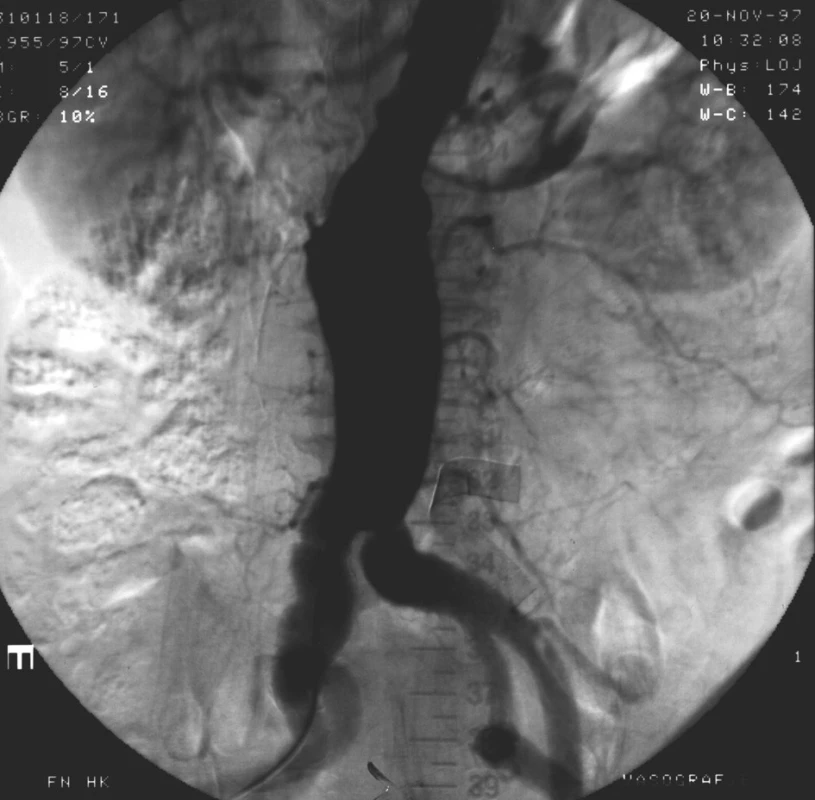
Image 2. 2. Angiografie s průkazem proximálního perigraft leaku (endoleak typu Ia), který byl řešen přestentováním proximálního krčku dalším stentgraftem Fig. 2. Angiography with detection of proximal perigraft leak (endoleak Ia) that was resolved with overstenting of proximal neck using next stentgraft 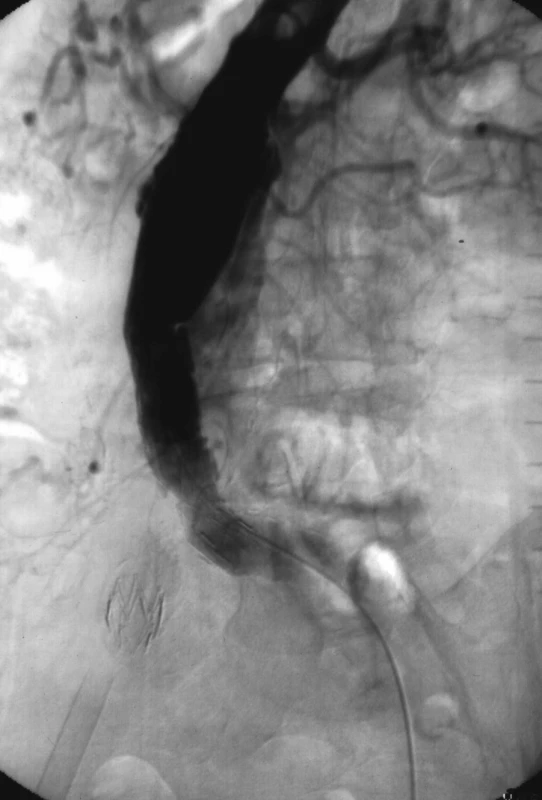
Image 3. Aortografie se intersegmentárním endoleakem typu III s plnící se dutinou ve vaku a odtokem k.l. do lumbálních tepen vlevo Fig. 3. Aortography with intersegmental endoleak III with filling of cavity in sac and outflow via lumbar left arteries 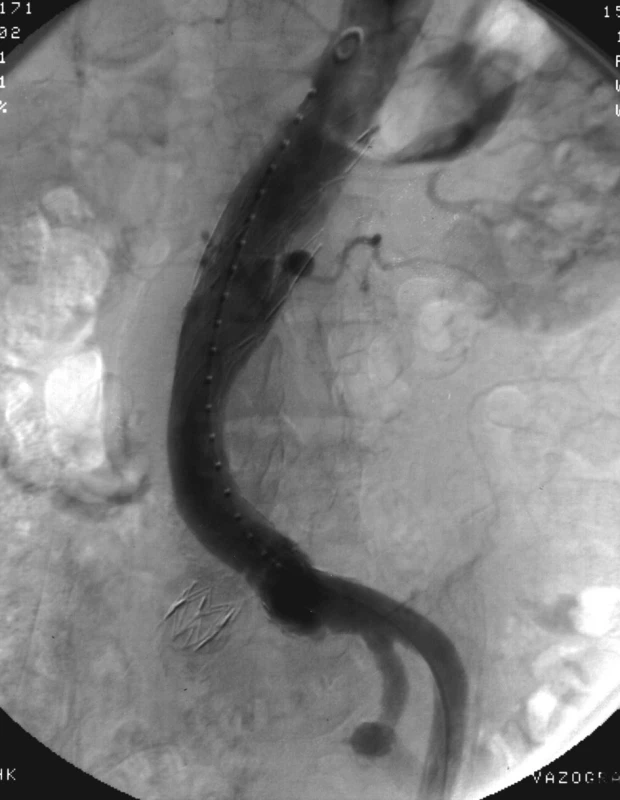
Image 4. Stav po embolizaci vaku endoleaku směsí histoakrylu a lipiodolu a po embolizaci lumbární tepny spirálkami Fig. 4. The condition after embolisation of endoleak with mixture of histoacryl and lipiodol and after embolisation lumbar artery with metallic coils 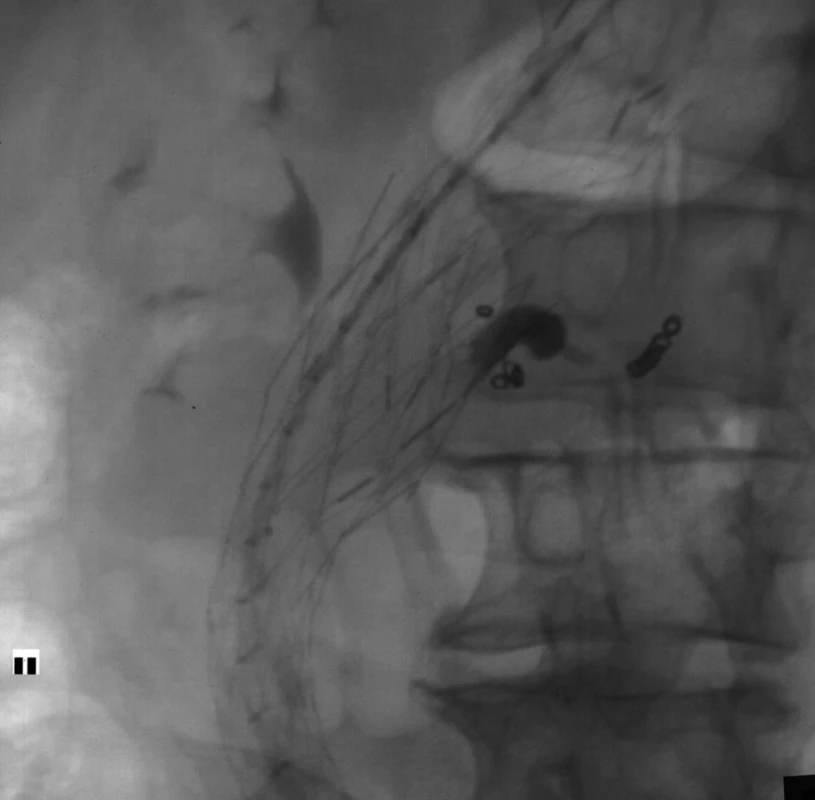
Image 5. Poslední angiografie nově s rozvojem distálního endoleaku Ib ze společné iliacké tepny vlevo Fig. 5. Last angiography with recent development of distal endoleak Ib from left common iliac artery 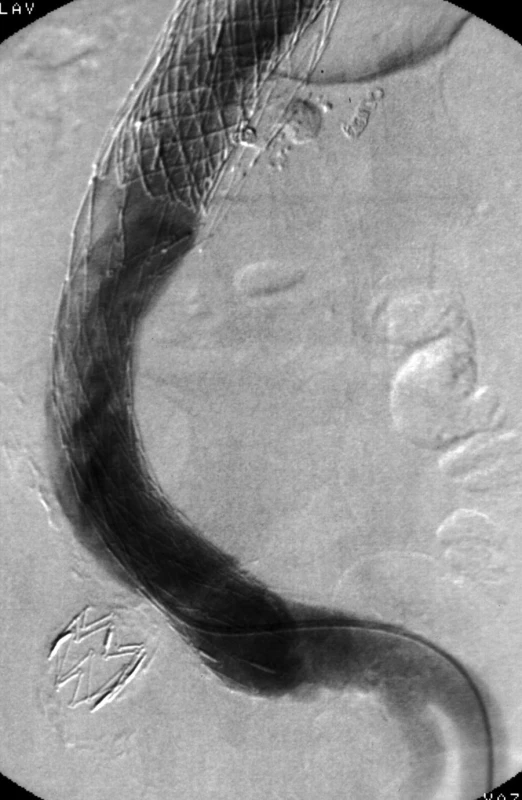
DISKUSE
Standardní léčba AAA nad 5 cm je chirurgická, kdy se provádí z laparotomie resekce výdutě a inkluzivní technikou end to end se nahrazuje postižená část aorty cévní protézou aortoaortálně, aortobiiliakálně nebo aortobifemorálně, pokud přestupuje aneuryzma na společné iliakální arterie.
S rozvojem intervenční radiologie došlo od 90. let minulého století k zavedení endovaskulární léčby AAA, jejíž podstatou je vyřazení vaku výdutě z toku v aortě pomocí potaženého stentu (stentgraftu). Tento přístup je miniinvazivní, je prováděn pouze z chirurgické tomie femorálních tepen a nevyžaduje klamp aorty. Pro možnost zavedení stentgraftu jsou rozhodující vhodné morfologické parametry výdutě, mezi něž patří délka proximálního krčku aneuryzmatu větší než 15 mm a angulace subrenální aorty, tj. úhel podélné osy krčku a podélné osy výdutě do 60° [5]. Technická úspěšnost endovaskulárního výkonu se pohybuje od 85–95 % a závisí na morfologii aneuryzmatu a typu použitého stentgraftu [6].
Kritériem technické úspěšnosti je EVL zavedení a následné uvolnění endovaskulární protézy v požadovaném místě. Očekávaným klinickým výsledkem je v časné fázi učinné přemostění a vyřazení vaku aneuryzmatu z toku krve a dlouhodobě zmenšování trombotizovaného vaku výdutě.
Specifické komplikace EVL [6] jsou komplikace vázané na endovaskulární protézu nebo zaváděcí systém. Tyto mohou nastat akutně během implantace stentgraftu, patří mezi ně především chybné uložení stentgraftu, jeho zalomení, nerozvinutí, migrace, nenasondování kontralaterálního raménka, disekce nebo perforace přístupových tepen a zalomení zavaděče. K dalším komplikacím však může docházet opožděně. Při selhání nebo nemožnosti jejich endovaskulárního řešení komplikací je indikována chirurgická konverze. Indikace pozdní (za více než 30 dní od implantace) chirurgické konverze je především endoluminálně neřešitelný endoleak, který vede ke vzniku toku krve do vaku aneuryzmatu s jeho možným dalším zvětšováním a hrozící rupturou, dále infekce stentgraftu, migrace nebo trombóza [7].
Endoleak [8]je definován jako přetrvávání toku ve vaku výdutě mimo lumen stentgraftu. Dle místa vzniku jsou čtyři typy endoleaků. Prognosticky nejzávažnější jsou endoleaky typu I. a III., kde hrozí vysoké riziko ruptur.
Typ I – perigraft endoleak, vzniká nedostatečným ukotvením stentgraftu, má subtypy Ia a Ib se vznikem v proximálním nebo distálním konci a Ic pokud k toku dochází kolem okludoru v uzavřeném kontralaterálním pánevním řečišti (Námi prezentovaný proximální Ia perigraft endoleak byl způsoben kaudální dislokací nedostatečně fixovaného infrarenálního stentgraftu). Typ III – endoleak představuje netěsnost vlastního stentgraftu, buď rozpojením jeho součástí nebo trhlinou v potahovaném materiálu.
Typ II – retrográdní endoleak je podmíněn retrográdním tokem z lumbálních tepen, dolní mesenterické tepny nebo jiných kolaterálních větví. U tohoto typu je naopak riziko ruptury malé [9] a má být proto léčen jen pokud dochází k další progresi velikosti vaku výdutě.
Incidence pozdní konverze po EVL je v literatuře popisovaná v širokém rozmezí 4–50 %, v závislosti na zkušenostech centra, typu stengraftu, délce a spolupráci při sledování [10].
EUROSTAR registr [11] popisuje kumulativní riziko konverze 2,1 % za rok, v další studii [10] bylo indikováno 29 pozdních konverzí ze 649 pacientů s EVL, s 9% rizikem konverze během 6 let. V recentnější [12] publikaci si během sledování 8 let z 1606 EVL 25 vyžádalo pozdní explantaci, u většiny (76 %) byla současně více než jedna indikace pro odstranění stentgraftu.
Vzhledem k tomu, že výsledky u elektivní konverze jsou podstatně lepší než u akutních výkonů s rupturou (mortalita 3 % oproti 67 %) [11, 12], proto je velmi důležité včasné rozpoznání endoleaku a zvětšování vaku výdutě nebo potvrzení známek infekce. Rozhodující roli v monitoraci pacientů po EVL dnes má multidetektorová výpočetní tomografie [13].
Při chirurgické konverzi je obecně cílem odstranění celého stentgraftu. Podle lokalizace a rozsahu problému a možnému hrozícímu poranění vlastních tkání je však někdy proveden hybridní výkon (tj. ponechání dobře fungující části stentgraftu in situ a našití chirurgické náhrady pouze jeho části) [11]. Tento hybridní postup s ponecháním proximální části stentgraftu byl zvolen i v našem případě. Kromě kompletní konverze se uplatňují další chirurgické postupy k úpravě komplikací EVL. Ty mohou být primární (v době inciální EVL) nebo sekundární. K chirurgickým korekčním výkonům patří ligatura tepny event. laparoskopická (u endoleaku typu II), banding (ligace kolem stentgraftu), trombektomie, endarterektomie ateroskleroticky postižené společné femorální tepny a femorofemorální zkřížený bypass [14].
V případě již jinak endovaskulárně neřešitelného zvětšování vaku výdutě je nutné včasné zvážení rizika konverze na klasický cévně chirurgický výkon a tím zabránění pozdních komplikací – především ruptury aneuryzmatu.
ZÁVĚR
Kazuistika dokumentuje dlouhodobé sledování pacienta s AAA léčeného v začátcích rozvoje endovaskulární terapie AAA, kdy došlo k výskytu vícečetných komplikací, které byly neúspěšně řešeny několika sekundárními endovaskulárními intervencemi. Vzhledem ke stálému zvětšování vaku AAA bylo po 7 letech přistoupeno k chirurgické konverzi, která byla u rizikového nemocného úspěšná. Kazuistika ukazuje, že je technicky možná i velmi pozdní konverze léčby při vhojené endovaskulární protéze, a to i přes to, že byl stentgraft kotven nepokrytou částí přes renální tepny.
MUDr. Radim Janoušek, Ph.D.
Štichova 654/54
149 00 Praha 4
e-mail: janousekradim@seznam.cz
Sources
1. Greenhalgh, R. M., Brown, L. C., Kwong, G. P., Powell, J. T., Thompson, S. G., EVAR trial participants Comparison of endovascular aneurysm repair with open repair in patients with abdominal aortic aneurysm (EVAR trial 1), 30-day operative mortality results: randomised controlled trial. Lancet, 2004; 364 (9437): 843–848.
2. EVAR trial participants Endovascular aneurysm repair and outcome in patients unfit for open repair of abdominal aortic aneurysm (EVAR trial 2): randomised controlled trial. Lancet, 2005; 365 (9478): 2187–2192.
3. Greenhalgh, R. M., Brown, L. C., Powell, J. T., et al. Endovascular versus open repair of abdominal aortic aneurysm. N. Engl. J. Med., 2010; 362 : 1863–1871.
4. Taufelsbauer, H., Prusa, A. M., Wolff, K., et al. Endovascular stent - grafting versus open surgical operation in patients with infrarenal aortic aneurysms.A propensity score-adjusted analysis. Circulation, 2002; 106 : 782–787.
5. Köcher, M., Utíkal, P. Endovaskulární léčba aneuryzmat břišní aorty. In: Krajina, A., Peregrin, J. H.: Intervenční radiologie. Vydala Olga Čermáková, Hradec Králové, 2005; 281–294.
6. Ferko, A., Krajina, A., Lojík, M., Raupach, J. Výsledky a komplikace endovaskulární léčby. In: Ferko, A., Krajina, A.: Arteriální aneuryzmata, základy endovaskulární a chirurgické léčby. Nakladatelství a grafické studio ATD, 1999; 97–105.
7. May, J., White, G. H., Harris, J. P. Techniques for surgical conversion of aortic endoprosthesis. Eur. J. Vas. Surg., 1999; 18 : 284–289.
8. Chaikoff, E. L., Blankenstein, J. D., Harris, et al. Reporting standards for endovascular aortic aneurysm repair. J. Vasc. Surg., 2002; 35 : 1048–1060.
9. Hinchliffe, R. J., Singh-Ranger, R., Davidson, I. R., Hopkinson, B. R. Rupture of abdominal aneurysm secondary to type II endoleak. Eur. J. Vasc. Endovasc. Surg., 2001;22 : 563–565.
10. Verzini, F., Cao, P., De Rango, P., et al. Conversion to open repair after endografting for abdominal aortic aneurysm: Causes, incidence and results. Eur. J. Vasc. Endovasc. Surg., 2006; 31 : 136–142.
11. Harris, P. L., Vallabhaneni, S. R., Desagranges, P., et al. Incidence and risk factors of late rupture, conversion, and death after endovascular repair of infrarenal aortic aneurysms: the EUROSTAR experience. J. Vasc. Surg., 2000; 32 : 739–749.
12. Kelso, R. L., Lyden, S. P., Butler, B., et al. Late conversion of aortic stent grafts. J. Vasc. Surg., 2009; 49 : 589–595.
13. Iezzi, R., Cotroneo, A. R., Filippone, A., et al. Multidetector CT in abdominal aortic aneurysm treated with endovascular repair: Are unenhanced and delayed phase enhanced images effective for endoleak detection? Radiology, 2006; 241 : 915–921.
14. Utíkal, P., Köcher, M., Koutná, J., et al. Surgical correction of endovascular aneurysms: repair complications. Biomed. Pap. Med. Fac. Univ. Palacky Olomouc, Czech Republic, 2006; 150 : 147–153.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2011 Issue 10-
All articles in this issue
- Hodnocení prognózy těžké sekundární peritonitidy
- Krvácanie do hrubého čreva spôsobené ruptúrou pseudoaneuryzmy arterie lienalis komplikujúcej pankreatickú pseudocystu
- Traumatická atlantoaxiálna rotačná fixácia u dieťaťa
- Pozdní chirurgická konverze po endovaskulární léčbě aneuryzmatu břišní aorty
- Ruptúra izolovanej aneuryzmy a. iliaca communis u vysoko rizikového pacienta – kazuistika
- Adenomyomatóza žlučníku
- Klinické výsledky operačního řešení acromioclaviculární luxace se suturou a bez sutury vazů
- Leiomyosarkom stěny dolní duté žíly (kazuistika)
- Akutní apendicitis – přehled současných poznatků
- Ojedinělý případ dlouhodobé průchodnosti axillo-bipopliteálního bypassu – kazuistika
- Porovnání mikčních, sexuálních a defekačních poruch u žen v aktivním věku po zlomeninách pánve typu B a C
- Chirurgické řešení komplikací divertikulózy jejuna
- Recidivujúce infekcie močových ciest ako jediný príznak cudzieho telesa gatrointestinálneho traktu pri divertikulóze
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Adenomyomatóza žlučníku
- Akutní apendicitis – přehled současných poznatků
- Klinické výsledky operačního řešení acromioclaviculární luxace se suturou a bez sutury vazů
- Chirurgické řešení komplikací divertikulózy jejuna
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

