-
Medical journals
- Career
Chirurgie karcinomu pankreatu na I. chirurgické klinice FN Olomouc
Authors: M. Loveček; Č. Neoral; Dušan Klos; P. Skalický; J. Kysučan; R. Vrba; B. Melichar 1; H. Švébišová 1; Tozzi Di Angelo I. 2; M. Kliment 3; R. Havlík
Authors‘ workplace: I. chirurgická klinika LF UP a FN Olomouc, přednosta: doc. MUDr. Č. Neoral, CSc. ; Onkologická klinika FN Olomouc 1; II. interní klinika FN Olomouc 2; Centrum péče o zažívací trakt, Vítkovická nemocnice a. s., Ostrava-Vítkovice 3
Published in: Rozhl. Chir., 2010, roč. 89, č. 12, s. 731-739.
Category: Monothematic special - Original
Overview
Úvod:
Chirurgická léčba hraje klíčovou roli ve snaze o zlepšení prognózy nemocných s karcinomem pankreatu. Incidence karcinomu pankreatu pozvolna stoupá a s ní i počet nemocných podstupujících potenciálně kurativní resekční výkon. Výsledky léčby přes veškeré pokroky v diagnostice a pacientovi přizpůsobené léčbě nejsou zatím dostatečně uspokojivé. Cílem chirurgického výkonu je radikální odstranění nádoru včetně regionálních spádových lymfatických cest, rychlé a nekomplikované zhojení a brzké zahájení onkologické terapie.Cíl:
Zhodnotit současné možnosti diagnostiky a resekční chirurgické léčby u karcinomu pankreatu s využitím všech dostupných současných diagnostických metod a prezentovat výsledky z univerzitního pracoviště.Metodika a soubor pacientů:
Na pracovišti autorů bylo v období 2006 – IX. 2010 provedeno 177 resekčních výkonů na pankreatu, pravostranných pankreatoduodenektomií pro maligní onemocnění bylo 123. Pro vývodový karcinom hlavy pankreatu bylo provedeno 76 pankreatoduodenektomií. Soubor tvořilo 51 mužů a 25 žen, průměrného věku 62,9 let. Na základě TNM (UICC) klasifikace 11 % mělo stadium I, 78 % stadium II a 3 % stadium III onemocnění. Radikalita operací v souboru byla: R0 v 59 případech, R1 v 5 případech, nezjištěno bylo 12. Histopatologický grading u této skupiny resekovaných nemocných byl: G1 ve 20 %, G2 ve 34 % a G3 ve 46 %. Perineurální invaze, invaze do lymfatických či jiných cév nebyla prokázána u 21 nemocných (27,6 %). Posuzován byl výskyt komplikací s použitím klasifikace podle DeOliveirové a přežívání podle jednotlivých stadií.Výsledky:
Komplikace se vyskytly u 44,7 % operovaných. Komplikace závažné povahy s nutností reintervence byly u 13 operovaných (17,1 %), z toho reintervence v celkové anestezii byla u 10 (13,1 %). Dva nemocní zemřeli – 79letá žena na multiorgánové selhání v důsledku aspirace a 76letý muž na multiorgánového selhání po dokončení pankreatektomie pro insuficienci pankreatikojejunální anastomózy. Třiceti - a šedesátidenní mortalita byla 2,6 %, v posledních třech letech je nulová. Průměrné přežití je 17,1 měsíce, medián je 13,5 měsíce. Celkové přežívání po radikální resekci je v souboru nemocných 3, 6, 9, 12, 15 a 18 měsíců v 95,6 %, 90,3 %, 76,3 %, 62,7 %, 52,3 % a 45 %. Ve stadiu I přežívá 1., 2., 3. a 4. rok 82 %, 52 %, 35 % a 35 % operovaných. Průměrná doba hospitalizace byla 16,8 dne (10–45).Závěr:
Přes extrémní obtížnost těchto výkonů, zejména jejich rekonstrukčních fází, se výsledky díky pokračujícím zkušenostem, zlepšující se technice operační i komplexní pooperační péči zřetelně zlepšují. Na specializovaných pracovištích klesá mortalita pod 5 %, morbidita pod 40 % a pod 10 % klesá rovněž počet pooperačních dehiscencí.
Naše pracoviště za poslední 3 roky dosahuje nulové 30 - a 60denní mortality po resekci hlavy pankreatu, výskyt komplikací pankreatikojejunální anastomózy lehce přesahuje 5 % (6,5 %) a morbidita lehce přesahuje 40 % (44,7 %). Tento výkon považujeme na našem pracovišti za bezpečný, ze kterého by měli indikovaní nemocní profitovat.Klíčová slova:
karcinom pankreatu – radikální resekce – komplikace – přežíváníÚVOD
Karcinom pankreatu je čtvrtou nejčastější příčinou úmrtí na nádorové onemocnění v České republice. Incidence neustále pozvolna stoupá a Česká republika zaujímá v incidenci karcinomu pankreatu jedno z předních míst ve světových statistikách [1]. Poslední známá incidence karcinomu pankreatu v české mužské populaci je z roku 2007 – 19,1 na 100 000 [2]. Úmrtnost na karcinom pankreatu je prakticky totožná s incidencí [3]. Na poli diagnostiky u karcinomu pankreatu v posledních letech dochází k masivnímu uplatnění endoultrasonografie jako klíčové modality v posuzování stagingu a při indikaci k chirurgické léčbě, PET-CT zaujímá spíše úlohu vylučující z chirurgické terapie [4]. Resekční výkon hraje nadále klíčovou úlohu v terapii nádorových onemocnění pankreatu. V současnosti využívané diagnostické postupy přes svou složitost, sofistikovanost, nákladnost a využití nejmodernějších technologií nemají stoprocentní senzitivitu ani specificitu a nemohou sloužit jako screeningové. Nadále platí pravidlo ověření ložiskové resekabilní a negeneralizované léze pankreatu chirurgickou cestou, pokud je pro nemocného únosná a může zlepšit prognózu onemocnění. Jen její kompletní odstranění ve smyslu R0 resekce může zlepšit prognózu a histologické vyšetření prokáže povahu onemocnění. Pouze postižení pankreatu lymfomem není primárně indikováno k chirurgické terapii. Autoři představují profil pracoviště na poli pankreatické chirurgie nádorových onemocnění.
Cílem práce je prezentovat a zhodnotit současné možnosti diagnostiky a resekční chirurgické léčby u karcinomu pankreatu na univerzitním pracovišti.
DIAGNOSTICKÝ ALGORITMUS, STAGING
Časná diagnostika nádorů pankreatu je obtížná pro pozdní vznik symptomatologie a mnohdy i z důvodu podcenění příznaků karcinomu pankreatu. Pro tumory lokalizované v hlavě slinivky či periampulárně je téměř typický bezbolestný obstrukční ikterus. Ikterus s bolestmi se objevuje přibližně u poloviny nemocných s neresekovatelným onemocněním, zatímco bezbolestný ikterus je zjišťován přibližně u poloviny pacientů s potenciálně resekabilním onemocněním [5]. Většina pacientů s jinou lokalizací nádoru pankreatu trpí spíše bolestmi, ztrátou hmotnosti nebo dyspepsií. Bolest se objevuje u 80–85 % nemocných s pokročilým onemocněním [5]. První klinické projevy závisejí na lokalizaci nádoru. Tumory v hlavě pankreatu se obvykle projevují steatoreou, ztrátou hmotnosti a ikterem. Někdy lze zaznamenat nedávné zjištění atypického diabetu či nevysvětlitelné tromboflebitidy [6]. Mnohdy je diabetes první signalizací postižení slinivky nádorem. Pacienti s nově zjištěným diabetem mají osminásobně vyšší riziko onemocnění karcinomu pankreatu během tří let oproti zbývající populaci [7].
V diagnostice se uplatňuje ultrasonografie, při obstrukčním ikteru ERCP, kde je mnohdy přínosné zobrazení pankreatických vývodných cest a kartáčová cytologie. Vysokou senzitivitu vykazuje endoultrasonografie (EUS), která má význam v předoperačním stagingu a v posouzení eventuální operability (neprokázaná angioinvaze). EUS navigovaná biopsie léze a pozitivní cytologický či histologický nález by měl vést k chirurgickému řešení i když samotný nález ložiska v pankreatu by měl být dostačující pro indikaci k chirurgické intervenci [8]. Negativní cytologický nález by neměl být důvodem odkládání chirurgické revize při lokalizované ložiskové lézi pankreatu. Hladina onkomarkerů, zejména CA 19-9 u zhoubných nádorů bývá zvýšena nad normu. Hlavní význam onkomarkerů však spočívá v dynamice změn v pooperačním období při dispenzarizaci. Spirální CT s intravenózně podanou kontrastní látkou s třídimenzionální rekonstrukcí je preferovanou metodou pro diagnostiku a staging karcinomu pankreatu, zejména k posouzení vaskulární invaze a detekci vzdálených metastáz [9, 10]. Naše pracoviště využívá u vybraných nemocných předoperační PET-CT pro přesnější staging a volbu terapeutického postupu, vždy však tak, aby nedošlo k prodlení mezi stanovením diagnózy a operačním řešením [4]. U časných stadií tumorů – velikosti do 10 mm – tato metodika často selhává a zde nemůže zastoupit významně senzitivnější EUS. U větších tumorů – T3, T4 je potenciál PET-CT využíván k vyloučení/potvrzení generalizace do jater, uzlin v hepatoduodenálním vazu, peripankreatických či při truncus celiacus a paraaortálních. Ani tato modalita však nevykazuje 100% senzitivitu a specificitu a setkáváme se, ačkoliv zřídka, s falešně negativními i falešně pozitivními nálezy. Pro rozhodování o indikaci případné neoadjuvantní onkologické terapie (předoperační radiochemoterapie) je nezbytná histologická nebo cytologická diagnóza a lokalizované onemocnění ve stadiu T3 či T4. Nejnovější zprávy s využitím SUV (standardized uptake values) během předoperačního PET-CT referují o schopnosti metody predikovat rekurenci v časném pooperačním období – do šesti měsíců [11]. S využitím výše zmíněných diagnostických modalit je cílem získat co nejpřesnější předoperační TNM staging (UICC). Na pankreatochirurgických pracovištích je využívána také nová japonská klasifikace – JPN, která lépe vystihuje i prognózu nemocných [12]. Stanovení stadia onemocnění by však mělo být co nejrychlejší, aby prodleva mezi začátkem symptomů a operačním řešením byla co nejkratší.
CHIRURGICKÁ TERAPIE PODLE STADIA – LÉČEBNÁ STRATEGIE
Tumory, které jsou lokalizovány na pankreas a peripankreatické lymfatické uzliny ve stadiu I-II B, by měly být léčeny primárně radikální operací se záměrem kurativní R0 resekce. Ta jediná dává nemocnému s karcinomem pankreatu naději na zlepšení prognózy. U nádorů v hlavě pankreatu a periampulární oblasti jsou prováděny resekce vycházející z Whippleovy operace. Na pracovišti autorů je v současnosti preferována modifikace podle Traverso-Longmire se zachováním pyloru a rekonstrukcí pasáže na jednu kličku tenkého střeva v pořadí anastomóz: pankreas, hepatocholedochus a duodenum. Možné jsou i rekonstrukce na dvě kličky tenkého střeva s nebo bez resekce žaludku. Ve sledovaném období byl pankreatický pahýl implantován výhradně do jejunální kličky v podobě pankreatikojejunální anastomózy. Problematika vaskulárních resekcí a rekonstrukcí je v současnosti živá a její indikace umožňuje rozšíření indikačního spektra o předoperační nálezy považované za T4 [13]. Lokalizované nádory ve stadiu T3, T4 by měly být zvažovány k předoperační (neoadjuvantní) onkologické terapii k docílení downstagingu a tedy dosažení operability i za cenu následných vaskulárních resekcí a rekonstrukcí, zejména v povodí VMS a VP. Radioterapií lze eliminovat mikrometastázy v peripankreatických tedy N1 uzlinách. Výkony s lymfadenektomií N2 eventuálně N3 a samostatným vyšetřením retroperitoneálních měkkých tkání, aortokaválních oblastí či resekovaných žilních struktur mohou pomoci v přesnosti stagingu a stanovení prognózy včetně indikace pooperační onkologické terapie. Rozsah lymfadenektomie však neovlivňuje prognózu nemocného. Zejména extenzivní lymfadenektomie v povodí horní mezenterické tepny (AMS) může vést k přechodně vyšší lymfatické sekreci. Indikace nemocných k neodjuvantní radiochemoterapii musí být výsledkem multioborového rozhodnutí a u nás zatím není standardem. K volbě tohoto postupu přistupujeme zcela individuálně. Pro nádory lokalizované v těle a kaudě pankreatu je metoda volby levostranná pankreatektomie se splenektomií a lymfadenektomií. Mucinózní cystadenom pro riziko malignizace je taktéž indikován k resekčnímu výkonu. Pokročilé a lokálně inoperabilní nádory či generalizované nádory nejsou indikovány k resekci pankreatu. Léčba je onkologická paliativní a symptomatická včetně substituční (endoskopické řešení obstrukce žlučových cest, zajištění pasáže zažívacím traktem, paliativní chemoterapie či radiochemoterapie, substituce zevní sekrece pankreatu, korekce glykemie, léčba bolesti, podpůrná terapie). U benigních tumorů těla pankreatu je někdy možné provést resekci těla s ušetřením hlavy i kaudy.
Kontraindikací resekčního výkonu jsou: extrapankreatické postižení včetně rozsáhlého peripankreatického lymfatického postižení, infiltrace peripankreatické tkáně a/nebo vzdálené metastázy. Zavzetí (více než poloviny obvodu) nebo okluze či trombóza horní mezenterické žíly nebo mezenterikoportálního segmentu je taktéž považováno za kontraindikaci radikálního výkonu. Mnoho center však reviduje toto kritérium a demonstruje úspěšné rekonstrukce horní mezenterické žíly. Tento trend vede k deklasifikaci postižení portomezenterické oblasti z T4 na T3 (AJCC) [14]. Přímé postižení horní mezenterické arterie, dolní duté žíly, aorty, celiacké osy nebo hepatické arterie definované jako chybění tukové vrstvy o nízké denzitně mezi těmito strukturami a tumorem na CT je pak považováno za kontraindikací absolutní [14].
METODIKA A SOUBOR PACIENTŮ
V období 2006 – IX. 2010 bylo na I. chirurgické klinice FN Olomouc provedeno přes 300 výkonů pro onemocnění pankreatu, z nich bylo 177 resekčních. 76 nemocných bylo operováno pro vývodový karcinom hlavy pankreatu, 51 mužů a 25 žen, průměrného věku 62,9 roku, medián byl 63 let a rozmezí 44–81 let. Tabulka 1 shrnuje resekční výkony na pankreatu, tabulka 2 a 3 zastoupení jednotlivých diagnóz u provedených resekčních výkonů. Za modifikovanou Whippleovu operaci považujeme pravostrannou pankreatoduodenektomii s resekcí žaludku a rekonstrukcí na dvě kličky tenkého střeva, s implantací pahýlu pankreatu do jejunální kličky. Radikalita operací v souboru byla: R0 v 59 případech, R1 v 5 případech, nezjištěno bylo 12. Průměrné přežití je 17,1 měsíce, medián pak 13,5 měsíce. Průměrná doba hospitalizace byla 16,8 dne (10–45). Histopatologický grading u této skupiny resekovaných nemocných (stupeň diferenciace nádoru) byl: G1 (dobře diferencovaný) ve 20 %, G2 (středně diferencovaný) ve 34 % a G3 (nízce diferencovaný) ve 46 %. Perineurální invaze, lymfatických či jiných cév nebyla prokázána u 21 nemocných (27,6 %).
Table 1. Resekční výkony na pankreatu, 2006 – IX. 2010 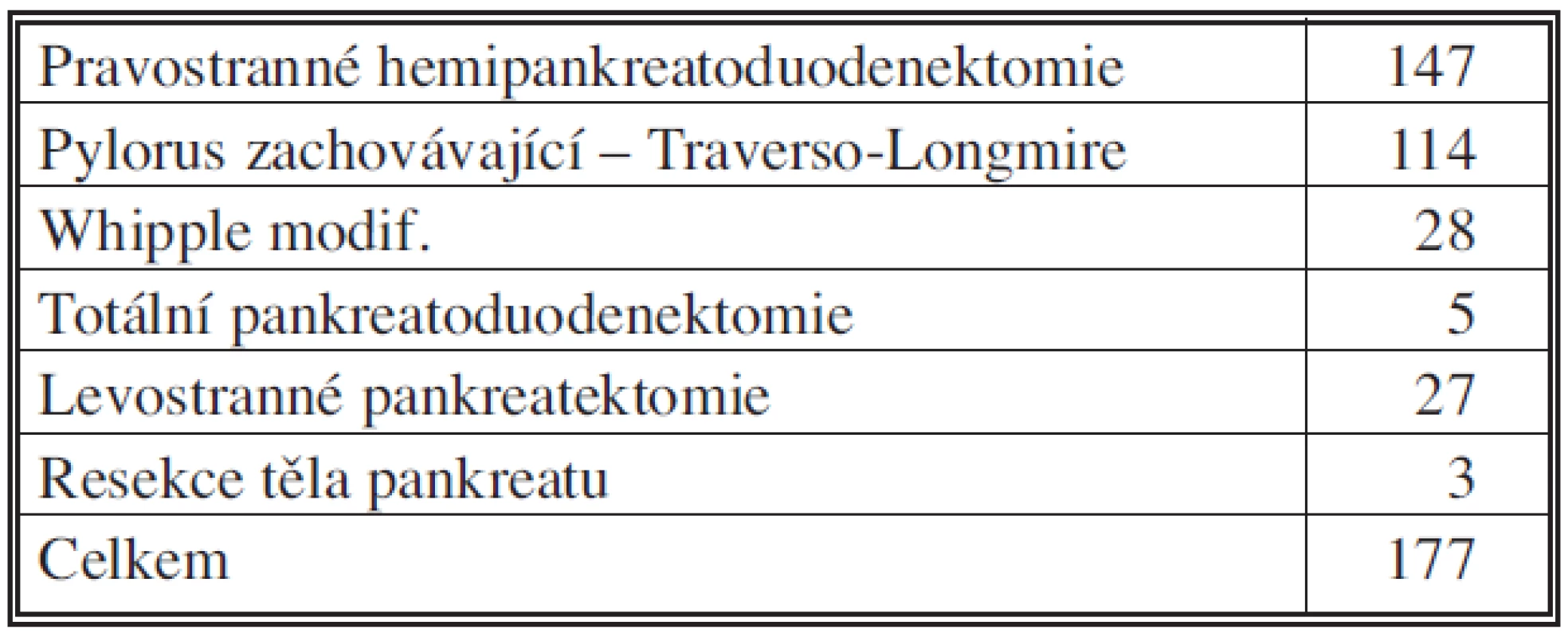
Table 2. Pravostranné pankreatoduodenektomie podle diagnóz, 2006 – IX. 2010 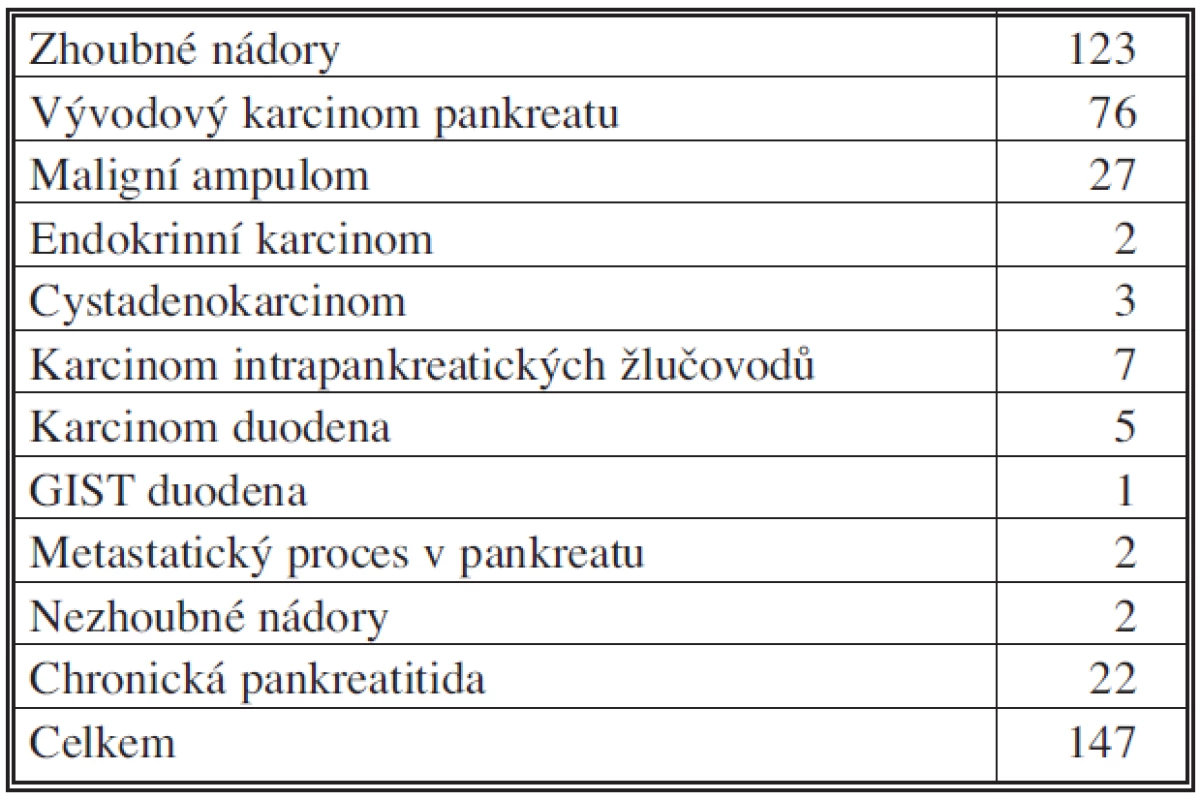
Table 3. Levostranné resekce pankreatu podle diagnóz, 2006 – IX.2010 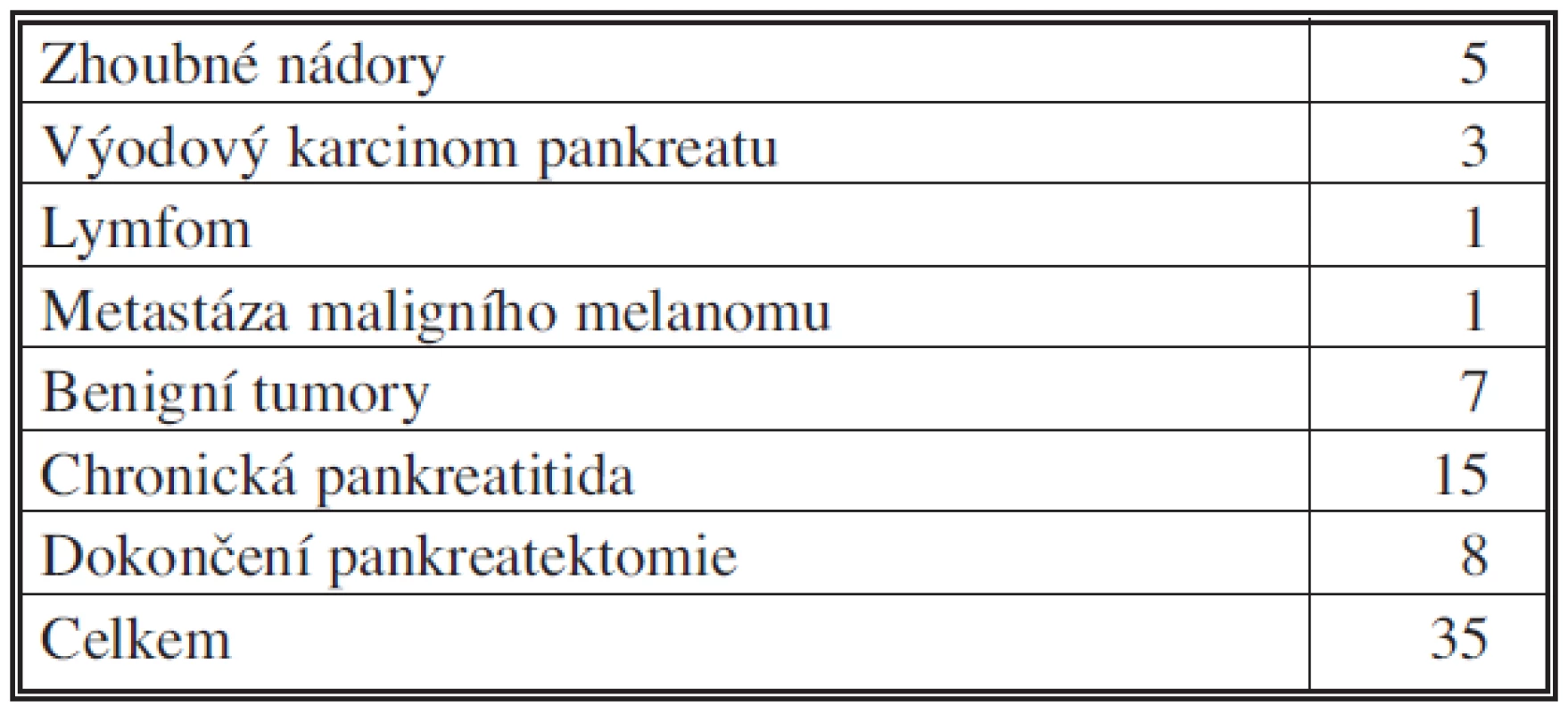
KOMPLIKACE PANKREATODUODENEKTOMIE
Perioperační mortalita (úmrtí do 30 dnů po operaci) po pankreatoduodenektomii v posledních desetiletích dramaticky klesla a na specializovaných pracovištích s velkými počty těchto výkonů se blíží nule nebo alespoň nepřesahuje 5 %. Mortalita tedy v současnosti nedostatečně charakterizuje kvalitu chirurgické péče. Morbidita po tomto výkonu však nadále zůstává významná [15, 16]. Do popředí hodnocení kvality poskytované chirurgické péče u nemocných podstupujících pankreatoduodenektomii se dostává výskyt specifických komplikací, celkový počet komplikací prodlužující hospitalizaci a zvyšující náklady na léčení a nutné reintervence. Pro objektivní a snadné hodnocení komplikací tohoto výkonu byl DeOliveirovou a spol. vypracován klasifikační systém hodnotící incidenci a závažnost specifických komplikací pankreatoduodenektomie [15]. Komplikace jsou rozděleny do pěti stupňů podle závažnosti a rozsahu nutného léčení. Stupeň I nevyžaduje specifickou terapii, stupeň II s potřebou farmakologické terapie včetně ATB, krevních převodů či parenterální nutrice, stupeň III vyžaduje invazivní terapii bez celkové anestezie – IIIa, nebo v celkové anestezii – IIIb. Stupeň IV zahrnuje orgánové dysfunkce s nutností pobytu na JIP (ARO) a stupeň V vede k úmrtí operovaného. Na základě tohoto schématu jsme klasifikovali naše komplikace. Specifickými komplikacemi pankreatoduodenektomie jsou pankreatická píštěl a opožděná evakuace žaludku. Obě tyto komplikace byly definovány v nemocnici Johna Hopkinse a z těchto definicí se nadále vychází [17]. Pankreatická píštěl je nyní definována jako přetrvávající drenáž více než 50 ml na amylázu bohatého sekretu (více než trojnásobná elevace horního limitu sérové amylázy) od 10. pooperačního dne nebo dehiscence pankreatikojejunální anastomózy prokázané radiologicky. Drén k anastomóze uložený peroperačně bývá odstraněn 4.–8. den pokud není pankreatická píštěl přítomna [17]. Klasifikace samotné pankreatické píštěle pak vychází ze stejných pěti stupňů, které byly využity pro základní dělení komplikací (DeOliveira) [15]. Opožděná evakuace žaludku (DGE) je definována jako: 1. nutnost dekomprese nazogastrickou sondou více než 10 dnů a jedno z dalších kritérií: a) zvracení po odstranění nazogastrické sondy, b) nutnost použití prokinetik po 10. dni po operaci, c) nutnost znovuzavedení sondy, nebo d) porucha pasáže po zatížení stravou; nebo 2. dekomprese nazogastrickou sondou méně než 10 dnů a dvě z výše uvedených kritérií.
Za komplikovaný průběh je považován výskyt nejméně jedné komplikace a stupeň komplikace poté vystihuje tu nejzávažnější, pokud se jich vyskytlo u jednoho pacienta více. Komplikace v našem souboru byly hodnoceny podle těchto kritérií na sestavě nemocných operovaných pro vývodový karcinom hlavy pankreatu.
Nejdůležitější prognostický faktor u kompletně resekovaných pacientů (R0) je stav postižení lymfatických uzlin. Další predikční faktory příznivějších výsledků jsou: nepřítomnost perineurální invaze, velikost tumoru méně než 3 cm, negativní resekční okraje včetně retroperitonea, umístění v hlavě pankreatu, lepší diferenciace tumoru a pooperační krevní ztráta menší než 750 ml [18].
Ze 76 nemocných bylo podle klasifikace TNM 11 % nemocných ve stadiu I a 78 % nemocných ve stadiu II a pouze 3 % nemocných ve stadiu III. Podle TNM-JPN klasifikace, která lépe vystihuje i prognózu nemocných bylo ve stadiu I 8 %, ve stadiu II 13 % a naopak ve stadiu III 55 %. Radikální resekce s využitím konvenčního hodnocení pomocí histopatologického vyšetření (v poslední době histologické vyšetření retroperitonea, uzlin N1,2, resekčních linií) byla docílena u 59 nemocných – 77 %. Podle kritérií TNM-UICC a TNM-JPN se významně rozchází staging mezi II a III stadiem.
Table 4. Klasifikace chirurgických komplikací pankreatické chirurgie [15] ![Klasifikace chirurgických komplikací pankreatické chirurgie [15]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/c13008ec531b4964626ff9e7551ceffc.png)
VÝSLEDKY
Tabulky 5 a 6 sumarizují počty a zastoupení jednotlivých komplikací podle klasifikace DeOliveirové. Specifické komplikace pankreatoduodenektomie shrnují tabulky 7 a 8. Všichni nemocní s poruchou evakuace byli léčeni pomocí parenterální výživy, prokinetik a NG sondy, 79letá nemocná zemřela na multiorgánové selhání jako následek aspirace. Komplikace pankreatikojejunální anastomózy byly řešeny chirurgickou revizí a dokončením pankreatektomie pro peritonitidu a hrozící septický stav u čtyř nemocných, 76letý nemocný zemřel na multiorgánové selhání v důsledku insuficience pankreatikojejunální anastomózy. Úspěšného konzervativního zhojení (parenterální režim, podávání analoga somatostatinu, cílená drenáž k anastomóze při operaci) bylo dosaženo u jednoho nemocného.
Table 5. Komplikace pravostranné pankreatoduodenektomie pro vývodový karcinom 2006 – IX. 2010; n = 76 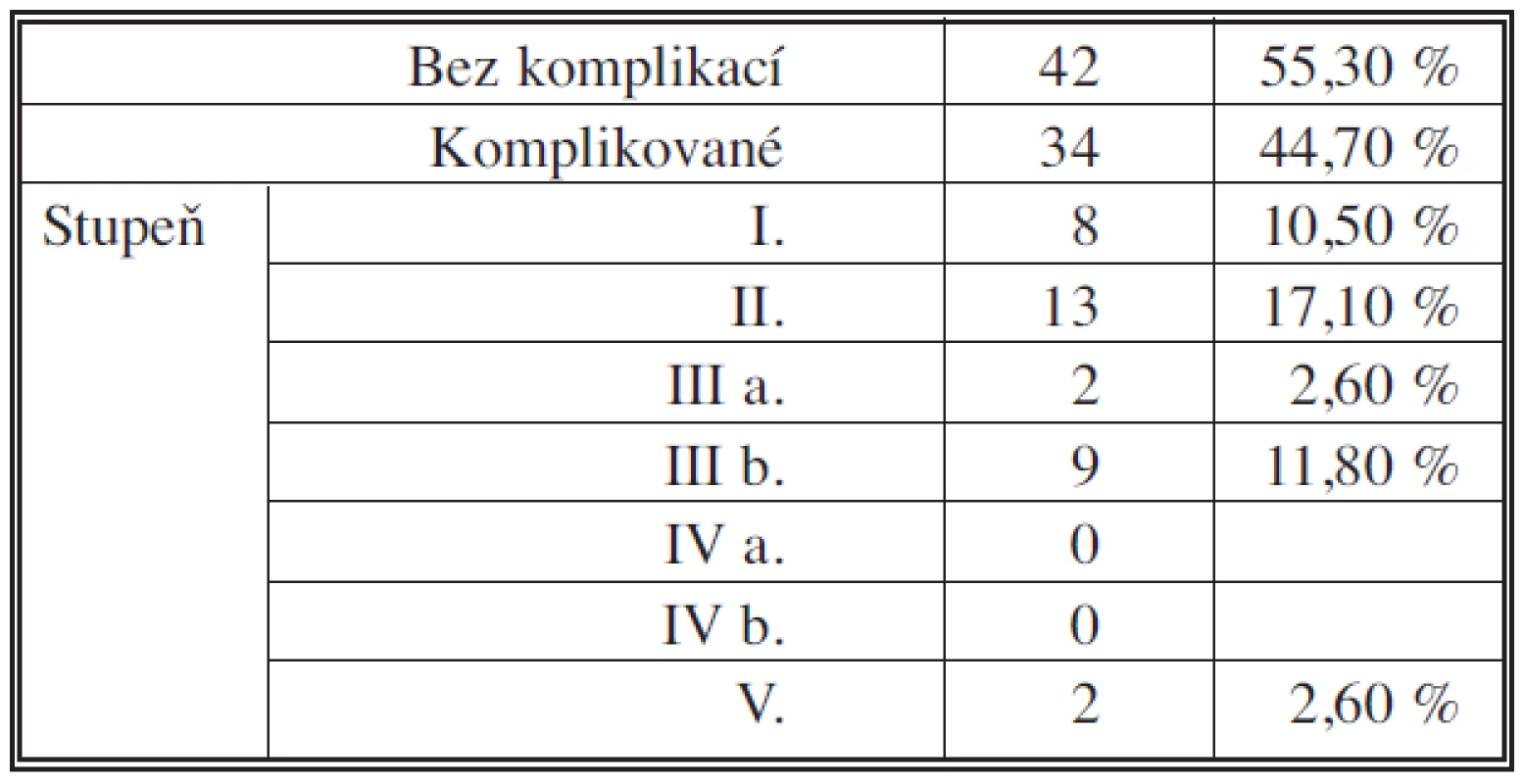
Table 6. Jednotlivé komplikace 2006 – IX. 2010; n=34 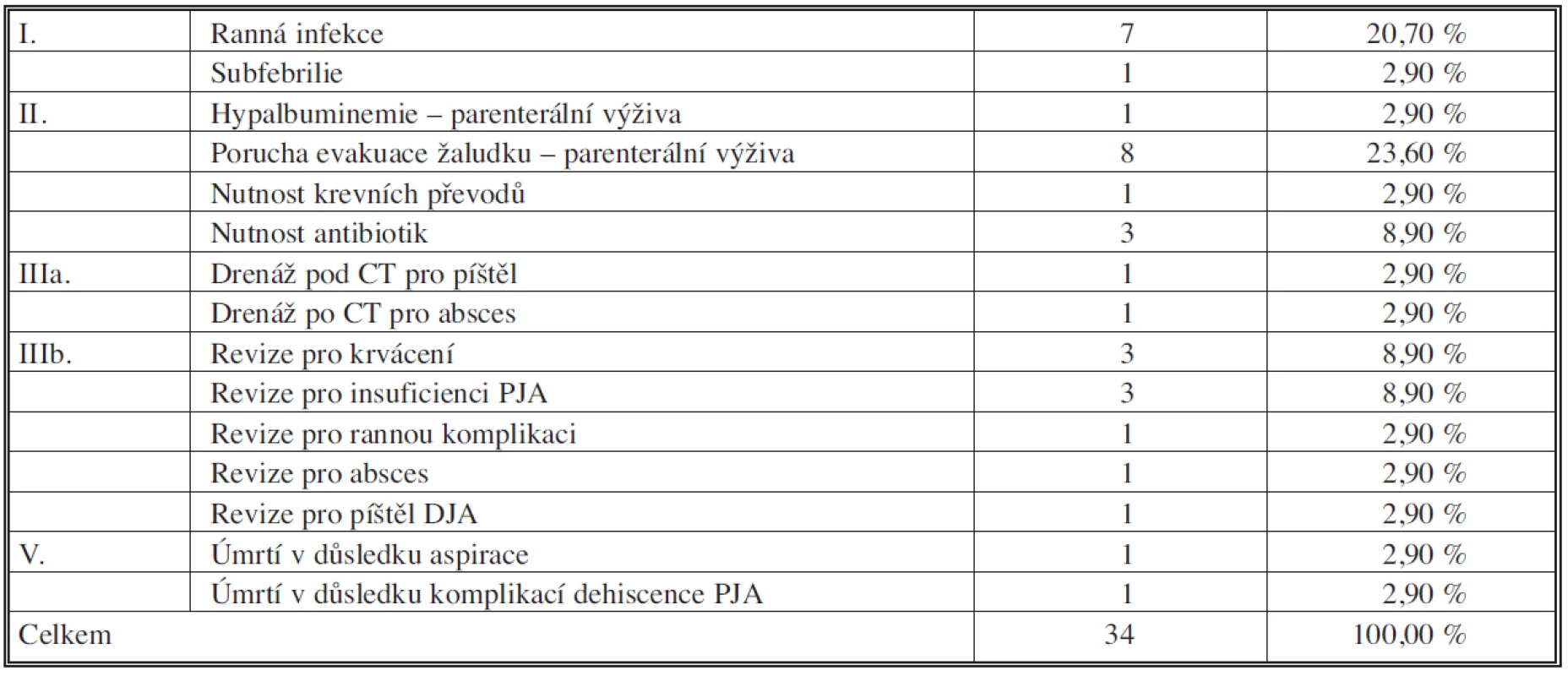
Table 7. Porucha evakuace žaludku (delayed gastric emptying) u pravostranné pankreatoduodenektomie pro vývodový karcinom 2006 – IX.2010 u jednotlivých výkonů. Stupeň I – léčený zcela konzervativně, stupeň II – parenterální režim, nazogastrická sonda, bez intervence, stupeň III – nutná intervence bez/s celkovou anestezií, stupeň IV – nutný pobyt na ARO, stupeň V – úmrtí pacienta 
Table 8. Píštěl či dehiscence pankreatikojejunální anastomózy u pravostranné pankreatoduodenektomie pro vývodový karcinom 2006 – XI. 2010; n = 76 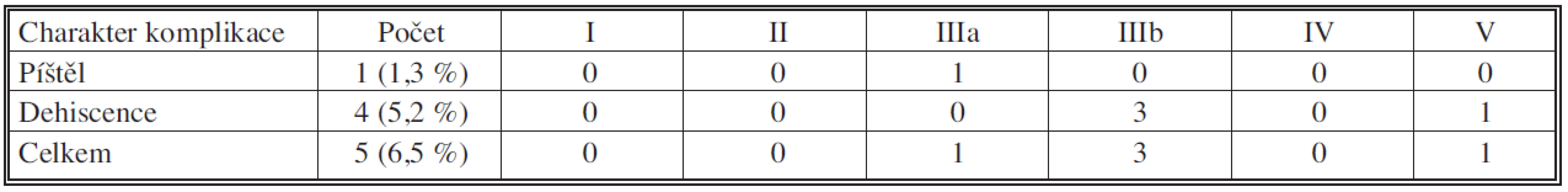
Přežívání nemocných po pankreatoduodenektomii pro vývodový karcinom hlavy pankreatu shrnují grafy 1–3 a tabulka 9. Delší hodnocení přežívání a podrobné statistické hodnocení zatím není možné pro krátké trvání souboru a převahu operovaných spíše v druhé části období (viz graf 4). Soubor je však veden nadále prospektivně a data budou průběžně aktualizována a statisticky zhodnocena.
Graph 1. Celkové přežívání nemocných radikálně operovaných pro vývodový karcinom hlavy pankreatu. N = 76 
Graph 2. Přežívání podle stadií 
Graph 3. Přežívání podle stavu postižení uzlin. Postižení uzlin v souboru bylo popsáno: N0 = 34 (44,7 %), N ≥ 1 = 42 (55,3 %) 
Table 9. Přežívání operovaných po radikální resekci hlavy pankreatu v měsících 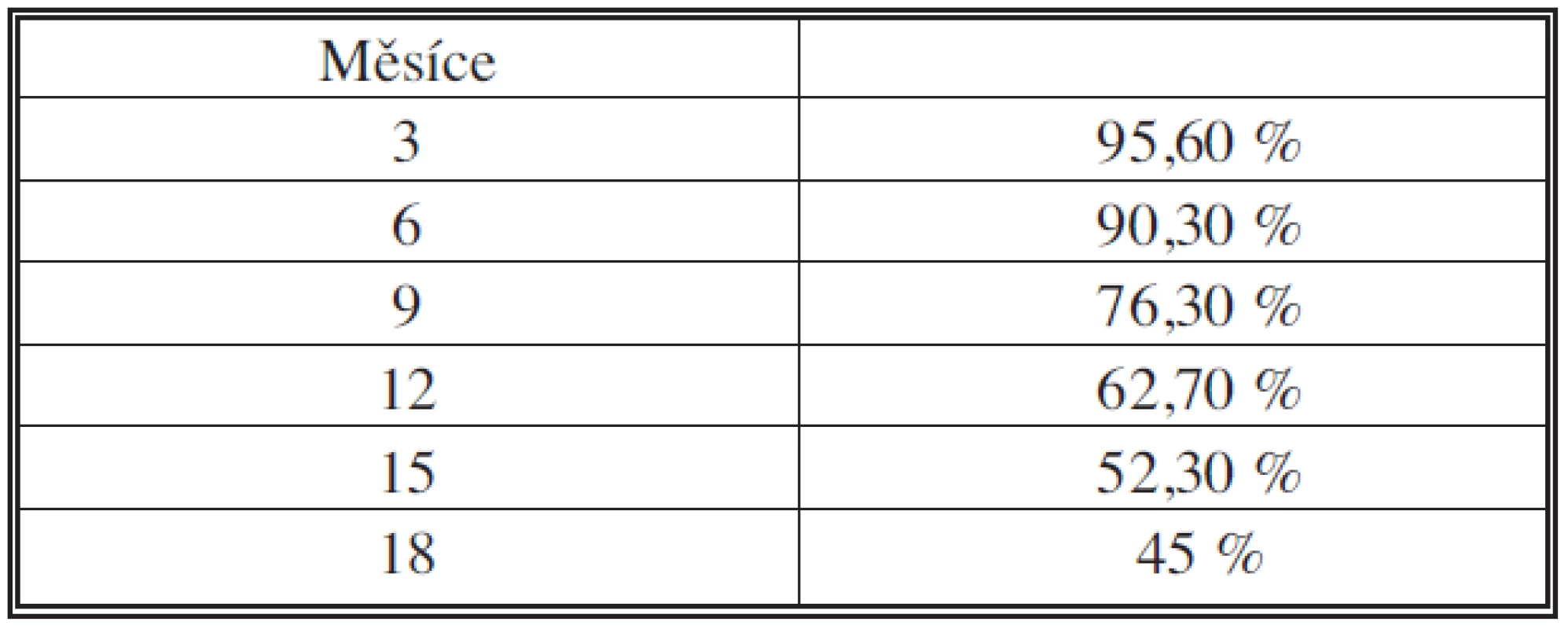
Graph 4. Počty radikálně operovaných v jednotlivých letech pro vývodový karcinom hlavy pankreatu: I. chirurgická klinika FN Olomouc 2006 – IX. 2010 
DISKUSE
Karcinom pankreatu je velmi agresivní a prognosticky nepříznivé onemocnění. Přes široké spektrum vysoce sofistikovaných diagnostických a léčebných postupů, snížení mortality chirurgických výkonů na co nejnižší možnou míru a aplikaci různých kombinací onkologické léčby zůstává průměrná délka přežití neoperovaných a paliativně operovaných v našich podmínkách rozmezí v 4–6 měsíců, po resekčních výkonech 11–18 měsíců a medián rekurence po resekčních výkonech 8–9 měsíců. Jen nepatrný zlomek nemocných s karcinomem pankreatu přežívá 5 let. Aktuální zahraniční práce prezentují medián přežití po R0 resekci 14–16 měsíců a dobu vzniku rekurence 16 –24 měsíců [19, 20]. Jiao a Sommerville udávají pětileté přežití bez nemoci (disease-free) a celkové pětileté přežití u karcinomu hlavy pankreatu 4,4 % a 10,5 % [20]. Některé práce prezentují desetileté přežití u nemocných s kurativní resekcí 19 % bez vaskulární resekce, s vaskulární resekcí 2,8 % [21]. Prediktory nepříznivého přežívání jsou perineurální invaze a uzlinové metastázy [22].
Na těchto výsledcích má zásadní vliv pozdní diagnóza, neexistence specifické screeningové metody a vysoký maligní potenciál těchto tumorů. Ryska uvádí, že v době stanovení diagnózy je u třetiny nemocných zjištěno postižení uzlin a u třetiny metastázy v játrech. U přibližně poloviny nemocných je prokázána angioinvaze a desetina má generalizaci na peritoneu [23]. Pouze 15–20 % nemocných jsou kandidáty pankreatektomie, jiné studie uvádějí jen desetiprocentní resekabilitu u karcinomu pankreatu [24]. Gooszen vyjadřuje názor o urgentnosti chirurgického řešení po zjištění diagnózy a preferuje resekci ještě před založením duodenobiliární drenáže [25]. Nejnovější práce referující o využití neoadjuvantních režimů v terapii pokročilého či hraničně resekabilního karcinomu pankreatu uvádějí resekabilitu 8,3–64,2 % a dosažitelnost R0 resekce v 8,3–57,1 %. Kompletní patologická odpověď (complete response) na neoadjuvantní režim se uvádí ve 3,0–8,8 % [26].
Na základě studií a vlastních zkušeností považujeme za důležité u nemocných s ložiskovou lézí pankreatu nebo se stenózou intrapankreatického úseku choledochu bez nálezu ložiska na CT co nejrychlejší a co nejpřesnější diagnostiku a staging onemocnění. U nemocných s podezřením na tumor v hlavě pankreatu se jeví jako nejpřínosnější EUS. Přesnost TNM stagingu pro EUS je uváděn v rozmezí 78–94 % pro modalitu T a 64–82 % pro modalitu N [27]. Vyšetření je vysoce závislé na zkušenosti endosonografisty. EUS je nejsenzitivnější neinvazivní metodou pro posouzení vaskulární invaze u karcinomu pankreatu [8, 27]. Mnohé studie srovnávající EUS s jinými modalitami pro iniciální diagnostiku a staging karcinomu pankreatu doporučují kombinaci EUS pro T a N staging, predikci vaskulární invaze doplněnou o „multidetector row“ CT (MDR-CT) k vyloučení vzdálených metastáz [28]. Zejména pro stadium I – T1 – tumory do velikosti 2 cm spirální CT často selhává a opakovaně se setkáváme s ikterickými nemocnými se založenou duodenobiliární drenáží a CT neprokazujícím tumorózní masu. Negativní nález na CT musí být u těchto nemocných důvodem pro EUS v krátké době k objasnění příčiny obstrukčního ikteru. Přibližně 10 % resekovaných na našem pracovišti za poslední 2 roky bylo indikováno na základě EUS s negativním nálezem na CT, u dalších 10 % nemocných se prokázaly tumory distálního choledochu, které taktéž na CT vykazovaly negativní nálezy. Ve vybraných případech využíváme předoperační PET-CT. Ani fúze radioizotopové a CT metodiky u časných stadií nezaručí detekci tumorózní masy (do 10–15 mm). U pokročilých tumorů a velkých ložisek využíváme PET-CT k detekci vzdálených metastáz. Miliární rozsev v játrech do 5 mm velikosti však PET-CT uniká a spolehlivě identifikuje ložiska velikosti 8 mm a větší, pokud akumulují značenou glukózu. Takto pozitivní nález vylučuje u nemocného radikální chirurgické řešení. U lokálně inoperabilních či diseminovaných onemocnění není radikální chirurgická intervence indikována. Stav vyžaduje neinvazivní paliativní léčbu (drenáž žlučových cest stentem, kvalitativní diagnóza – EUS + FNA, biopsie pod CT kontrolou, onkologická terapie podle stavu nemocného). U hraničně resekabilních je na místě vyloučení vzdálené generalizace (spirální CT, PET/CT), posouzení angioinvaze (spirální angio CT, EUS) k rozhodnutí o dalším postupu léčby.
Výsledky přežívání nemocných s primárně neresekabilním nádorem pankreatu, kteří podstoupili předoperační neoadjuvantní chemoradioterapii svědčí o čtvrtině až třetině nemocných přežívajících více než 3 roky. Některé studie naznačují lepší přežívání u skupiny s pokročilým tumorem pankreatu po neoadjuvantní radiochemoterapii než u skupiny resekovaných nemocných s časným karcinomem [25]. Časné jaterní metastázy (do 3 měsíců od operace) u cca 20 % časných karcinomů radikálně resekovaných svědčí o nezachytitelnosti těchto metastatických onemocnění v době operace.
Významně nepříznivé prognostické faktory pro délku přežití po resekci jsou udávány hlavně pozitivita nádoru v uzlinách, grading nádoru a velikost tumoru > 2,5 cm, přítomnost nádoru v resekční linii, cévní invaze, invaze nádoru přes kapsulu do přilehlých tkání, krevní transfuze > 2 jednotky a nedostatečný rozsah resekce.
Parametry pozitivity uzlin nejsme schopni operací ovlivnit, stejně jako grading nádoru a velikost tumoru. Přítomnost tumoru v resekční linii ověřujeme peroperačním kryostatickým vyšetřením a v případě pozitivity resekční linii posunujeme do zdravé tkáně. U dvou nemocných byl negativní peroperační nález přehodnocen na pozitivní a proto jsme v druhé době dokončili pankreatektomii. Cévní invaze se posuzuje velmi obtížně předoperačně a převažuje spíše obemknutí tumorem nežli přímé prorůstání. Cévní náhrada VP/VMS umožňuje docílit radikální resekci u těchto nálezů. Invaze nádoru do přilehlých tkání je mnohdy přesně hodnotitelná až mikroskopickým vyšetřením. Krevní ztráty lze ovlivnit operační technikou.
V případě chirurgické léčby je nezbytná snaha o co nejlepší výsledky operací z pohledu komplikací. Zásah operačním výkonem musí být co nešetrnější, pobyt v nemocnici co nejkratší a dopad chirurgického výkonu co nejmírnější. V našem souboru jsme zaznamenali u pravostranných resekcí u 42 ze 76 pankreatoduodenektomií zcela nekomplikovaný průběh – 55 %. U 45 % se vyskytly některé z komplikací, přičemž za závažné považujeme ty, které si vynutily reintervenci v celkové anestezii – 13,1 %. Dva nemocní (2,6 %) zemřeli v krátkém pooperačním období na multiorgánové selhání. Nejzávažnější komplikace vyplývající z pankreatikojejunální anastomózy se vyskytla u pěti nemocných (6,5 %). Jejich řešení si u čtyř nemocných vyžádalo chirurgickou revizi a jedenkrát drenáž pod CT. Zbývající intervence byly nutné třikrát pro krvácení, jedenkrát pro rannou komplikaci, jedenkrát pro absces a jedenkrát pro dehiscenci duodenojejunální anastomózy. Celkem tedy bylo 10 operačních reintervencí (13 %) a dvě neoperační pod CT kontrolou pro absces a píštěl pankreatikojejunální anastomózy (2,6 %). Třicetidenní mortalita je 2,6 %, medián přežití 13,5 měsíce a průměrná doba hospitalizace 16,8 dne.
ZÁVĚR
Přes extrémní obtížnost resekčních výkonů pankreatu (časová, preparační v oblasti mezenterikoportální, rekonstrukční v podobě pankreatikojejunální anastomózy) se výsledky díky pokračujícím zkušenostem, zlepšující se technice operační i komplexní péče zřetelně zlepšují. Na specializovaných pracovištích klesá mortalita pod 5%, morbidita pod 40 % a pod 10 % klesá rovněž počet pooperačních dehiscencí.Výsledky našeho pracoviště dosahují v posledních letech (2008–2010) nulovou peroperační, a 60denní mortalitu, morbidita lehce přesahuje 40 % a počet pooperačních dehiscencí či píštělí se blíží 5 % (6,5 %).
Během posledních desítek let zaznamenáváme velký pokrok v oblasti diagnostiky – endo usg, FNAB, PET-CT a implementace nových technologií do operační techniky – peroperační usg, harmonický skalpel, biologická lepidla. Zaznamenáváme nárůst výskytu onemocnění karcinomem pankreatu, centralizaci výkonů a nárůst jejich počtů. Zároveň zjišťujeme jen nepatrné změny v operační technice a typech rekonstrukce. Ne zcela čerstvou novinkou jsou cévní rekonstrukce žil a tepen mesenterikoportální a celiacké oblasti. Procento komplikací kolísá či se mírně snižuje podle počtu provedených výkonů na pracovišti. Perioperační mortalita klesá, ale na specializovaných pracovištích ani v minulosti nebyla vysoká. Jen nepatrně se však mění prognóza nemocných s tímto onemocněním, která nadále zůstává velmi nepříznivá. Slibnou je adjuvantní onkologická terapie a možné kombinované neoadjuvantní postupy s využitím radiochemoterapie a pooperační chemoterapie. Nadále jsou však ve stadiech výzkumu. Molekulární postupy zatím nemají své standardní místo v diagnostice a terapii karcinomu pankreatu, proto je pro nás prioritní chirurgická terapie, její kvalita a snaha o minimalizaci dopadu samotného výkonu na nemocného.
Zkratky:
DPE – duodenopankraetektomie, PPDPE – pylorus zachovávající duodenopankreatektomie, HJA – hepatikojejunoanastomóza, AMS – arteria mesenterica superior, NG – nazogastrická sonda, PJA – pankreatikojejunoanastomóza, TPE – totální pankreatektomie, PET/CT – kombinace výpočetní tomografie a pozitronové emisní tomografie, ERCP – endoskopická retrográdní cholangiopankreatikografie, EUS – endoskopická ultrasonografie, CT – výpočetní tomografie, SUV – standardised uptuake values, JPN – japonská klasifikace pro karcinom hlavy pankreatu, UICC – Union for International Cancer Control
MUDr. M. Loveček, Ph. D.
I. chirurgická klinika LF UP a FN Olomouc
I. P. Pavlova 6
775 20 Olomouc
Sources
1. Zavoral, M., Ryska, M.: Karcinom slinivky břišní. Projekt IGA MZ, 8027-3 [online]. Dostupný na http://www.genomac.cz/cz/karcinom-slinivky-brisni.php
2. ÚZIS 2007, www.uzis.cz
3. Kollárová, H., Janoutová, G., Foretová, L., et al. Epidemiologie karcinomu pankreatu. Epidemiol. Mikrobiol. Imunol., 2007; 56, 38–43.
4. Kysučan, J., Loveček, M., Klos, D., et al. Přínos PET/CT v předoperačním stagingu karcinomu pankreatu. Rozhl. Chir., 2010, roč. 89, č. 7, 433–440.
5. Kalser, M. H., Barkin, J., MacIntyre, J. M. Pancreatic cancer. Assessment of prognosis by clinical presentation. Cancer, 1985; 56, 397.
6. Khorana, A. A., Fine, R. L. Pancreatic cancer and tromboembolic disease. Lancet Oncol., 2004; 5 : 655.
7. Chari, S. T., Leibson, C. L., Rabe, K. G., et al. Probability of pancreatic cancer following diabetes: a population-based study. Gastroenterology, 2005; 129 : 504.
8. Kliment, M., Urban, O., Cegan, M., et al. Endoscopic ultrasound-guided fine needle aspiration of pancreatic masses: the utility and impact on management of patiens. Scand. J. Gastroenterol., 2010 Jul 14 [Epub ahead of print].
9. Horton, K. M., Fishman, E. K. Multidetector row CT with dual-phase CT angiography in the preoperative evaluation of pancreatic cancer. Crit. Rev. Comput. Tomogr., 2002; 43 : 323.
10. DeWitt, J., Deveraux, B., Chriswell, M., et al. Comparison of endoscopic ultrasonography and multidetector computed tomography for detecting and staging pancreatic cancer. Ann. Intern. Med., 2004; 141 : 753.
11. Okamoto, K., Koyama, I., Miyazawa, M., et al. Preoperative 18[F]-fluorodeoxyglucose positron emission tomography/computed tomography predicts early recurrence after pancreatic cancer resection. Int. J. Oncol., 2010 Sep 23. [Epub ahead of print].
12. Zavoral, M. Karcinom pankreatu. Praha, Galén, 2005.
13. Gürlich, R., Oliverius, M., Lipár, K., et al. Výsledky jednoročního přežití u nemocných po resekci hlavy slinivky břišní s resekcí žil portomezenterické oblasti (PMO). Rozhl. Chir., 2009, roč. 88, č. 8, s. 417–421.
14. Fernandes del Castillo, C., Tanabe, K. K., Howell, D. A. Clinical manifestations, diagnosis and surgical staging of exocrine pancreatic cancer. UpToDate v. 18.1, January 2010.
15. DeOliveira, M. L., Winter, J. M., Schafer, M., et al. Assessment of complications after pancreatic Surgery. A novel grading system applied to 633 patients undergoing pancreaticoduodenectomy. Annals of Surgery, 2006; 6 : 931–939.
16. Michalski, Ch. W., Weitz, J., Buchler, M. W. Surgery insight: surgical management of pancreatic cancer. Natural clinical practice oncology, 2007; 9 : 526–535.
17. Bassi, C., Dervenis, C., Butturini, G., et al. Postoperative pancreatic fistula: an international study group (ISGPF). Surgery, 2005; 138 : 8–13.
18. Fernandes-del Castillo, C., Jimenez, R. E., Steer, M. L. Surgery in treatment of exocrine pancreatic cancer and prognosis. Up To Date v. 18.2. 2010, May.
19. Smeenk, H. G., Erdmann, J., van Dekken, H., et al. Long-term survival after radical resection for pancreatic head and ampullary cancer: a potential role for the EGF-R. Dig. Surg., 2007; 24 : 38–45.
20. Sommerville, C. A., Limongelli, P., Pai, M., et al. Survival analysis after pancreatic resection for ampullary and pancreatic head carcinoma: an analysis of clinicopathological factors. J. Surg. Oncol., 2009; 100 : 651–656.
21. Ouaissi, M., Hubert, C., Verhelst, R., et al. Vascular reconstruction during pancreatoduodenectomy for ductal adenocarcinoma of the pancreas improves resectability but does not achieve cure. World J. Surg., 2010; Jul 7. Epub ahead of print.
22. Hatzaras, I., George, N., Muscarella, P., et al. Predictors of survival in periampullary cancers following pancreaticoduodenectomy. Ann. Surg. Oncol., 2010; 17 : 991–997.
23. Ryska, M., Strnad, R., Bělina, F., et al. Radikální resekce u nemocných s karcinomem hlavy pankreatu. Retrospektivní analýza přežívání u souboru 307 nemocných. Rozhl. Chir., 2007; 89, 432–439.
24. Friess, H., Uhl, W., Silva, J. C., et al. Preoperative laparoscopy: do we need it in patients with pancreatic malignancies? Am. J. Surg., 1998; 175 : 172–178.
25. Gooszen, H. Carcinoma of the head of the pancreas: indication for emergency Surgery. Ned. Tijdschr. Geneeskd., 2010; 154: A2148.
26. Morganti, A. G., Massaccesi, M., LaTorre, G., et al. A Systematic Review of Resectability and Survival After Concurrent Chemoradiation in Primarily Unresectable Pancreatic Cancer. Ann. Surg. Oncol., 2010; 17 : 194–205.
27. Al-Haddad, M., Eloubeidi, M. A. Interventional EUS for the diagnosis and treatment of locally advanced pancreatic cancer. JOP, 2010; 11 : 1–7.
28. Gress, F. G., Howell, D. A., Travis, A. C., et al. The role of endoscopic ultrasound in the staging of pancreatic adenocarcinoma. Up to date vision 18. 1, January 2010.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2010 Issue 12-
All articles in this issue
- Vzácné pupeční abnormality
- Možnosti transanální endoskopické mikrochirurgické techniky
- Ambulantní excize perianálních duplikatur
- Přežívání nemocných po radiofrekveční ablaci jaterních metastáz kolorektálního karcinomu
- XLIF – nová technika náhrady meziobratlové ploténky bederní páteře: první zkušenosti
- Radikalita resekčního výkonu u nemocných s karcinomem pankreatu z pohledu prodloužení života a jeho kvality
- Chirurgie karcinomu pankreatu na I. chirurgické klinice FN Olomouc
- Náhrada jícnu tlustým střevem – zkušenosti se 109 případy
- Videoasistovaná resekce jícnu pro karcinom – desetileté zkušenosti
- Solitární fibrózní tumor pleurální dutiny
- Riziko kolorektálního karcinomu v terénu ulcerózní kolitidy
- Vlastní modifikace rekonstrukce žaludku po gastrektomii pro karcinom
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Vzácné pupeční abnormality
- Ambulantní excize perianálních duplikatur
- Solitární fibrózní tumor pleurální dutiny
- XLIF – nová technika náhrady meziobratlové ploténky bederní páteře: první zkušenosti
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

