-
Medical journals
- Career
Intraoperační radioterapie v multimodalitní léčbě lokálně pokročilého karcinomu rekta
Authors: R. Soumarová; M. Škrovina *; S. Machala; L. Adamčík *; J. Bartoš *
Authors‘ workplace: Oddělení radioterapie a onkologie, Komplexní onkologické centrum Nový Jičín primářka: doc. MUDr. R. Soumarová, Ph. D. ; Chirurgické oddělení nemocnice Nový Jičín, Komplexní onkologické centrum Nový Jičín primář: MUDr. M. Škrovina *
Published in: Rozhl. Chir., 2010, roč. 89, č. 11, s. 685-688.
Category: Monothematic special - Original
Overview
Multimodalitní léčba lokálně pokročilého karcinomu rekta kombinuje chirurgický výkon s radioterapií a chemoterapií. Tento postup vede ke zlepšení lokální kontroly onemocnění i celkového přežití. Avšak u části pacientů vznikají lokální recidivy, které jsou lokalizované převážně v presakrální oblasti. Zařazení intraoperační radioterapie do léčebného schématu vede k další eskalaci dávky záření bez zvýšení toxicity, a tak sníží pravděpodobnost vzniku jinak obtížně řešitelných lokálních recidiv.
Klíčová slova:
lokálně pokročilý karcinom rekta – intraoperační radioterapie – multimodalitní léčbaZákladní kurativní léčbou lokalizovaných nádorů rekta je radikální chirurgický výkon. U lokálně pokročilých nádorů (v rozsahu T3, T4 nebo N+) je chirurgický výkon kombinován s předoperační radioterapií (RT) či radiochemoterapií (CHT-RT), což vede k lepší lokální kontrole onemocnění i zlepšenému přežití ve srovnání se samotným chirurgickým výkonem [1, 2].
Riziko vzniku lokální recidivy se zvyšuje se zvyšujícím se stadiem. U lokálně pokročilých nádorů se pohybuje od 52 % do 27 % u T3 a T4 tumorů [3, 4]. Lokální kontrola se dále snižuje v případě pozitivních resekčních okrajů [5]. Yu a kolektiv ve své práci analyzovali asi 550 pacientů s karcinomem rekta [6]. Dvě třetiny pacientů měli recidivu v ozařované oblasti. Z nich asi u 80 % z nich byla nejčastějším místem vzniku presakrální a perineální oblast. Nejčastějším místem pánevní recidivy podle jiné práce po radikální operaci rekta byla opět presakrální oblast: v 67 %, ve 13 % perineální oblast, ve 4 % boční pánevní stěna, v 0,5 % zadní poševní stěna, ve 2 % prostata a močový měchýř a ve 14 % oblast anastomózy [7].
Proto k dalšímu zvýšení lokální kontroly onemocnění může přispět boost na presakrální oblast. Prospektivní studii pravděpodobně nemůžeme očekávat, jelikož riziko vzniku lokální recidivy je relativně nízké a bylo by potřeba velkého počtu pacientů a dlouhého časového období k signifikantnímu rozdílu mezi skupinami s boostem a bez něj. Léčba recidiv je však velmi komplikovaná a spíše s paliativním cílem.
K doozáření presakrální oblasti je možné použít zevní radioterapii nebo intraoperační radioterapii (IORT). Dávková eskalace pomocí zevní radioterapie je spojena na jedné straně s vyšší lokální kontrolou onemocnění, ale také s větším zatížením okolních zdravých tkání, zejména kliček tenkého střeva a močového měchýře. Právě technika intraoperační radioterapie je vhodná pro eskalaci dávky bez zatížení zdravých tkání [8, 9, 10].
IORT umožní aplikovat vysokou dávku v krátkém čase bez ozáření zdravých tkání [11, 12]. Je proto vhodná v multimodalitní léčbě lokálně pokročilého karcinomu rekta (13). Navíc jednorázová aplikace dávky kolem 10 Gy odpovídá radiobiologicky 20–30 Gy frakciované zevní radioterapie.
Na Mayo Clinic srovnávali pacienty, kteří byli léčeni samostatnou zevní RT a kombinací zevní RT a IORT. Tříletá lokální kontrola byla 24 % vs. 85 %, tříleté celkové přežití 24 % vs. 55 % [14]. Následovaly další studie v Evropě, které kombinovaly chemoradioterapii s resekcí, zevní RT a IORT [15, 16]. Lokální kontrola byla dosažena v 3–13 % u lokálně pokročilého onemocnění. Ve studii z Madridu po použití IORT na presakrální oblast pouze u 1 pacienta ze 100 se objevila lokální recidiva v této oblasti [11]. U stadia T4 byla IORT účinná v kombinaci s multiviscerální resekcí [17].
Studie, které použili IORT u lokálně pokročilého karcinomu rekta, jsou uvedeny v tabulce 1.
Table 1. Studie s použitím intraoperační radioterapie v adjuvantní léčbě u karcinomu rekta 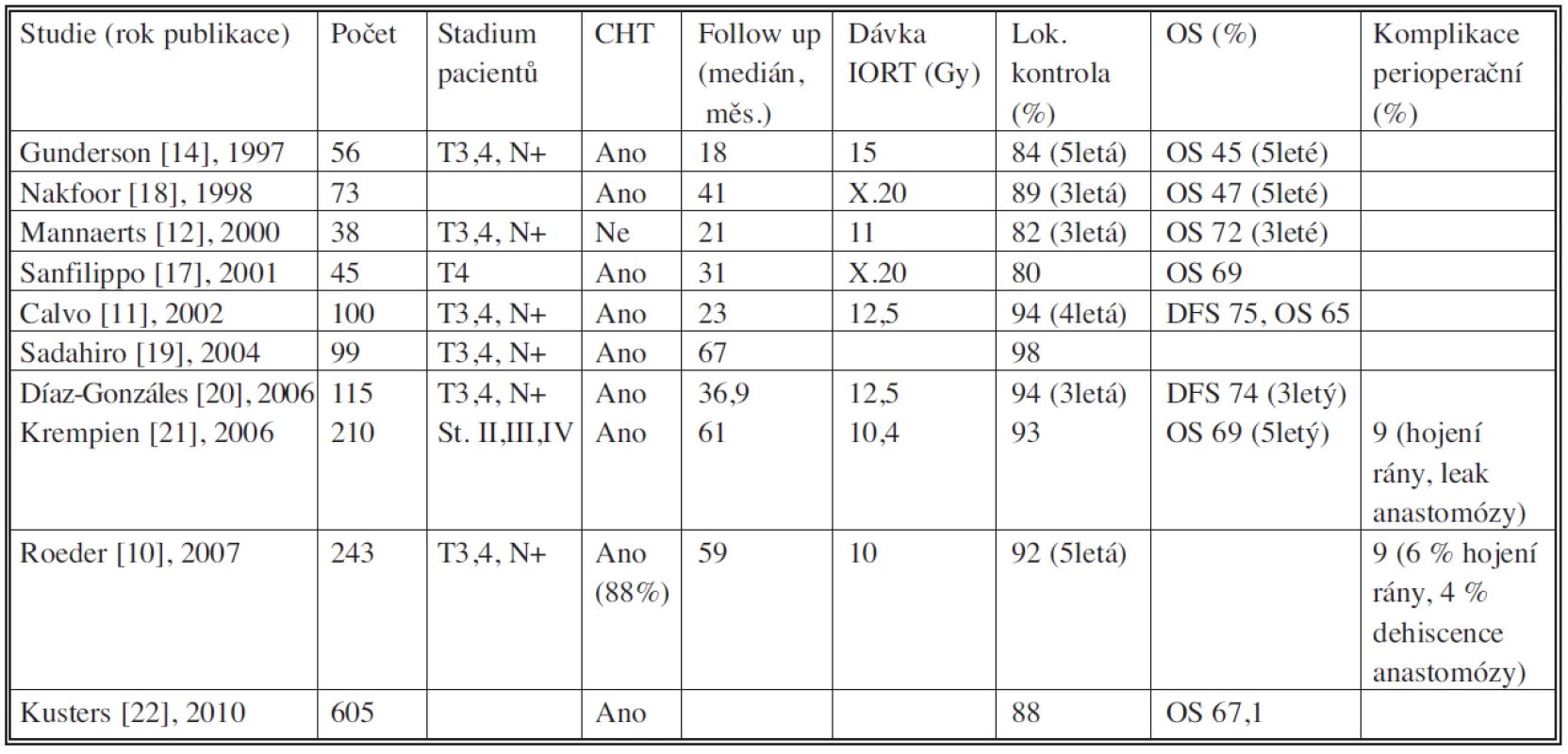
TOXICITA LÉČBY
Toxicita neoadjuvantní chemoradioterapie je dobře zdokumentovaná a zahrnuje především toxicitu kožní, gastrointestinální a hematologickou. Intraoperační radioterapie může způsobit delší hojení po operaci, rannou infekci, event. střevní obstrukci. V různých studiích se procento komplikací pohybuje různě, ve studii španělských autorů byla toxicita popsána až u 37 % pacientů [20]. V jiných studiích je perioperační toxicita nízká (9 %) a zahrnuje zejména delší hojení rány a dehiscenci anastomózy [10, 21].
Avšak zejména v případě R1 resekce je dávka nutná pro zajištění lokální kontroly onemocnění více než 60 Gy. Její dodání zevní radioterapií by nebylo možné bez překročení tolerančních dávek okolních zdravých tkání. Proto kombinace předoperační RT v dávce 45,0–50,4 Gy, chirurgická explorace a radikální resekce s IORT, vede ke zvýšení lokální kontroly a nižší toxicitě léčby.
INTRAOPERAČNÍ RADIOTERAPIE JAKO SOUČÁST SALVAGE TERAPIE
Lokální recidiva po resekci u pacientů s kolorektálním karcinomem je spojena se špatnou prognózou, medián přežití se pohybuje mezi 11 a 15 měsíci a méně než 5 % pacientů přežívá 5 let [23]. Lokálně recidivující karcinom je také často spojen s bolestí, krvácením a střevní obstrukcí. Zařazením IORT do léčebného schématu se přežití pacientů zvýší. Vybraným pacientům s pánevní recidivou by měla být nabídnuta agresivní léčba s kurativním potenciálem zahrnující chirurgický výkon, IORT a případně zevní radioterapii. Ve studii z Memorial Sloan-Kettering Cancer Centra byla IORT využita u 74 pacientů s lokální recidivou. Všichni měli provedenu radikální resekci tumoru, zevní RT byla použita u 39 % pacientů. Pětiletá lokální kontrola byla 36–41 %. Dvouleté a pětileté celkové přežití bylo 75 % a 23 % [24].
I v případě relapsu v pánevních uzlinách je možné použít IORT jako součást léčby s kurativním cílem. Haddock publikoval pětileté přežití 49 % u pacientů po exstirpaci uzlinových metastáz a IORT [25]. Stejný autor z Mayo kliniky v letošním roce publikoval výsledky u 607 pacientů s rekurentním kolorektálním karcinomem a IORT [26]. Medián přežití byl 36 měsíců, pětileté přežití 30 %. U 15 % pacientů byla zjištěna neuropatie, zvláště pokud byla dávka IORT vyšší než 12,5 Gy. 7 % pacientů mělo komplikace spojené s hojením rány a infekcí, ve 3 % se objevila obstrukce ureteru. Signifikantně lepších výsledků (lokální kontrola i interval bez nemoci) bylo dosaženo v případě kompletní resekce, případně R1 resekce než u R2 resekce [27].
METODA
IORT je kombinována zpravidla se zevní RT na oblast pánve v dávce 45,0–50,4 Gy.
Intraoperační radioterapie využívá působení svazku ionizujícího záření přímo do operačního pole během chirurgické revize. Na oblast tumoru nebo jeho lůžka je aplikována vysoká jednorázová dávka záření (10–30 Gy), přičemž zdravé tkáně jsou z ozařovaného objemu dočasně mechanicky odsunuty. Tak je umožněno aplikovat dostatečně vysokou dávku záření bez rizika nepřesného zaměření a bez zvýšení dávky v okolních zdravých tkáních.
Pojem intraoperační radioterapie zahrnuje ozáření během operačního výkonu, zdroje záření však mohou být odlišné. Používá se buď ortovoltážní (rentgenový) ozařovač, elektronový svazek lineárního urychlovače (IOERT) nebo brachyterapie s vysokým dávkovým příkonem (HDR IORT). Výhodou IOERT je možnost ozáření i do hloubky větší než 1 cm – v závislosti na volbě energie svazku urychlených elektronů – a relativně krátký ozařovací čas (do 5 minut). Rozdíl mezi technikou HDR IORT a IOERT je uveden v tabulce 2.
Table 2. Srovnání intraoperační radioterapie elektronovým svazkem (IOERT) a intraoperační radioterapie technikou HDR brachyterapie 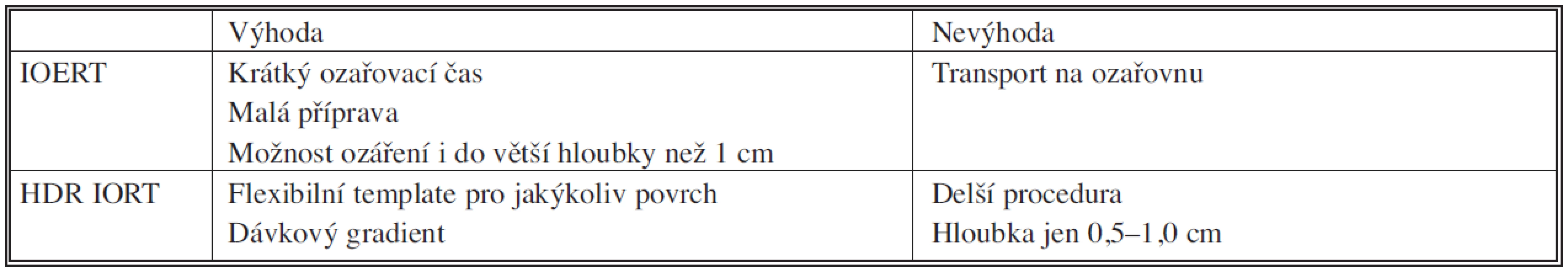
V ideálním případě je ozařovač umístěn přímo na operačním sále nebo tam může být přivezen (malé mobilní urychlovače, ortovoltážní ozařovač), nebo pacient je v průběhu operačního výkonu převezen na ozařovnu lineárního urychlovače. Po provedení resekce či cytoredukce je stanovena velikost vhodného tubusu pro příslušný cílový objem (Obr. 1), který je stanoven na podkladě předoperačních vyšetření (CT, UZ, MRI) a podle peroperačního nálezu. Je také vybrána vhodná energie svazku elektronového záření. Poté je operační pole sterilně překryto a pacient je transportován za monitorace vitálních funkcí na ozařovnu, kde je tubus napojen na hlavici lineárního urychlovače (Obr. 2). Z ozařovaného objemu jsou odtlačeny a odtamponovány citlivé struktury (např. kličky střevní). Po vlastním ozáření trvajícím několik minut, je pacient transportován zpět na operační sál, kde je operace dokončena. V případě použití HDR IORT je do operačního pole vložen speciální aplikátor z flexibilního materiálu, např. tzv. Harrison-Anderson-Mick (HAM) aplikátor. V ozařovně se prostřednictvím jednotlivých kabelů napojí na HDR přístroj, kde zdrojem záření je Iridium 192.
Image 1. Vložení tubusu pro IOERT do presakrální oblasti 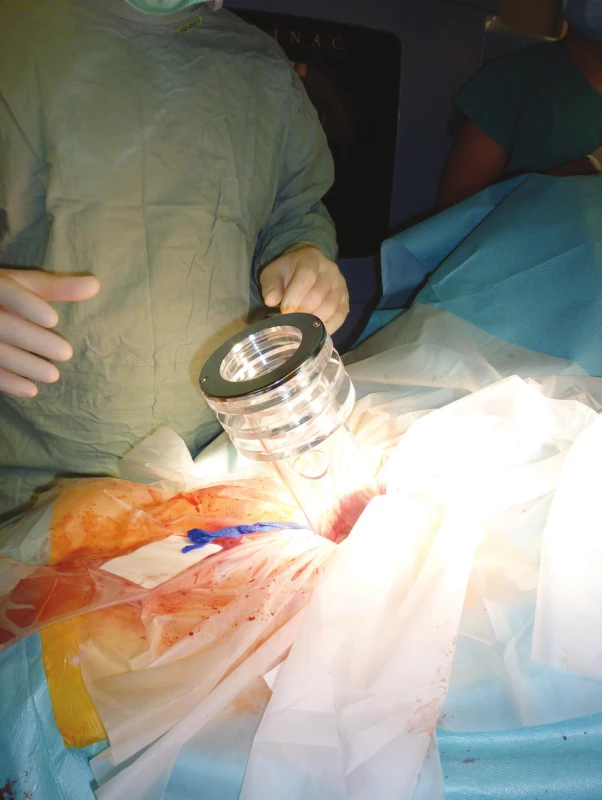
Image 2. Napojení tubusu pro IOERT na hlavici lineárního urychlovače 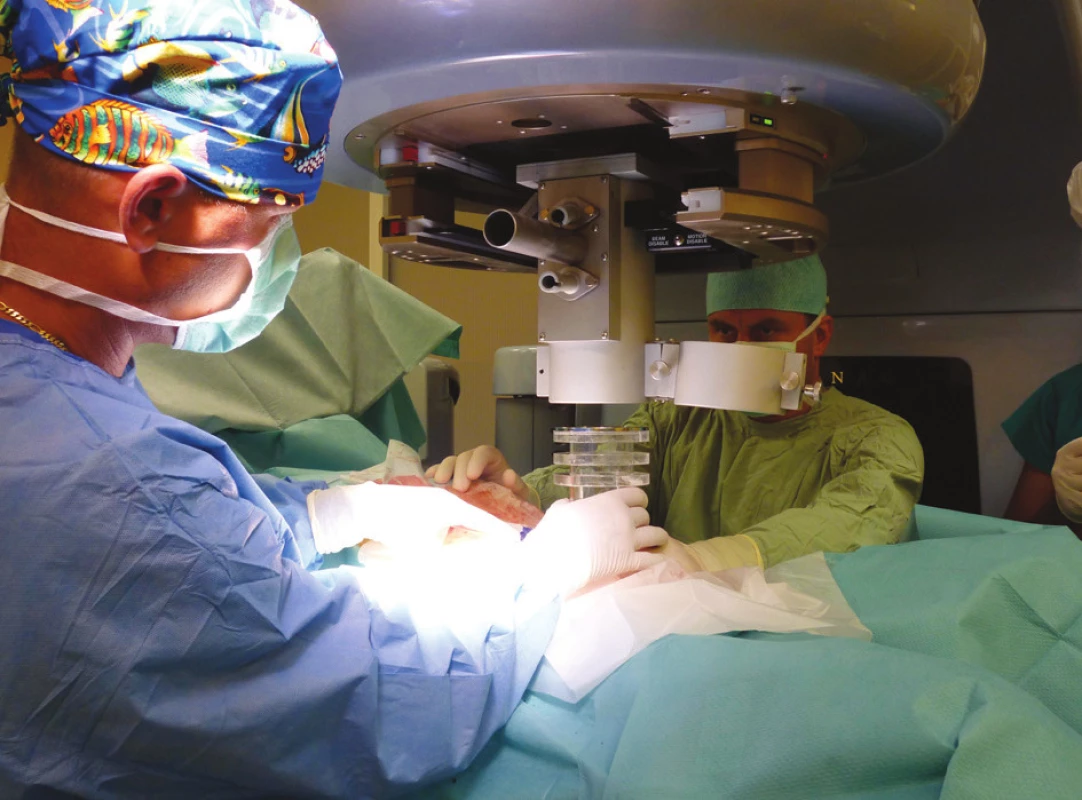
K hlavním výhodám IORT patří: 1. eliminace mikroskopického onemocnění v oblasti lůžka tumoru a zvýšení lokální kontroly onemocnění, 2. radiobiologický efekt vyplývající z aplikace jednorázové vysoké dávky záření, 3. optimalizace časové souslednosti operace a radioterapie.
Použití IORT je příkladem velmi úzké spolupráce několika specializací v léčbě onkologických pacientů. Tým pro IORT se skládá z chirurgů, kteří hrají klíčovou roli, mají celkovou odpovědnost za proceduru, diskutují s radiačním týmem o postupu před každou operací. Radiační onkolog indikuje IORT, během operace konzultuje nálezy s patologem a chirurgem, je na něm definitivní rozhodnutí, zda IORT provést či nikoliv. Komunikuje s fyzikem, vybírá velikost tubusu, určuje hloubku a dávku záření. Je odpovědný za umístění hardware pro IORT a zajištění procedury v ozařovně. Radiační fyzik zajišťuje všechna dozimetrická data, zajištění kvality, vybírá velikost aplikátoru, stanovuje potřebnou energii záření. Anesteziolog zajišťuje stabilní stav pacienta během operace, transportu a ozáření. Monitoruje vitální funkce. Indikuje přerušení léčby zářením v případě problémů. Sestry hrají nezastupitelnou roli v přípravě pacienta před operací, v zajištění návaznosti operace na ozařovnu, v přípravách místností a aseptického transportu. Patolog je také velmi důležitou součástí týmu, jelikož v některých případech rozhodnutí o provedení IORT závisí na odečtení okrajů na operačním sále.
Protokol používaný v Komplexním onkologickém centru Nový Jičín
U karcinomu rekta ve vzdálenosti do 12 cm od okraje anu v rozsahu T3, T4, Nx je indikována neoadjuvantní radiochemoterapie v režimu: zevní RT na oblast pánve 45 Gy, 1,8 Gy/frakci, 5 frakcí/týden + capecitabin (Xeloda) 825 mg/m2 p.o. 2x denně po celou dobu radioterapie, radikální operace s odstupem 6–8 týdnů, operace + IOERT na presakrální oblast v případě R0 resekce je aplikovaná 10 Gy, v případě R1 resekce 12 Gy, v případě R2 resekce 15 Gy na 90% izodóze.
ZÁVĚR
Intraoperační radioterapie je velmi vhodnou součástí multimodalitní léčby pokročilého karcinomu rekta. Ozáření presakrální oblasti během operačního výkonu sníží pravděpodobnost vzniku recidivy v této oblasti. S výhodou nízké toxicity a zvýšení dávky záření ji lze použít i v léčbě pánevních recidiv. Její použití je příkladem velmi úzké týmové spolupráce při léčbě těchto pacientů.
Doc. MUDr. Renata Soumarová, Ph.D.
Prostřední 6
634 00 Brno
e-mail: renata.soumarova@onkologickecentrum.cz
Sources
1. Camma, C., Grunta, M., Fiorica, F., et al. Preoperative radiotherapy for resectable rectal cancer: A meta-analysis. JAMA, 2000; 284 : 1008–1015.
2. Glimelius, B., Isacsson, U., Jung, B., et al. Radiotherapy in addition to radical surgery in rectal cancer: Evidence for a dose-response effect favoring preoperative treatment. Int. J. Radiat. Oncol. Biol. Phys., 1997; 37 : 281–287.
3. Tepper, J. E., O’Connell, M., Niedzwiecki, D., et al. Adjuvant therapy in rectal cancer: Analysis of stage, sex, and local control – Final report of intergroup 0114. J. Clin. Oncol., 2002; 20 : 1744–1750.
4. Kapiteijn, E., Marijnen, C. A., Nagtegaal, I. D., et al. Preoperative radiotherapy combined with total mesorectal excision for resectable rectal cancer. N. Engl. J. Med., 2001; 345 : 638–646.
5. Lindel, K., Willett, C. G., Shellito, P. C., et al. Intraoperative radiation therapy for locally advanced recurrent rectal or rectosigmoid cancer. Radiother. Oncol., 2001; 58(1): 83–87.
6. Yu, T. K., Bhosale, P. R., Crane, C. H., et al. Patterns of locoregional recurrence after surgery and radiotherapy or chemoradiation for rectal cancer. Int. J. Radiat. Oncol. Biol. Phys., 2008, 15; 71(4): 1175–1180.
7. Hoffman, J. P., Rilly, L., Carp, N. Z., Litwin, S. Isolated locally recurrent rectal cancer: a review of incidence, presentation, and management. Semin. Oncol., 1993; 20 : 506–519.
8. Nuyttens, J. J., Kolkman-Deurloo, I. K., Vermaas, M., et al. Highdose-rate intraoperative radiotherapy for close or positive margine in patients with locally advanced or recurrent rectal cancer. Int. J. Radiat. Oncol. Biol. Phys., 2004; 58 : 106–112.
9. Willett, C. G., Czito, B. G., Tyler, D. S. Intraoperative radiation therapy. J. Clin. Oncol., 2007; 25 : 971–977.
10. Roeder, F., Treiber, M., Oertel, S., et al. Patterns of failure and local control after intraoperative electron boost radiotherapy to the presacral space in combination with total mesorectal exciton in patients with locally advanced rectal cancer. Int. J. Radiat. Oncol. Biol. Phys., 2007; 67 : 1381–1388.
11. Calvo, F. A., Gomez-Espi, M., Diaz-Gonzalez, J. A., et al. Intraoperative presacral electron boost following preoperative chemoradiation in T3-4Nx rectal cancer: initial local effects and clinical outcome analysis. Radiother. Oncol., 2002; 62 : 201–206.
12. Mannaerts, G. H., Martijn, H., Crommelin, M. A., et al. Feasibility and first results of multimodality treatment, combining EBRT, extensive surgery, and IOERT in locally advanced primary rectal cancer. Int. J. Radiat. Oncol. Biol. Phys., 2000; 47 : 425–433.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2010 Issue 11-
All articles in this issue
- Traumatická atlantoaxiálna rotačná fixácia u dieťaťa
- Intratorakální struma – nediagnostikovaná – přece odoperovaná
- Axilárna disekcia v manažmente chirurgickej liečby invazívneho karcinómu prsníka u postmenopauzálnych pacientok
- Torze omenta – neobvyklá příčina náhlé příhody břišní
- Abdominální katastrofa – defekt stěny břišní komplikovaný střevní píštělí – strategie léčby
- Segmentální absence muscularis propria stěny tračníku – vzácná příčina perforace tračníku v těhotenství
- Mucinózní adenokarcinom apendixu – kazuistika
- Intraoperační radioterapie v multimodalitní léčbě lokálně pokročilého karcinomu rekta
- Pětileté sledování nemocných po operaci světlobuněčného karcinomu ledviny
- Lymfatické mapování a biopsie sentinelových uzlin s použitím kombinované metodiky in vivo aplikace Patentblue a radiokoloidu a ex vivo detekce metastatického postižení lymfatických uzlin u kolorektálního karcinomu
- Poranění pánve z pohledu urogynekologie. Souborný referát
- Mapování povrchového žilního systému před a po operaci varixů – literární souhrn specifických aspektů při vyšetřování duplexní sonografií
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Mucinózní adenokarcinom apendixu – kazuistika
- Abdominální katastrofa – defekt stěny břišní komplikovaný střevní píštělí – strategie léčby
- Pětileté sledování nemocných po operaci světlobuněčného karcinomu ledviny
- Torze omenta – neobvyklá příčina náhlé příhody břišní
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

