-
Medical journals
- Career
Antimikrobní léčba nozokomiálních nitrobřišních infekcí – nové léčebné možnosti tygecyklinem
Authors: F. Vyhnánek; Adámková V.+; V. Ducháč; Teplan V. Jr; Jirásek T.++
Authors‘ workplace: 3. LF UK a FNKV Praha ; +Ústav lékařské mikrobiologie, přednosta: doc. MUDr. Marek Bednář, CSc. ; ++Ústav patologie, přednosta: prof. MUDr. Václav Mandy, CSc. ; Chirurgická klinika, přednosta: prof. MUDr. Robert Gürlich, CSc.
Published in: Rozhl. Chir., 2009, roč. 88, č. 9, s. 503-507.
Category: Monothematic special - Original
Overview
Úvod:
Nozokomiální nitrobřišní infekce patří mezi velmi závažné infekce z pohledu jak časné diagnózy tak i účinné terapie. U těchto infekcí jsou častěji izolovány jako pathogeny multirezistentní bakterie (Enterobacteriacae produkující rozšířené spektrum beta-laktamáz – ESBL Escherichia coli, Klebsiella species, vankomycin rezistentní enterokoky [VRE], a methicilin rezistentní Staphylococcus aureus [MRSA]). Mezi nová antibiotika se širokým spektrem účinku postihující multirezistentní bakterie je do klinické praxe uváděn tygecyklin.
Cílem sdělení je vyhodnocení současné citlivosti tygecyklinu k nejčastějším patogenům nitrobřišních infekcí generovaných u nemocných hospitalizovaných na chirurgické klinice. Na základě citlivosti byl tygecyklin indikován k cílené antibiotické léčbě u nitrobřišních infekcí.Metoda:
Byla stanovena aktuální citlivost na tygecyklin u Escherichia coli, Klebsiella pneumonie, Enterobacter cloacea, Proteus mirabilis u aminopenicilinů, fluorochinolonů, tygecyklinu a gentamicinu. Citlivost na oxacilin, klindamycin a tygecyklin byla testována u Staphylococcus aureus, na flourochinolony, gentamicin a tygecyklin u Enterococcus faecalis, a na flourochinolony, gentamicin, ceftazidim a gentamicin u Pseudomonas aeruginosa.
Na základě výsledku citlivosti byl tygecyklin podán u dvou nemocných s pooperační nitrobřišní infekcí vyvolaných ESBL Escherichia coli a Klebsiella pneumonie. Tygecyklin byl podán v úvodní dávce 100 mg i.v. a dále 50 mg i.v. po l2 hodinách po dobu 7 dní.Výsledky:
Izolované bakterie byly citlivé k tygecyklinu a to 98–100 % mimo Psudomonas aeruginosa, kde byla prokázána 100% rezistence. Cílená antimikrobní léčba tygecyklinem u pooperační nozokomiální nitrobřišní infekce byla účinná, oba nemocní se zhojily.Závěr:
Výběr antimikrobní léčby u nozokomiálních nitrobřišních infekcí vyžaduje pečlivou úvahu s pohledu řady faktorů jako je předchozí antibiotická léčba, přidružená onemocnění a aktuální stav citlivosti proti multirezistentním potenciálním patogenům. Tygecyklin má významnou účinnost in vitro proti rezistentním Gram-pozitivním i klíčovým Gram-negativním fakultativním bakteriím, které jsou často příčinou nitrobřišní infekce u chirurgického nemocného. Dosavadní klinické zkušenosti ukazují, že tygecyklin je bezpečný a účinný v léčbě komplikovaných nitrobřišních infekcí.Klíčová slova:
nitrobřišní infekce – tygecyklin – citlivost in vitro – indikace k léčběÚVOD
Nozokomiální infekce vzniká u nemocných hospitalizovaných více než 48 hodin a obvykle je vyvolána nemocniční získanou infekcí, která zahrnuje bakterie se získanou antimikrobní rezistencí [1]. Rozvoj této nitrobřišní infekce závisí na stupni kontaminace peritonea bakteriemi a střevním obsahem a na stavu obranyschopnosti nemocného. Nozokomiální nitrobřišní infekce patří mezi velmi závažné infekce z pohledu jak časné diagnózy tak i účinné terapie [1, 2, 3]. Úspěšný výsledek léčby závisí na časné diagnóze, rychlé a přiměřené chirurgické intervenci a výběru účinného antibiotického režimu. Opoždění v chirurgické revizi je spojeno se signifikatním zvýšením úmrtnosti [2]. Iniciální výběr antimikrobní léčby u komplikovaných nozokomiálních nitrobřišních infekcí je extrémně důležitý protože při spojení nepřiměřené empirické antimikrobní léčby a opožděného klinického řešení se prodlužuje doba hospitalizace a zvyšuje se riziko úmrtnosti [1, 4, 5]. U těchto infekcí jsou častěji izolovány jako patogeny multirezistentní bakterie (Enterobacteriacae produkující rozšířené spektrum beta-laktamáz – ESBL Escherichia coli, Klebsiella species, vankomycin-rezistentní enterokoky [VRE] a methicillin rezistentní Staphylococcus aureus [MRSA]). Mezi nová antibiotika se širokým spektrem účinku postihující i multirezistentní bakterie vyvolávající nozokomiální nitrobřišní infekce je do klinické praxe uváděn tigecyklin [5, 6, 7, 8, 9]. Tygecyklin patří mezi glycylcykliny, semisyntetické deriváty tetracyklinů se širokým spektrem účinku proti bakteriím, se kterými se často setkáváme u nitrobřišních infekcí zahrnující aerobní a fakultativní Gram-pozitivní a Gram-negativní bakterie a anaerobní bakterie. Tygecyklin je in vitro účinný proti rezistentním bakteriím jako je MRSA, VRE a ESBL-produkující Enterobacteriaceae.
MATERIÁL, METODA, VÝSLEDKY
Cílem sdělení je vyhodnocení současné citlivosti tygecyklinu k nejčastějším patogenům nitrobřišních infekcí generovaných u nemocných hospitalizovaných na chirurgické klinice a na základě přehledu doporučení pro empirickou antimikrobní léčbu u nitrobřišních infekcí a i vlastní zkušenosti uvést současné možnosti zařazení tygecyklinu mezi léky volby u vysoce rizikových nemocných s nozokomiální nitrobřišní infekcí. Byla stanovena aktuální rezistence u Enterobacteriacae/Escherichia coli (131 bakterií), Klebsiella pneumonie (49), Enterobacter cloacae (8), Proteus mirabilis (36) u aminopenicilinů, fluorochinolonů, tygecyklinu a gentamicinu (Graf 1–4). Citlivost na oxacilin, klindamycin a tygecyklin byla testována u 70 izolovaných Staphylococcus aureus (Graf 5) a na flourochinolony, gentamicin a tygecyklin u 46 izolovaných Enterococcus faecalis (Graf 6). Dalším nozokomiálním patogenem, který byl vyšetřen byla Pseudomonas aeruginosa (Graf 7), kdy u 38 bakterií byla testována citlivost na tygecyklin, flourochinolony, ceftazidim a gentamicin. Všechny izolované bakterie byly získány z mikrobiologických vyšetření od nemocných hospitalizovaných na chirurgické klinice. Citlivost k tygecyklinu byla 98–100 % u všech testovaných bakterií mimo Pseudomonas aeruginosa, kde byla prokázána 100% rezistence. Na základě těchto výsledků in vitro a výsledků recentních studií byl tygecyklin podán k cílené léčbě pooperační nitrobřišní infekce.
Graph 1. In vitro citlivost Escherichia coli Graph 1. In vitro sensitivity of Escherichia coli Počet bakterií 131. Zkratky: AMC – aminopeniciliny, FQ – fluorochinolony, TYG – tygecyklin, GEN – gentamicin, CITL – % citlivosti , REZ – % rezistence 
Graph 2. In vitro citlivost Klebsiella pneumonie Graph 2. In vitro sensitivity of Klebsiella pneumonie Počet bakterií 49. Zkratky: AMC – aminopeniliny, FQ – fluorochinolony, TYG – tygecyklin, GEN – gentamicin, CITL – % citlivosti, REZ – % rezistence 
Graph 3. In vitro citlivost Enterobacter cloacae Graph 3. In vitro sensitivity of Enterobacter cloacae Počet bakterií 8. Zkratky: AMC – aminopeniciliny, FQ – fluorochinolony, TYG – tygecyklin, GEN – gentamicin, CTIL – % citlivosti, REZ – % rezistence 
Graph 4. In vitro citlivost Proteus mirabilis Graph 4. In vitro sensitivity of Proteus mirabilis Počet bakterií 36. Zkratky: AMC – aminopeniciliny, FQ – flouorochinolony, TYG – tygecyklin, GEN – gentamicin, CITL – % citlivosti, REZ – % rezistence 
Graph 5. In vitro citlivost Staphylococcus aureus Graph 5. In vitro sensitivity of Staphylococcus aureus Počet bakterií 70. Zkratky: OXA – oxacilin, CLI – klindamycin, TYG – tygecyklin, CITL – % citlivosti, REZ – % rezistence 
Graph 6. In vitro citlivost Enterococcus faecalis Graph 6. In vitro sensitivity of Enterococcus faecalis Počet bakterií 46. Zkratky: FQ – fluorochinolony, GEN – gentamicin, TYG – tygecyklin, CITL – % citlivosti, REZ – % rezistence 
Graph 7. In vitro citlivost Pseudomonas aeruginosa Graph 7. In vitro sensitivity of Pseudomonas aeruginosa Počet bakterií 38. Zkratky: TYG – tygecyklin, FQ – fluorochinolony, CTZ – ceftazidim, GEN – gentamicin, CITL – % citlivosti, REZ – % rezistence 
KAZUISTIKA 1
Nemocný, 63 let, přijat na chirurgickou kliniku pro recidivu bolestí v pravém podžebří, před 3 týdny propuštěn po konzervativní léčbě cholecystitidy s prokázanou cholelitiázou. Nemocný febrilní 38 °C. Laboratorní vyšetření: leukocyty 11,2, CRP 130. Ultrazvuk žlučníku: empyém žlučníku, výrazné zánětlivé změny ve stěně s drobnými abscesy, drobný konkrement (6 mm). Zahájena antimikrobní léčba ceforepazonem / sulbaktamem. Kontrolní vyšetření za 2 dny leukocyty 18,9, CRP 227, CT břicha (Obr. 1) se závěrem: známky abscesu v lůžku žlučníku. Indikována operace. Operační diagnóza: cholecystitis gangrenosa acuta, cholelithiasis, abscesu retrovesicalis. Operace: cholecystektomie, drenáž podjaterní krajiny. Histologický nález: těžká ulceroflegmonózní cholecystitis, ve stěně flegmonózní zánětlivý infiltrát, místy až s formací abscesů. V pooperačním průběhu šestý den přetrvává vysoká hodnota CRP 209, subfebrilie a hnisavá sekrece z rány. Podle klinického vyšetření a kontrolního CT břicha (Obr. 2) jde o hlubokou infekci chirurgického místa, která drénována. Vzhledem k výsledku mikrobiologického vyšetření ESBL-Escherichia coli rezistentní na betalaktamázová antibiotika podán podle citlivosti tygecyklin v dávce 100 mg i.v. a dále 50 mg po 12 hod po dobu jednoho týdne. Po 48 hodinách od zahájení léčby afebrilní kontrolní CRP 35, mírná sekrece z rány přetrvává ještě osmý den, kdy nemocný je propuštěn do domácího ošetření. Při ambulantní kontrole jedenáctý den hojící se rána per secundam, již bez sekrece.
Image 1. CT vyšetření břicha s nálezem rozšíření stěny žlučníku a tekutinou v lůžku žlučníku Fig. 1. Abdominal CT examination showing a thickened gall bladder wall and fluid within the gall bladder bed 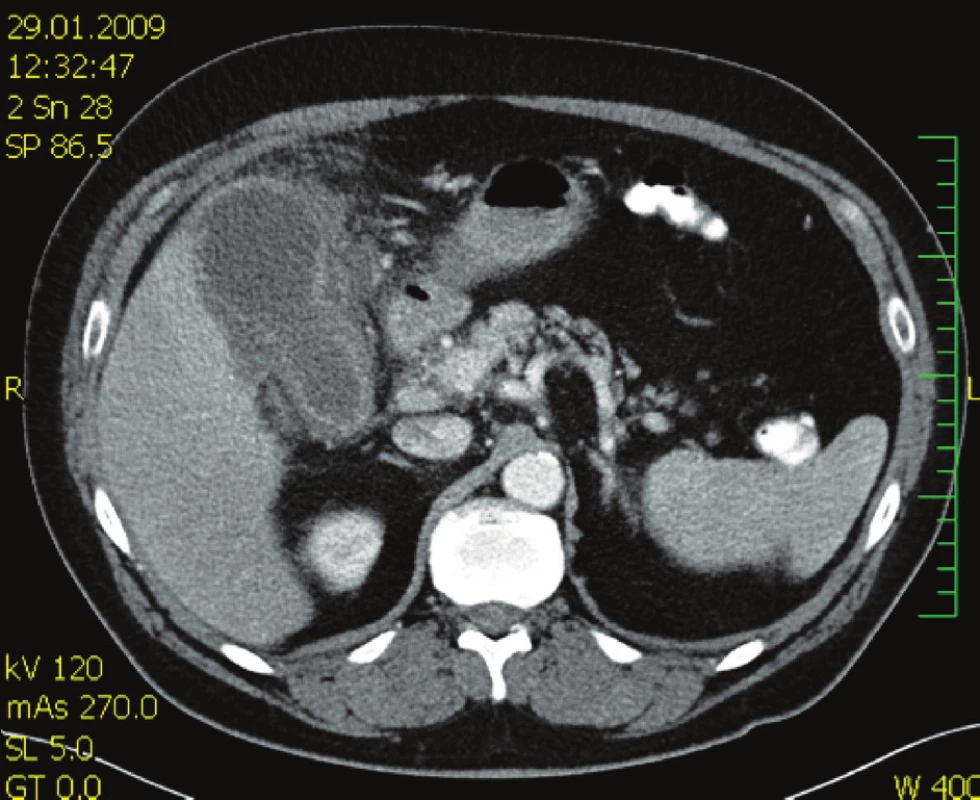
Image 2. CT vyšetření břicha s nálezem defektu v břišní stěně se vzduchem Fig. 2. Abdominal CT examination showing an abdominal wall defect with air 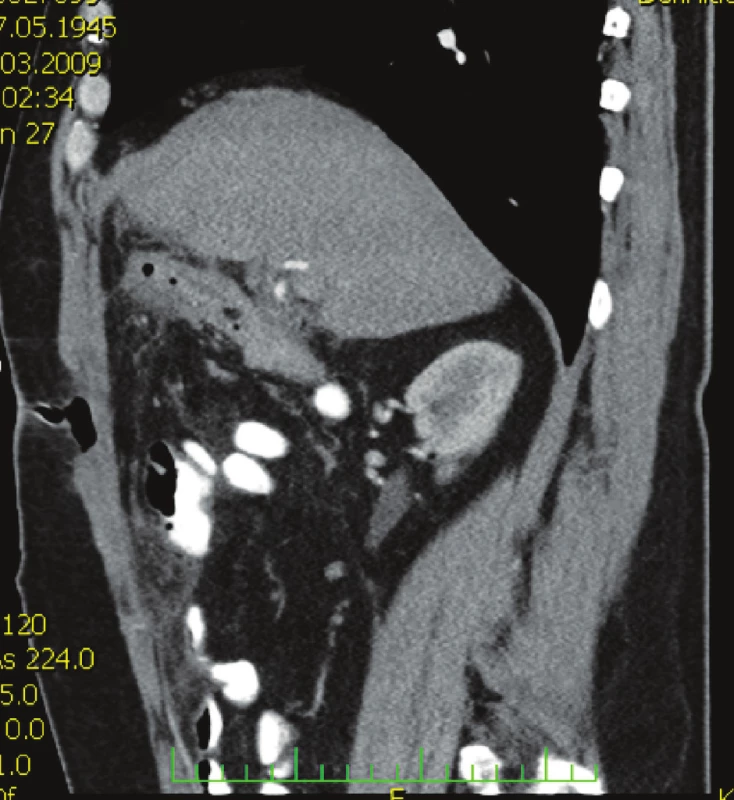
KAZUISTIKA 2
Nemocný, 56 let, přijat na chirurgickou kliniku s bolestí v pravém mezogastriu, zvracením, febrilní (37,8 °C) a nálezem na břiše s palpační bolestí v pravém mezo - a hypogastriu se známkami peritoneálního dráždění. Laboratorní vyšetření: leukocyty 18,2, CRP 190,7. Závěr klinického vyšetření: akutní appendicitis. Nemocný indikován k operaci. Operační diagnóza: appendicitis gangrenosa perforativa retrocoecalis, abscesu periappendicularis. Operace: appendektomia, drenáž peritoneální dutiny. Histologický nález: appendix rozsáhle prostoupen fibrinózně hnisavým zánětlivým infiltrátem, obraz ulceroflegmonózní apendicitidy, na mnoha místech přecházející do obrazu apendicitidy gangrenózní. Na povrchu rozsáhle fibrinózně hnisavá periappendicitis s přechodem zánětlivého infiltrátu až i do tukové vazivové tkáně mezoapendixu. Antimikrobní léčba ampicilin / sulbatam, metronidazol. Sedmý pooperační den febrilie 38,3 °C. CRP 188, bolesti v pravém hypogastriu, pro podezření na recidivu nitrobřišní infekce provedeno CT břicha (Obr. 3) s nálezem nitrobřišního abscesu indikována operační revize. Operační diagnóza: abscesuss intraperitonealis hypogastrii dx. Operace: evakuace abscesu, drén. Za tři dny po reoperaci střevní sekrece z drénů, indikována další revize. Operační diagnóza: pistula coecocutanea z dehiscence uzávěru pahýlu appendixu. Operace: sutura céka, laváž, drenáž peritoneální dutiny. Vzhledem k výsledku mikrobiologického vyšetření s nálezem ESBL-Escherichia coli a Klebsiella pneumonie rezistentní na betalaktamázová antibiotika podán tygecyklin v dávce 100 mg i.v. a dále 50 mg po 12 hodinách 7 dní. V dalším průběhu nemocný afebrilní a postupně se snižující sekrece z rány, propuštěn jedenáctý den po druhé reoperaci. Při ambulantní kontrole za 3 dny rána zhojena per secundam.
Image 3. CT vyšetření břicha s nálezem ohraničené kolekce tekutiny v ileocékální krajině Fig. 3. Abdominal CT examination showing defined fluid collection within the ileocaecal region 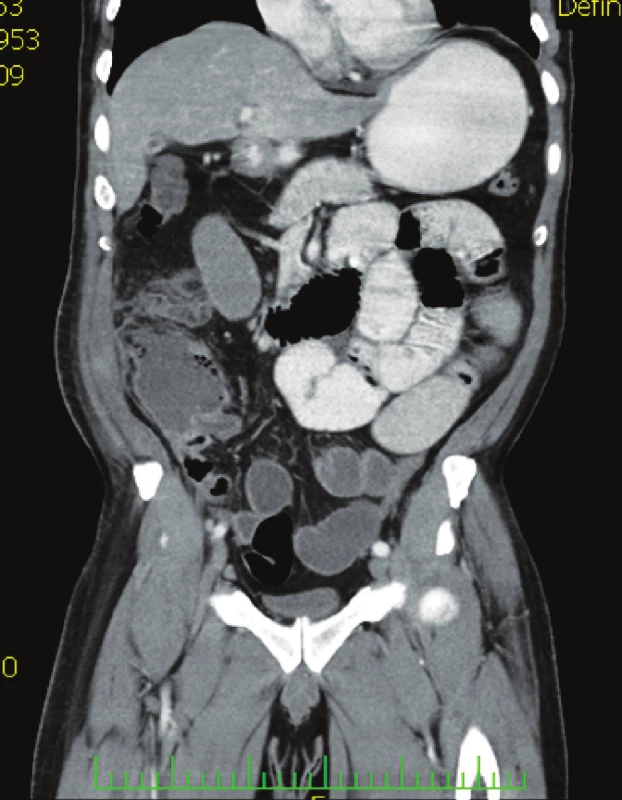
DISKUSE
Výsledek léčby nozokomiální nitrobřišních infekcí především pooperačních závisí na jejich časné diagnóze, rychlé a přiměřené chirurgické nebo radiologické intervenci a výběru účinného antibiotického režimu s cílem volby širokospektrých farmak účinných proti jak častým tak i neobvyklým patogenům [1, 2, 3]. Všechny iniciální antibiotické režimy u nitrobřišní infekcí jsou empirické, protože jde o velký počet potencionálních patogénů a dále fakt, že výsledky kultivace a citlivosti lze získat většinou až po 48 hodinách [1]. Promptní podání antibiotik je nezbytné a studie prokázaly, že podání antibiotik až 8 hodin po přijetí nemocného zvyšuje morbiditu a letalitu a to u obou tj. závažných komunitních – získaných a i u závažných nozokomiálních infekcí [1, 2]. K empirické rozvaze je proto nezbytné zajistit surveillance program, kde je sledována epidemiologická situace u patogenů na daném chirurgickém oddělení. Zvláště pak monitorace rezistentních patogenů jako je ESBL-produkující Enterobacteriaceae, vankomycin rezistentní enterokoky nebo methicilin rezistentní stafylokoky. K ním patří i karbapenem rezistentní Acinetobacter baumani nebo Pseudomonas aeruginosa [1]. Z hlediska výběru léčby jsou doporučovány režimy s monoterapií a kombinovanou léčbou. Především monoterapie je doporučována v léčení vysoce rizikových nemocných s nozokomiální nitrobřišní infekcí a to karbapenemy (meropenem, imipenem/ cilastatatin) nebo širokospektré peniciliny s inhibitorem betalaktamázy (piperacilin - tazobaktam) [1]. Nicméně i jejich účinnost je dnes limitována narůstající rezistencí uvedených multirezistentních bakterií. Mezi novější léčebné možnosti v terapii nozokomiálních infekcí se řadí tygecyklin [5, 6, 7, 8, 9], který má širokospektrou aktivitu a to především proti multirezistentním patogenům. Jediným rezistentním patogenem je Pseudomonas aeruginosa, což bylo prokázáno i v naší studii. Klinické studie srovnávaly účinek tygecyklinu s imimpenem / cilastatinem u nitrobřišních infekcí Výsledky byly srovnatelné (vyléčeno 89 % vs. 88 % nemocných) a i pokud jde o eradikaci jednotlivých patogenů (Escherichia coli 86,2 % vs. 87,1 %, Klebsiella pneumonie 88,5 % vs. 90 %, MRSA 92,9 % vs. 91,7 %). V taktice podání tygecyklinu u nitrobřišní infekcí je v současné době indikován jako: 1. iniciální empirická antimikrobní léčba komplikovaných infekcí (sekundární peritonitidy) s příznaky SIRS, 2. cílená antimikrobní léčba u nozokomiálních infekcí (pooperační peritonitida, absces, infekce chirurgického místa), 3. cílená antimikrobní léčba u reziduální infekce při selhání iniciální empirické antibiotické léčby [5, 6]. Limitující faktor tj. rezistence u Pseudomonas aeruginosa je u empirické antimikrobní léčby minimální, protože tento patogen je příčinou nozokominálních infekcí v pooperačním průběhu.
Zkušenosti s cílenou léčbou u nozokominální infekce vyvolané multirezistentními patogeny znamenají zařazení tygecyklinu jako antibiotika první volby.
ZÁVĚR
Výběr antimikrobní léčby u nozokomiálních nitrobřišní infekcí vyžaduje pečlivou úvahu s pohledu řady faktorů jako je předchozí antibiotická léčba a přidružená onemocnění a aktuální stav citlivosti především multirezistentních potenciálních nozokomiálních patogenů. Současné doporučení je u těchto infekcí pro volbu antibiotika účinného proti aerobním i anaerobním bakteriím. Tygecyklin je první z glycylcyklinů, který má významnou účinnost proti rezistentním Gram-pozitivním mikroorganismům a i kličovým Gram-negativním fakultativním bakteriím, které jsou často spojené s nitrobřišní infekcí. Dosavadní klinické zkušenosti ukazují, že tygecyklin je bezpečný a účinný v léčbě komplikovaných nitrobřišní infekcí. Tygecyklin reprezentuje slibné doplnění spektra v antimikrobní léčbě těchto závažných infekcí.
Doc. MUDr. František Vyhnánek, CSc.
Chirurgická klinika FNKV
Šrobárova 50
100 34 Praha 10
e-mail: vyhnanek@fnkv.cz
Sources
1. Dupont, H. The empiric treatment of nosocomial intra-abdominal infections. Int. J. Infect Dis., 2007 ,11: Suppl. 1: S1–S6.
2. Cheadle, W. G., Spain, D. A. The continuing challenge of intra-abdominal infection. Am. J. Surg., 2003, 186 : 5: 15–22.
3. Vogel, T. R., Dombrovskiy, V. Y., Lowry, S. F. Trends in postoperative sepsis: Are we improving outcomes? Surg. Infect., 2009, 10 : 1: 71–78.
4. Mazuski, J. E. Vancomycin-resistant enterococcus: risk factors, surveillance, infections, and treatment. Surg. Infect., 2008, 9 : 6: 567–571.
5. Fomin, P., Beran, M., Gradauskas, A., et al. Tygecycline is efficacious in the treatment of complicated intra-abdominal infections. Int. J. Surg., 2005, 3 : 1: 35–47.
6. Homer-Vanniasinkam, S. Treatment of intra-abdominal and skin and soft tissue infections: The role of the glycylcyclines. Int. J. Surg., 2005, 4 : 1: 45–52.
7. Marešová, V., Urbánková, P. Tigecyklin. Remedia, 2008, 18 : 3: 194–200.
8. Wilcox, M. H. Efficacy of tigecycline in complicated structure infections and complicated Intra-abdominal infections. J. Chemother., 2005, 17: Suppl. 1: S23–S29.
9. Babinchak, T., Ellis-Grosse, E., Dartois, N., et al. The efficacy and safety of tigecycline for the treatment of complicated intra-abdominal infections: analysis of pooled clinical trial data. Clin. Infect. Dis., 2005, 41: Suppl. 5: S354–S367.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2009 Issue 9-
All articles in this issue
- Transmyokardiální laserová revaskularizace
- Náhrada aortální chlopně a vzestupné aorty u pacienta s Takayasuovou arteritidou
- Kompresivní syndromy n. suprascapularis – zkušenosti s chirurgickou léčbou
- Antimikrobní léčba nozokomiálních nitrobřišních infekcí – nové léčebné možnosti tygecyklinem
- Laparoskopické resekce jater. Úspěchy a nezdary spojené se zavedením techniky – soubor kazuistik
- Laparoskopická adrenalektomie
- Cizí tělesa – méně obvyklá příčina poranění zažívacího traktu
- Fast track koncept v kolorektální chirurgii v podmínkách nemocnice okresního typu
- Fast track ve střevní chirurgii, aktuální přehled
- Operace varixů dolních končetin radiofrekvenční ablací metodou VNUS-Closure®
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Kompresivní syndromy n. suprascapularis – zkušenosti s chirurgickou léčbou
- Fast track ve střevní chirurgii, aktuální přehled
- Cizí tělesa – méně obvyklá příčina poranění zažívacího traktu
- Laparoskopická adrenalektomie
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

