-
Medical journals
- Career
Reexpanzný pľúcny edém, ako komplikácia drenáže hrudníka pri spontánnom pneumotoraxe – kazuistika
Authors: T. Toporcer; J. Iľková; L. Lakyová; J. Belák; J. Radoňak
Authors‘ workplace: II. chirurgická klinika, LF, UPJŠ, Košice, Slovenská republika, prednosta: MUDr. J. Belák, Ph. D.
Published in: Rozhl. Chir., 2008, roč. 87, č. 7, s. 347-351.
Category: Monothematic special - Original
Overview
Reexpanzný pľúcny edém je iatrogénna komplikácia vyskytujúca sa po reinflácii kolabovaných pľúc pri pneumotoraxe a fluidotoraxe. Medzi rizikové faktory patrí mladší vek pacientov, dlhšie trvanie pneumotoraxu, jeho veľký rozsah a rýchla reexpanzia pľúc.
Prezentovaná je kazuistika 26ročného muža, ktorý bol prijatý na II. chirurgickú kliniku FNLP, Košice s kompletným pravostranným pneumotoraxom. Bola vykonaná drenáž pravej hrudníkovej dutiny v lokálnej anestézii, v štvrtom medzirebrí a prednej axilárnej čiare. Po aplikovaní aktívneho podtlaku 20 cm H₂O bolo u pacienta zaznamenané náhle dyspnoe, pokles tlaku, tachykardia, tachypnoe a expektorácia ružového spúta. Saturácia krvi O₂ vykazovala hodnoty 90% napriek podávaniu kyslíka. Pacientovi boli podané, glukokortikoidy, diuretiká, analgetiká a bronchodilatanciá. Röntgen hrudníka a vyšetrenie počítačovou tomografiou potvrdili diagnózu výrazného pravostranného a incipientného ľavostranného pľúcneho edému. Stav pacienta sa postupne stabilizoval a po 16 hodinách nebolo potrebné podávať O₂ maskou. Pre pretrvávajúci pneumotorax bol pacient na 7. deň hospitalizácie podrobený videoasistovanej torakotómii. Po 13 dňoch hospitalizácie bol pacient prepustený v dobrom stave do ambulantnej starostlivosti.
Reperfúzny pľúcny edém je raritnou komplikáciou hrudníkovej drenáže a torakocentézy pri pneumotoraxe i fluidotoraxe, je však zaťažený mortalitou až 20%. Drenáž hrudníkovej dutiny a torakocentéza sú preto terapeutické postupy, ktoré patria výhradne na pracovisko s možnosťou zabezpečenia umelej pľúcnej ventilácie.Kľúčová slova:
reexpanzný pľúcny edém – spontánny pneumotorax – hrudníková drenážÚVOD
Reexpanzný pľúcny edém (RPE) je iatrogénna komplikácia vyskytujúca sa po reinflácii kolabovaných pľúc [1, 2]. Prvý krát bol RPE popísaný Pinaultom v roku 1853 ako komplikácia torakocentézy [3]. Prvá detailne popísaná kazuistika pochádza z roku 1875 [2]. RPE ako komplikáciu liečby pneumotoraxu však prvý krát popísal až Carlson v roku 1958 [4]. Väčšina štúdii zaraďuje RPE medzi raritné komplikácie liečby spontánneho pneumotoraxu s incidenciou 0 až 14% [5, 2]. Existujú však aj štúdie prezentujúce až 57% incidenciu RPE pri drenáži hrudníkovej dutiny pre spontánny pneumotorax [6]. Väčšina prác udáva výskyt RPE v reexpandovaných pľúcach, existujú však aj práce prezentujúce kontralaterálny výskyt RPE [7]. Priebeh RPE môže byť subklinický, len s pozitívnym röntgenologickým nálezom, sú však popísané i fatálne dôsledky RPE [8]. Niektorí autori prezentujú mortalitu spájanú s RPE viac ako 20 % [8].
Presná patofyziológia vzniku RPE je doposiaľ neznáma. Medzi rizikové faktory patrí mladší vek pacientov (< 40 rokov), dlhšie trvanie pneumotoraxu (> 4 dni), jeho veľký rozsah (> 30 % kapacity pľúc) a rýchla reexpanzia pľúc [5]. Hypoxická vazokonstrikcia v kolabovaných pľúcach pri dlhšom trvaní pneumotoraxu vedie k ischemickému poškodeniu postihnutých pľúc. Náhla reexpanzia je spojená so zvýšenou reoxigenáciou čo vedie k hypoxicko reperfúznemu poškodeniu so všetkými jeho špecifikami [2]. Náhly prísun kyslíka vedie k uvoľneniu kyslíkových radikálov, ktorých hlavným zdrojom je xantín oxidáza. Xantín oxidázou aktivované reaktívne kyslíkové radikáli vedú k poškodeniu alveolokapilárnej bariéry, zvýšeniu permeability kapilár a takzvanému capillary leak syndrómu [9]. Prezentovaný je aj vzostup hladiny interleukínu 8 (IL-8), tumorózneho nekrotického faktoru α (TNF-α) a monocytového chemoatraktant-proteínu 1 [7, 9, 2]. Uvoľnenie týchto aktívnych molekúl vedie k aktivácii monocytov, makrofágov a neutrofilov, sekvestrácii aktivovaných leukocytov a ďalej k poškodeniu mikrokapilár a alveolo-kapilárnej bariéry [2, 7]. Uvoľnenie reaktívnych molekúl môže viesť k poškodeniu nie len ipsilaterálnych pľúc, ale i iných orgánov [7].
Cieľom práce prezentujúcej kazuistiku RPE pri hrudníkovej drenáži pre spontánny pneumotorax je upozorniť odbornú verejnosť na túto raritnú, avšak potencionálne letálnu iatrogénnu komplikáciu terapie. Práca upozorňuje na diskrepancie v terapeutických štandardoch spontánneho pneumotoraxu i na varianty terapie RPE prezentované rôznymi autormi.
KAZUISTIKA
Prezentovaná je kazuistika 26ročného muža. Pri prijatí pacient anamnesticky udával bolesti medzi lopatkami a dyspnoické ťažkosti, ktoré začali pred deviatimi dňami. Ošetrený bol v spádovej nemocnici ako vertebrogénny algický syndróm, bolesti však neustávali. Na pľúcnej ambulancii bola vykonaná röntgenova snimka (RTG) hrudníka, ktorá poukazovala na kompletný spontánny pneumotorax (PNO) vpravo (Obr. 1). Pacient bol odoslaný na II. chirurgickú kliniku FNLP za účelom drenáže hrudníkovej dutiny a ďalšej liečby.
Image 1. RTG hrudníka pri prijatí, zobrazujúca kompletný spontánny PNO vpravo Fig. 1. Thoracic X-ray on admission, depicting complete spontaneous pneumothorax on the right 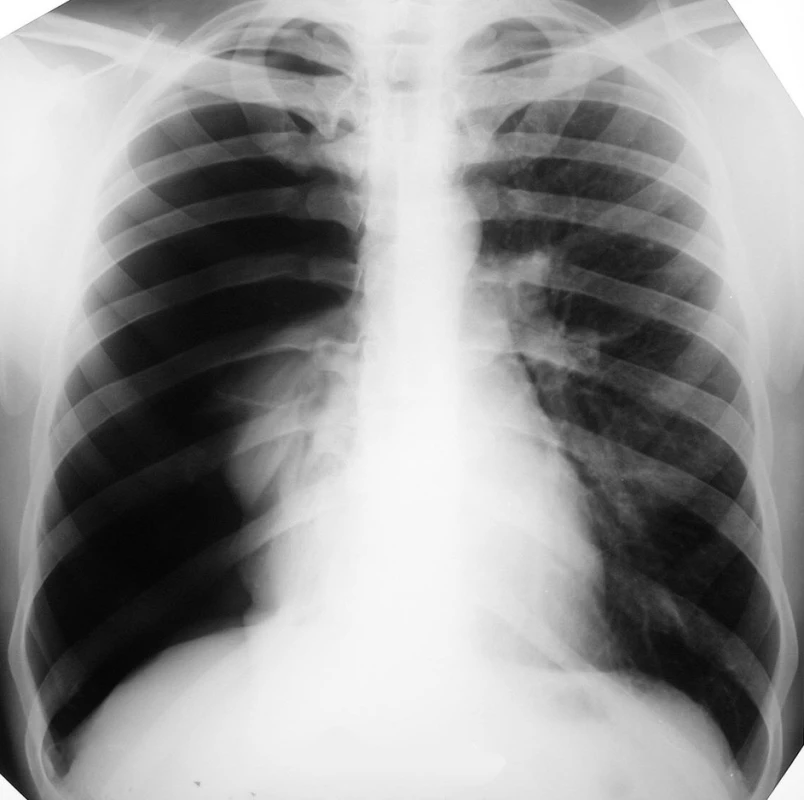
Pacient bol prijatý na jednotku intenzívnej starostlivosti. Udával sťažené dýchanie, avšak kľudové eupnoe. Podľa pulzného oxymetra bola saturácia krvi O2 96 %. Vykonaná bola drenáž pravej hrudníkovej dutiny v lokálnej anestézii v štvrtom medzirebrí v prednej axilárnej čiare. Drén bol 30 min. po drenáži ponechaný pod vodnou hladinou a následne bol napojený na aktívne odsávanie s podtlakom 20 cm vodného stĺpca. U pacienta bolo zaznamenané náhle dyspnoe, pokles tlaku, tachykardia, tachypnoe a expektorácia ružového spúta. Bolo podané O2 maskou (5 l/min), avšak podľa pulzného oxymetra bola saturácia krvi O2 len 90 až 92 %. RTG hrudníka 3 hod. po drenáži poukázala na difúzne zatienenie celého pravého pľúcneho krídla s početnými splývajúcimi infiltrátmi vpravo a zvýraznenou bronchiálnou kresbou vľavo, s pretrvávajúcim plášťovým PNO vpravo (Obr. 2). Bolo vyslovené podozrenie pre pravostranný reexpanzný edém pľúc. Indikované boli glukokortikoidy (Depo-Medrol 200 mg iv. bolus a 100mg iv. / 6 hod.), diuretiká (Furosemid 20 mg im. bolus), analgetiká (Dolsin 75 mg im. /8 hod., Novalgin 1 g. iv. /6 hod.) a bronchodilatanciá (Syntophyllin 120 mg/12 hod.). Päť hodín po drenáži hrudníka bolo vykonané vyšetrenie hrudníka počítačovou tomografiou (CT) poukazujúce na pretrvávajúci PNO vpravo hrúbky 4 cm a fluidotorax vpravo hrúbky 1 cm. Popísané bolo zhrubnutie peribronchovaskulárneho interstícia a bazálne v dolnom laloku diskrétny nález acinóznych opacifikácií a mikronodulárnych až nodulárnych opacifikácií vpravo. Záver CT vyšetrenia bol nasledovný: nález svedčí najskôr pre prítomnosť alveolárneho edému vpravo, s incipientnými známkami edematóznych zmien aj v ľavých pľúcach, fluidotorax vpravo a PNO vpravo (Obr. 3). Pokračovalo sa v medikamentóznej terapii i aplikácii O2 maskou. Stav pacienta sa postupne stabilizoval saturácia krvi O2 pulznou oxymetriou vykazovala hodnoty 92 až 96 %, 16 hod. po drenáži dosiahla 98 % a pacientovi prestal byť podávaný O2 maskou. Po odpojení pacienta od kyslíka bola saturácia vyšetrená pulznou oxymetriou kontinuálne viac ako 95 %. Časový priebeh saturácie krvi O2 vyšetrený pomocou ABR z kapilárnej krvi zobrazuje graf 1. Kontrolné RTG hrudníka opakované 1, 3 a 5 dní po drenáži vykazovali postupný ústup edému pravého pľúcneho krídla, avšak pretrvávajúci plášťový PNO (Obr. 4).
Image 2. RTG hrudníka 3 hod. po drenáži hrudníkovej dutiny, zobrazujúca difúzne zatienenie celého pravého pľúcneho krídla s početnými splývajúcimi infiltrátmi vpravo a zvýraznenou bronchiálnou kresbou vľavo, s pretrvávajúcim plášťovým PNO vpravo Fig. 2. Thoracic x-ray 3 hours following drainage of the thoracic cavity, depicting diffuse density over the whole right lung with multiple coalescing infiltrations on the right and marked bronchial outline on the left, with persisting pneumothorax on the right 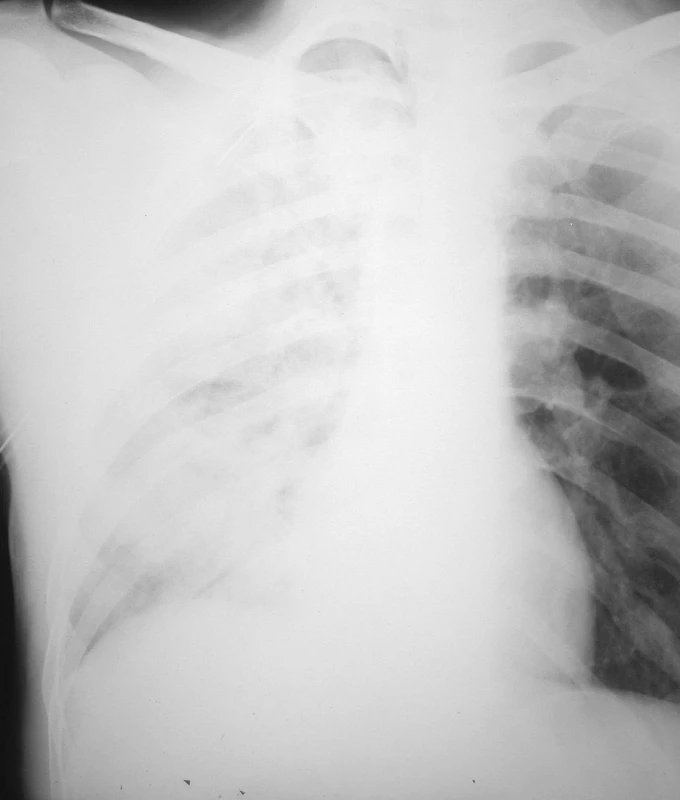
Image 3. CT hrudníka 5 hod po drenáži hrudníkovej dutiny, svedčiace najskôr pre prítomnosť alveolárneho edému vpravo, s incipientnými známkami edematóznych zmien aj v ľavých pľúcach, fluidotorax vpravo a PNO vpravo (A – transverzálny rez v úrovni 7. hrudného stavca, B – transverzálny rez v úrovni 9. hrudného stavca) Fig. 3. Thoracic CT 5 hours following drainage of the thoracic cavity, suggesting presence of alveolar edema on the right, with incipient signs of edematous changes in the left lung, fluidothorax on the right and pneumothorax on the right (A – transverse section at the T-7level , B – transverse section at the T-9 level ) 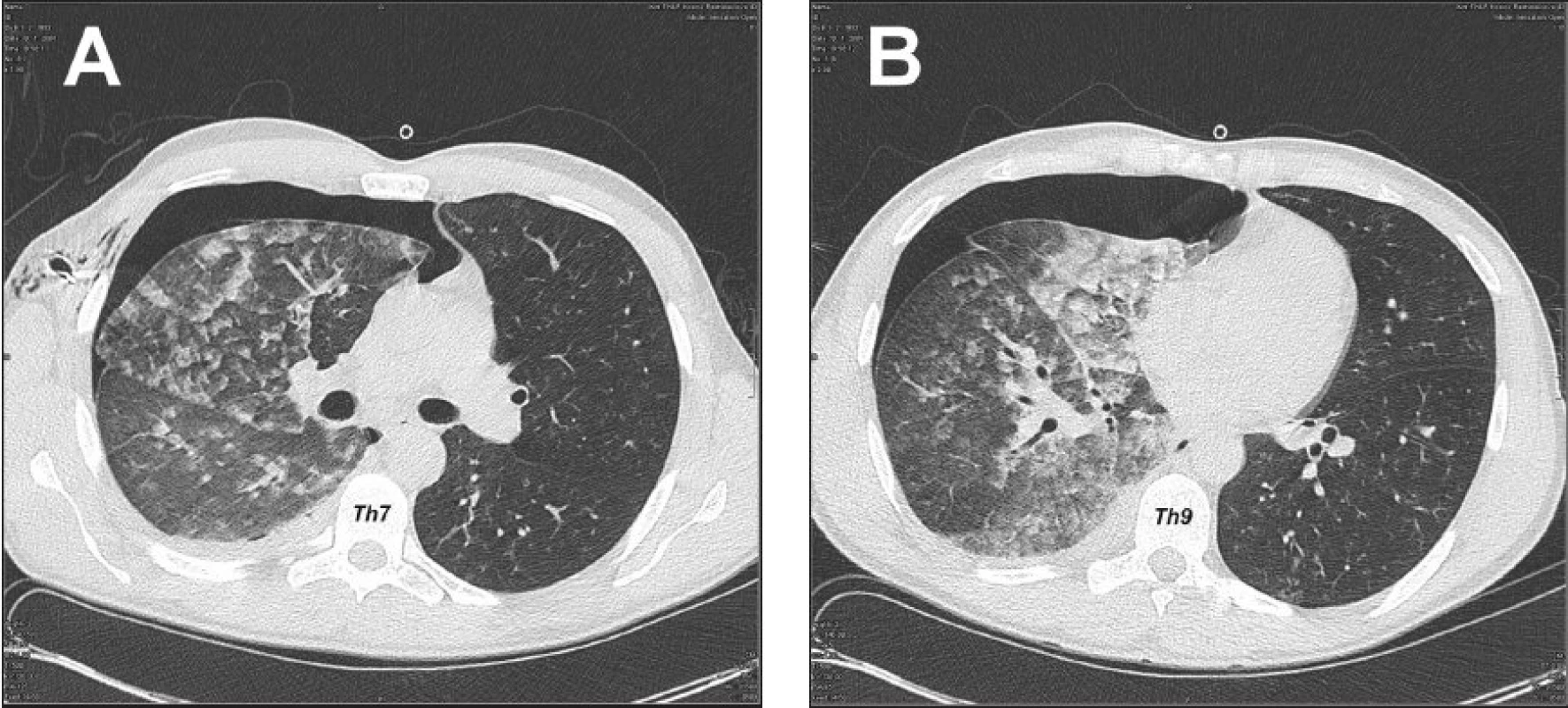
Image 4. RTG hrudníka 5 dní po drenáži hrudníkovej dutiny, zobrazujúca ústup pľúcneho edému a pretrvávajúci PNO vpravo Fig. 4. Thoracic x-ray 5 days following drainage of the thoracic cavity, depicting resolving pulmonary edema and persisting pneumothorax on the right 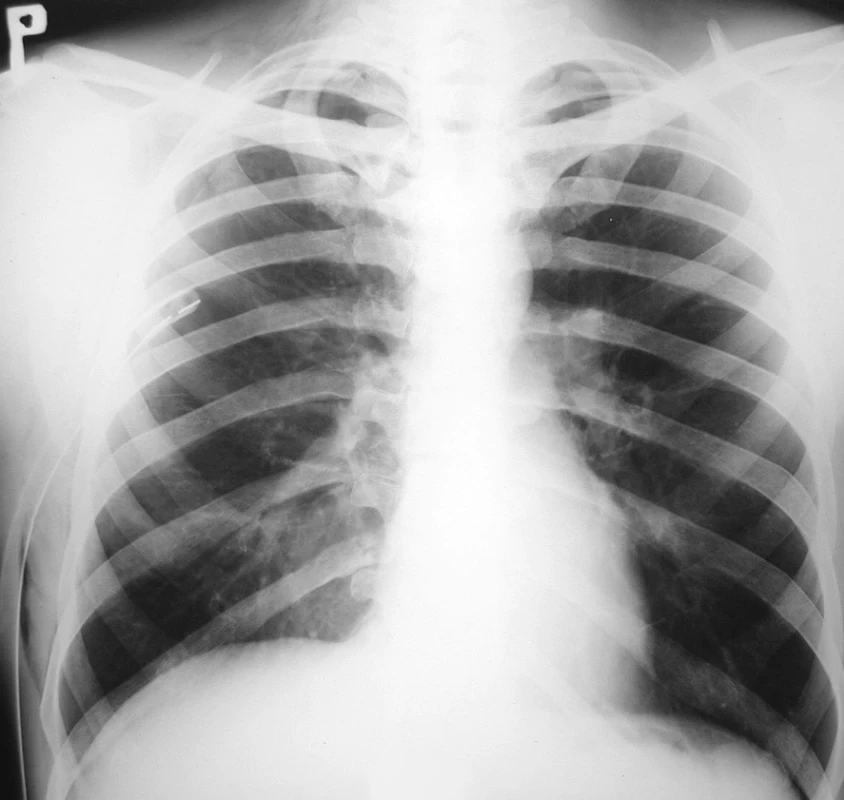
Graph 1. Časový priebeh saturácie krvi pacienta vyšetrený ABR (vodorovná osa zobrazuje čas od vykonania hrudníkovej drenáže) Graph 1. Time course of a patient’s blood saturation examined using ABR (the horizontal axis shows the time from the thoracic drainage) 
Pre pretrvávajúci PNO bol pacient 7. deň hospitalizácie podrobený operačnému výkonu. Vykonaná bola videoasistovaná torakotómia. V hornom a strednom laloku pľúc boli zistené rozsiahle buly a vykonaná bola ich tangenciálna resekcia, a parciálna pleurektómia v rozsahu horného laloka s abráziou pleury. Histologické vyšetrenie excidovanej vzorky odhalilo ložiskový kolaps pľúcneho tkaniva, areály chronického ložiskového emfyzému, hyperpláziu pneumocytov II. typu a ložiskové krvácania v tkanive pľúc. Operačný a pooperačný priebeh bol bez komplikácií, kontrolné RTG hrudníka vykazovala ústup PNO. Pacient bol po 13 dňoch hospitalizácie prepustený do ambulantnej starostlivosti v dobrom stave.
DISKUSIA
Napriek nejasnostiam v etiopatogenéze RPE väčšina v súčasnosti publikovaných experimentálnych i klinických prác poukazuje na dôležitú úlohu vzniku kyslíkových radikálov produkciou xantín oxidázy, TNF-α a IL-8 najmä v pneumocytoch II typu [9]. Histologické vyšetrenie excidovaného tkaniva pľúc poukázalo na hyperpláziu pneumocytov II typu, čo koreluje s publikovanými teóriami etiopatogenézy RPE. Systémové uvoľnenie aktívnych molekúl môže viesť k poškodeniu aj iných orgánov. Opakovane je v literatúre prezentovaný vznik kontralaterálneho pľúcneho edému a syndrómu akútnej respiračnej tiesne dospelých (ARDS) pri RPE [7, 10]. V prezentovanom prípade CT vyšetrenie poukázalo na incipientný kontralaterálny pľúcny edém, čo nasvedčuje systémovému pôsobeniu uvoľnených molekúl aj v uvedenej kazuistike. Pri ďalšom uvoľňovaní prozápalových cytokínov a kyslíkových radikálov z poškodených pľúc môže dôjsť k poškodeniu aj ďalších orgánových systémov a v konečnom dôsledku až k syndrómu systémovej zápalovej odpovede (SIRS) [7]. U nášho pacienta bola zaznamenaná elevácia sérovej hladiny c-reaktívneho proteínu (CRP), aspartátaminotransferázy (AST), alanínaminotransferázy (ALT) a gamma-glutamil transferázy (GMT), výraznejšie ovplyvnenie iných funkčných parametrov však nebolo zistené.
Drenáž hrudníkovej dutiny je v našich krajinách dnes stále zlatým štandardom liečby spontánneho PNO [11]. Je indikovaná pri totálnom i parciálnom symptomatickom PNO a pri neúspešnosti konzervatívnej terapie [12]. Štandardy vydané Britskou hrudníkovou asociáciou však odporúčajú drenáž hrudníkovej dutiny až pri neúspešnosti aspiračnej punkcie [10]. Väčšina prác porovnávajúca aspekty aspiračnej punkcie a hrudníkovej drenáže neprezentuje markantnejšie rozdiely medzi terapeutickým efektom týchto dvoch postupov, zdôrazňujúc diferenciálnu invazivitu [13]. Množstvo prác zaoberajúcich sa terapiou spontánneho PNO uvádza medzi metodikami drenáž hrudníkovej dutiny, avšak nešpecifikuje parametre aplikácie podtlaku hneď po drenáži [13, 12]. Iné práce medzi možné komplikácie drenáže hrudníkovej dutiny pri spontánnom PNO nezaradzujú RPE [13]. Štandardy liečby PNO publikované Americkým kolégiom hrudníkových lekárov, uvádza hrudníkovú drenáž ako možnú terapeutickú voľbu manifestného i nemanifestného PNO. Štandardy ďalej uvádzajú možnosť aplikovania podtlaku 20 cm H2O hrudníkovým drénom okamžite po jeho zavedení [14]. S týmito štandardmi ďalej korelujú aj terapeutické odporúčania uvádzané domácimi autormi a učebnice chirurgie [15, 16]. Terapeutický postup zvolený v prezentovanom prípade spĺňa podmienky a odporúčania týchto terapeutických štandardov. Britská hrudníková asociácia však prezentuje v roku 2003 diferenciálne odlišný pohľad na aplikovanie podtlaku hrudníkovou drenážou pri spontánnom PNO. Okamžité aplikovanie podtlaku po hrudníkovej drenáži je prísne kontraindikované práve pre riziko vzniku PNO. Prvých 48 hodín po zavedení hrudníkového drénu má byť drén umiestnený pod vodnú hladinu alebo na Heimlichovu chlopňu. Pri pretrvávaní PNO aj po 48 hodinách má byť drenáž napojená na aktívne odsávanie s podtlakom 20 cm H2O [10]. Práce ďalej prezentujú, že aj pri opomenutí rizika vzniku RPE, skoršie aplikovanie aktívneho odsávania nevedie k lepším terapeutickým efektom drenáže [17]. Na druhej strane, RPE môže vzniknúť aj pri neaplikovaní aktívneho odsávania [8, 18, 19]. V prezentovanom prípade však vznikli dyspnoické ťažkosti až po aplikovaní aktívneho podtlaku, čo koreluje s teóriou vyššieho rizika vzniku RPE pri aplikovaní podtlaku v porovnaní s pasívnym odsávaním. Feller-Kopman a kol. v svojej štúdii zdôrazňujú že prezentované riziko vzniku RPE je preceňované. Autori navyše odporúčajú zvýšenie hranice odporúčaného maximálneho podtlaku pri torakocentéze [3].
Vzhľadom na raritnosť RPE nie je doposiaľ terapia tohto ochorenia presne definovaná. Väčšina prác ako základnú terapiu uvádza aplikáciu O2 maskou [3, 5, 20, 21]. Viacero autorov sa zhoduje aj na aplikovaní inotropík, diuretík, a bronchodilatancií [3, 5, 20]. Zápalový charakter RPE a nebezpečenstvo progresie ochorenia do štádia SIRS indikuje aj aplikáciu steroidov [3, 5, 20, 22]. Terapia aplikovaná v prezentovanom prípade koreluje s publikovanými prácami. Pri výraznejšej respiračnej insuficiencii je ako terapia RPE odporúčaná umelá pľúcna ventilácia s pozitívnym koncovoexspiračným tlakom (PEEP) 5 cm H2O [3, 20]. Cho a kol. prezentujú kazuistiku RPE, kde bola pacientovi terapeuticky zavedená dvojcestná endobronchiálna kanyla. Zdravé pľúca boli ventilované (ventilačný objem: 400 ml, frekvencia: 20 / min, FI O2 1,0) a z pľúcneho krídla postihnutého RPE bolo počas prvých 70 min rozvoja RPE odsatých 700 ml tekutiny. Následne boli postihnuté pľúca napojené na druhý respiračný prístroj s ventilančným objemom 350 ml, frekvenciou 25/min, FI O2 1,0 a PEEP 5 cm H2O. Po 48 hodinách dvojcestnej ventilácie bol pacient reintubovaný endotracheálnou kanylou, a ponechaný na umelej pľúcnej ventilácii ešte nasledujúce 4 dni. Autori prezentujú veľmi pozitívne výsledky tohto terapeutického režimu [20]. Samostatná ventilácia zdravých a postihnutých pľúc je dôležitá z hľadiska diferenciálne rozdielnych tlakových pomerov v pľúcnych krídlach spôsobených unilaterálnym RPE, v súčasnosti však nepatrí k štandardnej terapii RPE. Novodobé pohľady na etiopatogenézu RPE prinášajú aj nové terapeutické možnosti. Experimentálne práce poukazujú na aplikáciu monoklonálnych protilátok proti IL-8 a xantín-oxidáze, inhibítorov adenozín 3,5-cyklický monofosfát fosfodyesterázy a inhibítorov fosfolipázy A2 [2, 7]. Pred použitím týchto preparátov v klinickej praxi sú však potrebné ďalšie štúdie. Už dnes je však indikované použitie antioxidantov, ako napríklad vitamínu E.
ZÁVER
Reperfúzny pľúcny edém je síce raritnou komplikáciou hrudníkovej drenáže a torakocentézy pri pneumotoraxe i fluidotoraxe, je však zaťažený vysokou mortalitou. Medzi rizikové faktory vzniku patrí mladší vek pacientov, dlhšie trvanie pneumotoraxu, jeho veľký rozsah a rýchla reexpanzia pľúc. V súčasnosti publikované štandardy drenáže hrudníkovej dutiny už zahŕňajú kontraindikácie aplikovania aktívneho odsávania počas prvých 48 hodín po drenáži, ako prevenciu vzniku RPE. Medzi terapeutické postupy liečby RPE patrí aplikovanie O2 maskou, aplikovanie inotropík, diuretík, bronchodilatancií a glukokortikoidov. Pri ťažkom klinickom priebehu RPE je indikovaná umelá pľúcna ventilácia s pozitívnym koncovoexspiračným tlakom. Drenáž hrudníkovej dutiny a torakocentéza sú teda terapeutické postupy, ktoré patria výhradne na pracovisko s možnosťou zabezpečenia umelej pľúcnej ventilácie.
MUDr. T. Toporcer
II. chirurgická klinika
Rastislavova 43
040 01 Košice
Slovenská republika
e-mail: topyto@gmail.com
Sources
1. Kelly, A. M. Review of management of primary spontaneous pneumotorax: is the best evidence clearer 15 years on? Emerg. Med. Australas., 2007; 19 : 303–308.
2. Neustein, S. M. Reexpansion pulmonary edema. J. Cardiotorac. Vasc. Anesth., 2007; 21 : 887–891.
3. Feller-Kopman, D., Berkowitz, D., Boiselle, P., et al. Large-volume toracocentesis and the risk of reexpansion pulmonary edema. Ann. Torac. Surg., 2007; 84 : 1656–1661.
4. Carlson, R. I., Classen, K. L., Gollan, F., et al. Pulmonary edema following the rapid reexpansion of a totally collapsed lung due to a pneumotorax: a clinical and experimental study. Surg. Forum, 1958; 9 : 367–371.
5. Conen, A., Joos, L., Bingisser, R. Ipsilateral reexpansion pulmonary edema after drainage of a spontaneous pneumotorax: a case report. J. Med. Case Reports., 2007; 1 : 107–107.
6. Tan, H. C., Mak, K. H., Johan, A., et al. Cardiac output increases prior to development of pulmonary edema after re-expansion of spontaneous pneumotorax. Respir. Med., 2002; 96 : 461–465.
7. Her, C., Mandy, S. Acute respiratory distress syndrome of the contralateral lung after reexpansion pulmonary edema of a collapsed lung. J. Clin. Anesth., 2004; 16 : 244–250.
8. Mahfood, S., Hix, W. R., Aaron, B. L., et al. Reexpansion pulmonary edema. Ann. Torac. Surg., 1988; 45 : 340–345.
9. Saito, S., Ogawa, J., Minamiya, Y. Pulmonary reexpansion causes xanthine oxidase-induced apoptosis in rat lung. Am. J. Physiol. Lung Cell Mol. Physiol., 2005; 289 : 400–406.
10. Henry, M., Arnold, T., Harvey, J. BTS guidelines for the management of spontaneous pneumotorax. Torax, 2003; 58 : 39–52.
11. Janik, M., Belak, J., Sauka, C., et al. Spontánny pneumotorax. Niekoľko aktuálnych pohľadov. Rozhl. Chir, 1999; 78 : 120–122.
12. Vodička, J., Spidlen, V. Spontánní pneumotorax. Čas. Lék. Česk., 2006; 145 : 611–615.
13. Zehtabchi, S., Rios, C. L. Management of emergency department patients with primary spontaneous pneumotorax: needle aspiration or tube toracostomy? Ann. Emerg. Med., 2008; 51 : 91–100, 100.
14. Baumann, M. H., Strange, C., Heffner, J. E., et al. Management of spontaneous pneumotorax: an American College of Chest Physicians Delphi consensus statement. Chest, 2001; 119 : 590–602.
15. Habal, P., Šimek, J., Novotný, J. Chirurgická léčba pneumotoraxu. Acta Medica. (Hradec Králové) Suppl., 2004; 47 : 47–53.
16. Zeman, M. Speciální chirurgie (2. vydání). Praha, Galen, 2006, 575 s.
17. So, S. Y., Yu, D. Y. Catheter drainage of spontaneous pneumotorax: suction or no suction, early or late removal? Torax, 1982; 37 : 46–48.
18. Baumann, M. H. Management of spontaneous pneumotorax. Clin. Chest Med., 2006; 27 : 369-381.
19. Shaw, T. J., Caterine, J. M. Recurrent re-expansion pulmonary edema. Chest, 1984; 86 : 784–786.
20. Cho, S. R., Lee, J. S., Kim, M. S. New treatment method for reexpansion pulmonary edema: differential lung ventilation. Ann. Torac. Surg., 2005; 80 : 1933–1934.
21. Tariq, S. M., Sadaf, T. Images in clinical medicine. Reexpansion pulmonary edema after treatment of pneumotorax. N. Engl. J. Med., 2006; 354 : 2046.
22. Grendel, T., Hudák, V., Firment, J. Nízke dávky kortikoidov a septický šok. Rozhl. Chir., 2008; 87 : 158–164.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2008 Issue 7-
All articles in this issue
- Zkušenosti s radiofrekvenční termoablací mozkových nádorů
- Ischemické poškození míchy následkem tupého poranění hrudníku – kazuistika
- Reexpanzný pľúcny edém, ako komplikácia drenáže hrudníka pri spontánnom pneumotoraxe – kazuistika
- Pacientka s fibrosarkomem srdce. Kazuistika
- Stenty – paliativní a kurativní ošetření jícnu. Sedmileté zkušenosti chirurgického pracoviště
- Pseudoaneurysma arteria hepatica manifestující se hemobilií jako komplikace laparoskopické cholecystektomie
- Ojedinělé případy liposarkomů retroperitonea obrovských rozměrů
- Rekonstrukce po gastrektomii
- Masivní hemotorax po kanylaci v. subclavia – kazuistika
- Ruptura šlachy m. pectoralis maior a anabolické steroidy v anamnéze – kazuistika
- Hybridní postupy v léčbě pseudoaneurysmat oblouku aorty – kazuistika
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Ruptura šlachy m. pectoralis maior a anabolické steroidy v anamnéze – kazuistika
- Ojedinělé případy liposarkomů retroperitonea obrovských rozměrů
- Reexpanzný pľúcny edém, ako komplikácia drenáže hrudníka pri spontánnom pneumotoraxe – kazuistika
- Stenty – paliativní a kurativní ošetření jícnu. Sedmileté zkušenosti chirurgického pracoviště
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

