-
Medical journals
- Career
Hluboká žíla dolní končetiny jako tepenná náhrada při řešení infekce cévní protézy
Authors: R. Staffa; Z. Kříž; R. Vlachovský
Authors‘ workplace: II. chirurgická klinika LF MU a FN u sv. Anny v Brně, přednosta: doc. MUDr. Z. Gregor, CSc.
Published in: Rozhl. Chir., 2008, roč. 87, č. 4, s. 186-189.
Category: Monothematic special - Original
Overview
Autoři jako první v České republice uskutečnili v červnu 2007 tepennou rekonstrukci, při které jako tepennou náhradu použili autologní hlubokou žílu z dolní končetiny. Vena femoralis superficialis byla za tím účelem odebrána v celé její délce včetně části žíly popliteální. Pacient byl po explantaci infikované cévní protézy, měl kritickou ischemii končetiny s pokročilou gangrénou nohy. Stav vyžadoval iliako-profundální bypass. Z důvodu rizika reinfekce nemohlo být provedeno žádné z tradičních řešení pomocí umělé cévní protézy. Použití hluboké žíly vykazuje velmi dobré výsledky při řešení infekce cévní protézy, jedné z nejobávanějších a nejzávažnějších komplikací v cévní chirurgii.
Klíčová slova:
infekce cévní protézy – vena femoralis superficialis – hluboká žíla dolní končetiny – autogenní rekonstrukceÚVOD
Infekce cévní protézy je relativně vzácnou, avšak velmi závažnou komplikací v cévní chirurgii. Incidence se pohybuje v rozmezí 1–6 % [1]. Chirurgická léčba infekce cévní protézy je spojena s vysokou mortalitou (20–75 %) a vysokým amputačním rizikem (5–25 %) v závislosti na typu a lokalitě graftu [2]. Ačkoliv existuje více alternativ řešení, standardním postupem je explantace infikované cévní protézy a revaskularizace extraanatomickým bypassem. Výsledky však nejsou zcela uspokojivé vzhledem k vyššímu riziku reinfekce nové cévní protézy a nižší dlouhodobé průchodnosti. O poznání lepší výsledky vykazují soubory pacientů, u nichž byla infekce cévní protézy řešena autogenní rekonstrukcí tepen pomocí hlubokých žil dolních končetin [3].
V předložené kazuistice referujeme klinický případ pacienta po explantaci infikované cévní protézy s následnou rekonstrukcí iliako-profundálního úseku pomocí autologní femorální žíly.
KLINICKÝ PŘÍPAD
Muž, 67 let, s kritickou ischemií levé dolní končetiny a gangrénou nohy s pozitivním mikrobiologickým nálezem (Klebsiella pneumonie, Escherichia coli, Staphylococcus sp.) i přes cílenou antibiotickou terapii. U pacienta byla diagnostikována infekce levostranné femoro-popliteální cévní protézy implantované na jiném pracovišti. Předoperační angiografie prokázala okluzi levostranných pánevních tepen včetně společné stehenní tepny. Pacient měl pozitivní zánětlivé markery (C-reaktivní protein – 86,3 mg/l, leukocyty – 16,5 mmol/l) a subfebrilie. Bylo zapotřebí explantovat infikovanou femoro-popliteální cévní protézu a přemostit uzavřené levostranné pánevní tepenné řečiště. Na základě angiografie jsme indikovali iliako-profundální bypass. Proximální anastomózu bylo možno založit na společnou pánevní tepnu, těsně pod bifurkací břišní aorty. Distální anastomózu bylo nutno založit na kmen arteria profunda femoris asi 8 cm pod jejím odstupem ze společné stehenní tepny (Obr. 4). Bylo tedy třeba přemostit asi 32 cm dlouhý úsek. Vzhledem k přítomnosti infekce v třísle a v lůžku po explantované infikované femoro-popliteální protéze jsme jako tepennou náhradu zvolili autologní femorální žílu z druho-stranné končetiny. Venu femoralis superficialis jsme odebrali v celé její délce včetně části vena poplitea tak, abychom docílili požadovanou délku nutnou k plánované rekonstrukci (Obr. 1, 2, 3). Po odstranění chlopní jsme žílu implantovali v nonreverzní pozici. Operační rány se zhojily per primam, během 5 týdnů došlo ke zhojení defektu na noze. Pacient je 10 měsíců po operaci v pořádku, bez elevace zánětlivých markerů, bez otoku pravé dolní končetiny po odběru hluboké žíly (Obr. 5). Žilní bypass je funkční, kontrolní angiografie prokazuje dobrou průchodnost a morfologii bypassu (Obr. 6).
Image 1. Detail distální anastomózy (end to side) žilního štěpu ke kmeni arteria profunda femoris asi 8 cm pod jejím odstupem ze společné stehenní tepny, která je po explantaci infikované cévní protézy ztrombozovaná. Arteria femoralis superficialis je chronicky uzavřena Fig. 4. Detail of distal anastomosis (end-to-side) of the venous graft to the deep femoral artery trunk at about 8 cm below its division from the common femoral artery which was thrombolized after infected prosthesis explantation. The superficial femoral artery was chronically occluded 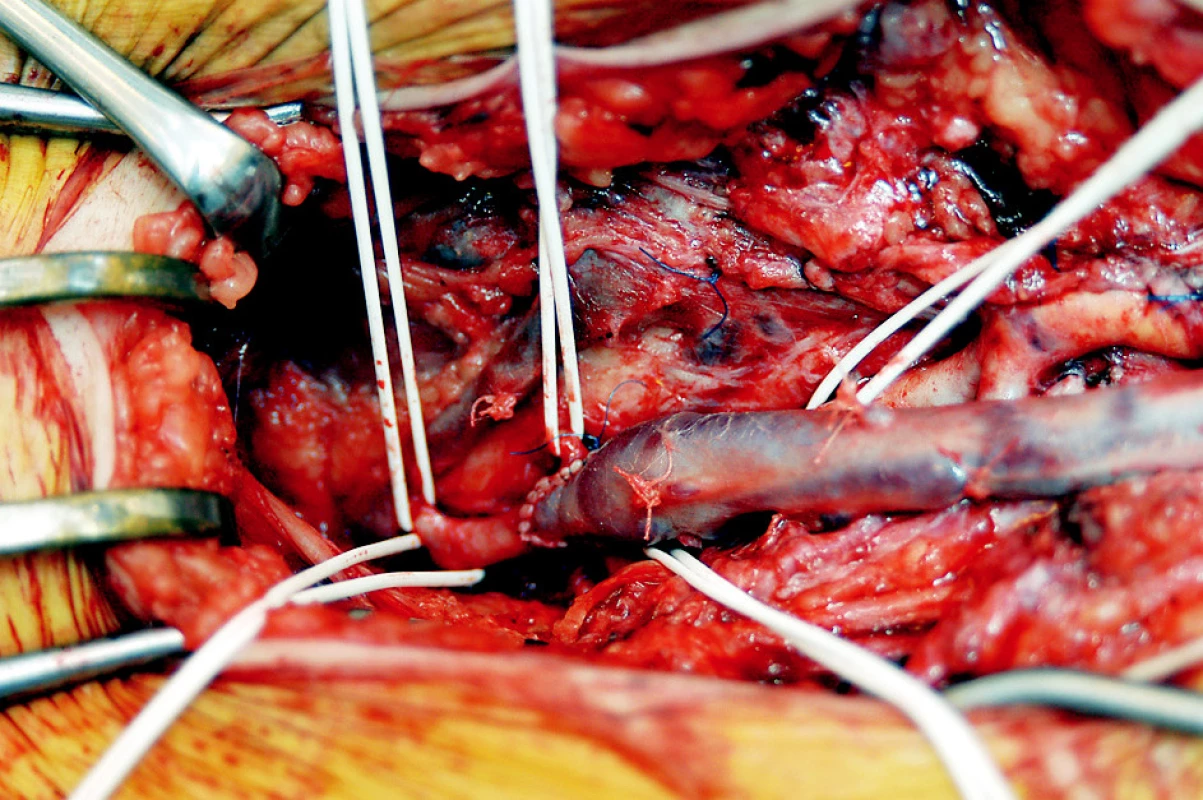
Image 2. Preparace vena femoralis superficialis v pravém třísle a dále v subsartoriálním a Hunterově tunelu, kde probíhá spolu s femorální tepnou. Vlevo je vidět odstup vena profunda femoris Fig. 1. Surgical exploration of the superficial femoral vein in the right groin, and in the subsartorial canal and Hunter’s canal, where it runs alongside the femoral artery. On the left, the deep femoral vein branches off 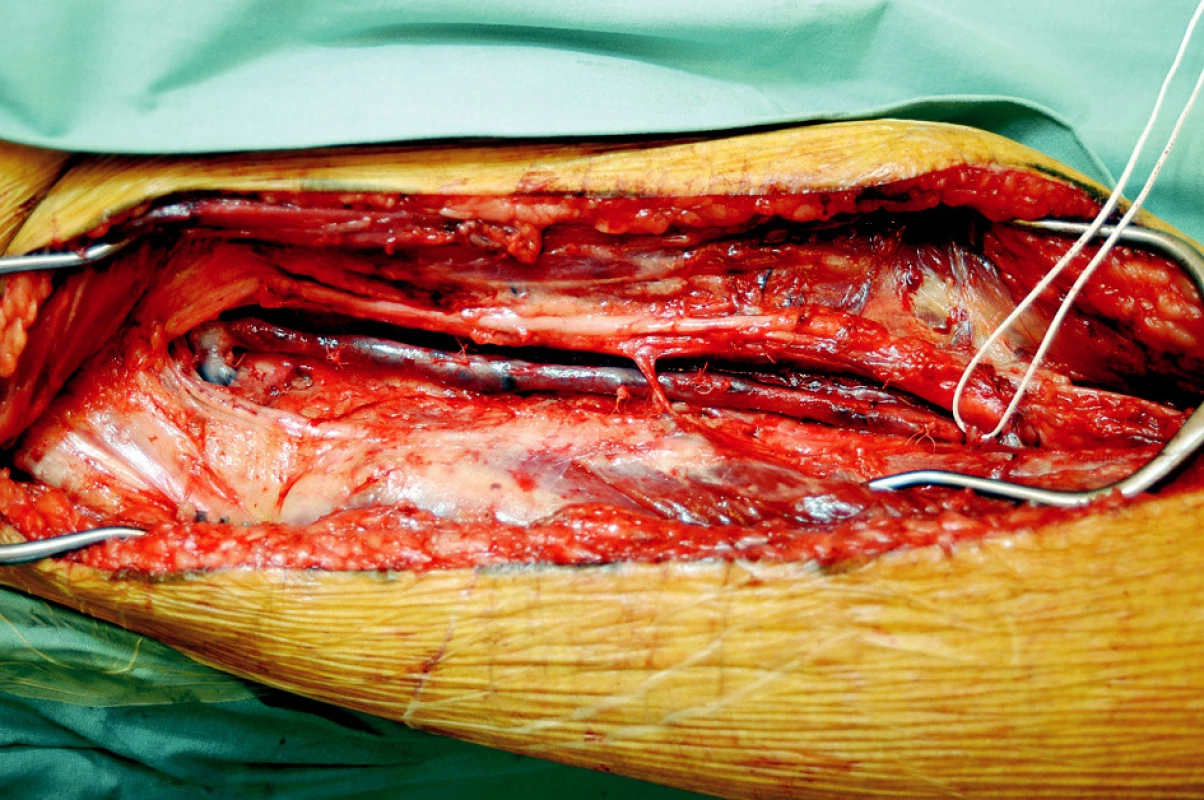
Image 3. Stav po odběru vena femoralis superficialis. Proximálně je žíla odebrána těsně pod odstupem vena profunda femoris a prošita tak, aby nevznikl slepý žilní pahýl, v němž by se mohl vytvořit trombus s potenciálním rizikem plicní embolie Fig. 2. Superficial femoral vein harvested for grafting. Proximally, the vein is dissected below the division of the deep femoral vein and closed with suture without creating a blind venous stump posing a potential risk of thrombus development and subsequent pulmonary embolism 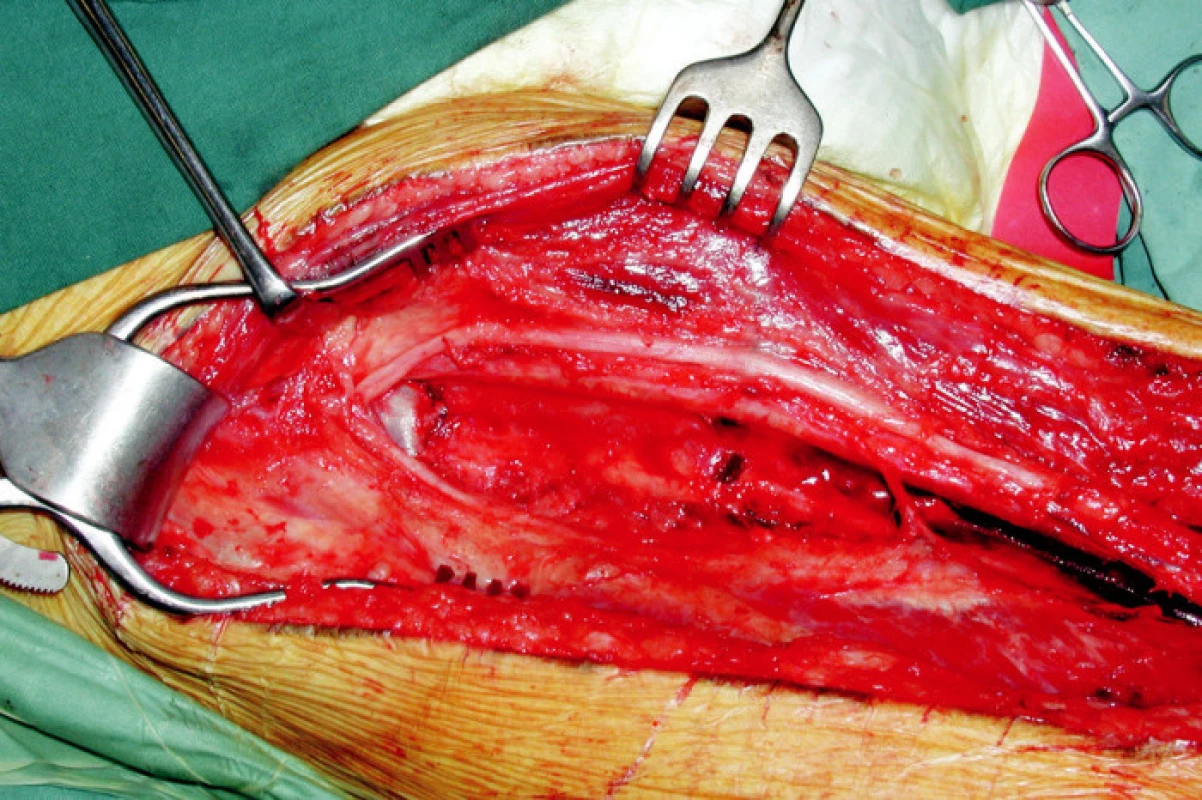
Image 4. Odebraná hluboká žíla v délce 32 cm a její příprava jako štěp. Všechny větve jsou dvojitě ligovány, chlopně odstraněny. Proximálně má žíla průměr 14 mm, distálně 9 mm. To jsou ideální míry pro aorto/iliako-femorální pozici Fig. 3. Harvested vein (32 cm long) – procedure for graft preparation. All branches are doubly ligated and valves are disrupted. A diameter of 14 mm proximally and of 9 mm distally are ideal measures for aortoiliofemoral reconstruction 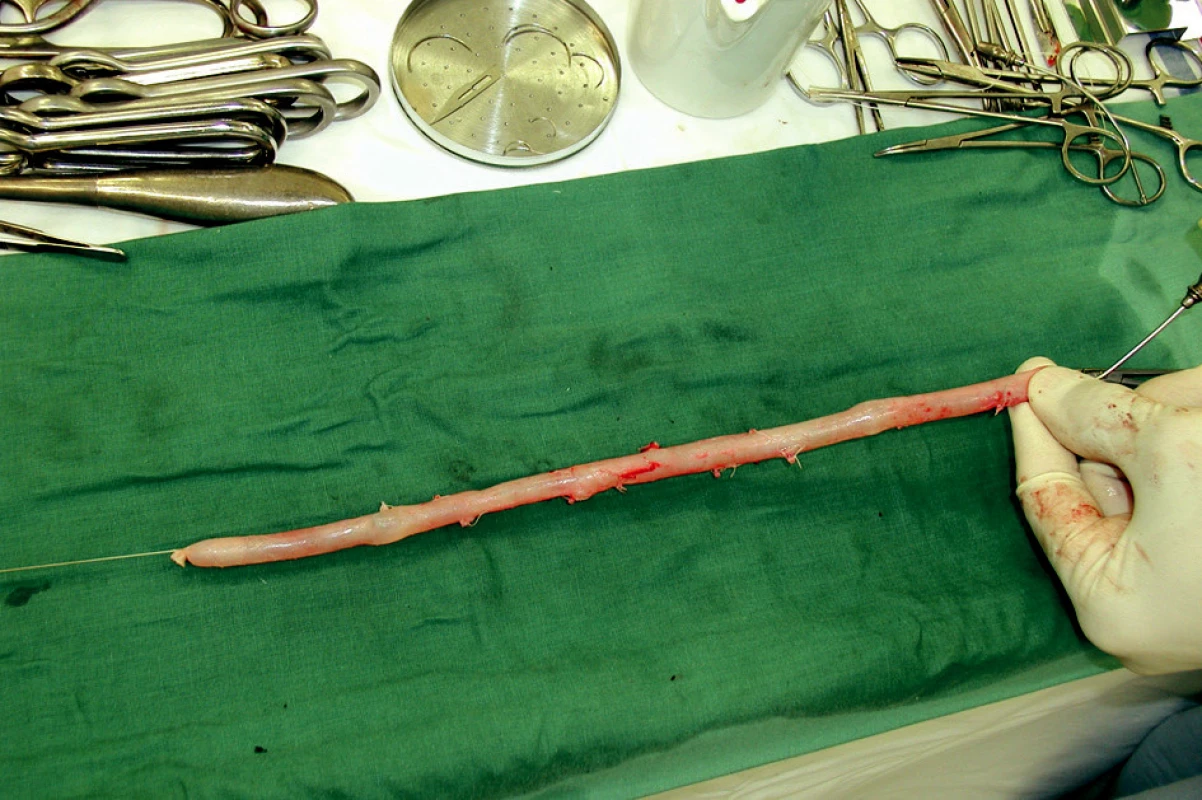
Image 5. Všechny operační rány se zhojily per primam. Není přítomen edém na pravé dolní končetině po odběru hluboké žíly Fig. 5. All surgical wounds healed by first intention. The right lower extremity following deep vein harvest is free from oedema 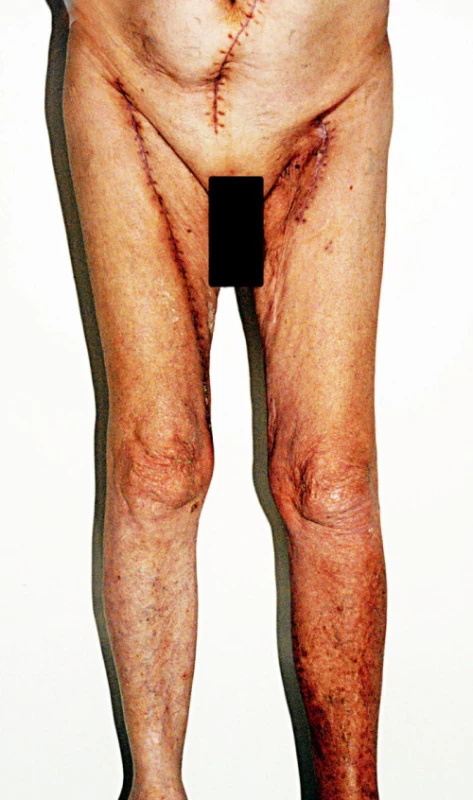
Image 6. Kontrolní angiografie prokazuje dobrou průchodnost a morfologii iliako-profundálního bypassu vlevo autologní hlubokou žilou z dolní končetiny Fig. 6. Angiograph of the autologous lower extremity deep vein graft in the left iliac-femoral position, showing good graft morphology and its patency 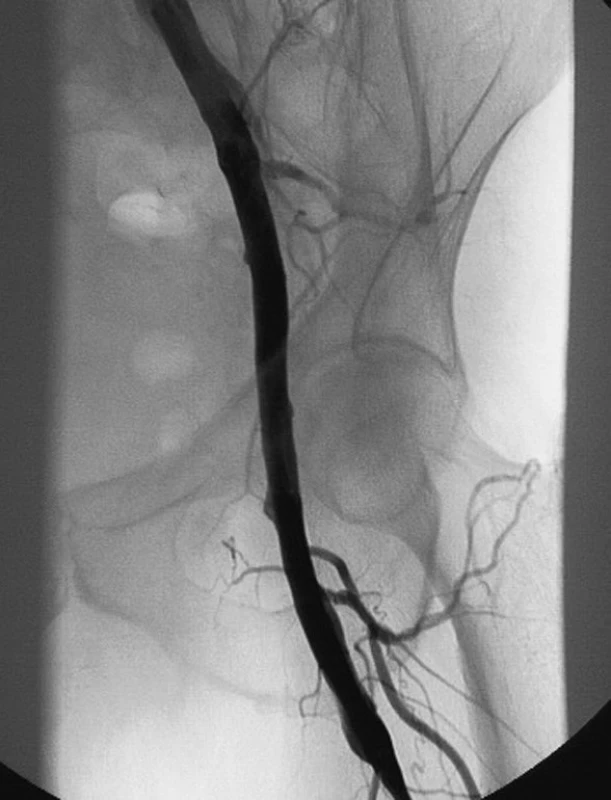
DISKUSE
Tradičním řešením infekce cévní protézy je explantace graftu a následná extraanatomická revaskularizace cévní protézou vedenou mimo oblasti zasaženými infekcí. Hlavní obávanou komplikací je rekurentní infekce extraanatomického bypassu (až 20 %) nebo jeho trombóza, která často vede k vysoké amputaci končetin [4]. Quinones-Baldrich uvádí primární průchodnost axillo-femorálních bypassů v tříletém období 43 % [5]. Tyto neuspokojivé výsledky vedly k hledání jiných alternativ. Například u tzv. nízkovirulentních infekcí je akceptovatelnou variantou parciální resekce cévní protézy a její in situ náhrada Rifampicinem napuštěnou cévní protézou nebo protézou impregnovanou solemi stříbra, vždy s následnou omentoplastikou [6, 7]. Rovněž při tomto řešení je riziko rekurentní infekce vysoké. Další alternativou je extirpace protézy a její in situ náhrada čerstvým nebo kryopreservovaným tepenným či žilním allograftem [8]. Limitujícími faktory v těchto případech jsou opět riziko infekce (nižší ve srovnání s cévní protézou), riziko degradace štěpu a závislost na existenci vhodného dárce. Všechny slabiny výše uvedených metod vedly ke snaze řešit infekci cévní protézy autologním materiálem, jehož odolnost vůči infekci obecně je vysoká. Použití velké safény v aorto/iliako-femorální pozici nevykazovalo dobré výsledky, především pro inkongruenci danou malým kalibrem safény a z toho plynoucím vysokým rizikem okluze štěpu. Clagett udává selhání takové rekonstrukce v 64 %, podobně Seeger pozoroval okluzi u 6 pacientů z 8, u nichž byla velká saféna použita v aorto-femorální pozici [9, 10]. Výrazným posunem v léčbě infekce cévní protézy bylo použití hlubokých žil dolní končetiny. Vena femoralis superficialis, odebíraná často v celé délce včetně části vena poplitea, má průměr cca 10–16 mm. Jde tedy o ideální štěp, který má všechny výhody autologního materiálu a zároveň splňuje požadavek na adekvátní průměr náhrady v aorto/iliako-femorálním úseku. Limitujícím faktorem je dopplerometricky potvrzená dobrá kvalita vena femoralis superficialis a volná průchodnost vena profunda femoris. Clagett v souboru 41 pacientů, u nichž byla infikovaná aorto/iliako-femorální cévní protéza nahrazena graftem často kombinovaným z obou vena femoralis superficialis, udává pětiletou kumulativní sekundární průchodnost 100 %. Pouze u 4 pacientů po odběru hluboké žíly pozoroval edém končetiny, dobře kontrolovaný kompresními punčochami, bez venózních ulcerací [11]. Podobně Nevelsteen, používající stejnou techniku, uvádí mortalitu 10 % a ztrátu končetiny v 5 % [12].
Metoda řešení infekce cévní protézy autologním štěpem z femorální žíly je považována za nejúspěšnější a dlouhodobě efektní terapeutickou modalitu. To potvrzuje i naše zkušenost se čtyřmi pacienty, které jsme dosud touto metodou řešili a u nichž jsme nepozorovali žádné časné a dosud ani pozdní pooperační komplikace.
Prof. MUDr. R. Staffa, Ph.D.
II. chirurgická klinika LF MU a FN u sv. Anny v Brně
Pekařská 53
656 91 Brno
e-mail: robert.staffa@fnusa.cz
Sources
1. Calligaro, K. D., Veith, F. J., Juan, J. G. Intra-abdominal aortic graft infection: complete or partial graft preservation in patients at very high risk. J. Vasc. Surg., 2003, 38, 1199–1205.
2. Dorweiler, B., Neufang, A., Schmiedt, W., Oelert, H. Autogenous Reconstruction of Infected Arterial Prosthetic Grafts Utilizing the Superficial Femoral Vein. Thorac. Cardiov. Surg., 2001, 49, 107–111.
3. Cardozo, M. A., Frankini, A. D., Bonamigo, T. P. Use of superficial femoral vein in the treatment of infected aortoiliofemoral prosthetic grafts. Cardiovasc. Surg., 2002, 10(4), 304–310.
4. Bacourt, F., Koskas, F. and the French University Association for research in surgery. Axillobifemoral bypass and aortic exclusion for vascular septic lesions: a multicenter retrospective study of 98 cases. Ann. Vasc. Surg., 1992, 6, 119–126.
5. Quinones-Baldrich, W. J., Hernandes, J. J., Moore, W. S. Long-term results following surgical management of aortic graft infection. Arch. Surg., 1991, 126, 507–511.
6. Chiche, L., Pitre, J., Sarfati, P. O. In situ repair of a secondary aorto-appendiceal fistula with a rifampin-bonded Dacron graft. Ann. Vasc. Surg., 1999, 13, 225–228.
7. D‘Addio, V. J., Clagett, G. P. Surgical Treatment of the Infected Aortic Graft: Introduction. ACS Surgery Online, 2002; ©2002.
8. Zhou, W., Lin, P. H., Bush, R. L., Terramani, T. T., Matsumura, J. H., Cox, M., et al. In situ reconstruction with cryopreserved arterial allografts for management of mycotic aneurysms or aortic prosthetic graft infection: a multi-institutional experience. Tex. Heart Inst. J., 2006, 33, 14–18.
9. Clagett, G. P., Bowers, B. L., Polez-Viego, M. A., et al. Creation of neo-aortoiliac system from lower extremity deep and superficial veins. Ann. Surg., 1993, 218, 239–249.
10. Seeger, J. M., Wheeler, J. R., Gregory, R. T. Autogenous graft replacement of infected prosthetic grafts in the femoral position. Surgery, 1983, 93, 39–45.
11. Clagett, G. P., Valentine, R. J., Hagino, R. T. Autogenous aortoiliac/femoral reconstruction from superficial femoral-popliteal veins: feasibility and durability. J. Vasc. Surg., 1997, 25(2), 255–266, discussion 267–270.
12. Nevelsteen, A., Lacroix, H., Suy, R. Autogenous reconstruction with lower extremity deep veins: an alternative treatment of prosthetic infection after reconstructive surgery for aortoiliac disease. J. Vac. Surg., 1995, 22, 129–134.
Labels
Surgery Orthopaedics Trauma surgery
Article was published inPerspectives in Surgery

2008 Issue 4-
All articles in this issue
- Akutní endovaskulární řešení disekce hrudní aorty a následné ischemie dolních končetin
- Výskyt a řešení prolongovaného úniku vzduchu po plicní lobektomii
- Biopsie sentinelové uzliny u karcinomu prsu v klinické praxi
- Hluboká žíla dolní končetiny jako tepenná náhrada při řešení infekce cévní protézy
- Skúsenosti s plastikou ventrálnych hernií podľa Chevrela s „on lay“ prolénovou sieťkou
- Naše zkušenosti s resekčními výkony na pankreatu. Retrospektivní analýza
- Chronická pankreatitída, indikácie k resekčným výkonom a pooperačné komplikácie
- Kvalita života pacientov po resekčných výkonoch pre chronickú pankreatitídu
- Epidemiologie a ekonomie zlomenin proximálního femuru, proximálního humeru, distálního radia a luxačních zlomenin hlezna
- Perspectives in Surgery
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Kvalita života pacientov po resekčných výkonoch pre chronickú pankreatitídu
- Skúsenosti s plastikou ventrálnych hernií podľa Chevrela s „on lay“ prolénovou sieťkou
- Chronická pankreatitída, indikácie k resekčným výkonom a pooperačné komplikácie
- Naše zkušenosti s resekčními výkony na pankreatu. Retrospektivní analýza
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

