-
Medical journals
- Career
Primární maligní nádory kostí u dětí − možnosti záchovné chirurgie s využitím aloštěpů
Authors: Martin Vlach; Jiří Schovanec; Vojtěch Havlas; Lukáš Wagenknecht; Tomáš Trč
Authors‘ workplace: Klinika dětské a dospělé ortopedie a traumatologie 2. LF UK a FN Motol
Published in: Čas. Lék. čes. 2016; 155: 406-412
Category: Review Articles
Overview
Terapie primárních maligních nádorů kostí je vždy multimodální a probíhá za těsné spolupráce onkologů, ortopedů, rentgenologů a dalších. V článku podáváme stručný přehled nejčastějších maligních kostních nádorů u dětských pacientů a shrnujeme obecně užívané terapeutické postupy. I přes pokroky onkologické léčby je stále nezbytné radikální chirurgické ošetření tumoru. Pokud je to možné, měla by být resekce postižených struktur provedena ve smyslu tzv. limb-saving (limb-sparing) surgery, která zachovává funkci a tvar postižené končetiny v co nejvyšší možné míře. Kromě resekce je nutné v jedné době provést též náhradu odstraněné kosti. Tu nejčastěji provádíme pomocí kostních štěpů, ať již autoštěpů či aloštěpů. Diskutujeme též porovnání jednotlivých přístupů záchovné chirurgie s ablativními výkony.
Klíčová slova:
maligní tumor, kost, pediatrie, osteosarkom, Ewingův sarkomÚvod
Primární maligní nádory kostí tvoří < 1 % maligních nádorových onemocnění. Ve skupině dětí a mladistvých jich však nacházíme 6−7 % (1). Proto je důležité těmto afekcím věnovat náležitou pozornost a při nejasných bolestech, zejména nočních, je třeba s ohledem na věk pacienta a lokalizaci obtíží zvážit i tuto diferenciálně diagnostickou možnost. Primární maligní nádory kostí patří mezi onemocnění vyskytující se především v dětském a adolescentním věku. Jejich léčba představovala do 70. let 20. století velký problém. Léčebným postupem byly amputace či exartikulace končetiny (1, 2). I přes tyto radikální a mutilující operační výkony nebyly výsledky quoad vitam dobré a ještě v 70. letech dlouhodobé přežití např. u lokalizovaného osteosarkomu nepřesahovalo 60 % (3). Jako jediné úspěšné řešení se v posledních desetiletích jeví komplexní terapie sestávající z chirurgického odstranění tumoru, onkologické léčby spočívající v chemoterapii, někdy v kombinaci s radioterapií, a samozřejmě další podpůrná terapie (3).
Prvním podstatným úspěchem bylo zavedení radioterapie, která v průběhu let doznala značného rozvoje. Výsledků však bylo dosaženo pouze u tumorů radiosenzitivních, jako je Ewingův sarkom, u kterého byla tato vlastnost popsána již samotným Ewingem v roce 1922 (4, 5). Ale i v tomto případě byl úspěch pouze dílčí, napomáhající lokální terapii tumoru a podporující efekt léčby celkové, která je u tohoto typu nádoru nezbytná. Bohužel u většiny ostatních kostních tumorů je účinek radioterapie diskutabilní a v dnešní době je využívána spíše jako léčba podpůrná či paliativní se současným analgetickým efektem (1, 2, 4).
Rozhodujícím mezníkem je rozvoj moderní chemoterapie podle vysoce účinných protokolů. Tyto protokoly jsou vytvořeny na základě široké mezinárodní spolupráce, zejména v rámci center zabývajících se výzkumem a terapií nejrozšířenějších nádorů − Ewingova sarkomu (Euro Ewing) a osteosarkomu (EURAMOS). Mezinárodní spolupráce je vzhledem k nízké prevalenci těchto tumorů nezbytná.
Do budoucna se jeví jako perspektivní též biologická léčba, např. protein IGFBP3, který cestou IGF ovlivňuje proliferaci, diferenciaci a apoptózu osteoblastů (6). Z dalších možností pak slibují zlepšení onkologické léčby nanomateriály, zejména jejich užití k cílenému transportu léčiv; též jsou nově zkoumány proapoptotické účinky některých látek (7, 8).
Přes zjevné úspěchy onkologické terapie je i nadále nezbytné radikální chirurgické odstranění tumoru, ve většině případů s náhradou resekované kosti. Pokud je to možné, resekce postižených struktur by měla být provedena ve smyslu tzv. limb-saving (limb-sparing) surgery, neboť funkční výsledky jsou u tohoto postupu lepší než u pacientů ošetřených amputací; přitom je zachována úroveň 5letého přežití (9).
Díky výše uvedeným faktům se terapie onkoortopedických pacientů stává mnohem úspěšnější, a to jak z hlediska dlouhodobého přežití, tak i z hlediska výsledků resekčních operačních výkonů zachovávajících postiženou končetinu, často pouze s minimálním funkčním deficitem. V současné době dlouhodobě přežívá > 60 % pacientů s diagnózou primárního maligního kostního procesu a ablativní výkony jsou indikovány u < 20 % postižených. Sekundární malignity (metastázy) v oblasti skeletu jsou sice častější, ale tvoří samostatnou kapitolu, a proto je tento text pomíjí (1, 4, 5, 8, 9).
Etiopatogeneze a epidemiologie primárních kostních tumorů
Mezi nejčastěji diagnostikované primární kostní nádory patří osteosarkom, Ewingův sarkom včetně primitivního neuroektodermálního tumoru (PNET) a chondrosarkom. Nález maligního fibrózního histiocytomu, angiosarkomu či fibrosarkomu je raritní a jejich chirurgická terapie bývá obdobná jako u prvně jmenovaných (10).
Osteosarkom se vyskytuje převážně u dospívajících, kde tvoří celkově třetí nejčastější malignitu vůbec. Obvykle se manifestuje bolestí v místě afekce, otokem a poruchou motorické funkce. Celkem 80−90 % těchto nádorů vzniká v metafýzách dlouhých kostí a proces je pouze vzácně víceložiskový (11). Nejčastějšími lokalitami jsou okolí kolenního kloubu, následují horní konce kostí stehenní a pažní (1). Poměr incidence u chlapců a dívek je uváděn 3 : 2. U dívek se nemoc obvykle projevuje v nižším věku, a to nejspíš na podkladě dřívějšího nástupu růstového spurtu (6).
Ewingův sarkom/PNET tvoří až 40 % primárních kostních nádorů u dětí. Stejně jako osteosarkom se častěji objevuje u chlapců a jen zřídka postihuje jedince mladší 5 let nebo starší 30 let (10). Histologický původ nádorových buněk u tohoto tumoru byl dlouho nejasný, v současnosti se předpokládá jejich původ v neuroektodermu. Léze častěji nacházíme v osovém skeletu a klinická manifestace bývá bohatší o neurologické příznaky (při útlaku míchy či kořenovém dráždění) a zvýšenou teplotu. Na rozdíl od osteosarkomu lze při inoperabilním nálezu dosáhnout příznivého lokálního efektu též radioterapií.
Chondrosarkom typicky vzniká u dospělých, a to buď primárně, nebo malignizací enchondromu či exostózy (11). Manifestace bývá stejná jako u předchozích nádorů.
Na distálním radiu můžeme nacházet postižení osteoklastomem neboli obrovskobuněčným nádorem kosti, u kterého bývá pro jeho značnou lokální agresivitu a sklon k častým recidivám i přes relativně nízký stupeň malignity nutná radikální resekce (11).
Diagnostika
K přesnému stanovení diagnózy se provádí komplexní onkologické a ortopedické vyšetření s využitím všech vhodných zobrazovacích metod. Nezastupitelnou úlohu hrají pečlivá anamnéza a důsledné klinické vyšetření (ortopedické, neurologické i další). Lokalizace obtíží a zvláště věk pacienta jsou pro správnou diagnózu zásadní. Nezbytné je rentgenové vyšetření, které při podezření na malignitu u dětských pacientů doplňujeme o vyšetření magnetickou rezonancí (MRI). Od dříve poměrně hojně užívané digitální subtrakční angiografie a scintigrafie skeletu se v diagnostice dětských pacientů spíše ustupuje (12). Laboratorní vyšetření má omezený přínos, specifické markery pro primární kostní malignity zatím nejsou známy, ale například pro osteosarkom bývá uváděna 2−3× zvýšená koncentrace alkalické fosfatázy (13). Laboratorní vyšetření mohou pomoci odlišit zánětlivou etiologii obtíží.
Diagnóza bývá potvrzena histologickým vyšetřením materiálu získaného probatorní biopsií a cytogenetickými a molekulárně genetickými metodami. Staging se provádí nejčastěji dle skóre MSTS (Musculoskeletal Tumor Society) navrženého Ennekingem již v roce 1980 (10). Celý diagnostický proces by pak měl být proveden v co nejkratším čase, neboť s délkou trvání onemocnění se zhoršuje prognóza pacienta (14).
Onkologická léčba
Léčba je po stanovení diagnózy obvykle zahájena neoadjuvantní chemoterapií dle příslušného protokolu. Jejím cílem je usmrcení nejméně 90 % nádorových buněk (10). V poločase neoadjuvantní léčby je poté provedeno komplexní onkologické přešetření a zhodnocení účinnosti. Při pozitivní odpovědi na předoperační terapii (regrese tumoru) a operabilitě tumoru je pacient indikován k operačnímu výkonu. Ten je plánován na podkladě aktuálních vyšetření, zejména MRI, která je v těchto diagnózách nezastupitelná pro citlivé zobrazení intramedulárního šíření, stejně jako ke zhodnocení měkkotkáňové složky tumoru. Zasahuje-li nádor do blízkosti nervově-cévního svazku, pak využíváme u dětských pacientů též MRI angiografii.
Chirurgické řešení
Základem chirurgické terapie je radikální resekce postižené oblasti – kosti, v případě metafyzární lokalizace mnohdy včetně přiléhajícího kloubu (2, 15, 16). Rozsah resekce se dle zvyklostí pracoviště může řídit předem připravenou šablonou usnadňující naměření rozsahu resekce a následné úpravy štěpu pro rekonstrukci (17), Onkologická radikalita operačního výkonu i při zachování postižené končetiny musí být srovnatelná s amputací, a proto je prováděna široká resekce tumoru (3). Resekát je histologicky vyšetřen, je provedena kontrola hranic resekce a podle počtu vitálních nádorových buněk je objektivizována efektivita chemoterapie i radikalita zákroku (3, 4, 10, 14).
Následně je řešena náhrada resekované kosti zasažené tumorózním procesem − v případě záchovného operačního zákroku její rekonstrukce. Pro náhrady v jednotlivých lokalizacích jsou vypracovány algoritmy respektující funkci a požadované vlastnosti pro danou oblast. Jedním z hlavních aspektů je zachování odpovídající pevnosti, tvaru a rozměrů (10, 14, 15). Myšlenka náhrady či transplantace kostní tkáně není nová. V historii bylo v těchto indikacích využito různých materiálů, biologických i syntetických. První zmínky nalezneme již v práci Traité experimental et clinique de la régénération des os vydané roku 1867 Ollierem, v roce 1879 pak Macewenem, který jako první provedl transplantaci alograftu (18). Naše pracoviště preferuje biologické náhrady – autografty či alografty. Neméně významné je zavádění moderních operačních postupů umožněných rozvojem instrumentárií a implantátů a dovolujících častější využití masivních kostních štěpů k rekonstrukčním výkonům ve všech lokalizacích. V poslední době se pak rozvíjí i využití kultivace osteoblastů či jiných prostředků ke stimulaci hojení kostní tkáně.
Autografty představují ideální řešení pro dobré vhojování štěpu. Jejich užití je však limitováno získáním adekvátního množství materiálu a kvalitou potřebného štěpu. Proto jsou častěji využívány alografty získané z kostní banky. Tato kost je však z hlediska hojení podstatně méně kvalitní, neboť se jedná o mrtvou kostní tkáň a proces inkorporace štěpu závisí především na viabilitě štěpu – množství přežívajících buněk (15). Neméně důležitým faktorem jsou i odpovídající rozměry použitého štěpu. U postižení kostí hrudního koše se jeví jako vyhovující řešení rekonstrukce hrudní stěny za využití kopolymerové biologicky odbouratelné destičky na bázi laktátu a glykolové kyseliny (19).
Horní končetiny
Pro rekonstrukci skeletu horní končetiny je výhodné využití autoštěpů, zejména fibuly, výjimečně klavikuly. Preference autoštěpů je dána menšími nároky na pevnost štěpu oproti nosné dolní končetině a dále jejich rozměry. Nejsilnějším argumentem pro využití autoštěpu je ovšem samozřejmě jeho rychlejší inkorporace (10, 14, 15).
Na humeru bývá nádor nejčastěji lokalizován v oblasti proximální metadiafýzy, proto často provádíme resekci proximální poloviny až dvou třetin kosti, včetně hlavice ramenního kloubu. K rekonstrukčnímu výkonu využíváme autoštěp – fibulu, jejíž hlavičku vkládáme do glenoidní jamky a obšíváme kloubním pouzdrem k zajištění dostatečné retence (obr. 1). Distálně fixujeme štěp dlahou nebo v případě, kdy je to možné, fibulu zasuneme do předfrézované dřeňové dutiny zbylé distální části humeru a zajišťujeme šrouby. Dále je nutné provést plastiku svalstva včetně vytvoření jejich úponů, jež jsou resekovány s postiženou kostí. Následuje fixace v Dessaultově obvazu na 6 týdnů a poté rehabilitace. U tumorů lokalizovaných v distální části humeru volíme mezi náhradou resekované části aloštěpem a implantací totální endoprotézy (TEP) lokte nebo vytvořením tzv. resekční artroplastiky lokte (15).
Image 1. Náhrada proximálního humeru vaskularizovaným autoštěpem fibuly 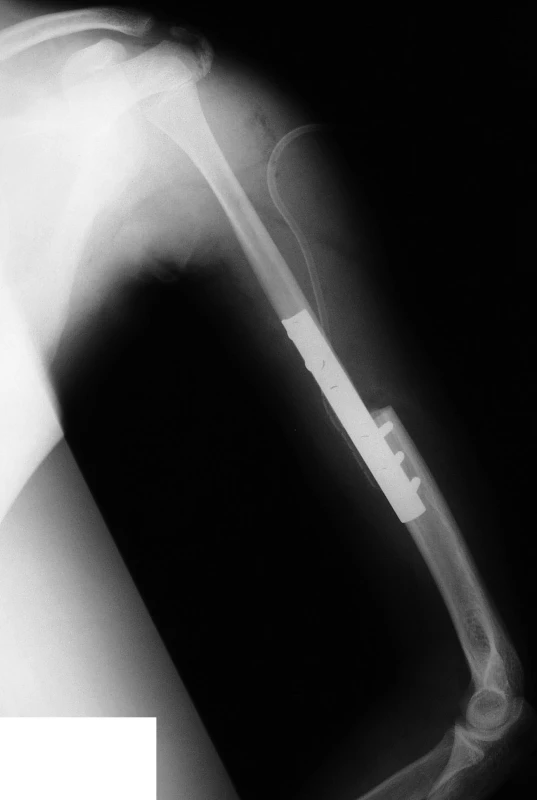
Z kostí předloktí bývá častěji postižen radius, zejména jeho distální část. Pro tuto oblast se proximální fibula jeví jednoznačně jako ideální řešení, neboť hlavičku fibuly lze tvarově přizpůsobit a navíc, zejména u malých dětí, dochází k následné dokonalé remodelaci s vytvořením dobré kloubní kongruence v karpálním kloubu včetně velmi dobré funkčnosti kloubu (obr. 2) (15).
Image 2. Náhrada distálního radia autoštěpem fibuly 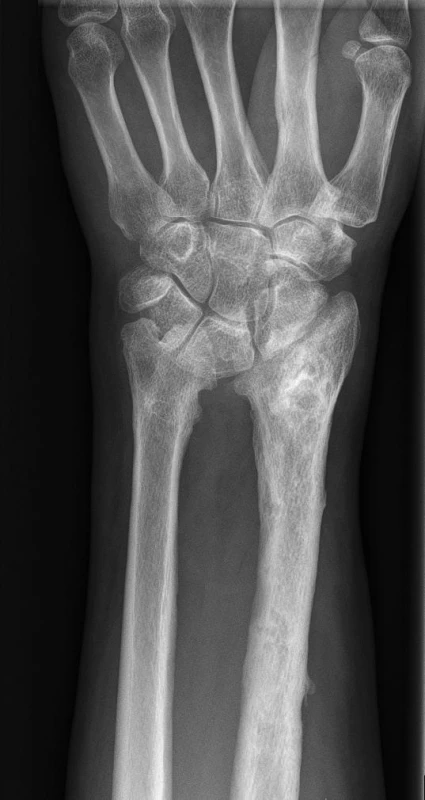
Dolní končetiny
V případě femuru se ošetření liší podle lokalizace. Nádor v oblasti diafýzy řešíme resekcí postiženého úseku a jeho náhradou štěpem z kostní banky, který fixujeme nejlépe pomocí kostní dlahy. Použití nitrodřeňové fixace je možné pouze u adolescentů při horní věkové hranici, v případě dětského skeletu by došlo k narušení růstové štěrbiny a následné poruše růstu (10, 14, 15).
Při postižení proximální metafýzy či oblasti krčku lze rekonstrukci technicky vyřešit použitím individuálně zhotovených bipolárních endoprotéz v kombinaci s aloštěpem. Jedná se o necementované titanové dříky s leštěným povrchem, který je zvolen pro snazší budoucí reimplantaci. Endoprotéza je zhotovena podle 3D-CT rekonstrukce pacientova femuru, délka dříku je volena tak, aby přemostila resekovanou kost až do distální metafýzy femuru, kde je dále fixována dvěma zajišťovacími šrouby, obdobně jako u zajištěného hřebování (obr. 3). Na proximální části dříku je navlečen předfrézovaný solidní štěp získaný z kostní banky. Dáváme přednost náhradě resekované části biologickým materiálem před použitím polyethylenových límců, neboť po prohojení štěpu získáme plnohodnotnou kost a předcházíme tím značným obtížím při reimplantacích po uvolnění implantátu. Použití bipolárních hlavic umožňuje jejich snadnou výměnu, která je u malých dětí nezbytná vzhledem k postupnému růstovému zvětšování acetabula. Použití individuálně zhotovených protéz vyžaduje odlišný způsob fixace s ohledem na věk pacienta (10, 14−16). Nejmladší pacientce ošetřené na naší klinice implantací endoprotézy byly 4 roky.
Image 3. Náhrada proximálního femuru cervikokapitální endoprotézou v kombinaci s aloštěpem a se zajištěním dříku 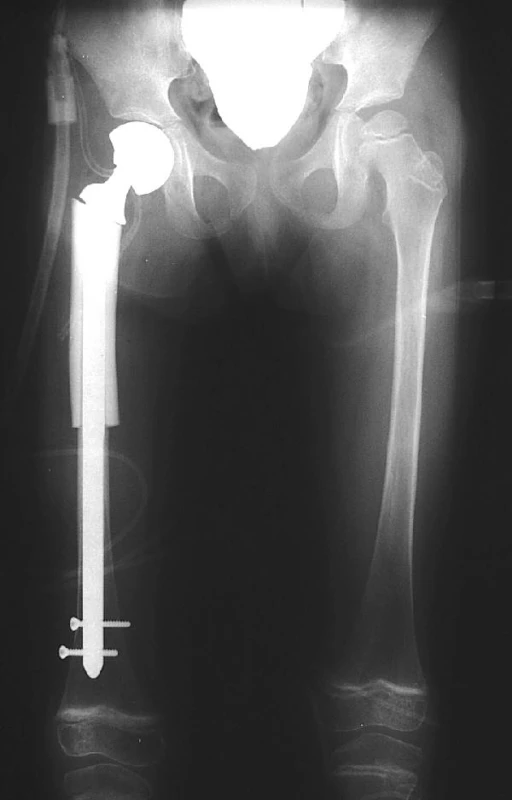
Při postižení distální metadiafýzy femuru provádíme proximálně resekci dle rozsahu tumoru se standardní onkologickou radikalitou, v distální části se pak snažíme provést epifyzární separaci se zachováním růstové chrupavky, čímž je zachována funkce kolenního kloubu a někdy i růst končetiny (obr. 4). Dostatečnou radikalitu při této tzv. epifyzeoseparaci je nutné ověřit peroperační biopsií, i když ze zkušeností víme, že tumor fyzární ploténkou neproniká. V některých případech jsme se však setkali s obrůstáním růstové chrupavky extraoseální složkou tumoru. Resekovaný úsek nahrazujeme aloštěpem fixovaným vnitřní osteosyntézou (2, 5, 10, 17).
Image 4. Náhrada proximální tibie aloštěpem s využitím epifyzeoseparace 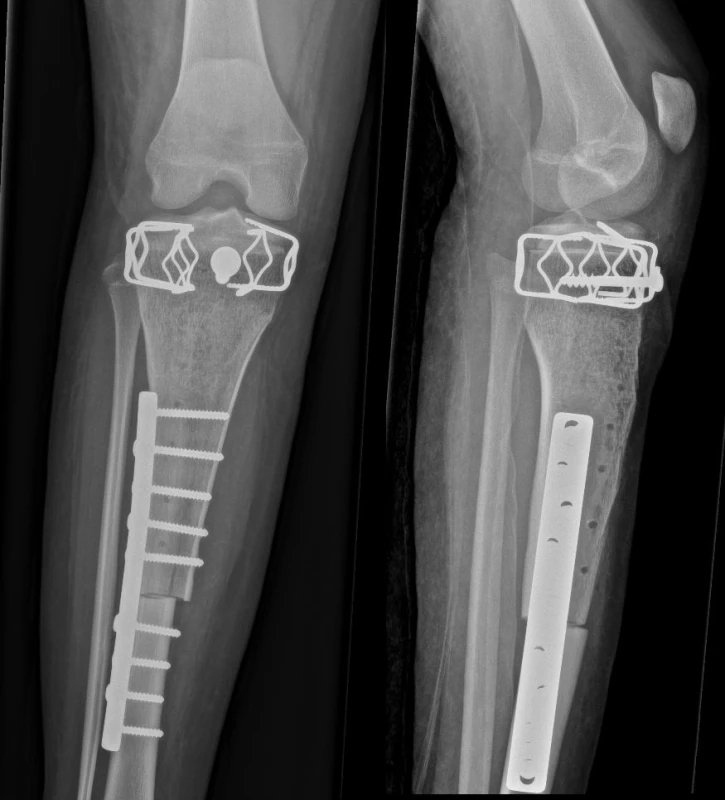
U některých pacientů je nutné využít endoprotéz fixovaných zajištěným dlouhým dříkem v kombinaci s aloštěpem, obdobně jako u postižení proximální metafýzy. V případě náhrad kolenních kloubů hraje roli také stupeň stability implantátu. Delší životnost mají implantáty málo stištěné, ty jsou však při těchto indikacích poměrně nevhodné, neboť vyžadují rozsáhlou resekci tkání včetně stabilizačního vazového aparátu kolene. Využívány jsou kloubní náhrady s různým stupněm stabilizace, kde se zvyšuje s rostoucí stabilizací zátěž na přechod mezi implantátem a kostní tkání, k níž jsou fixovány. Tím se ale zvyšuje riziko uvolnění endoprotézy (15, 18).
V případě postižení diafýzy tibie je, obdobně jako u postižení femuru, prováděna nejčastěji radikální resekce a náhrada štěpem. Resekce v oblasti proximální i distální metafýzy se opět snažíme řešit využitím epifyzeoseparace a zachovat tak původní kloub a růstovou aktivitu kosti (10, 15, 19). Tibie bývá převážně nahrazována aloštěpem, výjimečně lze u malých dětí použít autoštěpu – fibula pro tibii, případně vložit autoštěp do aloštěpu (15). V oblasti bérce bývá štěp fixován kostní dlahou, někdy je nutné užití zevního fixatéru.
V případech postižení proximálního konce tibie, kde nelze zachovat kloub, je řešení značně obtížné. Možnou variantou je implantace speciální endoprotézy kolenního kloubu, která je však v těchto indikacích zatížena značným procentem komplikací způsobených selháním extenzorového aparátu kolene a následné insuficience celého kolenního kloubu. Příčinou těchto komplikací je nutnost fixace ligamentum patellae k tibiální komponentě endoprotézy. I přes veškerou snahu o vytvoření dokonalého způsobu fixace toto spojení není biologické, a u jednoho z nejvíce zatěžovaných úponů v organismu po čase dochází často k jeho selhání (20). Proto na našem pracovišti výše uvedené řešení v dnešní době nevyužíváme a dáváme přednost Ennekingově artrodéze s náhradou kostním štěpem nebo náhradou kostním štěpem se zachovanou kloubní plochou (obr. 5). Při využití tohoto štěpu je možná fixace ke kosti a v případě zachování cévního zásobení ligamentum patellae i s částí tuberositas tibiae. Pokud to dovoluje radikální resekce, jsou výsledky stran funkce kolenního kloubu mnohem lepší.
V případě postižení fibuly provádíme prostou resekci kosti bez náhrady. Pouze v případě postižení distálního konce je nutná rekonstrukce laterálního maleolu, kde je obvykle využívána druhostranná proximální část fibuly (14, 15).
Image 5. Náhrada proximální tibie s využitím osteochondrálního aloštěpu 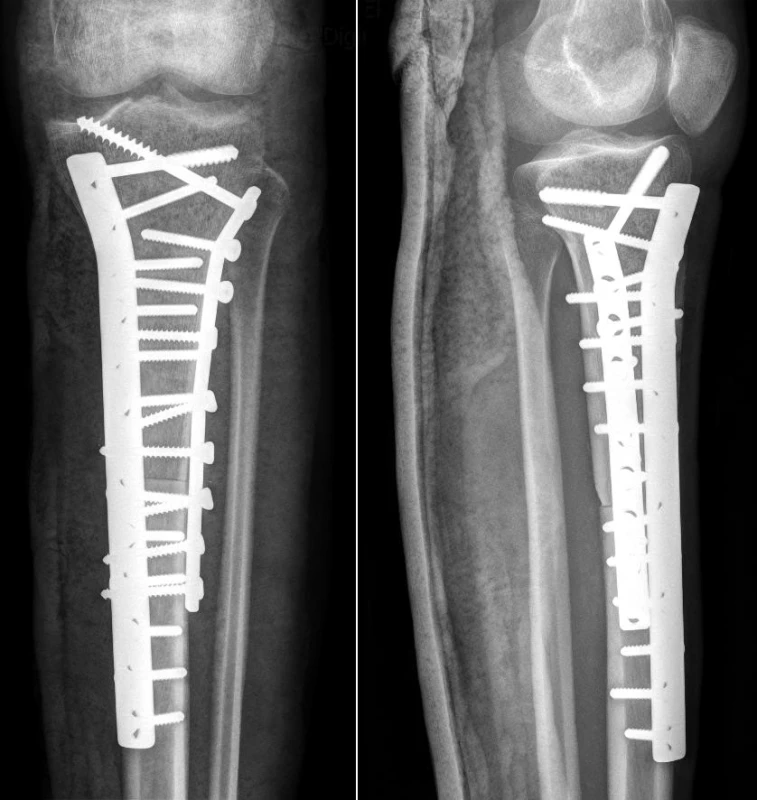
Pánev
V oblasti pánve se způsob ošetření značně liší v závislosti na lokalizaci a rozsahu kostní léze. Používáme klasifikaci dle Ennekinga rozlišující 3 typy (21):
- typ I: raménka
- typ II: acetabulární oblast
- typ III: lopata kosti kyčelní
V případě postižení lopaty a ramének lze provést prostou resekci bez náhrady, při postižení krajiny acetabula nebo sakroiliakálního kloubu je situace mnohem závažnější a mnohdy se jedná i o inoperabilní stavy (22). Případnou resekci tumoru lze řešit náhradou aloštěpem, interní hemipelvektomií, případně megaprotézou (obr. 6). Tyto postupy jsou však zatíženy značným procentem komplikací, zejména infekcí, selhání implantátu či lokálních recidiv (23).
Image 6. Náhrada části pánve a kyčelního kloubu megaprotézou 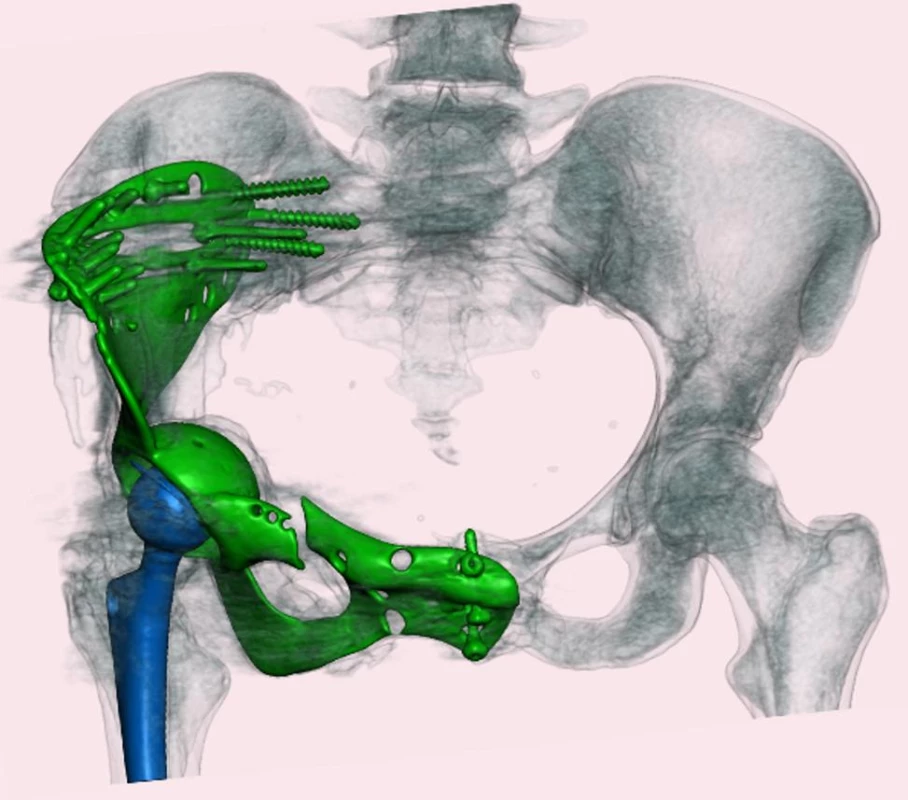
Vlastní soubor pacientů
V dětské části naší kliniky ošetřujeme pacienty ve věku do 19 let a zabýváme se léčbou všech tumorů pohybového aparátu. Počty resekčních výkonů u onkoortopedických pacientů s kostní patologií ošetřených na našem pracovišti mezi lety 2010 a 2015 shrnuje tab. 1. Relativně vysoký podíl amputací je důsledkem postupů používaných v době zařazování prvních pacientů souboru; v současnosti provádíme již prakticky všechny výkony v mezích limb-saving postupů. Přechod od amputací a exartikulací k rekonstrukčním výkonům, u kterých je zajištěna dostatečná onkologická radikalita, má v případě dětí a mladistvých zásadní význam, protože prvně jmenované výkony znamenají pro postižené pacienty celoživotní omezení ve většině oblastí života (15).
Table 1. Charakteristika souboru pacientů s kostními afekcemi z let 2010−2015 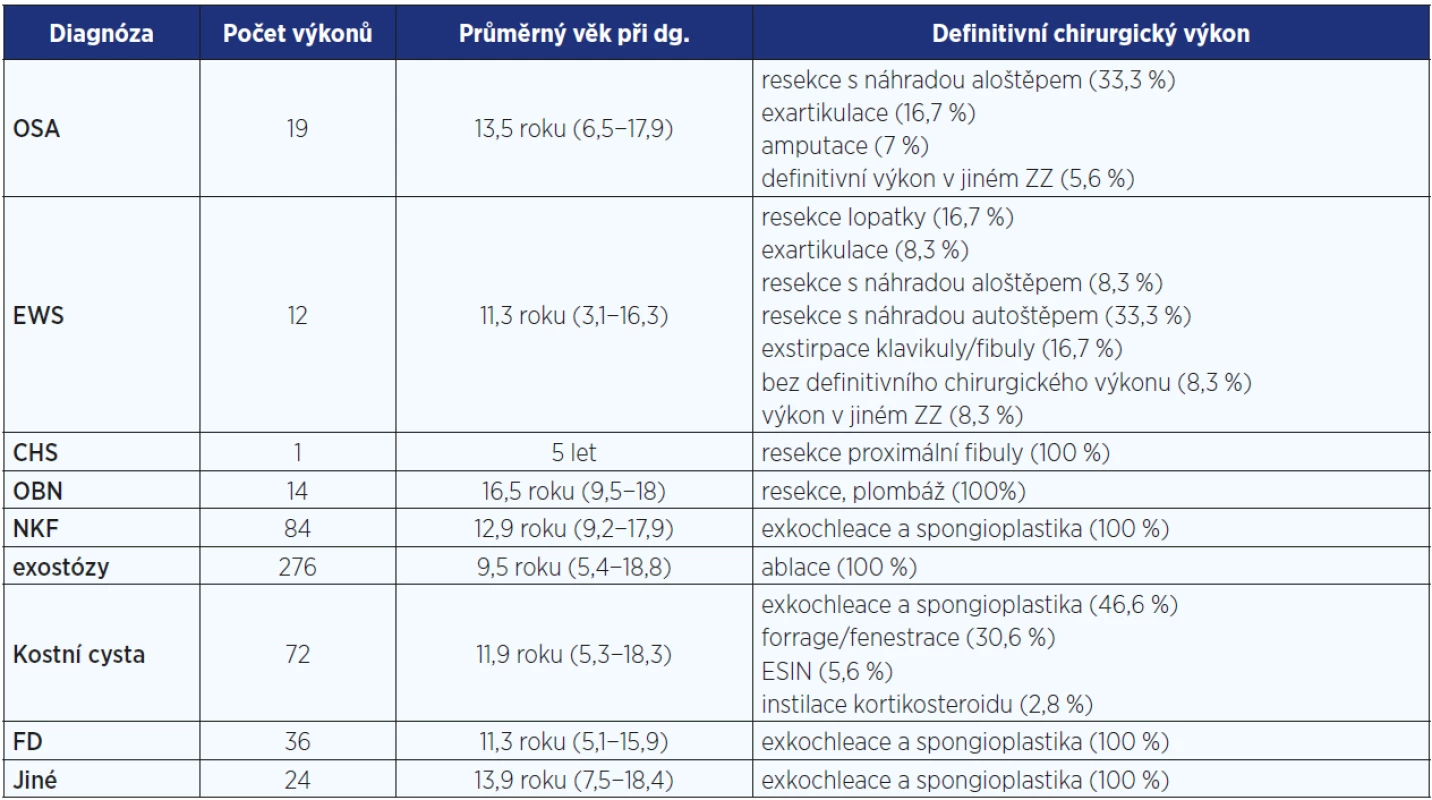
Pozn.: OSA = osteosarkom; EWS = Ewingův sarkom; CHS = chondrosarkom; OBN = obrovskobuněčný nádor; NKF = neosifikující kostní fibrom; ESIN = Prevotovy pruty; FD = fibrózní dysplazie; ZZ = zdravotnické zařízení. Diskuse
Radikální resekce maligního tumoru s náhradou kostním štěpem ve smyslu limb-saving surgery není ani v současné době „zlatým standardem“ pro ošetření pacientů s maligním tumorem kosti. Odklon od amputací a exartikulací je však v dostupné literatuře znatelný a uvádí se, že až 85 % pacientů je dnes ošetřitelných některou ze záchovných metod (2, 14, 15, 20, 21).
Dle zvyklostí pracoviště se užívají štěpy různého původu a i způsob jejich zpracování se liší. Ve světové literatuře se uvádí užití vaskularizovaného štěpu fibuly jako přístup s nejlepšími výsledky (15). Na naší klinice jsme tuto techniku též aplikovali s výsledky odpovídajícími literatuře, kdy přibližně v 1/3 případů následně ztrombotizovala přívodná céva a štěp se dále choval jako nevaskularizovaný (15, 20, 21). Vzhledem k výsledkům, kterých dosahujeme s nevaskularizovanými štěpy, se z našeho pohledu jeví prodloužení operačního času při preparaci cévního svazku fibuly jako nevýhodné. Někteří autoři též uvádí kombinaci autoštěpu s aloštěpem, např. navlečení autoštěpu fibuly do předfrézované dřeňové dutiny masivní kostního štěpu u náhrad diafýz dlouhých kostí (15, 22, 23). Podle našeho názoru však dosažený výsledek není adekvátní vzhledem k prodloužení operačního času a s tím spojenému zvýšení operačního rizika (anesteziologické komplikace, infekce, ischemie tkání).
V západní Evropě hojně propagovaná a užívaná implantace megaprotéz je též zatížena řadou nežádoucích jevů. Selhání primárního implantátu s nutností reimplantace je uváděno až u 58 % pacientů v průběhu 5 let po primárním ošetření (24). Proto tento přístup prakticky nevyužíváme. Obecně je třeba u implantací dětským pacientům vždy počítat s řadou reoperací, jednak pro omezenou životnost implantátů, jednak pro postupnou rozměrovou nedostatečnost použitého implantátu při pokračujícím růstu dětského organismu (15, 24). Druhou z výše zmíněných nevýhod se snaží eliminovat tzv. rostoucí endoprotézy, které se různým mechanismem snaží udržet optimální délku končetiny v průběhu růstového období. S jejich implantací však vlastní zkušenosti nemáme a ani u těchto endoprotéz není eliminováno riziko infektu rozsáhlého a konstrukčně složitého implantátu, které je uváděno jako 10−20× vyšší v porovnání s rizikem infekční komplikace u konvenční TEP (15, 24). V neposlední řadě bývají u resekčních výkonů zmiňovány rotační plastiky (9, 15). Ty na naší klinice neprovádíme, neboť nejsme přesvědčeni o jejich mechanické výhodnosti.
Z praxe je zřejmé, že ani radikální výkony v podobě mutilujících výkonů, jako jsou amputace či exartikulace, není radno zatracovat. V individuálních případech se tento typ výkonu může ukázat jako nevyhnutelný. S pokračujícím rozvojem protetiky jsme schopni poskytnout kvalitní exoprotézu daleko širšímu spektru pacientů, kteří jsou schopni se s touto náhradou vrátit do běžného života, včetně sportovní činnosti na vrcholové úrovni (25, 26). Slibně se též jeví vývoj exoprotéz s využitím elektromyografické stimulace, které mohou nabídnout i vůlí ovládanou hybnost segmentů, byť je tato možnost zatím (hlavně z finančních důvodů) dostupná jen velice omezeně (26).
Co se týče komplikací, odpovídají naše zkušenosti výsledkům uváděným ve světové i domácí literatuře, kdy 60 % aloštěpů dlouhodobě přežívá a poskytuje pacientovi uspokojivou funkci (26, 27). Zbylých 40 % je zatíženo různými komplikacemi: infektem, zlomeninou na podkladě resorpce štěpu apod. Při vhojování štěpu sice dochází k jeho přestavbě, ale i tak se jedná o mrtvou kostní tkáň, a proto je zde proti živé kosti zvýšené riziko osteomyelitidy. Ani zlomenina štěpu však obvykle není považována za absolutní indikaci k jeho extrakci a ve shodě s řadou autorů raději volíme re-osteosyntézu se spongioplastikou jako u pakloubů (15, 25, 26), případně u zlomenin periprotetických pak reimplantaci komponenty s delším dříkem (10, 24, 26).
Práce byla podpořena v rámci projektu koncepčního rozvoje výzkumné organizace MZ ČR č. 00064203 (FN Motol).
Autoři práce prohlašují, že v souvislosti s tématem, vznikem a publikací tohoto článku nejsou ve střetu zájmů a vznik ani publikace článku nebyly podpořeny žádnou farmaceutickou firmou. Toto prohlášení se týká hlavního autora i všech spoluautorů.
Seznam použitých zkratek
3D-CT výpočetní tomografie s trojrozměrnou rekonstrukcí obrazu
MRI magnetická rezonance
TEP totální endoprotéza
Adresa pro korespondenci:
MUDr. Martin Vlach
Klinika dětské a dospělé ortopedie a traumatologie 2. LF UK a FN Motol
V Úvalu 84
150 06 Praha 5
Tel.: 224 432 870
e-mail: martin.vlach@fnmotol.cz
Sources
1. Dungl P et al. Ortopedie (2., přepracované a doplněné vydání). Grada, Praha, 2014.
2. Elsner U, Henrichs M, Goshege G et al. Forequarter amputation: a safe rescue procedure in a curative and palliative setting in high-grade malignoma of the shoulder girdle. World J Surg Oncol 2016; 14 : 216.
3. Ando K, Heymann MF, Stresing V et al. Current therapeutic strategies and novel approaches in osteosarcoma. Cancers (Basel) 2013; 5 : 591–616.
4. Ewing J. A review and classification of bone sarcomas, Arch Surg 1922; 4 : 485–533.
5. Akagunduz O, Kamer SA, Kececi B et al. The role of radiotherapy in local control of nonextremity Ewing sarcomas. Tumori 2016; 102 : 162–167.
6. Osasan S, et al. Osteogenic sarcoma: A 21st century review. Anticancer Res 2016; 9 : 4391–4398.
7. Savvidou OD, Bolia IK, Chloros GD et al. Applied nanotechnology and nanoscience in orthopedic oncology. Orthopedics 2016; 39 : 280–286.
8. Jin T, Wu H, Wang Y, Peng H. Capsaicin induces immunogenic cell death in human osteosarcoma cells. Exp Ther Med 2016; 12 : 765−770.
9. Han G, Bi W Z, Xu M et al. Amputation versus limb-salvage surgery in patients with osteosarcoma: a meta-analysis. World J Surg 2016; 40 : 2016−2027.
10. Pappo A. Pediatric Bone and Soft Tissue Sarcomas, Springer, Berlin, Heidelberg, 2006.
11. Malawer M, Sugarbaker P. Musculoskeletal Cancer Surgery, Treatment of Sarcomas and Allied Diseases, Springer, Netherlands, 2001.
12. Schovanec J, Trč T, Kotaška J, Paděra R. Diagnostika a terapie benigních kostních tumorů. Postgraduální medicína 2008; 10 : 897–905.
13. Bullough PG. Orthopaedic Pathology, Mosby/Elsevier, Maryland Heights, 2010.
14. Goedhart LM, Gerbers JG, Ploegmakers JW, Jutte PC. Delay in diagnosis and Its effect on clinical outcome in high-grade sarcoma of bone: a referral oncological centre study. Orthop Surg 2016; 8 : 122−128.
15. Grimer RJ. Surgical options for children with osteosarcoma. Lancet Oncol 2005; 6 : 85−92.
16. Kruseová J et al. Radikální operační výkon a intenzivní chemoterapie jsou podmínkou úspěšné léčby osteosarkomu. Klin Onkol 2009; 22 : 168–175.
17. Ma L, Zhou Y, Zhu Y et al. 3D-printed guiding templates for improved osteosarcoma resection. Sci Rep 2016; 6 : 23335.
18. Macewen W. Observations concerning transplantation of bone. Illustrated by a case of inter-human osseous transplantation, whereby over two-thirds of the shaft of a humerus was restored. Proceedings of the Royal Society of London 1881; 32 : 232–247.
19. Guillén GL, Marhuenda GC, Pellisé F et al. Thoracic wall reconstruction with bioabsorbable plates in pediatric malignant thoracic wall tumors. J Pediatr Surg 2016; pii: S0022-3468(16)30294-9.
20. Titus V, Clayer M. Protecting a patellar ligament reconstruction after proximal tibial resection: a simplified approach. Clin Orthop Relat Res 2008; 466 : 1749–1754.
21. Enneking WF, Durnham WK. Resection and reconstruction for primary neoplasms involving the innominate bone. J Bone Joint Surg Am 1996; 6 : 266–267.
22. He F, Zhang W, Shen Y et al. Effects of resection margins on local recurrence of osteosarcoma in extremity and pelvis: Systematic review and meta-analysis. Int J Surg 2016; 36 : 283–292.
23. Witte D, Bernd L, Bruns J et al. Limb-salvage reconstruction with MUTARS hemipelvic endoprosthesis: A prospective multicenter study. Eur J Surg Oncol (EJSO) 2009; 35 : 1318–1325.
24. Kinkel S, Lehner B, Kleinhans JA et al. Medium to long-term results after reconstruction of bone defects at the knee with tumor endoprostheses. J Surg Oncol 2010; 101 : 166–169.
25. Demšar I, Duhovnik J, Lešnik B, Supej M. Multi-axis prosthetic knee resembles Alpine skiing movements of an intact leg. J Sports Sci Med 2015; 14 : 841–848.
26. Hargrove LJ, Simon AM, Young AJ et al. Robotic leg control with EMG decoding in an amputee with nerve transfers. N Engl J Med 2013; 369 : 1237–1242.
27. Spear MA, Dupuy DE, Park JJ et al. Tolerance of autologous and allogeneic bone grafts to therapeutic radiation in humans. Int J Radiat Oncol Biol Phys 1999; 45 : 1275–1280.
Labels
Addictology Allergology and clinical immunology Angiology Audiology Clinical biochemistry Dermatology & STDs Paediatric gastroenterology Paediatric surgery Paediatric cardiology Paediatric neurology Paediatric ENT Paediatric psychiatry Paediatric rheumatology Diabetology Pharmacy Vascular surgery Pain management Dental Hygienist
Article was published inJournal of Czech Physicians

-
All articles in this issue
- Jak postupovat při léčení idiopatické skoliózy
- Primární maligní nádory kostí u dětí − možnosti záchovné chirurgie s využitím aloštěpů
- Femoroacetabulární impingement a možnosti jeho řešení
- Zkrácení kosti jako operační řešení diference délek končetin
- Avaskulární nekróza hlavice femuru
- Rehabilitace po totální náhradě kyčelního a kolenního kloubu
- UHMWPE – polyethylen pro artikulační povrchy kloubních náhrad
- Arteficiální náhrady kosti
- První zkušenosti s podáním antidota dabigatran etexilátu ve FN Plzeň
- Paliativní péče v ČR v roce 2016
- Journal of Czech Physicians
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Avaskulární nekróza hlavice femuru
- Femoroacetabulární impingement a možnosti jeho řešení
- Rehabilitace po totální náhradě kyčelního a kolenního kloubu
- Zkrácení kosti jako operační řešení diference délek končetin
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

