-
Medical journals
- Career
Vápník, mléčné výrobky a redukce hmotnosti
Authors: PhDr. Karolína Hlavatá, Ph.D.
Authors‘ workplace: Endokrinologický ústav, Praha
Published in: Čas. Lék. čes. 2014; 153: 238-241
Category: Review Article
Článek je věnován k 90. narozeninám prof. MUDr. Vratislava Schreibera, DrSc.
Overview
Z hlediska nutričních faktorů je s ohledem na nadváhu a obezitu zaměřena značná pozornost na vápník a další komponenty mléka. Na základě studií se ukazuje, že především vápník, bílkoviny, větvené aminokyseliny a syrovátkové bioaktivní peptidy mohou napomáhat redukci hmotnosti a zlepšovat složení těla v průběhu hubnutí, zejména ve smyslu šetření beztukové hmoty (fat free mass, FFM). Dieta o vyšším obsahu bílkoviny a vápníku se uplatňuje i v regulaci příjmu potravy a zlepšuje celkovou spolupráci pacienta při dodržování redukčního režimu.
Klíčová slova:
obezita – vápník – bílkoviny – bioaktivní peptidy syrovátky – mastné kyseliny – mléčné výrobky – redukce hmotnostiÚvod
Nutriční faktory sehrávají důležitou úlohu nejen při vzniku obezity, ale predikují i úspěšnost redukčního režimu a jsou stěžejní pro celkovou úspěšnost léčby. Z hlediska rozvoje obezity je rizikový zejména nadměrný příjem tuků a jednoduchých sacharidů, nedostatek potravin bohatých na komplexní sacharidy a vlákninu, nedostatečná konzumace zeleniny a méně tučných mléčných výrobků. Z mikronutrientů je zvažován nedostatek vápníku a vitaminu D. Nutriční faktory obsažené v mléce a mléčných výrobcích příznivě ovlivňují metabolismus, tělesné složení a brání rozvoji metabolického syndromu. Jsou proto důležitou součástí vyvážené stravy a měly by být pravidelně zařazovány i v rámci redukční diety. Za optimální jsou považovány 2–3 porce mléčných výrobků denně, přičemž důraz by měl být kladen na polotučné výrobky a sýry s nižším obsahem tuku.
Vlivu vápníku na tělesnou hmotnost je věnována značná pozornost již dlouhou dobu. Vztah mezi zvýšeným příjmem vápníku, redukcí hmotnosti a pozitivním ovlivněním složení těla byl prokázán v řadě studií (1–6). Také ve studii prováděné v Endokrinologickém ústavu byl v odpovědi na redukční režim pozorován významně nižší úbytek FFM ve skupinách léčených kalciem, na rozdíl od skupiny placebové, kde docházelo k většímu úbytku aktivní svalové hmoty (7). Vyšší příjem vápníku je z hlediska příznivějšího složení těla a profilu růstu přínosný i u dětí staršího školního věku a u adolescentů (3).
Bílkoviny mléka a bioaktivní peptidy syrovátky
Ze studií na hlodavcích i na lidech vyplývá, že mléčné výrobky mají výraznější účinek na snížení tělesné hmotnosti, množství tuku a na redukci krevního tlaku než samotný vápník (6, 8, 9). Mléko a mléčné výrobky obsahují řadu bioaktivních látek, které buď nezávisle na vápníku, nebo společně s ním ovlivňují lipogenezi, lipolýzu, oxidaci lipidů a/nebo přerozdělování energie. Ve skutečnosti se tedy jedná o synergismus mezi syrovátkovými proteiny a dalšími složkami mléka, jako je vápník (2, 8, 10), triacylglyceroly (TG) s mastnými kyselinami se středně dlouhým řetězcem (11) a konjugovaná kyselina linolová (12).
Mléčné výrobky a mléčné komponenty také potlačují krátkodobý příjem stravy, zvyšují subjektivní pocit sytosti a stimulují mechanismus, který signalizuje pocit nasycení a sytosti (13). Bílkoviny mají ve srovnání s tuky a sacharidy největší schopnost zasytit. To znamená, že nasycení si vyžádá konzumaci většího množství tuků než bílkovin nebo sacharidů (14).
Peptidy odvozené ze syrovátky mají řadu fyziologických funkcí zahrnujících modulaci krevního tlaku, ovlivnění zánětlivých procesů, glykémie a systémů regulujících příjem potravy. Syrovátkové proteiny jsou prekurzory peptidů, které inhibují angiotenzin konvertující enzym (ACE) a které mají antihypertenzní a potenciálně antiobezigenní účinek (15). Inhibice ACE látkami obsaženými v syrovátce vede ke snížené přeměně angiotenzinu I na angiotenzin II, a v konečném důsledku i ke snížené tvorbě mastných kyselin de novo (16).
Bílkoviny mléka obsahují vysoké procento (asi 26 %) rozvětvených aminokyselin (AMK). Tyto AMK sehrávají významnou úlohu v syntéze bílkovin i jako energetické substráty. Layman (17) poukazuje na roli těchto AMK v podpoře glukoneogeneze a syntéze dalších AMK. Větvené AMK, speciálně leucin, hrají také klíčovou roli v regulaci syntézy svalových proteinů, což by mohlo vysvětlovat, proč při dietě o vyšším obsahu mléčných bílkovin nedochází k tak výraznému úbytku aktivní svalové hmoty. Větvené AMK jsou považovány za hlavní faktor zodpovědný za inzulinotropní účinky syrovátkového proteinu. Studie také dokládají, že bílkoviny ovlivňují uvolňování řady hormonů gastrointestinálního traktu, které mají vliv na pocit sytosti a následný příjem potravy (18). Tlumivý vliv bílkovin na příjem potravy je dán jak stimulací sekrece cholecystokininu (CCK), glukagonu a glukagonu podobného peptidu 1 (GLP1), tak přímým ovlivněním regulace příjmu potravy v hypotalamu některými AMK, např. tryptofanem jako prekurzorem serotoninu (17, 19).
Vliv syrovátkového proteinu na krátkodobý příjem potravy u lidí je výraznější než po příjmu kaseinu, sójového proteinu nebo vaječného albuminu (20). Nicméně konečný efekt je závislý na řadě faktorů, jako je dávka proteinu, forma (pevná látka nebo tekutina), interval mezi jednotlivými jídly a přítomnost nebo absence dalších mikronutrientů (21).
Významný je také vliv bílkovin na postprandiální termogenezi, která je po jejich požití stimulována, a to více než po požití sacharidů a tuků (22). Proteiny indukovaný energetický výdej může být dán syntézou proteinů a urey a stimulací jaterní glukoneogeneze. Tento efekt je výraznější při příjmu plnohodnotných bílkovin, které obsahují všechny esenciální aminokyseliny v optimálním poměru. Oxidace AMK přijímaných v nadbytku, zejména pokud se jedná o tryptofan, může být částečně zodpovědná za sytící schopnost proteinů (23).
Mastné kyseliny mléka
Tělesnou hmotnost a rozvoj složek metabolického syndromu ovlivňují též mastné kyseliny mléka. Studie ukazují na inverzní vztah mezi příjmem mléčného tuku nebo mléčných výrobků a metabolickým syndromem nebo jednotlivými složkami metabolického syndromu (24–26). Navzdory tomu, že v mléčném tuku převažují nasycené mastné kyseliny, v loňském roce provedená metaanalýza překvapivě nenalezla pozitivní asociaci mezi konzumací mléčného tuku a mírou hromadění tělesného tuku (27). Přesto je s ohledem na snížení kardiometabolických rizik vhodnější preferovat méně tučné mléčné výrobky a sýry. Mléčný tuk přežvýkavců obsahuje více než 400 různých mastných kyselin, zejména kyselinu laurovou (C12), myristovou (C14), palmitovou (C16), kyselinu máselnou (C4 : 0), konjugovanou kyselinu linolovou, kyselinu cis a trans palmitolejovou (C16 : 1) a kyselinu fytanovou (28). Kyselina máselná tvoří přibližně 4 % mastných kyselin obsažených v mléce. Dále vzniká i mikrobiální fermentací sacharidů, zejména vlákniny v tlustém střevě. Uplatňuje se jako zdroj energie pro enterocyty a snižuje produkci prozánětlivých faktorů (29). Přidání kyseliny máselné do diety vedlo ve studii u myší k zabránění rozvoje obezity a k lepší citlivosti k inzulinu (30). Kyselina fytanová stimuluje α i β oxidaci v játrech vazbou na transkripční faktory RXR a PPARα a ovlivněním aktivace odpřahujícího proteinu 1 (uncoupling protein 1, UCP1). U myší bylo pozorováno i snížení obsahu TG v játrech, produkce VLDL lipoproteinů a zlepšení inzulinové senzitivity (31).
Recentní studie poukazují i na možný účinek kyseliny cis palmitolejové na stimulaci oxidace tuků, inhibici lipogeneze v játrech a zlepšení inzulinové senzitivity (32). Nicméně v jiných studiích se tento účinek neprokázal (33). Zajímavý je i pohled na účinek kyseliny trans palmitolejové, která se přirozeně vyskytuje v mléce, mléčných produktech a tuku přežvýkavců. Vyšší koncentrace kyseliny trans palmitolejové v plazmatických fosfolipidech je spojena s nižším množstvím tukové tkáně, s vyšší hladinou HDL cholesterolu, nižší hladinou TG a nižší inzulinovou rezistencí (34).
Mechanismus působení vápníku
Hlavními regulátory hladiny vápníku v séru jsou pa-
rathormon (PTH) a vitamin D (1,25(OH)2D3, kalcitriol). Dieta s nízkým obsahem vápníku vede ke snížení hladiny vápníku v séru a k vzestupu produkce a uvolňování PTH do cirkulace. PTH stimuluje resorpci vápníku z kostí, reabsorpci vápníku v ledvinách a aktivuje 1α-hydroxylázu v ledvinách. Tento enzym konvertuje 25-hydroxyvitamin D3 (25OHD) na 1,25(OH)2D3, který svým účinkem na střevo, kosti a ledviny zvyšuje hladinu vápníku v krvi. Spolu s PTH zvyšuje i hladinu intracelulárního vápníku v adipocytech.Intracelulární vápník sehrává klíčovou úlohu v regulaci lipidového metabolismu adipocytů (35). Vzestup intracelulárního vápníku v adipocytech stimuluje expresi FAS (Fatty Acid Synthase) genu, a tím tedy i aktivitu syntázy mastných kyselin. Navíc zvýšená hladina intracelulárního vápníku inhibuje lipolýzu, což v konečném důsledku vede k hromadění TG v adipocytech (36–39) (obr. 1).
Image 1. Role kalcitriolu v regulaci energetického metabolismu (upraveno dle Zemel a Sun 2008) 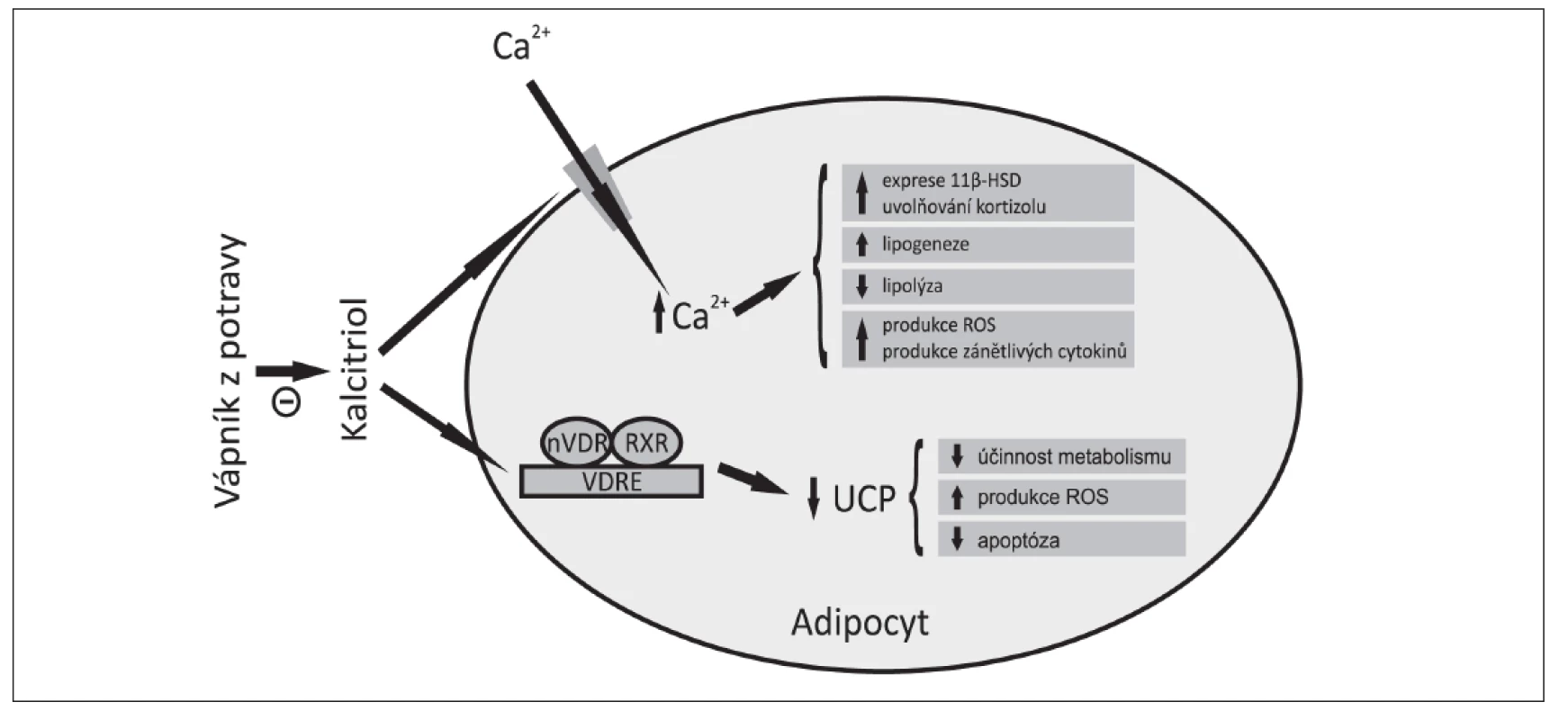
Suplementace vápníkem vede k poklesu intracelulárního vápníku v řadě typů buněk, včetně adipocytů. Tento efekt je zprostředkován zejména redukcí hladiny kalcitriolu, která vede ke snížení vstupu vápníku do buňky, a tím dochází k poklesu hladiny intracelulárního vápníku. Současné poznatky naznačují, že dieta o vyšším obsahu vápníku může také ovlivňovat energetický metabolismus supresivním účinkem kalcitriolu na inhibici exprese odpřahujících proteinů (UCP) a to cestou přes jaderný receptor pro vitamin D (nVDR). Kalcitriol prostřednictvím nVDR suprimuje expresi UCP v tukové tkáni (40). Suprese hladiny kalcitriolu dietou o vyšším obsahu vápníku vedla u myší k vzestupu exprese UCP2 v tukové tkáni a UCP3 v kosterním svalu (41) a zeslabila pokles tělesné teploty, který je jinak pozorován při energetické restrikci (6). Přímé ovlivnění UCP2 kalcitriolem tak může přispět k větší oxidaci tuků (42). Byly prováděny i studie porovnávající vliv diety o vysokém obsahu tuku a různém obsahu vápníku na expresi UCP3. Výsledky ukazují, že vápník zvyšuje expresi UCP3 v kosterním svalu, a to prostřednictvím vzestupu sérových hladin leptinu a volného trijódtyroninu (43).
Studie ukazují, že 1,25(OH)2D3 může také ovlivňovat obezitu inhibicí apoptózy tukových buněk. Účinek je zčásti zprostředkován inhibicí exprese UCP2 a následným vzestupem mitochondriálního membránového potenciálu a částečně prostřednictvím účinku 1,25(OH)2D3 na hladinu intracelulárního vápníku v cytoplazmě a výměnu vápníku mezi endoplasmatickým retikulem a mitochondriemi (44).
Kalcitriol může také regulovat energetický metabolismus prostřednictvím regulace produkce a exprese cytokinů. Produkce ROS (Reactive Oxygen Species) je zvýšena u obézních a je asociována s rozvojem hyperglykémie a hyperlipidémie (45). Bylo prokázáno, že produkce ROS je ovlivněna aktivitou UCP v mitochondriích a cytozomální vápníkovou signalizací (46). Nadbytek tukové tkáně, zejména v abdominální oblasti, je asociován se systémovým oxidativním stresem u lidí a myší. Zvýšený oxidativní stres v tukové tkáni se zdá být důležitým faktorem v patogenezi metabolického syndromu. Recentní studie ukazují, že 1,25(OH)2D zvyšuje oxidativní a zánětlivý stres, jelikož stimuluje produkci tumor nekrotizujícího faktoru-α, interleukinu-6, interleukinu-8 v adipocytech. Inhibice 1,25(OH)2D3 při dietě o vyšším obsahu vápníku snižuje u obézních myší oxidativní i zánětlivý stres jak v tukové tkáni, tak na úrovni celého organismu (47).
Další mechanismus působení vápníku spočívá ve zvýšené exkreci tuků stolicí. Tento efekt není příliš výrazný při běžné dietě, ale mohl by sehrávat důležitou úlohu u lidí, jejichž dietní příjem tuků je nadměrný (48). Novější hypotézy o vlivu příjmu vápníku na tělesnou hmotnost poukazují na to, že vápník v dietě může ovlivňovat chuť k jídlu, a snižovat tak příjem potravy (48). Ukazuje se také, že nedostatečný příjem vápníku v průběhu redukčního režimu může spouštět pocity hladu, a narušit tak compliance k dietě (49).
Nicméně tyto výsledky jsou v rozporu se studiemi, které prokazují, že mléčné výrobky nebo suplementace vápníkem nemá žádný efekt (50, 51) nebo může mít dokonce opačný efekt na tělesnou hmotnost (52). Rozdílné výsledky studií o vlivu vápníku mohou být dány především odlišnými charakteristikami sledovaných skupin, co se týká věku, etnika a tělesného složení a různými způsoby ovlivnění příjmu vápníku, resp. jeho sledování. Významnou úlohu mohou sehrávat také rozdílné doby sledování studie a použitá dávka a forma vápníku.
Podpořeno grantem IGA MZ ČR NT/12342-5/2011.
Seznam použitých zkratek
1,25-(OH)2 D3 1,25-dihydroxyvitamin D (kalcitriol)
25OHD 25-hydroxyvitamin D
ACE
enzym konvertující angiotenzin (Angiotensin Converting Enzyme)
AMK aminokyselina
CCK cholecystokinin
FAS
syntáza mastných kyselin (Fatty Acid Synthase)
FFM beztuková hmota (Fat free mass)
GIP
gastrický inhibiční peptid (Gastric Inhibitory Peptide)
GLP1
glukagonu podobný peptid 1 (Glucagon like peptide 1)
ηVDR jaderný receptor pro vitamín D
ROS Reactive Oxygen Species
TG triacylglycerol
UCP odpřahující protein (uncoupling protein)
ADRESA PRO KORESPONDENCI:
PhDr. Karolína Hlavatá, Ph.D.
Endokrinologický ústav
Národní 8, 116 94 Praha 1
e-mail: khlavata@endo.cz
Sources
1. Davies KM, et al. Calcium intake and body weight. J Clin Endocrinol Metab 2000; 85(12): 4635–4638.
2. Heaney RP. Normalizing calcium intake: projected population effects for body weight. J Nutr 2003; 133(1): 268S–270S.
3. Hlavatá K, et al. Effect of calcium intake on anthropometric parameters in Czech adolescents. ICO 2014, Kuala Lumpur.
4. Zemel MB, et al. Dairy augmentation of total and central fat loss in obese subjects. Int J Obes (Lond) 2005; 29 : 391–397.
5. Zemel MB, et al. Effects of calcium and dairy on body composition and weight loss in African-American adults. Obes Res 2005; 13(7): 1218–1225.
6. Zemel MB, et al. Regulation of adiposity by dietary calcium. FASEB J. 2000; 14(9): 1132–1138.
7. Kabrnová-Hlavatá K, et al. Calcium intake and outcome of short-term weight management. Physiol Res 2008; 57 : 237–245.
8. Zemel MB. Mechanisms of dairy modulation of adiposity. J Nutr 2003; 133(1): 252S–256S.
9. Shi H, et al. Effects of dietary calcium on adipocyte lipid metabolism and body weight regulation in energy-restricted aP2-agouti transgenic mice. FASEB J 2001; 15(2): 291–293.
10. Zemel MB. Role of calcium and dairy products in energy partitioning and weight management. Am J Clin Nutr 2004; 79(5): 907S–912S.
11. St-Onge MP, et al. Greater rise in fat oxidation with medium-chain triglyceride consumption relative to long-chain triglyceride is associated with lower initial body weight and greater loss of subcutaneous adipose tissue. Int J Obes Relat Metab Disord 2003; 27(12): 1565–1571.
12. Wang YW, et al. Conjugated linoleic acid and obesity control: efficacy and mechanisms. Int J Obes Relat Metab Disord 2004; 28(8): 941–955.
13. Aziz A, et al. The effect of dairy components on food intake and satiety: mechanisms of actions and implications for the development of functional foods. In: Saarela M., Functional Dairy Products, vol. 2. Cambridge, UK, Woodhead Publishing Ltd. 2007.
14. Alfenas RC, et al. Effect of fat sources on satiety. Obes Res 2003; 11 : 183–187.
15. Boos CJ, et al. Is hypertension an inflammatory process? Curr Pharm Des 2006; 12(13): 1623–1635.
16. Harris RBS. Dairy protein, calcium and body weight – the need for a mechanism. Int J Obes (Lond) 2005; 29(4): 388–390.
17. Layman DK. The role of leucine in weight loss diets and glucose homeostasis. J Nutr 2003; 133(1): 261S–267S.
18. Moran TH, et al. Intestinal feedback signaling and satiety. Physiol Behav 2011; 105 : 77–81.
19. Hall WL, et al. Casein and whey exert different effects on plasma amino acid profiles, gastrointestinal hormone secretion and appetite. Br J Nutr 2003; 89(2): 239–248.
20. Anderson GH, et al. Protein source, quantity, and time of consumption determine the effect of proteins on short-term food intake in young men. J Nutr 2004; 134 : 3011–3015.
21. Luhovy BL, et al. Whey proteins in the regulation of food intake and satiety. J Am Coll Nutr 2007; 26(6): 704S–712S.
22. Westerterp-Plantenga MS. The significance of protein in food intake and body weight regulation. Curr Opin Clin Nutr Metab Care 2003; 6(6): 635–638.
23. Westerterp-Plantenga MS, et al. Dietary protein, weight loss, and weight maintenance. Annu Rev Nutr 2009; 29 : 21–41.
24. Smedman AE, et al. Pentadecanoic acid in serum as a marker for intake of milk fat: relations between intake of milk fat and metabolic risk factors. Am J Clin Nutr 1999; 69(1): 22–29.
25. Mennen LI, et al. Possible protective effect of bread and dairy products on the risk of metabolic syndrome. Nutr Res 2000; 20 : 335–347.
26. Wirfalt E, et al. Food patterns and components of the metabolic syndrome in men and women: a cross-sectional study within the Malmo Diet and Cancer cohort. Am J Epidemiol 2001; 154(12): 1150–1159.
27. Kratz M, et al. The relationship between high-fat dairy consumption and obesity, cardiovascular, and metabolic disease. Eur J Nutr 2013; 52 (1): 1–24.
28. Månsson HL. Fatty acids in bovine milk fat. Food Nutr Res 2008; 52:
1821–1828.
29. Hamer HM, et al. Review article: the role of butyrate on colonic function. Aliment Pharmacol Ther 2008; 27(2): 104–119.
30. Gao Z, et al. Butyrate improves insulin sensitivity and increases energy expenditure in mice. Diabetes 2009; 58(7): 1509–1517.
31. Schlüter A, et al. Phytanic acid, a novel activator of uncoupling protein-1 gene transcription and brown adipocyte differentiation. Biochem J 2002; 362(Pt 1): 61–69.
32. Cao H, et al. Identification of a lipokine, a lipid hormone linking adipose tissue to systemic metabolism. Cell 2008; 134(6): 933–944.
33. Gong J, et al. Adipose tissue palmitoleic acid and obesity in humans: does it behave as a lipokine? Am J Clin Nutr 2011; 93(1): 186–191.
34. Mozaffarian D, et al. Trans-Palmitoleic Acid, Metabolic Risk Factors, and New-Onset Diabetes in US Adults. Ann Intern Med 2010; 153 (12): 790–799.
35. Zemel MB. The role of dairy foods in weight management. J Am Coll Nutr. 2005; 24(6 Suppl): 537S–546S.
36. Jones BH, et al. Upregulation of adipocyte metabolism by agouti protein: possible paracrine actions in yellow mouse obesity. Am J Physiol 1996; 270(1 Pt 1): E192–196.
37. Kim JH, et al. The effects of calcium channel blockade on agouti-induced obesity. FASEB J 1996; 10(14): 1646–1652.
38. Zemel MB, et al. Effects of a potent melanocortin agonist on the diabetic/obese phenotype in yellow mice. Int J Obes Relat Metab Disord 1998; 22(7): 678–683.
39. Zemel MB. Nutritional and endocrine modulation of intracellular calcium: implications in obesity, insulin resistance and hypertension. Mol Cell Biochem 1998; 188(1–2): 129–136.
40. Wong KE, et al. Involvement of the vitamin D receptor in energy metabolism: regulation of uncoupling proteins. Am J Physiol Endocrinol Metab 2009; 296(4): E820–828.
41. Sun X, et al. Calcium and dairy products inhibit weight and fat regain during ad libitum consumption following energy restriction in Ap2-agouti transgenic mice. J Nutr 2004; 134(11): 3054–3060.
42. Zemel MB, et al. Calcitriol and energy metabolism. Nutr Rev. 2008; 66(10 Suppl 2): S139–146.
43. Yu X, et al. The effect of dietary calcium on the expression of uncoupling protein 3 gene in skeletal muscle of rat fed with high fat diet. Wei Sheng Yan Jiu. 2003; 32(3): 204–207.
44. Sun X, et al. Role of uncoupling protein 2 (UCP2) expression and 1alpha, 25-dihydroxyvitamin D3 in modulating adipocyte apoptosis. FASEB J 2004; 18(12): 1430–1432.
45. Furukawa S, et al. Increased oxidative stress in obesity and its impact on metabolic syndrome. J Clin Invest 2004; 114(12): 1752–1761.
46. Sun X, et al. Dietary calcium regulates ROS production in aP2-agouti transgenic mice on high-fat/high-sucrose diets. Int J Obes (Lond) 2006; 30(9): 1341–1346.
47. Jacobsen R, et al. Effect of short-term high dietary calcium intake on 24-h energy expenditure, fat oxidation, and fecal fat excretion. Int J Obes (Lond) 2005; 29 : 292–301.
48. Teegarden D, et al. Can the controversial relationship between dietary calcium and body weight be mechanistically explained by alterations in appetite and food intake? Nutr Rev 2008; 66(10): 601–605.
49. Astrup A, et al. Dairy beverages and energy balance. Physiol Behav 2010; 100(1): 67–75.
50. Barr SI. Increased dairy product or calcium intake: is body weight or composition affected in humans? J Nutr 2003; 133(1): 245S–248S.
51. Yanovski JA, et al. Effects of calcium supplementation on body weight and adiposity in overweight and obese adults: a randomized trial. Ann Intern Med 2009; 150(12): 821–829.
52. Barr SI, et al. Effects of increased consumption of fluid milk on energy and nutrient intake, body weight, and cardiovascular risk factors in healthy older adults. J Am Diet Assoc 2000; 100(7): 810–817.
Labels
Addictology Allergology and clinical immunology Angiology Audiology Clinical biochemistry Dermatology & STDs Paediatric gastroenterology Paediatric surgery Paediatric cardiology Paediatric neurology Paediatric ENT Paediatric psychiatry Paediatric rheumatology Diabetology Pharmacy Vascular surgery Pain management Dental Hygienist
Article was published inJournal of Czech Physicians

-
All articles in this issue
- Perioperační chemoterapie u karcinomu žaludku – pohled chirurga
- Základné biologické úlohy galektínov v reparácii tkanív a raste nádorov
- Vápník, mléčné výrobky a redukce hmotnosti
- Mutagenní vliv vyššího věku otců u neurokardiofaciokutánního syndromu
- Centra pro závislé na tabáku v České republice v roce 2012: přehled, ekonomika
- Která etika pro lékařskou etiku? Pocta Hansu Jonasovi, 1903–1993
- Horizont 2020, rámcový program Evropské komise pro výzkuma inovace na roky 2014–2020
- ESHG Conference – Satellite meeting, MiCo
- DANIEL NATHANS
- Journal of Czech Physicians
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Perioperační chemoterapie u karcinomu žaludku – pohled chirurga
- Mutagenní vliv vyššího věku otců u neurokardiofaciokutánního syndromu
- Vápník, mléčné výrobky a redukce hmotnosti
- Základné biologické úlohy galektínov v reparácii tkanív a raste nádorov
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

