-
Medical journals
- Career
Vztah rizikových faktorů mezi metabolickým syndromem a nealkoholickým ztučněním jater u dětí a dospívajících
Authors: Vratislav Smolka 1; Jiří Ehrmann Jr. 2; Oksana Tkachyk 1; Martin Zápalka 1
Authors‘ workplace: Dětská klinika, Lékařská fakulta UP a FN, Olomouc 1; Ústav klinické a molekulární patologie, Lékařská fakulta UP a FN, Olomouc 2
Published in: Čas. Lék. čes. 2014; 152: 91-97
Category: Original Article
Overview
Úvod.
S nárůstem obézních dětí a adolescentů přibývá pacientů s nealkoholickým ztučněním jater (NAFLD) a pacientů s prokázaným metabolickým syndromem (MS). U dětských pacientů s NAFLD jsme v retrospektivní studii sledovali jejich vztah k MS.Metody.
Diagnóza NAFLD byla stanovena na základě zvýšených hladin transamináz a sonografického obrazu. MS byl definován podle kritérií Mezinárodní diabetologické federace. Jaterní biopsie byla provedena u pacientů se zvýšením transamináz déle než 1 rok. Histologická aktivita vzorků byla hodnocena podle skóre aktivity NAFLD (NAS) a podle pediatrického histologického skóre NAFLD (PNHS).Výsledky.
NAFLD bylo diagnostikováno u 39 dětí a 20 dětí splnilo kritéria pro MS. Mezi pacienty s MS a bez MS byl signifikantní rozdíl ze sledovaných parametrů v inzulinové rezistenci (IR) (< 0,001), hladině cholesterolu (< 0,04) a GMT (< 0,05). Jaterní biopsie byla provedena u 20 dětí, z toho u 10 dětí s MS. U těchto souborů nebyl rozdíl v rozsahu steatózy a NAS. Nebyl nalezen rozdíl v kritériích pro MS včetně sledovaných parametrů u dětí s nealkoholickou steatohepatitidou (NASH) a bez NASH hodnocených podle PNHS.Závěr.
Rizikovými faktory pro vznik NAFLD jsou obezita, přítomnost inzulinové rezistence a dyslipidémie, které se úzce váží k MS. K určení histologické aktivity NAFLD je nutná biopsie, protože žádné neinvazivní vyšetření neurčí jednoznačný rozsah jaterního postižení.Klíčová slova:
nealkoholické ztučnění jater – nealkoholická steatohepatitida – metabolický syndrom – inzulinová rezistence – portální zánětÚVOD
S růstem výskytu obezity u dětí a adolescentů se zvyšuje prevalence nealkoholického ztučnění jater (nonalcoholic fatty liver disease, NAFLD). Prevalence NAFLD v populaci je 2,6 %, ale u obézních dětí se zvyšuje až k 53 %, proto není překvapením, že NAFLD se stává nejčastějším onemocněním jater v dětském věku. Histopatologicky je NAFLD charakterizováno jednoduchou steatózou, nealkoholickou steatohepatitidou (NASH) bez fibrózy nebo s přítomnou fibrózou. Prostá steatóza je považována převážně za neprogresivní jaterní onemocnění na rozdíl od NASH, která může vést k prohloubení jaterního postižení až k rozvoji cirhózy. U dětí s potvrzenou NAFLD byly popsány tři histologické obrazy jaterního postižení: 1. obraz odpovídající NASH u dospělých pacientů (NAFLD typ 1), 2. steatóza lokalizovaná především do zóny 1 (periportální) nebo panacinárně, žádná nebo malá balónová degenerace hepatocytů a přítomnost portálního zánětu a fibrózy (NAFLD typ 2), 3. obraz překryvného syndromu mezi typem 1 a 2 (1,2). U dospělých pacientů se NAFLD považuje za jaterní projev metabolického syndromu (MS). Také v dětském věku jsou u pacientů s NAFLD často přítomny rizikové faktory MS a někteří pacienti splňují diagnostická kritéria pro MS. Četnost výskytu MS u dětí je 3–4% a kolísá v závislosti na použitých kritériích. Předcházející studie ukázaly, že děti s potvrzeným MS měly častěji zvýšené hladiny ALT (3). Také u dětí s nadváhou a biopticky prokázaným NAFLD byl signifikantně vyšší výskyt MS než u obézních pacientů bez známek NAFLD (4). Avšak neexistují ani klinické obrazy, biochemické parametry nebo zobrazovací metody, které by dokázaly rozlišit jednotlivé formy NAFLD. V této retrospektivní studii jsou prezentovány klinické, biochemické a histologické výsledky dětí a adolescentů s NAFLD ve vztahu k MS.
SOUBOR NEMOCNÝCH A POUŽITÉ METODY
Do retrospektivní studie byly zařazeny děti a adolescenti ve věku od 10 do 18 let, u kterých bylo NAFDL potvrzeno v období od ledna roku 2003 do prosince roku 2012 při sledování v hepatologické ambulanci Dětské kliniky Fakultní nemocnice v Olomouci. Pacienti byli odesláni k vyšetření do poradny praktickými lékaři pro děti a dorost nebo lékaři ze spádových nemocnic pro náhodně zjištěné zvýšené hladiny transamináz především alaninaminotransferázy (ALT).
NAFDL bylo definováno na základě zvýšené hladiny transamináz nad horní hranici normy určené biochemickou laboratoří s ohledem na použitou laboratorní metodu a na základě sonografického obrazu s hyperechogenitou jaterního parenchymu v porovnání s echogenitou ledviny, který odpovídal tukové infiltraci jater. U všech zařazených pacientů byla vyloučena jiná etiologie chronického jaterního onemocnění spojeného se steatózou hepatocytů. Byly vyloučeny infekce hepatotropními viry, Wilsonova choroba, deficit alfa-1-antitrypsinu, cystická fibróza, autoimunitní onemocnění jater, toxické postižení včetně dlouhodobé parenterální výživy. Anamnesticky nebyla u adolescentních pacientů zjištěna zvýšená konzumace alkoholu. Sonografické vyšetření břicha na lačno bylo realizováno u všech dětí. Velikost jater nebyla měřena, pokud dolní okraj nepřesahoval spodní žeberní oblouk. Slepá perkutánní biopsie jater byla indikována u pacientů s hladinami transamináz více než dvojnásobek horní hranice normy, které přetrvávaly déle než 12 měsíců, nebo bylo podezření na jinou etiologii hepatopatie. K biopsii byla použita Menghiniho jehla a výkon byl proveden ve spolupráci s anesteziologem v celkové anestezii. K výkonu bylo přistoupeno s informovaným souhlasem obou rodičů i pacienta.
U každého pacienta byl vypočten body mass index (BMI) na základě tělesné váhy (kg) dělené povrchem těla (m²). Výsledek byl zhodnocen podle percentilového grafu pro BMI pro věk a pohlaví české dětské populace (5). Obezita byla definována jako BMI nad 97. percentilem a nadváha jako BMI v rozmezí 92. až 97. percentilu. Ke srovnání pacientů bylo použito BMI z-skóre. Kromě výšky a váhy byl u všech pacientů změřen opakovaně krevní tlak (TK), byly stanoveny sérové hladiny transamináz (ALT, AST), gama-glutamyltransferázy (GGT), kyseliny močové (KM), cholesterolu, triacylglycerolu (Tg), HDL cholesterolu (HDLch), glukózy a inzulinu na lačno minimálně po 8 hodinách lačnění. Vyšetření byla provedena v termínu biopsie nebo 6 až 12 měsíců od určení diagnózy u dětí, u kterých biopsie jater nebyla indikována. Inzulinová rezistence (IR) byla stanovena výpočtem homeostatického modelu inzulinové rezistence (HOMA-IR): inzulin na lačno (U/ml) x glykémie na lačno (mmol/l)/22,5. IR je definována jako HOMA-IR > 2. MS byl definován podle modifikovaných kritérií Mezinárodní diabetologické federace (IDF) pro pa-cienty ve věku 10–16 let (6) a byl určen přítomností tří z pěti sledovaných rizikových faktorů:
- hladina glukózy na lačno ≥ 5,6 mmol/l,
- BMI ≥ 97. percentil (z-skóre > 2),
- systolický nebo diastolický krevní tlak > 130/85 mm Hg,
- triglyceridy ≥ 1,7 mmol/l,
- HDL cholesterol ≤ 1,03 mmol/l.
Změna souvisela s použitím BMI jako kritéria pro MS (7), jelikož v české populaci nejsou stanoveny referenční hodnoty pro obvod pasu v dětském věku. Byly porovnány hladiny transamináz, KM a rizikových faktorů u souborů pacientů s MS a bez MS.
Při histologickém vyšetření bylo NAFLD definováno jako > 5 % tukově změněných hepatocytů. Při kvantitativním hodnocení byla jako lehká hodnocena steatóza v rozsahu 5–33 %, jako střední v 34–66 % a v rozsahu 67–100 % jako těžká. Lokalizace steatózy byla určena podle převažujícího zastoupení jako panacinární, resp. jako steatóza v zóně 3 (perivenulárně/centrálně) nebo v zóně 1 (periportálně). Perisinusoidální fibróza byla hodnocena jako 0 (žádná),1 (mírná), 2 (střední). Podle Brunta et al. (8) byla zhodnocena fibróza portálních polí jako 0 (žádná), 1 (rozšíření portálních polí), 2 (rozšíření portálních polí se septy), 3 (septa porto-portální, septa porto-centrální) a 4 (cirhóza). Na základě hodnocení fibrózy (portální i perisinusoidální) byl stanoven staging od 0 do 4 : 0 (žádná fibróza), 1A (mírná perisinusoidální fibróza v zóně 3), 1B (střední perisinusoidální fibróza v zóně 3), 1C (portální fibróza – rozšíření portálních polí), 2 (periportální fibróza – rozšíření se septy), 3 (septa porto-portální, septa porto-centrální), 4 (cirhóza). Lobulární zánět byl hodnocen jako 0 (bez zánětlivých hnízd), 1 (méně než 2 hnízda při zvětšení 200krát), 2 (2–4 hnízda při zvětšení 200krát) a 3 (více jako 4 hnízda při zvětšení 200krát). Rozsah portálního zánětu byl určen dle Schwimmera et al. (1) od 0 do 3 : 0 (bez přítomného zánětu), 1 (mírný), 2 (střední),3 (těžký lymfoplasmocytární infiltrát v portálních polích). Balónová degenerace hepatocytů byla přítomna od 0 do 2 : 0 (nepřítomny), 1 (několik změněných buněk), 2 (velké množství balónově změněných buněk). U všech vzorků bylo stanoveno skóre aktivity NAFLD (NAS) také podle skórovacího systému dle Kleinera (9). NAS bylo stanoveno podle hodnocení steatózy od 0 do 3 bodů: 0 ≤ 5 %, 1 = 5–33 %, 2 ≥ 33–66 %, 3 ≥ 66 %. Zánět byl hodnocen od 0 do 3 bodů: 0 (bez přítomného zánětu), 1 (mírný), 2 (střední), 3 (těžký). Balónová degenerace hepatocytů byla zhodnocena od 0 do 2 bodů:0 (nepřítomny), 1 (několik změněných buněk), 2 (velké množství balónově změněných buněk). Po součtu bodů byla na základě výsledku stanovena diagnóza NASH jako jistá ≥ 5, hraniční 3–4 a nepřítomná ≤ 2. Protože NAS nezhodnocuje často přítomný portální zánět v dětském věku, použili jsme ještě pediatrické histologické skóre NAFLD (PNHS). PNHS je dáno následným výpočtem: PNHS = 100krát Zpnhs/1 + Zpnhs. Zpnhs = 8,4 + 2,5krát steatóza + 3,5krát balónová degenerace + 3,4krát lobulární zánět + 0,87krát portální zánět. Portální zánět je zjednodušeně hodnocen jako 0 (žádný), 1 (mírný), 2 (větší než mírný). Výsledek PNHS ≥ 85 odpovídá diagnóze NASH se senzitivitou 76 % a specificitou 91 % (10).
Statistické hodnocení
K porovnání získaných dat bylo použito popisné statistiky a nepárového t-testu. Hodnoty nižší než p < 0,05 byly hodnoceny jako statisticky významné. Vlastní výpočty byly provedeny v programu GraphPadPrism, firmy GraphPad Software, USA, evaluation version.
VÝSLEDKY
Ve sledovaném období jsme na základě definovaných kritérií diagnostikovali NAFLD u 39 pacientů, z toho bylo 35 chlapců v průměrném věku 14,6 roku (10–18,7) a čtyři dívky ve věku 13,5 roku (10,7–16,1). V celém souboru bylo 34 obézních dětí (BMI > 97. percentil) a mezi nimi byla pouze jedna dívka. Zbylých pět pacientů mělo nadváhu (BMI 92.–97. percentil). MS byl podle kritérií potvrzen u 20 dětí (51 %) a z toho bylo 18 chlapců a pouze dvě dívky. Devatenáct dětí nesplnilo kritéria MS. Medián věku dětí ve skupině s MS byl 14,46 ± 0,6 a bez MS 13,56 ± 0,51. Mezi oběma skupinami byl signifikantní rozdíl ve sledovaných rizikových faktorech MS a dále v HOMA-IR, v hladině cholesterolu a GGT (graf 1, 2, 3 a 4). Ale nebyl rozdíl v hladinách ALT, AST, KM, věku a BMI z-skóre (tab. 1). Rozložení a frekvence výskytu diagnostických kritérií pro MS je v tabulce 2. Nejčastějším přítomným rizikovým faktorem MS vyjma BMI (100 %) byla vysoká hladina Tg (75 %) a HDLch (75 %). HOMA-IR vyšší než 2 byl u 33 (85 %) dětí.
Graph 1. Porovnání hodnot sérových TG u dětí s MS a bez MS (p < 0,001) 
Graph 2. Porovnání HOMA-IR u dětí s MS a bez MS (p < 0,001) 
Graph 3. Hodnoty sérového GGT u dětí s MS a bez MS (p < 0,048) 
Graph 4. Porovnání hodnot sérového cholesterolu u dětí s MS a bez MS (p < 0,039) 
Table 1. Klinická a laboratorní charakteristika souboru pacientů (uvedeny průměrné hodnoty ± SD, hodnoty p) 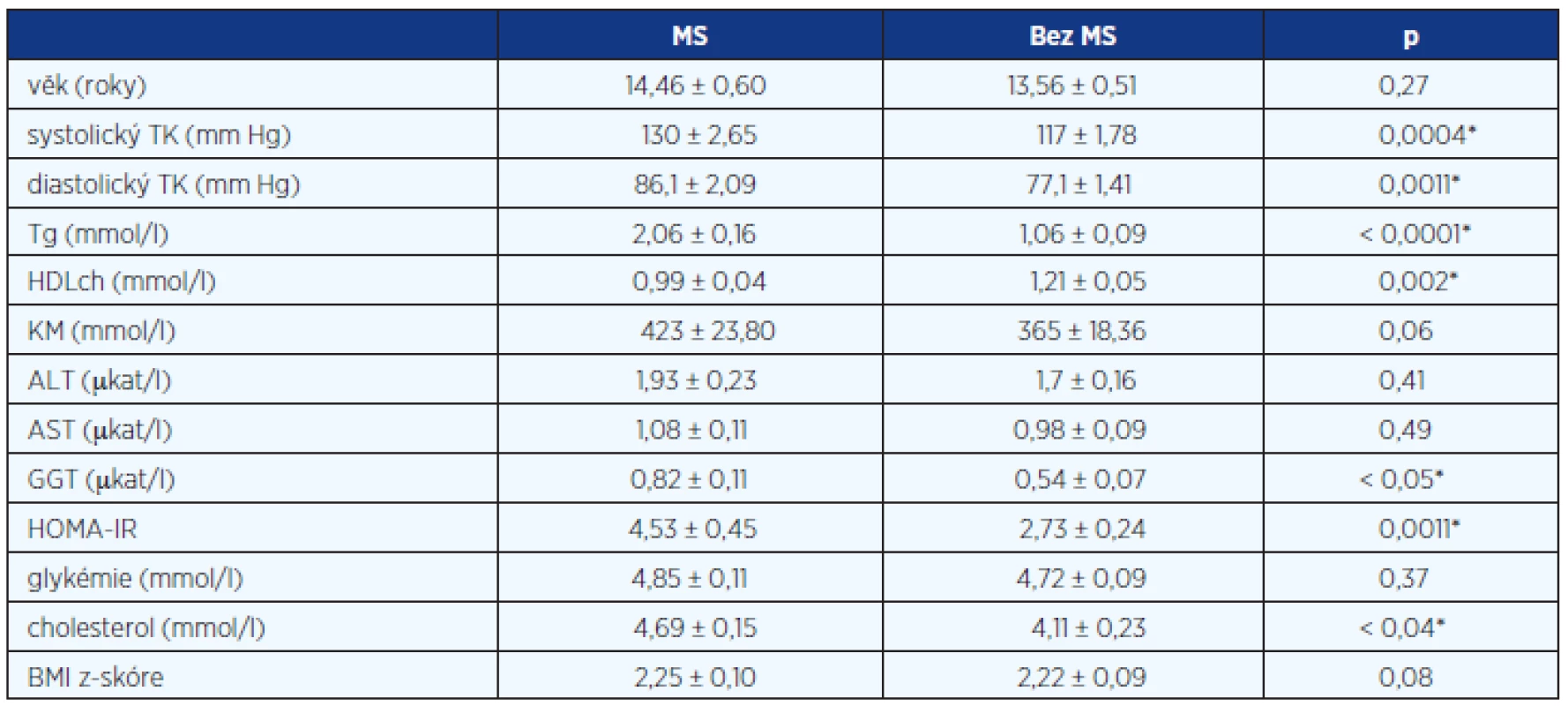
* statisticky významné Table 2. Rozložení a frekvence výskytu diagnostických kritérií pro MS 
Biopsie jater byla provedena u deseti pacientů s MS a u deseti dětí bez přítomných tří kritérií pro MS. Srovnání věku a rizikových faktorů dětí, u kterých byla provedena biopsie a bez indikované biopsie, neukázalo žádný signifikantní rozdíl ve sledovaných parametrech kromě HOMA-IR, které bylo signifikantně vyšší u dětí s provedenou biopsií (p < 0,02). Histologické vyšetření obou skupin pacientů, ve kterém byla sledována steatóza, lobulární a portální zánět, perisinusoidální a portální fibróza, nebylo rozdílné mezi pacienty s MS nebo bez MS. Jednotlivé nálezy histologického vyšetření jsou uvedeny v tabulce 3. Rozsah steatózy nebyl signifikantně rozdílný u obou souborů. Lokalizace steatózy byla především panacinárně (45 %). V zóně 3 to bylo u 35 % dětí a v zóně 1 20 %. Nebyl taky rozdíl mezi oběma soubory v NAS. Výsledek, který by odpovídal podle tohoto hodnocení definitivní NASH, byl pouze u tří dětí (15 %) a hraniční nález byl u deseti pacientů (50 %). NASH byla potvrzena u dvou dětí bez MS a u jednoho s MS. Hraniční hodnoty NAS byly u pěti pacientů s MS i bez potvrzeného MS. Podle hodnocení PNHS byla NASH přítomna u 11 dětí (55 %). Podle PNHS byla NASH zjištěna u šesti dětí s MS a u čtyř dětí bez MS. Portální zánět byl přítomen až v 80 % na rozdíl od lobulárního zánětu, který byl pouze popsán u 30 % pacientů. Balónová degenerace hepatocytů byla zjištěna u deseti dětí (50 %). Fibróza byla přítomna u 15 bioptovaných pacientů (75 %), z toho u tří byla fibróza portální i perisinusoidální a jen u jednoho pacienta byla izolovaná perisinusoidální. Při hodnocení skupin pacientů s PNHS > 85 a s PNHS ≤ 85 nebyl zjištěn signifikantní rozdíl v kritériích pro MS včetně HOMA-IR, věku, hladinách ALT, AST, GGT a KM.
Table 3. Histologické nálezy u dětí s NAFLD 
DISKUZE
Přesná prevalence výskytu NAFLD v dětském věku zůstává nejasná. Tato situace je ovlivněna kromě určité pasivity při vyhledávání pacientů s možným NAFLD také způsobem, jakým je NAFLD diagnostikováno. I v současné době zůstává zlatým standardem histologické vyšetření jaterní tkáně, ale k získání vzorku tkáně je potřebný invazivní výkon. Proto většina studií využívá k diagnóze NAFLD neinvazivní metody. Jako diagnostická kritéria jsou používány zvýšené hladiny transamináz nebo změněná echogenita jater při sonografickém vyšetření. I když sonografické vyšetření břicha v dětském věku je velmi přehledné, zůstává problémem, že pro dětský věk nebyla stanovena senzitivita a specificita tohoto vyšetření. Senzitivita sonografického vyšetření u dospělých je od 60 % do 94 % a specificita od 73 % do 93 % (11). Také byl zjištěn rozdíl mezi výsledky sonografického vyšetření a stanovením hladin transamináz u dětí s NAFLD (12). Z výsledků velkých studií se dá předpokládat, že prevalence NAFLD u adolescentů je přinejmenším 2,6–3,2%. Při vyšetření pitevních nálezů byla steatóza jater zjištěna u 9,6 % dětí ve věku od 2 do 19 let, které zemřely nepřirozenou smrtí (13). Avšak žádná neinvazivní metoda neodliší prostou steatózu od NASH, i když by byla postižena velká většina hepatocytů. Diagnostická kritéria pro NAFLD použitá v této studii byla mnohem přísnější, protože se jednalo o selektivní skupinu pacientů, která byla odeslána k vyšetření pro zvýšené hladiny transamináz. Z tohoto důvodu nebyli diagnostikováni pacienti s NAFLD s normálními hladinami transamináz nebo jen s jejich přechodným zvýšením. Ke stanovení diagnózy NAFLD byla nutná přítomnost obou kritérií, což snížilo počet pacientů s možnou NAFLD zahrnutých ve studii.
V souboru bylo jednoznačně více chlapců (90 %) a jejich převaha byla opakovaně potvrzena ve studiích s dětskými pacienty s NAFLD (1, 14). NAFLD se vyskytuje více u dospívajících než u dětí mladšího věku. Tento výskyt je velmi pravděpodobně spojen s hormonálními změnami v období puberty nebo snížením fyzické aktivity a negativními změnami v jídelníčku dozrávajících mladíků. Rozdíl mezi pohlavími je způsoben buď potenciálně protektivním vlivem estrogenů, nebo nepříznivým vlivem androgenů, jež zhoršují progresi NASH. Bylo ukázáno, že estrogeny mají antiapoptotické a antifibrinogenní vlastnosti a snižují peroxidaci lipidů, která zvyšuje nebezpečí progrese steatózy do NASH (15).
Diagnostika MS v dětském věku má určitá specifika, které vyplývají z růstu a z období puberty. Výskyt MS je jednoznačně ovlivněn výběrem použitých kritérií. Protože však ještě neexistují jednotná kritéria pro MS v dětském věku, jeho udávaná frekvence kolísá od 9 % do 50 % mezi dětmi s nadváhou a obezitou (16). V České republice má 50 % dospělé populace potíže s nadváhou a 20 % je obézních. U dětí ve věkové skupině od 6 do 12 let má 10 % nadváhu a 10 % je obézních. U starších ve věku od 13 do 17 let je situace mírně příznivější. S nadváhou má problémy 6 % adolescentů a 5 % je obézních (17). Ve skupině obézních dětí v České republice byl MS, definovaný podle IDF, přítomen u 37 % dětí a dospívajících. MS, byl v italské studii přítomen u 65,8 % dětí s prokázanou NAFLD (18). V souboru našich pacientů s NAFLD, kde dominovaly děti s BMI nad 97. percentilem, byl MS potvrzen u 51 % sledovaných. Není překvapením, že jsou signifikantní rozdíly mezi diagnostickými faktory MS ve skupinách s MS a bez MS. IR je velmi častým nálezem u obézních pacientů s potvrzeným MS. Zvýšený HOMA-IR byl opakovaně diagnostikován i u pacientů, kteří ještě nenaplnili kritéria pro MS. Proto je také zvažováno, že hodnoty HOMA-IR by měly být součástí diagnostických kritérií pro MS (19). I v této studii byl právě HOMA-IR jediným parametrem, který byl signifikantně rozdílný mezi pacienty s MS a bez MS.
IR je považována za kritický faktor v patogenezi steatózy a NASH u dětí. Mezi další rizikové faktory, které mohou vést ke vzniku NAFLD, patří obezita a další kritéria MS. Závažnost IR se ukázala jako nejdůležitější faktor ve spojení s histologickým obrazem NAFLD v souvislosti se závažností steatózy, fibrózy, zánětu, rozsahu balónové degenerace a NAS. Spojení IR s pubertálním zráním u obézních pacientů může být klíčovým faktorem projevu NAFLD u dětí (20). Široce přijímaná hypotéza patogeneze NASH je 2-hit teorie (21), při které dochází nejprve k akumulaci tuků v hepatocytech vlivem obezity a IR. Právě akumulace triglyceridů zvyšuje zranitelnost hepatocytů k dalším inzultům (second hit), což vede k poškození jaterní buňky, zánětu a vzniku fibrózy. Na patogenezi zánětu se velmi pravděpodobně podílí oxidační stres navozený peroxidací lipidů a uvolněním a působením cytokinů. Některé teorie kladou větší důraz na potencionální roli volných mastných kyselin. Etiopatogeneze NAFLD je však multifaktoriální a jeho rozvoj je ovlivňován genetickými, endokrinními a metabolickými vlivy včetně působení vnějšího prostředí.
Studie s dospělými pacienty s NAFLD ukázaly, že MS je nezávislý ukazatel steatózy, fibrózy a NASH při histologickém vyšetření jater (22, 23). Ve studii s dětskými a adolescentními pacienty Patton et al. popisuje, že přítomnost MS je předpovědním faktorem závažnosti steatózy, rozsahu balónové degenerace, NAS a histologického obrazu NAFLD. U našich pacientů jsme nezjistili, že by u dětí s MS byl závažnější histologický obraz jaterního postižení. Patton et al. také neprokázal, že by stupeň fibrózy souvisel s MS (24), na rozdíl od studie Manco et al., kde právě fibróza byla jediným histologickým nálezem NAFLD spojeným s MS (18). Ani přítomnost a rozsah fibrózy nebyly rozdílné mezi našimi pacienty s MS a bez MS. BMI a faktory MS u dětí nekorelují s přítomností chronického portálního zánětu, jehož přítomnost je u dětí častější než u dospělých a může být obrazem pokročilého jaterního postižení (25). V této studii nebyl také zjištěn signifikantní vztah mezi portálním zánětem a hladinami ALT. Avšak v další studii pro přítomnost portálního zánětu měla silnou předpovědní hodnotu kombinace sérové hodnoty ALT a hladiny inzulinu po lačnění (13). Mezi pacienty ve studii jednoznačně dominoval portální zánět i portální fibróza. Ve většině případů se jednalo o lehkou formu fibrózy, která ale může progredovat až do cirhózy (26). Některá z rutinních laboratorních vyšetření jsou schopna předvídat obraz NAFLD a rozsah jaterní fibrózy (27), ale nemohou nahradit jaterní biopsii při vyšetření NAFLD v dětském věku (19). Protože se jedná o invazivní vyšetření, indikací k provedení biopsie by měla být dynamika laboratorních parametrů v delším časovém období. Podle naší studie pouze biopsie určí rozsah jaterního postižení.
Byl potvrzen očekávaný rozdíl v použitých parametrech mezi histologickou aktivitou NAFLD při hodnocení NAS a PNHS s ohledem na přítomnost portálního zánětu. S ohledem na hodnocení přítomnosti portálního zánětu je hodnocení PNHS pro dětský věk přesnější a může lépe definovat NASH. Při srovnání pacientů s NASH diagnostikovaných podle PNHS a bez NASH nebyl zjištěn žádný rozdíl ve sledovaných klinických a biochemických parametrech. Predikce NASH na základě biochemických nebo klinických nálezů, a tím určení rozsahu jaterního postižení s aktivitou NAFLD se jeví jako nemožná. Ve studii nebyla zjištěna žádná korelace mezi biochemickými a klinickými nálezy a histologickým obrazem NAFLD na rozdíl od jiných studí s pediatrickými pacienty s NAFLD (13).
Studie má spoustu omezení. Jedná se o retrospektivní studii provedenou v jednom centru trvající poměrně dlouhou dobu a s úzce vybranými pacienty při přísných kritériích pro diagnózu NAFLD. Výběrová kritéria ovlivnila i počet pacientů ve studii, a tím i lepší statistické hodnocení souboru. V budoucnosti budou vhodné multicentrické prospektivní studie se zaměřením na diagnózu, histologické obrazy a léčbu dětských pacientů s NAFLD.
ZÁVĚR
S narůstajícím výskytem NAFLD mezi nemocemi jater u dětí a dospívajících je nutná jejich správná diagnóza a léčba. Předpovědními faktory pro NAFLD je především přítomnost rizikových faktorů pro MS. K určení histologické aktivity NAFLD je nutná biopsie, protože žádné neinvazivní vyšetření neurčí jednoznačný rozsah jaterního postižení. Přítomnost NASH může vést k závažné progresi histologického obrazu, a tím nepříznivě ovlivní prognózu pacienta. Feldstein et al.ve své studii ukázal, že děti s NAFLD mají signifikantně kratší dlouhodobé přežívání ve srovnání s očekávanou dobou přežití dětí stejného věku a pohlaví (28).
Zkratky
ALT alaninaminotransferáza
AST aspartátaminotransferáza
BMI body mass index
GGT gama-glutamyltransferáza
HOMA-IR homeostatický model inzulinové rezistence
IDF Mezinárodní diabetologická federace
IR inzulinová rezistence
KM kyselina močová
MS metabolický syndrom
NAFLD nealkoholické ztučnění jater
NAS, NAFLD skóre aktivity
NASH nealkoholická steatohepatitida
PNHS pediatrické histologické skóre NAFLD
Tg triacylglyceroly
TK krevní tlak
ADRESA PRO KORESPONDENCI:
MUDr. Vratislav Smolka
Dětská klinika LF UP a FN
I. P. Pavlova 6, 779 00 Olomouc
e-mail: vratislav.smolka@fnol.cz
Sources
1. Schwimmer JB, Behling C, Newbury R, Deutsch R, Nievergelt C, Schork NJ, Lavine JE. Histopathology of pediatric nonalcoholic fatty liver disease. Hepatology 2005; 42 : 641–649.
2. Nobili V, Marcellini M, Devito R, Ciampalini P, Piemonte F, Compar-cola D, et al. NAFLD in children: A prospective clinical-pathological study and effect of lifestyle advise. Hepatology 2006; 44 : 458–465.
3. Park HS, Han JH, Choi KM, et al. Relation between elevated serum alanine aminotransferase and metabolic syndrome in Korean adolescents. Am J Clin Nutr 2005; 82 : 1046–1051.
4. Schwimmer JB, Pardee PE, Lavine JE, et al. Cardiovascular risk factors and the metabolic syndrome in pediatric nonalcoholic fatty liver disease. Circulation 2008; 118 : 277–283.
5. Bláha P, Vígnerová J, Riedlová J, Kobzová J, Krejčovský L. VI. celostátní antropologický výzkum dětí a mládeže 2001. Čes.-slov. Pediat. 2003; 58 (12): 766–770.
6. Zimmet P, Alberti KG, Kaufman F, Tajima N, Silink M, Arslanian S, Wong G, Bennett P, Shaw J, Caprio S. Metabolic syndrome in children and adolescents – an IDF konsensus report. Pediatr Diabetes 2007; 8 : 299–306.
7. Weiss R, Dziura J, Burgert TS, Tamborlane WV, Taksali SE, Yeckel CW, Allen K, Lopes M, Savoye M, Kortison J, Sherwin RS, Caprio S. Obesity and the metabolic syndrome in children and adolescents. NEJM 2004; 350 : 2362–2374.
8. Brunt EM, Janney CG, Di Bisceglie AM, Neuschwander-Tetri BA, Bacon BR. Nonalcoholic steatohepatitis: a proposal for grading and staging the histological lesions. Am J Gastroenterol 1999; 94 : 2467–2474.
9. Kleiner DE, Brunt EM, Van Natta M, Behling C, Contos MJ, Cummings OW, Ferrell LD, Liu YC, Torbenson MS, Unalp-Arida A, Yeh M, McCullough AJ, Sanyal AJ. Nonalcoholic Steatohepatitis Clinical Research Network. Design and validation of a histological scoring system for nonalcoholic fatty liver disease. Hepatology 2005; 41 : 1313–1321.
10. Alkhouri N, De Vito R, Alisi A, Yerian L, Lopez R, Feldstein AE,Nobili V. Development and validation of a new histological score for pediatric non-alcoholic fatty liver disease. J Hepatol 2012; 57 : 1312–1318.
11. Siegelman ES, Rosen MA. Imaging of hepatic steatosis. Semin Liver Dis 2001; 21 : 71–80.
12. Franzese A, Vajro P, Argenziano A, Puzziello A, Iannucci MP, Saviano MC, Brunetti F, Rubino A. Liver involment in obese children. Ultrasonography and liver enzyme levels at diagnosis and during follow-up in an Italian population. Dig Dis Sci 1997; 42 : 1428–1432.
13. Schwimmer JB, Deutsch R, Rauch JB, Behling C, Newbury R,Lavine JE. Obesity, insulin resistence and other clinicopathological correlates of pediatric nonalcoholic fatty liver disease. J Pediatr 2003; 143 : 500–505.
14. Mager DR, Roberts EA. Nonalcoholic fatty liver disease in children. Clin Liver Dis 2006; 10 : 109–131.
15. Lonardo A, Carani C, Carulli N, Loria P. „Endocrine NAFLD“ a hormonocentric perspective of nonalcoholic fatty liver dinase pathogenesis.J Hepatol 2006; 44 : 1196–1207.
16. Ford ES, Li C. Defining the metabolic syndrome in children and adolescents: will the real definition please stand up? J Pediatr 2008; 152 : 160–164.
17. Marinov Z, Pastucha D. a kol. Praktická dětská obezitologie. Praha: Grada Publishing 2012.
18. Manco M, Marcellini M, Devito R, et al. Metabolic syndrome and liver histology in paediatric non-alcoholic steatohepatitis. Int J Obes (Lond) 2008; 32 : 381–387.
19. Pastucha D, Filipčíková R, Horáková D, Radová L, Marinov Z, Malinčíková J, Kocvrlich M, Horák S, Bezdičková M, Dobiáš M. The incidence of metabolic syndrome in obese Czech children: the importance of early detection of insulin resistance using homeostatic indexes HOMA-IR and QUICKI. Physiol Res 2013; 62 : 277–283.
20. Patton HM, Lavine JE, Van Natta ML, Schwimmer JB, Kleiner D, Molleston J and the Nonalcoholic Steatohepatitis Clinical Research Network. Clinical correlates of histopathology in pediatric nonalcoholic steatohepatitis. Gastroenterology 2008; 135 : 1961–1971.
21. Day CP, James OF. Steatohepatitis: a tale of two “hits”? Gastroenterology 1998; 114 : 842–845.
22. Kang H, Greenson JK, Omo JT, et al. Metabolic syndrome is associated with greater histologic severity, higher carbohydrate, and lower fat diet in patients with NAFLD. Am J Gastroenterol 2006; 101 : 2247–2253.
23. Ryan MC, Wilson AM, Slavin J, et al. Associations between liver histology and severity of the metabolic syndrome in subjects with nonalcoholic fatty liver disease. Diabetes Care 2005; 28 : 1222–1224.
24. Patton MH, Yates K, Unalp-Arida A, Behling CA, Huang TT, Ro-senthal P, Sanyal AJ, Schwimmer JB, Lavine JE and the NASH CRN. Association between metabolic syndrome and liver histology among children with nonalcoholic fatty liver dinase. Am J Gastroenterol 2010; 105 : 2093–2102.
25. Brunt EM, Kleiner DE, Wilson LA, Unalp A, Behling CE, Lavine JE, Neuschwander-Tetri BA and the NASH Clinical Research Network. Portal chronic Inflammation in Nonalcoholic Fatty liver dinase (NAFLD): A histological Marker of Advanced NAFLD – clinicopathological correlations from the Nonalcoholic steatohepatitis Clinical Research Network. Hepatology 2009; 49 : 809–920.
26. Molleston JP, White F,Teckman J, Fitzgerald JF. Obese children with steatohepatitis can develop cirrhosis in childhood. Am J Gastroenterol 2002; 97 : 2460–2462.
27. Carter-Kent C, Yerian LM, Brunt EM, Angulo P, Kohli R, Ling SC, Xanthakos SA, Whitington PF, Charatcharoenwitthaya P, Yap J, Lopez R, McCullough AJ, Feldstein AE. Nonalcoholic steatohepatitis in children: A multicenter clinicopathological study. Hepatology 2009; 50 : 1113–1120.
28. Feldstein AE, Charatcharoenwitthaya P, Treeprasertsuk S,Benson JT,Enders FB, Angulo P. The natural history of non-alcoholic liver dinase in children: a follow-up study for up to 20 years. Gut 2009; 58 : 1538–1544.
29. Weiss R, Dziura J, Burgert TS, Tamborlane WV, Taksali SE, Yeckel CW, Allen K, Lopes M, Savoye M, Kortison J, Sherwin RS, Caprio S. Obesity and the metabolic syndrome in children and adolescents. NEJM 2004; 350 : 2362–2374.
Labels
Addictology Allergology and clinical immunology Angiology Audiology Clinical biochemistry Dermatology & STDs Paediatric gastroenterology Paediatric surgery Paediatric cardiology Paediatric neurology Paediatric ENT Paediatric psychiatry Paediatric rheumatology Diabetology Pharmacy Vascular surgery Pain management Dental Hygienist
Article was published inJournal of Czech Physicians

-
All articles in this issue
- Potenciální interakce mezi léčivy a doplňky stravy rostlinného původu*
- Cirkulující nádorové buňky a prognóza karcinomu prostaty
- Krevní destičky v patogenezia léčbě solidních nádorů
- Vztah rizikových faktorů mezi metabolickým syndromem a nealkoholickým ztučněním jater u dětí a dospívajících
- Imunologické vlastnosti ženských slin a jejich vliv na pohyblivost spermií
- Journal of Czech Physicians
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Krevní destičky v patogenezia léčbě solidních nádorů
- Imunologické vlastnosti ženských slin a jejich vliv na pohyblivost spermií
- Potenciální interakce mezi léčivy a doplňky stravy rostlinného původu*
- Cirkulující nádorové buňky a prognóza karcinomu prostaty
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

