-
Medical journals
- Career
Diabetes mellitus, antidiabetika a kost
Authors: Štěpán Svačina
Authors‘ workplace: Univerzita Karlova v Praze, 1. lékařská fakulta, III. interní klinika VFN
Published in: Čas. Lék. čes. 2010; 149: 282-284
Category: Review Article
Overview
Je podán stručný přehled současných názorů na problematiku stále velmi sporného onemocnění – osteopatie u diabetes mellitus. Kostní metabolismus je ale určitě ovlivněn podáváním antidiabetik. Pozitivně ovlivňuje stav kosti u diabetiků léčba inzulínem, deriváty sulfonylurey a zejména léčba metforminem. Thiazolididiony přinášejí mírně zvýšené riziko kostních fraktur u diabetiček. Vemi zajímavý je pravděpodobně spíše pozitivní zásah GLP-1 a nových léků typu inkretinových analog do kostního metabolismu.
Klíčová slova:
diabetická osteopatie, thiazolidindiony, glucagon like peptid-1, inkretinová analoga.Úvod
Diabetes mellitus má vztah k mnoha orgánovým systémům. V poslední době bývá zdůrazňován například vztah ke kardiovaskulárnímu systému a diabetes je dokonce považován za nemoc cévní (1). Můj učitel, diabetolog a první porevoluční předseda diabetologické společnosti prof. Jaroslav Páv říkával, že ho nejprve mrzelo, když mu řekli, že se má zabývat jen cukrovkou. Pak ale zjistil, že cukrovka se týká celého pacienta a všech jeho orgánových systémů. Zamysleme se tedy při příležitosti životního jubilea významného českého internisty, endokrinologa a osteologa prof. MUDr. Jaroslava Blahoše, DrSc. nad vztahem diabetu a kosti.
Diabetické postižení skeletu
Kostní problematiku uváději jen podrobnější monografie o diabetu. Například podrobná diabetologie Pickupa, Williamse (2) konstatuje, že zůstáva stále nejasné, zda pojem diabetická osteopatie existuje. Popsán je jak snížený, zvýšený, tak normální obsah kostního minerálu u diabetiků. Snad mírně převažují názory, že kostní denzita je u diabetu 1. typu mírně snížena a u diabetu 2. typu mírně zvýšena. Pravděpodobně není jasný vztah kostní denzity k trvání diabetu a k jeho kompenzaci. Relativní deficience inzulínu způsobuje abnormality proteoglykanů a zhoršení kvality chrupavky i kosti. Kost významně ovlivňuje i hladina IGF-1 a systémový zánět přítomný u diabetiků. Osteoporóza pravděpodobně není u diabetiků častější a nejsou častější ani osteoporotické fraktury. Je však zřejmé, že diabetiky postihuje celá řada afekcí, které nejsou jen kostní a patří do oboru revmatologie – např. diabetická hyperostóza, diabetická osteoartropatie či neuropatická problematika kloubní.
Novější práce (3) uvádějí, že nevertebrální fraktury jsou častější u diabetiků 2. typu 1,2×, fraktury kyčle 1,7× a fraktury nohou 1,3×. Předpokládá se, že hyperinzulinémie má anabolický efekt na kost a častější fraktury vznikají při relativní hypoinzulinémii. Není jasné, zda roli přece jen nehraje i stav kompenzace diabetu, a je možné, že dekompenzace diabetu pravděpodobně svým katabolickým efektem kost poškozuje. Pokusy na zvířatech s diabetem ukazují, že jejich kost je křehčí. Kostní změny nevyvolávají prediabetické stavy jako tzv. zvýšená glykémie na lačno – impaired fasting glucose (4), ale až skutečně diagnostikovaný diabetes mellitus. Kostní denzita diabetiků je přitom vyšší (5), ale kosti jsou pravděpodobně křehčí. U diabetiků s frakturou je přitom denzita kostní nižší než u kontrolní skupiny diabetiků bez fraktury.
Obezita před osteoporózou chrání a řada diabetiků 2. typu je obézních. Velmi důležitou úlohu však hraje tuková tkáň kostní dřeně (6). Ta představuje zcela samostatný pool tukových buněk. Je typické, že u stavů spojených s poklesem kostní hmoty obvykle tato tuková tkáň expanduje a při dobré osteogenezi naopak tukové tkáně kostní dřeně ubývá. Leptin přitom podporuje tvorbu kosti a dokonce je významně sekretován i osteoblasty. Adiponektin je naproti tomu tvořen jen adipocyty. Mezenchymální kmenová buňka se může diferencovat jak v tukovou buňku, tak v osteoblast. Obě buňky produkují řadu mediátorů, které tvorbu kosti ovlivňují (podrobně v 6). Pool tukových buněk v kostní dřeni má zcela jiné charakteristiky než tukové buňky bílé a hnědé tukové tkáně (tab. 1).
Table 1. Fyziologické rozdíly mezi jednotlivými typy tukové tkáně (6) 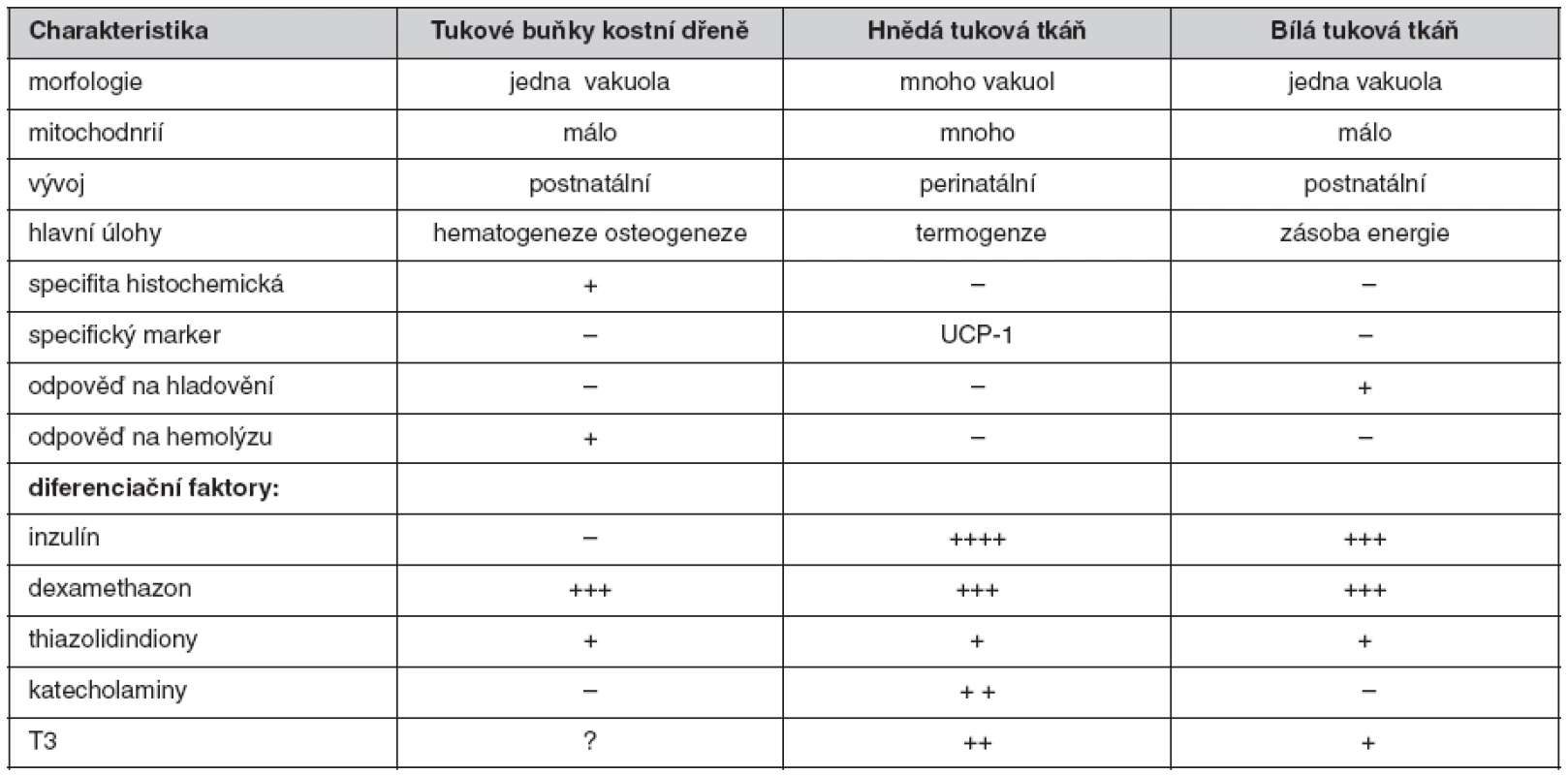
Tuková buňka kostní dřeně je tedy enzymaticky i exokrinně aktivní buňkou odlišnou od typických tukových buněk a dále diskutované efekty antidiabetik mohou souviset právě s ovlivněním tukové buňky kostní dřeně.
Antidiabetika a kost
Celá řada studií, článků i metaanalýz se zabývá vztahem antidiabetik k postižení kosti. Nejvíce studií se týká vztahu thiazolidindionů a kosti. V našem tisku upozornil na tuto problematiku prof. Vladimír Palička již v roce 2007 (7). Metformin a deriváty sulfonylurey mohou podle novějších článků (3) dokonce snižovat riziko kostních fraktur. Experimentálně byl u metforminu pokázán pozitivní efekt na osteogenezi a zároveň efekt na potlačení osteolýzy (8). Thiazolidindiony, jak je uvedeno dále, riziko fraktur u žen mírně zvyšují. Poté, co několik studií i publikovaných metatanalýz uzavřelo problematiku vztahu thiazolidindionů a kosti, objevila se nová skupina léků, která kostní tkáň ovlivňuje – inkretinová analoga. Oběma těmto problematikám věnujeme samostatné pojednání.
Thiazolidindiony a kost
Překvapivým zjištěním studie ADOPT (9) byl vyšší výskyt fraktur dlouhých kostí ve skupině léčené rosiglitazonem. Fraktury se vyskytovaly pouze u žen. Nebyl ale zvýšen výskyt klasických osteoporotických fraktur (obratle a krček femoru). Mechanismus vzniku fraktur zůstává nejasný. V databázích ze studií s pioglitazonem bylo pak zjištěno, že podobný výskyt fraktur je také po použití pioglitazonu.
Ve studii ADOPT byla analyzována data od 840 diabetiček 2. typu a 2511 diabetiků 2. typu. U mužů se výskyt fraktur nelišil při podávání rosiglitazonu, metforminu a glibenclamidu. U žen mělo alespoň jednu frakturu 9,3 % léčených rosiglitazonem, 5,1 %, léčených metforminem a 3,5 %, léčených glibenclamidem. Kumulativé pětileté riziko fraktury činilo 1,81 při srovnání rosiglitazonu s metforminem a 2,13 při srovnání s glibenclamidem.
Dosud jsou výsledky stále analyzovány a nedávno byla analyzována i séra deponovaná během studie. Nepodařilo se zjistit žádný biomarker rizika ani prediktivní faktor vzniku fraktur u těchto diabetiček (10).
Při srovnání rosiglitazonu a pioglitazonu došla řada autorů již před několika lety k závěru, že riziko fraktur je srovnatelné (např. 11). V této práci například rosiglitazon představuje riziko 2,38 a pioglitazon 2,59 vůči kontrolní skupině.
Dnes lze riziko fraktur při užívání thiazolidindionů shrnout na podkladě provedených metatanalýz (12).
Meier et al. (12) analyzovali podání glitazonů delší než 1 rok u 13715 účastníků randomizovaných studií a 31679 účastníků observačních studií. Jones et al. (13) sledovali 29000 diabetiků a rozdělili je na léčené a neléčené thiazolidindiony. Výsledky obou analýz jsou podobné (tab. 2). Ve druhé studii bylo dále zjištěno, že s každým rokem věku stoupá riziko fraktury související s thiazolidindiony o 2 %.
Table 2. Relativní riziko fraktury při léčbě glitazony 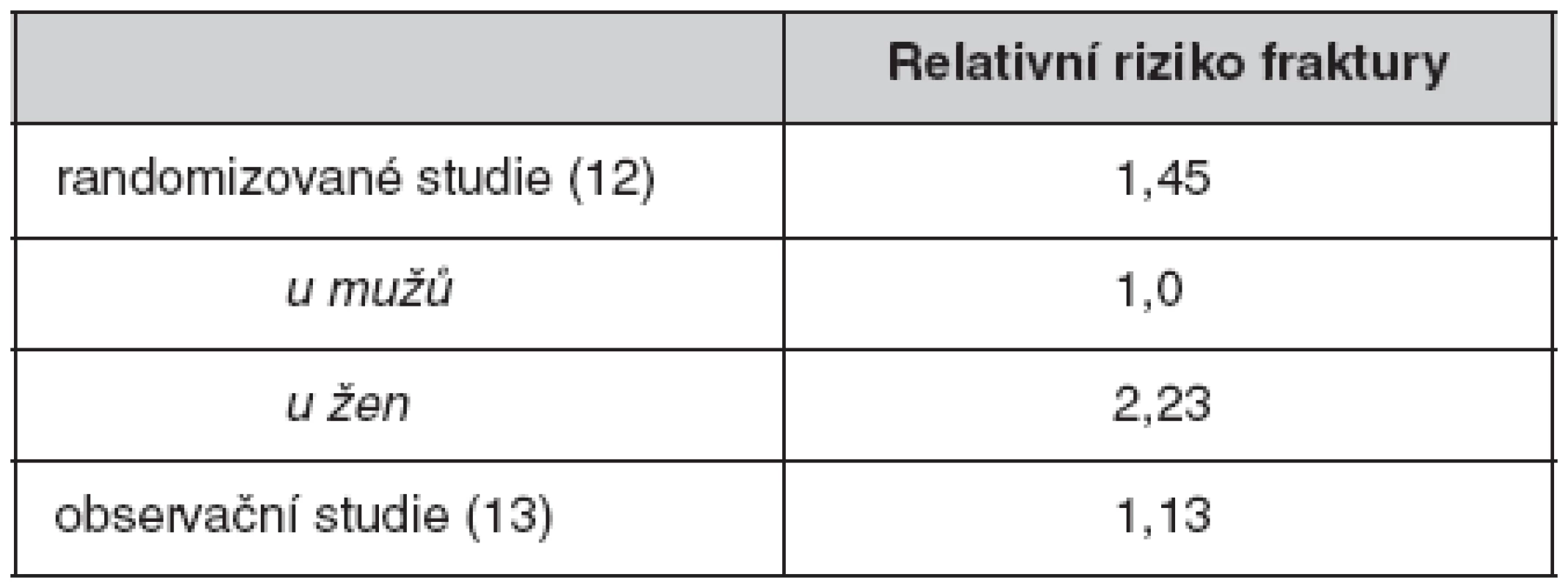
Celkově lze shrnout, že benefity užívání glitazonů převažují a riziko fraktur se vyskuje zejména u žen, u kterých je třeba kostní problematice věnovat pozornost.
Inkretinová analoga a kost
Inkretinová analoga přinášejí v posledních letech zásadní změnu do léčby diabetu. Exenatid je úspěšně používán ve Spojených státech amerických již několik let a u nás od roku 2009. Liraglutid je úspěšně používán v Evropě a u nás se objeví na trhu v tomto roce. Ve Spojených státech amerických nebyl zatím k užívání povolen.
Oba léky aplikované parenterálně velmi úspěšně kompenzují diabetes bez rizika hypoglykémií a zároveň redukují hmotnost. Ve vývoji je řada dalších léků, které budou moci být aplikovány i v delších časových intervalech – např. po 1–2 týdnech (podrobně v 14).
Zatím málo pozornosti bylo věnováno problematice vztahu inkretinového principu k ovlivnění kostního metabolismu.
Na světovém diabetologickém kongresu v Montrealu v říjnu 2009 zaznělo několik přednášet na téma inkretinů a kosti. Stručně lze shrnout: Inkretiny působí na kostní metabolismus přímo i nepřímo. GLP-1, GLP-2 a peptid YY - působí na osteoblasty a jejich apoptóza klesá, GIP působí jak osteoresorbci, tak ovlivňuje i tvorbu kosti přímým působením na osteoblasty. Exogenní podání GIP zvýší kostní denzitu, zvířata mají vyšší přežívání a vyšší kostní hmotu. Podání liraglutidu zvyšuje sekreci calcitoninu v C-buňkách štítné žlázy s maximem v 10. hodině, ale u primátů neindukuje proliferaci C-buněk. Vztah k medulárnímu karcinomu a proliferaci C‑buněk štítné žlázy prokázaný u hlodavců (15) tak není pravděpodobně přítomen u primátů a u člověka. Nedávno byly tyto efekty liraglutidu diskutovány na stránkách N Engl J Med (16). Je pravděpodobné, že liraglutid bude schválen pro užití i v USA.
Již starší práce (17) ukázaly, že kostní receptor pro GLP-1 je klíčový pro udržování kvalitní kostní hmoty. Myši s knockoutem tohoto receptoru ztrácely kostní hmotu a byly rezistentní k léčbě GLP-1 analogy. Z příbuzných a klinicky užívaných látek pankreatický peptid amylin nemění kostní denzitu (18).
Již dnes lze říci, že efekty inkretinových analog na kost vyžadují další podrobnější výzkum a nelze vyloučit, že v této oblasti bude vyvinut i lék pozitivně ovlivňující kostní denzitu. O působení jiných léků ovlivňujících inkretinový systém – DPP-4 inhibitorů (tzv. gliptinů) na kost je zatím málo známo, pravděpodobně kostní metabolismus neovlivňují.
Závěr
Stále více autorů se zabývá problematikou kostního zdraví u diabetu (bone health in diabetes). Dnes je třeba věnovat pozornost zejména ženám užívajícím thiazolidindiony, kde je mírně zvýšené riziko kostních fraktur. Zároveň platí, že inzulínová léčba, léčba sulfonylureou a metforminem ovlivňují stav kosti pozitivně. Celkově však platí, že problematika kostní je u diabetu stále velmi málo probádána. Nevíme, zda diabetická osteopatie existuje a neumíme definovat diabetika ohroženého více úbytkem kosti a vznikem fraktur. Určitě platí, že léčba diabetu novými antidiabetiky, tzv. inkretinovými analogy, může přinést ještě mnoho zajímavého i pro výzkum patofyziologie kosti i pro léčbu osteoporózy.
Adresa pro korespondenci:
prof. MUDr. Štěpán Svačina, DrSc.
III. interní klinika 1. LF UK a VFN
U Nemocnice 1, 128 08 Praha 2
e-mail: svacinas@lf1.cuni.cz
Sources
1. Fisman EZ, Tenenbaum A. (eds.) Cardivascular diabetology. Advances in kardiology vo. 45. Basel: Karger 2008.
2. Pickup JC, Williams G. (eds.) Textbook of diabetes. Blackwell 2004; kap. 61.10.
3. Adami S. Bone health in diabetes: considerations for clinical management. Curr Med Res Opin 2009; 25(5): 1057–1072.
4. Strotmeyer ES, et al. Nontraumatic fracture risk with diabetes mellitus and impaired fasting glucose in older white and black adults: the health, aging, and body composition study. Arch Intern Med 2005; 165(14): 1612–1617.
5. Strotmeyer ES, et al. Diabetes is associated independently of body composition with BMD and bone volume in older white and black men and women: The Health, Aging, and Body Composition Study. J Bone Miner Res 2004; 19(7): 1084–1091.
6. Fantuzzi G, Mazzone Th. (eds.) Adipose tissue in health and disease. Totowa: Humana Press 2007.
7. Palička V. Léky ovlivňující kostní metabolismus u diabetiků. Vnitr Lek 2009; 55(4): 368–370.
8. Gao Y, Li Y, Xue J, Jia Y, Hu J. Effect of the anti-diabetic drug metformin on bone mass in ovariectomized rats. Eur J Pharmacol 2010; 19. E-pub.
9. Kahn SE, et al. Rosiglitazone-associated fractures in type 2 diabetes: an Analysis from A Diabetes Outcome Progression Trial (ADOPT). Diabetes Care 2008; 31(5): 845–851.
10. Zinman B, et al: Effect of rosiglitazone, metformin, and glyburide on bone biomarkers in patients with type 2 diabetes. J Clin Endocrinol Metab 2010; 95(1): 134–142.
11. Douglas IJ, Evans SJ, Pocock S, Smeeth L. The risk of fractures associated with thiazolidinediones: a self-controlled case-series study. PLoS Med 2009; 6(9): e1000154.
12. Meier C, et al. Use of thiazolidinediones and fracture risk. Arch Intern Med 2008; 168(8): 820–825.
13. Jones SG, Momin SR, Good MW, Shea TK, Patric K. Distal upper and lower limb fractures associated with thiazolidinedione use. Am J Manag Care 2009; 15(8): 491–496.
14. Haluzík M, Svačina Š. Inkretinová léčba diabetu. Praha: Mladá fronta 2010.
15. Bjerre Knudsen L, et al. Glucagon-like Peptide-1 receptor agonists activate rodent thyroid C-cells causing calcitonin release and C-cell proliferation. Endocrinology 2010; 151(4): 1473–1486.
16. Parks M, Rosebraugh C. Weighing risks and benefits of liraglutide – the FDA‘s review of a new antidiabetic therapy. N Engl J Med 2010; 362(9): 774–777.
17. Yamada C, et al. The murine glucagon-like peptide-1 receptor is essential for control of bone resorption. Endocrinology 2008; 149(2): 574–579.
18. Borm AK. The effect of pramlintide (amylin analogue) treatment on bone metabolism and bone density in patients with type 1 diabetes mellitus. Horm Metab Res 1999; 31(8): 472–475.
Labels
Addictology Allergology and clinical immunology Angiology Audiology Clinical biochemistry Dermatology & STDs Paediatric gastroenterology Paediatric surgery Paediatric cardiology Paediatric neurology Paediatric ENT Paediatric psychiatry Paediatric rheumatology Diabetology Pharmacy Vascular surgery Pain management Dental Hygienist
Article was published inJournal of Czech Physicians

-
All articles in this issue
- Neurinom akustiku – vestibulární schwannom – osobní pohled na nejmodernější postupy v jeho léčbě
- Diabetes mellitus 2. typu jako subklinický zánět
- Diabetes mellitus, antidiabetika a kost
- Kalcitonin a jeho úloha v regulaci kalciofosfátového metabolismu
- Betablokátory v toku času – pohled anesteziologa a intenzivisty
- Karcinom pankreatu – naše zkušenosti se vztahem k diabetes mellitus
- Katétrová infekce vyvolaná Mycobacterium bovis
- Journal of Czech Physicians
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Neurinom akustiku – vestibulární schwannom – osobní pohled na nejmodernější postupy v jeho léčbě
- Kalcitonin a jeho úloha v regulaci kalciofosfátového metabolismu
- Betablokátory v toku času – pohled anesteziologa a intenzivisty
- Diabetes mellitus 2. typu jako subklinický zánět
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

