-
Medical journals
- Career
Vyšetření kondenzátu vydechovaného vzduchu u cystické fibrózy
: Libor Fila; Jaromír Musil
: Univerzita Karlova v Praze, 2. lékařská fakulta, Pneumologická klinika FN Motol
: Čas. Lék. čes. 2010; 149: 173-177
Vyšetření kondenzátu vydechovaného vzduchu v současnosti patří u řady plicních chorob k experimentálním metodám, kde se podílí na studiu patofyziologie onemocnění a je hodnocen přínos k diagnostice a k monitorování odpovědi na léčebné zásahy. U cystické fibrózy byla v kondenzátu vydechovaného vzduchu studována řada biomarkerů zánětu a oxidačního stresu. Za perspektivní se jeví vyšetření pH kondenzátu vydechovaného vzduchu jako biomarkeru zánětlivé acidifikace dýchacích cest, včetně hodnocení odpovědi na antibiotickou léčbu plicní exacerbace, a to vzhledem k možnosti prakticky okamžitě dostupného výsledku. Z dalších biomarkerů jde především o 8-isoprostan a 3-nitrotyrozin jako markery oxidačního stresu, u nichž je navíc prokazována negativní korelace s plicními funkcemi, a leukotrien B4 jako marker neutrofilního zánětu. Mezi vhodné biomarkery oxidačního stresu u cystické fibrózy na rozdíl od jiných plicních chorob nepatří peroxid vodíku, a to vzhledem k přítomnosti glutationperoxidázy a redukovaných tiolů nacházených ve sputu nemocných s cystickou fibrózou v nadbytku. Stejně tak u cystické fibrózy selhaly pokusy detekovat v kondenzátu vydechovaného vzduchu bakteriální DNA. Přes uvedené pokroky však vyšetření kondenzátu vydechovaného vzduchu zůstává výzkumnou metodou a nenašlo dosud uplatnění v klinické praxi.
Klíčová slova:
cystická fibróza, kondenzát vydechovaného vzduchu, patofyziologie, diagnostika, léčba.Úvod
Cystická fibróza (CF) je vrozené onemocnění vyvolané mutacemi genu pro transmembránový regulátor vodivosti (CFTR). Dysfunkce CFTR vede k poruše mukociliární clearance, chronické bakteriální infekci a neutrofilnímu zánětu dýchacích cest s rozvojem bronchiektazií a obstrukční ventilační poruchy (1). Na patogenezi CF se podílí rovněž porucha metabolismu oxidu dusnatého (NO) a polynenasycených mastných kyselin (PUFA) (2, 3).
Hodnotit tíži plicního postižení je možné řadou metod lišících se mírou invazivity. K neinvazivním metodám patří vyšetřování biomarkerů ve vydechovaném vzduchu a v kondenzátu vydechovaného vzduchu (KVV) (4). Potenciál využití vyšetření KVV u CF je v možnosti studovat patofyziologii nemoci, v hodnocení tíže zánětu a oxidačního stresu, v diagnostice (diferenciální diagnostika chronických plicních chorob, přítomnost plicních exacerbací) a v monitorování odpovědi na léčebné zásahy (5, 6). Přehled biomarkerů studovaných u CF je uveden v tabulce 1.
1. Přehled biomarkerů vyšetřovaných v kondenzátu vydechovaného vzduchu u cystické fibrózy (dle 6) 
Objem, iontové složení a pH kondenzátu vydechovaného vzduchu u Cystické fibrózy
U pacientů s CF je produkce KVV vyšší než u kontrol – 6,1 vs. 5,3 ml/h. (p < 0,02). KVV u nemocných s CF obsahuje signifikantně více kalia – 15,3 vs. 3,0 μmol/l (p < 0,05) a zinku – 3,2 vs. 1,7 μmol/l (p < 0,02). Nesignifikantně vyšší jsou koncentrace natria – 26,9 vs. 14,1 μmol/l, kalcia – 13,1 vs. 6,5 μmol/l, a chloridů – 24,2 vs. 16,8 μmol/l (7).
Intenzivně byla studována problematika pH KVV. Stanovení pH v KVV je možné dvojím způsobem, a to jednak s využitím deaerace, jednak bez ní. Deaerace znamená odstranění plynných komponent (především o CO2 a NH3) ze vzorku KVV bezprostředně po odběru za pomoci probublávání argonem. To umožňuje delší skladování vzorku beze změny pH. Pokud není deaerace použita, je žádoucí vyšetření v co nejkratší době. V posledních letech je doporučováno deaeraci využívat (8). Vzhledem k možnosti vyšetření pH bezprostředně po odběru KVV jde o jeden z mála biomarkerů, jejichž výsledek je dostupný prakticky okamžitě.
U CF je prokazováno ve stabilní fázi nemoci pokles pH oproti kontrolám. Bez využití dearace jde o hodnoty 5,88 vs. 6,15 (p < 0,02), 5,77 vs. 6,08 (p < 0,01), resp. 5,48 vs. 6,11 (p = 0,01) (9–11), s využitím deaerace pak 7,23 vs. 7,85 (p < 0,001) (12). V období plicní exacerbace pH KVV dále klesá, bez využití deaerace na hodnoty 5,32 vs. 5,88 (p = 0,001), resp. 5,30 vs. 5,77 (p < 0,02) (9, 10), s využitím deaerace pak na 7,12 vs. 7,31 (p < 0,0001) (12). Po antibiotické léčbě plicní exacerbace lze prokázat vzestup pH KVV – 5,71 vs. 5,27 (p < 0,05) (9), stejně tak dochází k vzestupu pH KVV po léčbě inhalačními kortikoidy ve stabilní fázi nemoci – 6,17 vs. 5,48 (p < 0,01) (11).
Pokles pH KVV je u CF dán jednak zánětlivou acidifikací periciliární tekutiny, jednak poruchou transportu bikarbonátů při dysfunkci CFTR. Zánětlivá acidifikace periciliární tekutiny má za následek další snížení aktivity ciliárních buněk a antibakteriálních defenzinů a rovněž další zvýšení viskozity hlenu a vazby bakterií na mucin. Tím se podílí na patogenezi plicního postižení u CF (9).
Metabolity NO v kondenzátu vydechovaného vzduchu u Cystické fibrózy
Nemocní s CF mají podobně jako nemocní s primární ciliární dyskinezí nižší obsah NO ve vydechovaném vzduchu (FeNO). Nižší FeNO je u CF z důvodu nižší produkce, vyššího oxidativního metabolismu vlivem zánětu a rovněž vlivem bakteriálních reduktáz u nemocných kolonizovaných Pseudomonas aeruginosa. Vzhledem k biologickým úlohám NO v dýchacím ústrojí (stimulace mukociliární clearance, bronchodilatace, antibakteriální účinky a inhibice epiteliálního natriového kanálu) tak porucha metabolismu NO ovlivňuje patogenezi plicního onemocnění u CF (2).
V KVV byly u CF studovány tyto metabolity NO: nitrity, nitráty, 3-nitrotyrozin (NO-Tyr) a nitrozotioly (R-SNO). Koncentrace NO2- v KVV u CF ve stabilní fázi plicního onemocnění jsou ve srovnání s kontrolami vyšší nebo stejné – 1,46 vs. 0,45 μmol/l (p < 0,01), resp. 3,9 vs. 3,2 μmol/l (p > 0,05) (13, 14). Naproti tomu jsou koncentrace NO3- oproti kontrolám snížené – 4,2 vs. 16,0 μmol/l (p < 0,01), resp. 7,3 vs. 39,5 μmol/l (p < 0,001) (7, 11). Během léčby inhalačním kortikoidy ve stabilní fázi plicního onemocnění se koncentrace NO3- v KVV signifikantně zvyšuje – 20,9 vs. 7,3 μmol/l (p < 0,05) (11). Koncentrace NO-Tyr v KVV je u CF ve stabilní fázi vyšší oproti kontrolám – 25,3 vs. 6,3 ng/ml (p < 0,0001), negativně koreluje s hodnotou usilovně vydechnutého objemu na první sekundu (FEV1), r = -0,70 (p < 0,0001) a léčba inhalačními kortikoidy na ni nemá vliv – 25,5 vs. 24,2 ng/ml (p > 0,05) (13). Stejně tak jsou zvýšené koncentrace R-SNO – 0,35 vs. 0,11 μmol/l (p < 0,01) (14).
Při hodnocení uvedených nálezů je třeba vzít v potaz dvě pro CF důležité skutečnosti. Jednak bakteriální kolonizaci horních cest dýchacích (především orofaryngu) a její příspěvek ke koncentraci NO2- v KVV (15), jednak retenci NO a jeho metabolitů v sekretech dolních cest dýchacích (16). To alespoň z části vysvětluje vyšší koncentrace NO2- v KVV u CF, na nichž se kromě oxidace NO podílí i redukce NO3- bakteriálními reduktázami. Ty jsou odpovědné za redukci NO a jeho metabolitů až na amoniak, jehož obsah ve sputu pacientů s kolonizací P. aeruginosa je zvýšený (ve formě amonného kationu) (17). NO-Tyr je produktem reakce peroxinitritu (vzniklého reakcí NO a superoxidu) a tyrozinových zbytků v peptidech. Je tak jedním z markerů oxidačního stresu, který je více vyjádřen v pokročilejších stadiích plicního onemocnění a jeho negativní korelace s hodnotu FEV1 je tak v souladu s naopak pozitivní korelací FeNO a hodnoty FEV1, r = 0,64 (p < 0,02) (10). Rovněž zvýšené koncentrace R-SNO svědčí spíše proti výrazněji snížené produkci NO a podílí se na nich pravděpodobně i zvýšený obsah redukovaných tiolů v respiračních sekretech nemocných s CF (18).
Metabolity kyseliny arachidonové v kondenzátu vydechovaného vzduchu u Cystické fibrózy
Z metabolitů kyseliny arachidonové (ARA) byly v KVV u CF studovány zejména 8-izoprostan (IP), leukotrien (LT) B4 a prostaglandin (PG) E2.
Koncentrace 8-IP je u stabilní fáze CF vyšší oproti kontrolám – 42,7 vs. 15,2 pg/ml (p < 0,01), resp. 30,5 vs. 15,5 pg/ml (p < 0,001) (19, 20), negativně koreluje s hodnotou FEV1, r = ‑0,61 (p < 0,01) (19) a dále stoupá při plicní exacerbaci – 47,5 vs. 30,5 pg/ml (p < 0,001) (20). 8-IP je produktem neenzymatické oxidace ARA, a slouží tak jako biomarker oxidačního stresu. Negativní korelace s hodnotou FEV1 je analogická korelaci uvedené výše u NO-Tyr.
Koncentrace LTB4 jsou u stabilní fáze CF vyšší ve srovnání s kontrolami – 35,9 vs. 6,8 pg/ml (p < 0,0001), negativně korelují s pH KVV, r = -0,5 (p < 0,01), a dále stoupají při plicní exacerbaci – 47,8 vs. 24,2 pg/ml (p < 0,001) (12). Ve stabilní fázi CF jsou pak koncentrace LTB4 vyšší u nemocných s kolonizací P. aeruginosa než bez ní – 34,3 vs. 18,3 pg/ml (p < 0,01) a v případě plicní exacerbace klesají po antibiotické léčbě – 31,1 vs. 18,8 pg/ml (p < 0,01) (21). LTB4 je jako důležitý chemotaktický mediátor neutrofilních leukocytů u CF pochopitelně v popředí zájmu. Probíhají studie s cílem zmírnit projevy onemocnění pomocí suplementace n-3 PUFA jako prekurzory biologicky méně aktivního LTB5. Podávání n-3 kyseliny eikosapentaenové a kyseliny dokosahexaenové (PUFA) v dávce odpovídající 1,3 % kalorického příjmu po dobu šesti týdnů vedlo k nesignifikantnímu poklesu koncentrace LTB4 v KVV – 120,5 vs. 173,0 pg/ml, provázenému vzestupem pH KVV – 6,32 vs. 6,08 (p < 0,05), avšak bez ovlivnění plicních funkcí a systémových zánětlivých parametrů (22).
Rovněž koncentrace PGE2 je u stabilní fáze CF vyšší oproti kontrolám – 72,0 vs. 41,0 pg/ml (p < 0,001) a dále stoupá při plicní exacerbaci – 83,0 vs. 72,0 (p < 0,001) (20). PGE2 je u CF využíván jako marker zánětlivé aktivace cyklooxygenázy.
Cytokiny v kondenzátu vydechovaného vzduchu u Cystické fibrózy
Studovány byly především interleukin (IL) 8 a IL-6 a dále interferon (IFN) γ. Koncentrace IL-8 v KVV je u stabilní CF oproti kontrolám vyšší – 0,45 vs. 0,34 pg/ml (p < 0,05), navíc je vyšší u kolonizovaných P. aeruginosa než u nemocných bez kolonizace tímto patogenem – 0,73 vs. 0,45 pg/ml (p < 0,05) a pozitivně koreluje s koncentrací LTB4, r = 0,40 (p < 0,05) (23). IL-8 je stejně jako LTB4 důležitý chemotaktický mediátor neutrofilů, proto je jejich vzájemná korelace pochopitelná, a IL 8 může být rovněž zodpovědný za neuspokojivé výsledky léčby n-3 PUFA u CF.
Obdobně jako u IL-8 je i u IL-6 koncentrace vyšší u stabilní CF v KVV ve srovnání s kontrolami – 8,7 vs. 2,6 pg/ml (p < 0,0001) a u nemocných s kolonizací P. aeruginosa oproti nekolonizovaným – 9,3 vs. 6,9 pg/ml (p < 0,01). Po antibiotické léčbě plicní exacerbace koncentrace IL-6 klesá – 6,4 vs. 9,5 pg/ml (p < 0,01) (21). Koncentrace IFN-γ v KVV je u stabilní CF vyšší ve srovnání s kontrolami – 3,3 vs. 2,2 pg/ml (p < 0,05) a současné vyšetření koncentrací IFN-γ, IP a NO2- v KVV určuje diagnózu CF se 78% senzitivitou, 83% specificitou a AUC 0,906 (p < 0,001) (24). IL-6 i IFN-γ (jako jeden z markerů TH1 imunitní odpovědi) jsou prozánětlivé cytokiny a jejich zvýšení odráží lokální zánětlivou aktivitu v dolních cestách dýchacích, u kolonizovaných P. aeruginosa navíc i vyšší prozánětlivý potenciál tohoto patogenu (při vyšetření IL-6 a IL-8).
Purinové deriváty v kondenzátu vydechovaného vzduchu u Cystické fibrózy
Mezi purinové deriváty vyšetřované v KVV u CF patří adenosin (Ado), adenosinmonofosfát (AMP) a adenosintrifosfát (ATP). Koncentrace ATP v KVV je u stabilní CF vyšší než u kontrol (p < 0,05) a klesá při antibiotické léčbě plicní exacerbace (p < 0,02). V tekutině získané bronchoalveolární laváží korelují koncentrace ATP i AMP pozitivně se zastoupením neutrofilních granulocytů a dále negativně korelují poměry koncentrací ATP/Ado i AMP/Ado s hodnotou FEV1 (25). Poměr koncentrací AMP/urea v KVV je u stabilní CF vyšší než u kontrol – 1,3 vs. 0,75 (p < 0,05), kdežto zvýšení poměru koncentrací Ado/urea v KVV u stabilní CF oproti kontrolám – 1,0 vs. 0,4 statistické významnosti nedosahuje (p > 0,05). Po antibiotické léčbě plicní exacerbace byla zjištěna negativní korelace mezi vzestupem FEV1 a změnou poměrů koncentrací AMP/urea, r = -0,53 (p < 0,01) i Ado/urea, r = -0,55 (p < 0,01) v KVV (26). V této práci byla urea využívána jako marker diluce KVV.
Význam purinergní signalizace u nemocných CF se týká jednak zvýšení mukociliární clearance (vazba ATP na nukleotidový P2Y2 receptor), jednak chemotaxe neutrofilních granulocytů (vazba Ado na adenosinový A3 receptor).
Ostatní biomarkery v kondenzátu vydechovaného vzduchu u Cystické fibrózy
Z dalších biomarkerů byly v KVV u CF vyšetřovány H2O2, matrixová metaloproteináza (MMP) 9, tkáňový inhibitor metaloproteináz (TIMP) 1 a rovněž kyselina deoxyribonukleová (DNA).
H2O2 je dalším z biomarkerů oxidačního stresu v KVV a lze jej v současnosti stanovovat v KVV on-line pomocí přístroje ECoCheck (VIASYS Healthcare GmbH, SRN). U stabilní CF však nejsou koncentrace H2O2 v KVV oproti kontrolám zvýšené – 0,97 vs. 1,11 μmol/l (p > 0,05) (27), nicméně při antibiotické léčbě plicní exacerbace klesají – 0,12 vs. 0,28 mol/l (p < 0,01) (28). Důvodem pro obdobné koncentrace H2O2 v KVV u stabilní CF jako u kontrol jsou antioxidační vlastnosti sekretů dolních dýchacích cest nemocných s CF, a to vzhledem k dostatečnému množství redukovaných tiolů a glutationperoxidázy (18). H2O2 tak není vhodným biomarkerem oxidačního stresu u CF.
Nejnovější výzkumy se týkají MMP-9 v KVV u stabilní CF, kde jsou hladiny vyšší než u kontrol – 48,9 vs. 30,0 ng/ml (p < 0,05). Hodnoty MMP-9 u nemocných s bronchiektaziemi různého původu (při CF i z dalších příčin) negativně korelují s hodnotou FEV1, r = -0,79 (p < 0,001). Hodnoty TIMP-1 v KVV se u nemocných s CF a kontrol signifikantně nelišily (23,2 vs. 20,1 ng/ml) (29). Autoři této práce považují vyšetření MMP-9 v KVV za potenciální marker tkáňového poškození dýchacích cest u nemocných s bronchiektaziemi.
Dále byla snaha zjišťovat patogeny v dolních dýchacích cestách nemocných s CF pomocí detekce jejich DNA v KVV. Na rozdíl od nemocných s bronchogenním karcinomem, kde lze v KVV detekovat mutace onkogenů (30), nebyla snaha detekovat DNA P. aeruginosa a Burkholderia cepacia pomocí polymerázové řetězové reakce úspěšná. U nemocných, kteří neodkašlávají, je tak nutno využívat invazivnější metody (indukované sputum nebo bronchoskopie) k získávání materiálu z dolních cest dýchacích (31).
Závěr
Přehled nálezů při vyšetření jednotlivých biomarkerů KVV ve vztahu k CF je uveden v tabulce 2.
2. Přehled nálezů u jednotlivých biomarkerů v kondenzátu vydechovaného vzduchu u cystické fibrózy 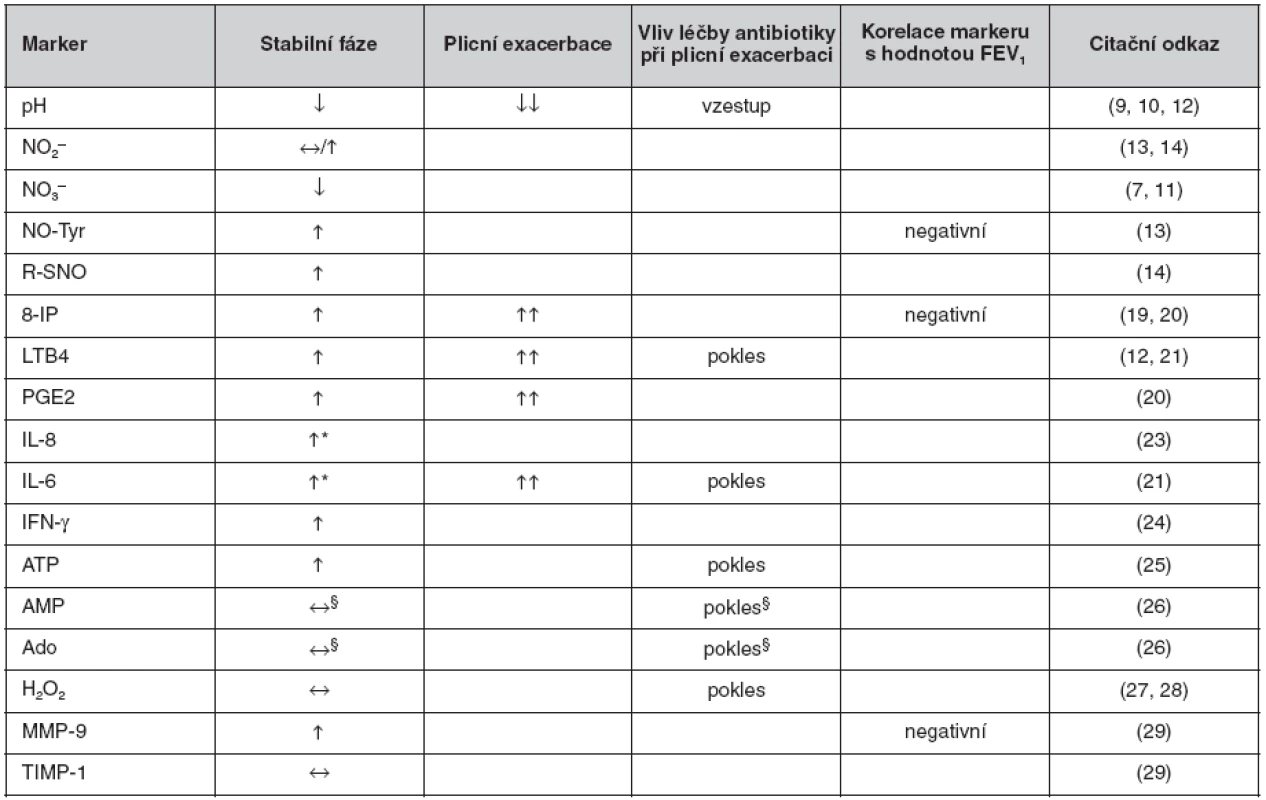
*vyšší u stabilní CF s kolonizací P. aeruginosa oproti nekolonizovaným. §poměr koncentrací AMP a urey, resp. Ado a urey. Ve srovnání s kontrolami: ↔ beze změny, ↓ nižší, ↑ vyšší. Ve srovnání se stabilní fází: ↓↓ nižší, ↑↑ vyšší. Zkratky: viz seznam zkratek Za nejperspektivnější lze pro klinické využití u CF považovat vyšetření pH KVV jako ukazatele zánětlivé acidifikace dolních cest dýchacích vzhledem k okamžité dostupnosti výsledku, např. ke kontrole účinnosti antibiotické léčby plicní exacerbace. Z dalších biomarkerů lze za perspektivní považovat 8-IP a NO-Tyr jako markery oxidačního stresu (v obou případech s prokázanými korelacemi s plicními funkcemi) a LTB4 jako marker zánětu, avšak s výsledky dostupnými s různě velkým časovým odstupem. V současnosti tedy zůstává vyšetření KVV u CF experimentálním postupem. Množství poznatků získaných díky vyšetření KVV u CF však narůstá, podobně jako je tomu i u dalších chronických plicních chorob, např. bronchiálního astmatu či chronické obstrukční plicní nemoci, u kterých již byly přehledové články v české odborné literatuře publikovány (32).
Zkratky
- Ado – adenosin
- AMP – adenosinmonofosfát
- ARA – kyselina arachidonová
- ATP – adenosintrifosfát
- CF – cystická fibróza
- CFTR – transmembránový regulátor vodivosti
- DNA – kyselina deoxyribonukleová
- FEV1 – usilovně vydechnutý objem za první sekundu
- FeNO – koncentrace oxidu dusnatého ve vydechovaném vzduchu
- IFN – interferon
- IL – interleukin
- IP – izoprostan
- KVV – kondenzát vydechovaného vzduchu
- LT – leukotrien
- MMP – matrixová metaloproteináza
- NO-Tyr – 3-nitrotyrozin
- PG – prostaglandin
- PUFA – polynenasycené mastné kyseliny
- R-SNO – nitrózotioly
- TIMP – tkáňový inhibitor metaloproteináz
Adresa pro korespondenci:
MUDr. Libor Fila
Pneumologická klinika 2. LF UK a FN Motol
V Úvalu 84, 150 06 Praha 5
fax: +420 224 436 620, e-mail: libor_fila@seznam.cz
Sources
1. Boucher RC. New concepts of the pathogenesis of cystic fibrosis lung disease. Eur Respir J 2004; 23 : 146–158.
2. de Winter-de Groot KM, van der Ent CK. Nitric oxide in cystic fibrosis. J Cyst Fibros 2005; 4 (Suppl 2): 25–29.
3. Freedman SD, Blanco PG, Zaman MM, et al. Association of cystic fibrosis with abnormalities in fatty acid metabolism. N Engl J Med 2004; 350 : 560–569.
4. Kharitonov SA, Barnes PJ. Exhaled markers of pulmonary disease. Am J Respir Crit Care Med 2001; 163 : 1693–1722.
5. Srbová M, Wilhelm J. Markery obsažené ve vydechovaném vzduchu při plicních onemocněních. Čas Lék čes 2003; 142 : 140–143.
6. Montuschi P. Analysis of exhaled breath condensate in respiratory medicine: methodological aspects and potential clinical applications. Ther Adv Respir Dis 2007; 1 : 5–23.
7. Griese M, Noss J, Schramel P. Elemental and ion composition of exhaled air condensate in cystic fibrosis. J Cyst Fibros 2003; 2 : 136–142.
8. Horváth I, Hunt J, Barnes PJ, et al. ATS/ERS Task Force on Exhaled Breath Condensate. Exhaled breath condensate: methodological recommendations and unresolved questions. Eur Respir J 2005; 26 : 523–548.
9. Tate S, MacGregor G, Davis M, et al. Airways in cystic fibrosis are acidified: detection by exhaled breath condensate. Thorax 2002; 57 : 926–929.
10. Ojoo JC, Mulrennan SA, Kastelik JA, et al. Exhaled breath condensate pH and exhaled nitric oxide in allergic asthma and in cystic fibrosis. Thorax 2005; 60 : 22–26.
11. Fila L, Musil J, Valentová Bartáková L, et al. Vliv terapie inhalačními kortikosteroidy na složení kondenzátu vydechovaného vzduchu u nemocných s cystickou fibrózou. Stud Pneumol Phthiseol 2008; 68 : 6–9.
12. Carpagnano GE, Barnes PJ, Francis J, et al. Breath condensate pH in children with cystic fibrosis and asthma: a new noninvasive marker of airway inflammation? Chest 2004; 125 : 2005–2010.
13. Balint B, Kharitonov SA, Hanazawa T, et al. Increased nitrotyrosine in exhaled breath condensate in cystic fibrosis. Eur Respir J 2001; 17 : 1201–1207.
14. Corradi M, Montuschi P, Donnelly LE, et al. Increased nitrosothiols in exhaled breath condensate in inflammatory airway diseases. Am J Respir Crit Care Med 2001; 163 : 854–858.
15. Marteus H, Tornberg DC, Weitzberg E, et al. Origin of nitrite and nitrate in nasal and exhaled breath condensate and relation to nitric oxide formation. Thorax 2005; 60 : 219–225.
16. Grasemann H, Ioannidis I, Tomkiewicz RP, et al. Nitric oxide metabolites in cystic fibrosis lung disease. Arch Dis Child 1998; 78 : 49–53.
17. Gaston B, Ratjen F, Vaughan JW, et al. Nitrogen redox balance in the cystic fibrosis airway: effects of antipseudomonal therapy. Am J Respir Crit Care Med 2002; 165 : 387–390.
18. Dauletbaev N, Rickmann J, Viel K, et al. Antioxidant properties of cystic fibrosis sputum. Am J Physiol Lung Cell Mol Physiol 2005; 288: L903–L909.
19. Montuschi P, Kharitonov SA, Ciabattoni G, et al. Exhaled 8-isoprostane as a new non-invasive biomarker of oxidative stress in cystic fibrosis. Thorax 2000; 55 : 205–209.
20. Lucidi V, Ciabattoni G, Bella S, et al. Exhaled 8-isoprostane and prostaglandin E(2) in patients with stable and unstable cystic fibrosis. Free Radic Biol Med 2008; 45 : 913–919.
21. Carpagnano GE, Barnes PJ, Geddes DM, et al. Increased leukotriene B4 and interleukin-6 in exhaled breath condensate in cystic fibrosis. Am J Respir Crit Care Med 2003; 167 : 1109–1112.
22. Fila L, Brázová J, Musil J. Vliv suplementace n-3 polynenasycenými mastnými kyselinami na složení kondenzátu vydechovaného vzduchu u nemocných s cystickou fibrózou. Stud Pneumol Phtiseol 2009; 69 : 216–220.
23. Bodini A, D’Orazio C, Peroni D, et al. Biomarkers of neutrophilic inflammation in exhaled air of cystic fibrosis children with bacterial airway infections. Pediatr Pulmonol 2005; 40 : 494–499.
24. Robroeks CM, Rosias PP, van Vliet D, et al. Biomarkers in exhaled breath condensate indicate presence and severity of cystic fibrosis in children. Pediatr Allergy Immunol 2008; 19 : 652–659.
25. Esther CR, Alexis NE, Clas ML, et al. Extracellular Purines are Biomarkers of Neutrophilic Airway Inflammation. Eur Respir J 2008; 31 : 949–956.
26. Esther CR Jr, Boysen G, Olsen BM, et al. Mass spectrometric analysis of biomarkers and dilution markers in exhaled breath condensate reveals elevated purines in asthma and cystic fibrosis. Am J Physiol Lung Cell Mol Physiol 2009; 296: L987–L993.
27. Worlitzsch D, Herberth G, Ulrich M, et al. Catalase, myeloperoxidase and hydrogen peroxide in cystic fibrosis. Eur Respir J 1998; 11 : 377–383.
28. Jöbsis Q, Raatgeep HC, Schellekens SL, et al. Hydrogen peroxide and nitric oxide in exhaled air of children with cystic fibrosis during antibiotic treatment. Eur Respir J 2000; 16 : 95–100.
29. Karakoc GB, Inal A, Yilmaz M, et al. Exhaled breath condensate MMP-9 levels in children with bronchiectasis. Pediatr Pulmonol 2009; 44 : 1010–1016.
30. Gessner C, Kuhn H, Toepfer K, et al. Detection of p53 gene mutations in exhaled breath condensate of non-small cell lung cancer patients. Lung Cancer 2004; 43 : 215–222.
31. Vogelberg C, Hirsch T, Rosen-Wolff A, et al. Pseudomonas aeruginosa and Burkholderia cepacia cannot be detected by PCR in the breath condensate of patients with cystic fibrosis. Pediatr Pulmonol 2003; 36 : 348–352.
32. Čáp P, Pehal F. Vyšetření kondenzátu vydechovaného vzduchu u nemocných s astmatem a chronickou obstrukční plicní nemocí. Čas Lék čes 2004; 143 : 742–746.
Labels
Addictology Allergology and clinical immunology Angiology Audiology Clinical biochemistry Dermatology & STDs Paediatric gastroenterology Paediatric surgery Paediatric cardiology Paediatric neurology Paediatric ENT Paediatric psychiatry Paediatric rheumatology Diabetology Pharmacy Vascular surgery Pain management Dental Hygienist
Article was published inJournal of Czech Physicians

-
All articles in this issue
- Adipose tissue blood flow and metabolic syndrome
- Plasma citrulline concentration – a reliable noninvasive marker of functional enterocyte mass
- Inflammatory bowel disease and pregnancy
- Examination of exhaled breath condensate in cystic fibrosis
- Cancer multiplicities in the Czech population
- Toxoplasmosis of the central nervous systems after allogeneic stem cell transplantation
- Concept of nicotine dependence treatment in Mayo Clinic, USA
- Journal of Czech Physicians
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Plasma citrulline concentration – a reliable noninvasive marker of functional enterocyte mass
- Inflammatory bowel disease and pregnancy
- Cancer multiplicities in the Czech population
- Examination of exhaled breath condensate in cystic fibrosis
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

