-
Medical journals
- Career
Kvalita spermatu plzeňských vysokoškolských studentů
Authors: P. Hušáková; Z. Ulčová-Gallová; K. Bibková; Z. Mičanová
Authors‘ workplace: Gynekologicko-porodnická klinika LF UK a FN, Plzeň
Published in: Čas. Lék. čes. 2008; 147: 85-88
Category: Original Article
Overview
Východisko.
Zhoršování kvality spermatu představuje problém pro lidskou populaci. Jednou z možností hodnocení plodnosti u mužů je hodnocení parametrů spermiogramu. Cílem bylo sledování spermiogramu a imunologických vlastností ejakulátu našich vysokoškoláků.Metody a výsledky.
Základní hodnocení vzorků získaných od 110 vysokoškoláků bylo prováděno podle kritérií Světové zdravotnické organizace. Průkaz přítomnosti spermaglutinačních protilátek jsme prováděli pomocí přímého mixed-antiglobulin-reaction-testu pro IgG a IgA. K detekci intraakrozomálních proteinů jsme použili monoklonální protilátky a následnou sekundární imunofluorescenci. Anamnestická data jsme získali cíleným dotazníkem. Normozoospermie byla zjištěna u 72 %, oligozoospermie ve 14 %, astenozoospermie v 5 %, teratozoospermie ve 4 % a oligoastenozoospermie v 5 % případů. Na 5% hladině významnosti jsme nepotvrdili negativní vliv nikotinismu, užívání drog, nošení těsného prádla, horkých koupelí a saunování na kvalitu spermatu. Ve skupině s patologickým spermiogramem významné procento studentů konzumuje více jak dvakrát týdně konzervované či kořeněné potraviny oproti skupině s normálním spermiogramem. Fyziologické nálezy intraakrozomálních proteinů jsme nalezli u 75 % normospermatiků a u 43 % patologických spermiogramů. Výskyt spermaglutinačních protilátek byl nevýznamný.Závěry.
Na kvalitě spermatu se podílí celá řada vnitřních i vnějších faktorů. Náhodně vybraná skupina našich vysokoškolských studentů měla lepší parametry ejakulátu, než jsme původně očekávali.Klíčová slova:
kvalita spermatu, ejakulát, spermiogram.Současné zhoršování kvality ejakulátu, dané nejen poklesem koncentrace spermií, ale i zvyšujícím se podílem morfologických abnormalit spermií a vznikem imunopatologických reakcí, znesnadňuje fertilizační proces, koreluje s plodností dnešních mužů, a představuje tak významný problém pro lidskou populaci. Mužský faktor je zodpovědný za 40–50 % infertilit párů (1–5). Vnitřní příčiny mužské snížené plodnosti se rozlišují jako pretestikulární (ageneze varlat, Klinefelterův syndrom, hypogonadotropní hypogonadismus), testikulární (oboustranný kryptorchismus, varikokéla, Sertoli-cell-only syndrom) a posttestikulární (obstrukční azoospermie, zánětlivá onemocnění, anatomické malformace genitálu vrozené a poúrazové, poruchy ejakulace – retrográdní ejakulace, přítomnost antispermatických protilátek) (6). Dále ke snížené plodnosti přispívají některé exogenní vlivy, stresový či ekologický faktor (zhoršující se kvalita životního prostředí) (4, 7–9), ale zřejmě i spotřeba kávy, alkoholu, tabákových výrobků, drog a léků. Například studie sledující vliv žvýkání tabáku na kvalitu spermatu u indiánů ukázala významnou asociaci se snížením kvality spermatu (10). Kouření cigaret, ale i vysoké koncentrace přízemního ozónu v atmosféře mohou spustit zánětlivou reakci v mužském genitálním traktu, či umožnit vznik cirkulujících toxických látek a zapříčinit tak snížení koncentrace spermií v ejakulátu (5). Negativně ovlivňují spermiogenezi rovněž různé fyzikální faktory z okolí (radioaktivní, elektromagnetické, tepelné záření) či konzumace potravin upravených konzervačními látkami nebo obsahující estrogeny. Zcela nedávné studie upozorňují, že elektromagnetické vlnění emitované mobilními telefony může u mužů snižovat fertilizační potenciál (3, 11–14).
KOHORTA
Vysokoškoláky jsme oslovili prostřednictvím inzerátů rozmístěných ve veřejných prostorách plzeňských fakult (zastoupení jednotlivých univerzit) (graf 1). Podmínkou účasti na studii byl věk do 30 let, dodržení třídenní sexuální abstinence před odběrem a dobrý zdravotní stav, tj. bez akutního infekčního onemocnění v době odběru.
Graph 1. Zastoupení univerzit ve studijní skupině 
Po podepsání informovaného souhlasu jsme od studentů průměrného věku 23 (20–29) let získali 110 vzorků ejakulátu, u nichž byl hodnocen spermiogram, přítomnost spermaglutinačních protilátek a intraakrosomálních proteinů.
POUŽITÉ METODY
Administrativní část zahrnovala podepsání informovaného souhlasu a vyplnění cíleného dotazníku, který posloužil jako zdroj anamnestických dat (obsahoval i dotazy ohledně kouření, užívání drog, konzumace kávy, alkoholu, konzervovaných a kořeněných potravin, nošení těsného prádla, koupání v horké lázni, saunování, frekvence pohlavních styků, typ používané antikoncepce, počet sexuálních partnerek (partnerů) ke dni odběru).
Vzorky byly odebírány masturbací do čistých širokohrdlých nádobek. Základní hodnocení spermiogramu jsme provedli po 30 minutovém zkapalnění ejakulátů podle kritérií Světové zdravotnické organizace (WHO) – objem a viskozita ejakulátu, koncentrace spermií, kvalita pohybu spermií dle McLeoda, procento pohyblivých spermií, hodnocení morfologie spermií.
Spermaglutinační protilátky v semenné plazmě jsme prokazovali pomocí přímého komerčního MAR-testu (přímý smíšený antiimunoglobulinový test) pro IgG a IgA (FertiPro). V přítomnosti protilátek proti spermiím dochází ke vzniku pohyblivých shluků spermií a latexových partikulí, které jsme sledovali pod inverzním mikroskopem (zvětšení 200×). Aglutinace, na jejichž vzniku se podílelo více než 50 % spermií, jsme hodnotili jako pozitivní.
Podstatou imunodetekce intraakrozomálních proteinů je specifická reakce monoklonální protilátky Hs 8, Hs 14 nebo Hs 36 k daným antigenům (proteinům) a akrozomu lidské spermie; 20 μl spermií získaných swim-up-ouvou metodou se rozetře na podložní sklo. Po zaschnutí při pokojové teplotě se fixuje 10 minut acetonem, následně promývá fosfátovým pufrem (PBS) a inkubuje s monoklonálními protilátkami (Hs 8, Hs 14, Hs 36), původně připravenými v Ústavu molekulární genetiky Akademie věd České republiky (15–18), inkubovány 45 min při 37 °C (protilátky byly naředěny v PBS na koncentraci imunoglobulinu 20 μg/ml). Po promytí v PBS jsou roztěry buněk inkubovány (45 min, 37 °C) se sekundární protilátkou značenou fluorescein izothiocyanátem. Vzorky jsou pak montovány do Vectashieldu H-1200 a hodnoceny pod imunofluorescenčním mikroskopem. Hodnotili jsme procento imunofluorescenčně označených spermií (17, 18).
VÝSLEDKY
Normozoospermie byla zjištěna u 72 %, oligozoospermie ve 14 %, astenozoospermie v 5 %, teratozoospermie ve 4 % a oligoastenozoospermie v 5 % případů (graf 2).
Graph 2. Typy spermiogramů a jejich podíl na celkovém množství hodnocených vzorků 
Průměrné hodnoty souboru (objem 3 ml; koncentrace spermií 57,6 mil./ml; celkové množství spermií v ejakulátu 176,24 mil.) odpovídaly normálním hodnotám dle WHO (tab. 1).
Table 1. Výsledné hodnoty základních parametrů spermiogramu 
Dobrou motilitu spermií vykazovalo 90 % vzorků. Nálezy spermaglutinačních protilátek v izotypu IgA ve 4 případech byly nevýznamné, v izotypu IgG se jednalo o 3 záchyty, z toho 2 významné (60 % H-H : aglutinace hlavička k hlavičce, 50 % T-T: aglutinace bičík k bičíku).
Fyziologické hodnoty intraakrozomálních proteinů byly nalezeny u 75 % normospermatiků a u 43 % patologických spermiogramů (tab. 2). Vzorek byl hodnocen jako pozitivní při označení nejméně 90 % spermií.
Table 2. Výsledky hodnocení přítomnosti intraakrozomálních proteinů 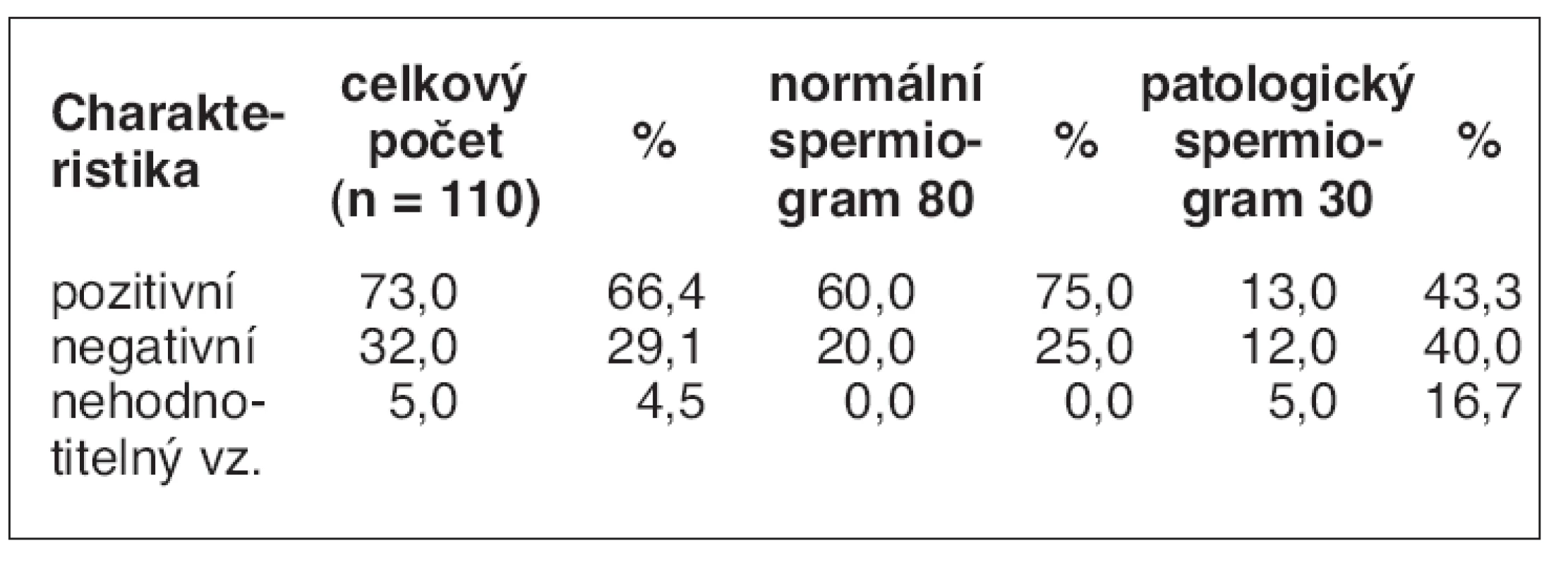
Na 5% hladině významnosti jsme nepotvrdili negativní vliv nikotinismu, užívání drog, nošení těsného prádla (navzdory všeobecně rozšířenému názoru), horkých koupelí a saunování na kvalitu spermatu. Ve skupině s patologickým spermiogramem bylo zjištěno mírně vyšší procento sportujících a také pijících denně kávu a alkohol a výrazně vyšší procento studentů konzumujících více než dvakrát týdně konzervované či kořeněné potraviny oproti skupině s normálním spermiogramem (tab. 3).
Table 3. Procentuální zastoupení studentů s různými anamnestickými faktory ve skupině s normálním a patologickým spermiogramem P udává závislost faktoru na typu spermiogramu, hodnoty P < 5 jsou statisticky významné. 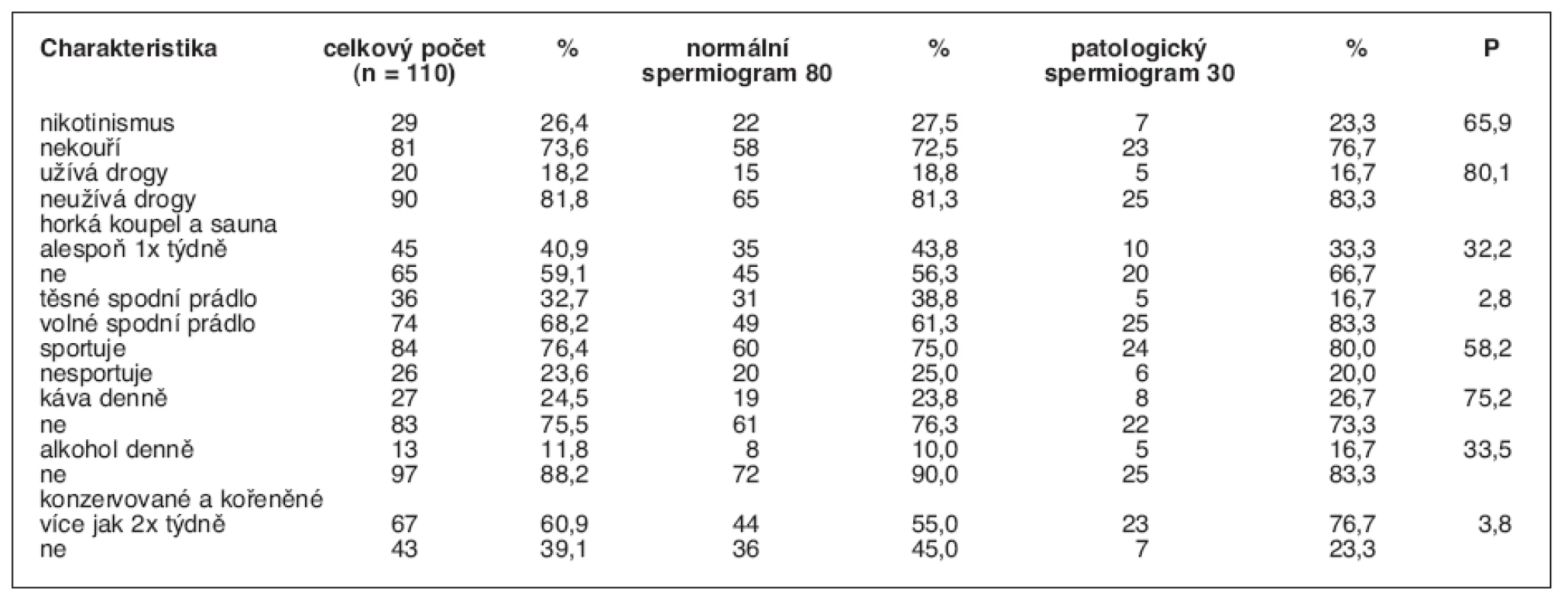
Prezervativ při každém styku používá jen 12 % studentů, 55 % jen někdy a 33 % nikdy (graf 3).
Graph 3. Používání prezervativu při souloži 
Průměrný počet sexuálních partnerek (partnerů) byl 5,3 (0–37). 64% respondentů uvádělo nepravidelnou frekvenci pohlavních styků, 1× za 2–3 dny 33 % a každodenní 3 % (graf 4).
Graph 4. Frekvence pohlavních styků 
DISKUZE A ZÁVĚR
Možností jak hodnotit mužskou fertilitu je mimo jiné sledování parametrů spermiogramu, především koncentrace spermií v ejakulátu (referenční hodnoty dle WHO > 20 mil./ml, přesto se nedá tvrdit, že nižší hodnoty znamenají neplodnost (19)), jejich motility (pokud 50 % a více spermií vykazuje pohyb stupně 1–2, nebo 25 % pohyb stupně 3–4) a morfologie (> 30 % spermií s normální morfologií je hodnoceno jako normální) (20), vyšetřování důležitých proteinů v akrozomu spermie (1, 15–18) a sledování spermaglutinačních protilátek v lidském ejakulátu (klinicky významné jsou při shluknutí více než 50 % spermií (20)).
Mezi další důležité markery snížené kvality spermatu a poškození spermií patří imunogennost seminální plazmy a povrchových spermiových antigenů a nepřítomnost akrozomálních proteinů (1). Sledování protilátek proti spermiím a detekce intraakrozomálních proteinů se tak stávají dalšími významnými ukazateli mužské plodnosti.
Nedávná dánská studie (21) ukázala náhodný vztah mezi zvýšenou frekvencí snížené plodnosti otců a hypospadie u jejich synů v porovnání spermiologických parametrů fertilních zdravých otců a zdravých synů. Na počtu 64 otců synů s hypospadií autoři prokázali nejen zvýšenou četnost hypospadie, ale i sníženou kvalitu ejakulátu. Otcové i synové zřejmě sdílejí společný gen pro reprodukční dysfunkce, ale autoři současně nevylučují i účast četných zevních faktorů.
Také vliv automaticky zahřívaných sedadel v moderních vozech silně ovlivňuje skrotální teplotu (22), která jako stresový faktor může negativně ovlivňovat kvalitu spermií především při dlouhých jízdách.
Na kvalitě spermatu se podílí celá řada vnitřních i vnějších faktorů. Náhodně vybraná skupina našich vysokoškolských studentů měla lepší parametry ejakulátu, než jsme původně očekávali. Pozitivní průkaz intraakrozomálních proteinů u 75,0 % normospermatiků oproti pozitivitě u 43,3 % vzorků ze skupiny s patologickým spermiogramem potvrzuje užitečnost použití monoklonálních protilátek k určení stavu akrozomu, potažmo kvality spermií, čehož bylo již využito u pacientů v IVF programu (15). V neposlední řadě studie umožnila náhled do sexuálního života studentů. Snažili jsme se najít souvislost mezi laboratorními výsledky a zjištěnými anamnestickými daty.
Zkratky
MAR-test – Mixed-Antiglobulin-Reaction-Test
PBS – Phosphate Buffered Saline
WHO – Světová zdravotnická organizace (World Health Organization)
Práce byla podpořena grantem MSM 002 162 0812.
doc. MUDr. Zdenka Ulčová-Gallová, DrSc.
Gynekologicko-porodnická klinika LF UK a FN
Alej svobody 80, 304 02 Plzeň–Lochotín
fax: +420 377 617 290, e-mail: ulcova@fnplzen.cz
Sources
1. Pavlásek, J., Pěknicová J., Ulčová-Gallová Z. et al.: Significance of the acrosome reaction and sperm agglutinating antibodies in human semen. Čes. Gyn., 2004, 69, s. 306–311.
2. Baker, H. W. G, Burger, H. G., DeKretser, D. M.: Relative incidence of etiologic disorders in male infertility. Male Sexual Dysfunction, 1995, 4, s. 341–352.
3. Kilgallon, S. J., Simmons, L. W.: Image content influences men’s semen quality. Biology Letters, 2005, 1, s. 253–255.
4. Sharp, R. M., Skakkebaek, N. E.: Are oestrogens involved in falling sperm counts and disorders of the male reproductive tract? Lancet, 1993, 341, s. 1392–1395.
5. Tillett, T.: Sperm Alert Environmental. Health Perspectives, 2006, 114, s. 2–3.
6. Hora, M.: Urologie pro studenty všeobecného lékařství. Praha, Karolinum, 2004, s. 103.
7. Carlsen, E., Jorgen, H. P., Anderson, A. M., Niels, E. S.: Effects of ejaculatory frequency and season on variations in semen quality. Fertil Steril., 2004, 82, s. 358–366.
8. Moline, J., Golden, A., Bar-Chama, N. et al.: Exposure to hazardous substances and male reproductive health: a research framework. Environ Health Perspect, 2000, 108, s. 803–813.
9. Safe, S.: Endocrine Disrupters and Human Health. Is there a problem? An update. Environ. Health Perspect, 2000, 108, s. 487–493.
10. Said, T. M.: Fertility Weekly, 2005, 3, s. 5-6.
11. Davoudi, M., Brossner, C., Kuber, W.: The influence of electromagnetic waves on sperm motility. Journal fiir Urologie und Urogynäkologie, 2002, 19, s. 18–22.
12. Erogul, O., Oztas, E., Yildirim, I. et al.: Effects of electromagnelic radiation from a cellular phone on human sperm motility; an in vitro study. Archive of Medical Research, 2006, 37, s. 843.
13. Fejes, I., Zavaczki, Z., Sollosi, J.: Is there a relationship between cell phone use and semen quality? Archives of Andrology, 2005, 51, s. 385–393.
14. Deepinder, F., Makker, K., Agarwal, A.: Cell phones and male infertility: dissecting the relationship, Reprod Biomed Online, 2007, 15, s. 266–270.
15. Capkova, J., Geussova, G., Peknicova, J.: Monoclonal antibody to human sperm acrosomal protein. Folia Biol., 2000, 46, s. 55–57.
16. Peknicova, J., Capkova, J., Geussova, G. et al.: Monoclonal antibodies to intra-acrosomal proteins inhibit gamete binding. Theriogenology, 2001, 56, s. 211–223.
17. Peknicova, J., Moos, J.: Monoclonal antibodies against boar acrosomal antigens labeling undamaged acrosomes of spermatozoa in immunofluorescence test. Andrologia, 1990, 22, s. 427–435.
18. Peknicova, J., Moos, J., Mollova, M. et al.: Changes in immunochemical localization of acrosomal and sperm proteins in boar spermatozoa in during capacitation and induced acrosome reaction. Anim. Reprod. Sci., 1994, 35, s. 255–271.
19. Nelson, C. M., Bunge, R. G.: Semen analysis: evidence for changing parameters of male fertility potential. Fertil Steril., 1974, 25, s. 503–507.
20. WHO (World Health Organization): WHO Laboratory Manual for the Examination of Human Semen and Sperm-Cervical Mucus Interaction. 4th ed. Cambridge, 2000.
21. Asklund, C., JŅrgensen, N., Skakkebĺk, N. E., Jensen, T. K.: Increased frequency of reproductive health problems among fathers of boys with hypospadias. Hum. Reprod., 2007, 22, s. 2639–2646.
22. Jung, A., Strauss, P., Lindner, H. J., Schuppe, H. C.: Influence of heating car seats on scrotal temperature. Fertil. Steril., 2007, 2, s. 125–129.
Labels
Addictology Allergology and clinical immunology Angiology Audiology Clinical biochemistry Dermatology & STDs Paediatric gastroenterology Paediatric surgery Paediatric cardiology Paediatric neurology Paediatric ENT Paediatric psychiatry Paediatric rheumatology Diabetology Pharmacy Vascular surgery Pain management Dental Hygienist
Article was published inJournal of Czech Physicians

-
All articles in this issue
- Zkušenosti s podáváním časné enterální výživy kriticky nemocným na jednotce intenzivní metabolické péče
- Je současný rozsah vyšetření dárců krve dostatečný? Onemocnění zhoubným nádorem u aktivních dárců krve
- Jaký je výskyt zhoubných nádorů mezi bývalými dárci krve?
- Metabolický syndrom a deprese – klinické vztahy
- Metabolické účinky endokanabinoidního systému
- Kvalita spermatu plzeňských vysokoškolských studentů
- Mozgový natriuretický peptid môže predikovať zmenu geometrie srdca u detí s chronickou obličkovou chorobou
- Tracheální intubace bez podání svalového relaxancia – vliv odlišných dávek sufentanilu na kvalitu intubačních podmínek: prospektivní studie
- Komplikace v oblasti kapsy kardiostimulátoru
- Journal of Czech Physicians
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Jaký je výskyt zhoubných nádorů mezi bývalými dárci krve?
- Komplikace v oblasti kapsy kardiostimulátoru
- Tracheální intubace bez podání svalového relaxancia – vliv odlišných dávek sufentanilu na kvalitu intubačních podmínek: prospektivní studie
- Je současný rozsah vyšetření dárců krve dostatečný? Onemocnění zhoubným nádorem u aktivních dárců krve
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

