-
Medical journals
- Career
Akutní infekce u pacientů po transplantaci ledviny
Authors: Zdeněk Lys 1,3; Klára Dombrovská 1; Jarmila Dědochová 1; Petra Kovářová 2; Ivo Valkovský 1,3; Jan Václavík 1,3
Authors‘ workplace: Interní a kardiologická klinika, FN Ostrava 1; Krevní centrum, FN Ostrava 2; Lékařská fakulta, Ostravská univerzita 3
Published in: Vnitř Lék 2022; 68(E-3): 12-17
Category: Review Articles
Overview
Imunosuprimovaní pacienti po transplantaci ledviny mají vysoké riziko infekčních komplikací. V této skupině pacientů se vyskytuje celá řada infekcí virové, bakteriální nebo mykotické etiologie včetně oportunních nákaz, ale za vysokou mortalitu jsou zodpovědné především infekce bakteriální. Z bakteriálních infekcí jsou nejčastější infekce močových cest a pneumonie, které mnohdy vyžadují hospitalizaci a přechodnou redukci imunosupresivní terapie, a to vždy po konzultaci transplantačního centra. Kromě symptomů daných lokalizací infekce se často vyskytuje horečka. Specifikem pacientů po transplantaci ledviny je diferenciální diagnostika horečky a/nebo vysoké zánětlivé aktivity. Kromě infekčních příčin zvažujeme polékovou horečku, rejekční epizodu, relaps systémového onemocnění nebo u pacientů se selháním funkce štěpu v dialyzační léčbě graft intolerance syndrom („symptomatický štěp“). Záchrana života pacienta, která mnohdy vyžaduje významnou redukci imunosupresivní terapie, má vždy přednost před zabráněním rejekční epizody. Nedílnou součástí péče o transplantované pacienty je prevence infekcí, včetně doporučení očkování tam, kde je to možné.
Klíčová slova:
antibiotiká – imunosuprese – transplantace ledviny – rejekce – akutní infekce
Úvod
Transplantace ledviny je optimální variantou náhrady funkce ledvin u pacientů s chronickým nezvratným renálním selháním a je spojena jak s lepším přežíváním, tak s vyšší kvalitou života v porovnání s pacienty v chronickém dialyzačním programu (1, 2).
V České republice (ČR) proběhne kolem 500 transplantací ledviny za rok. V roce 2019 bylo ve všech transplantačních centrech 510 transplantací ledviny a také v letech 2020 a 2021, které byly významně ovlivněny pandemií covidu-19 (Coronavirus disease 2019), byla transplantace ledviny provedena u 443, respektive u 449 pacientů (3). V ČR je řádově několik tisíc pacientů s funkčním ledvinným transplantátem (štěpem) a další skupina pacientů se selháním funkce štěpu, který však v těle zůstává, a tito pacienti, minimálně v začátku náhrady funkce ledvin, často nadále užívají imunosupresivní terapii. Narůstá také počet pacientů po transplantacích dalších solidních orgánů (játra, srdce, plíce, pankreas, tenko střevo), u kterých jsou rizika a management zvládání infekčních komplikací podobný. Péče o transplantované pacienty je vysoce specializovaná a je soustředěna především do transplantačních center.
U pacientů po transplantaci ledviny dochází k celé řadě komplikací. Jedná se o komplikace chirurgické (infekce operační rány, problémy s hojením rány, stenózy a trombózy cévních anastomóz nebo ureterocystoanastomózy, lymfokéla) a komplikace interního charakteru (rejekční epizody, rekurence základního renálního onemocnění do štěpu, kardiovaskulární příhody, potransplantační diabetes mellitus, hypertenze, dyslipidemie, maligní onemocnění, nežádoucí účinky imunosupresivní terapie a další) (4).
Významnou a relativně častou problematikou imunosuprimovaných pacientů, včetně pacientů po orgánových transplantacích, jsou infekční komplikace. Analýza dat více než 140 000 pacientů z amerických registrů ukázala kumulativní incidenci infekčních komplikací 36,9 % ve 3 měsících, 53,1 % v jednom roce a 78,0 % v 5 letech od transplantace ledviny (5). Přes zlepšující se přežívání pacientů po transplantaci ledviny v posledních dekádách a narůstající významnost onkologických onemocnění jsou infekční komplikace stále po kardiovaskulárních příhodách druhou nejčastější příčinou smrti v krátkodobém i dlouhodobém horizontu (6–8). Pacienti, u kterých dojde k infekční epizodě, mají v dalším období signifikantně vyšší mortalitu a také vyšší riziko selhání funkce transplantátu než pacienti u kterých infekce nebyla zaznamenána (5). Ve skupině pacientů po transplantaci ledviny se vyskytuje celá řada infekcí různé etiologie a závažnosti. Specifikem jsou oportunní infekce jako CMV (cytomegalovirus) infekce, polyomavirová (BK) infekce, pneumocystová pneumonie, mykotické infekce včetně aspergilózy nebo mukormykóz a řada dalších. Za vysokou mortalitu asociovanou s infekčními komplikacemi jsou však zodpovědné dominantně bakteriální infekce (9).
Tato práce podává základní informace o běžných bakteriálních infekcích u pacientů po transplantaci ledviny, jejich diagnostice, léčbě, prevenci, diferenciální diagnostice, a také základní pohled na přístup k imunosupresivní terapii v době akutní infekce pro lékaře pracující mimo transplantační centra.
Přehled infekcí u pacienta po transplantaci ledviny
Pacienti po transplantaci ledviny jsou díky imunosupresivní terapii ve zvýšeném riziku infekčních komplikací (10, 11). Toto riziko trvá po celou dobu užívání imunosuprese, avšak nejvyšší je v prvních týdnech a měsících po transplantaci, kdy míra útlumu imunitního systému je nejvyšší z důvodu vysokého rizika rejekční epizody. Vysoké riziko infekčních komplikací je taktéž v období antirejekční léčby, a to především při terapii rezistentní akutní protilátkami mediované rejekce, kdy se používá i řada biologických látek (rituximab, alemtuzumab, eculizumab). Zapomínat nesmíme ani na pacienta s nedávným selháním transplantátu, který již zahájil náhradu funkce ledvin. V případě, že nepodstoupil odstranění transplantované ledviny (graftektomii), užívá často nadále menší dávku imunoupresivního preparátu (většinou kortikoidy a/nebo tacrolimus) pro riziko trvající rejekční epizody nebo tzv. GIS syndromu (Graft Intolerance Syndrome) (12). U nás pro tento syndrom běžněji používáme termín „symptomatický štěp “. Stejně jako u jiných imunosuprimovaných pacientů se vyskytují běžné infekce bakteriální, virové nebo mykotické, ale nutno je pomýšlet i na celou řadu možných oportunních infekcí, a to především při netypických projevech nebo nedostatečné reakci na iniciální léčbu (4).
Kromě lokalizace nebo původce infekčního onemocnění z praktického hlediska infekce u pacientů po transplantaci ledviny dělíme dle doby od transplantace (Tab. 1) (4). Infekce v prvních 4 týdnech mohou být přeneseny od dárce, infekce operační rány, reaktivace preexistující infekce u příjemce nebo infekce nosokomiální. V období mezi 1. a 12. měsícem po transplantaci se objevuje reaktivace latentních infekcí (CMV infekce), oportunní infekce a po prvním roce pak dominují infekce komunitní, které se pochopitelně mohou vyskytnout kdykoli po transplantaci. Z hlediska lokalizace infekce se jedná o infekce močových cest (IMC), respiračního traktu, gastrointestinální infekce, neuroinfekce, katétrové infekce a infekce operační rány. V dalším textu se budeme zabývat především komunitními bakteriálními infekcemi.
Table 1. Přehled infekcí po transplantaci ledviny dle doby od transplantace, upraveno podle (10) 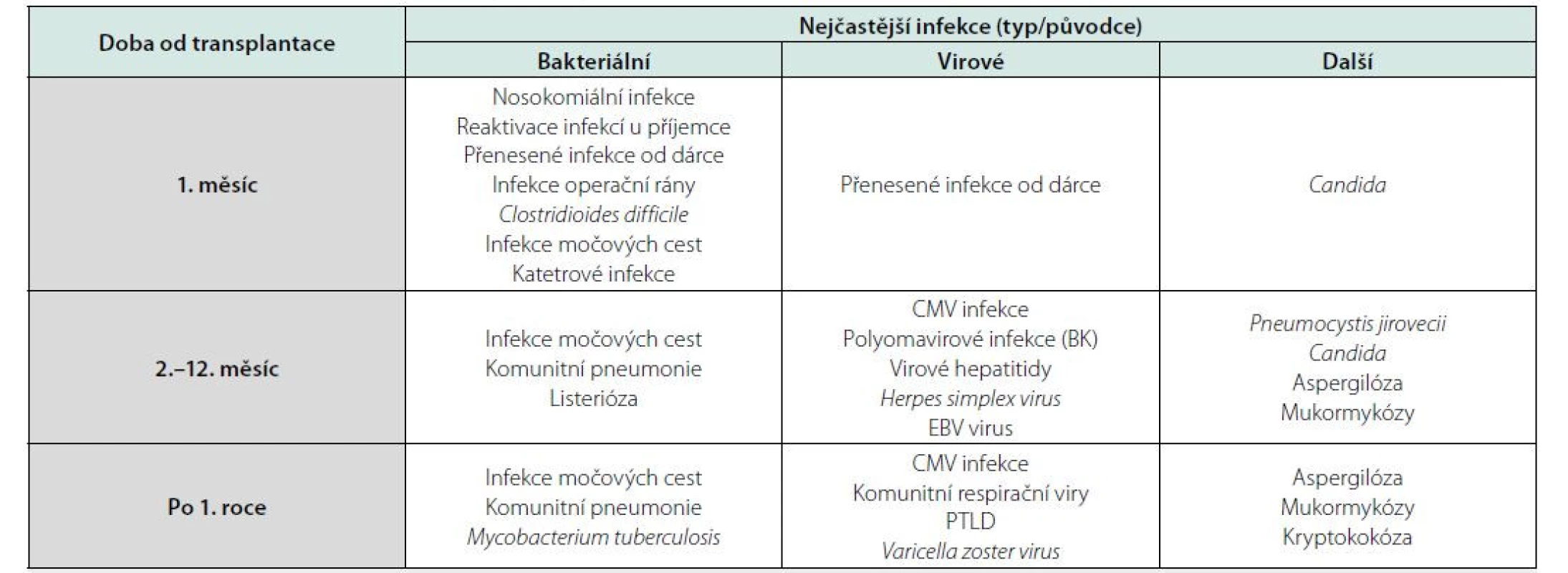
CMV – cytomegalovirus, EBV – virus Ebsteina-Barrové, PTLD – postransplant lymfoproliferative disorder Klinický obraz a diagnostika
Velká část infekcí se projevu klinicky i laboratorně obdobně jako u pacientů imunokompetentních. U imunosuprimovaných pacientů se častěji vyskytuje průběh s mírnějšími projevy a následně rychlá deteriorace stavu. U pacientů užívajících mykofenolát nebo azathioprin je dokumentovaná nižší teplota a leukocytóza než u osob bez imunosupresivní léčby (13). Z praktického hlediska nelze každého pacienta se zdánlivě nezávažnou infekcí v obavách z rychlé deteriorace stavu raději hospitalizovat, ale je nutné podrobnější vyšetření, častější sledování pacienta a jeho poučení pro případ horšení stavu. Konkrétní symptomy závisí především na lokalizaci infekce.
V případě souběžného zhoršení funkce transplantované ledviny k pacientovi přistupujeme obdobně jako při AKI (Acute Kidney Injury) vlastních ledvin. Nutno je vyloučit postrenální příčinu (sonografie štěpu) a myslet na častou prerenální etiologii (vhodné kromě základních vitálních funkcí také vyhodnocení volemie) (14). Specifikem transplantovaného pacienta je možná souběžná rejekční epizoda nebo nefrotoxicita kalcineurinových inhibitorů (tacrolimus, cyclosporin), ke které dochází v situaci již zahájené antibiotické terapie některými preparáty s významnou lékovou interakcí (makrolidová antibiotika kromě azithromycinu, fluconazol atd.) (15). V rámci diferenciální diagnostiky je potřeba myslet i na léky indukovanou akutní TIN (tubulointersticiální nefritida), která může být způsobena samotnou antibiotickou léčbou a v některých situacích může vyžadovat i provedení biopsie a nasazení terapie kortikoidy (16).
V oblasti diagnostiky je žádoucí jak odhalení původce infekce (přímá kultivace, PCR –polymerase chain reaction detekce, nepřímé metody jako serologické vyšetření nebo stanovení antigenů příslušných patogenů například v moči), tak zjištění lokalizace infekce. Kromě standardních ukazatelů zánětu využíváme PCT (prokalcitonin) k diagnostice bakteriální etiologie stavu, beta‑D - glukan a galaktomannan v séru jako pomůcku k diagnostice některých mykotických infekcí, respektive aspergilózy (17). Myslet je potřeba stále na možné oportunní patogeny, včetně nebezpečných invazivních mykotických infekcí (mukormykózy, kryptokokózy), které často vyžadující cílenou detekci (PCR stanovení atp.) (18, 19)
Diferenciální diagnostika
Diferenciální diagnostika se odvíjí od konkrétní situace pacienta, jeho projevů a vstupních nálezů klinického a paraklinických vyšetření. Většinou se jedná o pacienta s horečkou a/nebo zvýšenými parametry zánětu. Kromě všech infekčních příčin musíme myslet i na možné neinfekční příčiny:
1. Relaps/rekurence základního onemocnění. Celá řada renálních onemocnění může rekurovat do štěpu a v ojedinělých případech může dojít i transferu primární glomerulonefritidy od dárce ledviny. Nejčastěji z primárních glomerulonefritid rekuruje IgA nefropatie. Primární glomerulonefritidy se většinou projeví nefritickým či nefrotickým syndromem a problémy se zhoršující se renální funkcí. Teploty a vysoká zánětlivá aktivita mohou být přítomny v případě systémových onemocnění. Jedná se o pacienty se SLE (systémový lupus erytematodes), ANCA asociovanou vaskulitidou, především anti‑PR3 (anti‑proteináza 3) pozitivní, anti‑GBM (Glomerular Basement Membrane) nemoc, nebo primární HUS (hemolyticko‑uremický syndrom) (4, 20). Trombotické mikroangiopatie se mohou vyvinout i v potransplantačním období a v některých případech za ně může být zodpovědna, kromě infekcí, také imunosuresivní terapie CIN (kalcineurinové blokátory - nejčastěji tacrolimus).
2. Rejekce transplantované ledviny. K rejekční epizodě může dojít kdykoli po transplantaci ledviny. Specifické projevy nejsou přítomny a zvýšená teplota v kombinaci se zhoršením funkce štěpu může signalizovat rejekci. K rejekci muže dojít i u pacienta se selháním funkce štěpu.
3. Nádorové onemocnění. Pacienti po transplantaci ledviny mají v dlouhodobém horizontu zvýšené riziko maligních nádorových onemocnění, která mohou být doprovázena zvýšenou teplotou (21).
4. Poléková horečka. Opomíjenou příčinou teplot jsou samotné léky, které pacientům podáváme. Celá řada medikamentů včetně například beta‑laktamových antibiotik může způsobit teploty. Pomýšlet na tuto příčinu musíme především při souběžných kožních změnách, artralgiích a myalgiích.
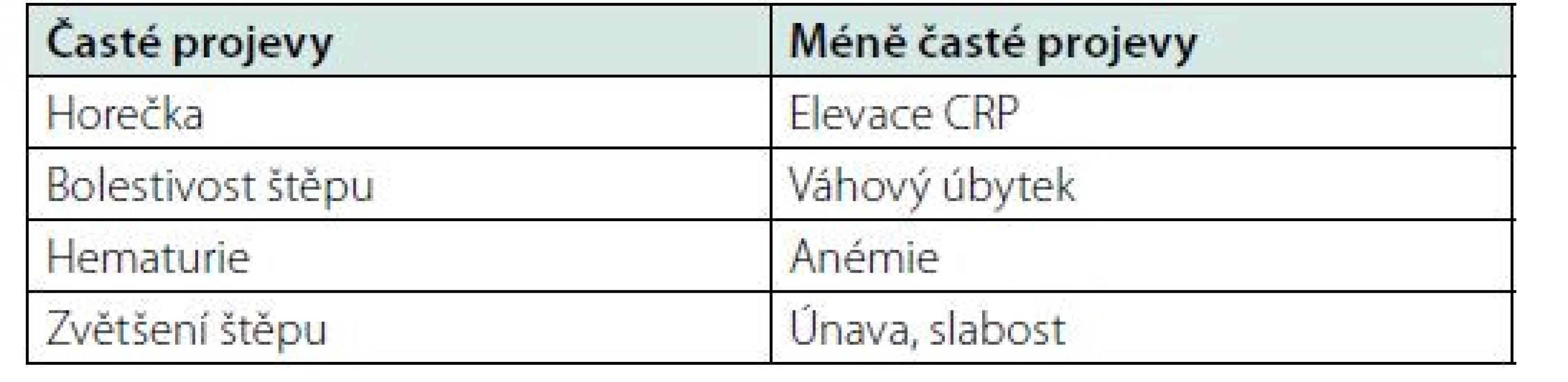
5. GIS (Graft Intolerance Syndrom) – „symptomatický štěp“. Pacienti v prvním roce dialyzační léčby po selhání funkce transplantované ledviny mají dle některých prací vyšší mortalitu. Příčina není zcela jasná, ale pravděpodobně jde o kombinaci vlivu pokračující imunosuprese, malignit a také vliv metabolických a kardiovaskulárních faktorů (12). Redukce nebo vysazení imunosupresivní léčby může vést k rejekční epizodě nebo k chronickému, imunitně podmíněnému prozánětlivému stavu nazývanému GIS („symptomatický štěp“). Tento syndrom se projevuje často horečkou, zvýšenou citlivostí v místě štěpu, v případě reziduální diurézy hematurií, elevací zánětlivých faktorů, anemizací atp (Tab. 2). Pulzní léčba kortikosteroidy a úprava následné imunosupresivní terapie je někdy potřebná. Při selhání konzervativní léčby a trvání symptomů se zvažuje odstranění transplantátu (graftektomie).
6. Další. Je možná celá řada jiných příčin teploty jako v běžné populaci. Jednat se může o tromboembolickou nemoc (pozor na paraneoplastickou etiologii), adrenokortikální insuficienci, cévní mozkové příhody a akutní koronární syndromy, dnu, akutní pankreatitidu, cholecystitidu, relativně časté posttransfuzní reakce a další.
Obecné zásady léčby bakteriálních infekcí
Léčba bakteriální infekce u transplantovaného pacienta se řídí obecnými zásadami. Po odběru vzorků ke kultivačnímu vyšetření podáváme empiricky antiinfektiva dle lokalizace a předpokládaného původce infekce a také podpůrná léčba a léčba případných komplikací je v zásadě stejná.
Při prvním kontaktu s pacientem je nutné zjistit, zda součástí chronické medikace jsou kortikosteroidy a případně podat dávku kortikoidů navíc z důvodu rizika život ohrožující akutní adrenokortikální nedostatečnosti, projevující se například hypotenzí a teplotou.
V antiinfekční léčbě nám může pomoci znalost recentních kultivačních nálezů, a to především kultivace moči, která se provádí rutinně při pravidelných kontrolách v transplantačním centru. Obecně léčíme antiinfektivy s ohledem na typ a předpokládaného původce infekce. Pokud je alterována funkce štěpu (AKI), s výhodou je měření hladin antibiotik tam, kde je to možné (včetně hladiny piperacilinu, meropenemu, některých cefalosporinů a samozřejmě aminoglykosidů nebo vankomycinu) s nastavením optimálního dávkování a zamezení nebezpečného poddávkování léčiva. Pokud je v medikaci ponechán tacrolimus nebo cyclosporin, zvažujeme i možné interakce a antiinfekční terapie buď změníme, nebo můžeme upravit dávkování imunosupresiva a sledovat v dalším průběhu hladiny imunosuprese.
Imunosupresivní léčba v době akutní infekce
Vždy při akutní infekci je nutno rozhodnout o podávání imunosupresivní terapie. Standardní udržovací imunosuprese sestává z kombinace kortikoidu, CIN (obvykle tacrolimus) a antiproliferační látky (nejčastěji mykofenolát) (Tab. 3). Jednoznačný recept na vedení imunosuprese v době akutní infekce neexistuje, ale platí, že život pacienta má vždy přednost před případnou záchranou transplantované ledviny. Při rozhodování je potřeba zvážit závažnost infekce a stav pacienta, dobu od transplantace a riziko rejekce (pacient 15 let po první transplantaci vs. pacient měsíc po 3. transplantaci ledviny). Ponechat imunosupresivní terapii lze u nezávažných infekcí s předpokladem dobré reakce na antiinfekční terapii, především u pacientů ve vysokém riziku rejekční epizody (relativně nedávno provedená transplantace, již proběhlá rejekční epizoda atp.). Naopak u pacientů v závažném stavu neváháme a imunosupresivní terapii vysazujeme téměř úplně. I u těchto pacientů vždy podáváme kortikoidy, a to v dávce 200 mg hydrocortisonu/den (nebo ekvivalent) (17).
Tab. 3. Nejčastější imunosupresiva (IS) v udržovací léčbě a vztah k infekcím 
GIT – gastrointestinální trakt Prvním krokem u akutních, život neohrožujících infekcí, je obvykle vysazení mykofenolátu a dále již management závisí na vývoji stavu a reakci na iniciální terapii.
Nasazení imunosupresivní terapie zpět taktéž nemá jasná pravidla a závisí na řadě výše zmíněných faktorů, především na aktuálním zdravotním stavu pacienta. Mykofenolát nasazujeme obvykle až v případě plného zotavení („doužívání antibiotik“), pokud se nejedná o imunologicky vysoce rizikového pacienta. Při dobrém efektu léčby obvykle po několika dnech vracíme CIN (tacrolimus) za monitorace hladin. V případě protrahovaného kritického stavu ponecháváme monoterapii kortikoidy i po dobu několika týdnů. Konzultace transplantačního centra je ale vždy nezbytná.
Rejekční epizodu můžeme diagnostikovat pouze biopsií štěpu. Z neinvazivních metod nám může pomoci vyšetření anti‑HLA (Human Luekocyte Antigen) protilátek například metodou Luminex. Nárůst protilátek předchází rozvoji klinicky manifestní humorální rejekční epizodě (22). Rozvoj akutní rejekce v krátkodobém horizontu po redukci imunosuprese z důvodu závažné infekce je málo pravděpodobný (23).
Infekce močových cest
Infekce urotraktu jsou nejčastější infekční komplikací pacientů po transplantaci ledviny. Epidemiologická data jsou dle typu práce velmi různorodá a udávané rozmezí výskytu infekcí se uvádí mezi 6 a 86 %. Dle dat z amerických registrů je kumulativní incidence 5 let od transplantace 78,0 % a infekce urotraktu tvoří 46,8 % všech dokumentovaných infekcí (5, 24). Většina infekcí se vyskytne v prvním roce po transplantaci. Dle lokalizace rozlišujeme uretritidu, cystitidu nebo pyelonefritidu štěpu.
Rizikovými faktory pro rozvoj infekce močových cest je především imunosupresivní terapie a přítomnosti cizích materiálů (katetry, stenty) v urotraktu (4, 25). Naopak proběhlá pyelonefritida je nezávislým rizikovým faktorem pro předčasnou ztrátu štěpu v dlouhodobém horizontu (26).
Diagnostika močových infekcí je na základně klinických projevů (dysurie, polakisurie, teploty, barva a zápach moči, lumbalgie) a paraklinických vyšetření (vysoká zánětlivá aktivita, leukocyturie, pozitivní nitrity v moči a signifikantní bakteriurie prokázaná kultivačním vyšetřením). Z původců se vyskytují obvykle gram negativní bakterie (E. Coli, Klebsiella spp., Proteus spp. a další) a narůstajícím problémem je zvyšující se výskyt rezistentních kmenů (ESBL kmeny) (27). Myslet je potřeba také na možné atypické původce, jako chlamydie, mycoplasma nebo ureaplasma.
Častý nález asymptomatické bakteriurie (i signifikantní) nevyžaduje obvykle léčbu. Individuálně je možné zvážit léčbu při výskytu v prvních 3 měsících od transplantace (28).
Symptomatickou infekci dolních cest močových léčíme obvykle ambulantně a využíváme řadu antibiotik: trimetoprim‑sulfamethoxazol, nitrofurantoin, cefalosporiny II. generace, amoxiclin, amoxicilin/klavulanát. V případě pyelonefritidy štěpu je často nutná hospitalizace s parenterální empirickou antibiotickou terapií, kdy se používají širokospektrá antibiotika často v kombinaci. Použít lze cefalosporiny vyšších generací nebo piperacilin/tazobaktam, v případě sepse nebo septického šoku v kombinaci s aminoglykosidy v empirické terapii (za monitorace hladin léků především při AKI). Každá infekce močových cest u pacienta po transplantaci je svým charakterem komplikovaná, s čímž souvisí i délka a razantnost antiinfekční léčby, která je obecně delší než u imunokompetentních pacientů, v případě recidivujících infekcí trvá i několik týdnů. Nutná je dostatečná hydratace a v případě přítomnosti cizích materiálů jejich odstranění nebo alespoň výměna, pokud trvá indikace k jejich zavedení. V případě recidivujících infekcí je nutné pátrat po možné urologické příčině (dysfunkce močového měchýře, postmikční reziduum, stenózy ureteru atp.).
Specifickou skupinou jsou pacienti s polycystickou chorobou vlastních ledvin, kdy je možná infekce v některé z cyst. V některých případech je nutné provedení nefrektomie jedné nebo obou původních ledvin. Management imunosupresivní terapie se řídí především klinickým stavem pacienta a byl popsán v samostatné kapitole.
Pneumonie
Jedná se o potencionálně závažné onemocnění, které nepříznivě ovlivňuje morbiditu a mortalitu pacientů po transplantaci ledviny (4, 29). Po IMC se jedná o druhou nejčastější bakteriální infekci, která tvoří 28,2 % všech infekcí (5). V prvním měsíci po transplantaci se jedná často o infekci nosokomiální nebo reaktivaci infekce u příjemce po zahájení imunosupresivní léčby. Etiologicky zde dominují gramnegativní kmeny bakterií. Po prvním měsíci se objevují komunitní patogeny (Streptococcus pneumoniae, Legionella, Haemophilus infl.) a také oportunní infekce jako pneumocystová pneumonie. Diferenciálně diagnosticky je nutno zvažovat CMV pneumonitidu, RS (respirační syncytiální) virus, dle aktuální epidemiologické situace také viry chřipky nebo aktuálně pneumonii způsobenou virem SARS‑CoV - 2, atypické původce (chlamydie, mycoplasma) a také řadu infekcí mykotických (mukormykóza, aspergilóza a další), případně mykobakteriózy. Z neinfekčních příčin může pneumonii napodobit krvácení do plic různé etiologie, vaskulitidy nebo nádorové onemocnění plic (primární nebo sekundární nádory), případně PTLD (post‑transplant lymphoproliferative disorder).
Klinický obraz i diagnostický přístup je obdobný jako u imunokompetentního pacienta. Důležitá je snaha o detekci vyvolávajícího agens, kdy se častěji využívají PCR metody, a především v případě nedostatečné reakce na empirickou léčbu pak zobrazovací metody (HRCT plic) a bronchoskopii.
Léčba se řídí klinickým stavem pacienta a předpokládaným původcem (komunitní vs. nosokomiální pneumonie). Při léčbě těžké komunitní pneumonie častěji volíme místo doporučených základních beta ‑ laktamových antibotik antipseudomonádové (piperacilin‑tazobaktam, meropenem, ceftazidim) a fluorochinolon (30). V případě sepse nebo septického šoku a relativně zachovalé funkci štěpu pak místo chinolonu je výhodné použít aminoglykosid. Hladiny antiinfektiv je vhodné monitorovat vždy, když je to možné (včetně monitorace beta ‑ laktamů). V případě použití fluconazolu nebo makrolidových antibiotik je nutno redukovat dávku CIN (pokud je ponechána) a měřit hladiny nebo zvolit jinou terapii. Management imunosupresivní terapie se řídí především klinickým stavem pacienta a byl popsán v samostatné kapitole.
Prevence infekcí
Nejúčinnějším nástrojem v medicíně obecně je prevence nemocí. Kromě snahy o redukci rizikových faktorů tam, kde to je možné (časné odstranění katetrů, správné vedení imunosupresivní terapie, léčba komorbidit, adekvátní nutrice), je velmi efektivním nástrojem očkování a antibiotická profylaxe.
Standardní součástí antibiotické profylaxe mimo samotnou perioperační fázi je v prvních 3 měsících po transplantaci sulfometoxazol‑trimethoprim k profylaxi pneumocystové pneumonie a také částečně infekcí močových cest. Valganciclovir podáváme u rizikových pacientů k profylaxi CMV infekce (3–6 měsíců dle sérologie příjemce a dárce) (31). Důležité je i profylaktické podání širokospektrých antiinfektiv před invazivním výkonem (například piperacilin/tazobactam před intervencí v urotraktu).
V případě transplantovaných pacientů je velmi důležité pravidelné očkování, které zlepšuje přežívání pacientů a snižuje riziko rejekce a předčasné ztráty štěpu (4, 31). Očkovat lze pouze neživými vakcínami. U pacientů starších 50 let je proto vhodné do doby, než bude dostupná neživá vakcína, očkování proti viru varicella zoster ještě před samotnou transplantací, a to z důvodů častého a recidivujícího výskytu pásového oparu. Po transplantaci ledviny se při očkování obáváme spíše nedostatečně vytvořené post‑vakcinační imunity než samotných nežádoucích reakcí na vakcínu. Doporučujeme očkování proti chřipce (nejdříve měsíc, lépe 3 měsíce po transplantaci ledviny), očkování proti pneumokokovým infekcím (6 měsíců po transplantaci) a řadu dalších po individuální konzultaci (hepatitida A, meningokok atp.). Aktuálně je doporučeno očkování proti nemoci covid-19.
Závěr
Imunosuprimovaní pacienti jsou ve zvýšeném riziku infekcí běžnými i oportunními původci s potencionálně závažným průběhem. V případě infekce vyžadující hospitalizaci, kromě odběru biologického materiálu ke kultivačnímu vyšetření, nasazení širokospektrých antibiotik při předpokladu bakteriální etiologie a podpůrné léčbě dané aktuálním stavem pacienta, redukujeme nebo vysazujeme imunosupresivní léčbu a jako minimum podáváme hydrocortison v dávce 200 mg/den a konzultujeme příslušné transplantační centrum. V diferenciální diagnostice febrilních stavů zvažujeme i neinfekční příčiny, jako je akutní rejekční epizoda, relaps systémového onemocnění nebo polékovou horečku. U pacientů v dialyzační léčbě po selhání funkce štěpu nezapomínáme na možný graft intolerance syndrom projevující se teplotami, bolestivostí v místě štěpu, anemizací, případně makroskopickou hematurií při zachovalé diuréze. V tomto případě je při vyloučení infekční etiologie po konzultaci transplantačního centra ke zvážení pulzní léčba kortikoidy. V případě jakýchkoli potíží u pacienta po transplantaci ledviny je konzultace příslušného transplantačního centra žádoucí.
Podpořeno MZ ČR‑RVO‑FNOs/ 2018
KORESPONDENČNÍ ADRESA AUTORA:
MUDr. Zdeněk Lys
Interní a kardiologická klinika, Fakultní nemocnice Ostrava
17. listopadu 1790/5, 708 52 Ostrava
Cit. zkr: Vnitř Lék 2022;68(3):E12-E17
Článek přijat redakcí: 3. 1. 2022
Článek přijat po recenzích: 4. 4. 2022
Sources
1. Obert R, Olfe AW, Alarie V et al. Comparison of Mortality in All Patients on Dialysis, Patients on Dialysis Awaiting Transplantation, and Recipients of a First Cadaveric Transplant. http://dx.doi.org/101056/NEJM199912023412303 [Internet]. 2008 Oct 21 [cited 2021 Dec 12];341(23):1725–30. Available from: https://www.nejm.org/doi/full/10.1056/ nejm199912023412303
2. Kostro JZ, Hellmann A, Kobiela J et al. Quality of Life After Kidney Transplantation: A Prospective Study. Transplant Proc. 2016 Jan 1;48(1):50–4.
3. Statistiky | Koordinační středisko transplantací (KST) [Internet]. [cited 2021 Dec 12]. Available from: https://kst.cz/statistiky/
4. Wohlfahrtová M, Ondřej Viklický LR. Transplantace orgánů v klinické praxi. 1. Praha: Grada Publishing, a. s.; 2021. 416 p. ISBN 978-80-271-0721-6.
5. Jackson KR, Motter JD, Bae S et al. Characterizing the landscape and impact of infections following kidney transplantation. Am J Transplant. 2021 Jan 1;21(1):198–207.
6. Awan AA, Niu J, Pan JS et al. Trends in the Causes of Death among Kidney Transplant Recipients in the United States (1996-2014) Keywords Kidney transplant · Cause‑specific death · Cardiovascular disease · Malignancy. Am J Nephrol [Internet]. 2018 [cited 2021 Dec 12];48 : 472–81. Available from: www.karger.com/ajn
7. Ying T, Shi B, Kelly PJ et al. Death after kidney transplantation: An analysis by era and time post‑transplant. J Am Soc Nephrol [Internet]. 2020 Dec 1 [cited 2021 Dec 12];31(12):2887 – 99. Available from: https://jasn.asnjournals.org/content/31/12/2887
8. Au EH, Chapman JR, Craig JC et al. Overall and site‑specific cancer mortality in patients on dialysis and after kidney transplant. J Am Soc Nephrol [Internet]. 2019 Mar 1 [cited 2021 Dec 12];30(3):471–80. Available from: https://jasn.asnjournals.org/content/30/3/471
9. Kinnunen S, Karhapää P, Juutilainen A et al. Secular trends in infection‑related mortality after kidney transplantation. Clin J Am Soc Nephrol [Internet]. 2018 May 7 [cited 2021 Dec 12];13(5):755–62. Available from: https://cjasn.asnjournals.org/content/13/5/755
10. Fishman JA, Fishman JA. Infection in Organ Transplantation. Am J Transplant. 2017;17(4):856-879. doi:10.1111/AJT.14208
11. Kalil AC, Opal SM. Sepsis in the Severely Immunocompromised Patient. CurrInfect Dis Rep 17, 32 (2015). Available from: https://doi.org/10.1007/s11908-015-0487-4
12. Lubetzky M, Tantisattamo E, Molnar MZ et al. The failing kidney allograft: A review and recommendations for the care and management of a complex group of patients. Vol. 21, American Journal of Transplantation. John Wiley and Sons Inc; 2021. p. 2937–49.
13. Sawyer RG, Crabtree TD, Gleason TG et al. Impact of solid organ transplantation and immunosuppression on fever, leukocytosis, and physiologic response during bacterial and fungal infections. Clin Transplant [Internet]. 1999 Mar 1 [cited 2021 Dec 12];13(3):260–5. Available from: https://onlinelibrary.wiley.com/doi/full/10.1034/j.1399-0012.1999.130307.x
14. Chertow GM, Burdick E, Honour M et al. Acute Kidney Injury, Mortality, Length of Stay, and Costs in Hospitalized Patients. J Am Soc Nephrol [Internet]. 2005 Nov 1 [cited 2021 Dec 13];16(11):3365–70. Available from: https://jasn.asnjournals.org/content/16/11/3365
15. Peeters P, Laecke S Van, Vanholder R. ACUTE KIDNEY INJURY IN SOLID ORGAN TRANSPLANT RECIPIENTS. http://dx.doi.org/101179/acb2007087 [Internet]. 2014 Jan [cited 2021 Dec 13];62(sup2):389–92. Available from: https://www.tandfonline.com/doi/ abs/10.1179/acb.2007.087
16. Moledina DG, Perazella MA. Drug ‑ Induced Acute Interstitial Nephritis. Clin J Am Soc Nephrol [Internet]. 2017 Dec 7 [cited 2021 Dec 13];12(12):2046. Available from: /pmc/articles/ PMC5718279/
17. Bafi AT, Tomotani DYV, De Freitas FGR. Sepsis in solid‑organ transplant patients. Shock [Internet]. 2017 [cited 2021 Dec 12];47 : 12–6. Available from: https://journals.lww.com/ shockjournal/Fulltext/2017/01001/Sepsis_in_Solid_Organ_Transplant_Patients.4.aspx
18. Gupta RK. Opportunistic Infections in Renal Allograft Recipients. Transplant Proc. 2007 Apr 1;39(3):731–3.
19. Santos T, Aguiar B, Santos L et al. Invasive Fungal Infections After Kidney Transplantation: A Single ‑ center Experience. Transplant Proc. 2015 May 1;47(4):971–5.
20. Infante B, Rossini M, Leo S et al. Molecular Sciences Recurrent Glomerulonephritis after Renal Transplantation: The Clinical Problem. [cited 2021 Dec 13]; Available from: www. mdpi.com/journal/ijms
21. Al‑Adra D, Al‑Qaoud T, Fowler K et al. De Novo Malignancies after Kidney Transplantation. Clin J Am Soc Nephrol [Internet]. 2021 Mar 29 [cited 2021 Dec 13];17:CJN.14570920. Available from: https://cjasn.asnjournals.org/content/early/2021/02/17/CJN.14570920
22. Terasaki PI, Ozawa M. Predicting Kidney Graft Failure by HLA Antibodies: a Prospective Trial. Am J Transplant [Internet]. 2004 Mar 1 [cited 2021 Dec 12];4(3):438–43. Available from: https://onlinelibrary.wiley.com/doi/full/10.1111/j.1600-6143.2004.00360.x
23. Yahav D, Sulimani O, Green H et al. Immunosuppression reduction in kidney transplant recipients during bacterial infection—A retrospective study. Clin Transplant [Internet]. 2019 Oct 1 [cited 2021 Dec 6];33(10):e13707. Available from: https://onlinelibrary.wiley. com/doi/full/10.1111/ctr.13707
24. Säemann M, Hörl WH. Urinary tract infection in renal transplant recipients. Eur J Clin Invest [Internet]. 2008 Oct [cited 2021 Dec 6];38(SUPPL.2):58–65. Available from: https:// onlinelibrary.wiley.com/doi/full/10.1111/j.1365-2362.2008.02014.x
25. Singh R, Geerlings SE, Peters‑Sengers H et al. Incidence, risk factors, and the impact of allograft pyelonephritis on renal allograft function. Transpl Infect Dis [Internet]. 2016 Oct 1 [cited 2021 Dec 6];18(5):647–60. Available from: https://onlinelibrary.wiley.com/doi/ full/10.1111/tid.12568
26. Maanaoui M, Baes D, Hamroun A et al. Association between acute graft pyelonephritis and kidney graft survival: A single ‑ center observational study. Am J Transplant [Internet]. 2021 Nov 1 [cited 2021 Dec 6];21(11):3640–8. Available from: https://onlinelibrary.wiley. com/doi/full/10.1111/ajt.16703
27. Korth J, Kukalla J, Rath P‑M et al. Increased resistance of gram‑negative urinary pathogens after kidney transplantation. BMC Nephrol 18, 164 (2017). https://doi.org/10.1186/ s12882-017-0580-z
28. Lee JR, Bang H, Dadhania D et al. Independent risk factors for urinary tract infection and for subsequent bacteremia or acute cellular rejection: A single‑center report of 1166 kidney allograft recipients. Transplantation [Internet]. 2013 Oct 27 [cited 2021 Dec 6];96(8):732–8. Available from: https://journals.lww.com/transplantjournal/Fulltext/2013/10270/Independent_ Risk_Factors_for_Urinary_Tract.9.aspx
29. Kara S, Sen N, Kursun E et al. Pneumonia in renal transplant recipients: A single ‑ center study. Exp Clin Transplant. 2018 Mar 1;16 : 122–5.
30. Guidelines | Pneumologie [Internet]. [cited 2021 Dec 14]. Available from: http:// www.pneumologie.cz/guidelines/?potvrzeni1=1 & potvrzeni2=1 & potvrdit=ANO% 0D%0 A%0D%0A++++Vstoupit#
31. Transplant Recipient – KDIGO [Internet]. [cited 2021 Dec 13]. Available from: https:// kdigo.org/guidelines/transplant‑recipient/
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2022 Issue E-3
Most read in this issue- Incidentalom nadledviny
- Akutní infekce u pacientů po transplantaci ledviny
- Záchyt, vyšetření a terapie sexuálních dysfunkcí u pacientů s diabetem
- Mortalitní riziko pacientů hospitalizovaných mezi lety 2003 a 2019 pro ischemickou cévní mozkovou příhodu
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career