-
Medical journals
- Career
Nintedanib v terapii intersticiálních plicních procesů u systémových onemocnění pojiva
Authors: Ondřej Zela
Authors‘ workplace: Plicní oddělení Nemocnice ve Frýdku-Místku, p. o.
Published in: Vnitř Lék 2021; 67(6): 330-333
Category: Main Topic
Overview
Systémová onemocnění pojiva tvoří širokou paletu diagnostických jednotek s pestrým klinickým obrazem a různou mírou postižení vnitřních orgánů. Jednou z limitujících afekcí je oblast respiračního systému, která může postihovat jak plicní intersticium, tak pleuru, plicní cévy i dýchací cesty jako takové. V případě některých diagnóz (systémová sklerodermie, revmatoidní artritida) je plicní postižení a z něho plynoucí důsledky hlavní příčinou morbidity a mortality nemocných. Respirační potíže mohou být prvním příznakem revmatického onemocnění nebo se mohou objevit kdykoliv v jeho průběhu. Každý revmatolog by měl u svých pacientů aktivně pátrat po možném plicním postižení, naopak každý pneumolog by neměl zapomenout na možné mimoplicní projevy u pacientů vyšetřovaných pro respirační potíže. V současné době máme k dispozici data pro použití moderní antifibrotické léčby nejen u pacientů s idiopatickou plicní fibrózou (IPF), ale i u vybraných pacientů s non-IPF intersticiálním plicním procesem s progredujícím fenotypem. Klíčovou se stává spolupráce pneumologa a revmatologa ve společné identifikaci těchto nemocných a zvážení časného nasazení léčby.
Klíčová slova:
intersticiální plicní procesy – nintedanib – systémová onemocnění pojiva – INBUILD – INPULSIS
Intersticiální plicní procesy a systémová onemocnění pojiva
Intersticiální plicní procesy (IPP) tvoří širokou skupinu více než 200 samostatných diagnóz, které spojuje podobný klinický obraz (dušnost, kašel, zvýšená únavnost) a obdobný nález při zobrazovacích vyšetřeních. IPP u systémových onemocnění pojiva tvoří jednu z podskupin, do kterých tato onemocnění dělíme (dále sem patří idiopatické intersticiální pneumonie, hypersenzitivní pneumonie, sarkoidóza a jiné IPP) (1). IPP se obzvláště často vyskytuje u pacientů se systémovou sklerodermií a je součástí diagnostických kritérií tohoto onemocnění. Incidence udávaná v literatuře je různá, ve studiích založených na datech z registrů je popisována přítomnost IPP na HRCT a rtg hrudníku u 64 %, resp. 22 % nemocných (Kanada) (2), ve studii 1374 nemocných ve Španělsku vykazovalo známky IPP na obou těchto zobrazovacích metodách 43 % (3). U revmatoidní artritidy je výskyt IPP relativně méně častý, celoživotní riziko rozvoje je odhadováno na 7,7 % (4). IPP u výše zmíněných systémových onemocnění pojiva jsou typicky asociovány s progredujícím fenotypem plicního postižení (1). Klinicky nejvýznamnější dopad má IPP u pacientů se systémovou sklerodermií, u kterých je hlavní příčinou mortality v přímé souvislosti se základním onemocněním (až 35 % úmrtí) (5). U revmatoidní artritidy je klinicky manifestní IPP asociovaný s obrazem obvyklé intersticiální pneumonie (UIP) na HRCT spojený s přežitím podobným jako u neléčené idiopatické plicní fibrózy (4).
Idiopatická plicní fibróza jako modelový IPP
Modelovým, nejvíce studovaným příkladem intersticiálního plicního procesu je idiopatická plicní fibróza (IPF). Toto onemocnění (odhadovaná incidence v ČR dle registru EMPIRE 6–15/100 000) s prognózou přežití blížící se některým maligním onemocněním bylo v posledních desetiletích podrobeno intenzivnímu zkoumání (6, 7). Standardní léčbu všech IPP vč. IPF představovala donedávna imunosupresivní léčba (nejčastěji kortikoidy, dále pak azathioprin, metotrexát, mykofenolát mofetil atd.), u pacientů s progredující formou onemocnění a rozvinutou respirační insuficiencí pak dlouhodobá domácí oxygenoterapie, event. u přísně selektovaných nemocných pak transplantace plic. Zásadní průlom v léčbě přineslo uvedení antifibrotických léčiv na trh, nejprve pirfenidonu v roce 2011 a o 4 roky později pak nintedanibu, který se ukázal jako slibný lék pro širší skupinu nemocných.
Nintedanib
Nintedanib je trikinázový inhibitor s efektem proti receptorům pro růstový faktor pro fibroblasty (FGF), vaskulární endoteliální růstový faktor (VEGF) a růstový faktor z destiček (PDGF) (8). Užívá se perorálně v dávce 2 x 150 mg, jeho účinnost ve smyslu snížení poklesu plicních funkcí u nemocných s IPF byla prokázána ve studiích INPULSIS-1 a INPULSIS-2, které prokázaly benefit jak ve snížení roční míry poklesu forsírované vitální kapacity (FVC), tak výskytu akutních exacerbací IPF(9). Je hrazen u dospělých nemocných s vitální kapacitou (VC) v rozmezí 50–90 % náležitých hodnot a transferfaktorem (TLCO) > 30 % náležitých hodnot, kteří dodržují zákaz kouření. Nejčastější nežádoucí účinky jsou průjmy (mírné až středně silné intenzity), ovlivnitelné podáním loperamidu, a zvýšení jaterních testů. Obojí lze eliminovat většinou přechodným snížením dávky na 2 x 100 mg, u pacientů se systémovými onemocněními pojiva je však třeba výskyt průjmů monitorovat pečlivěji, jejich dopad může být u těchto nemocných závažnější. Kontraindikaci představuje pouze těhotenství nebo hypersenzitivita na nintedanib, sóju či arašídy. Do poloviny roku 2020 byla úhrada z veřejného zdravotního pojištění ukončena při rychlejším poklesu plicních funkcí (definováno v 6měsíčním intervalu kontrol jako pokles VC o > 10 % a TLCO o > 15 %), toto omezení nyní již neplatí. Cena léčby činí přibližně 33 000 Kč na měsíc a v současné době bylo nintedanibem léčeno celosvětově již více než 80 000 nemocných.
Antifibrotická léčba u non-IPF intersticiálních plicních onemocnění
Zhruba u 18–32 % nemocných s IPP jiným než IPF dochází v čase k progresi plicního postižení ve smyslu podobném jako u IPF, tedy k postupnému zhoršení HRCT nálezu i plicních funkcí v důsledku fibrotizace plicní tkáně a rozvoji limitujících symptomů. Pacienti s tímto fenotypem onemocnění mají zhoršenou kvalitu života, častější exacerbace (10), vyžadují častěji kombinovanou imunosupresi, dlouhodobou domácí oxygenoterapii (DDOT) a jsou až 7x častěji transplantováni (11). Do skupiny IPP, u kterých se můžeme setkat s progredujícím fenotypem, patří i IPP v rámci systémových onemocnění pojiva. Přes rozdílný trigger je patofyziologický princip fibrotické představy u IPF a non-IPF ILD podobný, zahrnuje přeměnu fibroblastů v myofibroblastický fenotyp a excesivní depozici extracelulární matrix. Logicky byl tedy zkoumán potenciální efekt nintedanibu i u této široké skupiny nemocných. V roce 2019 byly publikovány výsledky studií SENSCIS a následně INBUILD, které se zabývaly účinností tohoto léku u skupiny nemocných s plicním postižením v rámci systémové sklerodermie, resp. u širší skupiny progredujících non-IPF ILD.
Studie Senscis
Studie SENSCIS (Safety and Efficacy of Nintedanib in Systemic Sclerosis), publikovaná v The New England Journal of Medicine v květnu 2019, byla designována jako randomizovaná, dvojitě zaslepená studie, která porovnávala pokles forsírované vitální kapacity (FVC) v průběhu 52 týdnů mezi skupinou pacientů užívajících nintedanib vs. skupinou užívající placebo. Inkluzivní kritéria zahrnovala mj. rozsah fibrotického postižení na CT s vysokým rozlišením (HRCT) minimálně 10 %, FVC ≥ 40 % a TLCO v rozmezí 30–89 % predikovaných hodnot, povoleno bylo užívání prednisonu v dávce do 10 mg denně a mykofenolátu mofetilu či metotrexátu ve stabilní dávce v posledních 6 měsících, naopak těžká plicní hypertenze představovala jedno z hlavních vylučovacích kritérií. Do studie bylo randomizováno celkem 576 pacientů z 32 zemí. Průměrný věk činil 54,0 ± 12,2 let, ženy převažovaly v obou větvích (76,7 %, resp. 73,6 %). Průměrná hodnota FVC byla 72,5 ± 16,7 %, TLCO pak 53,0 ± 15,1 %. Téměř polovina pacientů neužívala před zahájením studie žádnou imunosupresivní léčbu, ostatní byli léčeni mykofenolát mofetilem. Studii dokončilo celkem 539 pacientů (z toho 275 v placebové větvi), průměrný roční pokles FVC ve skupině léčené nintedanibem činil – 52,4 ml, v placebové skupině pak – 93,3 ml (rozdíl 41,0 ml, 95 % CI 2,9–79,0, p = 0,04). V nintedanibové větvi byl u pacientů současně léčených mykofenolát mofetilem zaznamenán o něco mírnější roční pokles FVC (-40,2 ml vs. -63,9 ml). Průjem, nejčastější nežádoucí účinek, byl prokázán u 75,7 % pacientů v nintedanibové a u 31,6 % v placebové větvi. Nebyl prokázán žádný vliv na mimoplicní projevy systémové sklerodermie (12).
Studie Inbuild
Studie INBUILD byla publikována krátce po SENSCIS (říjen 2019) ve stejném prestižním periodiku. Design obou studií ve smyslu primárního endpointu byl velmi podobný – i zde byl sledován pokles FVC v průběhu 52 týdnů, zkoumanou skupinu tvořili pacienti s progredujícím IPP jiným než IPF (non-IPF IPP) léčení nintedanibem. Do této randomizované, dvojitě zaslepené studie byli zahrnuti pacienti s minimálně 10% postižením plic dle HRCT, FVC ≥ 45 % a TLCO 30–79 % predikovaných hodnot. Na rozdíl od studie SENSCIS byla inkluzivním kritériem dokumentovaná progrese onemocnění v posledních 24 měsících (definovaná poklesem plicních funkcí a/nebo progresí HRCT nálezu). Studie se zúčastnilo celkem 663 pacientů, průměrný věk v nintedanibové větvi činil 65,2 ± 9,7 let, v placebové 66,3 ± 9,8, v obou skupinách převažovali muži (53,9 %, resp. 53,5 %).
V nintedanibové větvi činil roční pokles FVC -80,8 ml, v placebové pak -187,8 ml, rozdíl činil 107,0 ml (95 % CI, 65,4–148,5, p < 0,001). U skupiny pacientů s obrazem UIP (usual interstitial pneumonia) činil pokles -82,9 ml, resp. -211,1 ml, rozdíl pak 128,2 ml (95 % CI, 70,8–185,6, p < 0,001). Nejčastějším nežádoucím účinkem byl opět průjem, zaznamenaný u 66,9 %, resp. 23,9 % pacientů. Zvýšení jaterních testů bylo rovněž častější u pacientů léčených nintedanibem než v placebové větvi.
Podskupinu pacientů s IPP asociovaných se systémovými onemocněními pojiva tvořilo celkem 170 nemocných (82 v nintedanibové a 88 v placebové větvi). Z jednotlivých diagnóz byly nejvíce zastoupeny IPP při revmatoidní artritidě (n = 89), systémové sklerodermii (n = 39), smíšeném onemocnění pojiva (n = 19), dále pak při ostatních onemocněních (n = 23) včetně Sjögrenova syndromu (n = 7), intersticiální pneumonie s autoimunními rysy (n = 5) a nediferencovaného onemocnění pojiva (n = 3). V této podskupině rozdíl poklesu FVC (nintedanib vs. placebo) činil 104,0 ml (95 % CI, 21,1–186,9), výsledky ve smyslu výskytu akutní exacerbace IPP, úmrtí nebo progrese onemocnění v průběhu studie viz tabulka 1 (13, 14).
Table 1. Sekundární endpointy studie INBUILD v podskupině IPP asociovaných se systémovými onemocněními pojiva (14) 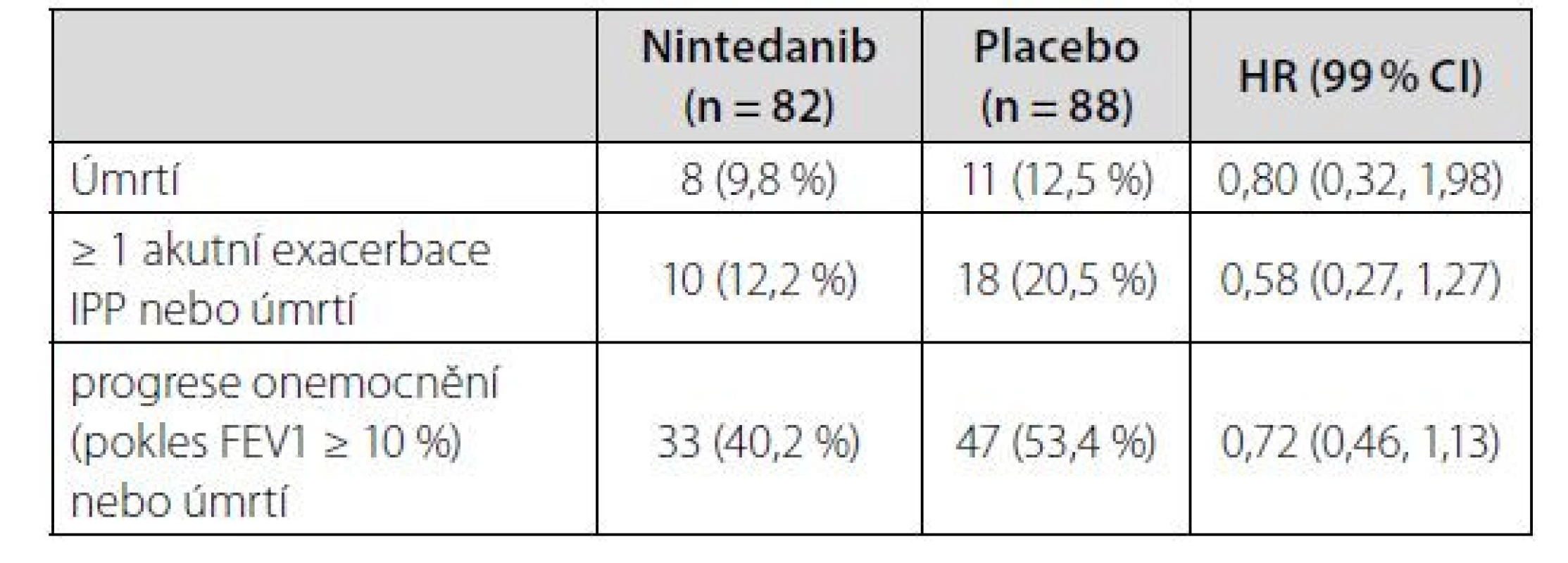
Na základě výše uvedených dat bylo v rámci EU v únoru 2020 schváleno použití nintedanibu pro léčbu IPP u systémové sklerodermie, následně pak v červenci 2020 pro ostatní IPP s progredujícím fibrotizujícím fenotypem.
Dle národních doporučení pro diagnostiku a léčbu intersticiálního plicního postižení u systémových onemocnění pojiva České pneumologické a ftizeologické společnosti (aktualizace 2021) je v současné době léčba nintedanibem doporučena u nemocných s recentní diagnózou systémové sklerodermie a respiračními příznaky. Důvodem je fakt, že většina IPP u systémových onemocnění pojiva se vyskytuje v rozmezí 2–5 let od stanovení diagnózy. Další indikací léčby je nízké FVC a/nebo TLco, ≥ 10–20 % plicního postižení na HRCT hrudníku a progrese plicních funkčních parametrů v čase (15).
Monitoring pacientů
Aktuálně jsou diskutovány různé možnosti aktivního vyhledávání pacientů s IPP asociovaných se systémovým onemocněním pojiva. Celoplošný skríningový program dosud nefunguje, nicméně vzhledem k závažnosti tohoto onemocnění a dostupnosti léčby by v ideálním případě byli pacienti pravidelně vyšetřeni pneumologem. Protože však dostupnost vyšetření není v některých regionech zdaleka ideální, je doporučeno vyšetření všech pacientů, u kterých se vyvine námahová dušnost, kašel, krepitace nebo známky respiračního selhání.
Závěr
Intersticiální plicní onemocnění představuje závažnou orgánovou manifestaci systémových onemocnění pojiva. Ukázalo se, že nintedanib, lék původně vyvinutý pro léčbu IPF, vykazuje srovnatelnou účinnost u pacientů s jinými IPP s progredujícím fibrotizujícím fenotypem, kam patří i IPP v rámci systémového onemocnění pojiva. U pacientů s těmito onemocněními je zapotřebí na možnou přítomnost subklinické nebo klinické formy IPP pomýšlet a aktivně po ní pátrat. Klíčovou roli zde hraje mezioborová spolupráce mezi revmatologem a pneumologem, případně praktickým lékařem či jiným oborově relevantním specialistou. Plicní vyšetření umožní kvantifikovat tíži funkčního postižení, případně zpřesnit histopatologický nález a odeslat vhodného pacienta do Centra pro diagnostiku a léčbu intersticiálních plicních onemocnění, kde je možno provést finální diagnostiku a u indikovaných nemocných zahájit neprodleně antifibrotickou léčbu, u pokročilejších nálezů pak případně pacienta referovat do transplantačního centra FN Motol. Léčba nintedanibem je pro pacienty komfortní, není spojena se závažnými nežádoucími účinky a nemá zásadní kontraindikace. V současné době není antifibrotická léčba u non-IPF IPP standardně hrazena z prostředků veřejného zdravotního pojištění, o úhradu lze žádat pouze prostřednictvím mediálně dobře známého paragrafu 16. Podobně jako u IPF lze do budoucna očekávat postupnou integraci této léčby do standardních terapeutických modalit a tím i její úhradu.
KORESPONDENČNÍ ADRESA AUTORA:
MUDr. Ondřej Zela, MBA
Plicní oddělení Nemocnice ve Frýdku-Místku, p. o., Elišky Krásnohorské 321, 738 01 Frýdek-Místek
Cit. zkr: Vnitř Lék 2021; 67(6): 330–333
Článek přijat redakcí: 14. 7. 2021
Článek přijat po recenzích: 30. 8. 2021
Sources
1. Cottin V, Hirani NA, Hotchkin DL et al. Presentation, diagnosis and clinical course of the spectrum of progressive-fibrosing interstitial lung diseases. Eur Respir Rev. 2018; 27(150). doi: 10.1183/16000617.0076–2018.
2. Steele R, Hudson M, Lo E, Baron M. Clinical decision rule to predict the presence of interstitial lung disease in systemic sclerosis. Arthritis Care Res (Hoboken). 2012; 64(4): 519 – 524. doi: 10.1002/ACR.21583
3. Sanchéz-Cano D, Ortego-Centeno N, Callejas JL et al. Interstitial lung disease in systemic sclerosis: data from the spanish scleroderma study group. Rheumatol Int. 2018; 38(3): 363–374. doi: 10.1007/S00296–017–3916-X.
4. Bongartz T, Nannini C, Medina-Velasques YF et al. Incidence and mortality of interstitial lung disease in rheumatoid arthritis: a population-based study. Arthritis Rheum. 2010; 62(6): 1583–1591. doi: 10.1002/ART.27405.
5. Tyndall AJ, Bannert B, Vonk M et al. Causes and risk factors for death in systemic sclerosis: a study from the EULAR Scleroderma Trials and Research (EUSTAR) database. Ann Rheum Dis. 2010; 69(10): 1809–1815. doi: 10.1136/ARD.2009.114264.
6. Tran T, Šterzlová M, Mogulkoc N et al. The European MultiPartner IPF registry (EMPIRE): validating long-term prognostic factors in idiopathic pulmonary fibrosis. Respir Res. 2020; 21(1). doi: 10.1186/S12931–019–1271-Z.
7. Doubková M, Švancara J, Svoboda M et al. EMPIRE Registry, Czech Part: Impact of demographics, pulmonary function and HRCT on survival and clinical course in idiopathic pulmonary fibrosis. Clin Respir J. 2018; 12(4): 1526–1535. doi: 10.1111/CRJ.12700.
8. Fukihara J, Kondoh Y. Nintedanib (OFEV) in the treatment of idiopathic pulmonary fibrosis. Expert Rev Respir Med. 2016; 10(12): 1247–1254. doi: 10.1080/17476348.2016.1249854.
9. Richeldi L, Kolb M, Jouneau S et al. Efficacy and safety of nintedanib in patients with advanced idiopathic pulmonary fibrosis. BMC Pulm Med. 2020; 20(1). doi: 10.1186/S12890–019–1030–4.
10. Wuyts WA, Papiris S, Manalie et al. The Burden of Progressive Fibrosing Interstitial Lung Disease: A DELPHI Approach. Adv Ther. 2020; 37(7): 3246–3264. doi: 10.1007/S12325–020–01384–0.
11. Kolb M, Vašáková M. The natural history of progressive fibrosing interstitial lung diseases. Respir Res 2019 201. 2019; 20(1): 1–8. doi: 10.1186/S12931–019–1022–1.
12. Distler O, Highland KB, Gahlemann M et al. Nintedanib for Systemic Sclerosis–Associated Interstitial Lung Disease. https://doi.org/101056/NEJMoa1903076. 2019; 380(26): 2518 – 2528. doi: 10.1056/NEJMOA1903076.
13. Flaherty KR, Wells AU, Cottin V et al. Nintedanib in Progressive Fibrosing Interstitial Lung Diseases. https://doi.org/101056/NEJMoa1908681. 2019; 381(18): 1718–1727. doi: 10.1056/NEJMOA1908681.
14. Brown KK, Martinez FJ, Walsh SLF et al. The natural history of progressive fibrosing interstitial lung diseases. Eur Respir J. 2020; 55(6). doi: 10.1183/13993003.00085 – 2020
15. Doubková M. Intersticiální plicní postižení a systémová onemocnění pojiva – doporučení diagnostiky a léčby. Aktualizace 2021. Dostupné online http://www.pneumologie. cz/upload/1612897353.6323.doc
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2021 Issue 6-
All articles in this issue
- HLAVNÍ TÉMA – PNEUMOLOGIE
- Respirační insuficience, chronická hyperkapnie a domácí neinvazivní ventilace z pohledu pneumologa
- Inhalační glukokortikoidy v terapii covidu-19
- Nintedanib v terapii intersticiálních plicních procesů u systémových onemocnění pojiva
- Metabolický syndrom u pacientů po prodělané protinádorové terapii
- Hereditární hemoragická teleangiektázie (syndrom Osler-Weber-Rendu) Díl I. Patofyziologie, klinické příznaky a doporučený skrínink cévních malformací
- Špičkové technologie v medicíně – vliv nastavení hodnot alarmů u systémů pro kontinuální monitoraci glykemie na metabolickou kompenzaci u diabetiků 1. typu: systematické review
- FDG-PET/CT dokumentované vymizení nekrobiotického xantogranulomu při potlačení tvorby monoklonálního imunoglobulinu bortezomibem, lenalidomidem a dexametazonem Popis případu a přehled literatury o léčbě nekrobiotického xantogranulomu
- Lokalizované formy plicní amyloidózy
- Screening gestačního diabetes mellitus
- Proč stále nedosahujeme cílových hodnot krevního tlaku
- Aktuální témata kardiovaskulární prevence
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Lokalizované formy plicní amyloidózy
- Respirační insuficience, chronická hyperkapnie a domácí neinvazivní ventilace z pohledu pneumologa
- Hereditární hemoragická teleangiektázie (syndrom Osler-Weber-Rendu) Díl I. Patofyziologie, klinické příznaky a doporučený skrínink cévních malformací
- Screening gestačního diabetes mellitus
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

