-
Medical journals
- Career
Hereditární hemoragická teleangiektázie (syndrom Osler-Weber-Rendu) Díl I. Patofyziologie, klinické příznaky a doporučený skrínink cévních malformací
Authors: Zdeněk Adam 1; Dagmar Brančiková 1; Gabriela Romanová 2; Luděk Pour 1; Marta Krejčí 1; Jiří König 3; Tomáš Nebeský 4; Zuzana Adamová 5; Martin Štork 1; Martin Krejčí 1; Sabina Ševčíková 4; Michal Eid 1; Zdeněk Král 1
Authors‘ workplace: Interní hematologická a onkologická klinika LF MU a FN Brno 1; Oddělení klinické hematologie FN Brno 2; Oddělní krční, nosní ušní FN Brno 3; Ústav patologické fyziologie LF MU a FN Brno 4; Chirurgické oddělení nemocnice Vsetín 5
Published in: Vnitř Lék 2021; 67(6): 339-344
Category: Review Articles
Overview
Hereditární hemoragická teleangiektázie (HHT), známá také jako Osler-Weber-Rendu syndrom, je dědičné onemocnění, způsobující abnormální tvorbu cév. Pacienti mají četné teleangiektázie, z nichž mohou krvácet. S přibývajícím věkem se u nich rozvíjí arteriovenózní malformace, vedoucí k masivním arteriovenózním zkratům a poškození orgánů, v nichž tyto malformace vznikají. U pacientů je nutno provádět skríninková vyšetření s cílem včasné detekce arteriovenózních malformací a v případě jejich detekce jejich specializované obvykle multidisciplinární léčby. Pokroky farmakologické léčby jsou zmíněny v dalším článku.
Klíčová slova:
hereditární hemoragická teleangiektazie – arteriovenózní malformace
Úvod – charakteristika nemoci
Hereditární hemoragická teleangiektázie (HHT) je vrozené onemocnění s autosomálně dominantním přenosem. Prvním příznakem je krvácení z nosu, obvykle v druhé dekádě života. Teprve později, ve třetí či čtvrté dekádě, se vyvinou typické drobné cévní arteriovenózní malformace (AVM) velikosti špendlíkové hlavičky (o průměru 1–2 mm) – zvané teleangiektázie. Bývají na kůži a na sliznicích dutiny ústní a samozřejmě také v žaludku a v tenkém střevě. Krvácivé projevy nejen z oblasti nosu, ale také z oblasti trávicí trubice, způsobují v pokročilých případech těžkou anémii se závislostí na transfuzích. Pokročilejší formy HHT jsou provázeny rozvojem AVM v oblasti jater, plic a případně v mozku. Hepatální arteriovenózní malformace (HAVM) způsobují hyperkinetický oběh, který může vyústit do srdečního selhání. V plicních arteriovenózních malformacích (PAVM) obchází krev filtraci plicním kapilárním řečištěm, a tak se mohou infikované mikrotromby dostat z oblasti dolní duté žíly třeba do mozku. Cerebrální arteriovenózní malformace (CAVM) mohou způsobovat krvácení do mozku.
HHT je velmi vzácná choroba. I mezinárodní doporučení pro tuto nemoc vychází zřídka, první vyšlo v roce 2009, druhé a zatím poslední bylo vydáno až v roce 2020 (Second International Guidelines for the Diagnosis and Management of Hereditary Hemorrhagic Telangiectasia (1), které je dostupné na adrese: https://pubmed.ncbi. nlm.nih.gov/32894695/) a vroce 2021 se objevila jeho stručnější verze v časopise Blood (2).
Epidemiologie HHT
Údaje o prevalenci HHT se v jednotlivých publikacích liší. Mezinárodní doporučení pro léčbu HHT z roku 2020 uvádí prevalenci 1 případ na 5000 osob, neboli 20/100 000 (1). Jiná recentní epidemiologická studie z USA uvádí postupně se zvyšující prevalenci z 6,1/100 000 na 12,1/100 000 osob, přičemž nejvyšší nárůst pozorovali ve věkové skupině 18 až 29 let a pak u osob starších 60 (3).
Pokud bychom aplikovali výše uvedená epidemiologická data, tak by v ČR mohlo žít 1 200 až 2 000 osob mezi 10 mil. obyvatel. Vlastní data z ČR neznáme.
U pacientů bez odpovídajícího skríninku cévních malformací a jejich léčby tato choroba signifikantně zkracuje délku života. To dokládá retrospektivní studie z centra ve Winnipegu (Kanada), která zahrnuje 225 pacientů s HHT, z nichž 95 % neprošlo skríninkovými vyšetřeními pro postižení orgánů, a 225 kontrolních osob bez HHT. Jednalo se o stejně postižené rodiče pacientů s HHT sledovaných v centru ve Winnipegu. Medián délky života pacientů s HHT byl 73,3 roku, zatímco v kontrolní skupině byl 76,6 let. Osoby s ACVRLK1 mutací měly normální délku života, zatímco pacienti s mutací endoglinu zemřeli o 7,1 roku dříve než kontrolní osoby. (p = 0,024). Ženy s mutací endoglinu měly délku života o 9.3 roku kratší než ženy kontrolní skupiny (p = 0,04) (4). Hlavně neošetřené cévní malformace v mozku mohou způsobovat předčasnou smrt (5).
Pro další analýzu z Winnipegu byly vybrány osoby s HHT, které byly sledovány a léčeny ve specializovaných centrech pro tuto nemoc. V této skupině nepopisují statisticky signifikantní rozdíly v délce přežití, ve skupině s HHT byla očekávaná délka života 75,9 roku, v kontrolní skupině 79,3 roku. Uvádějí, že chronické gastrointestinální krvácení, anémie a symptomatické jaterní cévní malformace jsou stále asociovány se zvýšenou mortalitou oproti průměrné populaci. Naproti tomu při odpovídajícím skríninku a léčbě PAVM a CAVM již nezpůsobují zvýšenou mortalitu (6).
Patofyziologie a diagnostická kritéria HHT
HHT je charakterizována postupnou tvorbou nových a teleangiektázií, které postihují kůži, slizniční povrchy, plíce, mozek, celou trávicí trubici (gastrointestinální trakt) a játra, lze je však detekovat v kterémkoliv orgánu. Teleangiektázie vznikají z dilatovaných postkapilárních venul, které se rozšiřují a anastomozují se sousedícími arteriolami, takže nakonec krevní tok neteče přes kapiláry, ale rovnou přes nově vytvořenou arteriovenózní komunikaci. Tyto morfy mohou tvořit diskrétní izolované arteriovenózní malformace (AVM), nebo se mohou slévat do difúzních AVM či ploch s difuzními teleangiektáziemi.
Prvním příznakem nemoci obvykle bývá epistaxe. První ataky epistaxe přicházejí u postižených osob po dvanáctém roce života a ve 40 letech již trpí epistaxí 100 % postižených. Interval od první epistaxe do výsevu viditelných teleangiektázií v obličeji, v ústech a na končetinách se pohybuje mezi 5–30 roky. Pacienti často udávají, že viditelných teleangiektázií si všimli obvykle až ve třetí dekádě života (7).
AVM postihují individuálně v různé míře všechny orgány. Plicní parenchym (PAVM) bývá postižen u 33 % pacientů, trávicí trubice (jícen a gastrointestinální trakt) u 44 %) a játra (HAVM) u 17 % nemocných. Postižení mozku (CAVM) bývá diagnostikováno až u 15–23 % nemocných (7).
Pro stanovení diagnózy byla v roce 2000 přijata klinická kritéria uvedená v tabulce 1, která jsou stále platná i v roce 2021. V publikacích se označují jako „Curaçao criteria“. Tato kritéria jsou založena čistě na klinice, nevyžadují genetickou či molekulárně biologickou analýzu, i když i tato možnost detekce nemoci existuje (8).
Table 1. Diagnostická kritéria hereditární hemoragické teleangiektázie „Curaçao criteria“ dle Shovlina (8) poprvé zveřejněná v roce 2000 a v roce 2021 stále platná 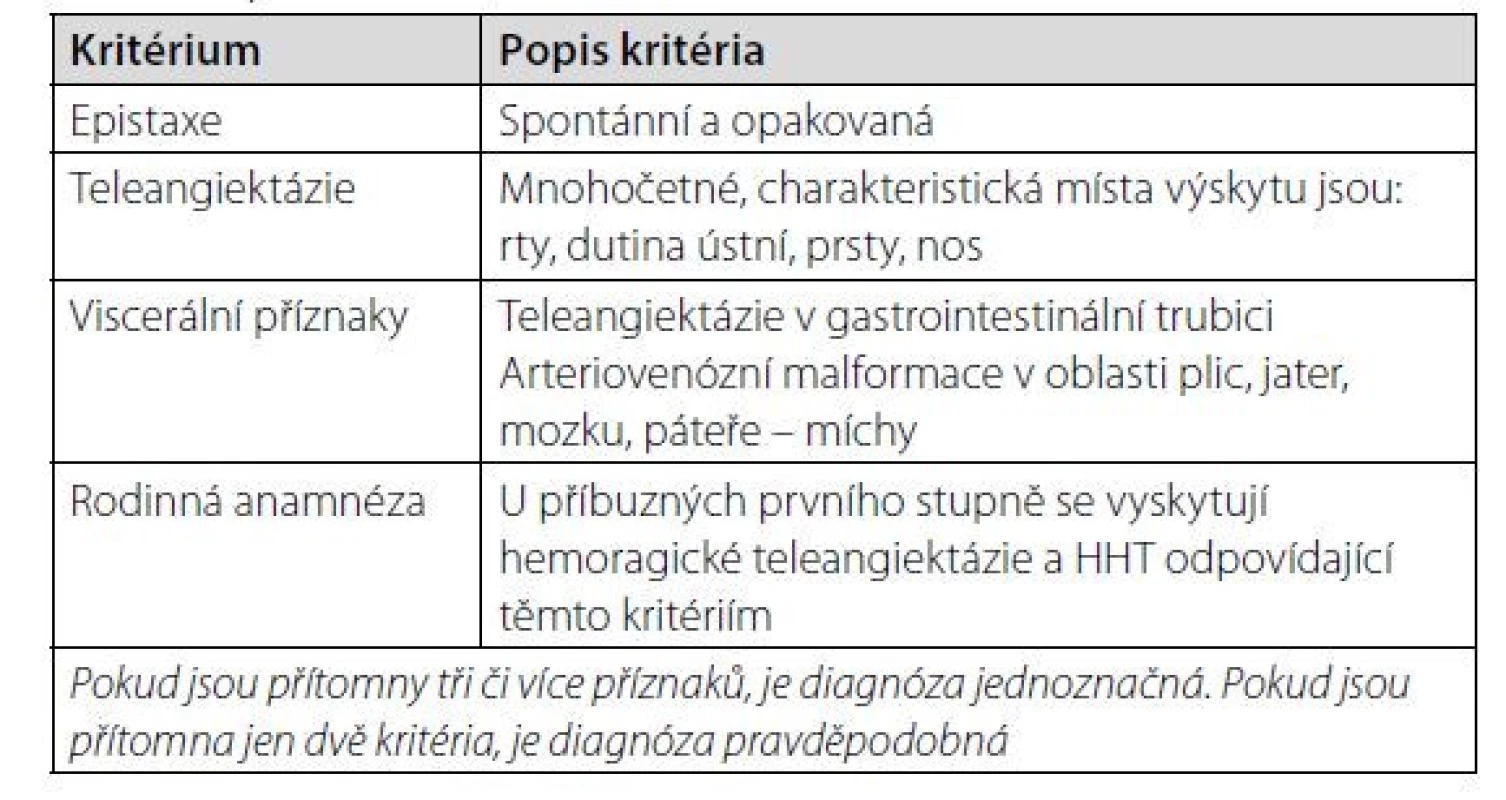
Genetická a molekulárně biologická klasifikace
HHT je autosomálně dominantě dědičná choroba. Sporadické mutace vedoucí k této nemoci jsou řídké. Většinu případů (87 %) tvoří dva typy níže popsaných genetických poruch, v současnosti je však známo pět genetických defektů, které mohou tento způsobit klinické projevy HHT:
HHT typ 1 je důsledkem mutace genu pro endoglin (ENG),
HHT typ 2 je důsledkem mutace genu nazvaného: activin receptor-like kinase 1 gene (ACVRLK1).
V současnosti je známo 470 variant mutací ENG a 375 variant mutací ACVRLK1 genu. Pokud je vyšetření mutací ENG and ACVRLK1 negativní, je třeba provést sekvenování Smad4 genu (SMAD4, MADH4). Mutace v tomto genu jsou nalézány u 1 až 2 % případů HHT. Existuje totiž překryvný syndrom HHT a juvenilní polypózy (juvenile polyposis-HHT overlap syndrome) s mutací Smad4 genu, který tvoří asi 1–2 % všech HHT případů v populaci. Tyto tři geny kódují proteiny pro signální cestu transforming growth factor-beta (TGF-β). Přesný mechanismus, jak tyto genetické defekty ovlivňují angiogenezi, není znám. Pravděpodobně naruší rovnováhu proangiogenní a antiangiogenní signalizace v cévách ve prospěch proangiogenní.
HHT typ 3 je asociován s mutací v lokusu 5q31.3-q32,
HHT typ 4 je asociován s mutací v lokusu 7p14.
U HHT typu 3 a 4 zatím nejsou definovány specifické geny, k jejich změně dochází při uvedené mutaci,
HHT typ 5 je dáván do souvislosti s mutací „growth differentiation factor 2 gene (GDR-2, BMP-9), která se také podílí na angiogenezi, byla popsána u osoby s vaskulárními anomáliemi podobnými HHT (9, 10, 11).
PAVM a CAVM jsou častější u HHT typu 1 (HHT-1), zatímco HAVM a plicní hypertenze jsou častěji pozorovány u typu HHT typu 2 (HHT-2). V míře gastrointestinálního krvácení se HHT-1 a HHT-2 neliší (12). Analýza z roku 2020 uvádí, že PAVM jsou diagnostikovány asi u 60 % pacientů s HHT-1 a jen u 5–10 % pacientů s HHT-2. CAVM jsou diagnostikovány u 8–16 % pacientů s HHT-1 jen u 0,5–1,5 % pacientů s HHT-2. (10).
Znalost mutace, která způsobila HHT, nemá žádný vliv na rozsah skríninkových vyšetření a léčebných postupů u individuálních pacientů. Jedinou výjimkou z tohoto pravidla jsou pacienti s překryvným syndromem juvenilní polypózy a HHT, kteří vyžadují pravidelné kolonoskopické prohlídky (skrínink) kolorektálního karcinomu. Dále u nich byly popsány i další defekty, rozšíření kořene aorty, chlopenní insuficience a aortální disekce (1, 2, 10,12).
Orgánové projevy HHT
Anémie z nedostatku železa
Tento typ anémie běžně provází HHT. Příčinou jsou krevní ztráty krvácením ze sliznic zažívacího traktu, případně z nosní sliznice. Asi u 5 % pacientů dochází k závažným hemoragiím z uvedených sliznic. V krevním obraze je pak mikrocytární anémie s nízkou hladinou ferritinu i železa.
Ferritin však nemusí u těchto pacientů vždy spolehlivě odrážet dostatek či nedostatek železa v organismu, protože často tito pacienti mívají zánětlivou reakci organismu a tím i zánětem zvýšenou hladinu ferritinu (7).
Krvácející teleangiektázie v nosní sliznici
Nemoc obvykle začíná krvácením z nosu, které je způsobeno postižením nosní sliznice teleangiektáziemi. Krvácení zpočátku nenápadné se stále opakuje ve větší a větší intenzitě a v pokročilých stadiích nemoci může být tak intenzivní, že ohrozí život nemocného vykrvácením (1, 2, 7). Teleangiektazie sice jsou viditelné i na kůži rukou, ale kožní projevy obvykle nepůsobí komplikace. Podrobnosti uvádí Nevoralová (13).
Cerebrovaskulární a spinální arteriovenózní malformace (CAVM a SAVM)
CAVM mohou způsobit epilepsii, transitorní cévní mozkové příhody, případně závažné mozkové příhody anebo krvácivé komplikace v oblasti mozku a míchy. Mozek mimoto může být postižen vaskulárními emboly při PAVM, jak je dále uvedeno. V oblasti mozku a míchy bývají u pacientů s dlouhodobějším průběhem HHT detekovány CAVM a SAVM až v 15–23 %. Proto se doporučuje provádět u pacientů s klinickými příznaky této nemoci screeningové vyšetření pomocí magnetické rezonance (MR), případně MR angiografie (MRA) které může odhalit potenciálně léčitelné CAVM v CNS, které by při spontánním krvácení mohly poškodit svého nositele (způsobit krvácení či kompresi nervové tkáně, což způsobí bolest hlavy anebo další neurologické příznaky). CT zobrazení v této indikaci se již nepoužívá pro vyšší radiační dávku a nižší rozlišení). Konvenční katetrizační angiografie je nahrazena MR, snad s výjimkou takzvaných mikroAVM.
Riziko krvácení z CAVM se u těchto pacientů uvádí 0,5 % za rok. Standardním postupem pro diagnostiku je MR angiografie, případně s aplikací kontrastní látky (gadolinia).
Pokud se prokáže CAVM, která by mohla ohrozit svého nositele, pak je na zvážení neurochirurgická resekce, stereotaktické radiochirurgické ošetření, embolizace nebo kombinace těchto postupů (14, 15).
Plicní arteriovenózní malformace (PAVM)
PAVM se objevují asi u 33 % (7), jiné práce udávají jiné frekvence této komplikace (15–50 %) (1, 2, 3) pacientů s HHT . Ze všech diagnostikovaných PAVM je asi 70 % způsobeno touto nemocí, a proto by se u všech pacientů, u nichž se diagnostikují PAVM, mělo pomýšlet právě na tuto chorobu. PAVM mohou způsobit:
septické či sterilní emboly směřující do mozku mozku a dalších orgánů s následujícím poškozením,
hemoptýzu,
dušnost,
hypoxemii.
Tím, že cévní malformace umožní průtok krve přímo z arterioly do plicní žíly, bez nutnosti projití plicními kapilárami, se naruší filtrační efekt plicního kapilárního řečiště. Bakterie, ale i tromby, případně infikované mikrotromby mohou projít PAVM do systémového oběhu, aniž by uvízly v plicní kapilární síti a způsobit závažné komplikace. K typickým patří mozkové abscesy či uzávěr mozkových tepen s odpovídajícími neurologickými příznaky. Z tohoto důvodu se doporučuje u těchto pacientů antibiotická profylaxe při všech výkonech, kdy by mohla vzniknout bakteriemie.
Vzhledem ke své vzácnosti se pořád stává, že tato choroba zůstane dlouho nerozpoznána. Z toho důvpdu je diagnóza této nemoci někdy stavena až v době vzniku mozkových abscesů, jak popsal v naší literatuře Polák v roce 2012 a Hanoun v roce 2015 (16, 17).
Další komplikací, kterou mohou PAVM způsobit, je hemoptýza. V případě umístnění PAVM v blízkosti pleurální dutiny může vzniknout hemotorax (18, 19).
U pacientů s HHT s nebo bez průkazu PAVM může vzniknout plicní hypertenze, kterou lze jen obtížně řešit (20, 21).
V případě závažného zkratu může hypoxemie v oblasti ledvin způsobit polyglobulii, která se nesmí zaměnit s primární polycytemií.
Proto se má provést u nově diagnostikovaných pacientů s HHT vhodný dostupný skrínink AVM od horní hrudní apertury pod úroveň bránice metodou CT zobrazení s cílem detekovat PAVM, a pokud jsou prokázány a pokud je průměr přívodné arterie do aneurysmatu nejméně 3 mm, zvážit lokální (embolizační) léčbu.
Zkušenosti s diagnostikou a léčbou PAVM se opakovaně publikovali i čeští autoři (22, 23, 24).
Kardiální problémy způsobené arteriovenózními malformacemi
Arteriovenózní spojky (nejčastěji HAVM) zkracují, a tedy zrychlují krevní oběh. Hyperkinetický oběh může vést k srdečnímu selhání. Klinické příznaky jsou podobné jako u srdečního selhání jiné etiologie: netolerance námahy, dušnost, únava. Laboratorním průkazem je srdeční výdej vyšší než 8 litrů/minutu, nebo kardiální index větší než 3,9 litrů/minutu/m2, ejekční frakce větší než 50 % a saturace venózní krve kyslíkem větší než 75 %. V důsledku hyperkinetického oběhu může dojít i k dilataci vaskulárního řečiště. Pokles rezistence zvyšuje tepovou frekvenci a minutový srdeční výdej. A to vše může vyústit do srdečního selhání při zvýšeném minutovém výdeji. Anémie může přispět k akceleraci tachykardie a zvýšení minutového objemu a přispět tak k srdečnímu selhání (25, 26). V české literatuře byla popsána kvantifikace pravo-levého zkratu u pacientky s mnohočetnými PAVM (27).
Gastrointestinální krvácení
Asi 80 % pacientů s HHT má teleangiektázie v žaludku a v tenkém střevě. Jsou dobře viditelné při endoskopickém vyšetření. V klinické studii bylo také prokázáno, že značný přínos má vyšetření polknutou videokapslí (28), ale lze použít i další metody, jak je popisuje česká (29–32) i mezinárodní literatura.
Teleangiektázie v žaludku, duodenu a v tenkém střevě jsou častější než teleangiektázie ve střevě tlustém. Symptomatické krvácení ze zažívacího traktu se však udává jen u 30 % pacientů, a to obvykle až po začátku páté životní dekády. Před 40. rokem bývá krvácení do trávicího traktu vzácné, není však vyloučené. Ztráty krve do trávicí trubice obvykle bývají malé, takže na prstu lékaře vyšetřujícího per rectum obvykle nezůstává stolice charakteru melény. Ztráty jsou však trvalé, a proto jsou příčinou hypochromní anémie.
Krvácení do trávicí trubice z teleangiektázií obvykle nezpůsobuje jiné symptomy než hypochromní anémii. Zpočátku je anémie řešitelná substitucí železem, ať již perorálně nebo nitrožilní cestou. Pokud ale ztráty krve přesáhnou kompenzační schopnosti kostní dřeně, je nutné řešit tuto ztrátovou anémii krevními transfuzemi. Výjimečné je masivní krvácení do trávicí trubice, které může být příčinou smrti. Vhledem k rozsahu postižení trávicí trubice nelze vždy pro léčbu mnohočetných žaludečních a střevních teleangiektázií použít embolizační léčbu (33–35).
Hepatální arteriovenózní malformace (HAVM)
Zajímavé je, že játra bývají nejčastěji postižena vaskulárními malformacemi, které mohou způsobovat portovenózní, arteriovenózní a arterioportální zkratový krevní oběh (shunting). HAVM se popisuje u 17 % nemocných, ale opět rozptyl frekvence HAVM udávaný různými publikacemi je velký.
Cévní malformace v játrech mohou způsobit následující příznaky:
selhání srdce při hyperkinetickém oběhu, neboli „hight output cardic failure“,
portální hypertenzi i se selháním jater,
biliární nekrózu.
Jaterní AVM jsou časté, ale nemusí vždy způsobovat nápadné symptomy. Klinické příznaky odvisí od typu AVM, zda se arterie spojí s jaterní žílou, odvádějí krev z jater směrem k srdci, nebo zda se arterie spojí s portální žílou, přivádějící krev z trávicího traktu do jater. Spojky mezi hepatálními arteriemi a hepatálními žílami způsobují hyperkinetický oběh. Naproti tomu spojky mezi hepatálními arteriemi a portálními žílami způsobují portální hypertenzi. Důsledkem je ascites a případně krvácení z portokaválních varixů. Arteriovenózní zkraty mohou způsobit ischemii biliárních cest s následnou nekrózou a sklerotizující cholangitidou.
Proto je důležité u pacientů s HHT po těchto AVM cíleně pátrat. Metodou volby je ultrazvukové vyšetření. Při podezření na tuto komplikaci vyšetření pomocí CT či MR s aplikací kontrastní látky anebo selektivní angiografií dále upřesní rozsah poškození a určí, zda se dominantně jedná o arteriální zkrat s hepatální nebo s portální žílou, což je klíčové pro typ vznikajících symptomů. Mohou tak být detekovány i další komplikace, jako je sekundární poškození žlučových cest (36, 37, 38).
Další komplikace HHT
K méně častým komplikacím patří tromboembolické komplikace, plicní hypertenze, poškození jater, rizikové gravidity a spinální komplikace. Riziko úmrtí v průběhu gravidity je 1 % na krvácení do plic či do mozku z existujících AVM. Pacienti také trpí psychicky, protože nekontrolovaná krvácení je stigmatizují ve společnosti. Proto mají problémy cestovat, mohou trpět sociofobií, izolací, anxietou a depresivními poruchami (7). Proto je nutno u nich vhodné při kontrole položit otázky cílené k rozpoznání psychické poruchy.
Základní diagnostická vyšetření a sledování nemocných
Koagulační vyšetření
Každý pacient musí mít kromě základního krevního obrazu (trombocyty) i podrobně vyšetřené koagulační parametry. Další krvácivá porucha by mohla výrazně zhoršit krvácivé projevy při této závažné diagnóze. Základem je: protrombinový čas (PT), aktivovaný parciální tromboplastinový čas (APTT), trombinový čas (TT) a vyšetření koncentrace fibrinogenu a k tomu vyšetření fibrinolýzy (euglobulinová lýza a retrakce koagula, případně tromboelastografické vyšetření. Došetřování koagulační aktivity jednotlivých koagulačních faktorů má význam v případě, že je prodloužený protrombinový nebo aktivovaný parciální tromboplastinový čas. V případě krvácivých komplikací má význam vyšetřování primární hemostázy – PFA 100, agregace trombocytů, vyloučení m. von Willebrand (vWF:RCO, AgvWF, FVIII), případně i FXIII. V případě patologické fibrinolýzy i vyšetření plazminogenu a alfa2antiplazminu (1, 2, 7).
Vyhledávání arteriovenózních malformací
Optimální péče a léčba pacientů s HHT by měla v sobě zahrnovat:
skrínink přítomnosti arteriovenózních malformací v těle nemocného a jejich řešení,
léčbu hemoragických a dalších komplikací HHT. Pokroky ve farmakologické léčbě uvedeme v dalším článku.
V tomto článku zmíníme pouze skrínink cévních malformací. Pro skrínink PAVM lze použít transtorakální kontrastní echokardiografii. Zlatým standardem detekce PAVM je počítačová tomografie. Klasická plicní angiografie není v dnešní době prováděna jako primární diagnostické vyšetření, je až součástí embolizační léčby PAVM.
Pro detekci HAVM se používá ultrasonografie, která má dostatečně vysokou senzitivitu pro detekci AVM. Blíže lze cévní malformace posoudit pomocí kontrastního CT. Z dalších metod lze použít selektivní angiografii jaterní tepny, tato však není pro svou invazivitu metodou první volby.
Pro skrínink CAVM je nutno MR a MRApoužít CT mozkovou angiografii, lépe však kontrastní MR mozku s možným provedením MR angiografie, stejně tak lze provést i klasickou angiografii mozkových tepen (1, 2, 7).
V ČR není publikováno doporučení pro skrínink pacientů s HHT odbornou společností. Proto zde uvedeme protokol, který používají specializovaná centra v Kanadě (6, 39).
Kontrola u lékaře obeznámeného s HHT 1x ročně. Kontrola má obsahovat klasické fyzikální vyšetření, doplněné cíleným hledání nových mukokutánních teleangiektázií, pátrání po epistaxích a po krvácení do trávicí trubice, cílené pátrání po dušnosti, úbytku fyzické tolerance a hemoptýze a také vyhledávání neurologických příznaků.
Každoročně se má vyšetřit stolice na okultní krvácení.
Každoročně vyšetření krevního obrazu, ale nejen krevní obrazu, ale i železa a ferritinu v séru a saturace transferinu s cílem odhalit nově nastupující anémii. Případně častější kontroly krevního obrazu dle anamnestických údajů o krvácivých projevech. Podrobnější vyšetření zažívacího traktu se indikují u pacientů s anémií nekorelující s tíží epistaxe.
Vyšetření pulsním oxymetrem 1–2x ročně v dětství jako skrínink arteriovenózních malformací. Kontrastní echokardiografické vyšetření je doporučeno v případech, kdy saturace kyslíkem poklesne pod 97 %, a v případně nálezu patologie na echokardiografickém vyšetření má následovat CT hrudníku.
Kontrolní echokardiografické vyšetření s cílem detekce PAVM u pacientů starších 10 let, s následným CT hrudníku, pokud je podezření na PAVM.
U dospělých je saturace krve kyslíkem ovlivňována dalšími možnými patologiemi, a tak je doporučována transtorakální kontrastní echokardiografie (TTCE) v rámci skríninku pravolevého zkratu při PAVM. V případě středního či závažného zkratu dle TTCE pak CT hrudníku.
V případně embolizace PAVM následuje vyšetření krevních plynů a CT po 6 měsících a pak se opakuje u embolizovaných pacientů po 3 až 5 letech cílem detekovat progresi původní PAVM nebo vznik nové PAVM.
Skríninkové vyšetření hepatálních arteriovenózních malformací (HAVM) se v rámci rutinního sledování nedoporučuje, měl by se ale provést, pokud jsou odpovídající klinické příznaky. Skrínink HAVM indikují v případně zvýšených jaterních enzymů, případně dušnosti nebo symptomů spojených s poškozením jater nebo high-output srdečním selháním.
V případně klinicky či geneticky potvrzené HHT se doporučuje u dospělých pacientů vyšetření cílené na případné CAVM pomocí MR mozku a následně pokud vznikne v průběhu let podezření. Citované doporučení neuvádí žádné časové intervaly pro opakování MR mozku, ale protože vše se vyvíjí, tak negativní nález na vstupním MR mozku neznamená, že za 10 či více let se nevyvine CAVM. V případě embolizační léčby CAVM se doporučuje reskrínink vždy po 5 letech.
Screeningová vyšetření dalších orgánů se provádějí pouze v případech klinického podezření.
Uvedené intervaly kontrolních vyšetření jsou vždy orientační, dle individuální závažnosti HHT se intervaly skríninkovými vyšetřeními upravují. HHT je spojena s rozvojem arteriovenózních cévních malformací, které ohrožují život svého nositele. Proto je nutné po nich cíleně pátrat a při jejich průkazu zvážit další kroky dle recentních léčebných doporučení (1, 2, 6, 39).
Skríninku arteriovnózních poruch je věnováno hodně literatury z Evropských zemí, jak ilustrují citace (40–47). Kilian zveřejnil v roce 2021 článek s názvem „Screening for pulmonary and brain vascular malformations is the North American standard of care for patients with hereditary hemorrhagic telangiectasia (HHT)“ (41). A tak by skrínínk arteriovenózích malformací bylo vhodné provádět i u našich pacientů. A pro nemocné by asi bylo přínosné, kdyby se ustanovila centra, která by systematicky poskytovala všestrannou péči těmto lidem, a to jak skrínink, tak i léčbu.
Závěr
HHT začíná velmi nenápadně. Je na ni nutno pomyslet u pacientů s opakovanou epistaxí, a pokud se ji podaří diagnostikovat, měli by tito nemocní mít systematickou péči, která sestává ze skrínigových vyšetření postupně vznikajících AVM a jejich léčby a pak z léčby akutních komplikací, obvykle krvácení.
KORESPONDENČNÍ ADRESA AUTORA:
prof. MUDr. Zdeněk Adam, CSc.
Interní hematologická a onkologická klinika, LF MU a FN Brno, Jihlavská 20, 625 00 Brno
Cit. zkr: Vnitř Lék 2021; 67(6): 339–344
Článek přijat redakcí: 5. 5. 2021
Článek přijat po recenzích: 31. 8. 2021
Sources
1. Faughnan ME, Mager JJ, Hetts SW et al.Second International Guidelines for the Diagnosis and Management of Hereditary Hemorrhagic Telangiectasia. Ann Intern Med. 2020; 173(12): 989–1001. doi: 10.7326/M20–1443.
2. Al-Samkari H. Hereditary hemorrhagic telangiectasia: systemic therapies, guidelines, and an evolving standard of care. Blood. 2021;137(7):888–895. doi: 10.1182/blood. 2020008739.
3. Ferry AM, Wright AE, Baillargeon G et al. Epidemiology and Trends of Hereditary Hemorrhagic Telangiectasia in the United States. Am J Rhinol Allergy. 2020; 34(2): 230–237. doi: 10.1177/1945892419886756.
4. de Gussem EM, Edwards CP, Hosman AE et al. Life expectancy of parents with Hereditary Haemorrhagic Telangiectasia. Orphanet J. Rare Dis. 2016; 11 : 46. doi: 10.1186/s13023 – 016–0427-x.
5. Thompson KP, Nelson J, Kim H et al. Brain Vascular Malformation Consortium HHT Investigator Group. Predictors of mortality in patients with hereditary hemorrhagic telangiectasia. Orphanet J Rare Dis. 2021; 16(1): 12. doi: 10.1186/s13023–020–01579–2.
6. de Gussem EM, Kroon S, Hosman AE et al. Hereditary Hemorrhagic Telangiectasia (HHT) and Survival: The Importance of Systematic Screening and Treatment in HHT Centers of Excellence. J Clin Med. 2020; 9(11): 3581. doi: 10.3390/jcm9113581.
7. Kritharis A, Al-Samkari H, Kuter DJ. Hereditary hemorrhagic telangiectasia: diagnosis and management from the hematologist's perspective. Haematologica. 2018; 103(9): 1433–1443.
8. Shovlin CL, Guttmacher AE, Buscarini E et al. Diagnostic criteria for hereditary hemorrhagic telangiectasia (Rendu-Osler-Weber syndrome) Am J Med Genet. 2000; 91 : 66–67.
9. Snellings DA, Gallione CJ, Clark DS et al. Somatic Mutations in Vascular Malformations of Hereditary Hemorrhagic Telangiectasia Result in Bi-allelic Loss of ENG or ACVRL1. Am J Hum Genet. 2019; 105(5): 894–906.
10. Shovlin CL, Simeoni I, Downes K et al. Mutational and phenotypic characterization of hereditary hemorrhagic telangiectasia. Blood. 2020; 136(17): 1907–1918. doi: 10.1182/ blood.2019004560.
11. McDonald J, Wooderchak-Donahue W et al. Hereditary hemorrhagic telangiectasia: genetics and molecular diagnostics in a new era. Front Genet. 2015; 6 : 1. doi: 10.3389/ fgene.2015.00001.
12. Garg N, Khunger M, Gupta A, Kumar N. Optimal management of hereditary hemorrhagic telangiectasia. J Blood Med. 2014; 5 : 191–206. doi: 10.2147/JBM.S45295.
13. Nevoralová Z. Teleangiectasia hereditaria haemorrhagica. Dermatologie pro praxi. 2007; 1(3): 130–131.
14. Brinjikji W, Iyer VN, Yamaki V et al. Neurovascular Manifestations of Hereditary Hemorrhagic Telangiectasia: A Consecutive Series of 376 Patients during 15 Years. AJNR Am J Neuroradiol 2016; 37(8): 1479–1486.
15. Chowdhury FN, Chandrarathne GS, Masilamani KD et al. Between Strokes and Hereditary Hemorrhagic Telangiectasia: A Population-Based Study. Can J Neurol Sci. 2019; 46( 1): 44–50.
16. Hanoun G, Vybíhal V, Sova M et al. Absces mozku jako první klinická manifestace hereditární hemoragické teleangiektázie – tři kazuistiky. Česká a slovenská neurologie a neurochirurgie. 2015; 78(3): 348–353.
17. Polák P, Snopková S, Husa P. Polymikrobieller Hirnabszess bei hereditärer hämorrhagischer Teleangiektasie (Morbus Osler). Deutsche Medizinische Wochenschrift. 2012; 137(33): 1635–1638.
18. Tellapuri S, Park HS, Kalva SP. Pulmonary arteriovenous malformations. Int J Cardiovasc Imaging. 2019; 35(8): 1421–1428.
19. Dupuis-Girod S, Cottin V, Shovlin CL. The Lung in Hereditary HemorrhagicTelangiectasia. Respiration. 2017; 94(4): 315–330.
20. Yokokawa T, Sugimoto K, Kimishima Y e al. Pulmonary Hypertension and Hereditary Hemorrhagic Telangiectasia Related to an ACVRL1 Mutation. Intern Med. 2020; 59(2): 221–227.
21. Harder EM, Fares WH. Hospitalizations with hereditary hemorrhagic telangiectasia and pulmonary hypertension in the United States from 2000 to 2014. Respir Med. 2019; 147 : 26–30.
22. Lischke R, Pafko P, Šimonek J et al. Bilateral pulmonary arteriovenous malformations in patient with Rendu-Osler-Weber disease European journal of cardio-thoracic surgery. 2004; 25(3): 461–463.
23. Takáč M, Koval Š, Klimčík J. Hereditárne hemoragické teleangiektázie s narastaním arteriovenóznych fistúl po 24 rokoch. Vnitřní lékařství. 1997; 43(9): 599–601.
24. Žurková M, Köcher M, Kolek V. Problematika plicních arteriovenózních zkratů. Studia pneumologica et phtiseologica. 2002; 62(1): 33–35.
25. Olsen LB, Kjeldsen AD, Poulsen MK et al. High output cardiac failure in 3 patients with hereditary hemorrhagic telangiectasia and hepatic vascular malformations, evaluation of treatment. Orphanet J Rare Dis. 2020; 15(1): 334. doi: 10.1186/s13023–020–01583–6.
26. Wu PR, Horwith A, Mai S et al. High-Output Cardiac Failure Due to Hereditary Hemorrhagic Telangiectasia: A Case of an Extra-Cardiac Left to Right Shunt. Int J Angiol. 2017; 26(2): 125–129.
27. Doležal J. Kvantifikace pravo-levého zkratu u pacientky s mnohočetnými plicními arteriovenózními malformacemi v rámci hemoragické hereditární teleangiektázie pomocí celotělové scintigrafies 99mTc-makroagregátem. Vnitřní lékařství. 2008; 54(2): 206–209.
28. Singh K, Zubair A, Prindle A et al. Diagnostic yield of capsule endoscopy for small bowel arteriovenous malformations in patients with hereditary hemorrhagic telangiectasia: a systematic review and meta-analysis. Endosc Int Open 2019; 7(2): E282-E289. doi: 10.1055/a-0799–9820.
29. Doležal J, Vižďa J, Kopáčová M et al. Lokalizace zdroje recidivujícího krvácení v tenkém střevě u hemoragické hereditární teleangiektazie pomocí scintigrafie s in vivo označenými erytrocyty pomocí 99mTc-pertechnetátu. Vnitřní lékařství. 2005; 51(5): 583–587.
30. Doležal J, Vižďa J, Bureš J. Přínos scintigrafie s autologními označeními erytrocyty k určení místa krvácení v tenkém střevě. Folia gastroentrerologica et hepatologica. 2004; 2(1): 13–20.
31. Doležal J, Vižďa J, Kopáčová J et al. Lokalizace zdroje recidivujícího krvácení v tenkém střevě u hemoragické hereditární teleangiektazie pomocí scintigrafie s in vivo označenými erytrocyty pomocí 99mTc-pertechnetátu Vnitřní lékařství. 2005; 51(5): 583–587.
32. Cihlář F, Laštůvka J, Krajina A et al. Multidetektorové CT v diagnostice zdroje recidivujícího gastrointestinálního krvácení. Česká radiologie. 2009; 63(2): 159–162.
33. Tortora A, Riccioni ME, Gaetani E et al.. Rendu – Osler-Weber disease: a gastroenterologist's perspective. Orphanet J Rare Dis. 2019; 14(1): 130. doi: 10.1186/s1301
34. Welle CL, Welch BT, Brinjikji W et al. Abdominal manifestations of hereditary hemorrhagic telangiectasia: a series of 333 patients over 15 years. Abdom Radiol (NY). 2019; 44(7): 2384–2391.
35. Jackson SB, Villano NP, Benhammou JN et al. Gastrointestinal Manifestations of Hereditary Hemorrhagic Telangiectasia (HHT): A Systematic Review of the Literature. Dig Dis Sci. 2017; 62(10): 2623–2630.
36. Harwin J, Sugi MD, Hetts SW et al. The Role of Liver Imaging in Hereditary Hemorrhagic Telangiectasia. J Clin Med. 2020; 9(11): 3750. doi: 10.3390/jcm9113750.
37. Černý E, Hušek K, Studeník P et al. Uncommon vascular transformation in explanted liver. Scripta medica Facultatis medicae Universitatis Brunensis Masarykianae. 1999; 72(2/3): 97–102.
38. CURA MA, Postoak D, Speeg VK et al. Transjugular Intrahepatic Portosystemic Shunt for Variceal Hemorrhage due to Recurrent of Hereditary Hemorrhagic Telangiectasia in a Liver Transplant. 2010; 21(1): 135–139.
39. Gran´Maison A. Hereditary hemorrhagic telangiectasia. Canadian Medical Assotiation Journal Praktice 2009; 180(8): 833–835.
40. Soysal N, Eyries M, Verlhac S et al. Non-invasive CT screening for pulmonary arteriovenous malformations in children with confirmed hereditary hemorrhagic telangiectasia: Results from two pediatric centers. Pediatr Pulmonol. 2017; 52(5) :642–649. doi: 10.1002/ppul.23649.
41. Kilian A, Clancy MS, Olitsky S et al. Screening for pulmonary and brain vascular malformations is the North American standard of care for patients with hereditary hemorrhagic telangiectasia (HHT): A survey of HHT Centers of Excellence. Vasc Med. 2021; 26(1): 53–55. doi: 10.1177/1358863X20974452.
42. Ribeiro E, Cogez J, Babin E et al. Stroke in hereditary hemorrhagic telangiectasia patients. New evidence for repeated screening and early treatment of pulmonary vascular malformations: two case reports. BMC Neurol. 2011; 11 : 84. doi: 10.1186/1471–2377–11–84.
43. Buscarini E, Danesino C, Olivieri C et al. Doppler ultrasonographic grading of hepatic vascular malformations in hereditary hemorrhagic telangiectasia – results of extensive screening. Ultraschall Med. 2004; 25(5): 348–55. doi: 10.1055/s-2004–813549.
44. Buscarini E, Buscarini L, Danesino C et al. Hepatic vascular malformations in hereditary hemorrhagic telangiectasia: Doppler sonographic screening in a large family. J Hepatol. 1997; 26(1): 111–118. doi: 10.1016/s0168–8278(97)80017–7.
45. Kjeldsen AD, Oxhøj H, Andersen P et al. Pulmonary arteriovenous malformations: screening procedures and pulmonary angiography in patients with hereditary hemorrhagic telangiectasia. Chest. 1999; 116(2): 432–4399. doi: 10.1378/chest.116.2.432.
46. Folz BJ, Wollstein AC, Alfke H et al. The value of screening for multiple arterio-venous malformations in hereditary hemorrhagic telangiectasia: a diagnostic study. Eur Arch Otorhinolaryngol. 2004; 261(9): 509–516. doi: 10.1007/s00405–003–0719–3.
47. Parra JA, Cuesta JM, Zarrabeitia R et al. Screening pulmonary arteriovenous malformations in a large cohort of Spanish patients with hemorrhagic hereditary telangiectasia. Int J Cardiol. 2016; 218 : 240–245. doi: 10.1016/j.ijcard.2016.05.065.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2021 Issue 6-
All articles in this issue
- HLAVNÍ TÉMA – PNEUMOLOGIE
- Respiratory insufficiency, chronic hypercapnia and domiciliary non-invasive ventilation from the point of view of a pneumologist
- Inhaled glucocorticoids in treatment of covid-19
- Nintedanib in the treatment of systemic rheumatic disease-associated interstitial lung disease
- Anti-cancer therapy-induced metabolic syndrome
- Hereditary hemorrhagic telangiectasia (Osler-Weber-Rendu syndrome) Part I. Pathophysiology, clinical symptoms and recommend screening for vascular malformations
- High-rank technology in the medicine – the impact of continuous glucose monitoring system alarm settings values on glycemic control in type 1 diabetes patients: a systematic review
- Complete remission of necrobiotic xanthogranuloma after disappearance of monoclonal immunoglobulin induced by bortezomib, lenalidomid and dexamethasone
- Localised forms of pulmonary amyloidosis
- Screening for gestational diabetes mellitus
- Why we still don’t achieve blood pressure targets
- Aktuální témata kardiovaskulární prevence
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Localised forms of pulmonary amyloidosis
- Respiratory insufficiency, chronic hypercapnia and domiciliary non-invasive ventilation from the point of view of a pneumologist
- Hereditary hemorrhagic telangiectasia (Osler-Weber-Rendu syndrome) Part I. Pathophysiology, clinical symptoms and recommend screening for vascular malformations
- Screening for gestational diabetes mellitus
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

