-
Medical journals
- Career
Delirium v intenzivní péči
Authors: Renata Černá Pařízková
Authors‘ workplace: Klinika anesteziologie, resuscitace a intenzívní medicíny LF UK a FN Hradec Králové
Published in: Vnitř Lék 2019; 65(6): 433-439
Category: Review
Overview
Delirium se u pacientů v intenzivní péči vyskytuje s vysokou prevalencí a je spojeno se zvýšením morbidity a mortality, horším dlouhodobým klinickým výsledkem a vyššími ekonomickými náklady. Článek se zabývá rozborem patofyziologie, rizikových faktorů a jednotlivých typů deliria u nemocných v intenzivní péči. V textu jsou uvedeny současné koncepty přístupu k pacientům v intenzivní péči s cílem včasné detekce, léčby a především prevence rozvoje delirantních stavů.
Klíčová slova:
delirium – intenzivní péče
Definice a epidemiologie deliria
Delirium je akutní kvalitativní porucha vědomí, která je tranzientní, zpravidla reverzibilní, s širokou symptomatologií neuropsychiatrických abnormalit. Mezi základní projevy patří porucha soustředění a udržení pozornosti, změny psychomotorické aktivity, porucha kognitivních funkcí, dezorientace, porucha spánku a vnímání včetně zrakových halucinací [1]. Charakteristická je proměnlivost v čase s rychlým rozvojem příznaků v horizontu minut až hodin. Delirium je multifaktoriální etiologie s ne zcela známou patofyziologií [1]. Prevalence deliria v běžné populaci činí kolem 1–2 %, výskyt se zvyšuje u hospitalizovaných pacientů. U pacientů na jednotkách intenzivní péče (JIP) je popisován výskyt deliria v rozmezí 16–90 %, u specifické populace po kardiochirurgických operacích je prevalence 10–73 % [2–5]. Široký rozptyl výskytu je dán především různou populací nemocných, variabilitou klinického sledování a rozdílnými screeningovými metodami. Delirium se v intenzivní péči (IP) vyskytuje častěji u starších nemocných [6] s maximem výskytu do prvních 48 hod od přijetí [7].
Typy deliria
V praxi rozeznáváme dle klinických projevů delirium hyperaktivní, hypoaktivní a smíšené. „Čisté“ hyperaktivní delirium se vyskytuje dle některých studií pouze do 2 % a je častější u mladších pacientů. Hyperaktivní delirium je charakterizováno agitovaností, slovní a fyzickou agresivitou, často halucinacemi a bludy, psychomotorickým neklidem s ohrožováním svého okolí i sebe sama. Tento typ deliria je snadno rozpoznatelný a zpravidla je na něj rychle a s různou efektivitou medikamentózně reagováno. Hypoaktivní typ se vyskytuje dle literatury u více než 40 % pacientů s deliriem, zvláště u pacientů ve vyšších věkových skupinách. Projevuje se apatií, letargií, spavostí a pasivitou pacienta. Hypoaktivní delirium je spojeno s vyšší mortalitou, je obtížně rozpoznatelné a často neléčené. U nejčastějšího smíšeného typu deliria se střídají obě fáze s různou intenzitou a délkou trvání [8].
Klinický význam deliria na JIP
Delirium má zásadní význam z hlediska krátkodobé i dlouhodobé prognózy pacientů. Výskyt a délka trvání deliria je nezávislým prediktorem krátkodobé i dlouhodobé mortality, doby pobytu na intenzivní péči, umělé plicní ventilace [9–11]. Delirium je spojeno s vyšším výskytem neplánovaných extubací, reintubací, odstranění katétrů, aspirací, nozokomiálních pneumonií a vyššími hospitalizačními náklady. Nemocní s deliriem mají rovněž vyšší výskyt kognitivních dysfunkcí, které dlouhodobě přetrvávají a riziko nutnosti institucionální péče [12].
Patofyziologie
Přestože patofyziologické mechanizmy vzniku deliria nejsou dostatečně známy, je předpokládán vliv lékové toxicity, zánětlivé reakce a akutní stresové odpovědi s poruchou neurotransmise [13] (tab. 1). Ve stavu deliria dochází k alteraci integrace a zpracování informací v mozku, na kterých se podílí dysbalance neurotransmiterů [14,15], dysfunkce endotelu cerebrálních cév, disrupce hematoencefalické bariéry s translokací neurotoxických molekul, dysbalance prozánětlivých a protizánětlivých mediátorů. Snížení cholinergní aktivity je jednou z patofyziologických hypotéz vzniku deliria, je prokázána korelace mezi předoperační hodnotou aktivity plazmatické cholinesterázy a zánětlivých mediátorů u pacientů podstupujících plánovanou artroplastiku, u kterých došlo k rozvoji deliria [16]. K dalším neurotransmiterům a biomarkerům, které jsou spojovány s rozvojem deliria, patří dopamin, kortizol, γ-aminomáselná kyselina (GABA), glutamát, 5-hydroxytryptamin, noradrenalin. Data Pisaniho podporují asociaci GABA mechanizmu a zvýšení trvání deliria při použití benzodiazepinů u kriticky nemocných pacientů starších 60 let [17].
Table 1. Patofyziologické mechanizmy rozvoje deliria 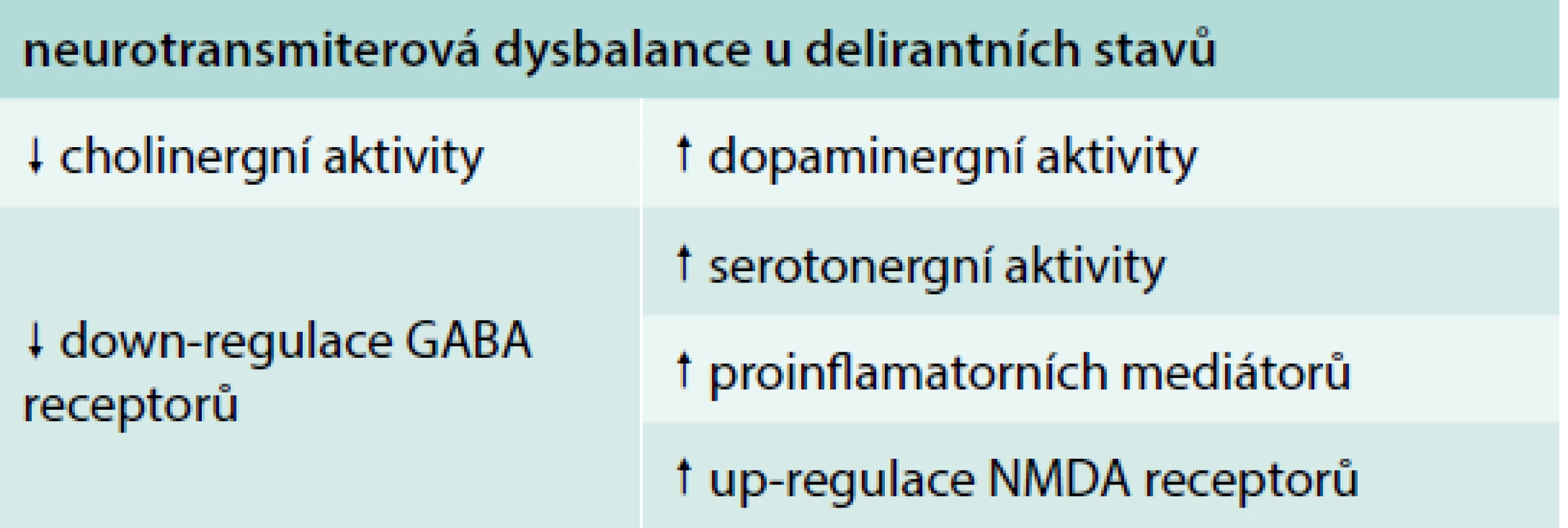
Rizikové faktory
Mezi základní rizikové faktory, které jsou spojeny s rozvojem deliria na JIP, patří dle recentních odborných doporučení preexistující demence, arteriální hypertenze, alkoholizmus a závažnost kritického stavu [18]. V klinické praxi lze rozdělit rizikové faktory na skupinu predisponující, která je sice v akutním stavu léčebně neovlivnitelná, ale faktory lze využít pro predikci rozvoje deliria, a na skupinu faktorů precipitujících, které jsou potencionálně ovlivnitelné (tab. 2). Současným trendem v intenzivní péči je nejen časná detekce a léčba deliria, ale především využití preventivních postupů se zaměřením na precipitující faktory s cílem snížení incidence, doby trvání a stupně závažnosti deliria.
Table 2. Rizikové faktory vzniku deliria v intenzivní péči 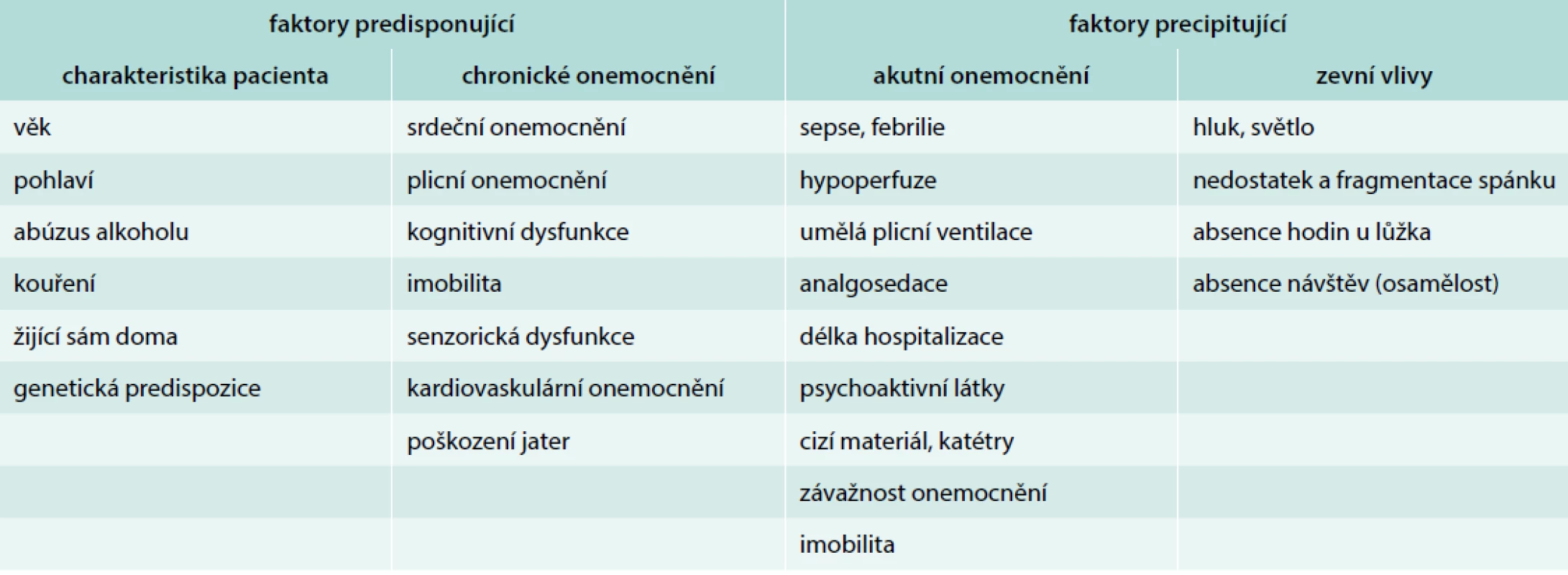
Delirium na JIP
Delirium na JIP se vyskytuje s vysokou prevalencí (viz výše) a vede ke zhoršení klinického výsledku pacientů i ke zvýšené spotřebě finančních zdrojů, zdravotní a sociální péče. U pacientů v intenzivní péči jsou popisovány některé subtypy delirantních stavů, které jsou specifické pro vybrané skupiny pacientů, přestože terminologie není jednotná.
Pooperační delirium
Výskyt deliria u pacientů po operacích se vyskytuje v různém časovém období po operačním výkonu. Charakteristický je časný výskyt, často bezprostředně po ukončení operačního výkonu a vyvedení z anestezie, v některých případech dochází k plnému rozvoji i s odstupem desítek hodin po výkonu. Za specifický rizikový faktor je považována nedostatečná analgezie akutní bolesti. Důraz na multimodální analgezii a snaha o implementaci tzv. konceptu ERAS (Enhanced Recovery After Surgery) do klinické praxe ve všech modalitách ve svém důsledku vede ke zlepšení klinického výsledku včetně snížení prevalence deliria, zkrácení doby na JIP a pooperačních komplikací [19]. U pacientů po chirurgických výkonech se vyskytuje kombinace možných příčin vzniku deliria: hypovolemie, hypoperfuze, inflamatorní reakce, nedostatečná analgezie, imobilizace.
Delirium z odnětí návykových látek (syndrom z odnětí)
U nemocných v intenzivní péči se může vyvinout specifický podtyp deliria spojený s odnětím léků či návykových látek, který se zpravidla manifestuje symptomatologií hyperaktivního deliria. Tento typ deliria je nazýván „syndromem z odnětí“ a v prostředí intenzivní péče se nejčastěji setkáváme se syndromem z odnětí při snížení či vysazení benzodiazepinů a opioidů, rovněž se vyskytuje u pacientů s chronickým abúzem alkoholu, který je přerušen pobytem v nemocnici a vzácně u pacientů, kteří jsou přijímáni na JIP primárně pro syndrom z odnětí z důvodu absence příjmu chronicky užívaných návykových látek.
Opioidy a benzodiazepiny
U pacientů s dlouhodobou expozicí opiodům nebo benzodiazepinům se může vyvinout fyzická závislost a při vysazení léků může dojít k rozvoji symptomatologie syndromu z odnětí. Vysazení opioidů je provázeno pocením, mydriázou, slzením, zvracením, průjmy, tachykardií, arteriální hypertenzí, teplotou, tachypnoí, neklidem, myalgiemi, iritabilitou, zvýšenou citlivostí k bolestivým podnětům, anxietou, křečemi břicha. Symptomy se dostavují asi do 12 hod od vysazení či snížení dávky opioidů nebo může být spuštěn podáním léků s antagonistickým účinkem, jako je naloxon nebo agonistou/antagonistou nalbufinem.
Vysazení dlouhodobě užívaných benzodiazepinů se projevuje obdobnou symptomatologií s dominující anxietou, agitací, tremorem, bolestí hlavy, pocením, nespavostí, myokloniemi až svalovými křečemi, známkami hyperaktivního deliria. Symptomy mohou být vyvolány i podáním antagonistů benzodiazepinů, flumazenilu.
Vysazení dexmedetomidinu u nemocných na JIP může být do 24–48 hod provázeno syndromem z odnětí, jako je nauzea, zvracení a agitace [20], přestože ve srovnání s benzodiazepiny je jeho výskyt signifikantně nižší (4,9 % vs 8,2 %, P = 0,25). Studie Rikera ukázala, že ve skupině pacientů sedovaných sufentanilem/midazolamem byla doba sedace delší než ve skupině sedované sufentanilem/propofolem (7,7 vs 3,5 dne) a syndrom z odnětí se častěji vyskytl ve skupině s midazolamem (35 % vs 28 %) [18].
Alkohol
Chronický abúzus alkoholu je popisován u 18 % všeobecné populace, odhaduje se výskyt ve 20 % u pacientů na urgentních příjmech a akutní delirium z odnětí alkoholu na chirurgických JIP je popisován v rozmezí 8–40 % [21,22]. Nejzávažnější průběh může vyústit až do tzv. deliria tremens, které je manifestováno těžkou alterací mentálního stavu různého vyjádření a sympatomimetickou hyperadrenergní aktivitou s vysokou mortalitou. Časná diagnostika a léčba je pro klinický výsledek pacientů s deliriem tremens zásadní, nerozpoznání a absence specifického léčebného postupu vede ke zhoršení klinického průběhu pacientů.
Vliv chronického abúzu alkoholu na transmiterové systémy v mozku:
- zvýšení sekrece endogenních opioidů
- interakce serotoninových a dopaminergních receptorů
- interakce adrenergního systému
- down-regulace GABA-A receptorů:
- alkohol receptory aktivuje, při chronickém užívání dochází k jejich down-regulaci
- při syndromu z odnětí dochází ke ztrátě stimulace a současně jejich nedostatku, která se manifestuje tremorem, dysforií, tachykardií, anxietou, křečemi
- up-regulace excitačních postsynaptických glutamátových NMDA receptorů:
- alkohol receptory inhibuje, při chronickém užívání dochází k jejich up-regulaci
- při syndromu z odnětí dochází k hyperreaktivitě NMDA receptorů, která se manifestuje tremorem, ataxiemi, epileptickými paroxyzmy.
Screening delirantních stavů na JIP
Vzhledem k vysokému výskytu, podhodnocení, klinickému negativnímu dopadu a současně možné preventabilitě deliria u nemocných na JIP je doporučeno aktivní rutinní vyhledávání (screening) delirantních stavů s cílem jeho časné detekce a léčbě [23]. K detekci deliria je doporučeno používání The Confusion Assessment Method for the Intensive Care Unit (CAM-ICU) a Intensive Care Delirium Screening Checklist (ICDSC), česká verze testu byla vytvořena a validována v rámci grantového projektu a byla publikována Mitášovu et al [24]. Hodnocení deliria testem CAM-ICU je dvoustupňové: prvním krokem je zhodnocení stupně vigility (bdělosti) a agitovanosti pomocí validované škály The Richmond Agitation and Sedation Scale (RASS), druhým krokem testu CAM-ICUcz je hodnocení přítomnosti deliria dle kritérií Americké psychiatrické asociace. Test hodnotí 4 základní znaky, při přítomnosti 3–4 znaků je pacient vyhodnocen jako delirantní:
- rychlý nástup a fluktuace poruchy vědomí a psychického stavu
- přítomnost poruchy pozornosti
- dezorganizace myšlení
- porucha vigility, která odpovídá úrovni RASS jiné než 0
Test nevyžaduje verbální odpověď a vyšetření je zpravidla prováděno nelékařským personálem.
Léčba deliria
Recentní literatura je zaměřena na farmakologické rizikové faktory rozvoje deliria na JIP a současně na farmakologické a nefarmakologické postupy vedoucí ke snížení incidence, trvání a závažnosti deliria. Dle vyjádření odborných společností je k léčbě deliria doporučeno podávání atypických antipsychotik, která mohou vést (na rozdíl od haloperidolu) ke zkrácení doby trvání deliria [23]. Inhibitor cholinesteráz (rivastigmin) není doporučen v indikaci léčby, resp. zkrácení trvání deliria u pacientů na JIP. U pacientů s rizikem vzniku torsades de pointes (nemocní s prodlouženým QT intervalem nebo s medikací, která vede k prodloužení QT intervalu) nejsou doporučena antipsychotika k léčbě delirantního stavu. Analgosedace pacientů na JIP je jedním ze základních léčebně-preventivních opatření rozvoje vzniku deliria. U pacientů s deliriem, které nevzniklo v souvislosti s alkoholizmem nebo podáváním a vysazením benzodiazepinů, je ke zkrácení doby trvání deliria doporučeno k sedaci na JIP upřednostnit dexmedetomidin před benzodiazepiny.
Prevence deliria
Farmakologická prevence
O farmakologické prevenci rozvoje deliria v intenzivní péči existují v literatuře rozporuplná data. Dle výsledků studií v současné době není doporučeno rutinní preventivní podávání neuroleptik (haloperidol, atypická neuroleptika). Vzhledem k nedostatečné evidenci dat ohledně efektivnosti dexmedetomidinu k prevenci vzniku deliria nelze dexmedetomidin v této indikaci doporučit [18]. Zcela recentní metaanalýza 7 studií poprvé ukázala možný protektivní efekt peroperačně podaného ketaminu (ve většině studií bolusová úvodní dávka 0,5 mg/kg s úvodem do anestezie) na výskyt pooperační kognitivní dysfunkce. Příznivý vliv ketaminu na výskyt pooperačního deliria nebyl v provedených studiích prokázán [25].
Analgosedace jako léčebně preventivní postup ke snížení rizika deliria
Individualizace typu a dávek látek využívaných k analgosedaci pacientů v intenzivní péči může vést k významnému ovlivnění prevalence, doby trvání i závažnosti deliria. Vzhledem k tomu, že nemocní v intenzivní péči (na chirurgických, ale i tzv. „medical“ JIP) mnohdy trpí bolestí při základním onemocnění, chirurgických intervencích či rutinních postupech na JIP (tracheální rourka, invazivní vstupy, močová cévka apod), je základním a výchozím postupem preference analgezie před zahájením sedativ. V intenzivní péči jsou používány opioidy jako základní analgetika, především u chirurgických pacientů a u nemocných s umělou plicní ventilací. Nicméně vzhledem k nežádoucím účinkům opioidů včetně možného vzniku závislosti a rozvoje deliria je nezbytné vést analgezii individuálně, s využitím technik vedoucích ke snížení dávek opioidů: neopiodní analgetika (paracetamol, nesteroidní analgetika), u populace vybraných chirurgických pacientů je vhodné využití regionální anestezie, ketaminu, u neuropatických bolestí využití gabapentinu či pregabalinu. Screening a monitorace bolesti u pacientů na JIP vede ke zlepšení klinického výsledku se zkrácením doby umělé plicní ventilace a doby pobytu na JIP [26,27] a je doporučen protokolizovaný přístup sledování bolesti [18]. Při nutnosti podávání sedativ jsou preferovány látky s krátkou dobou účinku, dávkování je určováno monitorací a cílovým stupněm sedace a musí být individualizováno. Dříve široce používané benzodiazepiny ve srovnání s propofolem a dexmedetomidinem vedou ke zvýšenému výskytu deliria, delší době umělé plicní ventilace a pobytu na JIP a v současné době nejsou k rutinnímu využití v sedaci na JIP doporučeny [18]. Srovnání dexmedetomidinu s ostatními sedativy (benzodiazepiny, propofol) ukázalo, že ve skupině pacientů s dexmedetomidinem byla popsána kratší doba umělé plicní ventilace a pobytu na intenzivní péči, ale při heterogenních výsledcích studií nebyl prokázán jednoznačný vliv na snížení výskytu deliria a mortalitu [28,29]. Benzodiazepiny jsou sedativem volby u pacientů se syndromem z odnětí či deliriem v souvislosti se závislostí na benzodiazepinech, alkoholu, při křečové aktivitě. Denní přerušení analgosedace u nemocných v intenzivní péči vedlo mimo jiné ke zkrácení trvání deliria [30], nicméně tento postup je svázán s nutností zvýšeného počtu ošetřujícího personálu. Morandi v roce 2010 publikoval protokolizovaný přístup k pacientům na JIP s cílem příznivého ovlivnění výskytu deliria [31], tzv. „ABCDE approach“ (tab. 3), implementace těchto postupů vede k signifikantnímu snížení výskytu deliria [32].
Table 3. „ABCDE“ přístup k pacientům na JIP s umělou plicní ventilací 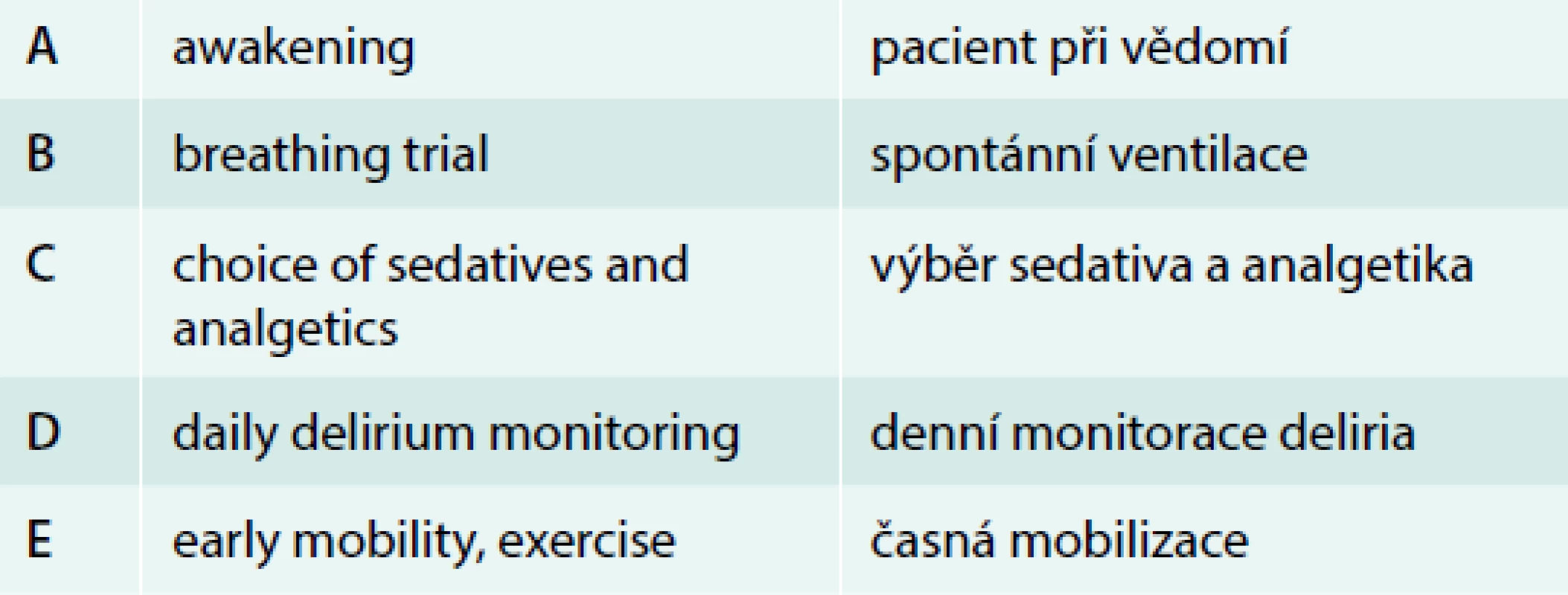
Nefarmakologická prevence
Nefarmakologické ovlivnění precipitujících faktorů je obtížnou, ale účinnou metodou, která vede ke snížení výskytu a doby trvání deliria (tab. 4). Mezi postupy, u kterých je prokázán efekt na výskyt deliria, patří časná mobilizace pacientů [33]. Důraz na nefarmakologický přístup s cílem minimalizace sedace, časné mobilizace spolu s dostatečnou multimodální analgezií je součástí konceptu ERAS (Enhanced Recovery After Surgery) – data jasně prokazují efekt implementace konceptu u chirurgických nemocných na klinický výsledek [34]. Zavedení balíčku nefarmakologických intervencí včetně tzv. protokolu reorientace pacienta se stimulací kognitivních funkcí vedlo v intervenované skupině k signifikantnímu snížení výskytu deliria (9,9 % vs 15 %, OR 0,6; 95 % CI: 0,39–0,92), celkovému počtu epizod deliria (62 vs 90, P = 03) a počtu dnů s deliriem (105 vs 161, P = 02). Intervenční strategie neměla vliv na závažnost deliria ani výskyt rekurence [29].
Table 4. Nefarmakologická preventivní opatření deliria 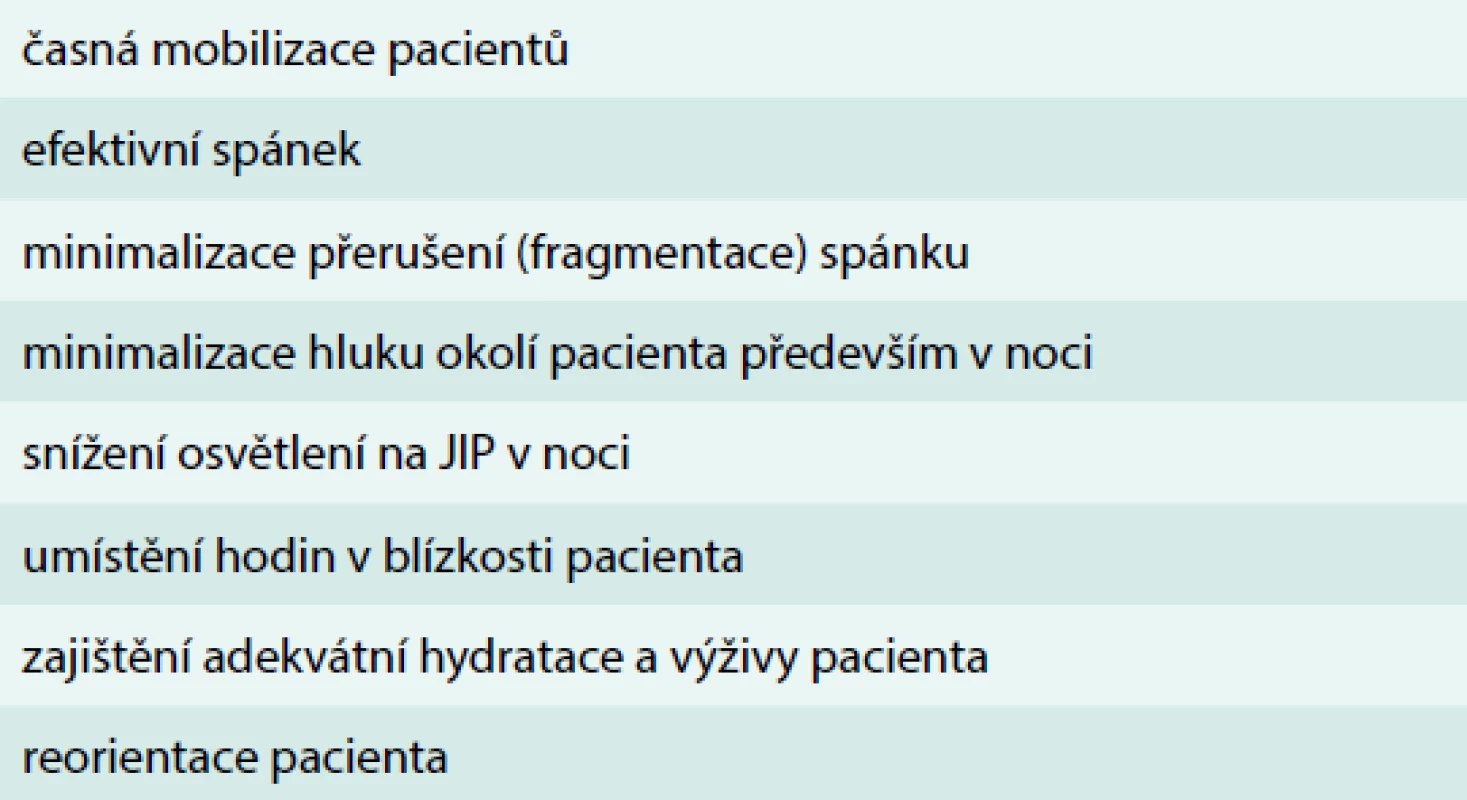
Dalším, zcela zásadním faktorem, který je preventabilní a ovlivnitelný, je zajištění dostatečného kvalitního spánku u pacientů na JIP. V současné době existuje dostatek dat, která ukazují na souvislost mezi nedostatečným a nekvalitním spánkem a delirantním stavem či imunodeprivací s dalšími důsledky [42,43]. Zajištění kvalitního spánku představuje úpravu prostředí – snížení hlučnosti, světelnosti, minimalizace fragmentace spánku (eliminace procedur a ošetřovatelských aktivit během spánku), snaha o zajištění diurnálního rytmu, použití ochrany očí, ušních obturátorů. Farmakologická podpora spánku je tématem pro samostatnou kapitolu, většina používaných sedativ včetně benzodiazepinů zhoršuje architekturu spánku a nevede k dostatečnému odpočinku pacientů. Z hlediska nejmenšího poškození architektury spánku je nejvhodnější využití dexmedetomidinu, melatoninu a trazodonu, přestože data na snížení výskytu delirií nejsou přesvědčivá. Časná mobilizace pacientů (fyzická i mentální) na JIP je jednoznačně preferována, neboť je mimo jiné spojena i se sníženým výskytem hyperaktivního deliria [30,35]. Součástí reorientace pacientů je komunikace (verbální i nonverbální) jak s ošetřujícím personálem, tak s rodinnými příslušníky a zajištění co nejčastější stimulace rodinou by mělo být součástí managementu těchto pacientů. K reorientaci slouží mimo jiné i pomůcky, jako jsou sluchadla, brýle, využití počítačů, televize apod.
eCASH koncept
Nadměrná a hluboká sedace je prokazatelně spojená se zhoršeným klinickým výsledkem včetně mortality, kognitivní dysfunkce a psychických komplikací. Přestože v řadě doporučení je u pacientů na JIP kladen důraz na minimalizaci a individualizaci analgosedace [18,31], recentní studie popisují pokračující běžnou praxi neadekvátní hluboké analgosedace [36,37]. Skupina expertů vypracovala integrovaný, adaptabilní přístup, který je cílen na co nejčasnější dosažení lehké sedace, iniciované časně během kritického stavu, jako jedné z priorit péče. Ideálně by nemocný měl být v komfortu, klidný a spolupracující se zdravotnickým personálem a rodinou v průběhu celého pobytu na JIP. Tento proces je postaven na efektivní analgezii, cílené řízené titraci minimální sedace a maximální cílené péči (tzv. patient-centred focus) se spoluprací celého ošetřujícího týmu a rodinných příslušníků. Strategie je nazvána jako eCASH – early Comfort using Analgesia, minimal Sedatives and maximal Humane care (schéma) [38]. Koncept je doporučen k využití u všech pacientů v intenzivní péči a měl by být jedním z klíčových bodů intenzivní péče se stejným důrazem jako protektivní umělá plicní ventilace nebo časná léčba sepse. Ústup od hluboké sedace je v popředí intenzivní péče již řadu let, je dokumentovaná spojitost mezi hloubkou sedace, délkou umělé plicní ventilace, pobytu na JIP a morbiditou.
Schéma. eCASH koncept časné implementace léčby a prevence bolesti, anxiety, agitace, deliria a imobility a optimalizace patient-centered care. Upraveno podle [36] ![Schéma. eCASH koncept časné implementace léčby a prevence bolesti, anxiety, agitace, deliria a imobility
a optimalizace patient-centered care. Upraveno podle [36]](https://pl-master.mdcdn.cz/media/image_pdf/adad64a06298dd63772aed14602d4532.png?version=1567327300)
Doporučení pro praxi
- „Analgesia first“ je prioritou péče s následným krokem minimalizace sedace. Dostatečná analgezie je základem pro zajištění nejen komfortu nemocného, ale eliminace bolesti snižuje sympatoadrenální a proinflamatorní reakci se všemi důsledky. Zajištění dostatečné analgezie se na JIP zpravidla neobejde bez opioidů, cílem nového konceptu je snížení dávky opioidů využitím multimodální léčby bolesti se snížením nežádoucích účinků opioidů. Léčba bolesti musí být individualizována, s individualizací léčby je nutné rozlišovat typy bolesti. Bolest akutní, spojená zpravidla s chirurgickými či jinými invazivními výkony, bolest chronická, se kterou již nemocný vstupuje do intenzivní péče včetně užívání některých skupin analgetik, bolest krátkodobá periprocedurální apod. V léčbě bolesti se dnes do popředí dostávají mimo paracetamol a nesteroidní antirevmatika jako bazální analgezie farmaka, jako jsou α-lytika a ketamin, využití regionální analgezie. Zcela recentně byla publikována doporučení odborných společnosti o použití ketaminu v léčbě perioperační bolesti s bolusovou dávkou až 0,35 mg/kg a kontinuální infuzí až 1 mg/kg/hod [39].
- Personalizovaná kombinace léků vede ke snížení vedlejších účinků a potenciaci analgetického efektu. Nedílnou součástí péče je sledování a kvantifikace bolesti u všech pacientů na JIP.
- Sedace by měla být minimalizována s tím, že cílem je klidný pacient, který je v komfortu a kooperující (tzv. pravidlo 3C: Calm, Comfortable, Cooperative). Pacient je při vědomí, spolupracuje, toleruje zavedené katétry, tracheální rourku, umělou plicní ventilaci apod. Současně v této souvislosti je nutné upozornit, že přes doporučení o minimalizaci sedace zůstávají skupiny pacientů, u nichž je hluboká analgosedace účelná, přestože je nutné hloubku sedace pravidelně přehodnocovat. Jedná se o nemocné s těžkým plicním poškozením, poraněním mozku s nitrolební hypertenzí, pacienty se status epilepticus, ventilační dysynchronií apod. Jak nadměrná, tak ale i nedostatečná analgosedace může být příčinou stresu a diskomfortu s následným rozvojem delirantních stavů. Od dříve užívaných benzodiazepinů jako hlavní skupiny lék pro sedaci v intenzivní péči je již dlouhodobě ústup a je doporučováno používání krátkodobých, lépe řiditelných látek, jako je propofol a dexmedetomidin. Dexmedetomidin ve srovnání s midazolamem a propofolem je spojen s nižším výskytem delirantních stavů [18,40]. Benzodiazepiny by měly být vyhraněny pouze ve specifických indikacích, jako je periprocedurální amnézie, křečové stavy, syndrom z odnětí benzodiazepinů nebo alkoholu, poranění mozku, paliativní péče. Intermitentní podávání by mělo být preferováno, kontinuální podávání benzodiazepinů je spojeno s vyšším rizikem deliria [41].
Závěr
Delirium na JIP se vyskytuje s vysokou prevalencí a vede ke zhoršení klinického výsledku pacientů, vyšším ekonomickým nákladům, vyšší spotřebě zdravotní a sociální péče. K základní léčbě delirantních stavů patří prevence s důrazem na individualizovaný multimodální přístup s preferencí minimalizace sedace, dostatečné analgezie a nefarmakologických přístupů prevence a léčby delirantních stavů.
Doručeno do redakce 9. 7. 2018
Přijato po recenzi: 28. 1. 2019
MUDr. Renata Černá Pařízková, Ph.D., LL.M.
Klinika anesteziologie, resuscitace a intenzivní medicíny LF UK a FN Hradec Králové
Sources
- [American Psychiatric Association]. Diagnostic and Statistical Manual of Mental Disorders. 5th ed. Amer Psychiatric Pub: Arlington, VA:2013. ISBN 978–0890425558.
- Li HC, Chen YS, Chiu MJ et al. Delirium, subsyndromal delirium, and cognitive changes in individuals undergoing elective coronary artery bypass graft surgery. J Cardiovasc Nurs 2015; 30(4): 340–345. Dostupné z DOI: <http://dx.doi.org/10.1097/JCN.0000000000000170>.
- Bakker RC, Osse RJ, Tulen JH et al. Preoperative and operative predictors of delirium after cardiac surgery in elderly patients. Eur J Cardiothorac Surg 2012; 41(3): 544–549. Dostupné z DOI: <http://dx.doi.org/10.1093/ejcts/ezr031>.
- Kalabalik J, Brunetti L, El-Srougy R. Intensive care unit delirium: a review of the literature. J Pharm Pract 2014; 27(2): 195–207. Dostupné z DOI: <http://dx.doi.org/10.1177/0897190013513804>.
- Van Eijk MM, Slooter AJ. Delirium in intensive care unit patients. Semin Cardiothorac Vasc Anesth 2010; 14(2): 141–147. Dostupné z DOI: <http://dx.doi.org/10.1177/1089253210371495>.
- Peterson JF, Pun BT, Dittus RS et al. Delirium and its motoric subtypes: a study of 614 critically ill patients. J Am Geriatr Soc 2006; 54(3): 479–484. Dostupné z DOI: <http://dx.doi.org/10.1111/j.1532–5415.2005.00621.x>.
- Pisani MA, Murphy TE, Van Ness PH et al. Characteristics associated with delirium in older patients in a medical intensive care unit. Arch Intern Med 2007; 167(15): 1629–1634. Dostupné z DOI: <http://dx.doi.org/10.1001/archinte.167.15.1629>.
- Peterson JF, Pun BT, Dittus RS et al. Delirium and its motoric subtypes: a study of 614 critically ill patients. J Am Geriatr Soc 2006; 54(3): 479–484. Dostupné z DOI: <http://dx.doi.org/10.1111/j.1532–5415.2005.00621.x>.
- Spronk PE, Riekerk B, Hofhuis J et al. Occurrence of delirium is severely underestimated in the ICU during daily care. Intensive Care Med 2009; 35(7): 1276–1280. Dostupné z DOI: <http://dx.doi.org/10.1007/s00134–009–1466–8>.
- Ouimet S, Kavanagh BP, Gottfried SB et al. Incidence, risk factors and consequences of ICU delirium. Intensive Care Med 2007; 33(1): 66–73. Dostupné z DOI: <http://dx.doi.org/10.1007/s00134–006–0399–8>.
- Ely EW, Shintani A, Truman B et al. Delirium as a predictor of mortality in mechanically ventilated patients in the intensive care unit. JAMA 2004; 291(14): 1753–1762. Dostupné z DOI: <http://dx.doi.org10.1001/jama.291.14.1753
- Girard TD, Jackson JC, Pandharipande PP et al. Delirium as a predictor of long-term cognitive impairment in survivors of critical illness. Crit Care Med 2010; 38(7): 1513–1520. Dostupné z DOI: <http://dx.doi.org/10.1097/CCM.0b013e3181e47be1>.
- Fong TG, Tulebaev SR, Inouye SK. Delirium in elderly adults: diagnosis, prevention and treatment. Nat Rev Neurol 2009; 5(4): 210–220. Dostupné z DOI: <http://dx.doi.org/10.1038/nrneurol.2009.24>.
- Hshieh TT, Fong T, Marcantonio ER et al. Cholinergic deficiency hypothesis in delirium: a synthesis of current evidence. J Gerontol A Biol Sci Med Sci 2008; 63(7): 764–772. Dostupné z DOI: <http://dx.doi.org/10.1093/gerona/63.7.764>.
- Han L, McCusker J, Cole M et al. Use of medications with anticholinergic effect predicts clinical severity of delirium symptoms in older medical inpatients. Arch Intern Med 2001; 161(8): 1099–1105.
- Cerejeira J, Nogueira V, Luis P et al. The cholinergic system and inflammation: common pathways in delirium pathophysiology. J Am Geriatr Soc 2012; 60(4): 669–675. Dostupné z DOI: <http://dx.doi.org/10.1111/j.1532–5415.2011.03883.x>.
- Pisani MA, Murphy TE, Araujo KL et al. Benzodiazepine and opioid use and the duration of intensive care unit delirium. Crit Care Med 2009; 37(1): 1771–83. Dostupné z DOI: <http://dx.doi.org/10.1097/CCM.0b013e318192fcf9>.
- Riker RR, Shehabi Y, Bokesch PM et al. [SEDCOM (Safety and Efficacy of Dexmedetomidine Compared With Midazolam) Study Group]. Dexmedetomidine vs midazolam for sedation of critically ill patients: A randomized trial. JAMA 2009; 301(5): 489–499. Dostupné z DOI: <http://dx.doi.org/10.1001/jama.2009.56>.
- Jia Y, Jin G, Guo S et al. Fast-track surgery decreases the incidence of postoperative delirium and other complications in elderly patients with colorectal carcinoma. Langenbecks Arch Surg 2014; 399(1): 77–84. Dostupné z DOI: <http://dx.doi.org/10.1007/s00423–013–1151–9>.
- Hospira Inc: FDA package insert for dexmedetomidine. Available at: http://www.precedex.com/wp-content/uploads/2010/11/Precedex_PI.pdf. [Accessed October 2010].
- Whiteman PJ, Hoffman RS, Goldfrank LR. Alcoholism in the emergency department: an epidemiologic study. Acad Emerg Med 2000; 7(1): 14–20.
- Awissi DK, Lebrun G, Fagnan M et al. Alcohol, nicotine, and iatrogenic withdrawals in the ICU. Crit Care Med 2013; 41(9 Suppl 1): S57-S68. Dostupné z DOI: <http://dx.doi.org/10.1097/CCM.0b013e3182a16919>.
- Barr J, Fraser GL, Puntillo K et al. Clinical Practice Guidelines for the Management of Pain, Agitation, and Delirium in Adult Patients in the Intensive Care Unit. Crit Care Med 2013; 41(1): 263–306. Dostupné z DOI: <http://dx.doi.org/10.1097/CCM.0b013e3182783b72>.
- Mitašova A, Bednařik J, Košťalova M et al. Standardizace české verze The Confusion Assessment Method for the Intensive Care Unit (CAM-ICU.cz). Cesk Slov Neurol N 2010; 73/106(3): 258–266.
- Hovaguimian F, Tschopp C, Beck-Schimmer B et al. Intraoperative ketamine administration to prevent delirium or postoperative cognitive dysfunction: A systematic review and meta-analysis. Acta Anaesthesiol Scand 2018; 62(9): 1182–1193. Dostupné z DOI: <http://dx.doi.org/10.1111/aas.13168>.
- Payen JF, Chanques G, Mantz J et al. Current practices in sedation and analgesia for mechanically ventilated critically ill patients: A prospective multicenter patient-based study. Anesthesiology 2007; 106(4): 687–695. Dostupné z DOI: <http://dx.doi.org/10.1097/01.anes.0000264747.09017.da>.
- Payen JF, Bosson JL, Chanques G et al. [DOLOREA Investigators]. Pain assessment is associated with decreased duration of mechanical ventilation in the intensive care unit: A post Hoc analysis of the DOLOREA study. Anesthesiology 2009; 111(6): 1308–1316. Dostupné z DOI: <http://dx.doi.org/10.1097/ALN.0b013e3181c0d4f0>.
- Chen K, Lu Z, Xin YC et al. Alpha-2 agonists for long-term sedation during mechanical ventilation in critically ill patients. Cochrane Database of Systematic Reviews 2015; (1).: CD010269. Dostupné z DOI: <http://dx.doi.org/10.1002/14651858.CD010269.pub2>.
- Inouye SK, Bogardus ST, Charpentier PA et al. A multicomponent intervention to prevent delirium in hospitalized older patients. N Eng J Med 1999; 340(9): 669–676. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJM199903043400901>.
- Schweickert WD, Pohlman MC, Polman AS et al. Early physical and occupational therapy in mechanically ventilated, critically ill patients: a randomized controlled trial. Lancet 2009; 373(9678): 1874–1882. Dostupné z DOI: <http://dx.doi.org/10.1016/S0140–6736(09)60658–9>.
- Morandi A, Brummel NE, Ely EW. Sedation, delirium and mechanical ventilation: the “ABCDE” approach. Curr Opin Crit Care 2011; 17(1): 43–49. Dostupné z DOI: <http://dx.doi.org/10.1097/MCC.0b013e3283427243>.
- Bounds M, Kram S, Speroni KG et al. Effect of ABCDE bundle implementation on prevalence of delirum in intensive care unit patients. Am J Crit Care 2016; 25(6): 535–544. Dostupné z DOI: <http://dx.doi.org/10.4037/ajcc2016209>.
- Needham DM, Korupolu R, Zanni JM et al. Early physical medicine and rehabilitation for patients with acute respiratory failure: A quality improvement project. Arch Phys Med Rehabil 2010; 91(4): 536–542. Dostupné z DOI: <http://dx.doi.org/10.1016/j.apmr.2010.01.002>.
- Ljungqvist O, Scott M, Fearon KC. Enhanced Recovery After Surgery. A Review. JAMA Surg 2017; 152(3): 292–298. Dostupné z DOI: <http://dx.doi.org/10.1001/jamasurg.2016.4952>.
- Balas MC, Vasilevskis EE, Olsen KM et al. Effectiveness and safety of the awakening and breathing coordination, delirium monitoring/management, and early exercise/mobility bundle. Crit Care Med 2014; 42(5): 1024–1036. Dostupné z DOI: <http://dx.doi.org/10.1097/CCM.0000000000000129>.
- Hodgson C, Bellomo R, Berney S et al. [TEAM Study Investigators]. Early mobilization and recovery in mechanically ventilated patients in the ICU: a bi-national, multi-centre, prospective cohort study. Crit Care 2015; 19 : 81. Dostupné z DOI: <http://dx.doi.org/10.1186/s13054–015–0765–4>.
- Page VJ, Ely EW, Gates S et al. Effect of intravenous haloperidol on the duration of delirium and coma in critically ill patients (Hope-ICU): a randomised, double-blind, placebo-controlled trial. Lancet Respir Med 2013; 1(7): 515–523. Dostupné z DOI: <http://dx.doi.org/10.1016/S2213–2600(13)70166–8>.
- Vincent JL, Shehabi Y, Walsh TS et al. Comfort and patientcentred care without excessive sedation: the eCASH concept. Intensive Care Med 2016; 42(6): 962–971. Dostupné z DOI: <http://dx.doi.org/10.1007/s00134–016–4297–4>.
- Schwenk ES, Viscusi ER, Buvanendran A et al. Consensus Guidelines on the Use of Intravenous Ketamine Infusions for Acute Pain Management From the American Society of Regional Anesthesia and Pain Medicine, the American Academy of Pain Medicine, and the American Society of Anesthesiologists. Reg Anesth Pain Med 2018; 43(5): 456–466. Dostupné z DOI: <http://dx.doi.org/10.1097/AAP.0000000000000806>.
- Jakob SM, Ruokonen E, Grounds RM et al. Dexmedetomidine vs midazolam or propofol for sedation during prolonged mechanical ventilation: two randomized controlled trials. JAMA 2012; 307(11): 1151–1160. Dostupné z DOI: <http://dx.doi.org/10.1001/jama.2012.304>.
- Zaal IJ, Devlin JW, Hazelbag M et al. Benzodiazepine-associated delirium in critically ill adults. Intensive Care Med 2015; 41(12): 2130–2137. Dostupné z DOI: <http://dx.doi.org/10.1007/s00134–015–4063-z>.
- Kamdar BB, Niessen T, Colantuoni E et al. Delirium transitions in the medical ICU: exploring the role of sleep quality and other factors. Crit Care Med 2015; 43(1): 135–141. Dostupné z DOI: <http://dx.doi.org/10.1097/CCM.0000000000000610>.
- Weinhouse GL. Delirium and sleep disturbances in the intensive care unit: can we do better? Curr Opin Anaesthesiol 2014; 27(4): 403–408. Dostupné z DOI: <http://dx.doi.org/10.1097/ACO.0000000000000093>.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2019 Issue 6-
All articles in this issue
- Diagnostika akutních poruch acidobazické rovnováhy
- Vybrané akutní stavy v moderní onkologii
- Mimotělní eliminační metody v toxikologii: 1. část
- Mimotělní eliminační metody v toxikologii: 2. část
- Delirium v intenzivní péči
- Imitátory sepse
- Úloha paliativní medicíny u akutních stavů
- K životnímu jubileu prof. MUDr. Heleny Tlaskalové Hogenové, DrSc.
- Z odborné literatury
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Diagnostika akutních poruch acidobazické rovnováhy
- Delirium v intenzivní péči
- Mimotělní eliminační metody v toxikologii: 1. část
- Vybrané akutní stavy v moderní onkologii
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

