-
Medical journals
- Career
CD38 cílená léčba u mnohočetného myelomu
Authors: Tomáš Jelínek 1,2,3; Jana Mihályová 1,2; Roman Hájek 1
Authors‘ workplace: Klinika hematoonkologie LF OU a FN Ostrava 1, 2; LF OU 2; Přírodovědecká fakulta OU Ostrava 3
Published in: Vnitř Lék 2018; 64(10): 939-948
Category:
Overview
Antigen CD38 je uniformně a vysoce exprimován na plazmatických buňkách a stal se tak ideálním cílem pro léčbu mnohočetného myelomu (MM) pomocí anti-CD38 cílených monoklonálních protilátek (mAbs). Nejdále ve vývoji je daratumumab, nicméně podobně slibných výsledků dosahuje i isatuximab, který cílí na zcela jiný epitop molekuly CD38. Anti-CD38 mAbs mají pleiotropní mechanizmus účinku, který je popisován i u jiných mAbs, nicméně zásadním, novým a specifickým mechanizmem je tzv. imunomodulační efekt díky depleci CD38+ imunosupresivních buněčných populací. Monoterapie anti-CD38 mAbs vede k odpovědím u asi 30 % silně předléčených MM pacientů. Jelikož je toxicita těchto látek minimální a mají odlišný mechanizmus účinku, jsou ideálním partnerem do kombinační léčby s běžně užívanými antimyelomovými léky. Daratumumab je schválen jako součást již 3 režimů u relabovaných pacientů s MM a jeho kombinace s lenalidomidem a dexametazonem je v současné době považována za nejlepší možnou léčbu relapsu nemoci, při níž bylo dosaženo bezprecedentního prodloužení mediánu doby bez progrese (Progression Free Survival – PFS), celkové léčebné odpovědi, i kvality odpovědí. Anti-CD38 mAbs se postupně posouvají i do léčby první linie. Stejně tak jsou s úspěchem zkoušeny u dalších plazmocelulárních dyskrazií (AL-amyloidóza), dalších hematologických malignit (akutní lymfoblastická leukemie – ALL, akutní myeloidní leukemie – AML, chronická lymfocytární leukemie – CLL), a dokonce u solidních nádorů či autoimunitních onemocnění. Léčba pomocí anti-CD38 mAbs znamená podobnou revoluci pro pacienty s MM, jako zavedení anti-CD20 mAbs u nemocných s CLL či non-hodgkinskými lymfomy a zcela jistě je velkou nadějí do budoucna směřující k možnosti vyléčení alespoň části nemocných s MM.
Klíčová slova:
akutní myeloidní leukemie – CD38 – daratumumab – isatuximab – mnohočetný myelom
Úvod
Mnohočetný myelom (MM) s incidencí asi 5–6 případů na 100 000 obyvatel je druhou nejčastější hematologickou malignitou [1,2]. Toto nádorové onemocnění, odjakživa považované za nevyléčitelné, zažívá dynamické období s implementací nových léčebných postupů díky recentně schváleným moderním lékům. Začíná se nahlas hovořit o tom, že minimálně menší část nemocných (asi 10 %) lze skutečně vyléčit již dnes (tzv. operational cure) [3]. V době, kdy budou plně přístupné moderní léky i v časných liniích léčby, bude možné vyléčit asi 20–30 % pacientů s MM (odhad expertů). Nové generace proteasomových inhibitorů (karfilzomib, ixazomib) a nová generace imunomodulačních látek (pomalidomid) byly nedávno schváleny, přičemž karfilzomib (Carf) a pomalidomid (Pom) jsou již dostupné i v České republice v rámci veřejného zdravotního pojištění k dubnu roku 2018 [4–6]. Z dalších léků s odlišným mechanizmem účinku, byly v roce 2015 v Evropské unii schváleny elotuzumab – monoklonální protilátka (anti-CS1) a panobinostat (inhibitor histon deacetylázy), nicméně dostupnost i používání těchto dvou látek je v tuto chvíli (duben roku 2018) v rámci České republiky velmi limitovaná [7,8]. Vůbec nejnadějnější výsledky jsou však dosahovány pomocí anti-CD38 monoklonálních protilátek (mAbs), které představují reálný průlom v léčbě pacientů s mnohočetným myelomem. Přestože je ve vývoji několik různých anti-CD38 mAbs, jako je např. MOR202 (Morphosys) a Ab79 (Takeda), budeme se v tomto souhrnném sdělení věnovat zejména daratumumabu (Genmab/Janssen) a isatuximabu (Sanofi).
Daratumumab
Daratumumab je lidská terapeutická IgG1κ monoklonální protilátka cílená proti antigenu CD38, což je membránový glykoprotein o molekulární hmotnosti 46 kDa [9]. Tento fylogeneticky zakonzervovaný antigen se ubikvitně nachází na buňkách imunitního systému, ale i na erytrocytech, trombocytech a rovněž na celé řadě dalších tkání [10], nicméně míra jeho exprese je zdaleka nejvyšší na plazmatických buňkách, což z něj dělá ideální cíl pro tento typ léčby. Daratumumab, podobně jako jiné monoklonální protilátky, zabíjí cílové buňky pomocí několika mechanizmů účinku:
- ADCC (antibody dependent cellular cytotoxicity) – protilátkou zprostředkovaná buněčná cytotoxicita
- CDC (complement dependent cytotoxicity) – komplementem zprostředkovaná cytotoxicita
- ADCP (antibody dependent cellular phagocytosis) – protilátkou aktivovaná fagocytóza
- přímá indukce apoptózy [11,12]
Velmi zajímavý a důležitý mechanizmus účinku, který byl popsán teprve nedávno, je tzv. imunomodulační efekt: daratumumab indukuje depleci imunosupresivních populací – zejména T regulačních buněk (Tregs), B regulačních buněk (Bregs) a myeloidních supresorových buněk (MDSc) [13].
Daratumumab (Darzalex) byl vůbec první anti-CD38 monoklonální protilátkou schválenou k léčbě mnohočetného myelomu (MM). V květnu roku 2016 schválila Evropská léková agentura (EMA) daratumumab v monoterapii k léčbě dospělých pacientů s relabujícím a refrakterním mnohočetným myelomem, u nichž předchozí léčba zahrnovala inhibitor proteasomu a imunomodulační látku a kteří při poslední terapii vykázali progresi nemoci. Následně v dubnu roku 2017 schválila EMA daratumumab v kombinaci s lenalidomidem a dexametazonem nebo s bortezomibem a dexametazonem u MM pacientů, kteří absolvovali alespoň jednu předchozí léčebnou linii. Americký úřad pro kontrolu léčiv (FDA – Food and Drug Administration) navíc v červnu roku 2017 schválil kombinaci daratumumabu s pomalidomidem a dexametazonen u pacientů s relabujícím a refrakterním onemocněním, kteří prodělali minimálně dvě předchozí linie léčby obsahující bortezomib a lenalidomid. V dubnu roku 2018 nejsou zatím pro žádné z výše uvedených indikací stanoveny podmínky úhrady z prostředků veřejného zdravotního pojištění v České republice.
Isatuximab
Isatuximab je chimérická IgG1κ monoklonální protilátka cílená proti unikátnímu epitopu CD38 molekuly vážící se na zcela odlišnou sekvenci aminokyselin než daratumumab [14]. Isatuximab funguje podobně jako daratumumab prostřednictvím mechanizmů účinků typických i pro jiné mAbs, přičemž nejvýznamnější z nich se zdá být NK buňkami zprostředkovaná ADCC [14,15]. Imunomodulační efekt byl rovněž popsán u isatuximabu, který spočívá zejména v depleci imunosupresivních Tregs [16]. Isatuximab je v porovnání s daratumumabem několik let pozadu v klinickém vývoji, nicméně dosavadní slibné výsledky naznačují, že se rovněž může stát rutinně podávaným léčivem. K dubnu roku 2018 nebyl isatuximab schválen v žádné indikaci a není zatím komerčně dostupný.
Klinické studie s daratumumabem u pacientů s mnohočetným myelomem
Daratumumab u nemocných s relabovaným/refrakterním mnohočetným myelomem
Monoterapie
Daratumumab (Dara) prokázal bezprecedentní účinnost i v monoterapii. První klinická studie fáze 1/2 (GEN 501) byla provedena u pacientů s RRMM, přičemž do její druhé části bylo zařazeno 72 značně předléčených pacientů s mediánem čtyř předchozích linií léčby. Při dávce daratumumabu 16 mg/kg bylo dosaženo celkové hematologické odpovědi (Overall Response Rate – ORR) u 36 % pacientů, medián PFS byl 5,7 měsíce, 1leté celkové přežití (Overall Survival – OS) 77 % [17]. Studie fáze 1/2 (Sirius) zkoumala rovněž účinnost daratumumabu (16 mg/kg) v monoterapii u 106 pacientů s mediánem 5 předchozích linií léčby (80 % nemocných s předchozí transplantací vlastních krvetvorných kmenových buněk (Autologous Stem Cell Transplantation – ASCT), 95 % dvojitě refrakterních k dvojitě refrakterních k inhibitorům proteasomu (PIs) a imunomodulačním látkám (IMiDs). Celková hematologická odpověď byla pozorována u 29 % pacientů, medián PFS byl 3,7 měsíce a 1leté OS 65 % [18]. Kombinovaná analýza těchto 2 studií s dávkou daratumumabu 16 mg/kg potvrdila ORR u 31 % pacientů a medián OS 20,1 měsíců [19].
Kombinované režimy
První studie testující kombinaci daratumumabu s lenalidomidem a dexametazonem (Dara/Len/Dex) byla studie fáze 1/2 (GEN 503), v jejíž druhé části bylo léčeno 32 RRMM pacientů s mediánem dvou předchozích léčebných linií. Celková léčebná odpověď byla 81 % (26/32), přičemž 25 % (8/32) pacientů dosáhlo stringentní kompletní remise (sCR), 9 % (2/32) kompletní remise (CR) a 28 % (9/32) velmi dobré parciální remise (VGPR). Čas do progrese (PFS) a celkové přežití (OS) ve 24 měsících byl dosažen u 69 % resp. 78 %.
Výsledky randomizované studie fáze 3 (POLLUX) srovnávající Dara/Len/Dex vs Len/Dex u 569 MM pacientů s mediánem jedné předchozí linie potvrdily výjimečnou účinnost daratumumabu. Signifikantně vyšší ORR byla pozorována v kohortě s daratumumabem oproti kontrolní skupině (92,9 % vs 76,4 %, P < 0,001), stejně tak množství kompletních a lepších odpovědí (43,1 % vs 19,2 %, P < 0,001). Přidání daratumumabu snížilo riziko progrese onemocnění či smrti (HR 0,37; P < 0,001) ve srovnání se standardem léčby režimem Len/Dex [20,21]. Po delší době sledování došlo k dalšímu prohloubení remise onemocnění. Počet MRD (minimální reziduální nemoc) negativních pacientů s citlivostí 10–5 bylo signifikantně vyšší u pacientů léčených daratumumabem (27 % vs 5 %; p < 0,0001; použitá technika: sekvenování nové generace). PFS bylo signifikantně prodlouženo ve skupině s daratumumabem (medián PFS nedosažen vs 17,5 měsíců, HR 0,44, p < 0,0001) [21].
Druhá velká randomizovaná studie fáze 3 (CASTOR) zkoumala efekt přidání daratumumabu k režimu bortezomib/dexametazon (Dara/bortezomib/dexametazon – DVd vs bortezomib/dexametazon – Vd). Podobně jako u předchozí studie přidání daratumumabu zásadně snížilo riziko progrese nemoci či smrti (HR 0,39). Celkem bylo zařazeno 498 MM pacientů s mediánem dvou předchozích linií léčby, přičemž ORR bylo signifikantně vyšší ve skupině s daratumumabem oproti kontrolní skupině (82,9 % vs 63,2 %; p < 0,001), stejně tak množství CR a lepších (19,2 % vs 9,0 %, p = 0,001). Medián PFS byl v kohortě s daratumumabem 16,7 měsíce ve srovnání se 7,1 měsíci (HR 0,39; p < 0,001) v kontrolní skupině [22,23]. V následné analýze po delší době sledování došlo k významnému prohloubení remise se zvýšením zvláště počtu CR ve skupině s daratumumabem z 19 % na 30 % (DVd ≥ CR 30 % vs Vd ≥ CR 10,0 %; p < 0,0001). Pacienti léčení kombinací DVd dosáhli MRD negativity ve 12 % ve srovnání se 2 % ve skupině Vd (p < 0,0001; citlivost 10–5) [23]. Přehled všech významných studií je uveden v tab. 1.
Table 1. Výsledky publikovaných klinických studií s daratumumabem a isatuximabem 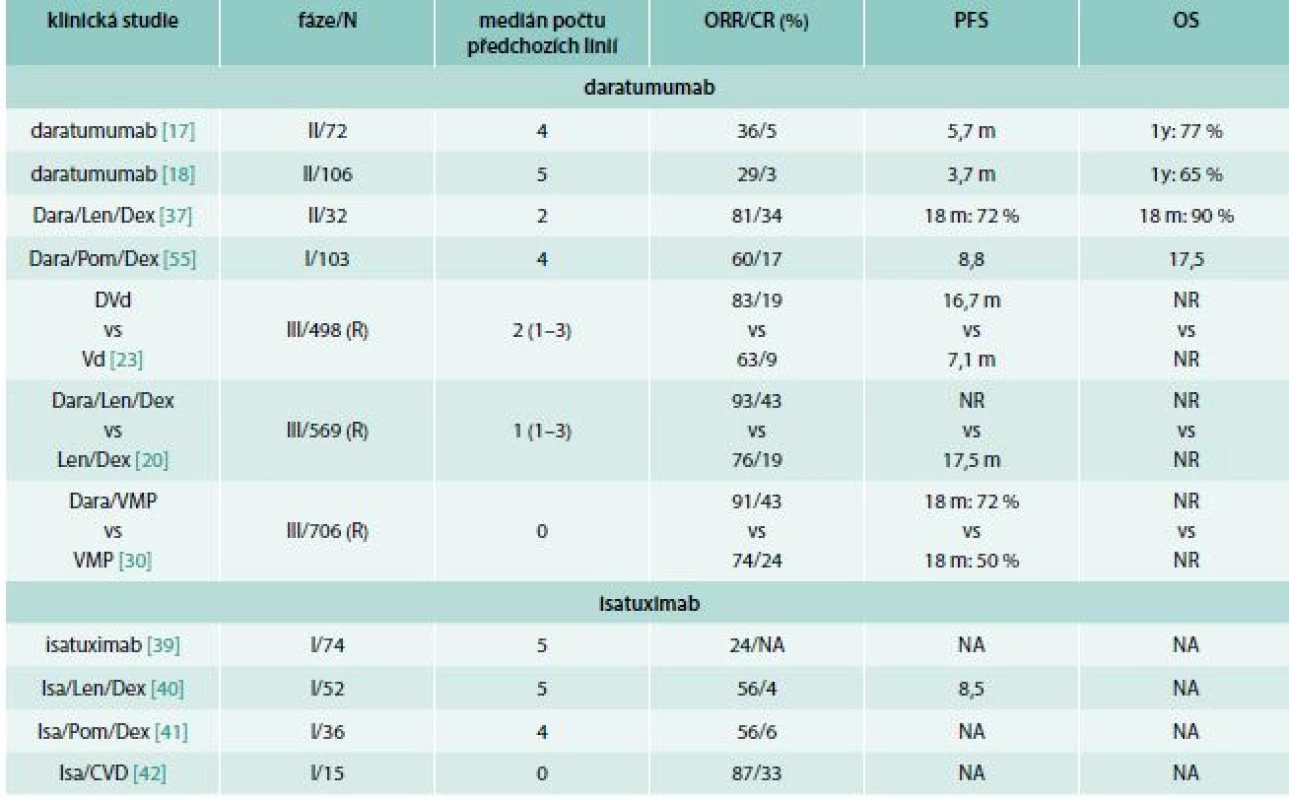
Bort – bortezomib CR – kompletní remise CVD – cyklofosfamid, bortezomib, dexametazon Dara – daratumumab Dex – dexamethason IRRs – reakce spojené s infuzí Isa – isatuximab Len – lenalidomid m – měsíc N – počet pacientů NA – není k dispozici NR – nedosaženo ORR – celková léčebná odpověď OS – čas celkového přežití PFS – čas do progrese nemoci R – randomizovaná studie VMP – bortezomib, melfalan, prednison Kombinace daratumumabu s pomalidomidem a dexametazonem byla hodnocena ve studii fáze 1 (EQUULEUS; MMY1001). Celkem bylo zařazeno 103 RRMM pacientů s mediánem čtyř předchozích léčebných linií (71 % nemocných refrakterních k bortezomibu, 30 % refrakterních ke karfilzomibu, 89 % refrakterních k lenalidomidu a 64 % dvojitě refrakterních k bortezomibu i lenalidomidu). Na léčbu odpovědělo 60 % (62/103) nemocných, z toho 8 % (8/103) dosáhlo sCR, 9 % (9/103) CR, 25 % (26/103) VGPR a 18 % (19/103) PR. Při podrobnější analýze jednotlivých podskupin nebyl pozorován rozdíl ve skupině s dvojitě refrakterním onemocněním (ORR 58 %). Medián PFS a OS pro celou kohortu byl 8,8 a 17,5 měsíce. Minimální reziduální nemoc stanovená citlivostí 10–5 byla negativní u 29 % (9/17) pacientů v CR či sCR [24].
Daratumumab u nemocných s nově diagnostikovaným mnohočetným myelomem
Kombinované režimy
Účinnost daratumumabu je ověřována v řadě kombinovaných režimů u režimů u pacientů s nově diagnostikovaným mnohočetným myelomem (NDMM). Probíhající studie studie fáze 3 jsou sumarizovány v tab. 4. Doposud nejdůležitějším klinickým výstupem je jeho zařazení do čtyřkombinace ve studii fáze 3 ALCYONE u nově diagnostikovaných pacientů nevhodných k autologní transplantaci krvetvorby, k jejichž léčbě byl přidán k současnému standardu – režimu VMP (bortezomib, melfalan, prednison). Přidání daratumumabu znamenalo signifikantní snížení rizika progrese nemoci (PFS v 18 měsících bylo ve skupině s Dara 71,6 % vs kontrolní rameno 50,2 %; HR 0,5; p < 0,001), zvýšení odpovědí na léčbu (ORR: 90,9 % vs 73,9 %; p < 0,001), zvýšení množství kompletních remisí (CR: 42,6 % vs 24,4 %; p < 0,001) včetně MRD negativity (22,3 % vs 6,2 %; p < 0,001; senzitivita 10–5) [25]. Americká FDA schválila tuto kombinaci v květnu 2018, evropská EMA následně v červnu 2018.
Daratumumab u „high-risk“ nemocných
Definice „high-risk“ onemocnění je definována dle přítomnosti alespoň jedné z následujících cytogenetických abnormalit: del 17p, t(4;14), t(14;16) [26]. Ze studie POLLUX vyplývá, že přidání daratumumabu k režimu RD (lenalidomid/dexametazon) významně zlepšuje léčebné výstupy i u prognosticky nepříznivé skupiny nemocných definované dle vysokého cytogenetického rizika (medián PFS 22,6 vs 10,2 měsíce, HR 0,53; p = 0,09). Nicméně s přihlédnutím k výsledkům skupiny se standardním rizikem (medián PFS: nedosažen vs 18,5 měsíce, HR 0,3; p < 0,0001) je zjevné, že ani daratumumab toto vysoké riziko nepřekonává [20,27]. V principu obdobné výsledky poskytla i studie CASTOR srovnávající režim Vd vs DVd. Přidání daratumumabu k režimu Vd u skupiny s vysokým rizikem prodloužilo medián PFS (11,2 měsíce vs 7,2 měsíce; HR 0,45, p = 0,005), nicméně u skupiny se standardním rizikem došlo k výraznějšímu prodloužení mediánu PFS (19,6 měsíce vs 7 měsíců (HR 0,26; p < 0,0001) [22,28,29]. Ve studii ALCYONE pro nově diagnostikované pacienty s MM nevhodné pro ASCT, srovnávající standardní léčbu VMP vs D-VMP (Dara/VMP), znamenalo přidání daratumumabu u „high-risk“ podskupiny nemocných dosažení podobného mediánu PFS v obou skupinách (VMP 18,1 měsíce vs D-VMP 18,0 měsíce; HR 0,78; n.s.) U pacientů se standardním rizikem vedlo přidání daratumumabu k výrazně lepším výsledkům (VMP 17,4 měsíců vs D-VMP nedosaženo; HR 0,39) [30].
Daratumumab u nemocných s doutnajícím mnohočetným myelomem
Daratumumab je nyní zkoušen i u pacientů s doutnajícím mnohočetným myelomem (smoldering multiple myeloma – SMM), tedy u nemocných, kteří by za standardních podmínek zatím nebyli indikováni k léčbě, ale riziko progrese do symptomatické formy je poměrně vysoké [31]. Ve studii CENTAURUS (randomizovaná multicentrická studie fáze 2) byla zkoušena 3 různá schémata podání daratumumabu (dlouhé, střední a krátké) pacientům se SMM se středním nebo vysokým rizikem. Předběžné výsledky 123 zařazených pacientů byly prezentovány na ASH 2017 (American Society of Hematology). Celková léčebná odpověď byla vyšší v rameni s dlouhým podáváním Dara vs se středním a krátkým (56 % vs 51 % vs 38 %), stejně jako PFS ve 12 měsících: 98 % vs 93 % vs 89 % [32]. Léčba byla všeobecně dobře tolerována a na základě těchto dat byla iniciována studie fáze 3 (Aquila – NCT03301220) u vysoce rizikových SMM pacientů s podkožně podávaným daratumumabem.
Dostupné výsledky všech klinických hodnocení s daratumumabem jsou přehledně sumarizovány v tab. 1. Dávkování daratumumabu, které se liší v jednotlivých režimech, je stručně shrnuto v tab. 2. Probíhající studie u mnohočetného myelomu jsou poté shrnuty v tab. 4 a u ostatních diagnóz v tab. 5.
Table 2. Dávkovací schéma daratumumabu a isatuximabu v monoterapii a v kombinovaných režimech 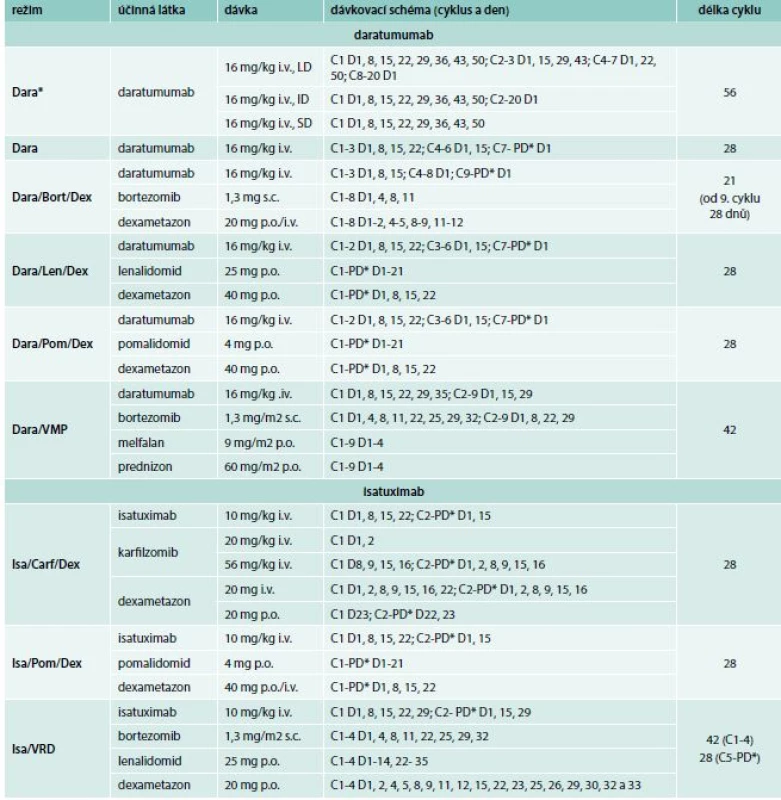
Bort – Bortezomib Carf – karfilzomib Dara – daratumumab Dara* – dávkovací schéma daratumumabu pro doutnající myelom Dex – dexametazon ID – středně intenzivní režim Isa – isatuximab i.v. – intranevenózně/in venam LD – vysoce intenzivní režim Len – lenalidomid PD* – do progrese nemoci, nebo netolerovatelné toxicity Pom – pomalidomid p.o. – perorálně/per os SD – nízce intenzivní režim s.c. – subkutánně/sub cutim VMP – bortezomib, melfalan, prednizon VRD – bortezomib, lenalidomid, dexametazon Vedlejší účinky a tolerance daratumumabu
Ačkoliv je CD38 téměř všudypřítomný antigen, toxicita daratumumabu je minimální, a to jak v monoterapii, tak v kombinaci se standardně užívanými látkami. Starší pacienti snášejí podávání daratumumabu bez větších potíží, tedy vyšší věk myelomových pacientů neznamená překážku v léčbě. Renální insuficience by neměla být důvodem redukce dávky farmaka, nicméně výsledky klinických studií u této skupiny nemocných zatím nejsou k dispozici [33]. Z vážnějších nežádoucích účinků stupňů 3 a 4 byly nejčastěji pozorovány neutropenie (13–52 %), trombocytopenie (13–45 %), anémie (12–14 %) a infekční komplikace (pneumonie 8 %). Prakticky jediným typickým vedlejším účinkem daratumumabu jsou tzv. reakce spojené s infuzí (Infusion-Related Reactions – IRRs). Nejčastějšími projevy jsou teplota, zimnice, rinitida, faryngitida, kašel či zvracení, z vážnějších přechodný bronchospazmus a laryngospazmus s projevy dušnosti. V publikovaných studiích s daratumumabem se vyskytují průměrně u asi 50 % nemocných (42–71 %), a to v naprosté většině v průběhu první infuze. Dominantně byly mírného stupně 1–2, jen v ojedinělých případech stupně vážnějšího. V rámci prevence IRR jsou rutinně podávány kortikoidy, antihistaminika a paracetamol 30–60 min před zahájením infuze, někdy i antileukotrieny. Stejně tak je podstatná i rychlost podání infuze, a proto by měla být první infuze podávána velmi pomalu (průměr 6 hod). Další infuze je již možno zrychlit na asi 3 hod, od 3. infuze je možno bezpečně podávat daratumumab během 90minutové infuze [34]. Důležitým prvním znakem nastupující reakce je sekrece z nosu či kongesce sliznic, kdy pacient žádá o kapesník. Tento moment by měl být ošetřujícím personálem rozeznán jako znamení a mělo by dojít ke zpomalení či zastavení infuze [17,18,33,35–37].
Klinické studie s isatuximabem u pacientů s mnohočetným myelomem
Isatuximab u nemocných s relabovaným/refrakterním mnohočetným myelomem
Monoterapie
Do první klinické studie fáze 1/2 (NCT01084252) s monoterapií isatuximabem byli zařazeni pacienti s refrakterním myelomem (Relapsed/Refractory Multiple Myeloma – RRMM) s mediánem 5 předchozích linií léčby. Ve druhé části této studie odpovědělo na léčbu 24 % (18/74) nemocných užívajících isatuximab (Isa) v dávce ≥ 10 mg/kg. Další data upřesňující délku PFS a OS nebyly v době analýzy dostupné [38,39].
Kombinované režimy
Ve studii fáze 1 (NCT01749969) byla testována kombinace Isa/Len/Dex u 52 pacientů s RRMM (medián 5 předchozích linií léčby, 83 % refrakterních k Len). V celé kohortě byla ORR 56 % (29/52) a u pacientů vstupně refrakterních k Len byla 52 % (22/42). Medián PFS pro celou kohortu byl 8,5 měsíce [40]. Další slibnou kombinací je režim Isa/Pom/Dex, který byl v iniciální studii fáze 1 (NCT02283775) podávaný RRMM pacientům s mediánem 4 předchozích léčebných linií (72 % bylo refrakterních k IMiDs, 69 % refrakterních k PIs a 58 % dvojitě refrakterních k PIs a IMiDs). Ze všech nemocných odpovědělo na léčbu 56 % (20/36), přičemž 3 % (1/36) pacientů dosáhlo sCR, 3 % (1/36) CR, 19 % (7/36) VGPR a 31 % (11/36) PR. Medián PFS a medián OS zatím nebyly publikovány [41].
Isatuximab u nemocných s NDMM
Kombinované režimy
Pro pacienty nevhodné k autologní transplantaci krvetvorby byla navržena studie fáze 1 (NCT02513186). Standardní režim bortezomib, cyklofosfamid a dexametazon v kombinaci s isatuximabem byl účinný u 87 % (13/15) nemocných s nejlepší léčebnou odpovědí sCR, kterou dosáhlo 13 % (2/15). Dalších 20 % (3/15) pacientů dosáhlo CR, 27 % (4/15) VGPR a 27 % (4/15) PR. V době analýzy nebyla délka sledování pacientů dostatečná k stanovení mediánu PFS a OS [42].
Dostupné výsledky klinických hodnocení s isatuximabem jsou sumarizovány v tab. 1. Na základě dosavadních slibných výsledků bylo iniciováno několik studií fáze 3, které jsou podrobně shrnuty v tab. 3. Dávkování isatuximabu je přehledně zobrazeno v tab. 2.
Table 3. Isatuximab: studie fáze 3 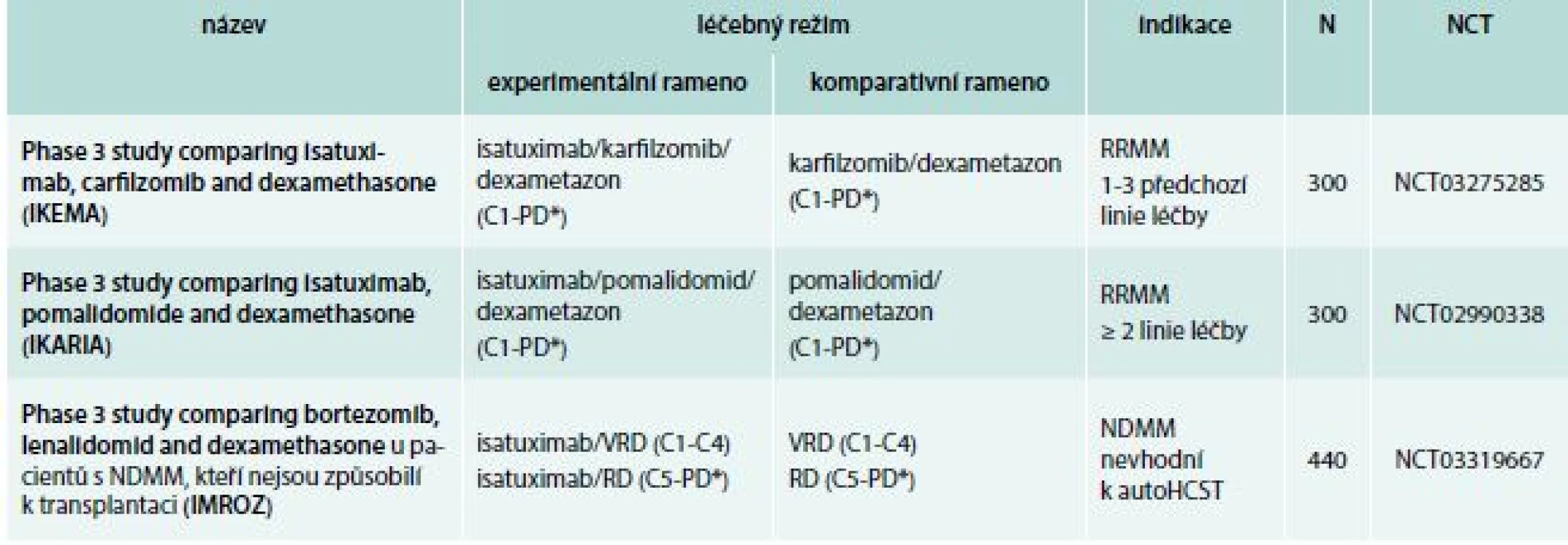
paautoHCST – autologní transplantace kmenových hematopoetických buněk C – cyklus N – očekávaný nábor pacientů NCT – identifikační číslo studie NDMM – nově diagnostikovaný mnohočetný myelom PD* – do progrese nemoci nebo netolerovatelné toxicity RD – lenalidomid, dexametazon RRMM – relabující/refrakterní mnohočetný myelom VRD – bortezomib, lenalidomid, dexametazon Table 4. Daratumumab: vybrané studie fáze 2 a 3 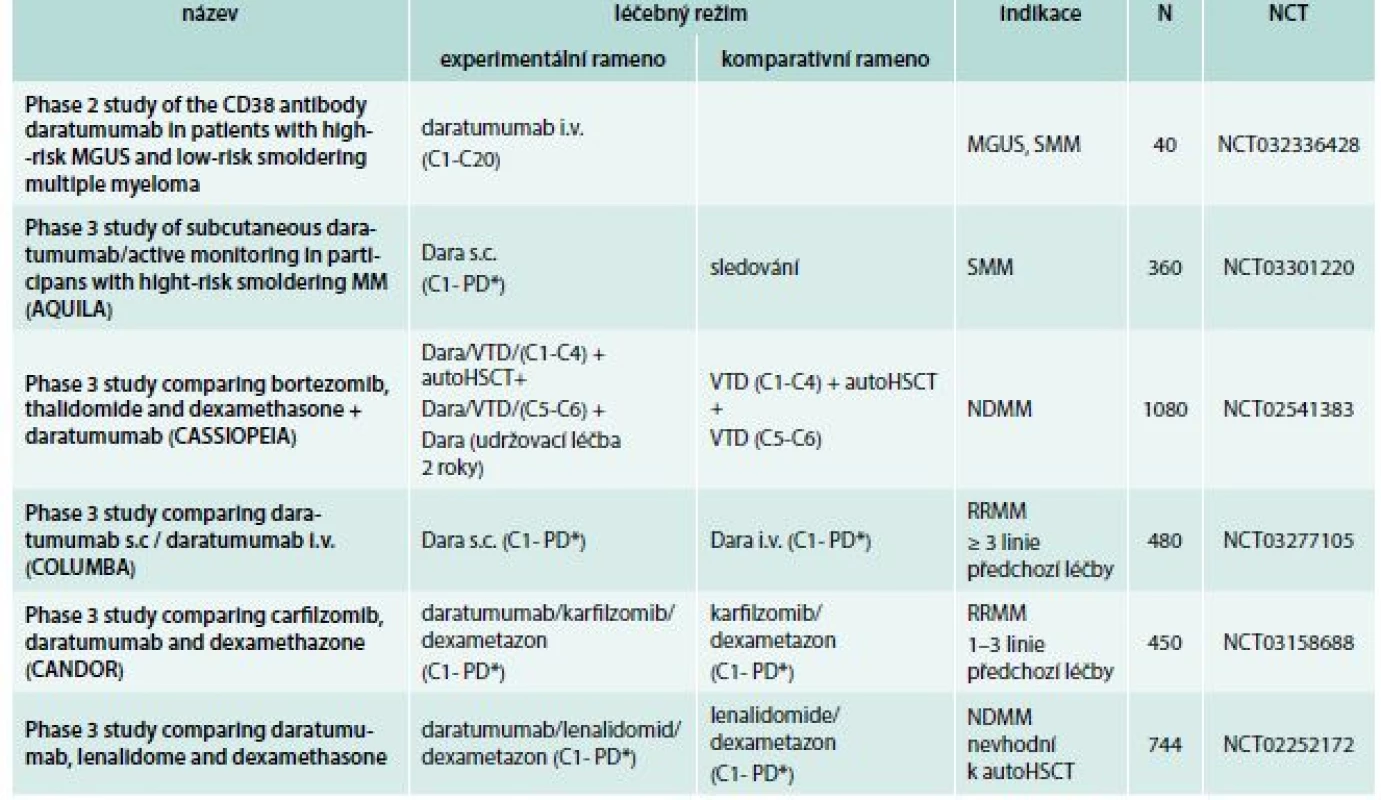
autoHCST – autologní transplantace kmenových hematopoetických buněk Bort – bortezomib C – cyklus Dara – daratumumab Dex – dexametazon i.v. – intravenózně Len – lenalidomid MGUS – monoklonální gamapatie nejasného významu N – očekávaný nábor pacientů NCT – identifikační číslo studie NDMM – nově diagnostikovaný mnohočetný myelom PD* – do progrese nemoci nebo netolerovatelné toxicity RRMM – relabující/refrakterní mnohočetný myelom SMM – doutnající mnohočetný myelom s.c. – subkutánně Thal – talidomid Vedlejší účinky a tolerance isatuximabu
Isatuximab jak v monoterapii, tak v kombinovaných režimech je dobře tolerovanou monoklonální protilátkou. Závažné nežádoucí účinky stupně 3 a 4 se v průběhu léčby objeví jen u části pacientů. Nejčastější je hematologická toxicita, a to zejména lymfopenie (58–64 %), dále neutropenie (9–60 %), trombocytopenie (38 %) a anémie (9–25 %). Z infekčních komplikací se nejvíce objevují respirační infekce (9–28 %). Zhruba polovina pacientů (44–56 %) vyvine v průběhu aplikace isatuximabu IRR, přičemž u drtivé většiny (88–94 %) dojde k této reakci v době prvního podání. Jen 2 % všech IRR mají formu závažné nežádoucí reakce. Nejčastějším projevem je teplota, kašel, nazální kongesce, nauzea či zvracení, ze závažnějších pak dušnost provázená bronchospazmem. Ke zmírnění potíží se před podáním isatuximabu podávají kortikoidy, antihistaminika a paracetamol a rovněž se koriguje rychlost infuze. Průměrně doba prvního podání je 3 hod (2–7 hod), délka další infuze je kratší a většinou netrvá déle než 2,5 hod [24,38–43].
Komplikace spojené s podáním anti-CD38 mAbs
V průběhu klinických hodnocení se objevily i nečekané a specifické vedlejší efekty podání anti-CD38 mAbs, jež mohou interferovat s mnohými laboratorními technikami, a tak negativně ovlivňovat celý léčebný proces:
- interference v rámci předtransfuzních vyšetření
- interference s ELFO a imunofixací
- interference s flowcytometrickým hodnocením minimální reziduální nemoci
V principu nejzásadnější je interference v transfuzním lékařství, jež je spojena s expresí CD38 na povrchu erytrocytů a způsobuje obraz panreaktivity v LISS-NAT (nepřímý antiglobulinový test). Výše uvedené může vést ke zpožděnému vydání či nevydání kompatibilního transfuzního přípravku v případě potřeby. Ze zhruba 2 000 pacientů léčených daratumumabem u žádného nedošlo k reakci při podání transfuze. Doporučeným postupem je proto informovat kolegy z krevní banky o léčbě anti-CD38 mAb u daného pacienta ještě před jeho prvním podáním a současně provedení vstupního imunohematologického vyšetření [44]. Interference s imunofixací může vést k nesprávnému podhodnocení kompletní remise u pacientů s IgGκ MM: v těchto případech může být terapeutická protilátka hodnocena jako reziduální množství pacientova paraproteinu [45]. Anti-CD38 mAbs způsobují komplikace i ve flowcytometrickém stanovení MRD – několika mechanizmy může vést k falešně negativnímu vyhodnocení MRD stavu [46,47]. Při použití anti-CD38 mAbs je obecně doporučeno užívání antivirotik (acyklovir, valacyklovir) v rámci prevence reaktivace pásového oparu (Varicella-zoster virus – VZV), a to po celou dobu léčby a 3 měsíce po jejím ukončení.
Diskuse a závěr
Zavedení anti-CD38 cílených monoklonálních protilátek do léčby mnohočetného myelomu znamenalo podobnou revoluci jako implementace rituximabu do terapie chronické lymfocytární leukemie či non-hodgkinských lymfomů. Většina dat pochází ze studií s daratumumabem, nicméně lze předpokládat, že efektivita isatuximabu bude velmi podobná. Monoterapie anti-CD38 mAbs vede k odpovědi u asi 30 % výrazně předléčených nemocných (medián 4 předchozích linií léčby) [17]. Tyto výjimečná data vedla k tomu, že byl daratumumab v monoterapii schválen i bez výsledků studie fáze 3, což je něco zcela raritního a k čemuž americká FDA přistupuje jen sporadicky. Monoklonální protilátky anti-CD38 jsou ideálním partnerem ke standardně používaným antimyelomovým režimům. Skutečně, daratumumab v kombinaci s Len/Dex, s Pom/Dex a s Vd výrazně zvyšuje efektivitu těchto režimů u relabovaných nemocných a tyto nové kombinace již byly schváleny k použití [24,35,36]. Na konci roku 2017 byly publikovány výsledky úspěšné studie i u nově diagnostikovaných pacientů s MM nevhodných k autologní transplantaci – přidání Dara k režimu VMP lze tedy považovat za nový standard léčby těchto pacientů [30]. Lze očekávat, že se anti-CD38 mAbs velmi brzo stanou součástí léčby všech nově diagnostikovaných pacientů s MM. Daratumumab je zkoušen i u pacientů s doutnajícím mnohočetným myelomem a pozitivní výsledky probíhající studie fáze 3 by mohly vést k zahájení této netoxické léčby už ve stadiu prekancerózy (studie AQUILA). Velmi slibné výsledky byly prezentovány i u dalších plazmocelulárních dyskrazií, jako je např. AL-amyloidóza [48]. Preklinická data jsou k dispozici u chronické lymfocytární leukemie, akutní lymfoblastické leukemie, akutní myeloidní leukemie i NK/T lymfomu [49–52] a u těchto diagnóz byly rovněž zahájeny klinické studie (tab. 5). Dalšími oblastmi, v nichž mohou být anti-CD38 mAbs s úspěchem použity, jsou solidní nádory, zejména slibná se zdá být kombinace s checkpoint inhibitory [53]. Jinou potenciální skupinou jsou také autoimunitní onemocnění, příkladem budiž autoimunitní hemolytická anémie, u níž byl Dara již s úspěchem použit [54]. Léčba anti-CD38 mAbs je velmi dobře tolerována. Specifickým nežádoucím účinkem jsou IRRs, které jsou po adekvátní premedikaci a edukaci ošetřujícího personálu dobře zvladatelné [55]. Navíc, od subkutánní formy podání lze v budoucnu očekávat jejich další zmírnění. Z vlastní zkušenosti lze říct, že snášenlivost těchto léků je skutečně výborná. Výjimkou jsou IRRs, které se vyskytují v naprosté většině případů pouze v průběhu prvního podání, a proto na tuto infuzi pacienty rutině hospitalizujeme. Jinou specifickou toxicitu jsme nepozorovali. Interference daratumumabu s předtransfuzním vyšetřením a flowcytometrickým vyšetřením lze do značné míry ovlivnit adekvátní informovaností laboratorních pracovníků o užití anti-CD38 mAbs. Věříme, že zavedení CD38 cílené léčby povede v blízké budoucnosti k možnosti skutečného vyléčení alespoň části nemocných s mnohočetným myelomem.
Table 5. Klinické studie s daratumumabem v léčbě hematoonkologických nemocí a solidních tumorů 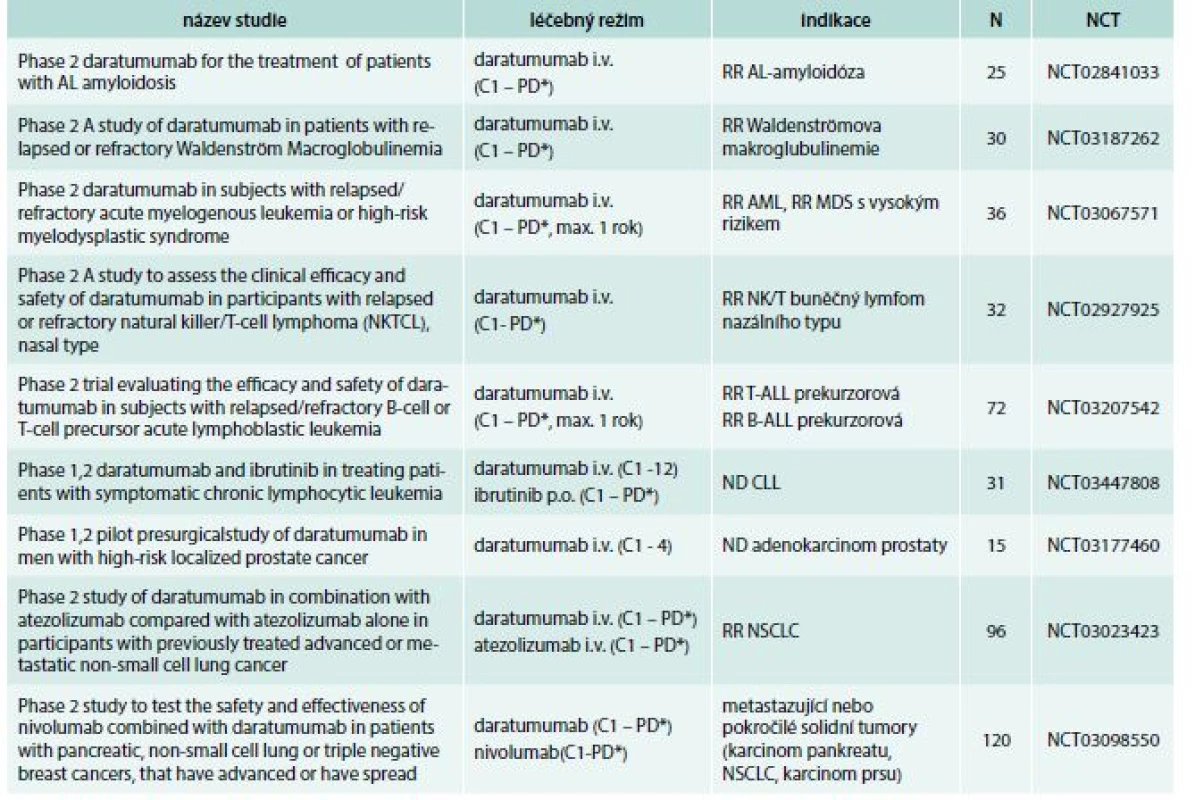
AL – amyloidóza – amyloidóza z volných lehkých řetězců AML – akutní myeloidní leukemie B-ALL – B lymfoblastická leukemie C – cyklus CLL – chronická lymfocytární leukemie i.v. – intravenózně max. – maximálně MDS – myelodysplastický syndrom N – očekávaný nábor pacientů NCT – identifikační číslo studie ND – nově diagnostikované onemocnění NSCLC – nemalobuněčný karcinom plic PD* – do progrese nemoci nebo netolerovatelné toxicity RR – relabující/refrakterní onemocnění T-ALL – T lymfoblastická leukemie Autoři by rádi poděkovali Denise Hrnčířové za pomoc při tvorbě tabulek a při zpracování manuskriptu.
Práce vznikla za podpory MZ ČR – RVO – FNOs/2017, Institucionálního rozvojového plánu OU v Ostravě (projekt č. IRP03_2018–2020), specifického VŠ výzkumu Lékařské fakulty Ostravské university (SGS02/LF2017–2018).
MUDr. Tomáš Jelínek
Klinika hematoonkologie LF OU a FN, Ostrava
Doručeno do redakce 10. 4. 2018
Přijato po recenzi 12. 5. 2018
Sources
- Maluskova D, Svobodová I, Kucerova M et al. Epidemiology of Multiple Myeloma in the Czech Republic. Klin Onkol 2017; 30(Suppl 2): 35–42.
- Sant M, Allemani C, Tereanu C et al. Incidence of hematologic malignancies in Europe by morphologic subtype: results of the HAEMACARE project. Blood 2010; 116(19): 3724–3734. Dostupné z DOI: <http://dx.doi.org/10.1182/blood-2010–05–282632>.
- Lahuerta JJ, Paiva B, Vidriales MB et al. Depth of Response in Multiple Myeloma: A Pooled Analysis of Three PETHEMA/GEM Clinical Trials. J Clin Oncol 2017; 35(25): 2900–2910. Dostupné z DOI: <http://dx.doi.org/10.1200/JCO.2016.69.2517>.
- San Miguel J, Weisel K, Moreau P et al. Pomalidomide plus low-dose dexamethasone versus high-dose dexamethasone alone for patients with relapsed and refractory multiple myeloma (MM-003): a randomised, open-label, phase 3 trial. Lancet Oncol 2013; 14(11): 1055–1066.Dostupné z DOI: <http://dx.doi.org/10.1016/S1470–2045(13)70380–2>.
- Moreau P, Masszi T, Grzasko N et al. Oral Ixazomib, Lenalidomide, and Dexamethasone for Multiple Myeloma. N Engl J Med 2016; 374(17): 1621–1634. Dostupné z DOI: <http://dx.doi.org(10.1056/NEJMoa1516282>.
- Stewart AK, Rajkumar SV, Dimopoulos MA et al. Carfilzomib, lenalidomide, and dexamethasone for relapsed multiple myeloma. N Engl J Med 2015; 372(2): 142–152. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa1411321>.
- Lonial S, Dimopoulos M, Palumbo A et al. Elotuzumab Therapy for Relapsed or Refractory Multiple Myeloma. N Engl J Med 2015; 373(7): 621–631. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa1505654>.
- San-Miguel JF, Hungria VTM, Yoon SS et al. Panobinostat plus bortezomib and dexamethasone versus placebo plus bortezomib and dexamethasone in patients with relapsed or relapsed and refractory multiple myeloma: a multicentre, randomised, double-blind phase 3 trial. Lancet Oncol 2014; 15(11): 1195–1206. Dostupné z DOI: <http://dx.doi.org/10.1016/S1470–2045(14)70440–1>. Erratum in Lancet Oncol 2015; 16(1): e6.
- Malavasi F, Funaro A, Roggero S et al. Human CD38: a glycoprotein in search of a function. Immunol Today 1994; 15(3): 95–97. Dostupné z DOI: <http://dx.doi.org/10.1016/0167–5699(94)90148–1>.
- Deaglio S, Mehta K, Malavasi F. Human CD38: a (r)evolutionary story of enzymes and receptors. Leuk Res 2001; 25(1): 1–12.
- Overdijk MB, Verploegen S, Bögels M et al. Antibody-mediated phagocytosis contributes to the anti-tumor activity of the therapeutic antibody daratumumab in lymphoma and multiple myeloma. MAbs 2015; 7(2): 311–321. Dostupné z DOI: <http://dx.doi.org/10.1080/19420862.2015.1007813>.
- Jelinek T, Hajek R. Monoclonal antibodies – A new era in the treatment of multiple myeloma. Blood Rev 2016; 30(2): 101–110. Dostupné z DOI: <http://doi: 10.1016/j.blre.2015.08.004>.
- Krejcik J, Casneuf T, Nijhof IS et al. Daratumumab depletes CD38+ immune regulatory cells, promotes T-cell expansion, and skews T-cell repertoire in multiple myeloma. Blood 2016; 128(3): 384–394. Dostupné z DOI: <http://dx.doi.org/10.1182/blood-2015–12–687749>.
- Deckert J, Wetzel MC, Bartle LM et al. SAR650984, a novel humanized CD38-targeting antibody, demonstrates potent antitumor activity in models of multiple myeloma and other CD38+ hematologic malignancies. Clin Cancer Res 2014; 20(17): 4574–4583. Dostupné z DOI: <http://dx.doi.org/10.1158/1078–0432.CCR-14–0695>.
- Moreno L, Zabaleta A, Alignani D et al. Critical Analysis on the Mechanism of Action (MoA) of the Anti-CD38 Monoclonal Antibody Isatuximab in Multiple Myeloma (MM). Blood 2016; 128(16): 2105–2105. Dostupné z DOI: <http://dx.doi.org/10.1182/blood-2016–07–727958>.
- Feng X, Zhang L, Acharya C et al. Targeting CD38 suppresses induction and function of T regulatory cells to mitigate immunosuppression in multiple myeloma. Clin Cancer Res 2017; 23(15): 257–266. Dostupné z DOI: <http://dx.doi.org/10.1158/1078–0432.CCR-16–3192>.
- Lokhorst HM, Plesner T, Laubach JP et al. Targeting CD38 with Daratumumab Monotherapy in Multiple Myeloma. N Engl J Med 2015; 373(13): 1207–1219. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa1506348>.
- Lonial S, Weiss BM, Usmani SZ et al. Daratumumab monotherapy in patients with treatment-refractory multiple myeloma (SIRIUS): an open-label, randomised, phase 2 trial. Lancet 2016; 387(10027):1551–1560. Dostupné z DOI: <doi: 10.1016/S0140–6736(15)01120–4>.
- Usmani SZ, Weiss BM, Plesner T et al. Clinical efficacy of daratumumab monotherapy in patients with heavily pretreated relapsed or refractory multiple myeloma. Blood 2016; 128(1): 37–44. Dostupné z DOI: <http://dx.doi.org/10.1182/blood-2016–03–705210>.
- Dimopoulos MA, Oriol A, Nahi H et al. Daratumumab, Lenalidomide, and Dexamethasone for Multiple Myeloma. N Engl J Med 2016; 375(14): 1319–1331. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa1607751>.
- Dimopoulos MA, White DJ, Benboubker L et al. Daratumumab, Lenalidomide, and Dexamethasone (DRd) Versus Lenalidomide and Dexamethasone (Rd) in Relapsed or Refractory Multiple Myeloma (RRMM): Updated Efficacy and Safety Analysis of Pollux. Blood 2017; 130(Suppl 1): 739–739.
- Palumbo A, Chanan-Khan A, Weisel K et al. Daratumumab, Bortezomib, and Dexamethasone for Multiple Myeloma. N Engl J Med 2016; 375(8): 754–766. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa1606038>.
- Spencer A, Hungria VTM, Mateos MV et al. Daratumumab, Bortezomib, and Dexamethasone (DVd) Versus Bortezomib and Dexamethasone (Vd) in Relapsed or Refractory Multiple Myeloma (RRMM): Updated Efficacy and Safety Analysis of Castor. Blood 2017; 130(Suppl 1): 3145–3145.
- Chari A, Suvannasankha A, Fay JW et al. Daratumumab plus pomalidomide and dexamethasone in relapsed and/or refractory multiple myeloma. Blood 2017; 130(8): 974–981. Dostupné z DOI: <http://dx.doi.org/10.1182/blood-2017–05–785246>.
- Mateos MV, Dimopoulos MA, Cavo M et al. Daratumumab plus Bortezomib, Melphalan, and Prednisone for Untreated Myeloma. N Engl J Med 2018; 378(6): 518–528. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa1714678>.
- Moreau P, San Miguel J, Sonneveld P et al. Multiple myeloma: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2017; 28(Suppl 4): iv52-iv61. Dostupné z DOI: <http://dx.doi.org/10.1093/annonc/mdx096>.
- Moreau P, Oriol A, Kaufman JL et al. Daratumumab, Lenalidomide, and Dexamethasone (DRd) Versus Lenalidomide and Dexamethasone (Rd) in Relapsed or Refractory Multiple Myeloma (RRMM) Based on Prior Treatment History, Renal Function, and Cytogenetic Risk: Subgroup Analyses of Pollux. Blood 2017; 130(Suppl 1): 1883–1883.
- Mateos MV, Estell J, Barreto W et al. Eficacy of Daratumumab, Bortezomib, and Dexamethasone Versus Bortezomib and Dexamethasone in Relapsed or Refractory Myeloma Based on Prior Lines of Therapy: Updated Analysis of Castor. Blood 2016; 128(22): 1150.
- Weisel KC, San Miguel J, Cook G et al. Efficacy of daratumumab in combination with lenalidomide plus dexamethasone (DRd) or bortezomib plus dexamethasone (DVd) in relapsed or refractory multiple myeloma (RRMM) based on cytogenetic risk status. J Clin Oncol 2017; 35(15 Suppl): 8006–8006. Dostupné z DOI: <http://dx.doi.org/10.1200/JCO.2017.35.15_suppl.8006>.
- Mateos MV, Dimopoulos MA, Cavo M et al. Daratumumab plus Bortezomib, Melphalan, and Prednisone for Untreated Myeloma. N Engl J Med 2018; 378(6): 518–528. Dostupné z DOI: <http://doi: 10.1056/NEJMoa1714678>.
- Landgren O, Kyle RA, Pfeiffer RM et al. Monoclonal gammopathy of undetermined significance (MGUS) consistently precedes multiple myeloma: a prospective study. Blood 2009; 113(22): 5412–5417. Dostupné z DOI: <http://dx.doi.org/10.1182/blood-2008–12–194241>.
- Hofmeister CC, Chari A, Cohen Y et al. Daratumumab Monotherapy for Patients with Intermediate or High-Risk Smoldering Multiple Myeloma (SMM): Centaurus, a Randomized, Open-Label, Multicenter Phase 2 Study. Blood 2017; 130(Suppl 1): 510–510.
- van de Donk NWCJ, Moreau P, Plesner T et al. Clinical efficacy and management of monoclonal antibodies targeting CD38 and SLAMF7 in multiple myeloma. Blood 2016; 127(6): 681–695. Dostupné z DOI: <http://dx.doi.org/10.1182/blood-2015–10–646810>.
- Barr H, Dempsey J, Waller A et al. Ninety-Minute Daratumumab Infusion Is Safe in Multiple Myeloma. Blood 2018. Dostupné z DOI: <http://dx.doi.org/10.1038/s41375–018–0120–2>.
- Dimopoulos MA, Oriol A, Nahi H et al. Daratumumab, Lenalidomide, and Dexamethasone for Multiple Myeloma. N Engl J Med 2016; 375(14): 1319–1331. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa1607751>.
- Palumbo A, Chanan-Khan A, Weisel K et al. Daratumumab, Bortezomib, and Dexamethasone for Multiple Myeloma. N Engl J Med 2016; 375(8): 754–766. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa1606038>.
- Plesner T, Arkenau HT, Gimsing P et al. Phase 1/2 study of daratumumab, lenalidomide, and dexamethasone for relapsed multiple myeloma. Blood 2016; 128(14): 1821–1828. Dostupné z DOI: <http://dx.doi.org/10.1182/blood-2016–07–726729>.
- Martin TG, Hsu K, Strickland SA et al. A phase I trial of SAR650984, a CD38 monoclonal antibody, in relapsed or refractory multiple myeloma. J Clin Oncol 2014; 32(15 Suppl): 8532–8532. Dostupné z DOI: <http://dx.doi.org/10.1200/jco.2014.32.15_suppl.8532>.
- Richter JR, Martin TG, Vij R et al. Updated data from a phase II dose finding trial of single agent isatuximab (SAR650984, anti-CD38 mAb) in relapsed/refractory multiple myeloma (RRMM). J Clin Oncol 2016; 34(15 Suppl): 8005–8005. Dostupné z DOI: <http://dx.doi.org/10.1200/JCO.2016.34.15_suppl.8005>.
- Martin T, Baz R, Benson DM et al. A phase 1b study of isatuximab plus lenalidomide and dexamethasone for relapsed/refractory multiple myeloma. Blood 2017; 129(25): 3294–3303. Dostupné z DOI: <http://dx.doi.org/10.1182/blood-2016–09–740787>.
- Richardson PG, Mikhael J, Usmani SZ et al. Updated Results from a Phase Ib Study of Isatuximab Plus Pomalidomide (Pom) and Dexamethasone (dex) in Relapsed/Refractory Multiple Myeloma (RRMM). Blood 2017; 130(Suppl 1): 1887–1887.
- Ocio EM, Bringhen S, Oliva S et al. A Phase Ib Study of Isatuximab in Combination with Bortezomib, Cyclophosphamide, and Dexamethasone (VCDI) in Patients with Newly Diagnosed Multiple Myeloma Non-Eligible for Transplantation. Blood 2017; 130(Suppl 1): 3160–3160.
- Martin TG, Mannis GN, Chari A et al. Phase Ib Study of Isatuximab and Carfilzomib in Relapse and Refractory Multiple Myeloma. Blood 2016; 128(22): 2111–2111.
- Dimopoulos MA, Sonneveld P, Sun H. Daratumumab and Blood-Compatibility Testing. N Engl J Med 2016; 375(25): 2497–2498.
- van de Donk NWCJ, Otten HG, El Haddad O et al. Interference of daratumumab in monitoring multiple myeloma patients using serum immunofixation electrophoresis can be abrogated using the daratumumab IFE reflex assay (DIRA). Clin Chem Lab Med 2016; 54(6): 1105–1109. Dostupné z DOI: <http://dx.doi.org/10.1515/cclm-2015–0888>.
- Jelinek T, Bezdekova R, Zatopkova M et al. Current applications of multiparameter flow cytometry in plasma cell disorders. Blood Cancer J 2018; 8(1): e621. Dostupné z DOI: <http://dx.doi.org/10.1038/bcj.2017.101>. Erratum for Current applications of multiparameter flow cytometry in plasma cell disorders. [Blood Cancer J. 2017]
- Jelínek T, Kořístka M, Čermáková Z et al. Daratumumab – Hope for Myeloma Patients, a Challenge for Clinical Laboratories. Klin Onkol Winter 2017; 30 : 13–19. Dostupné z DOI: <http://dx.doi.org/10.14735/amko201713>.
- Kaufman GP, Schrier SL, Lafayette RA et al. Daratumumab yields rapid and deep hematologic responses in patients with heavily pretreated AL amyloidosis. Blood 2017; 130(7): 900–902. Dostupné z DOI: <http://dx.doi.org/10.1182/blood-2017–01–763599>.
- Jelinek T, Zabaleta A, Perez C et al. Pre-Clinical Efficacy of the Anti-CD38 Monoclonal Antibody (mAb) Isatuximab in Acute Myeloid Leukemia (AML). Blood 2017; 130(Suppl 1): 2655.
- Matas-Céspedes A, Vidal-Crespo A, Rodriguez V et al. The Human CD38 Monoclonal Antibody Daratumumab Shows Antitumor Activity and Hampers Leukemia-Microenvironment Interactions in Chronic Lymphocytic Leukemia. Clin Cancer Res 2017; 23(6): 1493–1505. Dostupné z DOI: <http://dx.doi.org/10.1158/1078–0432.CCR-15–2095>.
- Bride KL, Vincent TL, Im SY et al. Preclinical efficacy of daratumumab in T-cell acute lymphoblastic leukemia. Blood 2018; 131(9): 995–999. Dostupné z DOI: <http://dx.doi.org/10.1182/blood-2017–07–794214>.
- Hari P, Raj RV, Olteanu H. Targeting CD38 in Refractory Extranodal Natural Killer Cell-T-Cell Lymphoma. N Engl J Med 2016; 375((15): 1501–1502. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMc1605684>.
- Jelinek T, Hajek R. PD-1/PD-L1 inhibitors in multiple myeloma: The present and the future. OncoImmunology 2016; 5(12): e1254856. Dostupné z DOI: <http://dx.doi.org/10.1080/2162402X.2016.1254856>.
- Tolbert VP, Goldsby R, Huang J et al. Daratumumab Is Effective in the Treatment of Refractory Post-Transplant Autoimmune Hemolytic Anemia: A Pediatric Case Report. Blood 2016; 128(22): 4819–4819.
- Chari A, Nahi H, Mateos MV et al. Subcutaneous Delivery of Daratumumab in Patients (pts) with Relapsed or Refractory Multiple Myeloma (RRMM): Pavo, an Open-Label, Multicenter, Dose Escalation Phase 1b Study. Blood 2017; 130(Suppl 1): 838–838.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2018 Issue 10-
All articles in this issue
- Je funkčná dyspepsia skutočne tak častá?
- Ovlivňuje doba od potíží do léčení průběh žilní trombózy dolních končetin?
- Tranzientní elastografie – přínos v hodnocení vývoje jaterního onemocnění
- Některé příčiny špatné adherence k dlouhodobé terapii statiny a jejich řešení
- Angioedém indukovaný inhibitory enzymu konvertujícího angiotenzin: epidemiologie, patogeneze a léčba
- Obštrukčné spánkové apnoe a dyslipidémia
- CD38 cílená léčba u mnohočetného myelomu
- Steatóza slinivky břišní: klinický význam
- Léčba pravé polycytemie
- Weberova-Christianova choroba: kazuistika
- Mnohočetné postižení tenkého střeva neuroendokrinním tumorem: kazuistika a přehled literatury
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Steatóza slinivky břišní: klinický význam
- Léčba pravé polycytemie
- Weberova-Christianova choroba: kazuistika
- Angioedém indukovaný inhibitory enzymu konvertujícího angiotenzin: epidemiologie, patogeneze a léčba
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

