-
Medical journals
- Career
Léčba pravé polycytemie
: Petr Dulíček
: IV. interní hematologická klinika LF UK a FN Hradec Králové
: Vnitř Lék 2018; 64(10): 955-960
:
Pravá polycytemie je chronické klonální myeloproliferativní onemocnění charakterizované erytrocytózou, leukocytózou a trombocytózou. Doba přežití je snížena ve srovnání s normální populací. Mezi hlavní příčiny úmrtí patří trombohemoragické komplikace, progrese do fibrózy a transformace do akutní leukemie. Diagnostickým markerem je přítomnost JAK2 kinázy, mezi další hlavní kritéria dle WHO klasifikace z roku 2016 patří i hodnota hemoglobinu, hematokritu, objem erytrocytární masy a nález v trepanobiopsii. Terapie závisí na rozdělení nemocných dle míry rizika v závisti na věku a osobní anamnéze trombózy. Nemocní v nízkém riziku jsou v 1. linii léčeni venepunkcí a malou dávku aspirinu. Cytoreduktivní léčba je indikována u vysokého rizika. Interferon α prokázal účinnost v mnoha klinických studiích. Pegylovaná forma je dobře snášena a výhodou je nižší frekvence podávání. Proto je v doporučení Central European Myeloproliferative Neoplasm Organisation v 1. linii léčby. Ropeginterferon α-2b se ukazuje jako účinnější než hydroxyurea. Ta je velmi suspektní z leukemogenního potencionálu. JAK1/JAK2 inhibitor ruxolitinib je možné podávat u jedinců rezistentních na hydroxyureu, či u těch, kteří ji netolerují.
Klíčová slova:
diagnostika – léčba – pravá polycytemie
Úvod
Pravá polycytemie (polycythaemia vera – PV) je chronické klonální onemocnění patřící mezi Ph negativní (Ph-) myeloproliferativní neoplazie (MPN). Tam dále řadíme zejména esenciální trombocytemii (ET) a primární myelofibrózu (PMF). PV je onemocnění staršího věku (výskyt v mediánu 60 let věku), ale na MPN je důležité myslet i u mladých jedinců, u nichž je prvním projevem onemocnění trombóza, nejčastěji v splanchnické oblasti. Incidence PV se udává 1,9/100 000 (u mužů 2,8/u žen 1,3). V 95 % případů se vyskytuje JAK2 kináza v exonu 14 (V617F), u 3 % případů pak v exonu 12. Medián délky přežívání u PV činí 14 let, je tedy delší než u PMF, ale kratší než u ET [1].
Prognóza záleží na přítomnosti leukocytózy a abnormálního karyotypu. Existují proto různé prognostické modely založené na věku, leukocytóze > 15 × 109/l a osobní anamnéze venózního tromboembolizmu (VTE). Medián přežití je pak 27,8 let u nízkého rizika, 18,9 let u intermediálního a 10,9 let u vysokého rizika. Dle největší mezinárodní studie, Barbui T et al 2015, (1 545 nemocných) patří mezi rizikové faktory (RF) pro celkové přežívání: věk > 61 let, leukocytóza > 10,5 × 109/l, VTE v anamnéze a abnormální karyotyp. Medián přežívání, zaznamenaný v této studii, byl 23 let bez těchto rizikových faktorů a 9 let bez prvních 2 rizikových faktorů [2].
Trombohemoragické komplikace jsou nejčastější příčinou morbidity a mortality, pak následuje přechod do myelofibrózy a transformace do akutní leukemie [3].
Diagnostika pravé polycytemie
Diagnostika PV prošla a stále prochází vývojem, a to od diagnostických kritérií Polycythemia Vera Study Group (PVSG) přes WHO klasifikaci 2001 až po současnou z roku 2016.
Diagnostická kritéria WHO 2016 jsou následující:
diagnostická kritéria velká
- hemoglobin (Hb) > 165 g/l u mužů, > 160 g/l u žen nebo hematokrit (HTK) > 49 % u mužů, > 48 % u žen, či zvýšení RCM (Red blood Cell Mass) o 25 %
- trepanobiopsie – hypercelularita vzhledem k věku: trilineární hematopoéza (panmyelosis)
- JAK2V617F nebo JAK2 mutace v exonu 12
diagnostické kritérium malé
- snížená hodnota erytropoetinu
Diagnóza PV je tehdy, pokud jsou splněna všechna 3 hlavní kritéria nebo první 2 hlavní a malé kritérium.
Změny hemostázy patří mezi průvodní znaky PV s velmi variabilní klinickou expresivitou. U některých nejsou přítomny vůbec, u některých jsou spojeny s vyšším rizikem VTE či arteriální trombózy, u některých s vyšším rizikem krvácení. Incidence dle studie ECLAP (The European Collaboration on Low-dose Aspirin in PV), která sledovala 1 638 pacientů s PV (variabilní čas od diagnózy), v době náboru byla pozitivní osobní anamnéza trombózy ve 39 % (29 % arteriální, 14 % venózní) [4].
Při dalším sledování (medián 2,8 l) mělo kardiovaskulární příhodu 14 % nemocných (incidence 5,5 příhody/100 nemocných/rok, z toho 6,95 u pacientů s vyšším rizikem a 2,52 u nízkého rizika). Trombotická příhoda byla příčinou úmrtí v 41 %. Anamnézu krvácení mělo při náboru 8,1 % nemocných, resp. 2,9 % v dalším sledování. V novější a nedávné studii IWGMRT (International Working Group for MPN Research and Treatment) mělo v době diagnózy pozitivní osobní anamnézu (OA) trombózy 23 % jedinců (16 % arteriální, 7,2 % žilní) [5].
Výskyt trombotických událostí v dalším sledování (medián 6,9 roků) byl 21 % (12 % arteriální a 9 % žilní trombózy). Tyto výsledky jsou podobné jako v další práci (CYTO-PV) [6], kde arteriální trombóza byla v 17 % a venózní v 12 %. Za rizikové faktory pro trombózu je považován věk nad 65 let, trombóza v OA, arteriální hypertenze, kouření, srdeční selhání. Dnes jsou rizikové faktory více upřesněny a rozděleny na RF pro VTE a arteriální trombózu.
Mezi RF VTE patří přítomnost JAK2 kinázy, věk nad 65 let, vrozené nebo získané trombofilní stavy, VTE v OA, leukocytóza > 15 × 109/l.
Mezi rizikové faktory arteriální trombózy patří věk nad 65 let, kouření, diabetes mellitus, arteriální hypertenze, porucha lipidového metabolizmu. Jedinci s fibrózou kostní dřeně mají nižší riziko trombózy. Trombocytóza byla rizikovým faktorem pro trombózu i v registru nemocných léčených anagrelidem [7].
Rizikem pro krvácení jsou vysoké počty trombocytů, které vedou k získanému von Willebrandovu syndromu. Ke krvácení dochází často po požití aspirinu nebo nesteroidních antiflogistik. Proto by tyto léky neměly být podávány při hodnotě vWFRiCo (von Willebrand factor ristocetin co-factor activity) ≤ 30 %.
Terapie pravé polycytemie
Léčba PV není celosvětově zcela jednotná, liší se dle jednotlivých doporučených postupů (různé názory na toxicitu léků) a dostupnosti léků. Nicméně je nutno ctít princip „primum non nocere“.
Cíle terapie
Cíle terapie jsou následující:
- prevence trombotických komplikací – VTE, ATE, mikrocirkulace
- prevence transformace do myelofibrózy
- prevence transformace do akutní leukemie
- léčba symptomů – svědění kůže aj
V současné době nemáme možnost ovlivnit přechod do myelofibrózy či akutní leukemie, ale můžeme předcházet trombotickým a krvácivým komplikacím.
Koho léčit
Přes řadu pokroků v poznání patogeneze onemocnění i trombotických komplikací stále při odpovědi na tuto otázku platí rozdělení nemocných dle míry rizika založených na věku nemocného a osobní anamnéza trombotické příhody (tab. 1).
1. Rozdělení nemocných dle míry rizika trombózy 
Čím léčit
Před zavedením venepunkce byla doba přežití nemocných pouze 2 roky, a to z důvodu velkého počtu trombotických komplikací [8].
Venepunkce (VP) s cílem hematokritu (HTK) < 45 % je skutečně spojena s redukcí trombotických komplikací. Přidání aspirinu vede k dalšímu snížení trombotických příhod [9].
Proto je dnes doporučena u všech jedinců venepunkce s cílem HTK ≤ 45 % a malá dávka aspirinu bez ohledu na přítomnost či absenci dalších rizikových faktorů. Pokud není HTK dobře kontrolován a je současně přítomna leukocytóza, riziko trombózy roste.
Historicky se v léčbě podával radioaktivní fosfor (32P), chlorambucil, dosud v některých částech světa i pipobroman.
Hydroxyurea (HU) je historicky dlouho a velmi často užívaným lékem v léčbě PV, na základě několika studií (včetně PVSG), v nichž užívání HU snížilo výskyt trombózy ve srovnání s venepunkcí (6,6 % vs 14 %) během 2 let. Také přechod do leukemické transformace ve srovnání s léčbou chlorambucilem či 32P byl nižší (5,9 % vs 10,6 %, respektive vs 8,3 % během prvních 11 let terapie).
O leukogenicitě HU dodnes panují různé názory, někteří ji považují za nedostatečně prokázanou s výskytem 1,0–5,6 % [10]. Jiné práce ukazují na zvýšené riziko transformace do akutní leukemie [11] či vyššího rizika nádorů, zejména kožních. Rozhodně dochází k výskytu různých keratóz a hyperkeratóz. Také u jedinců léčených s PV a postrombotickým syndromem je vzhledem ke kožnímu nálezu nutno často terapii ukončit. Návrat k původnímu stavu trvá většinou asi 5 měsíců. Také 10–20 % nemocných netoleruje léčbu, nebo na ní nereaguje, event. i malé dávky vedou k cytopenii.
Interferon (INF) se v léčbě MPN užívá více než 30 let. IFNα není považován za leukemogenní [12]. IFN je jediným známým lékem cíleným na maligní klony a s potenciálem k modifikaci onemocnění. V současné době jsou však všechny standardní i pegylované INF u MPN „off-label“ indikací. Nicméně zejména pegylovaná forma se v terapii jeví jako slibná. Pegylovaný IFNα v iniciální fázi terapie PV se projevuje jako bezpečný a účinný s dosažením kompletní hematologické remise v 76–95 % a molekulárně genetické v 18 %.
V probíhající fázi 3 klinické studie dosáhlo hematologickou remisi 81 % a molekulárně genetickou 19 %.
Otázkou je, zdali dosažení těchto remisí bude mít vliv na progresi onemocnění a na výskyt trombózy.
Naše pracoviště se účastní studie s RopegINF (charakteristika přípravku je na obr).
Jedná o nový monopegylovaný interferon α-2b s jedinou izoformou díky inovativní pegylační technologii. Dávkování 1krát každých 14 dní (1krát měsíčně při dlouhodobé udržovací léčbě) pomocí předplněného autoaplikačního pera s nastavitelnou dávkou je uživatelsky velmi přívětivé. Ve studii PEGINVERA (Pegylated Interferon Alpha 2b to Treat Polycythemia Vera) bylo dosaženo hematologické remise v 90 % (kompletní v 47 % a parciální v 43 %). Kompletní a parciální molekulární odpověď bylo dosaženo v 21 %, resp. v 47 % [12]. Také data z fáze 3 klinické studie PROUD-PV, která srovnává léčbu ropeginterferonem α-2b s HU jsou velmi slibná [13]. Ropeginterferon α-2b je ve fázi registrace v EU.
Co se týče 2. linie léčby, tak byl v randomizované klinické studii porovnáván ruxolitinib k nejlepší dostupné léčbě u HU rezistentních nebo HU netolerujících nemocných [14]. Terapie ruxolitinibem vedla ≥ 35% snížení velikosti sleziny (38 % vs 1 %) a ke kontrole symptomů (49 % vs 5 %). Terapie byla však provázena vyšším výskytem herpetických (Herpes zoster) infekcí (6 % vs 0 %) a pouze u 24 % nemocných vedla ke kompletní hematologické remisi a kompletní genetické remisi < 2 % [15]. Studie také neměla za cíl hodnocení klinicky relevantních cílů, jako období bez trombózy, leukemie či přechodu do myelofibrózy. Z výše uvedeného vyplývá, že názory na jednotlivá léčiva, a tudíž doporučení jsou různorodá. Příkladem může být např. rakouské doporučení – schéma 1 [16].
My postupujeme dle doporučení CEMPO (Central European Myeloproliferative Organization) [17].
Algoritmus terapie je založen na:
- limitované účinnosti současné terapie
- současných doporučení o prevenci trombózy
- posledních klinických studií
Cytoreduktivní terapie
Nízké riziko
1. linie: nízké dávky aspirinu + venepunkce
2. linie: IFNα (PEGylated IFNα)
Druhá linie je indikována také u nízkého rizika:
- špatná tolerance venepunkcí
- vysoká frekvence venepunkcí
- symptomy z nedostatku Fe (MCH < 28)
- symptomy PV (např. pruritus, únava, noční pocení)
- progresivní splenomegalie (ne z důvodu progrese do myelofibrózy)
- progresivní trombocytemie
- progresivní leukocytóza
- přítomnost kardiovaskulárních RF (AH, DM, hyperlipidemie, kouření)
Vysoké riziko
I. Věk < 70 let bez velkých komorbidit
1. linie: IFNα (PEGylated IFN-α) + ASA (kyselina acetylsalicylová)
2. linie: HU nebo JAK1/JAK2 inhibitor + ASA
Druhá linie je indikována také u „high-risk“ < 70 let s horší tolerancí či rezistencí k 1. linii léčby.
II. Věk ≥ 70 let nebo při přítomnosti komorbidit
1. linie: IFNα (PEGylated IFN-α) nebo HU + ASA
2. linie: JAK1/JAK2 inhibitor + ASA
Druhá linie je indikována také u „high-risk“ ≥ 70 let s horší tolerancí či rezistencí k 1. linii léčby. Algoritmus terapie shrnuje tab. 2.
2. Terapie PV dle doporučení Central European Myeloproliferative Neoplasm Organisation (CEMPO) 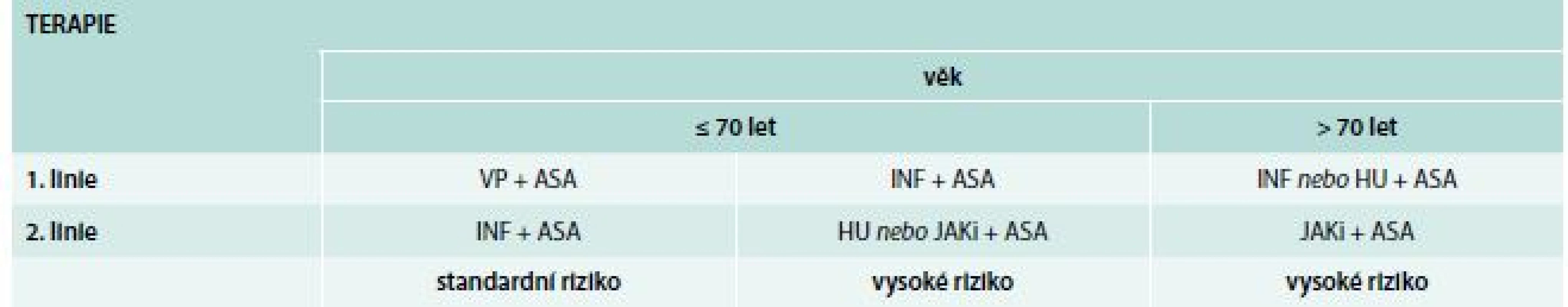
ASA – kyselina acetylsalicylová (aspirin) HU – hydroxyurea INF – interferon JAKi – JAK inhibitory VP – venepunkce Cíle léčby: HTK < 45 %, normalizace počtu trombocytů.
V České republice máme doporučení České pracovní skupiny pro Ph negativní myeloproliferativní onemocnění (Czech Group for Ph- Myeloproliferative Disorders – CZEMP), která jsou v souhlase s doporučeními CEMPO s jedinou odlišností, a to že anagrelid lze použít i v 1. linii u pacientů s trombocytózou.
Léčba svědění kůže
Tento projev patří k velmi svízelně ovlivnitelným, přitom dost obtěžujícím pro každého nemocného. Často nastává při koupeli v teplé vodě. V jedné studii s 1 545 nemocnými byl však tento příznak spojen s delším přežíváním [2]. Ze 418 nemocných z Mayo Clinic byl pruritus přítomen u 31 % nemocných v době stanovení diagnózy, a tito jedinci měli méně arteriální trombóz a vyšší nálož JAK2V617F mutace.
K léčbě používáme antihistaminika, antidepresiva SSRI, fotochemoterapii s psoralenem, PUVA záření, JAK2 inhibitory [18], TOR inhibitory [19].
Léčba trombotických komplikací
Prevence trombotické příhody je u MPN obzvláště důležitá, protože v případě již vzniklé příhody je zde vyšší riziko rekurence, a tudíž ve většině případů potřeba dlouhodobé až celoživotní antikoagulační terapie. Je také nutná cytoredukce, a to ve všech krevních řadách, na prvním místě v trombocytech.
Všichni jedinci s PV mají ASA v dávce 100 mg. V současnosti neexistuje důkaz, že by větší dávky či jiné antiagregans vedlo ke snížení výskytu infarktu myokardu (IM) nebo cévní mozkové příhody (CMP). V případě rizikových situací pro VTE (operace aj) nemocné zajišťujeme nízkomolekulárními hepariny (LMWH). V případě operací s nejvyšším stupněm rizika VTE (např. u náhrad nosných kloubů) u nemocných normalizujeme počet trombocytů.
V případě již prodělaného IM či CMP jsou jedinci léčeni dle patřičného odborníka, úlohou hematologa je volba správné cytoreduktivní léčby s cílem dosažením normalizace krevního obrazu.
U jedinců s VTE při výskytu spontánní hluboké žilní trombózy, plicní embolii či trombóze v neobvyklé lokalizaci volíme v akutní fázi léčbu LMWH s přechodem nejčastěji na warfarin. Antikoagulační terapie je většinou dlouhodobá, u trombóz v neobvyklé lokalizaci a při kumulaci RF pak celoživotní. Lze využít i některého z přímých perorálních antikoagulancií (Direct Oral AntiCoagulants – DOACs), ale při současné léčbě ruxolinitibem je jejich použití nedoporučováno (metabolizmus přes cytochrom 3A4), schéma 2.
Schéma 2. Léčba VTE u PV 
Poznámka: Cytoredukci tedy provádíme v případě počtu leukocytů > 10 × 109/l a počtu trombocytů > 400 × 109/l, venepunkci s cílem HTK ≤ 45 %.
SHRNUTÍ:
V několika bodech shrnujeme nejdůležitější aspekty v terapii MPN-PV
1. Včasná diagnóza PV (hlavně na MPN myslet!)
U všech jedinců s trombózou v abdominální oblasti (nádor, cirhóza)
JAK2, zejména u mladých, dosud zdravých jedinců!
Pozor: minimální nebo žádné změny v krevním obraze (okultní krvácení, hypersplenizmus, hemodiluce)
2. Zhodnocení všech rizikových, stratifikace nemocného dle míry rizika
3. U všech ASA
4. HTK ≤ 45 %
5. Zajištění všech rizikových faktorů pro VTE
6. V případě indikace k cytoreduktivní léčbě se řídit heslem „primum non nocere“, postupovat dle doporučených postupů s případnou individualizací léčby
7. V případě VTE – cytoreduktivní terapie a antikoagulační terapie
Jinak použití DOACs u MPN se jeví dle registru jako vysoce účinné a bezpečné [20]. Při akutní trombotické příhodě a vysokém počtu trombocytů lze provést akutně i trombocytaferézu.
Závěr
Léčba PV je stále diskutovaným problémem a názory na to, kterým lékem začít v případě nutné cytoredukce, nejsou jednotné a ani nemohou být ve světě jednotné. Nicméně se snažíme vždy eliminovat trombotické či krvácivé komplikace. V případě nutné cytoredukce pak volit takovou terapii, která je účinná, bezpečná a pro nemocného uživatelsky nejpříznivější a s co možná nejmenším výskytem závažných nežádoucích účinků. Proto očekáváme možnost rozšíření terapeutických možností o pegylovaný interferon.
Práce vznikla za podpory výzkumného záměru PROGRES Q40/08.
doc. MUDr. Petr Dulíček, Ph.D.
IV. interní hematologická klinika LF UK a FN Hradec Králové
Doručeno do redakce 1. 10. 2018
Přijato po recenzi: 4. 10. 2018
Sources
- Tefferi A, Guglielmelli P, Larson DR et al. Long-term survival and blast transformation in molecularly annotated essential thrombocythemia, polycythemia vera, and myelofibrosis. Blood 2014; 124(16): 2507–2513. Dostupné z DOI: <http://dx.doi.org/10.1182/blood-2014–05–579136>.
- Tefferi A, Rumi E, Finazzi G et al. Survival and prognosis among 1545 patients with contemporary polycythemia vera: an international study. Leukemia 2013; 27(9): 1874–1881. <http://dx.doi.org/10.1038/leu.2013.163>.
- Barbui T, Vannucchi AM, Carobbio A et al. Patterns of presentation and thrombosis outcome in patients with polycythemia vera strictly defined by WHO-criteria and stratified by calendar period of diagnosis. Am J Hematol 2015; 90(5): 434–437. Dostupné z DOI: <http://dx.doi.org/10.1002/ajh.23970>.
- Finazzi G. Low-dose aspirin in p. A prospective analysis of thrombotic events in the European collaboration study on low-dose aspirin in polycythemia (ECLAP). Pathol Biol (Paris) 2004; 52(5): 285–288. Dostupné z DOI: <http://dx.doi.org/10.1016/j.patbio.2004.02.007>.
- Barbui T, Carobbio A, Rumi E et al. In contemporary patients with polycythemia vera, rates of thrombosis and risk factors delineate a new clinical epidemiology. Blood 2014; 124(19): 3021–3023. Dostupné z DOI: <http://dx.doi.org/10.1182/blood-2014–07–591610>.
- Marchioli R, Finazzi G, Specchia G et al. Cardiovascular events and intensity of treatment in polycythemia vera. N Engl J Med 2013; 368(1): 22–33. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa1208500>.
- Schwarz J, Ovesná P, Černá O et al. Thrombosis in thrombocythemic Ph-myeloproliferations is associated with higher platelet count prior to the event: results of analyses of prothrombotic risk factors from a registry of patients treated with anagrelide. Eur J Haematol 2016; 96(1): 98–106. <http://dx.doi.org/10.1111/ejh.12554.
- Chievitz E, Thiede T Complications and causes of death in polycythaemia vera. Acta Med Scand 1962; 172 : 513–523.
- Landolfi R, Marchioli R, Kutti J et al. Efficacy and safety of low-dose aspirin in polycythemia vera. N Engl J Med 2004; 350(2): 114–124. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa035572>.
- Finazzi G, Caruso V, Marchioli R et al. Acute leukemia in polycythemia vera. An analysis of 1,638 patients enrolled in a prospective observational study. Blood 2005; 105(7): 2664–2670. Dostupné z DOI: <http://dx.doi.org/10.1182/blood-2004–09–3426>.
- Alvarez-Larran A, Kerguelen A, Hernandez-Boluda JC et al. Frequency and prognostic value of resistance/intolerance to hydroxycarbamide in 890 patients with polycythemia vera. Br J Haematol 2016; 172(5): 786–793. Dostupné z DOI: <http://dx.doi.org/10.1111/bjh.13886>.
- Quintás-Cardama A, Kantarjian H, Manshouri T et al. Pegylated interferon alfa-2a yields high rates of hematologic and molecular response in patients with advanced essential thrombocythemia and polycythemia vera. J Clin Oncol 2009; 27(32): 5418–5424. Dostupné z DOI: <http://dx.doi.org/10.1200/JCO.2009.23.6075>.
- Gisslinger H, Zagrijtschuk O, Buxhofer-Ausch V et al. Ropeginterferon alfa-2b, a novel IFN alfa-2b, induces high response rates with low toxicity in patients with polycythemia vera. Blood 2015; 126(15): 1762–1769. Dostupné z DOI: <http://dx.doi.org/10.1182/blood-2015–04–637280>.
- Vannucchi AM. Ruxolitinib versus standard therapy for the treatment of polycythemia vera. N Eng J Med 2015; 372(5): 426–435. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa1409002>.
- Vannucchi AM, Verstovsek S, Guglielmelli P et al. Ruxolitinib reduces JAK2p.V617F allele burden in patients with polycythemia vera enrolled in the RESPONSE study. Ann Hematol 2017; 96(7): 1113–1120. Dostupné z DOI: <http://dx.doi.org/10.1007/s00277–017–2994-x>.
- Burgstaller S, Buxhofer-Ausch V, Sliwa T et al. Austrian recommendations for the management of polycythemia vera. Wien Klin Wochenschr 2018; 130(17–18): 535–542. Dostupné z DOI: <http://dx.doi.org/10.1007/s00508–018–1359–3>.
- Hatalova A, Schwarz J, Gotic M et al. Recommendations for the diagnosis and treatment of patients with polycythaemia vera. Eur J Haematol 2018. Dostupné z DOI: <http://dx.doi.org/10.1111/ejh.13156>.
- Vaa BE, Tefferi A, Gangat N et al. Pruritus in primary myelofibrosis: management options in theera of JAK inhibitors. Ann Hematol 2016; 95(7): 1185–1189. Dostupné z DOI: <http://dx.doi.org/10.1007/s00277–016–2674–2>.
- Guglielmelli P, Barosi G, Rambaldi A et al. Safety and efficacy of everolimus, a mTOR inhibitor, as single agent in a phase 1/2 study in patients with myelofibrosis. Blood 2011; 118(8): 2069–2076. Dostupné z DOI: <http://dx.doi.org/10.1182/blood-2011–01–330563>.
- Lanotto JC, Couturier MA, Galinat H et al. Administration of direct oral anticoagulants in patients with myeloproliferative neoplasms. Int J Hematol 2017; 106(4): 517–521. Dostupné z DOI: <http://dx.doi.org/10.1007/s12185–017–2282–5>.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2018 Issue 10-
All articles in this issue
- Is functional dyspepsia really that frequent?
- Does the time from symptoms onset to treatment impact further development of vein thrombosis in the leg?
- Transient elastography – role in the assessment of the liver disease development
- Some causes of poor adherence to long-term statin therapy and their solution
- Angiotensin-converting enzyme inhibitor-induced angioedema: epidemiology, pathogenesis and management
- Obstructive sleep apnea and dyslipidemia
- CD38 targeted treatment for multiple myeloma
- Fatty pancreas disease: clinical impact
- Treatment of polycythemia vera
- Weber-Christian disease: a case report
- Multiple neuroendocrine tumor of the small bowel: a case report and a review of literature
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Fatty pancreas disease: clinical impact
- Treatment of polycythemia vera
- Weber-Christian disease: a case report
- Angiotensin-converting enzyme inhibitor-induced angioedema: epidemiology, pathogenesis and management
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career



