-
Medical journals
- Career
Cytomegalovirová a polyomavirová infekce po transplantaci ledviny
Authors: Jana Machová; Tomáš Reischig
Authors‘ workplace: I. interní klinika LF UK a FN Plzeň
Published in: Vnitř Lék 2017; 63(7-8): 488-497
Category: Reviews
Overview
Virové infekce patří mezi jedny z nejčastějších infekčních komplikací postihující příjemce transplantovaných orgánů. V důsledku imunosupresivní terapie, která dominantně ovlivňuje buněčnou imunitu a úspěšně tak redukuje incidenci akutní rejekce, dochází k vyššímu výskytu virových infekcí. Herpetické viry a polyomaviry jsou ubikvitérní patogeny, které mají schopnost perzistence v organizmu ve stadiu latence. Kromě reaktivace infekce dochází po transplantaci k primoinfekci přenesené od dárce, které zvyšují morbiditu a podílejí se na zhoršeném přežívání pacientů. Vedle toho mají dlouhodobé nepřímé dopady, v jejichž důsledku dochází k poškození funkce transplantovaných orgánů a jejich předčasné ztrátě. V tomto článku je uveden stručný přehled infekcí s největším dopadem na příjemce transplantované ledviny, tedy cytomegalovirus a BK polyomavirus, jejich diagnostika, prevence a léčba.
Klíčová slova:
BK virus – cytomegalovirus – ganciklovir – imunosupresivní terapie – JC virus – polyomavirová nefropatie – polyomavirus – preemptivní terapie – profylaxe – transplantace ledviny – valaciklovirCytomegalovirus
Cytomegalovirus (CMV) je běžně se vyskytující herpetický virus se séroprevalencí v dospělé populaci v rozmezí 40–100 % dle geografického rozložení [1]. Primární infekce se u imunokompetentních osob projevuje inaparentně či jako syndrom mononukleózy, nicméně u imunokompromitovaných osob, především po transplantaci solidních orgánů (SOT), způsobuje významné oportunní infekce (CMV infekci a nemoc).
Latentní CMV infekce se vyskytuje až u 90 % příjemců. Bez užití preventivních opatření dochází k aktivní CMV replikaci v 50–90 % a ke vzniku CMV nemoci s mediánem vzniku 2–4 měsíce po transplantaci ve 20–60 % [2,3]. Největší riziko mají séronegativní příjemci orgánu od séropozitivních dárců (D+/R-), kteří tvoří 15–25 % transplantované populace [4]. Mezi další rizikové faktory vzniku CMV infekce patří potentní imunosuprese (např. antilymfocytární terapie jako indukce či terapie rejekce), akutní rejekce či druh transplantovaného orgánu [5].
Dopad CMV se změnil v posledních desetiletích. Před nástupem antivirových léků měli pacienti, u nichž se vyvinula CMV nemoc, především zvýšený počet předčasných ztrát štěpů a mortality v přímé souvislosti s CMV nemocí (65% mortalita u neléčené tkáňově invazivní nemoci) [6]. S příchodem moderní diagnostiky a preventivních strategií se výskyt život ohrožujících CMV nemocí významně snížil. Incidence symptomatické CMV u příjemců transplantované ledviny se pohybuje mezi 0–10 % s výjimkou skupiny v riziku primoinfekce (D+/R-), u níž přesahuje 20 % [7–10]. Nyní však dominují nepřímé dlouhodobé dopady CMV infekce v důsledku asymptomatické DNAemie, která se vyskytuje navzdory preventivním postupům v 40–90 % v závislosti na rizikovosti příjemce a typu preventivní strategie [11] a vede v dlouhodobém horizontu prostřednictvím nepřímé modulace imunitního systému k významnému zhoršení přežívání příjemců a štěpů [11–14].
CMV nemoc, CMV infekce a jejich diagnostika
Pojmem CMV nemoci zahrnuje tkáňově invazivní nemoc postihující cílové orgány a CMV syndrom (tab.1). Za „prokázanou nemoc cílového orgánu“ lze označit přítomnost odpovídajících klinických symptomů společně s histopatologicky dokumentovaným CMV ve tkáni příslušného orgánu [15,16]. Vysoká virová nálož DNA ve tkáni odpovídajícího orgánu je obecně uznávána za „možnou CMV nemoc cílového orgánu“, obzvláště pokud vzorek krve získaný v tutéž dobu neobsahuje CMV DNA. Klinická odpověď na anti-CMV terapii může zvyšovat pravděpodobnost CMV jako příčiny symptomatologie [16].
Table 1. Klinická manifestace CMV u příjemců transplantované ledviny 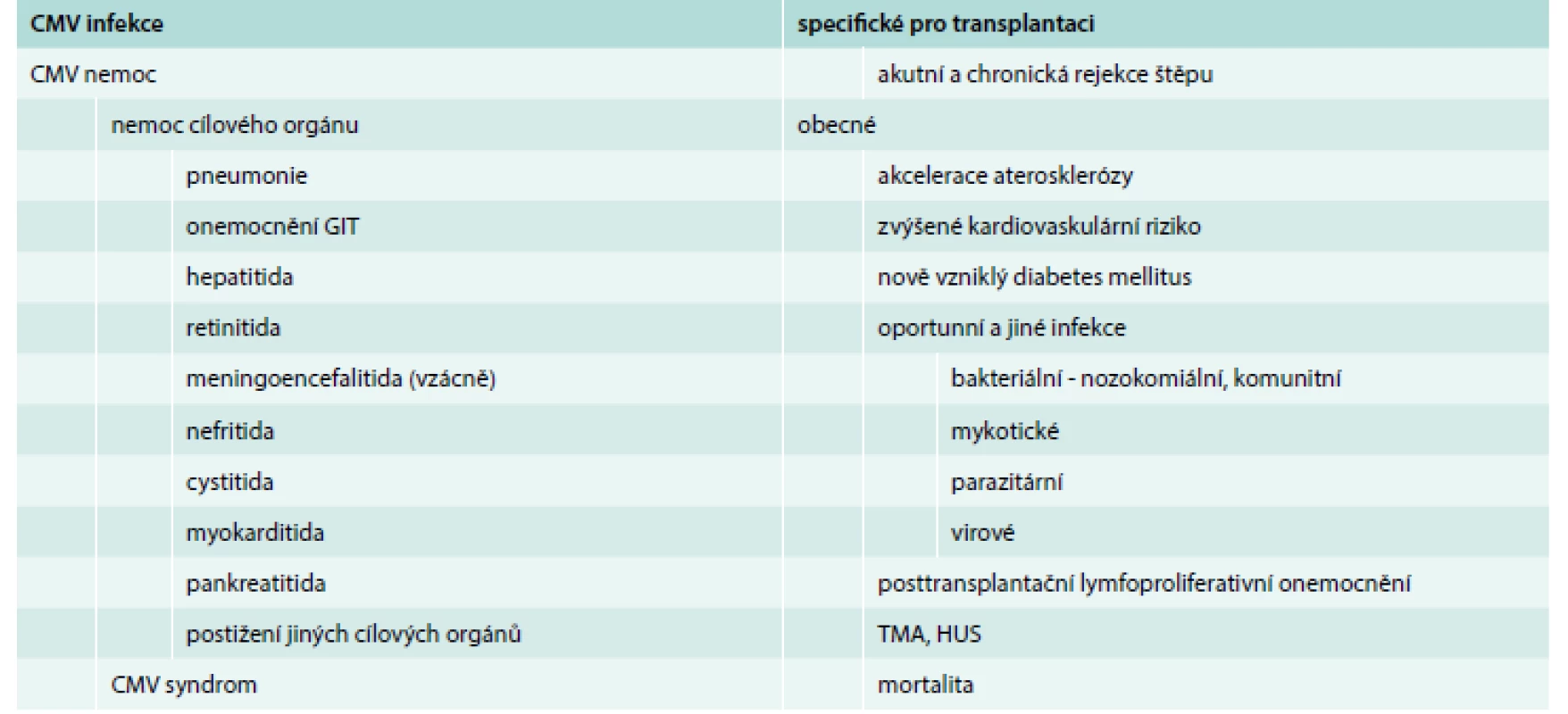
CMV – cytomegalovirus GIT – gastrointestinální trakt PTLD – posttransplant lymphoproliferative disease TMA – trombotická mikroangiopatie HUS – hemolyticko-uremický syndrom Přítomnost CMV v krvi společně se symptomy definuje lehčí formu CMV nemoci, tzv. CMV syndrom [16]. Diagnóza CMV syndromu vyžaduje detekci viremie v krvi kultivací či dnes častěji detekci přímo CMV DNA nebo CMV pp65 antigenu společně se splněním alespoň 2 z následujících kritérií: horečka, nově vzniklá/zhoršená nevolnost či únava, leukopenie či neutropenie, atypické lymfocyty, trombocytopenie a elevace aminotrasferáz [16].
CMV infekce je definována izolací viru nebo detekcí virového antigenu (pp65) či nukleové kyseliny v tělesné tekutině či vzorku tkáně [16], a to bez ohledu na symptomatologii. Odlišuje se od latentní CMV infekce.
Detekce CMV DNA (DNAemie, virová nálož; doporučované jednotky IU/ml) v plazmě či plné krvi je základním kamenem diagnostiky, řízení preemptivní terapie, monitorace odpovědi na léčbu a detekce relapsu [15,16]. Stanovuje se prostřednictvím techniky amplifikace nukleové kyseliny (NAT; obvykle PCR), která je preferovanou metodou vzhledem k dostupnosti mezinárodních standardů (World Health Organization International Standard – WHO IS). Variabilita CMV DNA výsledků byla redukována IS, nicméně klinicky významná variabilita přetrvává a zabraňuje tak smysluplnému vzájemnému porovnávání výsledků [17] a definování referenčních a cutoff hodnot virové nálože [15–17]. Akceptovatelnou alternativou při nedostupnosti NAT je detekce CMV antigenu pp65 (antigenemie), která nevyžaduje drahé vybavení a je snadno proveditelná. Naopak limitující je absence standardizace a menší stabilita vzorku [15].
CMV sérostatus (IgG) dárce a příjemce (D/R) by měl být stanoven před transplantací a je určujícím prediktorem rizika infekce a managementu po transplantaci. Sérologie nehraje žádnou roli v diagnostice aktivní CMV infekce po transplantaci a není tedy doporučována [15].
Viremie neboli izolace CMV v krvi buď standardními či rychlými technikami kultivace má limitovanou roli v diagnostice vzhledem k nízké senzitivitě. Podobně má omezené využití kultivace CMV moči pro nízkou specificitu.
Monitorace CMV specifické T buněčné imunity může predikovat individuálně zvýšené riziko CMV infekce po transplantaci i po ukončené profylaxi, na jejímž základě lze přizpůsobit imunosupresivní a antivirovou terapii [4,15,18]. Dosavadní data ukazují, že kvantita a funkce virově specifických T-lymfocytů inverzně koreluje s virovou replikací [18].
Nepřímé dopady CMV
Vedle zmiňovaných přímých účinků má CMV i nepřímé dopady jak specifické pro transplantaci, tak obecné. CMV nemoc i asymptomatická DNAemie zvyšují incidenci akutní rejekce štěpu. Bez ohledu na akutní rejekci CMV replikace zvyšuje riziko chronické nefropatie štěpu [9,11,12,14,19–22]. Hlavním mechanizmem, kterým se CMV podílí na rozvoji rejekce, je aktivace lokální inflamace a zvýšená aloantigenní odpověď ve štěpu [12].
Pravděpodobně nejvýznamnějším vysvětlením zvýšené mortality asociované s CMV je jeho přispění k posttransplantační akcelerované ateroskleróze. U pacientů exponovaných CMV bylo prokázáno téměř dvojnásobně zvýšené riziko kardiovaskulárních příhod, obzvláště pak u těch s CMV replikací [23,24].
CMV svou modulací imunitního systému má za následek zvýšené riziko oportunních infekcí [11], posttransplantačního lymfoproliferativního onemocnění v souvislosti s virovou koinfekcí Epsteina-Barrové (EBV): 3–10 % příjemců SOT [11,25]. Další nepřímé dopady ukazuje tab. 1.
Prevence CMV
V důsledku CMV preventivních strategií se dramaticky snížil výskyt CMV nemoci (o 80 %) [8]. Nicméně optimální strategie dosud nebyla definována a nadále existuje významná variabilita aplikace napříč transplantačními centry. Jsou 2 hlavní strategie využívané pro prevenci CMV: univerzální profylaxe a preemptivní terapie (tab. 2) [15].
Table 2. Srovnání profylaxe a preemptivní terapie 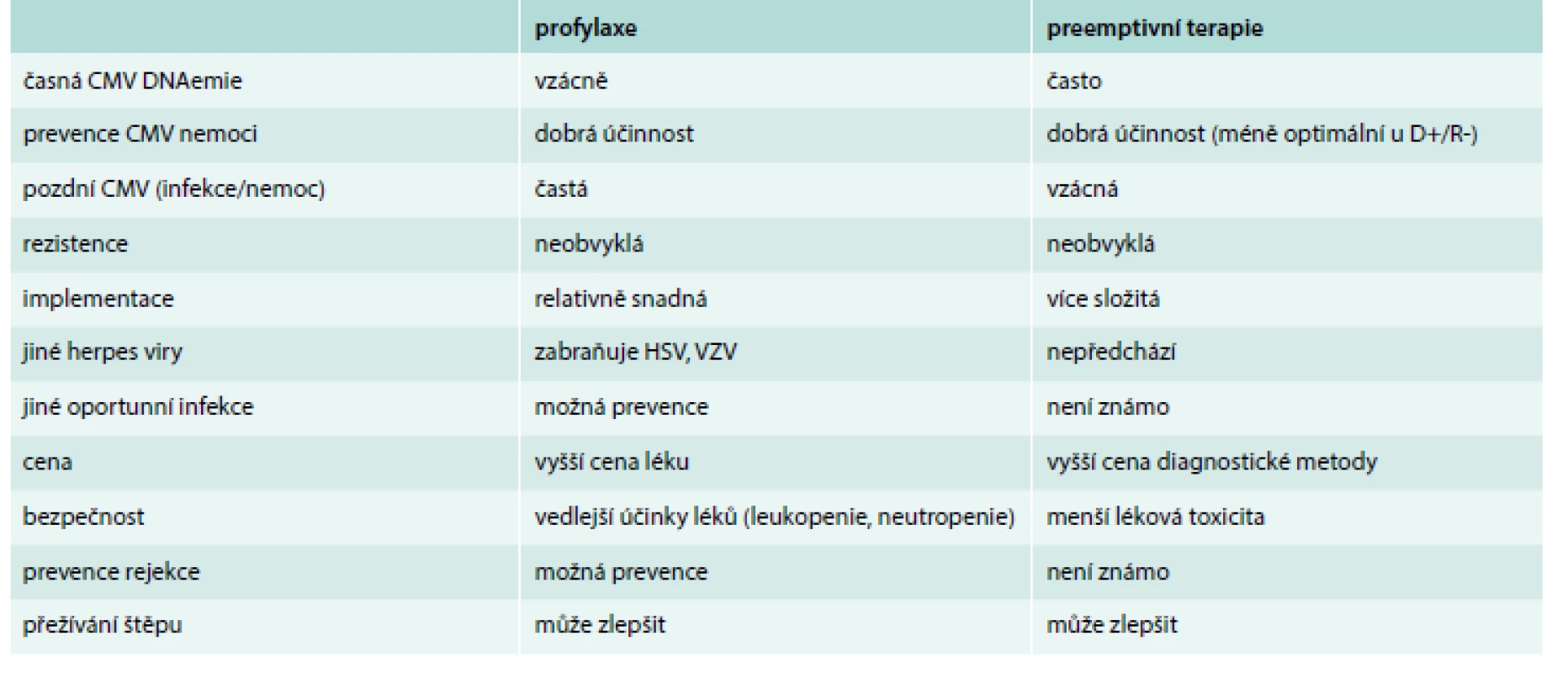
Univerzální profylaxe zahrnuje podávání antivirových léků všem pacientům s rizikem vzniku CMV infekce, typicky vyjma pacientů D-/R - vzhledem k jejich zanedbatelnému riziku. Profylaxe se zahajuje bezprostředně či velmi časně po transplantaci a podává se po dobu obvykle 3–6 měsíců v závislosti na rizikovosti příjemce a intenzitě imunosupresivní terapie. Preferují se orálně podávaná antivirotika, konkrétně valganciklovir [10,13,26,27]. Alternativou pro pacienty po transplantaci ledviny je vysokodávkovaný valaciklovir se srovnatelnou účinností dokumentovanou v randomizovaných studiích [8,9,28–30]. Dávkování u obou léků je potřeba upravovat dle renální funkce [15].
Nejvýznamnější klinickou nevýhodou profylaxe je pozdní CMV nemoc a viremie, která se rozvíjí po ukončení antivirové profylaxe [15,26,28,29,31,32], nejčastěji u D+/R - pacientů, s nepříznivým dlouhodobým dopadem [9,33,34]. Nejedná se o vzácný stav, pozdní CMV nemoc se objevuje v 3–39 %, CMV DNAemie v 20–59 % [8–10,26,27,29,30]. Zatímco preemptivní terapie je spojována s minimální incidencí pozdní CMV nemoci (< 3 %) [7,30]. Možným vysvětlením je absence antigenní stimulace během profylaxe a potlačení vytvoření CMV specifické T buněčné odpovědi [34]. Je dokázáno, že adekvátní obnovení CMV specifické imunity je důležité nejen pro prevenci CMV nemoci [4,34], ale také pro redukci nepřímých dopadů CMV [35–39]. Svou roli může hrát i imunosupresivní efekt valgancikloviru [34,40]. I přesto, že prodloužení profylaxe valganciklovirem ze 3 na 6 měsíců mělo za následek významné snížení výskytu pozdní CMV nemoci a DNAemie, je incidence u rizikových příjemců (D+/R-) nadále téměř 20 % [10].
Preemptivní terapie využívá monitoraci CMV DNAemie v pravidelných intervalech (1krát týdně po dobu 3–4 měsíců) [7,15,30] pomocí senzitivních testů umožňujících detekci CMV replikace před rozvojem klinické symptomatologie. Antivirová terapie valganciklovirem či intravenózním ganciklovirem v terapeutických dávkách se zahajuje při dosažení cutoff hodnoty virové nálože definované v daném centru [15,34]. Doba podávání je obvykle 2–3 týdny nebo do clearance viremie (tzn. dosažení 1–2 po sobě následujících negativních hodnot DNAemie). Efektivnost preemptivní terapie je plně závislá na adekvátní monitoraci CMV, promptním zahájení adekvátní terapie v případě detekce CMV [41,42]. Řízení preemptivní terapie je logisticky náročné a vyžaduje komplianci pacienta.
Aktuální guidelines [15], randomizované studie [7,9,30,41,43], stejně tak recentní metaanalýza [44] považují profylaxi a preemptivní terapii za stejně účinné strategie ve snížení incidence CMV infekce a nemoci, bez rozdílu týkajícího se rejekce, ztráty štěpu, oportunních infekcí či mortality. Profylaxe je spojena s menším výskytem časné posttransplantační DNAemie, ale signifikantně častěji s pozdní CMV a vedlejšími účinky léků ve srovnání s preemptivní terapií [15,44]. V případě méně časté monitorace či při špatné spolupráci pacienta v režimu preemptivní terapie je prokázán významně vyšší výskyt CMV nemoci, nepřímých dopadů CMV a ganciklovirové rezistence [41].
Přibývá důkazů naznačujících, že použití preventivních strategií snižuje výskyt nepřímých dopadů CMV. Profylaxe je spojena s nižším výskytem epizod akutní rejekce po transplantaci ledvin [30], stejně tak redukuje riziko vzniku posttransplantačních lymfoproliferativních onemocnění a jiných oportunních infekcí [45]. Co se týká preemptivní terapie, recentní metaanalýza dokládá, že prevence CMV nepřímých dopadů je dobře srovnatelná s profylaxí [44]. V randomizované studii příjemců transplantované ledviny má preemptivní terapie dokonce lepší výsledky z hlediska dlouhodobé funkce štěpu a nižší incidence intersticiální fibrózy a tubulární atrofie (IF/TA) v pozdních protokolárních biopsiích [9].
Aktuálně je ve vývoji několik CMV vakcín, dle dostupných dat dosahují klinických výsledků, ale žádná není v současné době k dispozici pro rutinní klinické použití [15].
Léčba CMV
V léčbě CMV nemoci je preferován valganciklovir s výjimkou život ohrožujících infekcí a situací, v nichž je předpoklad nízké biologické dostupnosti v perorální podobě (postižení gastrointestinálního traktu) nebo není předpoklad k dobré adherenci k léčbě [15]. V tom případě je indikován intravenózní ganciklovir [15,46]. Dávkování je nutné upravovat podle renální funkce. Neadekvátní dávkování může způsobit nedostatečný klinický efekt a rozvoj rezistence [47], zatímco supraterapeutické dávky zvyšují toxické účinky [48]. Terapie by měla pokračovat do dosažení eradikace viru v jednom či 2 po sobě následujících testech (s týdenním odstupem) po minimální době léčby 2 týdnů [15], která minimalizují riziko rozvoje rezistence a rekurence nemoci [3,49,50].
Redukci dávky kvůli nežádoucím účinkům, jako je leukopenie, je třeba se vyvarovat vzhledem k riziku vzniku rezistence, nejdříve by měly být zváženy jiné příčiny (imunosupresivní léky, antibiotická profylaxe) či podání granulocyty stimulujícího faktoru (G-CSF) [15].
Rezistence na ganciklovir
CMV nemoc rezistentní na ganciklovir může vést k závažnému klinickému průběhu [51]. Podezření na rezistenci by mělo vzniknout v případě, že nedochází ke snížení CMV DNAemie či zlepšení klinického obrazu během prolongované antivirové terapie, obzvláště pokud jsou přítomny rizikové faktory, mezi něž patří pacienti D+/R-, vysoká hladina imunosuprese nebo neadekvátní dávka antivirové terapie [52]. V rámci diagnostiky jsou dostupné genotypové testy mutací pro rezistenci antivirotik [15]. V případě, že není laboratorně prokázaná rezistence, je více kladen důraz na zmírnění rizikových faktorů než na změnu antivirotika, tedy snížení imunosuprese na co nejnižší dávku [15]. Přínosná může být změna imunosupresivní terapie na mTOR inhibitory, s ohledem na studie prokazující menší výskyt CMV infekce a nemoci při jejich léčbě a prokázaný anti-CMV efekt in vitro [53]. Některé mutace (UL97, UL54) vedou jen k nízké úrovni rezistence a klinického efektu lze dosáhnout eskalací dávky gancikloviru za cenu vyššího rizika možné suprese kostní dřeně. U mutací odpovídajících vysokému stupni ganciklovirové rezistence je doporučována změna za foskarnet. V případě detekovatelné mutace rezistence jak na ganciklovir tak na foskarnet, může být zváženo krátkodobé použití cidofoviru, nicméně nejsou dostupná žádná data o jeho účinnosti jako záchranné terapii u SOT (u transplantace hematopoetických buněk – HSCT jsou výsledky nejednoznačné [54]) [15].
Polyomaviry
Mezi nejvýznamnější lidské polyomaviry (HPyV) se řadí BK virus (BKV) a JC virus (JCV). Jsou nazvány podle prvních pacientů, u kterých byly izolovány. Tyto infekce jsou široce rozšířené u běžné populace, v níž séroprevalence představuje více než 90 % již v 1. dekádě života [55,56]. Pravděpodobná cesta přenosu primární infekce je respirační, fekálně-orální či prostřednictvím dárcovské tkáně, následně viry perzistují v latentní podobě v uroteliárních a renálních tubulárních buňkách [57,58].
Primoinfekce u většiny imunokompetentních jedinců má subklinický průběh či nespecifický flu-like syndrom. U imunokompromitovaných jedinců může BKPyV replikace způsobit manifestní onemocnění, jako je hemoragická cystitida (PyVHC) u 5–15 % pacientů po HSCT, u příjemců transplantované ledviny pak progresivní a ireverzibilní poškození štěpu, neboli PyV asociovanou nefropatii (PyVAN). Její hlavní příčinou je BKV a postihuje 1–10 % pacientů [59–61]. Při opožděné diagnóze ve stadiu manifestního zhoršení renální funkce dochází až v 70 % k předčasné ztrátě štěpu vlivem infekce, ve zbývajících případech často zůstává porucha funkce [62,63]. U jiných SOT jsou komplikace BKV velmi vzácné. Raritně se HPyV uplatňuje v extrarenální lokalizaci, jako je pneumonie, encefalitida, hepatitida, retinitida, capillary leak syndrom a malignita [64,65]. Rizikové faktory pro rozvoj PyVAN ukazuje tab. 3 [60,66–68].
Table 3. Rizikové faktory pro PyVAN 
* takrolimus-mykofenolát > takrolimus-azatioprin > cyklosporin-mykofenolát > kombinace s mTOR inhibitory Ve vzácných případech není histologicky prokázaná PyVAN vyvolaná BKV, ale JCV [69,70]. S JCV asociovaná PyVAN by měla být zvažována v případě histologických znaků PyVAN, sníženou renální funkcí a absencí BKV v krvi, moči či tkáni štěpu. Univerzální screening pro JCV replikaci a nefropatii není doporučován vzhledem k raritě tohoto stavu a obecně lepším výsledkům [66]. Samotná replikace JCV v moči nepředstavuje riziko pro poškození štěpu a není projevem nadměrné imunosuprese [71].
Diagnostika
U jedinců po transplantaci ledviny je asymptomatická replikace BKV v moči pozorována v 30–60 % [67,72,73], je detekovatelná pomocí kvantitativní PCR, cytologicky jsou v moči zřejmé tzv. decoy cells a negativním barvením v elektronové mikroskopii jsou přímo detekovatelné virové částice [66].
Téměř třetina pacientů s vysokou virovou náloží v moči [> 7 log10 genomového ekvivalentu (geq)/ml] nebo decoy cells vyvine klinicky němou BK viremii [72–75], detekovatelnou pomocí PCR ve vzorku plné krve či plazmy. Nejčastěji se objevuje v prvních 3 měsících po transplantaci [75].
Pozdní diagnóza je spojena s ireverzibilním snížením funkce štěpu, špatnou odpovědí na léčbu a ztrátou štěpu [66]. U všech pacientů po transplantaci ledviny je tedy doporučován screening BKV virové nálože v pravidelných intervalech nebo při snížení funkce štěpu (schéma 1) [66].
Schéma 1. Screening a management BKV replikace a s polyomaviry asociované nefropatie 
K definitivní diagnóze „prokázané PyVAN“ jsou požadovány PyV cytopatické změny ve tkáni alograftu potvrzené imunohistochemickým průkazem SV40 antigenu či in situ hybridizací [66]. Negativita bioptického výsledku však nemůže s jistotou vyloučit PyVAN vzhledem k fokálnímu výskytu hlavně v časných stadiích, a tedy riziku tzv. sampling error (10–35 % případů) [76]. Ke standardizaci histologických nálezů se používá klasifikace do kategorií A, B a C na základě rozsahu inflamace, a především intersticiální fibrózy, která je nejdůležitějším ukazatelem prognózy. Subklasifikace na B1–B3 je založena výhradně na stupni zánětu, který je taktéž důležitý a nezávislý ukazatel prognózy štěpu [77,78] (tab. 4) [66].
Table 4. Histologický obraz PyVAN jako ukazatel prognózy štěpu 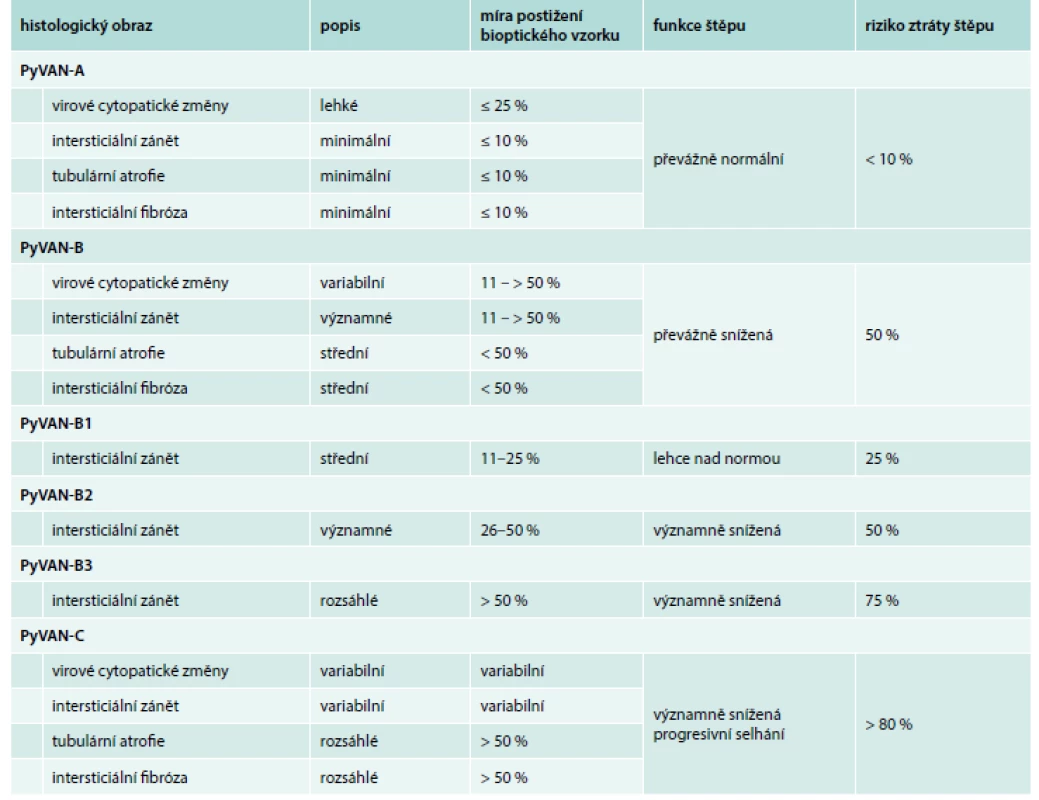
Diagnóza „předpokládané PyVAN“ je stanovena při absenci prokazatelné BKV v biopsii u pacientů s plazmatickou virovou náloží > 4 log10 geq/ml. Porucha funkce štěpu není podmínkou [66].
Sérologie nehraje v posttransplantační diagnostice podstatnou roli, ale napomáhá při určení rizika BKV. Kombinace vysoce séroreaktivního dárce a příjemce s nízkou séroreaktivitou 10krát zvyšuje riziko rozvoje BK viremie. Silná pozitivní korelace mezi hladinou BKV IgG u dárce a rozvojem BK viremie a BKPyVAN u příjemce naznačuje, že protilátková odpověď dárce reflektuje virovou nálož štěpu [79].
Prevence
Vzhledem k absenci účinné a bezpečné antivirové terapie se screening BKV replikace stává klíčovou strategií k zahájení a vedení postupné redukce imunosuprese. Tato intervence dovoluje rozvoj BKV specifické buněčné imunitní odpovědi snižující BKV replikaci ve štěpu a clearance BK viremie u 70–90 % pacientů [72,73,80,81].
Screening by měl být prováděn nejméně každé 3 měsíce během prvních 2 let, poté ročně do 5 let po transplantaci (schéma 1) [66]. Vzhledem k nejvyššímu riziku v časném období po transplantaci provádí řada center měsíční screening v prvních 6 měsících. V případě přetrvávající BK virové nálože v plazmě jsou zvažovány různé strategie redukce imunosuprese, ať už založené na primárním snížení hladiny kalcineurinového inhibitoru o 25–50 % v jednom či dvou krocích následované jejich vysazením nebo primární redukce antiproliferativních léků o 50 % následované redukcí kalcineurinových inhibitorů ev. pak vysazením antiproliferativních léků. Imunosuprese je dále upravována v závislosti na viremii a průběhu sérové koncentrace kreatininu [66].
Navzdory preemptivní BK viremií řízené redukci imunosuprese se prokázaná PyVAN stále objevuje v třetině případů. Nicméně riziko selhání štěpu je u takto diagnostikované PyVAN výrazně nižší [82]. U téměř poloviny pacientů se vyvine perzistentní viremie [72,74], jejíž dopad není zcela jasný, může zhoršovat přežívání pacientů, způsobovat častější dysfunkce štěpu či zvýšené riziko rozvoje de novo dárcovsky specifických protilátek (DSA) [72,74,83].
Léčba
V současné době je jedinou efektivní a doporučovanou léčbou včasná redukce imunosuprese [66,72,83]. Jednou ze strategií je ukončení podávání mykofenolátu mofetilu či azatioprinu nebo redukce cílové hladiny imunosupresiv na 25–50 %. Koncentrace takrolimu jsou obvykle cíleny < 6 ng/ml, cyklosporinu < 150 ng/ml, sirolimu < 6 ng/ml a ekvivalent denní dávky mykofenolátu mofetilu ≤ 1 000 mg [66]. V individuálních případech pacientů a při závažnějším stupni onemocnění je vhodná další redukce. Mezi další strategie patří přechod z takrolimu na nízkodávkovaný cyklosporin, z kalcineurinového inhibitoru na nízkodávkovaný sirolimus nebo z mykofenolátu na leflunomid či sirolimus v nízké dávce [66]. Úspěšnost jednotlivých režimů je různá a závisí také na virové náloži nebo dysfunkci štěpu v době zahájení redukce imunosuprese. I navzdory léčbě dochází ke ztrátě štěpu v 10–80 % případů [64].
Terapie takrolimem je spojena se signifikantně vyšším rizikem perzistující BK virurie a BK viremie ve srovnání s cyklosporinem [67,73]. Ačkoli oba inhibují kalcineurinovou fosfatázu potřebnou pro expresi interleukinu 2 v následné aktivaci T-lymfocytů, mají různé cílové molekuly: cyklosporin se váže na cyklofiliny, zatímco takrolimus na FK vázající protein 12. Studie in vitro naznačují, že cyklosporin a mykofenolát inhibují replikaci BKV [84–86], zatímco takrolimus replikaci aktivuje právě pomocí FK vázajícího proteinu 12 v primárně lidském tubulárním epitelu [87].
U pacientů s přetrvávající vysokou hladinou BKV virové nálože v plazmě navzdory adekvátní redukci imunosuprese může být zvažováno doplňkové použití antivirových látek zahrnujících podání cidofoviru, leflunomidu, intravenózních imunoglobulinů a chinolonových antibiotik [66]. Výsledky multicentrických observačních studií ale neprokazují benefit doplňkové léčby na přežívání štěpu [88,89]. Je nezbytné získat další data z prospektivních randomizovaných studií.
Pokles viremie neboli „odeznívající PyVAN“ má typicky histologický nález samolimitující intersticiální nefritidy s nálezem významně zvýšených intraepiteliálních lymfocytů, tubulitidy a intersticiální inflamace, bez nárůstu IF či TA. Dochází ke stabilizaci či zlepšení renální funkce. „Reziduální PyVAN“ je charakterizovaná clearance viremie a pomalým ústupem inflamace v rámci měsíců [90].
Retransplantace po PyVAN je převážně úspěšná, ale vyžaduje častý monitoring pro rekurentní BKV replikaci [66].
BKPyV a rejekce štěpu
Redukce imunosuprese při terapii BKV infekce je spojována s vyšším rizikem akutní rejekce, která se objevuje v 8–12 % [82]. Předpokládá se také, že BKV může zprostředkovat alosenzibilizaci a rejekci prostřednictvím heterologní imunity. Tvorba DSA po transplantaci je nyní široce užívaný prediktor subklinické aloreaktivity a často předchází zjevné protilátkově zprostředkované rejekci o měsíce až roky [91,92]. Je předpoklad, že přetrvávající BK viremie je rizikový faktor a předchází rozvoji DSA [75]. Histologické rozlišení konkomitantní rejekce není vždy spolehlivě možné, diagnóza rejekce je považována za bezpečnou pouze tehdy, pokud je v biopsii nález endarteritidy, fibrinoidní vaskulární nekrózy (vaskulární rejekce), glomerulonefritidy nebo C4d+ depozit podél peritubulárních kapilár (akutní humorální rejekce). Oba případy mají podobnou molekulární charakteristiku, exprimují stejně proinflamační geny a vedou k mohutné expresi genů asociovaných s fibrózou [66,90,93].
Podpořeno Programem rozvoje vědních oborů Univerzity Karlovy PROGRES Q39.
MUDr. Jana Machová
machovaj@fnplzen.cz
I. interní klinika LF UK
a FN Plzeň
www.fnplzen.cz
Doručeno do redakce 4. 6. 2017
Přijato po recenzi 17. 5. 2017
Sources
1. Krech U. Complement-fixing antibodies against cytomegalovirus in different parts of the world. Bulletin of the World Health Organization 1973; 49(1): 103.
2. Hibberd PL, Tolkoff-Rubin NE, Cosimi AB et al. Symptomatic cytomegalovirus disease in the cytomegalovirus antibody seropositive renal transplant recipient treated with OKT3. Transplantation 1992; 53(1): 68–72.
3. Sia IG, Wilson JA, Groettum CM et al. Cytomegalovirus (CMV) DNA load predicts relapsing CMV infection after solid organ transplantation. J Infect Dis 2000; 181(2): 717–720.
4. Manuel O, Husain S, Kumar D et al. Assessment of cytomegalovirus-specific cell-mediated immunity for the prediction of cytomegalovirus disease in high-risk solid-organ transplant recipients: a multicenter cohort study. Clin Infect Dis 2013; 56(6): 817–824. Dostupné z DOI: <http://dx.doi.org/10.1093/cid/cis993>.
5. Razonable RR, Humar A. [AST Infectious Diseases Community of Practice]. Cytomegalovirus in solid organ transplantation. Am J Transplant 2013;13(Suppl 4): 93–106. Dostupné z DOI: <http://dx.doi.org/10.1111/ajt.12103>.
6. Reusser P Human cytomegalovirus infection and disease after bone marrow and solid organ transplantation. Baillière‘s clinical infectious diseases 1996; 3(3): 357–371.
7. Khoury JA, Storch GA, Bohl D et al. Prophylactic versus preemptive oral valganciclovir for the management of cytomegalovirus infection in adult renal transplant recipients. Am J Transplant 2006; 6(9): 2134–2143.
8. Lowance D et al. Valacyclovir for the prevention of cytomegalovirus disease after renal transplantation. N Engl J Med 1999; 340(19): 1462–1470.
9. Reischig T, Hribova P, Jindra P et al. Long-term outcomes of pre-emptive valganciclovir compared with valacyclovir prophylaxis for prevention of cytomegalovirus in renal transplantation. J Am Soc Nephrol 2012; 23(9):1588–1597. Dostupné z DOI: <http://dx.doi.org/10.1681/ASN.2012010100>.
10. Humar A, Lebranchu Y, Vincenti F et al. The Efficacy and Safety of 200 Days Valganciclovir Cytomegalovirus Prophylaxis in High‐Risk Kidney Transplant Recipients. Am J Transplant 2010; 10(5): 1228–1237. Dostupné z DOI: <http://dx.doi.org/10.1111/j.1600–6143.2010.03074.x>.
11. Freeman RB Jr. The “indirect” effects of cytomegalovirus infection. Am J Transplant 2009; 9(11): 2453–2458. Dostupné z DOI: <http://dx.doi.org/10.1111/j.1600–6143.2009.02824.x>.
12. Reischig T. Cytomegalovirus-associated renal allograft rejection: new challenges for antiviral preventive strategies. Expert Rev Anti Infect Ther 2010; 8(8): 903–910.
13. Sagedal S, Hartmann A, Nordal KP et al. Impact of early cytomegalovirus infection and disease on long-term recipient and kidney graft survival. Kidney Int 2004; 66(1): 329–337.
14. Smith JM, Corey L, Bittner R et al. Subclinical viremia increases risk for chronic allograft injury in pediatric renal transplantation. J Am Soc Nephrol 2010; 21(9): 1579–1586. Dostupné z DOI: <http://dx.doi.org/10.1681/ASN.2009111188>.
15. Kotton CN, Kumar D, Caliendo AM et al. Updated international consensus guidelines on the management of cytomegalovirus in solid-organ transplantation. Transplantation 2013; 96(4): 333–360. Dostupné z DOI: <http://dx.doi.org/10.1097/TP.0b013e31829df29d>.
16. Ljungman P, Boeckh M, Hirsch HH et al. Definitions of cytomegalovirus infection and Disease in Transplant Patients for Use in Clinical Trials Clin Infect Dis 2017; 64(1): 87–91.
17. Preiksaitis JK, Hayden RT, Tong Y et al. Are we there yet? Impact of the 1st International Standard for cytomegalovirus DNA on the harmonization of results reported on plasma samples. Clin Infect Dis 2016; 63(5): 583–589. Dostupné z DOI: <http://dx.doi.org/10.1093/cid/ciw370>.
18. Sester M, Leboeuf C, Schmidt T et al. The “ABC” of Virus‐Specific T Cell Immunity in Solid Organ Transplantation. Am J Transplant 2016; 16(6): 1697–1706. Dostupné z DOI: <http://dx.doi.org/10.1111/ajt.13684>.
19. Reischig T, Jindra P, Svecová M et al. The impact of cytomegalovirus disease and asymptomatic infection on acute renal allograft rejection. J Clin Virol 2006; 36(2): 146–151.
20. Sagedal S, Nordal KP, Hartmann A et al. The impact of cytomegalovirus infection and disease on rejection episodes in renal allograft recipients. Am J Transplant 2002; 2(9): 850–856.
21. Reischig T, Jindra P, Hes O et al. Effect of cytomegalovirus viremia on subclinical rejection or interstitial fibrosis and tubular atrophy in protocol biopsy at 3 months in renal allograft recipients managed by preemptive therapy or antiviral prophylaxis. Transplantation 2009; 87(3): 436–444. Dostupné z DOI: <http://dx.doi.org/10.1097/TP.0b013e318192ded5>.
22. Pascher A, Proesch S, Pratschke J et al. Rat Cytomegalovirus Infection Interferes with Anti‐CD4 mAb‐(RIB 5/2) Mediated Tolerance and Induces Chronic Allograft Damage. Am J Transplant 2006; 6(9): 2035–2045.
23. Courivaud C, Bamoulid J, Chalopin JM et al. Cytomegalovirus exposure and cardiovascular disease in kidney transplant recipients. J Infect Dis 2013; 207(10): 1569–1575. Dostupné z DOI: <http://dx.doi.org/10.1093/infdis/jit064>.
24. Humar A, Gillingham K, Payne WD et al. Increased incidence of cardiac complications in kidney transplant recipients with cytomegalovirus disease. Transplantation 2000; 70(2): 310–313.
25. Walker RC, Marshall WF, Strickler JG et al. Pretransplantation assessment of the risk of lymphoproliferative disorder. Clin Infect Dis 1995; 20(5): 1346–1353.
26. Paya C, Humar A, Dominguez E et al. Efficacy and safety of valganciclovir vs. oral ganciclovir for prevention of cytomegalovirus disease in solid organ transplant recipients. Am J Transplant 2004; 4(4): 611–620.
27. Humar A, Limaye AP, Blumberg EA et al. Extended valganciclovir prophylaxis in D+/R − kidney transplant recipients is associated with long-term reduction in cytomegalovirus disease: two-year results of the IMPACT study. Transplantation 2010; 90(12): 1427–1431.
28. Reischig T, Kacer M, Jindra P et al. Randomized Trial of valganciclovir versus valacyclovir prophylaxis for prevention of cytomegalovirus in renal transplantation. Clin J Am Soc Nephrol 2015; 10(2):294–304. Dostupné z DOI: <http://dx.doi.org/10.2215/CJN.07020714>.
29. Reischig T, Jindra P, Mares J et al. Valacyclovir for cytomegalovirus prophylaxis reduces the risk of acute renal allograft rejection. Transplantation 2005; 79(3): 317–324.
30. Reischig T, Jindra P, Hes O et al. Valacyclovir prophylaxis versus preemptive valganciclovir therapy to prevent cytomegalovirus disease after renal transplantation. Am J Transplant 2008; 8(1): 69–77.
31. Hodson EM, Jones CA, Webster AC et al. Antiviral medications to prevent cytomegalovirus disease and early death in recipients of solid-organ transplants: a systematic review of randomised controlled trials. Lancet 2005; 365(9477): 2105–2115.
32. Kalil AC, Levitsky J, Lyden E et al. Meta-analysis: the efficacy of strategies to prevent organ disease by cytomegalovirus in solid organ transplant recipients. Ann Intern Med 2005; 143(12): 870–880.
33. Arthurs SK, Eid AJ, Pedersen RA et al. Delayed-onset primary cytomegalovirus disease and the risk of allograft failure and mortality after kidney transplantation. Clin Infect Dis 2008; 46(6): 840–846. Dostupné z DOI: <http://dx.doi.org/10.1086/528718>.
34. Reischig T. Advances in cytomegalovirus-preventive strategies in solid organ transplantation: defending pre-emptive therapy. Expert Rev Anti Infect Ther 2012; 10(1): 51–61. Dostupné z DOI: <http://dx.doi.org/10.1586/eri.11.156>.
35. Gerna G, Lilleri D, Fornara C et al. Monitoring of Human Cytomegalovirus‐Specific CD4+ and CD8+ T‐Cell Immunity in Patients Receiving Solid Organ Transplantation. Am J Transplant 2006; 6(10): 2356–2364.
36. Egli A, Binet I, Binggeli S et al. Cytomegalovirus-specific T-cell responses and viral replication in kidney transplant recipients. J Transl Med 2008; 6 : 29. Dostupné z DOI: <http://dx.doi.org/10.1186/1479–5876–6–29>.
37. Mattes FM, Vargas A, Kopycinski J et al. Functional Impairment of Cytomegalovirus Specific CD8 T Cells Predicts High‐Level Replication After Renal Transplantation. Am J Transplant 2008; 8(5): 990–999. Dostupné z DOI: <http://dx.doi.org/10.1111/j.1600–6143.2008.02191.x>. Erratum in Am J Transplant 2011; 11(5): 1107.
38. Benmarzouk-Hidalgo OJ, Cisneros JM, Cordero E et al. Therapeutic effect of the acquisition of cytomegalovirus-specific immune response during preemptive treatment. Transplantation 2011; 91(8): 927–933. Dostupné z DOI: <http://dx.doi.org/10.1097/TP.0b013e3182115ba2>.
39. Nickel P, Bold G, Presber F et al. High levels of CMV-IE-1-specific memory T cells are associated with less alloimmunity and improved renal allograft function. Transpl Immunol 2009; 20(4): 238–242. Dostupné z DOI: <http://dx.doi.org/10.1016/j.trim.2008.11.002>.
40. Battiwalla M, Wu Y, Bajwa RP et al. Ganciclovir inhibits lymphocyte proliferation by impairing DNA synthesis. Biol Blood Marrow Transplant 2007; 13(7): 765–770.
41. Kliem V, Fricke L, Wollbrink T et al. Improvement in Long‐Term Renal Graft Survival due to CMV Prophylaxis with Oral Ganciclovir: Results of a Randomized Clinical Trial. Am J Transplant 2008; 8(5): 975–983. Dostupné z DOI: <http://dx.doi.org/10.1111/j.1600–6143.2007.02133.x>.
42. Witzke O, Hauser IA, Bartels M et al. Valganciclovir prophylaxis versus preemptive therapy in cytomegalovirus-positive renal allograft recipients: 1-year results of a randomized clinical trial. Transplantation 2012; 93(1): 61–68. Dostupné z DOI: <http://dx.doi.org/10.1097/TP.0b013e318238dab3>.
43. Spinner ML, Saab G, Casabar E et al. Impact of prophylactic versus preemptive valganciclovir on long-term renal allograft outcomes. Transplantation 2010; 90(4): 412–418. Dostupné z DOI: <http://dx.doi.org/10.1097/TP.0b013e3181e81afc>.
44. Florescu DF, Qiu F, Schmidt CM et al. A Direct and Indirect Comparison Meta-analysis on the Efficacy of Cytomegalovirus Preventive Strategies in Solid Organ Transplantation. Clin Infect Dis 2014; 58(6): 785–803. Dostupné z DOI: <http://dx.doi.org/10.1093/cid/cit945>.
45. Brennhan DC, Garlock KA, Lippmann BA et al. Control of cytomegalovirus-associated morbidity in renal transplant patients using intensive monitoring and either preemptive or deferred therapy. J Am Soc Nephrol 1997; 8(1): 118–125.
46. Åsberg A, Humar A, Rollag H et al. Oral valganciclovir is noninferior to intravenous ganciclovir for the treatment of cytomegalovirus disease in solid organ transplant recipients. Am J Transplant 2007; 7(9): 2106–2113.
47. Emery VC, Griffiths PD. Prediction of cytomegalovirus load and resistance patterns after antiviral chemotherapy. Proc Natl Acad Sci U.S.A. 2000; 97(14): 8039–8044.
48. McGavin JK, Goa KL. Ganciclovir: an update of its use in the prevention of cytomegalovirus infection and disease in transplant recipients. Drugs 2001; 61(8): 1153–1183.
49. Åsberg A, Humar A, Jardine AG et al. Long‐Term Outcomes of CMV Disease Treatment with Valganciclovir Versus IV Ganciclovir in Solid Organ Transplant Recipients. Am J Transplant 2009; 9(5): 1205–1213. Dostupné z DOI: <http://dx.doi.org/10.1111/j.1600–6143.2009.02617.x>.
50. Chou SW. Cytomegalovirus drug resistance and clinical implications. Transplant Infectious Disease 2001; 3(Suppl 2): S20-S24.
51. Eid AJ, Arthurs SK, Deziel PJ et al. Emergence of drug‐resistant cytomegalovirus in the era of valganciclovir prophylaxis: therapeutic implications and outcomes. Clin Transplant 2008; 22(2): 162–170. Dostupné z DOI: <http://dx.doi.org/10.1111/j.1399–0012.2007.00761.x>.
52. Lurain NS, Chou S. Antiviral drug resistance of human cytomegalovirus. Clin Microbiol Rev 2010; 23(4): 689–712. Dostupné z DOI: <http://dx.doi.org/10.1128/CMR.00009–10.>.
53. Ozaku KS, Câmara NO, Nogueira E et al. The use of sirolimus in ganciclovir‐resistant cytomegalovirus infections in renal transplant recipients. Clin Transplant 2007; 21(15): 675–680.
54. Ljungman P, Deliliers GL, Platzbecker U et al. Cidofovir for cytomegalovirus infection and disease in allogeneic stem cell transplant recipients. Blood 2001; 97(2): 388–392.
55. Egli A, Infanti L, Dumoulin A et al. Prevalence of polyomavirus BK and JC infection and replication in 400 healthy blood donors. J Infect Dis 2009; 199(6): 837–846.
56. Antonsson A, Green AC, Mallitt KA et al. Prevalence and stability of antibodies to the BK and JC polyomaviruses: a long-term longitudinal study of Australians. J Gen Virol 2010; 91(Pt 7): 1849–1853. Dostupné z DOI: <http://dx.doi.org/10.1099/vir.0.020115–0>.
57. Boldorini R, Veggiani C, Barco D et al. Kidney and urinary tract polyomavirus infection and distribution: molecular biology investigation of 10 consecutive autopsies. Arch Pathol Lab Med 2005; 129(1): 69–73.
58. Chesters PM, Heritage J, McCance DJ. Persistence of DNA sequences of BK virus and JC virus in normal human tissues and in diseased tissues. J Infect Dis 1983; 147(4): 676–684.
59. Schachtner T et al. The Loss of BKV‐specific Immunity From Pretransplantation to Posttransplantation Identifies Kidney Transplant Recipients at Increased Risk of BKV Replication. Am J Transplant 2015; 15(8): 2159–2169. Dostupné z DOI: <http://dx.doi.org/10.1111/ajt.13252>.
60. Hirch HH, Knowles W, Dickenmann M et al. Prospective study of polyomavirus type BK replication and nephropathy in renal-transplant recipients. N Engl J Med 2002; 347(7): 488–496.
61. Bohl DL, Brennan DC. BK virus nephropathy and kidney transplantation. Clin J Am Soc Nephrol 2007; 2(Suppl 1): S36-S46.
62. Ahuja M, Cohen EP, Dayer AM et al. Polyoma virus infection after renal transplantation: Use of Immunostaining as a Guide to Diagnosis. Transplantation 2001; 71(7): 896–899.
63. Mengel M, Marwedel M, Radermacher J et al. Incidence of polyomavirus‐nephropathy in renal allografts: influence of modern immunosuppressive drugs. Nephrol Dial Transplant 2003; 18(6): 1190–1196.
64. Hirsch HH, Steiger J. Polyomavirus Bk. Lancet Infect Dis 2003; 3(10): 611–623.
65. Hirsch HH, Snydman DR. BK virus: opportunity makes a pathogen. Clin Infect Dis 2005; 41(3): 354–360.
66. Hirch HH, Randhawa P. [AST Infectious Diseases Community of Practice]. BK polyomavirus in solid organ transplantation. Am J Transplant 2013; 13(Suppl 4): S179-S188. Dostupné z DOI: <http://dx.doi.org/10.1111/ajt.12110>.
67. Hirsch HH, Vincenti F, Friman S et al. Polyomavirus BK replication in de novo kidney transplant patients receiving tacrolimus or cyclosporine: a prospective, randomized, multicenter study. Am J Transplant 2013; 13(1): 136–145. Dostupné z DOI: <http://dx.doi.org/10.1111/j.1600–6143.2012.04320.x>.
68. Prince O, Savic S, Dickenmann M et al. Risk factors for polyoma virus nephropathy. Nephrol Dial Transplant 2009; 24(3): 1024–1033. Dostupné z DOI: <http://dx.doi.org/10.1093/ndt/gfn671>.
69. Drachenberg CB, Hirsch HH, Papadimitriou JC et al. Polyomavirus BK versus JC replication and nephropathy in renal transplant recipients: a prospective evaluation. Transplantation 2007; 84(3): 323–330.
70. Mengelle C, Kamar N, Mansuy JM et al. JC virus DNA in the peripheral blood of renal transplant patients: A 1‐year prospective follow‐up in France. J Med Virol 2011; 83(1): 132–136. Dostupné z DOI: <http://dx.doi.org/10.1002/jmv.21951>.
71. Cheng XS, Bohl DL, Storch GA et al. Inhibitory interactions between BK and JC virus among kidney transplant recipients. J Am Soc Nephrol 2011; 22(5): 825–831. Dostupné z DOI: <http://dx.doi.org/10.1681/ASN.2010080877>.
72. Hardinger KL, Koch MJ, Bohl DJ et al. BK‐Virus and the Impact of Pre‐Emptive Immunosuppression Reduction: 5‐Year Results. Am J Transplant 2010; 10(2): 407–415. Dostupné z DOI: <http://dx.doi.org/10.1111/j.1600–6143.2009.02952.x>.
73. Brennan DC, Agha I, Bohl DL et al. Incidence of BK with tacrolimus versus cyclosporine and impact of preemptive immunosuppression reduction. Am J Transplant 2005; 5(3): 582–594.
74. Elfadawy N, Flechner SM, Schold JD et al. Transient versus Persistent BK Viremia and Long-Term Outcomes after Kidney and Kidney–Pancreas Transplantation. Clin J Am Soc Nephrol 2014; 9(3): 553–561. Dostupné z DOI: <http://dx.doi.org/10.2215/CJN.08420813>.
75. Sawinski D, Forde KA, Trofe-Clark J et al. Persistent BK viremia does not increase intermediate-term graft loss but is associated with de novo donor-specific antibodies. J Am Soc Nephrol 2015; 26(4): 966–975. Dostupné z DOI: <http://dx.doi.org/10.1681/ASN.2014010119>.
76. Drachenberg CB, Papadimitriou JC, Hirsch HH et al. Histological patterns of polyomavirus nephropathy: correlation with graft outcome and viral load. Am J Transplant 2004; 4(12): 2082–2092.
77. Masutani K, Shapiro R, Basu A et al. The Banff 2009 Working Proposal for polyomavirus nephropathy: a critical evaluation of its utility as a determinant of clinical outcome. Am J Transplant 2012; 12(4) :907–918. Dostupné z DOI: <http://dx.doi.org/10.1111/j.1600–6143.2012.03993.x>.
78. Dadhania D, Snopkowski C, Ding R et al. Validation of noninvasive diagnosis of BK virus nephropathy and identification of prognostic biomarkers. Transplantation 2010; 90(2):189–197. Dostupné z DOI: <http://dx.doi.org/10.1097/TP.0b013e3181e2a932>.
79. Wunderink HF, van der Meijden E, van der Blij-de Brouwer CS et al. Pretransplantation Donor-Recipient Pair Seroreactivity Against BK Polyomavirus Predicts Viremia and Nephropathy After Kidney Transplantation. Am J Transplant 2017; 17(1):161–172. Dostupné z DOI: <http://dx.doi.org/10.1111/ajt.13880>.
80. Schachtner T, Müller K, Stein M et al. BK Virus‐Specific Immunity Kinetics: A Predictor of Recovery from Polyomavirus BK‐Associated Nephropathy. Am J Transplant 2011; 11(11): 2443–2452. Dostupné z DOI: <http://dx.doi.org/10.1111/j.1600–6143.2011.03693.x>.
81. Binggeli S, Egli A, Schaub S et al. Polyomavirus BK‐specific cellular immune response to VP1 and large T‐antigen in kidney transplant recipients. Am J Transplant 2007; 7(5): 1131–1139.
82. Schaub S, Hirsch HH, Dickenmann M et al. Reducing immunosuppression preserves allograft function in presumptive and definitive polyomavirus‐associated nephropathy. Am J Transplant 2010; 10(12): 2615–2623. Dostupné z DOI: <http://dx.doi.org/10.1111/j.1600–6143.2010.03310.x>.
83. Sood P, Senanayake S, Sujeet K et al. Management and outcome of BK viremia in renal transplant recipients: a prospective single-center study. Transplantation 2012; 94(8): 814–821. Dostupné z DOI: <http://dx.doi.org/10.1097/TP.0b013e31826690c6>.
84. Li YJ, Weng CH, Lai WC et al. A suppressive effect of cyclosporine A on replication and noncoding control region activation of polyomavirus BK virus. Transplantation 2010; 89(3): 299–306. Dostupné z DOI: <http://dx.doi.org/10.1097/TP.0b013e3181c9b51c>.
85. Acott PD, O’Regan PA, Lee SH et al. In vitro effect of cyclosporin A on primary and chronic BK polyoma virus infection in Vero E6 cells. Transpl Infect Dis 2008; 10(6): 385–390. Dostupné z DOI: <http://dx.doi.org/10.1111/j.1399–3062.2008.00330.x>.
86. Acott P, O’Regan PA, Crocker JF. Suppression of early and chronic BK polyoma virus replication by mycophenolic acid in Vero cells. Transpl Int 2009; 22(2): 225–231. Dostupné z DOI: <http://dx.doi.org/10.1111/j.1432–2277.2008.00766.x>.
87. Hirsch HH, Lu M, Wernli M. Polyomavirus Bk (bkv) Replication in Renal Tubular Epithelial Cells Is Inhibited by mtor Inhibitors, but Activated by Tacrolimus in a Pathway Involving the Fkbp12. Am J Transplant 2011; 11(1) :179. Dostupné z DOI: <http://dx.doi.org/10.1111/j.1600–6143.2010.03307.x>.
88. Lee BT, Gabardi S, Grafals M et al. Efficacy of levofloxacin in the treatment of BK viremia: a multicenter, double-blinded, randomized, placebo-controlled trial. Clin J Am Soc Nephrol 2014; 9(3): 583–589. Dostupné z DOI: <http://dx.doi.org/10.2215/CJN.04230413>.
89. Johnston O, Jaswal D, Gill JS et al. Treatment of polyomavirus infection in kidney transplant recipients: a systematic review. Transplantation 2010; 89(9): 1057–1070. Dostupné z DOI: <http://dx.doi.org/10.1097/TP.0b013e3181d0e15e>.
90. Menter T, Mayr M, Schaub S et al. Pathology of Resolving Polyomavirus‐Associated Nephropathy. Am J Transplant 2013; 13(6): 1474–1483. Dostupné z DOI: <http://dx.doi.org/10.1111/ajt.12218>.
91. Wiebe C, Gibson IW, Blydt-Hansen TD et al. Evolution and clinical pathologic correlations of de novo donor‐specific HLA antibody post kidney transplant. Am J Transplant 2012; 12(5): 1157–1167. Dostupné z DOI: <http://dx.doi.org/10.1111/j.1600–6143.2012.04013.x>.
92. Everly MJ, Rebellato LM, Haisch CE et al. Incidence and impact of de novo donor-specific alloantibody in primary renal allografts. Transplantation 2013; 95(3): 410–417. Dostupné z DOI: <http://dx.doi.org/10.1097/TP.0b013e31827d62e3>.
93. Mannon RB, Hoffmann SC, Kampen RL et al. Molecular evaluation of BK polyomavirus nephropathy. Am J Transplant 2005; 5(12): 2883–2893.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2017 Issue 7-8-
All articles in this issue
- Historie a současnost léčby hepatitid B a C
- PCR diagnostika infekcí
- Nozokomiální infekce a antibiotická rezistence v současnosti
- Vývoj názorů na patofyziologii sepse
- Cytomegalovirová a polyomavirová infekce po transplantaci ledviny
- Virová hepatitida A – možný diferenciálně diagnostický a terapeutický problém
- Infekce HIV jako nové onemocnění vnitřního lékařství
- Myokarditidy a zánětlivé kardiomyopatie
- Komunitní pneumonie – základy diagnostiky a léčby
- Nozokomiální pneumonie
- Infekční komplikace u transplantací jater
- Virová hepatitida C a transplantace orgánů
- Transplantace srdce a infekce
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Nozokomiální pneumonie
- PCR diagnostika infekcí
- Nozokomiální infekce a antibiotická rezistence v současnosti
- Komunitní pneumonie – základy diagnostiky a léčby
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

