-
Medical journals
- Career
Nozokomiální infekce a antibiotická rezistence v současnosti
: Renata Tejkalová 1,2
: Mikrobiologický ústav LF MU a FN u sv. Anny v Brně 1; Centrum kardiovaskulární a transplantační chirurgie, Brno 2
: Vnitř Lék 2017; 63(7-8): 476-480
: Reviews
Nozokomiální infekce jsou v současnosti považovány za významný indikátor kvality péče ve všech zdravotnických zařízeních. Jedná se o nežádoucí komplikaci poskytované zdravotnické péče s řadou negativních následků, jako jsou nárůst morbidity a mortality, prodloužení doby hospitalizace a vzestup nákladů. Jejich výskyt dnes mimo jiné souvisí i s narůstajícími, mnohdy invazivními technickými možnostmi diagnostiky i terapie. Dalším problémem v nemocnicích České republiky je nárůst rezistence některých bakterií k antibiotikům. Prakticky to znamená značně omezené možnosti léčby. Příspěvek přináší aktuální data o bakteriální rezistenci v Českých nemocnicích (evropský projekt EARS-Net – rok 2015).
Klíčová slova:
bakteriální rezistence – European Antimicrobial Resistance Surveillance Network (EARS-Net) – infekce spojené se zdravotní péčí – nozokomiální infekceÚvod
Nozokomiální infekce je definována jako infekce získaná v souvislosti s hospitalizací, která nebyla přítomna při přijetí, ani nebyla přítomna v inkubační době před přijetím pacienta. Na jejím vzniku se podílí celá řada faktorů, jako je přítomnost specifických mikroorganizmů v daném zdravotnickém zařízení, oslabení organizmu základní nemocí, různé diagnostické a léčebné zásahy, úroveň asepse, sterilizace, dezinfekce a také odbornost personálu daného zdravotnického zařízení [1,4].
V Evropě jsou nozokomiální infekce známy už od 4. století, to znamená z doby vzniku prvních nemocnic. Pravděpodobně prvním známým protiepidemickým opatřením v nemocničním prostředí bylo zavedení dezinfekce rukou před kontaktem s pacientem. Tento průlom v přístupu k možnému nebezpečí vzniku infekce je spojen se jménem maďarského lékaře pracujícího ve Vídeňské všeobecné nemocnici Ignaze Semmelweisse, který zavedl na svém gynekologickém oddělení povinné mytí rukou chlorovým vápnem, a díky tomu ihned úmrtnost rodiček velmi významně poklesla. Ve stejném století byl poprvé pro nozokomiální nákazu použit termín hospitalizmus. Použil ho anglický lékař James Young Simpson po zjištění, že pacienti hospitalizovaní po amputaci končetiny umírali podstatně častěji než ti, kteří byli po takovém zákroku ošetřováni doma [1].
Další pokrok nastal v 30. a 40. letech 20. století, kdy byla objevena a v nemocniční praxi použita první antibiotika – penicilin a sulfonamidy. Řada odborníků se tehdy domnívala, že problém nozokomiálních infekcí je jednou provždy vyřešen, protože v této době opravdu došlo k významnému poklesu nozokomiálních infekcí. Nikdo netušil jak rychle a jak dokonale jsou bakterie schopny vytvářet si rezistenci [1,4].
Klasifikace nozokomiálních infekcí
Klasifikace nozokomiální infekce je zásadní pro každý program surveillance nákaz. Starší zdroje dělí nozokomiální infekce podle epidemiologického hlediska na specifické, které jsou charakteristické přímo pro dané zdravotnické zařízení, a nespecifické, které jsou do zdravotnického zařízení zaneseny z vnějšího prostředí. Jiná možnost je dělení podle původců na endogenní, při nichž bakterie pocházejí z vlastní mikroflóry pacienta, a exogenní, při nichž jsou bakterie do místa infekce zavlečeny zvenčí. Dalším pohledem je dělení podle lokality infekce, např. infekce močové, respirační, infekce v místě chirurgického výkonu (ranné), infekce krevního řečiště (sepse), infekce gastrointestinální a kožní [3,4,6].
Podle nové klasifikace se dnes nozokomiální infekce dělí na primárně endogenní, které mohou být jak komunitní, tak i nemocniční a které se vyskytují během 1. týdne pobytu v nemocnici (incidence 55 %), sekundárně endogenní neboli nemocniční, které se vyskytují až po 1. týdnu hospitalizace (incidence 30 %), a exogenní, rovněž nemocniční, které se vyskytují kdykoliv během pobytu v nemocnici (incidence 15 %) [7,11].
Nozokomiální infekce a bakteriální rezistence
Značným problémem v nemocnicích České republiky se v posledních 20 letech stává narůstající rezistence některých bakterií k antibiotikům. V krajním případě se jedná o tzv. multirezistentní bakterie (multidrug-resistant organisms – MDRO), které jsou rezistentní k řadě základních, ale i záložních antibiotik, někdy dokonce ke všem. Bakterie disponují obrovským počtem různých genetických mechanizmů k vytvoření rezistence k antibiotikům. Může se tak stát chromozomálními mutacemi s expresí genů pro rezistence, mohou získat nový genetický materiál jeho přímou výměnou (konjugace), přes bakteriofágy (transdukce), přes extrachromozomální plazmidy (konjugace) nebo získáním nové DNA transformací. Takto získané genetické informace umožní bakteriím získat rezistenci vůči antibiotikům různými mechanizmy, např. produkcí enzymů, které mají schopnost inaktivovat nebo zničit antibiotikum, změnou cílového místa vazby antibiotika nebo zabráněním přístupu antibiotika k cílovému místu. Některé typy rezistencí vznikají spontánně genetickou mutací: např. změna DNA gyrázy ústí v rezistenci vůči fluorochinolonům. Jiné mechanizmy jsou komplexnější, s genetickým zakódováním schopnosti bakterií vytvářet vysoce specifické enzymy, mající schopnost inaktivovat antibiotika pomocí širokospektrých betalaktamáz [7,12].
V naší zemi představují největší problém především gramnegativní tyčky, jako je Klebsiella pneumoniae, Escherichia coli, Pseudomonas aeruginosa či Acinetobacter baumannii, produkující nejrůznější typy širokospektrých betalaktamáz. Jiné gramnegativní bakterie, např. Stenotrophomonas maltophilia nebo Burkholderia cepacia, se vyznačují vrozenou odolností vůči většině dostupných antibiotik. Tyto kmeny se vyskytují především na jednotkách intenzivní péče, u onkologických či imunokompromitovaných pacientů nebo na popáleninových jednotkách. Všechny takové bakteriální kmeny mohou hospitalizovaného pacienta pouze kolonizovat, ale mohou mu způsobit závažné infekce. Infekce způsobené takto rezistentními kmeny mají vyšší mortalitu než infekce způsobené citlivými kmeny stejných bakterií. Jejich léčba je příčinou zvýšených nákladů, protože pacienty je třeba kromě užití záložních antibiotik izolovat, aby se snížilo nebezpečí jejich přenosu. Také se prodlužuje doba hospitalizace [12].
Projekt EARS-Net
EARS-Net (European Antimicrobial Resistance Surveillance Network), je mezinárodní síť národních systémů surveillance antibiotické rezistence u nejčastěji se vyskytujících invazivních bakterií na území Evropy. Tento projekt, označovaný v letech 1999–2009 jako EARSS (European Antimicrobial Resistance Surveillance System), vznikl na podnět evropské komise. EARS-Net shromažďuje a analyzuje údaje získané při rutinním vyšetřování citlivosti bakterií na antibiotika.
Evropská komise vydala v roce 1998 Kodaňské doporučení [1] pro zahájení kontinuální surveillance antibiotické rezistence bakterií na území Evropy. Projekt nazvaný EARSS (European Surveillance Resistance System), zahájený v roce 1999, shromažďuje a analyzuje údaje získané prostřednictvím mezinárodní sítě národních systémů surveillance. Česká republika se těchto aktivit účastní od roku 2000. Koordinaci surveillance a analýzu shromážděných evropských údajů prováděl v období let 1999–2009 holandský RIVM (Rijksinstituut voor Volksgezondheid en Milieu/National Institute of Public Health and Environment), 1. 1. 2010 byl tento projekt převeden do systémů surveillance TESSy (The European Surveillance System), který je koordinován ECDC (European Centre for Disease Prevention and Control/Evropské centrum pro prevenci a kontrolu infekčních onemocnění) a přejmenován na EARS-Net (European Antimicrobial Resistance Surveillance Network) [2]. Evropská surveillance rezistence shromažďuje a analyzuje informace o aktuálním stavu antibiotické rezistence a jejích trendech u klinicky významných invazivních bakterií. V letech 1999–2000 byly do sledování zařazeny druhy Streptococcus pneumoniae a Staphylococcus aureus, v roce 2001 bylo zahájeno sledování u Escherichia coli, Enterococcus faecalis a Enterococcus faecium, a od roku 2005 u Klebsiella pneumoniae a Pseudomonas aeruginosa. V roce 2013 se začaly sledovat všechny invazivní druhy rodu Acinetobacter. Získané údaje o antibiotické rezistenci u invazivních kmenů těchto druhů jsou základním nástrojem pro výběr antibiotik volby k léčbě infekcí a slouží také k zavedení postupů ke snížení frekvence rezistence, prevenci šíření rezistentních kmenů a ke kontrole účinnosti těchto opatření. Aktivity EARS-Net jsou podepřeny základními dokumenty Evropského parlamentu a rady [3,4]:
- Report from the invitational EU Conference on the microbial threat, Copenhagen, Denmark 9–10 September 1998, by Thamdrup Rosdahl et al
- European Antimicrobial Resistance Surveillance Network (EARS-Net)
- Rozhodnutí Evropského parlamentu a rady č. 2119/98/ES ze dne 24. září 1998 o zřízení sítě epidemiologického dozoru a kontroly přenosných nemocí v EU
- Regulation (EC) no 851/2004 of the European Parliament and of the Council of 21 April 2004 establishing a European Centre for Disease Prevention and Control
- další významné dokumenty ECDC:
- A recommendation on prudent use of antimicrobial agents in human medicine (2002/77/EC)
- Council Conclusions on Antimicrobial Resistance
Kontakt: Národní referenční laboratoř pro antibiotika – e-mail: nrlatb@szu.cz
Bakteriální rezistence v České republice
Bakteriální rezistence v České republice u některých sledovaných kmenů – údaje z projektu EARS-Net 2015 http://apps.szu.cz/earsnet/ ukazují obr. 1–6.
1. Klebsiella pneumoniae, ČR 2015, CEF III 54,1 % 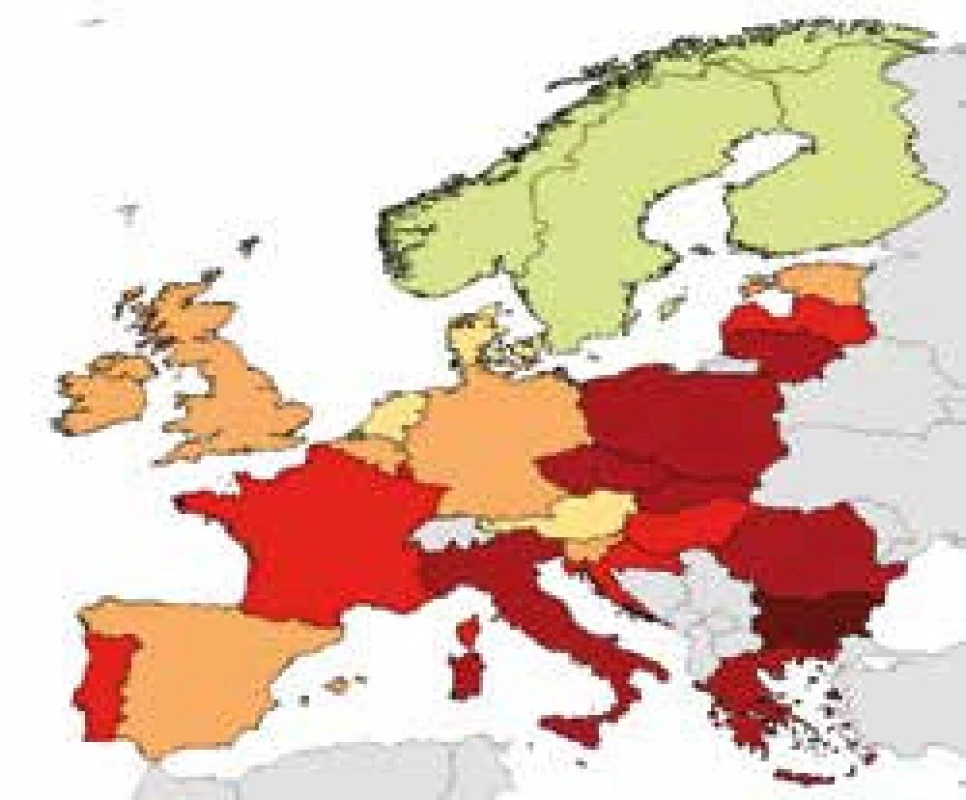
2. Klebsiella pneumoniae, ČR 2015, FQ 48,9 % 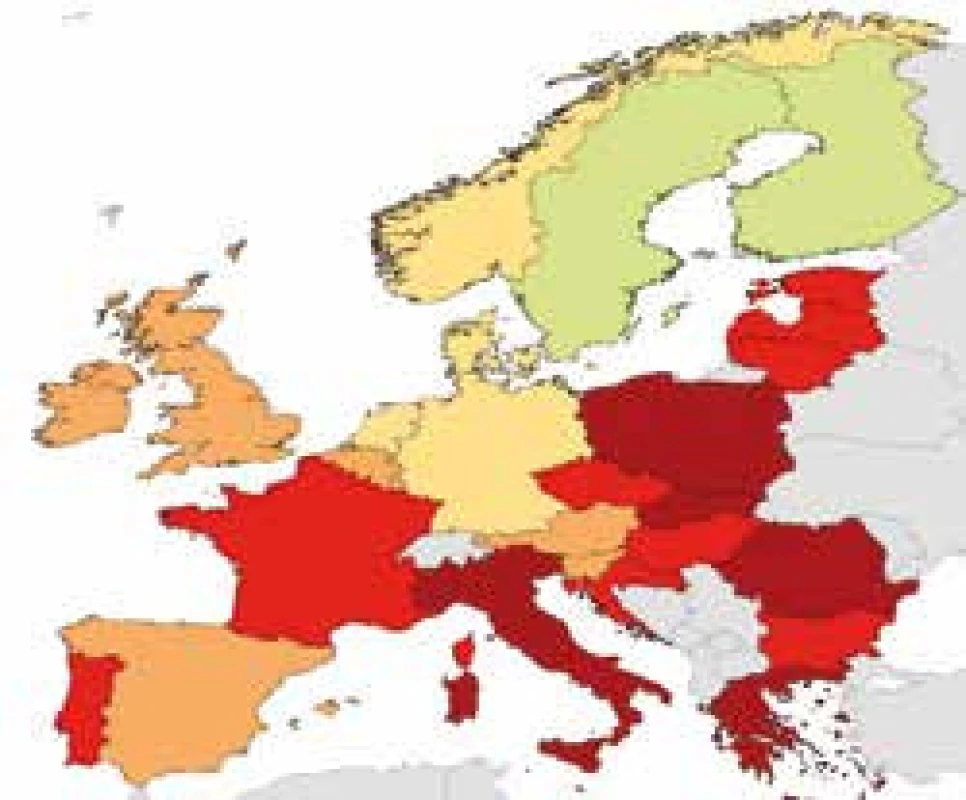
3. Klebsiella pneumoniae, rezistence ke karbapenemům, ČR 2015 0,3 %, Itálie 33,5 %, Řecko 61,9 % 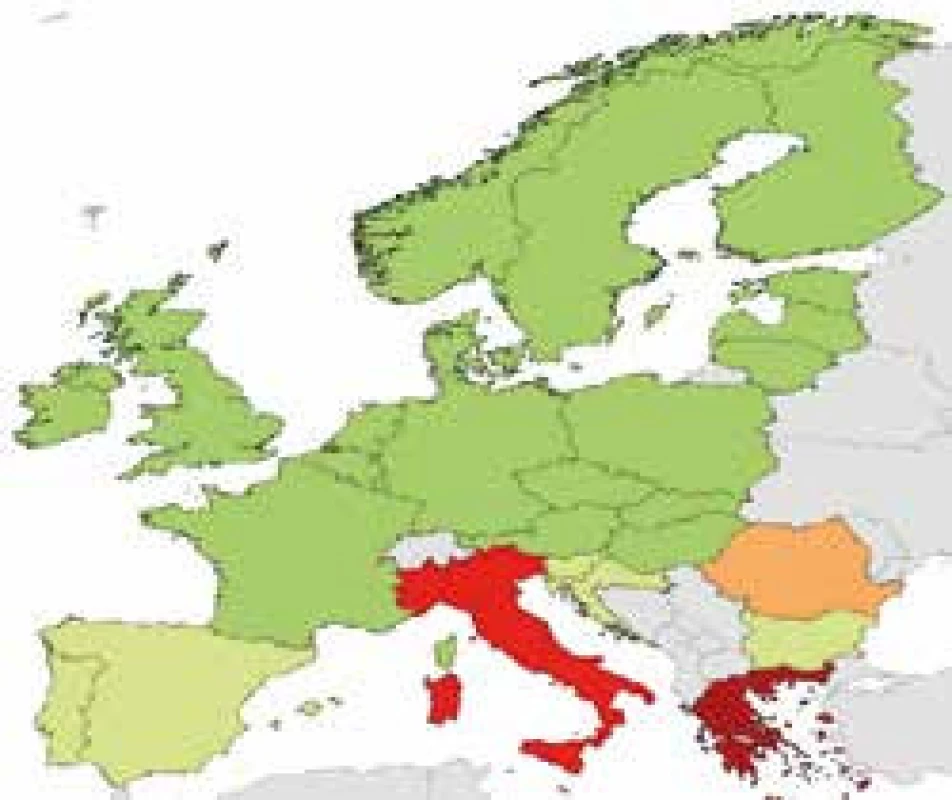
4. Escherichia coli, ČR 2015, CEF III 14,5 % 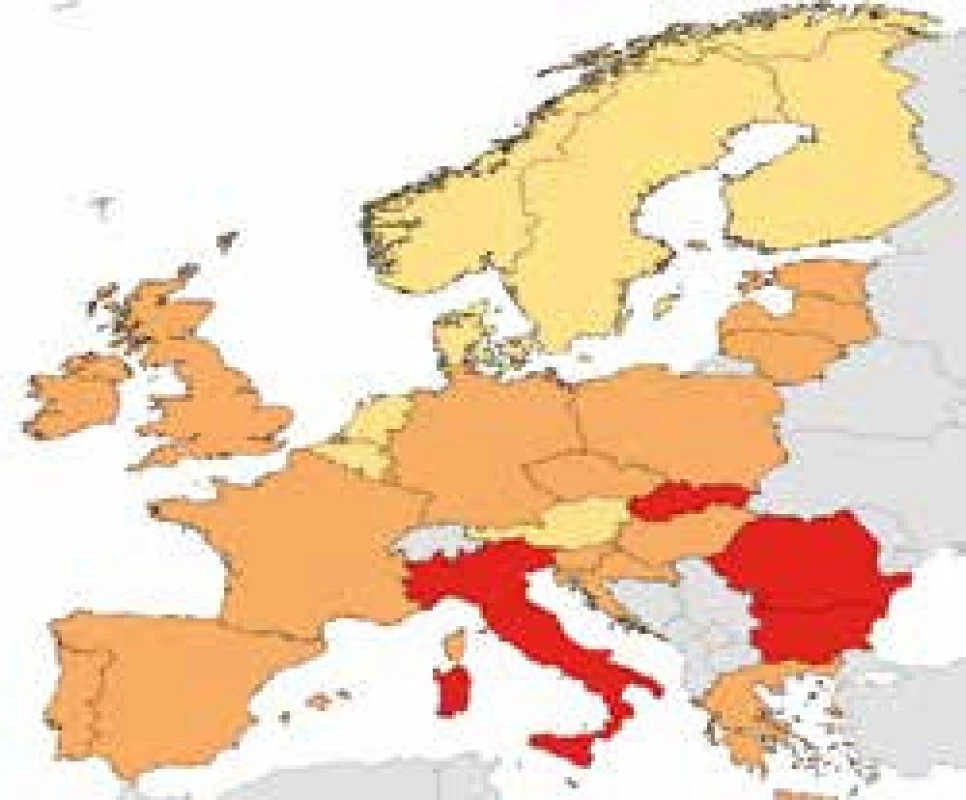
5. Pseudomonas aeruginosa, ČR 2015, kombinovaná rezistence PIP/TAZO, CEF III, FQ, AG, KP 19 % 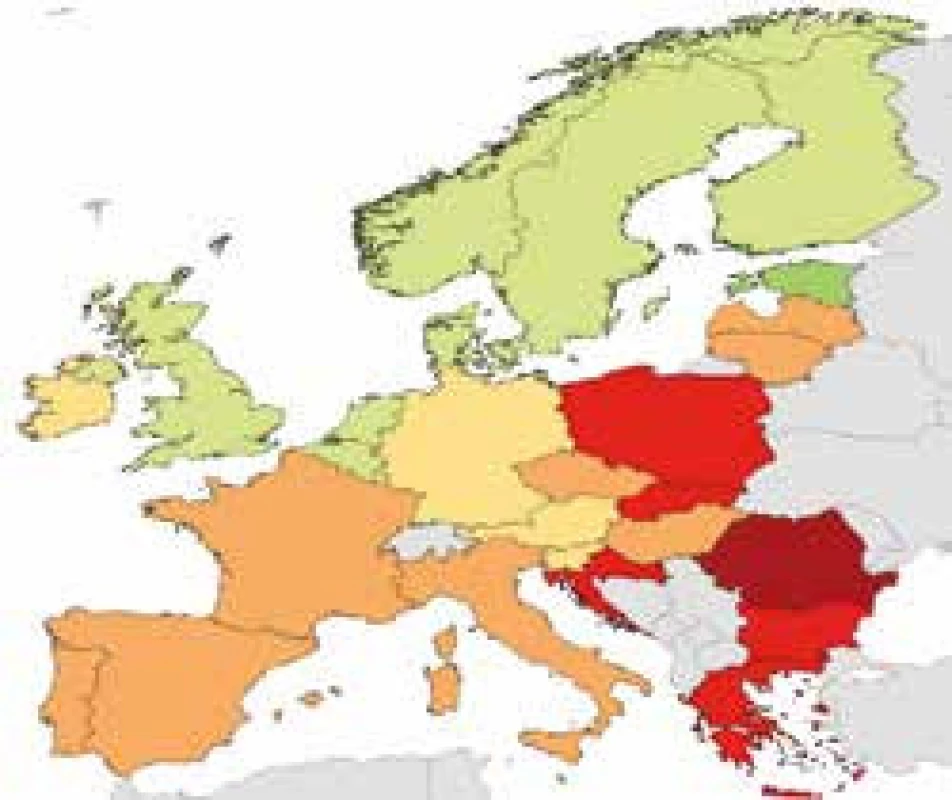
6. Klebsiella pneumoniae, ČR 2015, kombinovaná rezistence CEF III, FQ, AG 41,5 % 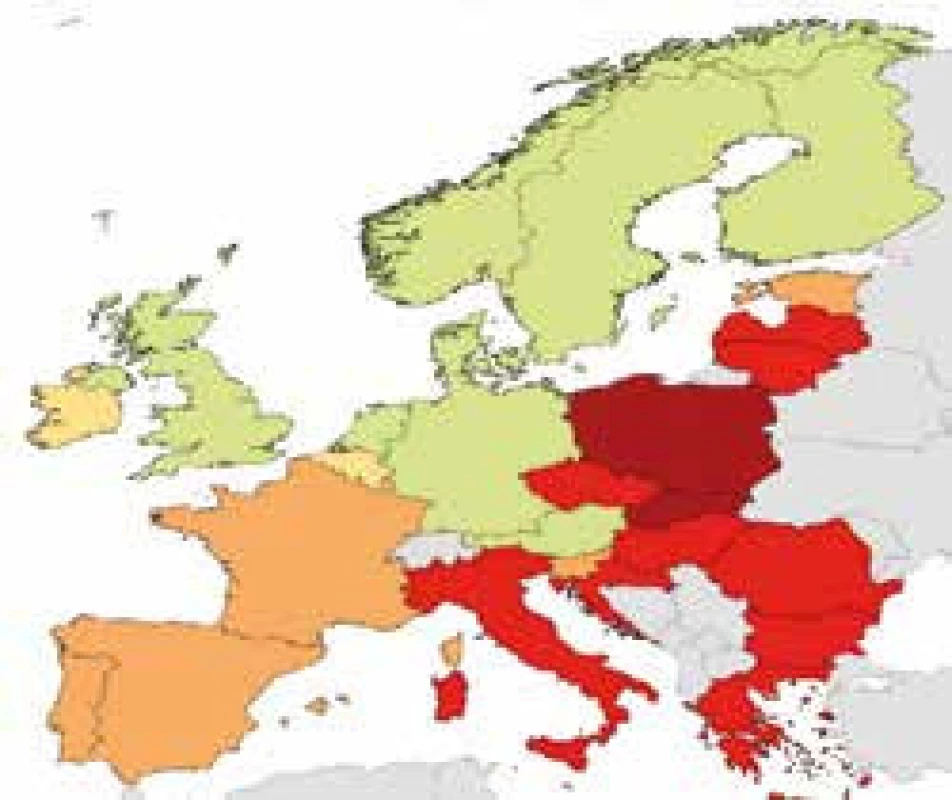
Závěr EARS-Net v České republice
V České republice byly prokázány všechny nebezpečné fenomény antibiotické rezistence a v případě gramnegativních bakterií patříme mezi nejhorší země v Evropě. Kromě multirezistentních kmenů s produkcí širokospektrých betalaktamáz se u nás vyskytují i kmeny panrezistentní, produkující různé karbapanemázy a metalobetalaktamázy, takže do terapie někdy zbývá jediné antibiotikum – kolistin. V poslední době stoupá rezistence i ke kolistinu, takže jsou zaznamenány kmeny rezistentní ke všem v současnosti dostupným antibiotikům. Opatření, která mají zabránit šíření takto rezistentních bakteriálních kmenů, jsou založena na bariérovém přístupu a aktivní surveillance [10,12].
Dvě krátké kazuistiky
Oba tyto případy byly konzultovány s Antibiotickým střediskem FN u sv. Anny v Brně.
První kazuistika popisuje případ polymorbidního, warfarinizovaného pacienta, rok narození 1929, který byl dne 12. 1. 2011 po pádu na ulici přivezen sanitkou RZS do FN u sv. Anny v Brně. Byl přijat na I. interní kardio-angiologickou kliniku FN u sv. Anny v kolapsovém stavu a v bezvědomí. Byla diagnostikována mnohočetná hemoragická kontuzní ložiska v mozku a fraktura týlní kosti. Pacient byl ve FN u sv. Anny hospitalizován celkem 3 měsíce a léčen na různých klinikách (I. interní kardio-angiologická klinika, Neurochirurgická klinika, Anesteziologicko-resuscitační klinika). Během hospitalizace na Anesteziologicko-resuscitační klinice byl kolonizován kmenem polyrezistentní pseudomonády (kmen citlivý pouze ke kolistinu a amikacinu). Pseudomonáda byla poprvé zachycena dne 26. 2. 2011 v dýchacích cestách, nejprve v krku a nose, později i v tracheálním aspirátu. Z původní kolonizace se během doby vyvinula ventilátorová pneumonie. Pacient byl úspěšně přeléčen kolistinem, celkově i inhalačně, a po stabilizaci stavu a odpojení od ventilátoru byl dne 18. 3. 2011 přeložen na spádovou internu Nemocnice Milosrdných bratří v Brně. Jeho dýchací cesty byly i nadále kolonizovány touto pseudomonádou. Kmen byl v Mikrobiologickém ústavu FN u sv. Anny podroben bližšímu vyšetření a pro podezření na produkci metalobetalaktamázy byl jako epidemiologický závažný zaslán do Národní referenční laboratoře (NRL) pro antibiotika ke konfirmaci.
Druhá kazuistika popisuje případ muže narozeného roku 1942, který byl přijat dne 28. 3. 2011 na interní oddělení Nemocnice Milosrdných bratří v Brně s diagnózou komunitní bronchopneumonie. Pacient byl polymorbidní, hypertonik s ischemickou chorobou srdeční. Po konzultaci s Antibiotickým střediskem FN u sv. Anny v Brně byl léčen dle obvyklých schémat kombinací antibiotik. Klinicky se po plicní stránce lepšil, ale dne 22. 4. 2011 u něho došlo k rozvoji katétrové sepse. V hemokulturách i na centrálním žilním katétru jsme zachytili kmen polyrezistentní pseudomonády, která vykazovala známky produkce metalobetalaktamázy, a proto byla rovněž zaslána ke konfirmaci do Prahy. Také tento pacient byl zaléčen kolistinem s dobrým klinickým efektem.
Závěr vyšetření NRL pro antibiotika
Po stanovení mechanizmu rezistence a ověření obou kmenů metodou PFGE (Pulsed-field gel electrophoresis – pulzní gelová elektroforéza) se jedná o identický kmen Pseudomonas aeruginosa, producenta širokospektré metalobetalaktamázy.
Závěr obou kazuistik
Po telefonické konzultaci s Antibiotickým střediskem a ošetřujícím lékařem interního oddělení Nemocnice Milosrdných bratří v Brně se ukázalo, že oba pacienti byli ve stejnou dobu hospitalizováni na stejném interním oddělení, kde leželi na stejném pokoji vedle sebe. Nepochybně se jednalo o nozokomiální přenos epidemiologicky závažného kmene.
Závěr
Prevence vzniku nozokomiálních infekcí a infekce multirezistentními bakteriálními kmeny spočívá ve vytvoření adekvátních postupů a jejich zavádění do denní praxe. Patří sem kvalitní mikrobiologická diagnostika, racionálně vedená antibiotická léčba, správná péče o zavedené vaskulární a močové katétry, prevence infekce dolních dýchacích cest u intubovaných nemocných a rovněž kvalitní, smysluplná prevence přenosu infekcí a dostatečná úroveň bariérových opatření. V rámci preventivních opatření je jednoznačně doporučováno sledování výskytu rezistentních bakteriálních kmenů v rámci nemocniční surveillance a monitorace spotřeby antibiotik. Klíčová je dobrá spolupráce mikrobiologických oddělení včetně antibiotických středisek a oddělení hygieny a epidemiologie. Samozřejmostí je používání obecně platných postupů prevence nozokomiálních nákaz včetně bariérového ošetřovacího režimu. Izolace nemocných s infekcí, ale zřejmě i s kolonizací multirezistentními organizmy, se doporučuje, okolní prostředí kolem nemocného totiž může být významným rezervoárem rezistentních kmenů [7,9,12].
MUDr. Renata Tejkalová
renata.tejkalova@fnusa.cz
Antibiotické středisko,
Mikrobiologický ústav LF MU
a FN u sv. Anny v Brně
www.fnusa.cz
Doručeno do redakce 24. 5. 2017
Přijato po recenzi 28. 6. 2017
Sources
1. Gopfertová D, Pazdiora P, Dáňová J. Epidemiologie (obecná a speciální epidemiologie infekčních nemocí). Karolinum: Praha 2006. ISBN 80–246–1232–1.
2. Kolář M. Antibiotická léčba nozokomiálních infekcí. Triton: Praha 2000. ISBN 80–7254–151-X.
3. Maďar R, Podstatová R, Řehořová J. Prevence nozokomiálních infekcí v klinické praxi. Grada Publishing: Praha 2006. ISBN 80–247–1673–9.
4. Šrámová H. Nozokomiální nákazy. 2nd ed. Maxdorf: Praha 2001. ISBN 80–85912–25–2.
5. Časopis Komfort 03/2004 [on line]. Dostupné z WWW: <https://www.linet.cz/zdravotnicka-technika/ospolecnosti/casopis-komfort/komfort-3–2004/26763/verze-v-pdf>.
6. Nozokomiální nákazy – nemocniční onemocnění [on line]. Dostupné z WWW: <https://zanet.zdrave.cz/nozokomialni-nakazy - nemocnicni-onemocneni/.>.
7. Sas I. Nozokomiální infekce a infekce multirezistentními organismy v podmínkách intenzívní péče. Postgraduální medicína 2010; 12(9): 1079–1087.
8. Projekt EARS-Net. Dostupné z WWW: <http://apps.szu.cz/earsnet/>.
9. Jindrák V, Hedlová D, Urbášková P et al. Antibiotická politika a prevence infekcí v nemocnici. Mladá fronta: Praha 2014. ISBN 978–80–204–2815–8.
10. Metodický postup. Kontrola výskytu importovaných případů kolonizace a/nebo infekce enterobakteriemi produkujícími karbapenamázu (CPE – Carabapenamase producing Enteroabacteriaceae). Věstník Ministerstva zdravotnictví České republiky 2012; 8 : 10–19. Dostupné z WWW: <http://www.mzcr.cz/Legislativa/dokumenty/vestnik-c8/2012_6865_2510_11.html>.
11. Centers for Disease Control and Prevention – CDC Guidelines. Dostupné z WWW: <https://www.cdc.gov/hai/>.
12. 12.NRL pro antibiotika. Dostupné z WWW: <http://www.szu.cz/narodni-referencni-laborator-pro-antibiotika>.
13. European Centre for Disease Prevention and Control. Dostupné z WWW: <http://ecdc.europa.eu/en/healthtopics/antimicrobial-resistance-and-consumption/antimicrobial_resistance/EARS-Net/Pages/EARS-Net.aspx>.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2017 Issue 7-8-
All articles in this issue
- History and presence of hepatitis B and C therapy
- PCR diagnosis of infectious diseases
- The current problems related to nosocomial infections and antibiotic resistance today
- Development of views on pathophysiology of sepsis
- Cytomegalovirus and polyomavirus infection after renal transplantation
- Viral hepatitis A – possible diagnostic and therapeutic problems
- HIV infection – a new disease of internal medicine
- Myocarditis and inflammatory cardiomyopathy
- Community pneumonia – fundamentals of diagnosing and treatment
- Nosocomial pneumonia
- Infectious complications related to liver transplants
- Viral hepatitis C and organ transplantation
- Heart transplantation and infection
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Nosocomial pneumonia
- PCR diagnosis of infectious diseases
- The current problems related to nosocomial infections and antibiotic resistance today
- Community pneumonia – fundamentals of diagnosing and treatment
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career


