-
Medical journals
- Career
Nozokomiální pneumonie
: Jana Skřičková
: Klinika nemocí plicních a TBC LF MU a FN Brno, pracoviště Bohunice
: Vnitř Lék 2017; 63(7-8): 518-526
: Reviews
Nozokomiální pneumonie (hospital-acquired pneumonia – HAP) je pneumonie, jejíž příznaky vznikly za dobu delší než 2 dny (> 48 hod) od přijetí do nemocnice nebo až 14 dnů od propuštění z nemocnice. Nozokomiální pneumonie představují 13–18 % všech nozokomiálních infekcí. Výskyt HAP je nejčastější u uměle ventilovaných nemocných. Druh a zastoupení původců HAP závisí především na délce pobytu pacienta v nemocnici a na jeho stavu a charakteru léčby. Diagnostika pneumonie je opřena o anamnézu, fyzikální a RTG nález, o výsledky mikrobiologického vyšetření vzorků z respiračního traktu, hemokultury, vyšetření pleurálního výpotku, sérologického vyšetření, hematologického a biochemického vyšetření. Antibiotická léčba je klíčová v komplexní léčbě HAP. Léčba HAP vyžaduje vždy použití dávkování antibiotik na horní hranici možného rozmezí. Předpokladem úspěšného předcházení nozokomiální pneumonii je vytvoření preventivního programu, kterého se aktivně účastní zdravotnický personál.
Klíčová slova:
diagnostika – léčba – nozokomiální pneumonie – ventilátorová pneumonieÚvod
Nozokomiální pneumonie (hospital-acquired pneumonia – HAP) je pneumonie, jejíž příznaky vznikly za dobu delší než 2 dny (> 48 hod) od přijetí do nemocnice nebo až 14 dnů od propuštění z nemocnice. Klinická kritéria HAP jsou nová nebo progredující infiltrace na skiagramu hrudníku po 48 nebo více hodinách od přijetí a nejméně 2 další příznaky (teplota > 38 °C, hnisavé sputum, leukocytóza nebo leukopenie < 1,5 × 109/mm3). Časná nozokomiální pneumonie vzniká do 4 dnů po přijetí do nemocnice. Pozdní nozokomiální pneumonie vzniká za dobu delší než 4 dny od přijetí k hospitalizaci [1,2].
Nozokomiální pneumonie představují 13–18 % všech nozokomiálních infekcí. Nejčastěji se s nimi setkáváme na resuscitačních odděleních a na jednotkách intenzivní péče, na kterých jsou nejčastějšími nozokomiálními infekcemi (představují až 50 % všech nozokomiálních infekcí v intenzivní péči) [3].
Výskyt nozokomiální pneumonie je nejčastější u uměle ventilovaných nemocných. Tento typ nozokomiální pneumonie se nazývá pneumonie ventilátorová (ventilator-associated pneumonia – VAP). Její výskyt je odhadován až na 35 případů na 1 000 dnů umělé plicní ventilace. Ventilátorová pneumonie vzniká po > 48–72 hod od endotracheální intubace a dělí se na časnou (do 5 dnů od přijetí) a pozdní (po 5 dnech od přijetí). Klinická kritéria VAP zahrnují novou nebo progredující infiltraci na skiagramu hrudníku a nejméně 2 další příznaky (teplota > 38,5 °C nebo < 36,5 °C, leukocytóza nebo leukopenie < 1,5 × 109/mm3, hnisavá tracheální sekrece, pozitivní kultivace tracheálního aspirátu v koncentraci > 106/ml) [2–5].
Novou podskupinou HAP je pneumonie spojená se zdravotní péčí (health-care-associated pneumonia – HCAP). HCAP je pneumonie vznikající u lidí s anamnézou minimálně 2denní hospitalizace v posledních 90 dnech, u rezidentů sociálních zařízení, nebo domácí sesterské péče, u hemodialyzovaných pacientů, nemocných s domácí infuzní léčbou a dále u těch, kteří byli v posledních 30 dnech zraněni, chodí na časté ambulantní kontroly do nemocnice nebo mají kontakt se členy rodiny, jež má infekci patogenem s mnohočetnou rezistencí k lékům (MDR – multiple drug resistence). Klinická kritéria HCAP jsou stejná jako HAP [6].
Vyvolávající mikroorganizmus u nozokomiální pneumonie může pocházet z vlastní flóry nemocného (endogenní původ), od nemocničního personálu, od ostatních pacientů, ze zdravotnického materiálu a přístrojů (tracheální rourky, odsávací cévky, bronchoskopy) nebo ze vzduchu a vody (exogenní původ). Infekce se může do plic dostat mikroaspirací z kolonizovaného orofaryngu, inhalací i hematogenní cestou a velmi vzácně přímým přestupem či penetrací z vnějšku [3].
Epidemiologie nozokomiální pneumonie
K naprosté většině nozokomiálních pneumonií dochází na jednotkách intenzivní péče. Incidence nozokomiální pneumonie se udává obvykle mezi 4 až 50 případy na 1 000 přijatých pacientů za rok a závisí na typu zařízení a na druhu nemocných, kteří jsou v něm ošetřováni. Nejnižší roční incidence nozokomiální pneumonie je na porodnických (0,3/1 000) a dětských odděleních (3/1 000), vyšší je na standardních interních a chirurgických odděleních (5–10/1 000). Nejvyšší incidence nozokomiální pneumonie je pozorována na JIP, na kterých čísla kolísají mezi 20 až 500 případy na 1 000 přijatých za rok, při čemž většina studií uvádí hodnoty mezi 80 až 200/1 000/rok [3].
Letalita se u nozokomiální pneumonie pohybuje mezi 25–41 %. Pokud jde o letalitu na ventilátorovou pneumonii, hrubá smrtnost se pohybuje v různých zařízeních od 24 % do 76 % [3,4].
Etiologie nozokomiální pneumonie
Druh a poměrné zastoupení původců nozokomiálních pneumonií závisí především na délce pobytu pacienta v nemocnici a na jeho stavu, resp. charakteru léčby. Ukazuje se dále, že v etiologii jsou značné místní rozdíly, a to nejen mezi zařízeními, ale i mezi jednotlivými odděleními a JIP. Výsledky mikrobiologického vyšetření jsou dále nesmírně ovlivněny i způsobem odběru vzorků a způsobem jejich zpracování v laboratoři.
Nozokomiální pneumonie vzniklé u předtím zdravých dospělých v prvních dnech hospitalizace bývají většinou vyvolány patogeny komunitního původu, které jsou v okamžiku přijetí přítomny na sliznici respiračního traktu. Bývají to hlavně Haemophilus influenzae, Streptococcus pneumoniae a na oxacilin citlivé kmeny Staphylococcus aureus, ale i Moraxella catarrhalis, Legionella pneumophila a respirační viry, především virus chřipky A a RS-virus [1–3].
Gramnegativní aerobně rostoucí tyčinky jsou ve faryngu zdravého člověka přítomny jen vzácně, v komunitě se nalézají asi u třetiny diabetiků nebo alkoholiků. Během hospitalizace postupně začínají kolonizovat orofarynx, a to tím rychleji, čím vážnější je onemocnění, čím déle je pacient léčen antibiotiky a čím déle je intubován. Bývají to ale zpočátku většinou jen enterobakterie (enterobaktery, klebsiely, proteové, Escherichia coli a Serratia marcescens), nikoli tzv. gramnegativní nefermentující tyčinky, jako Pseudomonas aeruginosa, komplex Acinetobacter calcoaceticus-Acinetobacter baumannii nebo Burkholderia cepacia či Stenotrophomonas maltophilia. Tyto gramnegativní nefermentující tyčinky, vesměs rezistentní k řadě antibiotik, odpovídají za vznik pneumonie především u dlouhodobě hospitalizovaných nemocných, u déle mechanicky ventilovaných a u pacientů delší dobu léčených antibiotiky [3].
Velmi zřetelná je závislost etiologie nozokomiálního plicního zánětu na délce umělé plicní ventilace. Časná ventilátorová pneumonie je prakticky vždy vyvolána komunitními patogeny. Převažujícím původcem je Staphylococcus aureus (což je typické zejména pro úrazy hlavy). Dalšími důležitými původci časné VAP bývají Haemophilus influenzae a Streptococcus pneumoniae, Moraxella catarrhalis a u pacientů s rizikovými faktory i enterobakterie. Podíl pseudomonád je zcela minimální [3,7].
Na etiologii pozdní ventilátorové pneumonie se podílejí především gramnegativní tyčinky, a to jak enterobakterie, tak nefermentující tyčinky, významné místo si uchovává Staphylococcus aureus. Z enterobakterií převažují příslušníci rodu Enterobacter (spíše Enterobacter aerogenes než Enterobacter cloacae) a Proteus, dále Klebsiella pneumoniae, Escherichia coli a Serratia marcescens. Z gramnegativních nefermentujících tyčinek jsou to především Pseudomonas aeruginosa a acinetobaktery (tj. mikroby z komplexu Acinetobacter calcoaceticus-Acinetobacter baumannii). Kmeny Staphylococcus aureus izolované u nemocných s pozdní VAP bývají často meticilin-rezistentní (MRSA). Velmi častá je polymikrobiální etiologie nozokomiálních pneumonií [3,8].
Etiologii nozokomiálních pneumonií dále významně ovlivňuje základní onemocnění pacienta. Častější je zastoupení enterobakterií u diabetiků a alkoholiků. Jako etiologické agens se významně častěji vyskytuje Staphylococcus aureus v souvislosti s traumaty, zejména s úrazy hlavy, a také v souvislosti s operačními zákroky. Staphylococcus aureus je dále nalézán častěji jako etiologické agens nozokomiální pneumonie u nemocných s diabetes mellitus, u selhání ledvin, u kómatu a obdobných neurologických problémů, u cystické fibrózy, u chřipky a u narkomanů aplikujících si drogu nitrožilně. Stejně tak se spolu s Haemophilus influenzae častěji vyskytuje u původně zdravých osob. Nozokomiální pneumonie vyvolané Haemophilus influenzae lze dále poměrně často očekávat u pacientů s chronickou obstrukční plicní nemocí. U pneumonií nemocných s cystickou fibrózou bývá typickým původcem Pseudomonas aeruginosa. Po zjevné aspiraci žaludečního obsahu a po operacích v oblasti hrudníku a břicha hrozí pneumonie vyvolané anaerobními mikroby [3,7–10].
Výrazný vliv na etiologii nozokomiálního zánětu má případná předchozí antimikrobiální terapie. Dobře je to vidět na etiologii ventilátorové pneumonie časného typu. Zatímco časná VAP u pacientů, kteří předtím nedostávali antibiotika, bývá vyvolána Haemophilus influenzae a Streptococcus pneumoniae, případně citlivými kmeny Staphylococcus aureus a enterobakterií, v etiologii časné VAP u nemocných, kteří v předchozích 15 dnech prodělávali léčbu antibiotiky, převládají nad zmíněnými mikroby rezistentnější kmeny enterobakterií a objevují se nefermentující gramnegativní tyčinky. Stejný obraz poskytuje etiologie pozdní VAP u pacientů předtím neléčených antibiotiky. Pneumonie pozdního typu u nemocných ovlivněných nedávnou antibiotickou léčbou bývají většinou vyvolány multirezistentními kmeny. Patří k nim Pseudomonas aeruginosa, Acinetobacter baumannii, Stenotrophomonas maltophilia a Staphylococcus aureus meticilin rezistentní. Multirezistentní kmeny se vyskytují významně častěji, pokud umělá plicní ventilace trvá po 7 a více dní a pokud byly podávány širokospektré antimikrobiální látky typu cefalosporinů III. generace, fluorochinolonů anebo karbapenemů [2,3,7].
Patogeneze, patofyziologie a rizikové faktory HAP
Porucha jednoho nebo více obranných mechanizmů respiračního traktu, ať už následkem vlastního onemocnění nebo léčebným zákrokem, usnadňuje vznik nozokomiální pneumonie.
Podmínkou rozvoje nozokomiální pneumonie je proniknutí patogenu do dolních cest dýchacích [11].
Mikroorganizmy se mohou dostat do plic aspirací z orofaryngu, inhalací kontaminovaného aerosolu, hematogenní cestou, přímým přestupem nebo penetrací z vnějšku.
Aspirace je hlavním mechanizmem průniku bakterií do dolních cest dýchacích. Během spánku dochází k aspiraci obsahu dutiny ústní a orofaryngu do dolních cest dýchacích u 45 % zdravých jedinců, u 70 % nemocných s útlumem vědomí (pooperační stavy) a téměř u 90 % ventilovaných nemocných. Vysoká incidence gramnegativních bakterií jako původců HAP souvisí se změnou kolonizace orofaryngu. Mikroflóra orofaryngu zdravých osob obvykle zahrnuje nepatogenní grampozitivní a gramnegativní koky a anaerobní mikroorganizmy. Ke kolonizaci orofaryngu fakultativně anaerobními a aerobními gramnegativními tyčinkami dochází často již po 48 hod po přijetí do intenzivní péče. Rizikovými faktory pro kolonizaci orofaryngu gramnegativními bakteriemi jsou porucha vědomí, malnutrice, uremie, abúzus alkoholu, diabetes mellitus, tracheální intubace, nazogastrická sonda, alkalické pH žaludečního obsahu a antibiotická léčba [11].
Přítomnost tracheální kanyly snižuje odolnost respiračního traktu vůči infekci, poškozuje výstelku průdušnice a vyvolává její zánět a zvyšuje pravděpodobnost aspirace nozokomiálních patogenů z orofaryngu. Kanylu krátce po zavedení pokrývá vrstva tzv. biofilmu, což jsou mikrobiální společenství obklopená mezibuněčnou hmotou. I když tento biofilm lne dosti pevně k povrchům, na nichž se vytvořil, mechanickými zásahy, jako je např. odsávání sekretu z kanyly, se mohou částice biofilmu odloupnout a být aspirovány, a tak se stanou vyvolávajícím faktorem plicní infekce. Další možností, jak může dojít k infekci plic, je aspirace sekretu hromadícího se nad nafukovací manžetou kanyly [11,12].
Inhalace kontaminovaného aerosolu je druhým nejčastějším způsobem průniku bakterií do dolních cest dýchacích. Za normálních podmínek, při zachování všech obranných mechanizmů horních cest dýchacích a dobré funkci mukociliárního transportního systému se uplatní jen zřídka. U spontánně ventilujícího nemocného je možná inhalace infekčního agens při kontaminovaných pomůckách nebo přístrojích užívaných pro dechovou rehabilitaci nebo pro anestezii. Jak ultrasonografické, tak tryskové nebulizátory mohou generovat kontaminované částice aerosolu, které se dostávají ve vysoké koncentraci hluboko do dýchacích cest nemocného. U intubovaného a ventilovaného nemocného je riziko inhalačního vstupu infekčních patogenů do dýchacích cest významně vyšší [5,11].
V ojedinělých případech může být NP způsobena hematogenním přenosem infekčního agens z jiného místa např. při purulentní flebitidě, infekci chirurgické rány, pravostranné bakteriální endokarditidě, při katétrové sepsi apod [11].
Jako možný mechanizmus vzniku HAP při závažném postižení a selhání gastrointestinálního traktu (GIT) bývá zmiňována translokace živých bakterií přes sliznici GIT do mezenteriálních lymfatických uzlin, do krve a do plic. To se předpokládá u nemocných s porušením bariérové funkce střevní stěny při závažné hypoperfuzi (a následné reperfuzi) splanchnické oblasti, u nemocných s imunosupresí, zhoubnými nádory nebo popáleninami [11].
Přímý přestup nebo penetrace infekčního agens z vnějšku jsou vzácné a bývají spojeny s pronikajícím poraněním hrudníku nebo s invazivním nitrohrudním výkonem (hrudní drenáž, hrudní punkce, torakotomie, torakoskopie apod). Přestup infekčního agens do hrudníku je možný rovněž z břišní dutiny [11].
Mezi rizikové faktory nozokomiální pneumonie patří extrémní věk, velmi vážné základní onemocnění (popáleniny, trauma, onemocnění CNS, respirační a kardiovaskulární onemocnění, imunosuprese), faktory podporující kolonizaci orofaryngu nebo žaludku (předchozí antimikrobiální léčba, přijetí na JIP, chronické plicní onemocnění, porucha vědomí, užití svalových relaxancií během umělé plicní ventilace, léčba antacidy a H2 blokátory), faktory podporující aspiraci nebo gastroezofageální reflux (tracheální intubace, nazogastrická sonda, poloha vleže, transport ventilovaného nemocného), stavy vyžadující dlouhodobou invazivní ventilaci (riziko přenosu infekce kontaminovanou ventilační technikou, prostředky užívanými k péči o dýchací cesty nebo rukama personálu), faktory, které brání řádné toaletě dýchacích cest (operační výkony na krku, hlavě, hrudníku, v epigastriu, imobilizace následkem těžkého onemocnění nebo traumatu) [1,4].
Diagnostika nozokomiální pneumonie
Diagnostika pneumonie se opírá o anamnézu, fyzikální a RTG nález, o výsledky mikrobiologického vyšetření vzorků z respiračního traktu, hemokultury, vyšetření pleurálního výpotku, sérologického vyšetření, potřebné je i vyšetření moči (např. průkaz antigenu Legionella pneumophila typ I), hematologické a biochemické vyšetření [1,2,13].
Důležité anamnestické údaje v diagnostice HAP
- příznaky akutního infekčního onemocnění: rýma, kašel, třesavka, zvýšená teplota, pleurální bolest, bolesti svalů
- věk: u starších nemocných často chybí „klasická symptomatologie“
- potíže: zjišťujeme, zda vznikly akutně, subakutně nebo zda jsou chronického rázu, pátráme po příznacích zánětu horních dýchacích cest, případně po stomatologických problémech, pleurální bolesti, hnisavém sputu a dušnosti
- důležité údaje z osobní anamnézy: kouření, abúzus alkoholu, drog; etiologickými agens bývají anaeroby a gramnegativní bakterie; při údaji o HIV pozitivitě pomýšlíme na oportunní infekce, podstatné jsou údaje o prostředí, ve kterém nemocný žije, alergie, koníčky a sociální faktory
- epidemiologické údaje: pokud nemocný žije v ústavu sociální péče, budeme jako původce pneumonie zvažovat bakterie Streptococcus pneumoniae, Staphylococcus aureus a gramnegativní bakterie, ptáme se, zda nemocný nebyl v posledních dnech hospitalizován pro jiné onemocnění, pátráme po výskytu chřipky v místě bydliště
- údaje o souběžných onemocněních: především kardiopulmonální onemocnění; rizikoví jsou především nemocní s CHOPN, u kterých jsou častými původci pneumonie Streptococcus pneumoniae, Haemophilus, Moraxella a Legionella, důležité jsou informace o dalších plicních onemocněních vrozených nebo získaných
- další faktory související se vznikem pneumonie: špatná dentální hygiena, dysfagie, nedávno provedené ošetření v dutině ústní, zákrok v celkové anestezii, těhotenství jsou faktory, u nichž je častější aspirační pneumonie
- údaje o užívání léků: zjišťujeme alergie, zajímáme se o intravenózní léčbu, o léky, které mohou vyvolat plicní postižení, o užívání imunosupresiv (riziko oportunní infekce) [1,2,14]
Objektivní vyšetření v diagnostice HAP
Při objektivním vyšetření věnujeme pozornost těmto fyzikálním nálezům:
- vitální funkce: závažné jsou dechová frekvence vyšší než 30 dechů/min, tachykardie nebo bradykardie, hypotenze, vysoká tělesná teplota nebo hypotermie
- rozsah plicního a pleurálního postižení: poslechově bývají na hrudníku přízvučné chrůpky, trubicové dýchání, pokud je přítomen pleurální výpotek, bývá dýchání nad touto oblastí oslabené až vymizelé, slyšitelné mohou být i pískoty a vrzoty nebo pleurální třecí šelest
- cyanóza: pokud je přítomna, signalizuje závažný stav
- alterace vědomí
- oligurie
- mimoplicní projevy: jedním z častých mimoplicních projevů je herpes labialis, dále věnujeme pozornost afekcím v horních dýchacích cestách, jako je absces, gingivitida, kariézní chrup, pátráme po hnisavých ložiscích na různých místech organizmu (meningitida, mozkový absces, artritida, perikarditida, endokarditida, peritonitida, empyém) [1,2,14]
U nemocných s pneumonií nesmíme opomenout rozvoj příznaků rozvoje sepse a septického šoku. Sepse je systémová zánětlivá odpověď na infekci. Úmrtnost v souvislosti se sepsí je udávána mezi 20–30 %, u těžké sepse mezi 40–50 % a u septického šoku mezi 50–60 %. Počet sepsí přibývá [15].
Příznaky sepse jsou horečka nebo hypotermie, třesavka, pocení, tachypnoe, tachykardie, hyperdynamický oběh (teplá a růžová periferie, rychlé kapilární plnění a pružný skákavý puls), nauzea a zvracení, leukocytóza, někdy až leukemoidní reakce, méně často leukopenie, hyperglykemie, v nejtěžších případech hypoglykemie [15].
Jako těžká sepse je označován stav, v němž jsou známky sepse kombinovány s hypotenzí nebo příznaky hypoperfuze a orgánové dysfunkce – hypoxemie, oligurie (< 0,5 ml/kg/hod), laktátové acidózy (laktát v séru > 2 mmol/l), alterace mentálního stavu. U závažných případů sepse se často vyskytuje jaterní dysfunkce s ikterem a koagulopatie s trombocytopenií až diseminovanou intravaskulární koagulací (DIC), které se projevují krvácivými projevy. Klinické známky sepse mohou, ale také nemusí, být spojeny s bakteriemií. V některých případech doprovázejí klinické známky sepse infekce houbami, viry, parazity [15].
Syndrom systémové zánětlivé odpovědi (SIRS – systemic inflammatory response syndrome) vzniká jako odpověď organizmu na různé závažné podněty (sepse, pankreatitida, závažná popálenina, těžké trauma a další).
Projevuje se 2 nebo více následujícími příznaky:
- teplota > 38 °C nebo < 36 °C
- tachykardie > 90/min
- dechová frekvence > 20/min nebo PaCO2 < 4,3 kPa
- leukocyty > 12 × 109/l nebo < 4 × 109/l nebo > 10 % nezralých forem leukocytů
Sepse je SIRS vyvolaná infekcí [15].
Základní laboratorní nálezy u HAP a jejich interpretace
Zvýšení sedimentace, pokud by se vyšetřovala, se vyskytuje prakticky u všech nemocných.
Koncentrace leukocytů může být normální nebo zvýšená s posunem doleva. U neutropenických nemocných se naopak setkáváme s nápadným snížením. Na bakteriální infekci pomýšlíme při leukocytóze ≥ 15 × 109/l. Na těžkou infekci upozorňuje počet leukocytů > 30 × 109/l nebo < 4 × 109/l. Pozornost věnujeme nemocným s poklesem neutrofilů < 1 × 109/l, s poklesem lymfocytů < 1 × 109/l a s poklesem CD4+ lymfocytů < 1 × 109/l [1,2,13].
Důležité je i vyšetření koagulace (INR, TT, APTT a fibrinogen). Pokles trombocytů < 80 × 109/l je jednou z indikací hospitalizace na lůžku intenzivní medicíny. U závažných pneumonií, zvláště u těch, které probíhají dlouho, bývá přítomna trombocytemie.
Zvýšené hodnoty jaterních enzymů bývají častým nálezem u rozsáhlých pneumonií s těžkým průběhem i u jedinců bez předchozího postižení jater.
Pokud pneumonie vede k dehydrataci, setkáváme se se zvýšením hodnot urey a u velmi těžkých stavů může dojít k rozvratu vnitřního prostředí. Zvýšenou pozornost je zapotřebí věnovat nemocným se vzestupem urey > 11 mmol/l, vzestup > 20,0 mmol/l je jednou z indikací k přijetí na lůžko intenzivní medicíny, nemocným se vzestupem sodíku > 150 mmol/l a poklesem < 130 mmol/l, se vzestupem glykemie > 14 mmol/l.
Pro určení závažnosti pneumonie a při sledování vývoje onemocnění je důležitá hodnota C–reaktivního proteinu (CRP), která u nemocných s pneumonií, indikovaných k hospitalizaci na lůžku intenzivní medicíny, bývá obvykle mnohonásobně zvýšena. Sledování hodnoty CRP má velký význam pro hodnocení odpovědi na léčbu, protože k jeho poklesu, ale i vzestupu dochází pouze s krátkou latencí. Pro hodnocení závažnosti stavu se v prostředí intenzivní medicíny doporučuje sledovat hodnoty prokalcitoninu, jehož zvýšení předchází vzestupu CRP [1,2,13,16].
Velmi důležité je u nemocných s pneumoniemi vyšetření krevních plynů a acidobazické rovnováhy, protože se jedná o jedno z vyšetření, na jehož základě rozhodujeme o hospitalizaci a o dalších terapeutických postupech. Ke kontinuální oxygenoterapii jsou indikováni nemocní s poklesem parciálního tlaku kyslíku < 8 kPa a k úpravě vnitřního prostředí nemocní s pH < 7,35 [1,2,13].
Zobrazovací metody v diagnostice HAP
Pomocí zobrazovacích metod jsme schopni odhalit změny v souvislosti s plicní infekcí, lokalizovat tyto změny, stanovit jejich rozsah, odhalit komplikace, sledovat odpověď na léčbu.
Skiagrafie hrudníku (RTG snímek plic v zadopřední a bočné projekci) je primární metodou volby u pacientů s podezřením na plicní zánět a následné komplikace. Mezi metody, které se významně uplatňují v diagnostice hrudních onemocnění, a tedy i plicních zánětů, patří především výpočetní tomografie (CT – computed tomography), v menší míře ultrasonografické vyšetření (USG) a zobrazení magnetickou rezonancí (MRI – magnetic resonance imaging) [8,17,18].
Základním radiologickým znakem pneumonie je snížení vzdušnosti, a tedy transparence plicní tkáně charakteru až plicní konzolidace. Ta se může rozpadat a vytvářet obraz kavitace (tvorby dutin) a může být doprovázena výpotkem. Radiologické změny mohou být od malých zastínění po velká zastínění jednoho či vícečetných stínů až po zastínění typu vzdušného bronchogramu. Změny mohou být v jednom nebo více lalocích. Tyto změny ve skiagrafickém obraze závisí jak na infekčním agens, tak na stavu obranyschopnosti nemocného [17,18].
U pacientů s podezřením na zánět plic je nejčastěji indikovaným vyšetřením zadopřední skiagram hrudníku (přehledný snímek plic). CT/HRCT je dnes indikováno nejen jako vyšetření doplňující skiagrafii při nejasnostech týkajících se např. kavitací či opouzdřených kolekcí tekutin, ale i jako metoda, s jejíž pomocí je možno daleko přesněji interpretovat výše popsané změny. Skiagrafie hrudníku může být dokonce i falešně negativní, nebo mohou být patologické změny vyjádřeny jen velmi nezřetelně. To platí obdobně i pro CT. Diferenciální diagnostika jednotlivých onemocnění pak může být velmi obtížná až nemožná. Je chybou spoléhat se při diagnostice pneumonie pouze na RTG obrazy [17,18].
Ultrasonografické vyšetření (USG) je dostupné, levné a neohrožující pacienta radiační zátěží. Pomocí USG lze diagnostikovat poměrně snadno tekutinu v pohrudniční dutině, která doprovází často bronchopneumonii. Výhodou USG je i snadná opakovatelnost bez radiační zátěže [18].
Výpočetní tomografie s vysokou rozlišovací schopností (HRCT – high resolution computed tomography) – představuje zdokonalení v současnosti standardní výpočetní tomografie (CT) a je další velmi důležitou modalitou v diagnostickém algoritmu. Existují však stavy, u nichž je její použití velmi omezené: nespolupracující pacienti (nemocnění s obleněným vědomím, pacienti na řízené ventilaci), dostupnost CT (pacienti k takovémuto vyšetření musí být převáženi), pohybové artefakty, často nemožnost vyšetřit nemocné v poloze na břiše [17,18].
MRI je další metoda řadící se mezi moderní zobrazovací postupy. Její největší výhodou je možnost zobrazení v jakékoliv rovině a vysoká rozlišovací schopnost měkkotkáňových struktur. Její využití v diagnostice zánětů plic je však velmi omezené.
Diagnostický algoritmus zobrazovacích metod u pacientů s klinickými známkami pneumonie je jednoduchý. Zlatým standardem zůstává skiagrafie hrudníku doplněná v indikovaných případech CT/HRCT, méně časté je využití USG (pleurální výpotky) a zcela na okraji v současné době stojí MRI [18].
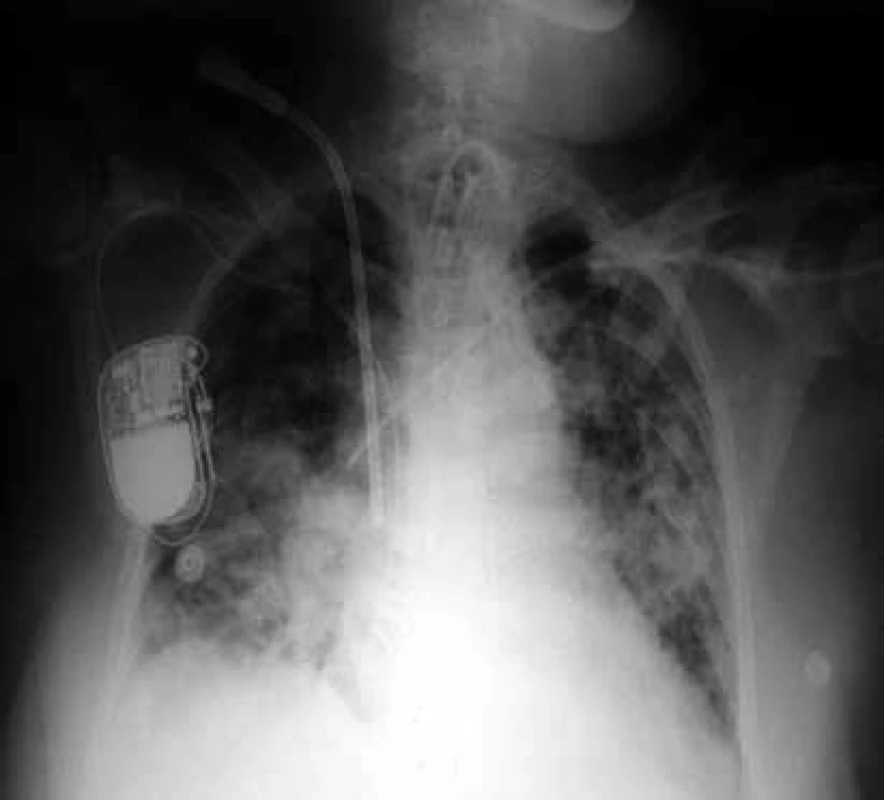
Při interpretaci musíme pečlivě rozlišovat, zda bylo vyšetření provedeno vleže na lůžku nebo vestoje na RTG pracovišti. Na skiagramu hrudníku vleže jsou srdce a mediastinum zobrazeny přibližně o 15 % širší, než by tomu bylo na snímku vestoje. Pozornosti může na snímku vleže uniknout pleurální výpotek, hůře se zobrazují cévní struktury, patologické nálezy v kostofrenických úhlech. Obtížné hodnocení snímků vleže dokumentuje obr. 1.
Nález na zadopředním skiagramu hrudníku podá také důležité informace o umístění katétrů, drénů, kanyl a rourek – o pozici tracheální rourky i o případném nadměrném naplnění její manžety, o umístění centrální žilního katétru, plicnicového katétru či hrudního drénu [18].
Mikrobiologické vyšetření v diagnostice HAP
Účelem mikrobiologického vyšetření je zjistit, který mikrob je příčinou sledovaného onemocnění, tedy prokázat etiologické agens vyšetřované infekce. Etiologické agens lze prokazovat v infikovaném organizmu jednak přímo, jednak nepřímo [19].
Přímý průkaz infekce spočívá v nálezu mikrobu nebo jeho složek ve vyšetřovaném vzorku. Nepřímý průkaz (mnohdy zvaný sérologický) je založen na průkazu protilátek.
V mnoha případech nález mikrobu či protilátek proti němu k etiologické diagnostice právě probíhající infekce sám o sobě nestačí. Je třeba vzít v úvahu řadu faktorů týkajících se jak pacienta a jeho onemocnění, tak mikrobu a jeho vlastností, aby se výsledek mikrobiologického vyšetření dal správně interpretovat. K tomu je bezpodmínečně nutná úzká spolupráce mezi ošetřujícím lékařem a mikrobiologem [19].
K metodám přímého průkazu patří zejména klasické postupy mikroskopie a kultivace. Nedílnou součástí kultivace je bližší určení neboli identifikace vypěstovaného mikrobu a stanovení jeho citlivosti na antibiotika. Postupně se uplatňují i další metody, zejména nové rychlé nekultivační postupy, jako jsou průkaz antigenů, průkaz nukleových kyselin a průkaz jiných typických chemických složek mikrobu přímo ve vyšetřovaném vzorku [19].
Až na základě nelepšícího se klinického stavu a nedostatečné reakce na empirickou léčbu nebo léčbu na základě výsledků dosud provedených vyšetření (sputa, hemokultur, moči) indikujeme invazivní vyšetření (fibrobronchoskopii s bronchoalveolární laváží, transbronchiální plicní biopsii, transparietální plicní biopsii, případně otevřenou plicní biopsii) [19].
Nejčastěji používaným vyšetřením k určení etiologického agens pneumonie je vyšetření sputa. Problémem je kvalita jeho odběru, rychlost transportu do laboratoře a kvalita vyšetření [19,20].
Význam má nejen kultivační, ale i mikroskopické vyšetření sputa. Nález grampozitivních protáhlých diplokoků při mikroskopickém vyšetření může svědčit pro infekci Streptococcus pneumoniae. Důležitý je i nález leukocytů ve sputu při mikroskopickém vyšetření, neboť ukazuje, že se nejedná o pouhé sliny [19,20].
Kultivační vyšetření sputa slouží nejen ke stanovení etiologického agens, ale i ke stanovení citlivosti izolovaného agens k antimikrobiální léčbě. Je potřebné určovat i koncentraci bakterií. Za signifikantní je považována koncentrace ≥ 105 CFU v 1 ml sputa (1 CFU – colony forming unit čili kolonii tvořící jednotka – odpovídá přibližně jedné živé mikrobiální buňce). Podle současných studií se však nepodaří ve sputu prokázat etiologické agens u 50 % nemocných s pneumonií a v rutinní praxi je uváděno dokonce jen 25 % pneumonií, u kterých se podařilo prokázat etiologii. Problém spočívá v rychlosti transportu sputa po jeho odebrání do laboratoře. Pokud není sputum zpracováno do 4 hod po odběru, ztrácí jeho vyšetření význam. Dalším problémem je to, že některá agens jsou nezachytitelná při běžné kultivaci a vyžadují kultivaci na zvláštních půdách (Legionella pneumophila), nebo izolaci na tkáňových kulturách (cytomegalovirus) [19,20].
Musíme si být vědomi toho, že vyšetření sputa má jen omezenou hodnotu, protože mnoho nemocných není schopno vykašlat a mikrobiologický nález ve sputu nemusí vypovídat o situaci v dolních dýchacích cestách a v plicním parenchymu. Velkou diagnostickou cenu má nález mikroorganizmů, které se za žádných okolností nevyskytují jako organizmy kolonizující dutinu ústní – např. Legionella, Mycobacterium tuberculosis a Pneumocystis jiroveci. Naproti tomu nález běžných bakteriálních patogenů a kvasinek je pro etiologickou diagnostiku plicního postižení mnohem méně významný, neboť tyto mikroorganizmy mohou běžně sídlit v dutině ústní i velkých dýchacích cestách. Podezření by mohl vyvolat nález aspergilů [19,20].
Materiál z dolních dýchacích cest lze bez bronchoskopické kontroly získat rovněž endotracheálním odsátím (velmi často používaná odběrová metoda u intubovaných nebo tracheostomovaných pacientů), případně transtracheální punkcí u neintubovaných nemocných. Při transtracheální punkci je katétr zasunut sterilně naslepo do bronchů po punkci průdušnice v místě krikotyreoidní membrány. Výhodou vyšetření je možnost získání sekretu z dýchacích cest, který nebyl kontaminován orofaryngeální flórou [20].
U nemocných s teplotou a třesavkou je nezbytné odebrat 2krát před zahájením antibiotické léčby krev na hemokulturu a pak opakovaně v průběhu antibiotické léčby, pokud tato léčba selhává. U pneumokokové pneumonie je udávána poměrně vysoká pozitivita hemokultur, přesto nedosahuje 20 %. Centrální ani periferní žilní katétry či kanyly nemají být k odběru hemokultur používány. Odběr je vždy je nutné provést jednorázovou punkcí periferní žíly [19,20].
V diagnostice pneumonií lze využít i vyšetření pleurálního výpotku (cytologického, biochemického, kultivačního na nespecifickou bakteriální flóru i na mykobakterie). Ve výpotku můžeme detekovat i antigeny Streptococcus pneumoniae [20].
V moči lze prokazovat antigeny Streptococcus pneumoniae a Legionella pneumophila [19,20].
V současné době se často používají bronchoskopické techniky odběru, které omezují možnost kontaminace bakteriální flórou přítomnou v horních partiích dýchacích cest. Jedná se o vyšetření, která mají za určitých podmínek vysokou senzitivitu i specificitu. Jelikož se jedná o invazivní techniku spojenou s možností iatrogenního poškození pacienta, je nutno vždy vážit přínos a rizika [20,21].
Mikrobiologické vyšetření bronchoskopicky odebraného materiálu je zaměřeno na určení bakterií (včetně mykoplazmat, legionel a mykobakterií), virů, houbových mikroorganizmů (včetně Pneumocystis jiroveci) a parazitů [19,20].
Při podezření na infekční postižení průduškového stromu se provádějí odběry biologického materiálu především flexibilním bronchoskopem. K mikrobiologickému vyšetření můžeme odeslat materiál získaný bronchiálním výplachem, bronchoalveolární laváží (BAL), chráněnou bronchoalveolární laváží (protected BAL – PBAL) nebo mini-BAL (bronchoalveolární laváží, která je provedena menším množstvím fyziologického roztoku než klasická bronchoalveolární laváž), odběrem prostřednictvím chráněného kartáčku nebo aspirací chráněným katétrem, případně dalšími metodami [20–22].
Léčba HAP
Základem je léčba antibiotická, kterou je nutno zahájit co nejdříve při naléhavém podezření na pneumonii na základě klinického a RTG vyšetření. Rozhodně není nutno vyčkávat na výsledky kultivačního vyšetření a vyšetření citlivosti, tato vyšetření mají význam pro případnou pozdější úpravu léčby. Při volbě antibiotika musíme brát v úvahu způsob podávání, toleranci a možnou alergii na antibiotika, závažnost onemocnění, věk nemocného, přidružená onemocnění, epidemiologickou situaci a údaje o rezistenci k antibiotikům v dané oblasti [23].
Zásady léčby nozokomiální pneumonie (HAP)
Antibiotická léčba je v komplexní léčbě HAP klíčová. Velkým problémem je rezistence etiologických agens na antibiotika. Pro vznik rezistence má zásadní význam předchozí expozice antibiotikům (definovaná jako podávání antibiotik po dobu alespoň 24 hod v průběhu 14 dnů před vznikem pneumonie). Předchozí expozice antibiotikům je považována za významný rizikový faktor, a dokonce za nezávislý prediktor mortality [23].
Pro používání antibiotik v případě HAP platí jednoduché zásady. Antibiotiky mají být léčeni pouze pacienti s klinicky manifestní HAP při použití dostatečně vysokých dávek bez zbytečného prodlužování délky podávání. Při volbě antibiotika v případě HAP musíme v konkrétním případě vycházet z individuální situace daného nemocného při pečlivém zohlednění základních kritérií pro volbu úvodní antibiotické léčby. Nezbytná je podrobná a aktuální znalost místní epidemiologické situace [13,23].
Včasně zahájená léčba správně zvolenými antibiotiky vede s vysokou pravděpodobností k vyléčení a rozhoduje o příznivé prognóze nemocného s HAP. Správná indikace antibiotické léčby však předpokládá přesné stanovení klinické diagnózy HAP a kvalifikovaný odhad etiologie infekce a časný přechod na cílenou léčbu na základě průkazu původce a zjištění jeho citlivosti k antibiotikům [23].
Současný přístup k antibiotické léčbě NP se snaží co nejvíce omezovat polypragmatickou empirickou terapii a nahrazuje ji neodkladnou terapií úvodní, která vychází z kvalifikovaného zhodnocení některých epidemiologických, klinických a diagnostických kritérií. Léčba úvodní by měla být zahájena po odběrech biologického materiálu na mikrobiologické vyšetření, pokud to je možné. Na základě kvalifikovaně interpretovaných výsledků má být úvodní léčba s širším antimikrobiálním spektrem změněna na léčbu cílenou, pokud se podaří prokázat původce. Tato strategie nezbytně vyžaduje úzkou spolupráci mezi klinickým lékařem a zkušeným klinickým mikrobiologem. Výše popsaný přístup je vysoce efektivní a omezuje riziko vzestupu antibiotické rezistence [13,23].
Léčba HAP vyžaduje vždy dávkování antibiotik na horní hranici možného rozmezí, což v praxi znamená dávky několikrát vyšší, než se doporučuje pro léčbu běžných, nekomplikovaných infekcí. Doporučená délka podávání antibiotik je vždy pouze orientační a v konkrétních případech se řídí individuálním vývojem klinického stavu nemocného. V současnosti se preferuje razantní léčba vyššími dávkami antibiotik po kratší dobu. Nekomplikovanou časnou formu NP je možno léčit ve shodě s běžnými doporučeními obvykle asi 10 dnů. Mimo jiné také proto, že jsou vyvolány převážně mikroorganizmy dobře citlivými k lékům volby s ověřenou klinickou účinností. Konkrétní délka léčby závisí pochopitelně na závažnosti a průběhu onemocnění, včetně výskytu komplikací [13,23].
V případě pozdní formy HAP bývá situace mnohem složitější. U nemocných vyžadujících dlouhodobou umělou ventilaci s různorodě poškozenými plícemi, u nichž zánět způsobují mikroorganizmy nepříznivých vlastností (Pseudomonas aeruginosa, Acinetobacter baumannii, MRSA), bývá klinický efekt léčby problematický. U těchto forem pneumonie je obvykle nutná délka léčby kolem 14 dnů. Není však výjimečné, že závažně probíhající infekce musí být léčena i několik týdnů a její prognóza je přesto nejistá.
Hlavními kritérii, která je třeba zhodnotit pro volbu optimální strategie úvodní antibiotické léčby NP, jsou zejména předchozí hospitalizace (délka, typ péče), délka umělé plicní ventilace (časný vs pozdní typ pneumonie), předchozí expozice antibiotikům, věk nemocného a souběžná onemocnění, epidemiologická situace pracoviště intenzivní medicíny (výsledky lokální mikrobiologické surveillance), stav mikrobiální kolonizace dýchacích cest (výsledky mikrobiologického monitorování), dílčí výsledky mikrobiologických vyšetření (mikroskopie) [13,23,24].
Předchozí hospitalizace ovlivňuje nepřímo etiologii nozokomiální pneumonie. Nemocný je v průběhu pobytu v nemocnici vystaven některým vlivům, které přispívají ke změnám mikrobiálního osídlení sliznic dýchacího ústrojí. Kolonizující mikroorganizmy jsou hlavním rezervoárem potenciálních patogenů vyvolávajících HAP. Riziko kolonizace multirezistentními nemocničními kmeny je závislé na délce dosavadního pobytu v nemocnici a na typu poskytované péče. Pobyt na standardním oddělení konzervativního typu (interna, kardiologie atp) je z hlediska kolonizace nemocničními kmeny nejméně rizikový, zatímco hospitalizace na odděleních chirurgických může být problematičtější (riziko kolonizace MRSA apod). Nejvyšší riziko osídlení nemocničními kmeny je u pacienta, který byl před přijetím hospitalizován na jiné jednotce intenzivní péče. Pokud vznikne pneumonie u pacienta s delší předchozí hospitalizací, je třeba počítat s odlišnou etiologií infekce ve srovnání s nemocným hospitalizovaným krátkou dobu. Nejsou-li k dispozici žádné zpřesňující epidemiologické údaje, pro úvodní léčbu je třeba použít antibiotika s širším spektrem, která budou s vysokou pravděpodobností účinná proti nemocničním kmenům s abnormální citlivostí [13,23,24].
Délka umělé plicní ventilace je významným rizikovým faktorem vzniku pneumonie, ale současně je také důležitým kritériem pro správnou volbu antibiotik pro úvodní léčbu NP. Je to dáno odlišnou skladbou patogenů charakteristických pro časný a pozdní typ ventilátorové pneumonie [23,24].
Předchozí expozice antibiotikům ovlivňuje etiologii plicní infekce zásadním způsobem. Např. výskyt MRSA jako původce pneumonie může být u nemocných s předchozí expozicí antibiotikům několikanásobně častější, zejména při umělé plicní ventilaci delší než 1 týden. U nemocného s klinickými příznaky pneumonie, kterému byla podávána v průběhu předchozích 2 týdnů antibiotika, musíme předpokládat etiologickou účast pseudomonád, acinetobakterů a jiných gramnegativních tyčinek, které mohou být multirezistentní. Pacienty, kteří antibiotika nedostávali, je možné při správném zohlednění dalších faktorů úspěšně léčit základními antibiotiky [23].
Mikrobiologické monitorování dolních cest dýchacích může být při dodržení interpretačních kritérií přínosné pro zpřesnění indikace úvodní antibiotické léčby. V případě klinického podezření na HAP je však vždy nezbytné odebrat a mikrobiologicky vyšetřit aktuální, klinicky relevantní vzorek, který může poskytnout skutečný důkaz o etiologii infekce. V případě závažného klinického stavu je vhodná předchozí domluva s mikrobiologem [23,24].
Dle doporučení IDSA/ATS se zahajuje léčba HAP antipseudomonádovými beta-laktamovými antibiotiky (ceftazidim, imipenem, meropenem, piperalilin-tazobaktam) společně s fluorochinolony (ciprofloxacin nebo levofloxacin nebo aminoglykosid). Pokud existuje podezření na souvislost s aspirací, je doporučována monoterapie (imipenem, meropenem, piperalilin-tazobaktam, cefoperazon/sulbactam) [7,13,25,26].
Cílená antibiotická léčba NP, pokud je mikrobiologickým vyšetřením prokázán jeho původce, má určité zákonitosti a strategii [13,24,26].
Léčba houbových NP spočívá v podávání antimykotik, která jsou rozdělena podle léčebného dosahu na lokální a systémová [13,24,26].
Podpůrná léčba u pneumonie
Podávání antimikrobiálních léků musí být vždy doplněno odpovídající léčbou podpůrnou, která zahrnuje podávání mukolytik, antitusik, analgetik (při pleurálním dráždění), antipyretik a bronchodilatancií. Dále je nutná dostatečná hydratace a výživa nemocných. Nutné je také dohlížet na dostatečnou oxygenaci a udržení stability vnitřního prostředí. Mukolytika podáváme obvykle formou nebulizace 3–4krát denně. Nejčastěji používané k nebulizaci jsou ambroxol, bromhexin, mesna. Velmi důležitou součástí podpůrné léčby u pneumonií na lůžku intenzivní medicíny je léčba bronchodilatační. Formou nebulizace můžeme podávat bronchodilatancia ze skupiny β-adrenergik. Jsou to fenoterol (Berotec), salbutamol (Salbutamol, Ventolin). S výhodou lze použít i léky ze skupiny anticholinergik, a to ipratropium bromidu (Atrovent). Preparát, který obsahuje jak β-adrenergikum, tak anticholinergicum ipratrouim bromid, je Berodual. Optimální je podávání nebulizací 4–6krát denně. Další léky s bronchodilatačními účinky jsou metylxantiny (aminofylin a teofylin), které působí bronchodilatačně a stimulují dechové centrum v prodloužené míše. K nitrožilní aplikaci se nejčastěji používá aminofylin (Aminophyllin, Syntophyllin). Pokud je u nemocného s pneumonií přítomen spastický poslechový nález a respirační insuficience, je po vyhodnocení anamnézy a rizikových faktorů nutné podání systémových kortikosteroidů [13,25].
Nedílnou součástí podpůrné léčby je i výživa, dechová rehabilitace a fyzioterapie. Úkolem dechové rehabilitace a fyzioterapie u ventilovaného nemocného je péče o mobilizaci a odstranění sekretu z dýchacích cest, prevence vzniku a odstranění atelektáz, zlepšení efektivity ventilace a zvýšení výkonnosti dýchacího svalstva. Důležité je i odsávání z dýchacích cest, které by mělo být provedeno, kdykoliv jsou zřejmé známky jeho nahromadění v dýchacích cestách [13,25].
Komplikace HAP
U nemocných, jejichž stav se nezlepšuje (patologický nález patrný na zadopředním skiagramu hrudníku přetrvává, přetrvávají nebo se znovu objevily teploty a potíže), musíme po vyloučení nádorového onemocnění pátrat především po komplikaci pneumonie, jako je pleurální výpotek, plicní absces, empyém, pneumotorax, pneumomediastinum nebo recidiva původně ustupující pneumonie, u rozsáhlých pneumonií může dojít i k rozvoji ARDS [1].
Prevence HAP
Předpokladem úspěšného předcházení nozokomiální pneumonii je nejen vytvoření preventivního programu, ale především aktivní účast zdravotnického personálu (lékařů i sester) daného oddělení na jeho vypracování a zavedení do praxe. Program prevence nozokomiální pneumonie by měl vycházet z efektivních, vědecky prokázaných preventivních metod a opatření, ale současně by měl respektovat i vlastní zkušenosti a místní podmínky. Přizpůsobení programu místním podmínkám je důležitým faktorem usnadňujícím jeho přijetí a dodržování. Základní preventivní opatření zahrnují výchovu personálu a epidemiologickou surveillance, přerušení přenosu mikrobů eradikací infekčních mikroorganizmů z jejich epidemiologicky významných rezervoárů a prevenci přenosu mezi jednotlivými osobami, ovlivnění infekčního rizika přímo u nemocného [27].
Problematice pneumonií u imunokompromitovaných nemocných bude věnován článek v čísle Vnitřního lékařství, které bude věnováno pneumologické problematice.
prof. MUDr. Jana Skřičková, CSc.
skrickova.jana@fnbrno.cz
Klinika nemocí plicních a TBC LF MU
a FN Brno,
pracoviště Bohunice
www.fnbrno.cz
Doručeno do redakce 3. 6. 2017
Přijato po recenzi 20. 6. 2017
Sources
1. Jarvis WR. Nosocomial pneumonia. Marcel Dekker: New York – Basel 2000. IBSN 978–0824799427.
2. Cunha AB. Hospital-Acquired Pneumonia (Nosocomial Pneumonia) and Ventilator-Associated Pneumonia. Emedicine. Medscape Reference. Drugs &Diseases. 2017. Dostupné z WWW: <http://emedicine.medscape.com/article/234753-overview>.
3. Votava M, Jindrák V. Epidemiologie a etiologie nozokomiální pneumonie. In: Ševčík P, Skřičková J, Šrámek V et al. Záněty plic v intenzivní medicíně. Galén: Praha 2004. ISBN 80–7262–278–1.
4. Chastre J, Fagon JY. Ventilator-associated pneumonia. Am J Respir Crit Care Med 2002; 165(7): 867–903.
5. Kollef MH, Morrow LE, Biederman MS et al. Clinical Characteristics and Treatment Patterns Among Patients With Ventilator-Associated Pneumonia. Chest 2006; 129(5): 1210–1218.
6. Carrabba M., Zarantolello M, Bonara P et al. Severity assessment of healthcare-associated pneumonia and pneumonia in immunosuppression. Eur Respir J 2012; 40(5): 1201–1210. Dostupné z DOI: <http://dx.doi.org/10.1183/09031936.00187811>.
7. Leroy O, Giradie P, Yaydapanah Y et al. Hospital-acquired pneumonia: microbiological data and potential adequacy of antimicrobial regimens. Eur Respir J 2002; 20(2): 432–439.
8. Porzecanski I, Bowton DL. Diagnosis and treatment of ventilator-associated pneumonia. Chest 2006; 130(2): 597–604.
9. Kollef MH, Morow LE, Niederman MS et al. Clinical Characteristics and Treatment Pattnerns Among Patients With Ventilator-Associated Pneumonia. Chest 2006; 129(5): 1210–1218. Erratum in Chest 2006; 130(1): 308.
10. Kornum JB, Norgaard M, Dethlefsen C et al. Obesity and risk of subsequent hospitalisation with pneumonia. Eur Respir J 2010; 36(6): 1330–1336. Dostupné z DOI: <http://dx.doi.org/10.1183/09031936.00184209>.
11. Chytra I, Ševčík P, Zvoníček V. Patogeneze, patofyziologie a rizikové faktory nozokomiální pneumonie. In: Ševčík P, Skřičková J, Šrámek V et al. Záněty plic v intenzivní medicíně. Galén: Praha 2004. ISBN 80–7262–278–1.
12. Nseir R, Di Pompeo C, Jozefowicz E et al. Relationship between tracheostomy and ventilator-associated pneumonia: a case control study. Eur Respir J 2007; 30(2): 314–320.
13. [American Thoracic Society; Infectious Disease Society of America]. Guidelines for the Management of Adults with Hospital-acquired, Ventilator-associated, and Healtcare associated Pneumonia. Am J Respir Crit Care Med 2005; 171(4): 388–416.
14. Skřičková J, Salajka F, Ševčík P. Anamnéza a fyzikální nález u zánětů plic. In: Ševčík P, Skřičková J, Šrámek V et al. Záněty plic v intenzivní medicíně. Galén: Praha 2004. ISBN 80–7262–278–1.
15. Dellinger RP, Levy MM, Carlet JM et al. Surviving Sepsis Campaign: International Guidelines or Management of Severe Sepsis and Septic Shock: 2008. Crit Care Med 2008; 36(1): 296–327. Erratum in Crit Care Med 2008; 36(4):1394–1396.
16. Hausfater P, Garric S, Ben Ayed S et al. Usefulness of procalcitonin as a marker of Systemic infection in emergency department patients: a prospective study. CID 2002; 34(7): 895–901.
17. Decramer M, Roussos C. Imaging in lung disease. Eur Respir J 2002; 19(Suppl 35): 1–2.
18. Nebeský T. Zobrazovací metody v diagnostice pneumonií. In: Ševčík P, Skřičková J, Šrámek V et al. Záněty plic v intenzivní medicíně. Galén: Praha 2004. ISBN 80–7262–278–1.
19. Votava M, Jindrák V. Mikrobiologická diagnostika pneumonií a její interpretace. In: Ševčík P, Skřičková J, Šrámek V et al. Záněty plic v intenzivní medicíně. Galén: Praha 2004. ISBN 80–7262–278–1.
20. Skřičková J, Pavlík P. Odběry materiálnu na mikrobiologické vyšetření v diagnostice pneumonií. In: Ševčík P, Skřičková J, Šrámek V et al. Záněty plic v intenzivní medicíně. Galén: Praha 2004. ISBN 80–7262–278–1.
21. Bulpa PA, Dive AM, Mertens L et al. Combined bronchoalveolar lavage and transbronchial lung biopsy: safety and yield in ventilated patients. Eur Respir J 2003; 21(3): 489–494.
22. Papaziann L, Gainnier M. Indications of BAL, lung biopsy or both in mechanically ventilated patients with unexplained infiltrations. Eur Respir J 2003; 21(3): 383–384.
23. Jindrák V, Votava M. Úvodní antibiotická léčba zánětů plic – kritéria pro volbu antibiotika. In: Ševčík P, Skřičková J, Šrámek V et al. Záněty plic v intenzivní medicíně. Galén: Praha 2004. ISBN 80–7262–278–1.
24. Rello J, Ulldemolins M, Lisboa T et al. Determinations of prescription and choice of empirical therapie for hospital-acquired and ventilator-associated pneumonia. Eur Respir J 2011; 37(6): 1332–1339. Dostupné z DOI: <http://dx.doi.org/10.1183/09031936.00093010>.
25. Jakubec P, Kolek V, Kolář M. Diagnostika a léčba těžké pneumonie. In: Kolek V et al. Doporučené postupy v pneumologii. 2nd ed. Maxdorf: Praha 2016. ISBN 978–80–7345–507–1.
26. Aarts MA, Hancock JN, Heyland D at al. Empiric antibiotic therapy for suspected ventilator-associated pneumonia: A systematic review and meta-analysis of randomized trials. Crit Care Med 2008; 36(1): 108–117.
27. Chytra I, Ševčík P, Votava M et al. Prevence nozokomiální pneumonie. In: Ševčík P, Skřičková J, Šrámek V et al. Záněty plic v intenzivní medicíně. Galén: Praha 2004. ISBN 80–7262–278–1.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2017 Issue 7-8-
All articles in this issue
- History and presence of hepatitis B and C therapy
- PCR diagnosis of infectious diseases
- The current problems related to nosocomial infections and antibiotic resistance today
- Development of views on pathophysiology of sepsis
- Cytomegalovirus and polyomavirus infection after renal transplantation
- Viral hepatitis A – possible diagnostic and therapeutic problems
- HIV infection – a new disease of internal medicine
- Myocarditis and inflammatory cardiomyopathy
- Community pneumonia – fundamentals of diagnosing and treatment
- Nosocomial pneumonia
- Infectious complications related to liver transplants
- Viral hepatitis C and organ transplantation
- Heart transplantation and infection
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Nosocomial pneumonia
- PCR diagnosis of infectious diseases
- The current problems related to nosocomial infections and antibiotic resistance today
- Community pneumonia – fundamentals of diagnosing and treatment
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career