-
Medical journals
- Career
Non-CF bronchiektázie dospělých: stručný přehled pro praxi
Dokument Sekce chorob s bronchiální obstrukcí České pneumologické a ftizeologické společnosti České lékařské společnosti J. E. Purkyně
Authors: Zuzana Antušová 1,2; Libor Fila 3; Vladimír Herout 4; Eva Kočová 5; Kateřina Neumannová 6; Jaromír Zatloukal 7; Vladimír Koblížek 2
Authors‘ workplace: Plicní ambulance, GEPAMED – NEXTCLINIC, Hradec Králové 1; Plicní klinika LF UK a FN Hradec Králové 2; Pneumologická klinika 2. LF UK a FN v Motole, Praha 3; Klinika nemocí plicních a tuberkulózy LF MU a FN Brno, pracoviště Bohunice 4; Radiologická klinika LF UK a FN Hradec Králové 5; Katedra fyzioterapie Fakulty tělesné kultury UP v Olomouci 6; Klinika plicních nemocí a tuberkulózy LF UP a FN Olomouc 7
Published in: Vnitř Lék 2017; 63(11): 821-833
Category: Reviews
Overview
Bronchiektázie (BE) reprezentují klinicky závažný, nicméně dosud málo pochopený pneumologický problém charakterizovaný rozšířením lumen a zesílením stěny bronchů. V globálním pohledu představují bronchiektázie výraznou příčinu morbidity a mortality. Cílené úsilí směrované k časné diagnostice a detailnímu poznání příčinných souvislostí je v centru pozornosti respiračních specialistů v mnoha rozvinutých zemích Evropské unie. Riziková populace zahrnuje nemocné s perzistujícím nebo produktivním kašlem bez jiné zjištěné příčiny. Časná specifická kauzální léčba a nespecifická terapie zaměřená na zlepšení hygieny dolních dýchacích cest jsou schopny redukovat poškození plíce. Na důkazech založené algoritmy protizánětlivé a antibiotické léčby však stále čekají na velké kontrolované studie. Plicní resekce jsou určeny pro symptomatické osoby s lokalizovaným postižením nereagujícím na ostatní neinvazivní postupy. Validních dat v oblasti bronchiektázií bez přítomnosti cystické fibrózy (non-CF BE) je stále málo. Ve snaze o získání rychlého přístupu k informacím o velkém počtu evropských nemocných a o rychlejší nábor nemocných do nových klinických studií vznikl v posledních letech Evropský registr bronchiektázii. Autoři tohoto dokumentu doporučují všem respiračním specialistům pečujícím o osoby s bronchiektáziemi aktivní participaci na tomto rozsáhlém a stále otevřeném projektu.
Klíčová slova:
bronchiektázie – diagnostika – registr – terapieÚvod
Sekce chorob s bronchiální obstrukcí České pneumologické a ftizeologické společnosti (ČPFS) České lékařské společnosti J. E. Purkyně se od roku 2014 zabývá tvorbou pozičního dokumentu týkajícího se bronchiektázií bez přítomnosti cystické fibrózy (tzv. non-CF BE). Tato heterogenní skupina chorob je, bohužel, stále stranou zájmu lékařů nejen v České republice. Předkládaný dokument je souhrnem dostupných znalostí a důkazů akceptovaných mezinárodními autoritami na tomto poli [1–26]. Nejedná se o doporučený postup, nýbrž o stručný a poněkud simplifikovaný souhrn zaměřený na lékaře různých odborností. Hlavním důvodem pro publikaci tohoto dokumentu je nutnost položit základní kámen pro tvorbu národní strategie diagnostiky a léčby non-CF BE v blízké budoucnosti. Autoři dokumentu rovněž doporučují všem lékařům zainteresovaným v problematice non-CF BE aktivní zapojení do Evropského registru bronchiektázií (EMBARC – a pan-European network committed to promoting clinical research and education in bronchiectasis) [3].
Definice
Bronchiektázie (BE) jsou definovány jako ireverzibilní dilatace bronchů středního a malého kalibru, klinicky se zpravidla prezentující produktivním kašlem, dušností, únavou, recidivujícími infekcemi dýchacích cest nebo hemoptýzou. Tento dokument nepojednává o BE asociovaných s cystickou fibrózou (CF) ani o tzv. trakčních BE přítomných při intersticiálních plicních procesech. V Evropě a USA mluvíme tedy o tzv. non-CF BE [1,9].
Epidemiologie
Vzhledem k nespecifickým klinickým projevům mohou být pacienti s bronchiektáziemi někdy sledováni pod jinou plicní diagnózou, např. jako nemocí s chronickou obstrukční plicní nemocí (CHOPN), s prostou chronickou bronchitidou nebo s průduškovým astmatem. Díky moderním zobrazovacím metodám, jako je vysokorozlišovací výpočetní tomografie (high-resolution computed tomography – HRCT) hrudníku, se však v posledních 2 dekádách daří poznat stále více klinických případů. I tak dosud zůstává přesná prevalence non-CF BE v ČR neznámá. Výskyt tohoto onemocnění obecně výrazně stoupá s rostoucím věkem [1,2,9]. V USA je odhadnuta prevalence tohoto onemocnění ve věkové kategorii 18–34 let 4,2/100 000 obyvatel, ve věkové kategorii > 75 let je to již 271/100 000 obyvatel [2].
Etiologie a patogeneze
Non-CF BE mohou být vrozené (vzácnější) nebo získané – spojené s jinou základní nemocí (tab. 1). Mezi nejčastější příčiny vzniku non-CF BE patří recidivující, závažné respirační infekce, imunodeficity a opakované aspirace. V mnoha případech se však ani po podrobném vyšetření pacienta nepodaří základní příčinu vzniku non-CF BE objasnit. V tomto případě hovoříme o tzv. idiopatických non-CF BE (dle zahraničních literárních údajů se jedná až o 30–53 % všech případů) [1,9,10].
Table 1. Nejčastější příčiny výskytu bronchiektázií (BE) u dospělých.* 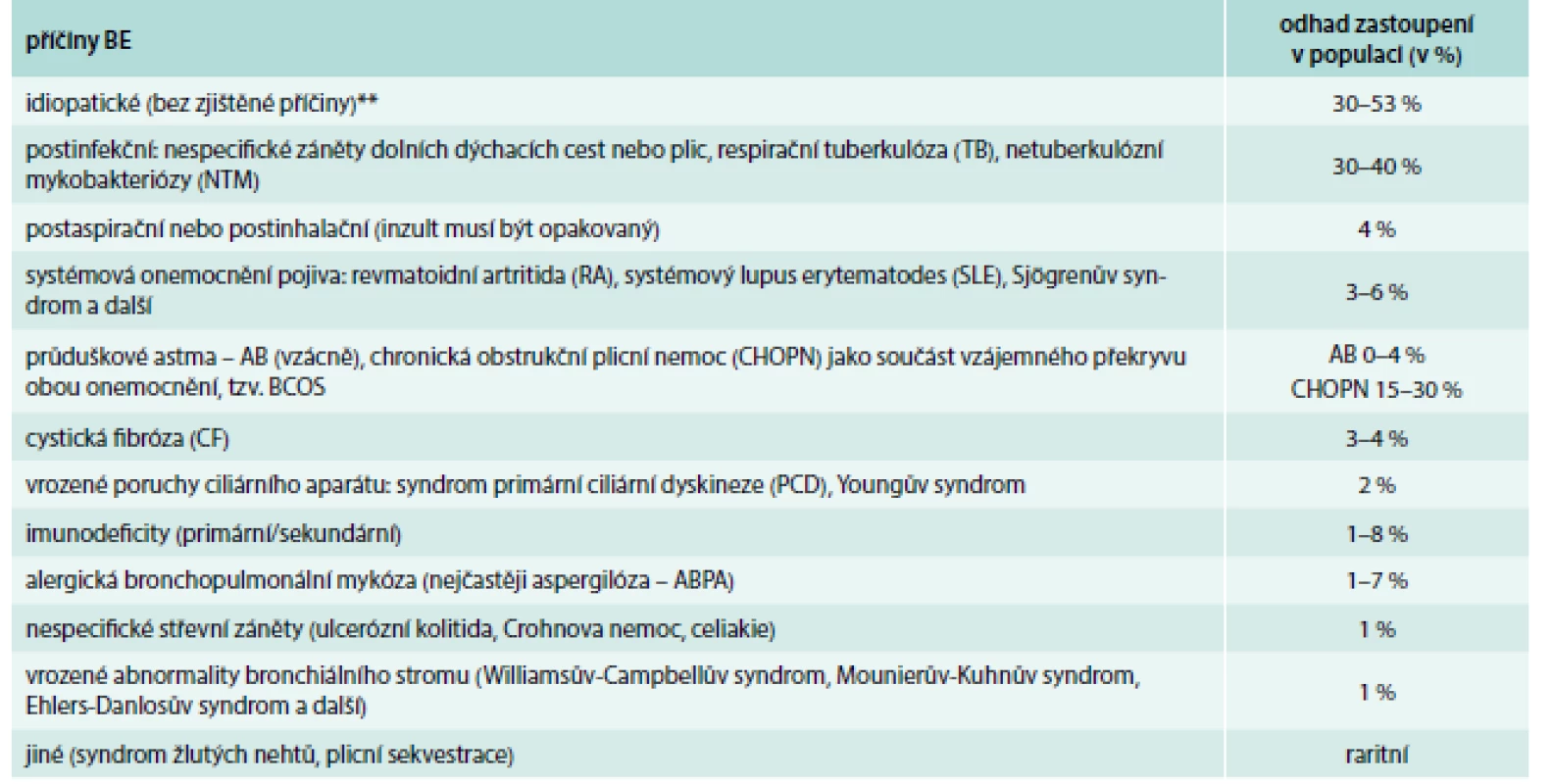
*volně upraveno autory (sekundární tzv. trakční BE v terénu intersticiálních plicních chorob nejsou do tohoto výčtu zahrnuty) **při pečlivějším vyšetření logicky klesá počet tzv. idiopatických forem BE [9] Upraveno podle [1,9] Patogeneze tohoto onemocnění je charakterizována „bludným kruhem“, v němž zánět bronchiální stěny (vyvolaný např. těžkou infekcí či aspirací) vede k jejímu poškození, následkem toho se zhorší mukociliární clearance dolních dýchacích cest, klesá očistná efektivita kašle a dále se progresivně rozvíjí chronický slizniční zánět (doprovázený zvýšenou produkcí hlenů, chronickou převážně bakteriální kolonizací dolních dýchacích cest). To vše pomalu a postupně přispívá k destrukci stěny průdušky s vývojem a následnou progresí non-CF BE (obr. 1) [1,9].
Image 1. Patogeneze destrukce bronchiální stěny: morfologický rozdíl mezi zdravou průduškou (vlevo) a bronchiektatickou průduškou (vpravo). 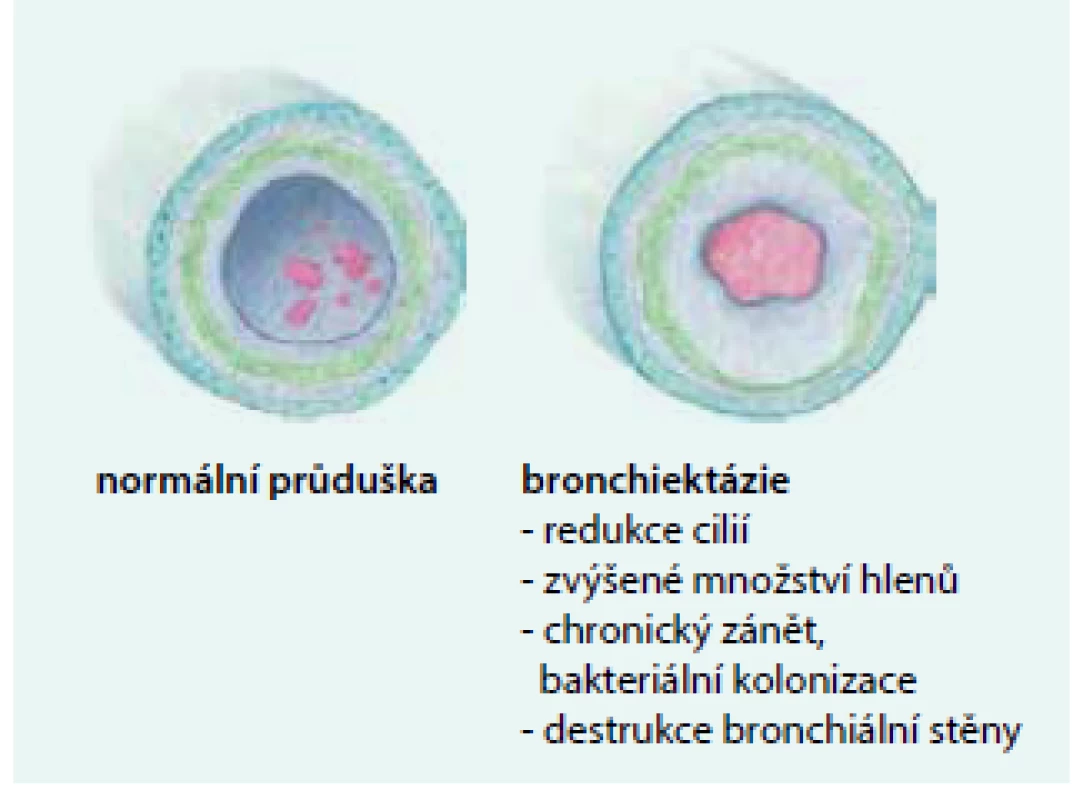
Původní ilustrace pro tento dokument od akademického malíře Josefa Bavora Klinické projevy
U některých pacientů jsou non-CF BE zcela náhodným nálezem při HRCT vyšetření hrudníku provedeném z jiného důvodu. Pokud jsou non-CF BE malého rozsahu a pacient je zcela asymptomatický, není jejich další došetřování zcela relevantní. Takové náhodně zjištěné případy non-CF BE někdy nacházíme u nemocných s CHOPN (jako součást tzv. překryvného syndromu některými autory nazývaném BCOS – bronchiectasis-COPD/chronic obstructive pulmonary disease). Další část odstavce se týká osob s přítomností symptomů. Nejčastějším klinickým projevem bronchiektázií je kašel (90 % všech symptomatických pacientů), který je převážně produktivní. Neproduktivní kašel se vyskytuje pouze u menší části (5–8 %) nemocných [1]. Dalším klinickým projevem je dušnost (70–80 % pacientů), která do určité míry koreluje s redukcí plicních funkcí (FEV1) a s rozsahem postižení dle HRCT hrudníku. Přibližně u poloviny postižených jedinců je, minimálně jednou za život, přítomná hemoptýza, která může být i prvním příznakem onemocnění. Ve většině případů je vznik hemoptýzy spojen s infekční epizodou (tzv. infekční exacerbací) BE. Hemodynamicky významná hemoptýza (více než 200–250 ml) se naštěstí vyskytuje zřídka (u asi 4 % pacientů s non-CF BE) [1]. K dalším projevům patři bolesti na hrudi, únava a pomalý váhový úbytek. Pokročilé, neléčené stadium onemocnění může vést k rozvoji respiračního selhání a k vývoji plicního srdce (tzv. cor pulmonale). Akutní exacerbace non-CF BE je definována jako náhlé zhoršení symptomů:
- nárůst objemu nebo
- purulentnost sputa
- zhoršení dušnosti
- zvýšení intenzity kašle
- progrese únavy
- pokles plicních funkcí při spirometrickém vyšetření nebo
- vznik nových symptomů: teploty, pleurální bolesti, objevení se hemoptýzy [1]
Diagnostika
Anamnéza
Na přítomnost non-CF BE bychom měli myslet u pacientů s recidivujícími záněty dýchacích cest (DC), nemocné s dlouhodobou anamnézou produktivního kašle u nekuřáků (určité respirační obtíže jsou nezřídka patrné již od dětství), dále u pacientů s hemoptýzou ne zcela jasné etiologie, či s kultivačním záchytem Pseudomonas aeruginosa ve sputu. Jak bylo uvedeno výše, onemocnění je stále v mnoha případech nepoznané. Pacienti jsou často vedeni jako chronická bronchitida či CHOPN (dle literárních údajů u pacientů s CHOPN najdeme na HRCT bronchiektázie až v 15–30 %) [1,9,27]. Non-CF BE bychom měli vyloučit i u pacientů s těžkým průběhem průduškového astmatu, u kterých onemocnění nemůžeme dostat pod kontrolu ani při maximální inhalační terapii a adekvátní léčbě všech komplikujících faktorů.
Fyzikální vyšetření
Poslechový nález může být zcela normální, v mnoha případech jsou přítomny (trvale nebo intermitentně) inspiračně-exspirační pískoty, jindy přízvučné inspirační chrůpky/chropy z oblasti bronchiektázií, asi u třetiny pacientů můžeme zachytit čistě exspirační vrzoty/pískoty imitující CHOPN nebo průduškové astma [1].
Zobrazovací vyšetření
Esenciálním základem moderní diagnostiky non-CF BE je HRCT hrudníku [1,9]. Na HRCT jsou non-CF BE definované jako průdušky s rozšířenou nebo ztluštělou stěnou, jejichž vnitřní průměr je větší než zevní průměr průdušku provázející arterie (tzv. příznak pečetního prstenu). Dále jsou to bronchy, které jsou na HRCT plic viditelné v plášťové zóně plic (tedy blíže než 10 mm od pleury) a bronchy, u kterých nedochází k pravidelnému zužování po dvojím dichotomickém dělení (na HRCT patrno jako tzv. příznak kolejnice). U bronchiektázií je zpravidla přítomna rozšířená stěna průdušek. Bronchiektázie jsou často spojeny s přítomností tzv. mukoidních impakcí v bronších ev. s abnormalitami malých dýchacích cest. Mukoidní impakce (neboli bronchokély) v dilatovaných bronších jsou denzní struktury tvaru V či Y. Patologický hlenový obsah v malých bronších tvoří tzv. obraz morf „tree-in-bud“ neboli obraz rašícího stromu jako obecný HRCT projev bronchiolitidy [20]. Podle tvaru lze BE rozdělovat na cylindrické (nejčastější), varikózní a cystické (vzácné, nejzávažnější), obr. 2. Na přítomnost BE nás může upozornit i skiagram hrudníku, na němž mohou být bronchiektázie patrné jako kolejnicová, cystická či hroznovitá projasnění; pokud jsou spojeny s patologickým obsahem, pak hovoříme o tzv. příznaku prstu rukavice (obr. 3) [21].
Image 2. Predilekční místa výskytu BE u jednotlivých nemocí. 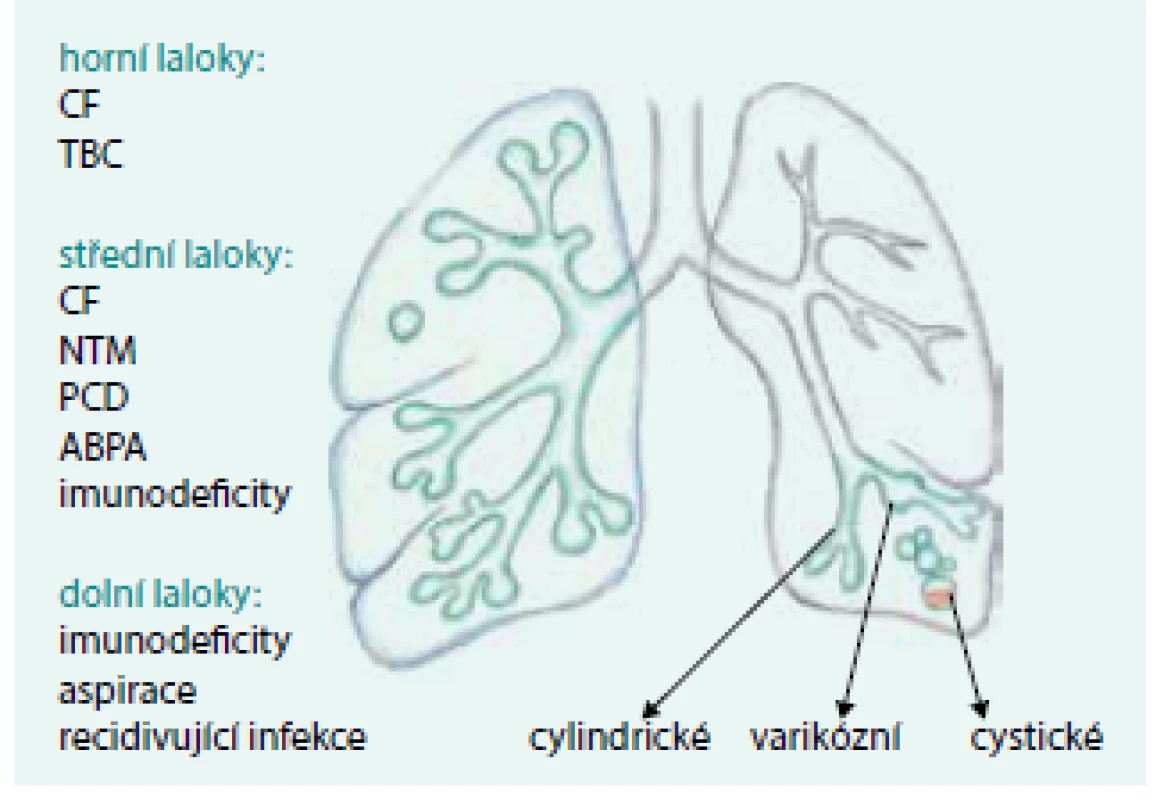
ABPA – alergická bronchopulmonální aspergilóza CF – cystická fibróza NTM – netuberkulózní mykobakteriózy PCD – primární ciliární dyskineze TBC – tuberkulóza Původní ilustrace pro tento dokument od akademického malíře Josefa Bavora Obr. 3a. HRCT plic, transverzální řez, plicní okno: obraz non-CF bronchiektázií s patologickým obrazem a hladinkou. 
Otištěno s laskavým svolením autorky snímků Evy Kočové Obr. 3b. HRCT plic, koronární řez, plicní okno: HRCT nález non-CF bronchiektázií v plášťové zóně plic. 
Otištěno s laskavým svolením autorky snímků Evy Kočové Obr. 3c. HRCT plic, transverzální řez, plicní okno: HRCT nález non-CF cylindrických bronchiektázií. 
Otištěno s laskavým svolením autorky snímků Evy Kočové Obr. 3d. HRCT plic, transverzální řez, plicní okno: HRCT nález non-CF cystických bronchiektázií. 
Otištěno s laskavým svolením autorky snímků Evy Kočové Obr. 3e a 3f. HRCT plic, koronární a transverzální řez, plicní okno: HRCT nález příznaku kolejnice. 
Otištěno s laskavým svolením autorky snímků Evy Kočové Obr. 3g. HRCT plic, transverzální řez, plicní okno: HRCT nález příznaku pečetního prstenu. 
Otištěno s laskavým svolením autorky snímků Evy Kočové Obr. 3h. HRCT plic, transverzální řez, plicní okno: HRCT nález morf „tree-in bud“. 
Otištěno s laskavým svolením autorky snímků Evy Kočové Obr. 3ch. HRCT plic, koronární řez, plicní okno: HRCT nález varikózních non-CF bronchiektázií. 
Otištěno s laskavým svolením autorky snímků Evy Kočové Plicní funkce
U každého pacienta s non-CF BE by měly být vyšetřeny plicní funkce minimálně pomocí spirometrie po provedení bronchodilatačního testu (podobně jako u nemocných s CHOPN). Plicní funkce méně postižených osob mohou být v normě, nebo (v závislosti od rozsahu postižení) je přítomná obstrukční ventilační porucha. U třetiny až čtvrtiny pacientů s non-CF BE nacházíme bronchiální hyperreaktivitu (tedy v řeči funkčního vyšetření pozitivní metacholinový, případně manitolový bronchokonstrikční test) [1,3–5,12].
Vyšetřovací panely
Základní vyšetřovací panel u všech nově diagnostikovaných se symptomatickými non-CF BE:
- imunoglobuliny IgG, IgA, IgM
- celkový IgE a specifické IgE/IgG proti Aspergillus fumigatus
- sputum na nespecifickou kultivaci a citlivost (zejména k záchytu Haemophilus influenzae a Streptococcus pneumoniae musí být sputum doručeno do laboratoře do 3 hod od odběru)
- sputum na specifickou (mykobakteriální) kultivaci a mikroskopii (na acidorezistentní tyčky)
- krevní obraz a diferenciální krevní rozpočet, základní biochemie včetně C-reaktivního proteinu
- revmatologický screening k vyloučení revmatoidní artritidy (RF latex, antiCCP), Sjögrenova syndromu (ANA screening, ENA screening, ENA SSA/B), vaskulitidy (ANF, ANCA protilátky) – interpretace vždy nejlépe ve spolupráci s revmatologem
- ORL vyšetření (podezření na extraezofageální reflux, suspekce na poruchu ciliárního aparátu, podezření na dosud nediagnostikovanou cystickou fibrózu, obava ze syndromu žlutých nehtů, suspekce na respirační systém postihující vaskulitidy)
- anamnestické, případně gastroenterologické (pH-metrie či impedance jícnu) vyšetření při podezření na extraezofageální reflux s opakovanými aspiracemi
- anamnestické pátrání po infekcích v dětství (spalničky, černý kašel, virové pneumonie, tuberkulóza)
- pečlivé zhodnocení HRCT nálezu hrudníku (k vyloučení vrozených BE, někdy spojených s rozšířením trachey)
Rozšířený vyšetřovací panel provádíme ve specifických případech, pokud je přítomna klinická suspekce na následující onemocnění:
- potní test a případně genetické vyšetření k vyloučení cystické fibrózy (věk < 40 let nebo chronická kolonizace dýchacích cest Staphylococcus aureus či Pseudomonas aeruginoza v jakémkoliv věku, neprospívaní a malnutrice, anamnéza steatorey, dominantní postižení horních plicních laloků, u mužů neplodnost)
- sacharinový test a nazální měření oxidu dusnatého (NO), ev. nativní vysokorychlostní mikroskopické vyšetření ciliárních buněk respiračního traktu při suspekci na primární ciliární dyskinezu – PCD (záněty středouší, recidivující infekce horních cest dýchacích od dětského věku, neplodnost, dextrokardie, postižení dominantně středních laloků), při iniciální pozitivitě sacharinového testu (> 1 hod – pozor, není považováno za validní u nespolupracujících osob a u dětí) nebo při zvýšeném množství nazálního NO (< 100 ppb) je vhodné provést odběr řasinek z HDC či DCD k vyšetření nativní vysokorychlostní mikroskopií k verifikaci PCD (dostupné ve FN v Motole v Praze a ve FN Hradec Králové), finální ověření přítomnosti PCD, odlišení od sekundárních poruch a podrobnější identifikace typu PCD (pomocí kultivace ciliárních buněk a jejich následné vysokorychlostní nativní mikroskopie, případně pomocí elektronové mikroskopie) je prováděno pro české dětské i dospělé pacienty v referenční laboratoři na Dětské klinice FN v Motole v Praze (prof. MUDr. P. Pohunek, CSc.)
- flexibilní bronchoskopie: při podezření na aspiraci (závažné formy extraezofageálního refluxu, neurologické onemocnění, trauma, abúzus) či na plísňovou nebo mykobakteriální infekci (postižení pravého středního laloku či linguly, BE většinou segmentární/lobární, v jejich okolí „tree-in-bud“, často náhodně roztroušené 1–2 cm noduly) zejména pokud je předchozí kultivace sputa negativní nebo pacient žádné sputum „neprodukuje“
- vyšetření imunologem při podezření na imunodeficit (primární – recidivující infekce dýchacích cest od dětství, menší vzrůst, postižení dolních laloků, či sekundární – při autoimunitních onemocněních, hematologických malignitách, po chemoterapii), dále vyšetření imunitní odpovědi na vakcinaci (schopnost tvorby specifických protilátek) proti tetanu, proti pneumokoku, případně Haemophilus influenzae (typ b)
- hladina α1-antitrypsinu – A1AT při současné přítomnosti plicního emfyzému, často v mladším věku (zejména u kuřáků)
Mikrobiologie
U dvou třetin pacientů s non-CF BE nacházíme při kultivačním vyšetření sputa patogenní mikroorganizmy. Nečastější je záchyt Haemophilus influenzae (asi 35 % pacientů), dále pak Pseudomonas aeruginosa (5–31 % pacientů), Moraxella catarrhalis, Streptococcus pneumoniae a Staphylococcus aureus [3]. Méně často jsou zachyceny patogeny jako Aspergillus sp., koliformní gramnegativní organizmy, MRSA a atypická mykobakteria. Kolonizace dolních dýchacích cest (DDC) Pseudomonas aeruginosa je u pacientů s non-CF BE spojena s častějšími exacerbacemi, rychlejším poklesem plicních funkcí, horší kvalitou života a vyšší mortalitou. Pacienti bez kolonizace dýchacích cest Pseudomonas aeruginosa mají průměrnou deklinaci plicních funkcí asi 50 ml/rok, u pacientů s kolonizací dýchacích cest tímto patogenem je to výrazně více (> 120 ml/rok) [1,9,12].
Zhodnocení tíže a prognózy onemocnění
Stejně jako u mnoha jiných plicních chorob (CHOPN, průduškového astmatu a plicní fibrózy) jsou aktuálně i u pacientů s non-CF BE vypracované skórovací systémy k posouzení tíže a prognózy tohoto onemocnění. Dosud byly publikovány 2 typy těchto hodnotících škál: Bronchiectasis Severity Index (neboli BSI), tab. 2 a FACED score (tab. 3) (zatím ani jeden nemá vytvořený oficiální český překlad) [4–6]. Zhodnocení rizika mortality/morbidity pomocí skórovacích systému BSI či FACED je doporučeno provádět co nejdříve od doby stanovení diagnózy (nejpozději do půl roku) a dále je nutné je kalkulovat ve stabilním stavu (bez exacerbace) [4–6,13].
Table 2. Bronchiectasis Severity Index (BSI). 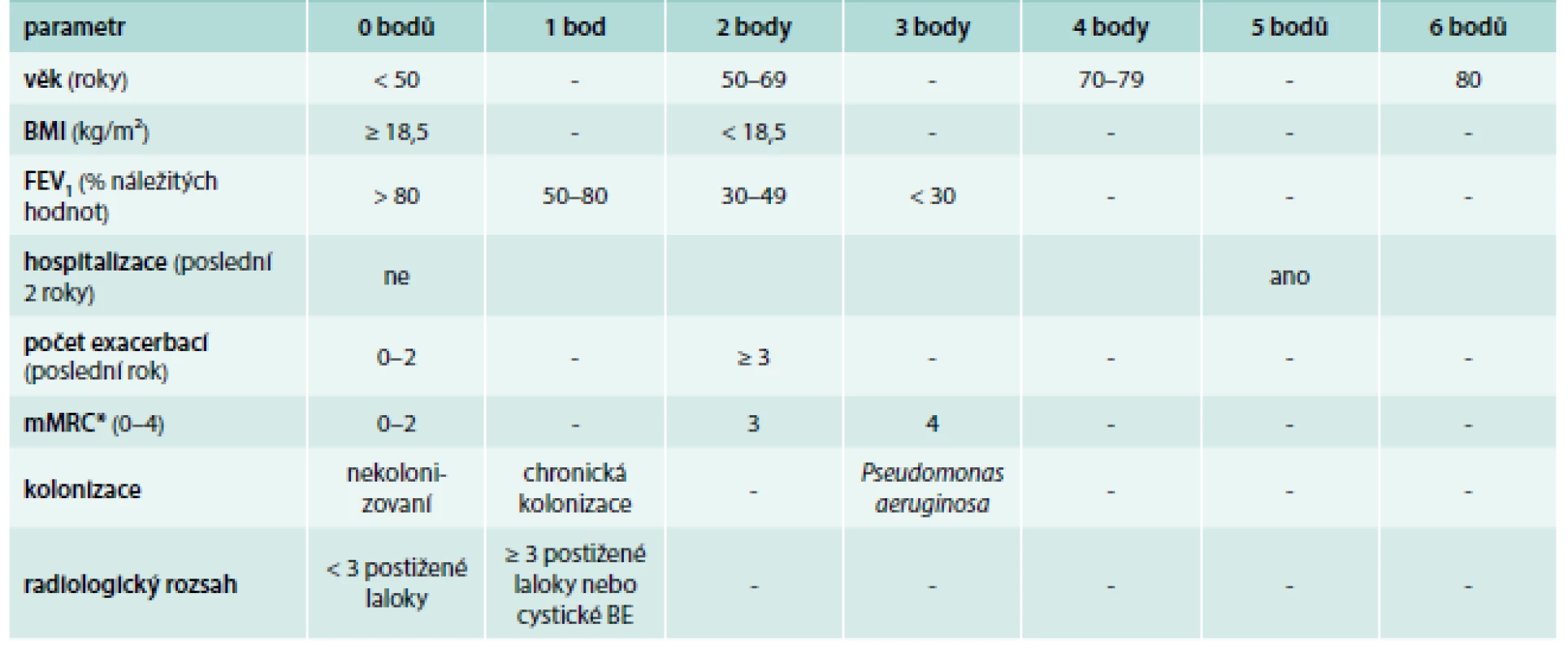
*upraveno – v originální tabulce je uvedena nemodifiková MRC škála (1–5) vyhodnocení: 0–4 body = mírné postižení 5–8 bodů = středně těžké postižení ≥ 9 bodů = těžké postižení Elektronická kalkulačka tohoto prognostického indexu je nyní volně dostupná na: http://www.bronchiectasisseverity.com Upraveno podle [4] Table 3. FACED score: FEV1, Age, Colonization Pseudomonas aeruginosa, Extent (rozsah postižení na CT), Dyspnea. 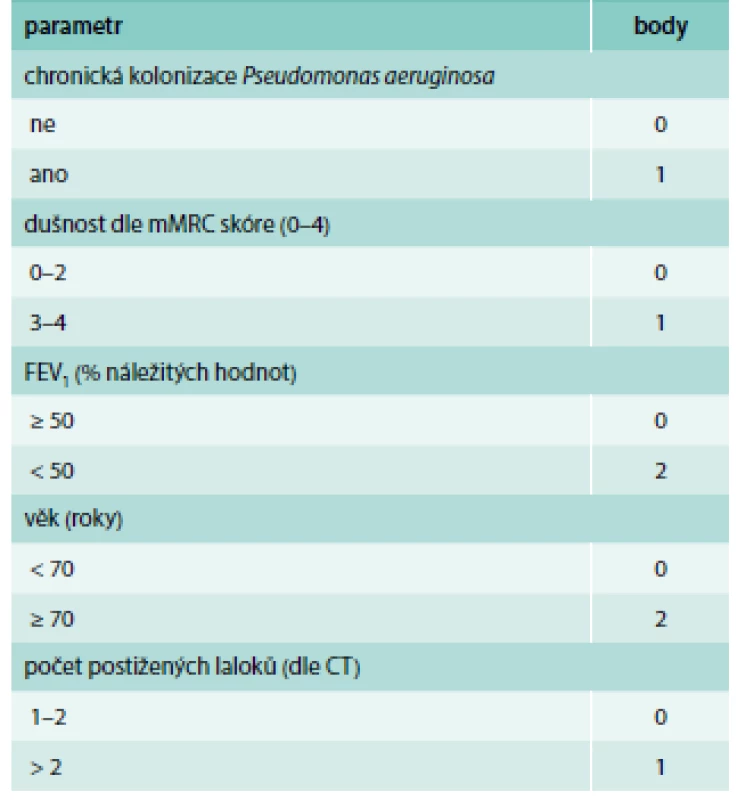
vyhodnocení: 0–2 body = mírné postižení 3–4 body = středně těžké postižení 5–7 bodů = těžké postižení Upraveno podle [5] Mortalita pacientů s non-CF BE nejčastěji souvisí s progresivním respiračním selháním a se závažnými nebo recidivujícími respiračními infekcemi [3]. Mezi rizikové faktory, které jsou spojeny s vyšší letalitou u pacientů s BE, patří kolonizace DC Pseudomonas aeruginosa, mužské pohlaví, větší tíže obstrukční ventilační poruchy a přítomnost poruchy plicní difuze (neboli transferfaktoru) [13].
Léčba
Cílem dlouhodobé léčby pacientů s non-CF BE je zlepšení klinických symptomů, snížení frekvence exacerbací, udržení plicních funkcí a zlepšení kvality života [1,9]. Terapie akutních stavů asociovaných s non-CF BE není předmětem tohoto sdělení. Nicméně pro úplnost je třeba ji velmi stručně zmínit. Při akutních exacerbacích jsou obecně doporučovány
- systémové kortikosteroidy v dávkách podobných jako u exacerbace CHOPN případně astmatu
- intenzifikovaná (4–6krát denně) bronchodilatační inhalační léčba
- akcentovaná fyzioterapie
- antibiotická léčba korigovaná ve spolupráci s lokální mikrobiologickou laboratoří dle aktuálního mikrobiologického statusu pacienta a závažnosti probíhající respirační infekce
U osob s výraznější nebo recidivující hemoptýzou je po stanovení krvácející strany metodou 1. volby provedení léčebné embolizace bronchiální tepny postižené strany (neboli BAE – bronchial artery embolization) [28].
Bronchiální hygiena
Zcela klíčovou komponentou terapie je adekvátní bronchiální očista (tzv. hygiena) dolních dýchacích cest. Je indikována u pacientů s produktivním kašlem nebo nálezem hlenových zátek na HRCT plic. Správná očista vede k usnadnění expektorace, k prevenci vzniku dalších hlenových zátek a redukci komplikací (pneumonií, atelektáz). Základem farmakologické léčby v oblasti bronchiální hygieny jsou mukoaktivní látky často zjednodušeně nazývané jako mukolytika, které můžeme podávat jak perorálně, tak inhalační cestou (např. N-acetylcystein, ambroxol nebo erdostein). V době akutní exacerbace je obecně doporučeno dávku mukolytik poněkud zvýšit. U pacientů s BE byl prokázán pozitivní efekt inhalace hypertonického solného roztoku (NaCl 3–14 %) na zlepšení plicních funkcí (FEV1). K posouzení, zda tato léčba nezpůsobuje bronchospazmus, je vhodné provést spirometrické vyšetření před podáním a 5 min po aplikaci hypertonického solného roztoku. V případě přítomnosti bronchospazmu podáváme před inhalací hypertonického roztoku bronchodilatační nebulizaci (např. krátkodobě působící salbutamol). Inhalační léčba dornázou α neboli dezoxyribonukleázou (preparát Pulmozyme) není zatím u pacientů s non-CF BE indikovaná (není pro ni dosud dostatek důkazů na rozdíl od nemocných s BE podmíněnými cystickou fibrózou) [1,9].
K usnadnění expektorace hlenů se doporučuje pravidelné provádění respirační fyzioterapie (obr. 4–7), pro niž lze využít techniky aktivní drenáže s pomůckami nebo bez pomůcek. Mezi aktivní drenážní techniky patří autogenní drenáž a aktivní cyklus dechových technik.
Image 3. Dechové trenažéry s vibrací: Pari O-PEP, Flutter, RC-Cornet, Acapella. 
Otištěno s laskavým svolením autorky snímků Kateřiny Neumannové Image 4. Dechové trenažéry bez vibrace: Threshold PEP, TheraPEP, PariPEP S-Systém. 
Otištěno s laskavým svolením autorky snímků Kateřiny Neumannové Image 5. Dechové trenažéry pro zvýšení síly dýchacích svalů: Threshold PEP (výdechový trenažér) a Threshold IMT (nádechový trenažér). 
Otištěno s laskavým svolením autorky snímků Kateřiny Neumannové Image 6. Treshold (vlevo) a flutter (vpravo): způsob použití. 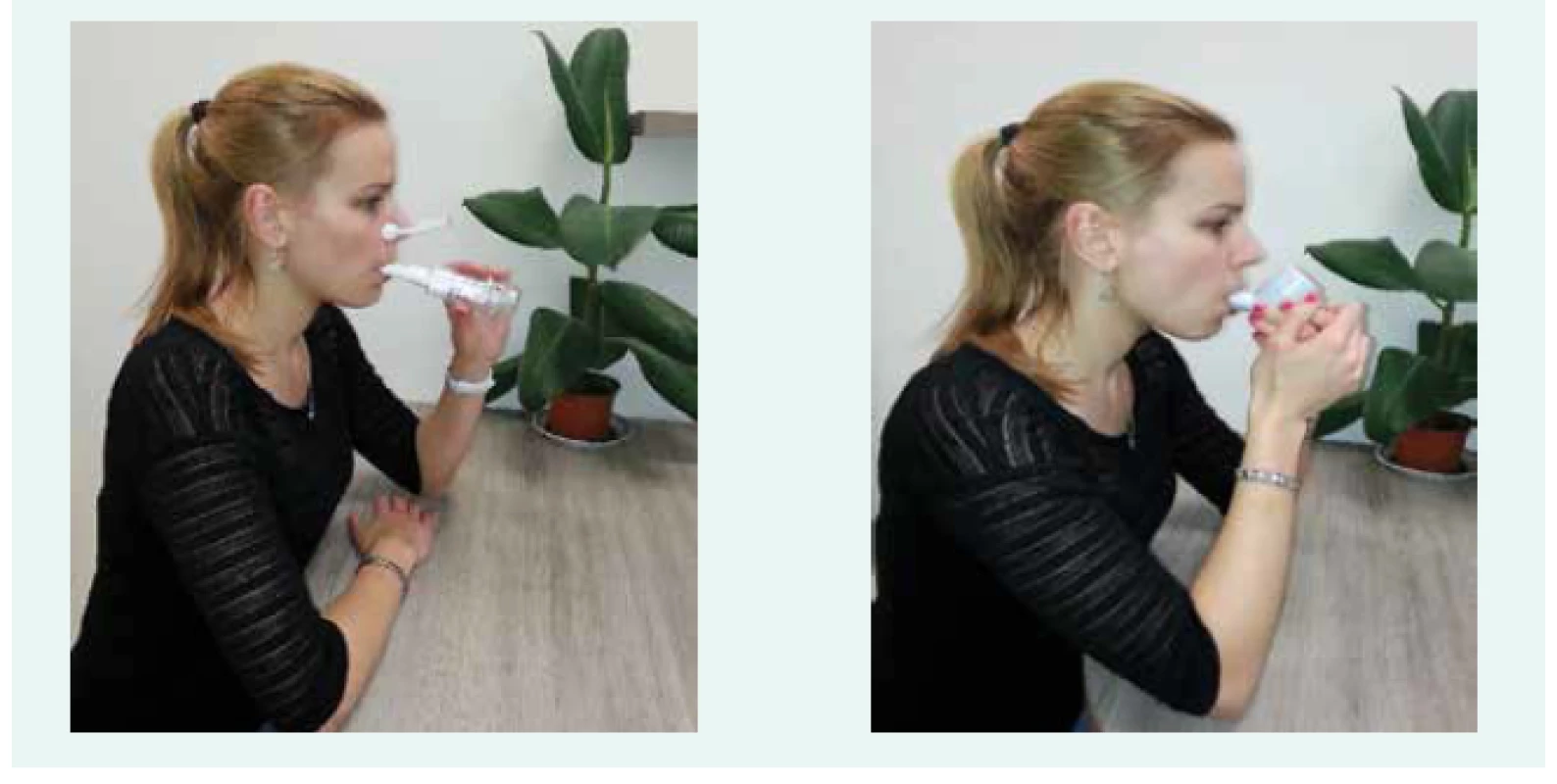
Otištěno s laskavým svolením autorky snímků Kateřiny Neumannové, snímky vznikly se souhlasem nemocné Pro usnadnění posunu bronchiálního sekretu z periferních dýchacích cest směrem do centrálních používáme drenážní techniky, při kterých je výdech prováděn přes různé typy dechových trenažérů. Lze využít dechové trenažéry s vibrací – např. Pari O-PEP, Flutter, RC-Cornet, Acapellu anebo dechové trenažéry bez vibrace – např. Threshold PEP, TheraPEP, PariPeP S-Systém. Zejména u nemocných, u kterých jsou hleny husté a vazké, je vhodnější využít dechové trenažéry s vibrací. Vytvořené vibrace/oscilace se přenesou z dutiny ústní na bronchiální strom, a tím postupně uvolní hleny lpící na stěnách průdušek. Všechny dechové trenažéry kladou určitý odpor do výdechu a pomáhají tak předcházet výdechovém kolapsu dýchacích cest. Drenážní techniky jsou často kombinované s inhalační bronchodilatační (níže) a mukolytickou léčbou (níže). Znalost správného provádění technik respirační fyzioterapie vyžaduje opakovanou edukaci erudovaným respiračním fyzioterapeutem, který dokáže dle individuálních potřeb pacienta edukovat i o dalších technikách respirační fyzioterapie s cílem podpory správného dechového vzoru (např. dechová gymnastika, neurofyziologická facilitace dýchání, dýchání přes sešpulené rty, brániční dýchání), zvýšení síly nádechových a výdechových svalů (např. pomocí vytrvalostního a silového tréninku s dechovým trenažérem Threshold PEP a IMT). Nedílnou součástí komplexní plicní rehabilitace je také vytrvalostní a silový trénink. Drenážní techniky pro udržení čistoty dýchacích cest je doporučováno u osob s non-CF BE provádět každodenně (1–2krát denně), v případě klinických potíží í častěji. Vytrvalostní a silový trénink je vhodné provádět alespoň 3krát týdně, aby byla dosažena a udržena dostatečná kondice nemocného [1,9,16–19].
Vakcinace
U pacientů se symptomatickými non-CF BE lze doporučit každoroční vakcinaci proti sezónní chřipce a jednorázovou vakcinaci proti pneumokokům [8].
Léčba antibiotiky
Léčba antibiotiky (ATB) má zásadní roli v managementu pacientů s non-CF BE. Jejím cílem je přerušení začarovaného kruhu „infekce – zánět – destrukce bronchiální stěny“. ATB užíváme k:
- léčbě akutních exacerbací
- eradikaci patogenů zhoršujících prognózu pacientů s non-CF BE a v neposlední řadě
- potlačení chronické infekce dýchacích cest pomocí dlouhodobě podávaných antibiotik
Léčba akutní exacerbace
Akutní exacerbace je definována jako zhoršení stávajících dechových potíží pacienta. Obvykle se jedná o změnu množství nebo charakteru hlenů (hleny jsou více vazké nebo purulentní, mají nitky krve nebo čerstvou krev), zhoršení dechu, kašle, přítomnost teplot či pleurálních bolestí. V těchto případech je doporučeno co nejdříve zahájit ATB léčbu v monoterapii. O výběru ATB se rozhodujeme na základě výsledku kultivace a citlivosti sputa vyšetřeného ve stabilním stavu. Vzhledem k charakteru nemoci je doporučeno ATB podávat minimálně po dobu 14 dnů (tab. 4). Před zahájením ATB léčby je doporučeno odeslat sputum na vyšetření aktuální kultivace. V případě selhání perorální ATB léčby, alterace celkového zdravotního stavu pacienta či při záchytu patogenu, který je rezistentní na perorálních ATB, je indikováno podání intravenózní ATB terapie dle citlivosti. Zatím nejsou k dispozici žádná data, která by doporučovala rutinní podávání antivirotik. Za úspěšně zvládnutou exacerbaci považujeme stav, při němž se pacient po dechové stránce dostane na svou dlouhodobou normu.
Table 4. Doporučená perorální ATB léčba – minimálně 14 dnů. 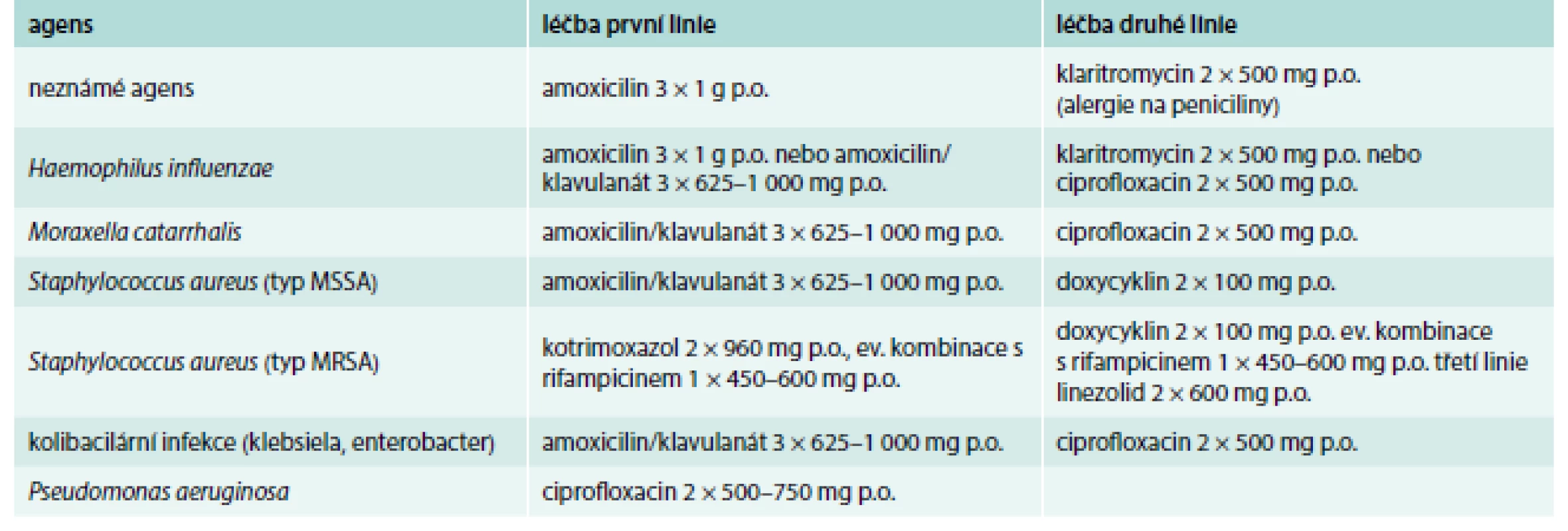
Upraveno podle [1] Eradikační léčba infekce Pseudomonas aeruginosa
Jak již bylo opakovaně zdůrazněno, chronická kolonizace Pseudomonas aeruginosa je u pacientů s non-CF BE asociovaná s častějšími exacerbacemi, rychlejším poklesem plicních funkcí, vyšší mortalitou a horší kvalitou života. Z těchto důvodů je doporučeno pokusit se o eradikaci prvozáchytu Pseudomonas aeruginosa v DC s cílem zabránit rozvoji chronické infekce (tab. 5).
Table 5. Schéma eradikace prvozáchytu Pseudomonas aeruginosa. 
Upraveno podle [1] Inhalační ATB k eradikaci nebo supresi infekce Pseudomonas aeruginosa
Výběr antibiotika k inhalační léčbě Pseudomonas aeruginosa se řídí výsledkem citlivosti na ATB.
Klinické studie prokázaly bezpečnost a efektivitu léčby inhalačním kolistinem, tobramycinem i gentamycinem [7,14,15]. Žádné z těchto ATB zatím nemá v ČR schválenou indikaci k léčbě pacientů s non-CF bronchiektáziemi. V praxi lze použít inhalační kolistin 2 MIU ve 4 ml aqua pro injectione 2krát denně, tato léčba podléhá schválení lokálního antibiotického střediska. K inhalační ATB léčbě je nutno používat kompresorové inhalátory. Před zahájením inhalační terapie ATB je vhodné posoudit, zda aplikace léku nevede k bronchospazmu, tj. provést spirometrii před podáním léku a pak 15 a 30 min po aplikaci inhalačního ATB. Při klinických projevech bronchospazmu či poklesu FEV1 o > 15 % a > 200 ml je doporučeno před aplikací samotného inhalačního ATB podat salbutamol (v nebulizaci či ve formě dozovaného aerosolu). Následující den je vhodné zkontrolovat, zda bronchospazmus přetrvává i při aplikaci salbutamolu před podáním inhalačního ATB. Pokud je bronchospazmus přítomen i po přípravě bronchodilatačním lékem, je doporučeno vybrat alternativní ATB léčbu.
Dlouhodobá perorální ATB léčba
Cyklické střídání perorálních ATB dle výsledků předchozích kultivací a citlivosti sputa (či bronchiálního výplachu) lze zvážit u pacientů, kteří mají časté (≥ 3 za 1 rok) nebo těžké (s pobytem v nemocnici) exacerbace [1,3]. Dlouhodobá terapie fluorochinolony se vzhledem k jejich nežádoucím účinkům a vzniku rezistence spíše nedoporučuje. Naopak dlouhodobá léčba perorálními makrolidy působí kromě antibakteriálního efektu také prostřednictvím jejich protizánětlivého a imunomodulačního efektu (popsána níže).
Protizánětlivá léčba
Jelikož podstatou bronchiektázií je zánět bronchiální stěny a infekce dýchacích cest, jeví se tedy jako přirozené, že součástí komplexní terapie bronchiektázií by měla být také protizánětlivá léčba, jejímž cílem by vedle ovlivnění zánětu (převážně neutrofilního) byla také modulace imunitní odpovědi bronchiální sliznice na chronickou infekci. Na druhé straně, protizánětlivé působení musí být při léčbě bronchiektázií natolik vyvážené, aby nevedlo ke vzniku či aktivaci bakteriálních a oportunních infekcí. V souvislosti s protizánětlivou léčbou u bronchiektázií probíhají klinické studie k využití statinů, biologické léčby či nesteroidních antirevmatik. V současnosti lze konstatovat, že pro dlouhodobé využití specifické protizánětlivé léčby zatím chybí dostatek informací (bude třeba čekat na výsledky dalších randomizovaných studií dlouhodobého charakteru) [1,9].
Kortikosteroidy mají sice dobrý protizánětlivý účinek u eozinofilního zánětu, avšak podstatně neovlivňují neutrofilní zánět, který je obvykle dominantně přítomen u non-CF BE. Dosud bylo provedeno několik studií, které sledovaly účinek inhalačních kortikosteroidů (IKS) u pacientů s bronchiektáziemi, navíc jen s malými počty zařazených pacientů. Např. inhalační flutikazon podávaný v dávce 1 000 μg denně dospělým pacientům s bronchiektáziemi, sice vedl ke snížení množství sputa a zmírnění dušnosti, ale nedošlo ke zlepšení kašle, plicních funkcí ani ke snížení počtu exacerbací, naopak byl již po 4 týdnech terapie zjištěn nárůst množství bakterií ve sputu, včetně Pseudomonas aeruginosa [1]. V současné době není dostatek důkazů, které by prokázaly léčebný přínos inhalačních kortikosteroidů u pacientů s non-CF bronchiektáziemi ani průkazů jejich bezpečnosti (riziko vzniku pneumonií a jiných bakteriálních či mykotických infekcí v terénu chronického zánětu dýchacích cest a hyperprodukce hlenů) [22–24]. Léčbu inhalačními kortikosteroidy u pacientů s bronchiektáziemi tedy v současné době nelze doporučit. Výjimkou mohou být pacienti, kteří vedle bronchiektázií mají bronchiální astma; v takových případech je však nutno pečlivě sledovat výskyt případných infekčních komplikací, případně u osob s překryvem CHOPN a non-CF BE v případě, že je současně přítomná zjevná tendence k opakovaným exacerbacím eozinofilního typu. Systémové kortikosteroidy nejsou u pacientů s bronchiektáziemi pro dlouhodobé použití indikovány, lze je použít pouze v případě terapie exacerbací nebo krátkodobé léčby ABPA (alergické bronchopulmonární aspergilózy) v terénu non-CF bronchiektázií [1].
Perorální makrolidy mají v léčbě non-CF svoje důležité místo. Perorálně podávaný azitromycin redukuje exacerbace a zlepšuje kvalitu života a mírně zlepšuje i plicní funkce (FEV1). Perorálně podávaný erytromycin také redukuje výskyt exacerbací. Dlouhodobou protizánětlivou a imunomodulační léčbu makrolidy (celosvětově nejčastěji používán azitromycin po dobu 6–12 měsíců v dávce 250 mg nebo 500 mg 3krát týdně) lze zvážit u pacientů s častými exacerbacemi non-CF BE (≥ 3 za rok), dále s exacerbacemi a přetrvávající zhoršenou kvalitou života navzdory adekvátní léčbě a rovněž při chronické infekci Pseudomonas aeruginosa. Určitým rizikem této (z plicního pohledu efektivní) terapie je rozvoj rezistence na makrolidy, vznik hepatopatie, špatná gastrointestinální tolerance a popisován je i výskyt kardiovaskulárních komplikací (arytmie při prodloužení QT intervalu) a poruchy sluchu. Nutné jsou rovněž kontroly respiračních sekretů na přítomnost netuberkulózních mykobakterií (základem jejich léčby jsou totiž makrolidy). Po uplynutí období 6–12 měsíců je vždy třeba individuálně rozhodnout o pokračování v léčbě s ohledem na přínosy, rizika a toleranci makrolidového léku [1,6,11].
Inhalační antibiotika pro dlouhodobé podávání u nemocných ve stabilní fázi non-CF BE (s cílem protizánětlivého působení) jsou ve středu zájmu současného výzkumu. Aktuální metaanalýza 26 studií (1 898 nemocných) ukázala, že studie s inhalačním tobramycinem a inhalačním ciprofloxacinem shodně prokazují potenciál redukovat množství bakterií Pseudomonas aeruginosa ve sputu, nicméně není schopna příznivě ovlivnit exacerbace, hospitalizace, plicní funkce ani kvalitu života [22–26]. Studie s inhalačně podávaným gentamycinem kromě redukce bakteriální nálože ve sputu zlepšuje kvalitu života a redukuje exacerbace, nicméně ani gentamycin nemá žádný přínos pro plicní funkce. Rovněž inhalovaný kolimycin kromě redukce bakteriální denzity snižuje výskyt exacerbací a kvalitu života. Inhalačně podávaný aztreonam nepřináší žádný pozitivní výsledek ve výše uvedených klinických parametrech. Navíc u inhalovaných antibiotik bylo potvrzeno výše uvedené riziko bronchospazmu zejména u tobramycinu a aztreonamu [11,14,15,22–26].
Antileukotrieny nejsou u pacientů s bronchiektáziemi indikovány [1].
Bronchodilatační léčba
Inhalační bronchodilatační terapie (formoterol, indakaterol, tiotropium a další dlouhodobě působící léky) je indikována u pacientů s přítomností bronchiální obstrukce (potvrzené funkčním vyšetřením), u kterých vede ke snížení kašle a k omezení pocitu dušnosti. V případě bronchospazmů (jako projevu bronchiální hyperreaktivity) při léčbě inhalačními mukolytiky či ATB se doporučuje preventivní podání krátkodobě působícího salbutamolu před inhalacemi výše uvedených farmak. Perorální retardované teofyliny lze u pacientů s BE použít jako doplněk k inhalační bronchodilatační léčbě (viz výše), nejsou ale doporučovány k paušálnímu užívání [1,9].
Léčba základní příčiny vyvolávající non-CF BE
V případě zjištěni kurabilního základního onemocnění, které podminuje vznik non-CF BE, je v rámci snahy o zabránění progrese tohoto onemocnění nutná mezioborová spolupráce: imunolog, revmatolog, gastroenterolog, centrum pro deficit A1AT (Thomayerova nemocnice Praha), CF centra (FN Motol Praha, FN Brno, FN Hradec Králové, FN Olomouc a FN Plzeň).
Chirurgická léčba
Chirurgické metody vyhrazujeme pro případy přísně lokalizovaného postižení (např. pozánětlivé non-CF BE postihující pouze jeden plicní lalok nebo jeho část), u nichž selhává farmakologická léčba a pacient má perzistující klinické potíže, které negativně ovlivňují kvalitu jeho života (recidivující respirační infekce s obtěžující chronickou produkci purulentního sputa, opakovaná hemoptýza pocházející z non-CF BE, perzistující plicní absces v okolí non-CF BE, výrazný zápach z úst podmíněný non-CF BE). Nejlepší výsledky resekce mají pacienti s jednostranným segmentálním postižením, u kterých je možná kompletní resekce postiženého plicního laloku [1]. Neanatomické resekce by neměly být prováděny, protože někdy vedou k nekompletnímu odstranění postižené části plíce. Chirurgická resekce z indikace non-CF BE se obvykle provádí z laterální torakotomie, při rozsáhlejší resekci z posterolaterální torakotomie. Videotorakoskopie (VATS) se v současné době používá pouze u menší části resekcí. Vzácnou indikací k chirurgické resekci může být i masivní hemoptýza nezvládnutelná předchozí léčebnou embolizací bronchiální tepny (neboli BAE), či recidivující hemoptýza, která je v kauzální souvislosti s lokalizovaným postižením plíce při non-CF BE.
Léčba v terminálních fázích onemocnění
V případě chronické hypoxemické respirační insuficience zajištujeme dlouhodobou domácí oxygenoterapii (neboli DDOT) pomocí stacionárních či přenosných koncentrátorů kyslíku. Chronické respirační selhání s hyperkapnií je pak indikací k domácí neinvazivní ventilační podpoře (neboli NIPV) aplikované často spolu s výše uvedenou DDOT. Oba léčebné postupy (DDOT a NIPV) sice nesnižují mortalitu non-CF BE pacientů, ale byl prokázán jejich příznivý efekt na zlepšení kvality života a na redukci počtu akutních hospitalizací. Mladší pacienty (< 65 let) s těžce omezenými plicními funkcemi (FEV1 pod 30 % normy nebo s rychlým poklesem FEV1) a s dalšími projevy (častými exacerbacemi vyžadujícími ATB léčbu, případně s neustupujícím pneumotoraxem nebo s hemoptýzou nezvládnutelné embolizací bronchiálních tepen) je teoreticky možné konzultovat v transplantačním centru FN v Motole v Praze k posouzení indikace k plicní transplantaci (non-CF BE však představují spíše marginální indikaci v oblasti transplantace plic).
Lázeňská terapie
Pacienti s BE mají nárok na komplexní lázeňskou péči dle kategorie V/4 (nejčastěji v Luhačovicích, v Karlově Studánce nebo Jeseníku). Efekt lázeňské terapie je zejména v možnosti dlouhodobé a efektivní edukace inhalační techniky a všech způsobů optimální hygieny DDC.
Dispenzarizace pneumologem
Pacienti postiženi non-CF BE v souvislosti s primárním imunodeficitem, primární ciliární dyskinezou (PCD), revmatoidní artritidou (RA), alergickou bronchopulmonální aspergilózou (ABPA), a všichni nemocní s rychlým poklesem (deklinací) plicních funkcí nebo ti s četnými infekčními exacerbacemi, by měli mít 4krát v roce vyšetřeny plicní funkce a 2–4krát v roce mikrobiologické vyšetření sputa. U ostatních se četnost kontrol řídí individuálně jejich klinickým stavem: u většiny lehčích forem onemocnění postačuje vyšetření plicních funkcí a kultivace sputa jednou za 6 či spíše 12 měsíců.
Závěr
Bronchiektázie nemocných bez přítomnosti cystické fibrózy (tzv. non-CF BE) nejsou ani v rozvinutých zemích Evropy žádnou vzácností. Jejich symptomy se částečně překrývají s projevy dalších respiračních onemocnění, a proto mohou v reálném životě často uniknout pozornosti lékařů i nemocných. Základní diagnostickou metodou je v současnosti výpočetní tomografie s vysokým rozlišením. Terapie non-CF BE zahrnuje zejména intervence směřující k řešení kauzální příčiny non-CF BE a pečlivou toaletu dolních dýchacích cest spolu s podáváním mukoaktivních (mukolytických) farmak. Paušální přínos vakcinace je obdobný jako u pacientů s CHOPN. Protizánětlivá medikace nemá zcela jasnou oporu v klinických studiích. Nejpravděpodobnější se v této oblasti jeví přínos perorálně podávaného azitromycinu. Někteří nemocní mohou profitovat z chirurgické léčby. Komplikace spojené se závažnou hemoptýzou můžeme řešit angiograficky. Rovněž dlouhodobá domácí oxygenoterapie, domácí neinvazivní ventilační podpora a případná transplantace plic u osob bez absolutních kontraindikací jsou dalšími modalitami dostupnými pro každého pacienta sledovaného s non-CF BE v České republice.
MUDr. Vladimír Koblížek, Ph.D.
vladimir.koblizek@fnhk.cz
Plicní klinika LF UK a
FN Hradec Králové
www.fnhk.cz
Doručeno do redakce 17. 9. 2017
Přijato po recenzi 26. 9. 2017
Sources
1. Pasteur MC, Bilton D, Hill AT. British Thoracic Society guideline for non-CF bronchiectasis. Thorax 2010; 65(7): 577. Dostupné z DOI: <http://dx.doi.org/10.1136/thx.2010.142778>.
2. Weycker D, Edelsberg J, Oster G et al. Prevalence and economic burden of bronchiectasis. Clin Pulm Med 2005; 12(4): 205–209.
3. EMBARC – The European Bronchiectasis Registry. Dostupné z WWW: <https://www.bronchiectasis.eu/>.
4. Chalmers JD, Goeminne P, Aliberti S et al. The Bronchiectasis Severity Index An International Derivation and validation Study. Am J Respir Crit Care Med 2014; 189(5): 576–585. Dostupné z DOI: <http://dx.doi.org/10.1164/rccm.201309–1575OC>.
5. Martinez-Garcia MA, de Gracia J, Vendrell Relat M et al. Multidimensional approach to non-cystic fibrosis bronchiectasis: the FACED score. Eur Respir J 2014; 43(5): 1357–1367. Dostupné z DOI: <http://dx.doi.org/10.1183/09031936.00026313>.
6. Saleh AD, Hurst JR. How to assess the severity of bronchiectasis. Eur Respir J 2014; 43(5): 1217–1219. Dostupné z DOI: <http://dx.doi.org/10.1183/09031936.00226913>.
7. Haworth CS, Foweraker JE, Wilkinson P et al. Inhaled Colistin in Patients with Bronchiectasis and Chronic Pseudomonas aeruginosa Infection. Am J Respir Crit Care Med 2014; 189(8): 975–982. Dostupné z DOI: <http://dx.doi.org/10.1164/rccm.201312–2208OC>.
8. Doporučení české vakcinologické společnosti pro pneumokokovou vakcinaci v dospělosti [online] aktualizováno 16.dubna 2013. Dostupné z WWW: <http://www.linkos.cz/aktualne-odbornikum/doporuceni-ceske-vakcinologicke-spolecnosti-pro-pneumokokovou-vakcinaci-v-dospelosti/>.
9. Floto RA, Haworth CS. Bronchiectasis. European Respiratory Monograph; 52. European Respiratory Society Journals: 2010. ISBN 978–1849840118.
10. Alteburg J, Wortel K, de Graaff CS et al. Validation of visual analogue score (LRTI-VAS) in non-CF bronchiectatis. Clin Respir J 2016; 10(2): 168–175. Dostupné z DOI: <http://dx.doi.org/10.1111/crj.12198>.
11. Zemánková J, Stříž I. Imunomodulační účinky makrolidových antibiotic. Alergie 2012; 14(4): 271–281.
12. Martinez-Garcia MA, Soler-Cataluna JJ, Perpina-Tordera M et al. Factors associated with lung function decline in adult patients with stable non-cystic fibrosis bronchiectasis. Chest 2007; 132(5): 1565–1572.
13. Loebinger MR, Wells AU, Hansell DM et al. Mortality in bronchiectasis: a long-term study assessing the factors influencing survival. Eur Respir J 2009; 34(4): 843–849. Dostupné z DOI: <http://dx.doi.org/10.1183/09031936.00003709>.
14. Murray MP, Govan JRW, Docherty CJ et al. A randomised controlled trial of nebulised gentamicin in non-cystic fibrosis bronchiectasis. Am J Respir Crit Care Med 2011; 183(4): 491–499. Dostupné z DOI: <http://dx.doi.org/10.1164/rccm.201005–0756OC>.
15. Barker AF, Couch L, Fiel SB et al. Tobramycin solution for inhalation reduces sputum Pseudomonas aeruginosa density in bronchiectasis. Am J Respir Crit Care Med 2000; 162(2 Pt 1): 481–485.
16. Spruit, MA, Singh SJ, Garvey C et al. An official American Thoracic Society/European Respiratory Society statement: Key concepts and advances in pulmonary rehabilitation. Am J Respir Crit Care Med 2013; 188(8): e13-e64. Dostupné z DOI: <http://dx.doi.org/10.1164/rccm.201309–1634ST>. Erratum in Am J Respir Crit Care Med. 2014; 189(12): 1570.
17. Bolton CE, Blakey JD, Morgan MD. British Thoracic Society guidelines on pulmonary rehabilitation in adults: your opinion is noted. Thorax 2014; 69(4): 388–389. Dostupné z DOI: <http://dx.doi.org/10.1136/thoraxjnl-2013–204754>.
18. Smolíková L, Máček M. Respirační fyzioterapie a plicní rehabilitace. Národní centrum ošetřovatelství a nelékařských zdravotnických oborů: Brno 2010. ISBN 978–80–7013–527–3.
19. Neumannová K, Zatloukal J, Koblížek V et al. Doporučený postup pro plicní rehabilitaci. 2014. Dostupné z WWW: <http://www.pneumologie.cz/guidelines/>.
20. Kim SJ, Im JG, Kim IO et al. Normal bronchial and pulmonary arterial diameters measured by thin section CT. J Comput Assist Tomogr 1995; 19(3): 365–369.
21. Hansell DM, Bankier AA, MacMahon H et al. Fleischner Society: glossary of terms for thoracic imaging. Radiology 2008; 246(3): 697–722. Dostupné z DOI: <http://dx.doi.org/10.1148/radiol.2462070712>.
22. Tsang KW, Tan KC, Ho PL et al. Inhaled fluticasone in bronchiectasis: a 12 month study. Thorax 2005; 60(3): 239–243.
23. Martinez-Garcia MA, Perpina-Tordera M, Roman-Sanchez P et al. Inhaled steroids improve quality of life in patients with steady-state bronchiectasis. Respir Med 2006; 100(9): 1623–1632.
24. Kapur N, Bell S, Kolbe J et al. Inhaled steroids for bronchiectasis. Cochrane Database Syst Rev 2009; (1): CD000996. Dostupné z DOI: <http://dx.doi.org/10.1002/14651858.CD000996.pub2>.
25. Henkle E, Aksamit TR, Barker AF et al. Pharmacotherapy for Non-Cystic Fibrosis Bronchiectasis: Results From an NTM Info & Research Patient Survey and the Bronchiectasis and NTM Research Registry. Chest. 2017. pii: S0012–3692(17)30810–3. Dostupné z DOI: <http://dx.doi.org/10.1016/j.chest.2017.04.167>.
26. Fjaellegaard K, Sin MD, Browatzki A et al. Antibiotic therapy for stable non-CF bronchiectasis in adults – A systematic review. Chron Respir Dis 2017; 14(2): 174–186. Dostupné z DOI: <http://dx.doi.org/10.1177/1479972316661923>.
27. Hurst JR, Elborn JS, De Soyza A. [BRONCH-UK Consortium]. COPD – bronchiectasis overlap syndrome. Eur Respir J 2015; 45(2): 310–313. Dostupné z DOI: <http://dx.doi.org/10.1183/09031936.00170014>.
28. Panda A, Bhalla AS, Goyal A. Bronchial artery embolization in hemoptysis: a systematic review. Diagn Interv Radiol 2017; 23(4): 307–317. Dostupné z DOI: <http://dx.doi.org/10.5152/dir.2017.16454>.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2017 Issue 11-
All articles in this issue
- Cílené vyhledávání nemocných s chronickou obstrukční plicní nemocí: stručný přehled
- Asthma bronchiale v kontextu vnitřního lékařství
- Diagnostika a léčba komunitní pneumonie – v jednoduchosti je klíč k úspěchu
- Nozokomiální pneumonie
- Pneumonie u imunokompromitovaných
- Idiopatická plicní fibróza. Umíme ji vždy správně diagnostikovat a léčit?
- Exogenní alergické alveolitidy: minimum pro praxi
- Sarkoidóza – nadále záhadné onemocnění
- Současný přístup k diagnostice, léčbě a prevenci tuberkulózy
-
Non-CF bronchiektázie dospělých: stručný přehled pro praxi
Dokument Sekce chorob s bronchiální obstrukcí České pneumologické a ftizeologické společnosti České lékařské společnosti J. E. Purkyně - Cystická fibróza dospělých
- Kardiovaskulární riziko spánkové apnoe a kazuistika
- Komplikace po transplantaci plic
- Nemalobuněčný karcinom plic
- Malobuněčný karcinom plic: epidemiologie, diagnostika a léčba
- Maligní mezoteliom pleury – dosud nepokořený nádor
- Spirometrie – základní vyšetření funkce plic
- Postavení bronchologie v pneumologické diagnostice
- Ultrasonografické vyšetření hrudníku v rukou lékaře klinika
- Neinvazivní ventilace
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Spirometrie – základní vyšetření funkce plic
- Neinvazivní ventilace
- Pneumonie u imunokompromitovaných
- Malobuněčný karcinom plic: epidemiologie, diagnostika a léčba
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

