-
Medical journals
- Career
Asthma bronchiale v kontextu vnitřního lékařství
Authors: Milan Teřl
Authors‘ workplace: Klinika pneumologie a ftizeologie LF UK a FN v Plzni
Published in: Vnitř Lék 2017; 63(11): 757-769
Category: Reviews
Úvodem poněkud kacířské tvrzení: astma je dnes „dobrá diagnóza“. Na rozdíl od ostatních nemocí a stavů, které nejčastěji navozují potíže dušnosti – jimiž jsou levostranná srdeční slabost při kardiovaskulárních onemocněních, dekondice (často spojená s obezitou) a chronická obstrukční plicní nemoc (CHOPN) – dokáží současné léčebné možnosti v případě astmatu dostat pod plnou kontrolu, tj. zbavit veškerých potíží a zabránit nepříznivému vývoji, více než 95 % nemocných [1].
Overview
Článek se snaží podat moderní pohled na etiopatogenezi astmatu, jeho diagnostiku a léčbu. Akcentovány jsou nové diagnostické a terapeutické možnosti, styčné plochy s ostatními interními obory a pragmatická doporučení pro každodenní praxi.
Klíčová slova:
alergie – asthma bronchiale – diagnostika – eozinofilie – fenotypicky cílená léčba – heterogenita – paušální stupňovitá farmakoterapie – vnitřní lékařstvíÚvod
Úvodem poněkud kacířské tvrzení: astma je dnes „dobrá diagnóza“.
Na rozdíl od ostatních nemocí a stavů, které nejčastěji navozují potíže dušnosti – jimiž jsou levostranná srdeční slabost při kardiovaskulárních onemocněních, dekondice (často spojená s obezitou) a chronická obstrukční plicní nemoc (CHOPN) – dokáží současné léčebné možnosti v případě astmatu dostat pod plnou kontrolu, tj. zbavit veškerých potíží a zabránit nepříznivému vývoji, více než 95 % nemocných [1].
Plné kontroly nad astmatem lze přitom dosáhnout v zásadě jednoduchou léčbou zatíženou minimem nežádoucích účinků a lékových interakcí.
Výše uvedená tvrzení ovšem platí pouze za těchto situací:
- astma je správně a důsledně diagnostikováno a v návaznosti poté
- adekvátně léčeno [2]
Reálná situace je tomuto stavu vzdálená. Potížemi trpí více než polovina astmatiků, třetina má potíže natolik výrazné, že omezují jejich každodenní aktivity, a čtvrtina zažívá těžké, někdy až život ohrožující exacerbace [1,3].
Článek se snaží podat moderní pohled na etiopatogenezi astmatu, jeho diagnostiku a léčbu. Akcentovány jsou nové diagnostické a léčebné možnosti, styčné plochy s ostatními interními obory a pragmatická doporučení pro každodenní interní praxi.
Etiopatogeneze a klinický obraz astmatu, styčné plochy s kardiologií
V myslích některých lékařů podnes panuje představa, že astma je akutní záchvatové alergické onemocnění projevující se při expozici alergenům náhlými stavy dušnosti, které je potřeba rychle a razantně léčit, přičemž po odeznění akutních záchvatů je astmatik „zdráv“ – analogicky jako např. alergik na včelí jed. Akutní stavy dušnosti jsou však pouze pověstným vrcholem ledovce chronického onemocnění.
Astma jako chronické zánětlivé (a ne pouze záchvatové) onemocnění
Podstatou astmatu je chronický zánět průduškové stěny. Zánět mívá nejčastěji eozinofilní charakter a bývá navozen – ne však vždy – IgE mediovanými alergickými mechanizmy [4]. Nejklasičtější forma astmatu, asi 60–80 % případů, vzniká (anebo je předcházena jinými projevy alergie) již v dětském věku, v rámci tzv. atopického pochodu. S přibývajícím věkem, a tehdy, propukne-li astma v pozdějším věku, bývá role klasických alergií méně významná a u řady astmatiků nehrají alergie žádnou roli. Z nealergických příčin astmatu jsou diskutovány, ne však jednoznačně potvrzeny některé chronické infekce (RS viry, chlamydie, mykoplazmata, superantigeny stafylokoků) a dále četné chemické polutanty zevního i vnitřního prostředí (často v rámci profesní expozice), spojené s tzv. westernizací našeho života s komplexními dopady na náš imunitní systém. Výsledný zánětlivý profil již nemusí mít eozinofilní charakter, vždy je však spojen s bronchiální hyperreaktivitou [1,2,4].
Astmatický zánět postihuje průduškovou stěnu ve všech etážích bronchiálního stromu, tj. průdušky všeho kalibru, nealteruje však – na rozdíl od CHOPN – plicní intersticium [4]. V případě CHOPN je přítomen neutrofilní typ zánětu postihující a destruující i plicní parenchym/intersticium, jehož důsledkem je emfyzém spojený se ztrátou elastického tahu plicní tkáně, významně přispívající k ireverzibilitě bronchiální obstrukce. Základní vodítko k diferenciální diagnóze astmatu versus CHOPN přináší (schéma 1).
U některých astmatiků dominuje postižení periferních průdušek – hovoříme o tzv. SAD (small airway disease) – s významnými klinickými konsekvencemi, včetně potenciálního vlivu na funkci levého srdce (viz dále) [2,5].
Již samotný zánětlivý proces průduškové stěny vede k pozvolnému zúžení lumina dýchacích cest. Tyto změny jsou z velké části reverzibilní a v různé míře potencované přítomností dyskrinie, tj. zvýšenou produkcí nebo vazkostí hlenu. Současně však přítomnost perzistujícího zánětu významně zvyšuje pohotovost k akutním spazmům svaloviny průdušek na nejrůznější podněty (tzv. triggery, spouštěče), které by samy o sobě bronchospazmus nevyvolaly, tj. nastoluje výraznou bronchiální hyperreaktivitu (BHR) [1,6,7].
Typickými endogenními triggery jsou např. menstruace, psychická tenze a stres, gastroezofageální reflux. Typickými zevními triggery – vedle alergenů, které představují jak induktory zánětu, tak triggery bronchospazmu – jsou respirační (hlavně virové) infekce, tabákový kouř, polutanty (zvláště ozón, SOx a jiné produkty spalování uhlí a zvláště dieselových motorů, výpary chemických látek), klimatické vlivy atp. Komplexním triggerem je fyzická námaha, při níž hyperventilace navodí desikaci a ochlazení průduškové stěny – akutní bronchospazmus se většinou dostaví až 5–7 min po ukončení námahy, až pomine protektivní vliv sympatotonu a cirkulujících katecholaminů. Mezi sportovci jsou díky chladové expozici nejčastěji postiženi běžci na lyžích. Hovoříme o námahou indukované bronchokonstrikci/astmatu (exercise induced asthma – EIA) [1,6,7]. Specifickými triggery se mohou stát aspirin a jiné nesteroidní protizánětlivé léky (nonsteroidal anti-inflammatory drugs NSAID) – důvodem je „překlopení“ metabolizace kyseliny arachidonové od protektivních prostaglandinů k bronchokonstrikčně působícím leukotrienům blokací cyklooxygenázy 1 (COX-1 inhibitory). U labilních astmatiků s výraznou BHR mohou svou farmakologickou aktivitou působit jako trigger některé méně selektivní betablokátory (BB). Vzácně mohou jako trigger bronchokonstrikce (mnohem častěji pak jako příčina dráždivého kašle) působit ACE inhibitory: důvodem je skutečnost, že inhibují nejen konverzi angiotenzinu I na angiotenzin II, ale i metabolizaci jiných peptidů (biogenních aminů), které mají bronchokonstrikční, resp. prozánětlivý potenciál (bradykinin, serotonin atp) [7].
Dušnost a pískoty jako nejtypičtější a současně nejvíce zavádějící klinické projevy astmatu
Důsledky permanentního zánětu průdušek (zánětlivý edém a remodelace, dyskrinie a bronchospazmus) jsou v klinickém obraze podkladem základních projevů nemoci, které se v měnlivých proporcích a intenzitě kombinují:
- různě vnímaná a interpretovaná chronická dušnost, zprvu jen námahová, později až klidová
- dráždivý kašel, většinou suchý, event. spojený s obtížnou expektorací a pískoty na hrudi
- akutní stavy dušnosti, dříve označované jako astmatický záchvat
Kardiální vs bronchiální dušnost
Dušnost je subjektivní pocit nedostatku vzduchu vycházející především z uvědomění si zvýšeného dechového úsilí, které za normálních okolností nevnímáme. Dechové úsilí je vlastně práce, kterou jedinec vykonává k zajištění ventilace – u zdravého člověka práce dýchacích svalů spotřebovává v klidu pouze asi 3 % energetického výdeje. V případě patologické dušnosti si pacient uvědomuje neadekvátnost dechového úsilí/práce dané situaci, uvědomuje si, že na dýchání vynakládá více energie, než je jeho dosavadní zkušenost – dechová práce může u některých astmatiků již v klidu přesahovat 50 % energetického výdeje [8].
Až potud je situace v případech kardiální i bronchiální příčiny dušnosti obdobná, v dalším však odlišná.
Dušnost navozená bronchiální obstrukcí má totiž zcela jiný „fyzikální“ podklad než dušnost navozená levostrannou srdeční slabostí a při detailnější analýze bývá pacienty i odlišně vnímána a interpretována.
V případě kardiální dušnosti je zvýšená dechová práce potřebná především k překonání zvýšeného tzv. elastického odporu plic navozeného kardiálním edémem. Nemocný si uvědomuje zvýšené inspirační úsilí, výdech zůstává pasivní.
V případě nemocí s bronchiální obstrukcí je zvýšená dechová práce potřebná především k překonání zvýšených tzv. proudových odporů dechových cest, které se dále zvyšují při deflaci plíce. Nemocný si uvědomuje nejen zvýšené inspirační, ale především exspirační úsilí [2,8].
Pískoty na hrudi vs „tichá plíce“
Pískoty a vrzoty jsou uváděny jako typický poslechový nález u astmatu, nejsou však nálezem patognomickým – nemusí být přítomny při každém vyšetření a vyskytují se i u jiných diagnóz.
Vznikají především v místech nehomogenní obstrukce, kde dochází při dostatečně rychlém proudění vzduchu k jeho turbulenci.
Pískoty pravidelně chybějí při menším stupni bronchiální obstrukce, mohou však chybět i u jejích nejtěžších forem – buď proto, že je obstrukce homogenní nebo u vyčerpaných nemocných, u nichž je proudění vzduchu již tak pomalé, že není schopno vyvolat turbulenci. Podezření na průduškovou dušnost v těchto případech musí vzbudit charakter dušnosti (viz výše) a prodloužené exspirium. Významným pomocníkem v těchto případech je poslech pacienta během manévru usilovného výdechu – „tichá plíce“ se v důsledku zrychleného proudění vzduchu „rozehraje“ [2].
Vedle jiných onemocnění průdušek (bronchiektázie, cystická fibróza) se pískoty mohou vzácněji vyskytovat i v případě kardiálních onemocnění – zúžení lumina bronchů může být navozeno kongescí bronchiální stěny (při srdeční slabosti) nebo reflexně (v případě plicní embolizace) [2].
Astmatický záchvat vs exacerbace
Klinický průběh astmatu v čase osciluje s výraznou intraindividuální a interindividuální variabilitou. V této souvislosti, pokud dochází k významné undulaci projevů, se často směšují pojmy astmatický záchvat a exacerbace.
Astmatický záchvat znamená rychlé zhoršení nebo náhlé objevení dechových potíží, především dušnosti, exacerbace zhoršení příznaků nad rámec běžného kolísání, trvající minimálně 2 dny – je zřejmé, že hranice není ostrá [2].
S jistou mírou zjednodušení lze říci, že patofyziologickým podkladem astmatického záchvatu je především bronchokonstrikce, podkladem exacerbace pak amplifikace zánětu.
Klasický astmatický záchvat je představován izolovanou příhodou, která se objeví z plného zdraví, bez předchozí chronické dušnosti – např. po prvé cigaretě v životě, vykouřené pylovým alergikem na začátku pylové sezony/prázdnin. U takového „sezonního“ astmatika bude na začátku pylového období přítomen pouze malý stupeň zánětu a cigaretou navozená bronchokonstrikce rychle ustoupí – spontánně nebo po bronchodilatační léčbě.
Naproti tomu exacerbaci většinou předchází různě dlouhá perioda měnlivé chronické dušnosti, navozené z velké části zánětlivým edémem. Extrémem je těžká exacerbace vyžadující systémovou kortikoterapii [1,2].
Asthma bronchiale vs asthma cardiale
Praxe interní medicíny často přináší problémy při posouzení, zda za příčinou aktuálních dechových potíží pacienta stojí asthma cardiale nebo asthma bronchiale, zahrnující v širším (zvláště americkém) pojetí i CHOPN – tj. nemoci s bronchiální obstrukcí. Nejsložitější je situace při kombinaci, resp. overlapu uvedených stavů, resp. onemocnění – někdy je skutečným uměním posoudit, která příčina/nemoc je u konkrétního pacienta v daný moment přítomna, resp. je určující.
Specifickou situaci představuje astma s dominujícím postižením malých dýchacích cest (small airway disease – SAD) vedoucí k plicní hyperinflaci, s možnými důsledky na funkci levého srdce [5,9].
Významné postižení malých dýchacích cest je typické především pro CHOPN [10]. Při výdechu se zmenšuje celkový objem plic a v oblasti nejmenších průdušek, jejichž lumen je zánětlivým procesem výrazně zúženo, může docházet k jejich uzávěru. Tendence k uzávěru je v případě CHOPN potencována kolapsem průdušinek – příčinou je ztráta tzv. elastického tahu (elastic recoil) plic při emfyzému. Pro ilustraci: při klidném dýchání nemocný nadechne každým vdechem 500 ml, ale vydechne např. 498 ml. Opakování této situace navozuje různý stupeň plicní hyperinflace.
Hyperinflace se v různé míře objevuje i u těžších astmatiků a významně progreduje především při námaze/hyperventilaci, při níž přistupuje i nedostatek času k exspiriu – hovoříme o tzv. dynamické plicní hyperinflaci [10].
„Více plic pak znamená méně srdce“, a to nejen obrazně, ale i patofyziologicky. Plicní hyperinflace brání normálnímu venóznímu návratu a relaxaci levé komory, a může tak potencovat (nebo i navodit?) diastolickou dysfunkci levé komory. Pokud je v rámci diferenciální diagnostiky dušnosti takový nemocný kardiologicky vyšetřen pouze k posouzení systolické ejekční frakce LK, výsledek bývá normální. Podnětem k detailnějšímu vyšetření funkce levého srdce v diastole (dnes nejlépe metodou tkáňového dopplerovského vyšetření, tzv. tissue doppler imaging – TDI) by měl v těchto situacích být výsledek zvýšených hodnot natriuretických peptidů. Jejich koncentrace výrazně stoupá i při izolovaném diastolickém srdečním selhání. Cennější, zvláště u starších pacientů, se jeví vyšetřování BNP než NT-proBNP. V případě akutní dušnosti hodnoty BNP ≤ 100 pg/ml s velkou spolehlivostí vylučují její kardiální příčinu, v případě chronické dušnosti naopak hodnoty ≥ 50 pg/ml signalizují pravděpodobnou kardiální (spolu)příčinu dušnosti [9,11].
Praktické konsekvence pro klinickou praxi:
- astma není výhradně ani záchvatové, ani alergické onemocnění
- ani opakovaně normální poslechový nález na plicích nevylučuje přítomnost astmatu
- intenzita pískotů na hrudi nekoresponduje s tíží bronchiální obstrukce
- astma a CHOPN jsou 2 zásadně odlišné nemoci s odlišnou etiopatogenezí, diagnostickými atributy, léčbou i prognózou
- prvým krokem k odlišení kardiální vs bronchiální dušnosti je analýza jejího charakteru a fyzikální nález
- těžké formy astmatu spojené s hyperinflací mohou mít významný vliv na funkci levého srdce
Diagnostika astmatu
Diagnóza astmatu bývá „doživotní“, s mnohostrannými dopady pro další osud pacienta, a proto by měla být důsledná.
V klinické praxi se jistě nelze spokojit s diagnózou např. ischemické choroby srdeční pouze na základě – byť velmi sugestivní – anamnézy a fyzikálního vyšetření. Je však klinickým paradoxem, že v případě astmatu bývá u řady nemocných diagnóza postavena právě jen na těchto vyšetřeních [3].
Diagnostický proces astmatu musí být zaměřen na objektivizaci základních charakteristik nemoci – zánětu, bronchiální hyperreaktivity (BHR) a remodelace průdušek.
Velká část vyšetřovacích metod užívaných k diagnóze astmatu přitom tyto atributy nevyšetřuje přímo, ale posuzuje jejich snadněji detekovatelné a měřitelné klinické důsledky na funkce plic [2].
Diagnostický proces astmatu má za cíl:
- průkaz vlastní nemoci objektivizací přítomnosti variabilní a reverzibilní bronchiální obstrukce (resp. bronchiální hyperreaktivity); k potvrzení diagnózy může přispět průkaz eozinofilního typu zánětu průduškové stěny, ačkoliv existují i případy noneozinofilního astmatu
- stanovení bližších charakteristik (klasifikace) nemoci – tj. tíže astmatu, úrovně jeho kontroly a snahu o bližší fenotypizaci spolu s určením eventuálních komplikujících onemocnění a okolností; pro fenotypizaci astmatu je nepostradatelné alergoimunologické vyšetření [2]
Průkaz vlastní nemoci: důsledná snaha o objektivizaci
Bronchiální obstrukce má složku konstrikční, reagující na bronchodilatancia, složku zánětlivou, reagující až na protizánětlivou léčbu a složku remodelační, která přetrvává i po bronchodilatační a protizánětlivé léčbě. S narůstající tíží astmatu většinou stoupá podíl a význam posledních dvou složek.
Ač lze diagnózu astmatu ve většině případů s velkou mírou pravděpodobnosti stanovit již pečlivě odebranou anamnézou, zvláště je-li podpořena typickým fyzikálním nálezem, je z důvodu exaktnosti žádoucí doložit ji objektivizujícími vyšetřeními – s vědomím jejich limitů – a v případech nejasností zvažovat použití exaktnějších metod (přímé vyšetřování zánětu a BHR).
Vyšetření funkce plic
S jistou mírou zjednodušení lze uvést, že ve většině případů postačuje k potvrzení diagnózy astmatu kvalitně provedená spirometrie, prokazující obstrukční ventilační poruchu (poměr FEV1/VCmax, tzv. Tiffenauův index, pod 80 %) a následně její reverzibilitu pomocí bronchodilatačního testu (BDT) – standardně za použití 400 μg salbutamolu. Klasické, „didaktické“ spirometrické vyšetření s registrací vydechovaného objemu vzduchu v čase se již neprovádí, je nahrazeno metodou křivky průtok/objem (flow/volume – F/V), která poskytuje více informací [6,12].
Pro potvrzení diagnózy astmatu platí kritérium zlepšení FEV1 o ≥ 12 % a zároveň o nejméně 200 ml, vztaženo k výchozí, tj. prebronchodilatační hodnotě. Příslušné nálezy by měly být u každého pacienta vždy řádně zdokumentovány, nejlépe uchováváním grafických záznamů vyšetření. Vedle numerických hodnot totiž může k potvrzení nebo naopak zpochybnění diagnózy astmatu významně přispět i tvar smyčky F/V [2,12]. Bronchodilatační test by měl být proveden i v případě, pokud výchozí hodnota FEV1 je tabulkově normální – řada pacientů, zvláště sportovců (extrémem bývají někteří „bezpřístrojoví“ potápěči) vysoce překračuje horní rozpětí normálních tabulkových hodnot.
Pokud je opakovaně zjištěna normální ventilace s normálním BDT, je v případě trvajících pochybností na místě provedení bronchokonstrikčního testu (BKT), dnes nejčastěji s metacholinem, ideálně s manitolem. Obě látky jsou schopny navodit bronchokonstrikci v dávkách/koncentracích podstatně menších než v případě zdravých osob. Metacholin působí farmakologicky přímo na receptory, výsledky jsou vysoce senzitivní, ale méně specifické. Specifičtější je použití manitolu, který navozuje osmotické změny, lépe simulující patofyziologické děje – viz vysušení sliznice při námahou indukovaném astmatu. Jeho používání je však velmi drahé. Neocenitelná hodnota bronchokonstrikčních testů spočívá především ve skutečnosti, že negativní výsledek v naprosté většině případů vylučuje astma – a nutí v případě dechových potíží vést diagnostiku jiným směrem [2].
Bronchokonstričkní test je potenciálně rizikový; interní kontraindikace představují akutní kardiorespirační onemocnění včetně 3 měsíců po infarktu myokardu, nekontrolovaná hypertenze, prokázané aneuryzma aorty a floridní tyreotoxikóza. Relativní kontraindikací je gravidita a dále myasthenia gravis léčená inhibitory cholinesterázy [13].
Steroidní test je vyhrazen pro situace, pokud prokážeme přítomnost obstrukční ventilační poruchy, ale ta není po podání bronchodilatancia reverzibilní.
Důvod této „ireverzibility“ může spočívat v již zmiňované možnosti, že dominující příčinou zúžení průsvitu dýchacích cest jsou chronické zánětlivé změny – především u dlouho neléčených, resp. nedostatečně léčených astmatiků. Pokud v uvedených případech není steroidní test proveden, může astmatik – zvláště v případě kuřáků – po dlouhá léta (a někdy i po celý život) nést falešnou nálepku pacienta s CHOPN [2].
Průkaz eozinofilního typu zánětu dýchacích cest
Průkaz eozinofilního typu zánětu dýchacích cest významně podporuje diagnózu astmatu – zvláště tehdy, je-li prováděn před nasazením kontrolující (preventivní) léčby. Přítomnost eozinofilního typu zánětu zároveň predikuje dobrou léčebnou odpověď na kortikosteroidy, viz dále a schéma 1 a tab. 1. Má-li zánět jiný než eozinofilní charakter (neutrofilní, paucigranulární aj), jsou diagnóza astmatu i odpověď na kortikosteroidní léčbu méně pravděpodobné [2].
Schéma 1. Odlišnosti mezi astmatem a CHOPN. 
Astma a CHOPN mají odlišnou etiopatogenezi, a tím i různé diagnostické a terapeutické konsekvence. U části pacientů se mohou charakteristiky obou nemocí v různé míře kombinovat. Průsečíkem, v němž nelze rozhodnout, která diagnóza je určující, je tzv. Asthma COPD Overlap (Syndrome) ACO(S) – Asthma COPD Overlap (Syndrome) Table 1. Základní možnosti průkazu přítomnosti eozinofilního typu zánětu u astmatu. 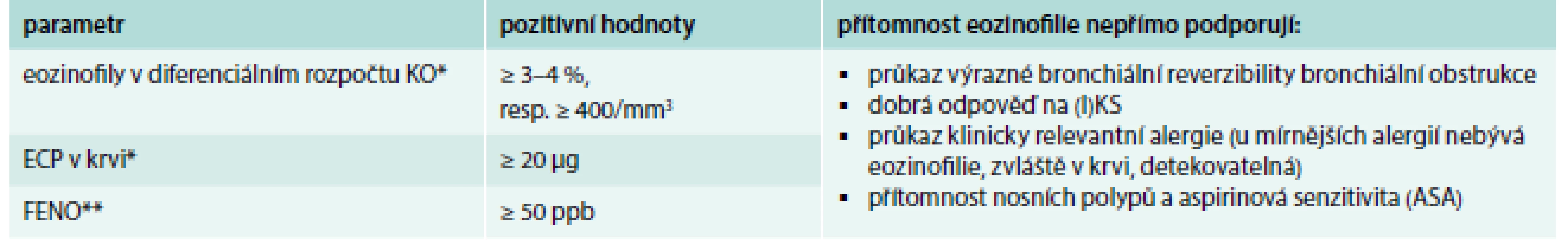
* omezený význam; pozitivní hodnoty mohou být způsobeny jinými onemocněními (atopický ekzém, helmintózy aj) ** úzký vztah eozinofilie a FENO neplatí u kuřáků ASA – kyselina acetylsalicylová/acetylsalicylic acid ECP – eozinofilní kationický protein FENO – frakční koncentrace oxidu dusnatého ve vydechovaném vzduchu/fraction of exhaled nitric oxide (I)KS – (inhalační) kortikosteroidy KO – krevní obraz Upraveno podle [2] Snaha o posouzení přítomnosti eozinofilie by proto měla být vyvinuta při diagnostickém procesu u každého astmatika. Donedávna však nebyla k dispozici neinvazivní metoda, která by poskytovala informaci o přítomnosti eozinofilie přímo v dýchacích cestách. V praxi jsme byli odkázáni na detekci systémové eozinofilie (diferenciální rozpočet, eozinofilní kationický protein v periferní krvi) s významnými interpretačními limitacemi (tab. 1). Eozinofilie periferní krve nemusí odrážet přítomnost eozinofilie v dýchacích cestách (parazitární onemocnění, atopický ekzém, potravinové alergie aj), a naopak u lehčích forem astmatu mohou být uvedené parametry v normě [2].
Velký klinický přínos přineslo zavedení vyšetřování frakční koncentrace oxidu dusnatého ve vydechovaném vzduchu (Fraction of Exhaled Nitric Oxide – FENO). Jedná se o neinvazivní, z praktického aspektu jednoduchou metodu, při níž vyšetřovaný jednorázově zvolna vydechne obsah plic/průdušek do stolního analyzátoru detekujícího s vysokou přesností koncentraci oxidu dusnatého.
Pro většinu klinických situací u nekuřáků a steroid-naivních (tj. dosud neléčených kortikosteroidy) pacientů platí, že hodnoty < 25 ppb jsou normální a hodnoty > 50 ppb jsou průkazem přítomnosti eozinofilního zánětu průdušek. Hodnoty mezi 25–35 ppb představují šedou zónu, mezi 35–50 ppb pravděpodobnou přítomnost eozinofilního zánětu [14]. Velký význam FENO v diagnostice astmatu spočívá v jeho negativní prediktivní hodnotě – nízká hodnota FENO (< 25 ppb u nezaléčeného a nekouřícího pacienta) a současně negativní výsledek bronchokonstrikčního testu téměř vylučují astma.
Stanovení bližších charakteristik nemoci – předpoklad adekvátní léčby
Významnou součástí diagnózy astmatu je jeho bližší klinická klasifikace, která je předpokladem adekvátní léčby, jejímž cílem je dosažení plné kontroly.
Plná kontrola nad astmatem zahrnuje nejen odstranění aktuální symptomatologie, ale i zabránění vzniku ireverzibilních remodelačních změn z dlouhodobého hlediska, tj. minimalizaci subklinického (reziduálního) zánětu.
S ohledem na stávající léčebné možnosti jsou dnes akcentovány 2 klasifikace – klasifikace podle tíže nemoci a klasifikace fenotypická.
Tíže astmatu je posuzována podvojně: podle intenzity léčby vedoucí k plné kontrole. V souladu s pětistupňovou úrovní farmakoterapie (viz dále) je definováno i 5 stupňů tíže astmatu:
- intermitentní astma
- lehké astma
- středně těžké astma
- těžké astma
- těžké refrakterní astma (myšleno refrakterní na obvyklou, paušální léčbu) [1]
Fenotyp astmatu
Těžké refrakterní astma představuje pacienty s nejtěžšími formami nemoci, k jejichž kontrole je zapotřebí dlouhodobá systémová kortikoterapie, přičemž u části pacientů ani ta k dostatečnému potlačení zánětu/kontrole nemoci nestačí.
Hledání a testování nových léků pro tyto nemocné prohloubilo naše poznání o heterogenitě etiopatogeneze astmatu. Tato heterogenita je přítomna u všech tíží astmatu, praktické významnosti však nabývá právě u pacientů s jeho těžkými formami. Při klinickém zkoušení tzv. biologik, tj. léků zasahujících do dílčích mechanizmů zánětu, se ukázalo, že různé druhy těchto léků jsou účinné pouze u části pacientů (na rozdíl od pleiotropně působících kortikosteroidů, účinných alespoň zčásti prakticky u všech nemocných – viz analogie s biologickou léčbou např. u zánětlivých onemocnění střev nebo v revmatologii).
Stávající možnosti cílené biologické léčby (viz dále) jsou směrovány především k ovlivnění signálních drah vedoucích k eozinofilii – ať už alergickými, nebo nealergickými mechanizmy [15].
Česká republika se stala v roce 2015 prvou zemí na světě, která v národních guidelines doporučuje pragmatickou a jednoduchou fenotypickou klasifikaci zohledňující přítomnost klinicky významné eozinofilie a alergie [2].
Tříkrokový diagnostický algoritmus (schéma 2) vyúsťuje v rozlišení 3 klinicky významných fenotypů (tab. 2):
Schéma 2. Tříkroková diagnóza astmatu: zjednodušené schéma. 
U každého pacienta by měla být provedena vyšetření vedoucí k zodpovězení všech 3 otázek. Průkaz bronchiální hyperreaktivity (BHR), resp. revezibility bronchiální obstrukce, je výchozím krokem diagnostického procesu. Průkaz (bronchiální) eozinofilie (Eo) zvyšuje pravděpodobnost diagnózy astmatu. Průkaz klinicky významné respirační alergie je nepřímou známkou přítomnosti bronchiální eozinofilie. Blíže viz text a tabulky. Upraveno podle [16] Table 2. Fenotypická klasifikace astmatu prizmatem přítomnosti eozinofilie a alergie. 
Upraveno podle [2] Eozinofilní alergické astma
Dominujícím znakem je přítomnost klinicky významné alergie. Začíná často již v dětství, bývají přítomna nebo jej předcházejí jiná alergická onemocnění – tzv. atopický pochod. Eozinofilie v průduškové stěně nemusí mít systémovou odezvu v krvi a rychle ustupuje po zavedení protizánětlivé léčby IKS. Významnou pomoc v diagnostice proto přináší včasné vyšetření FENO (viz výše).
Tato forma astmatu je nejčastější, nejklasičtější a většinou nejlépe léčitelný typ. Nejzávažnější bývají případy spojené se senzibilizací na plísně (severe asthma with fungal sensitization – SAFS, allergic bronchopulmonary aspergillosis – ABPA), při nichž zdroje alergie – plísně – kolonizují dýchací cesty pacientů.
Eozinofilní nealergické astma
Dominujícím znakem je přítomnost výrazné eozinofilie. Začíná ve středním věku, alergologické vyšetření je obvykle negativní; pokud je ev. alergie zjištěna, nemá větší klinický význam. Eozinofilie průduškové stěny bývá spojena s výraznou bronchiální hyperreaktivitou, současně je však i rizikem ireverzibilní remodelace. Nejzávažnější formy eozinofilního nealergického astmatu bývají při intoleranci NSAID a u autoimunitních onemocnění typu vaskulitid (syndrom Churgův-Strausssové atp), někdy zahrnující (vedle neurologické symptomatologie) i významné renální, vzácněji i kardiální manifestace [17].
Non-eozinofilní nealergické astma
Chybí jak přítomnost eozinofilie, tak klinicky významné alergie, jsou však přítomny BHR, variabilita bronchiální obstrukce a typické příznaky astmatu. Začíná spíše v dospělosti, závažnost bývá spojena s nadváhou, jinými komorbiditami (autoimunitní tyreoiditida) a ženským pohlavím.
Specifickou situaci představuje astma kuřáků, které se často prolíná s chronickou obstrukční plicní nemocí – v této souvislosti je nově užíván termín „syndrom překryvu astmatu s CHOPN“ (ACOS). ACOS je pravděpodobný u astmatiků s dominující námahovou dušností, chronickou expektorací, anamnézou nikotinizmu, perzistující obstrukcí po kortikoidním testu a sníženou difuzí (transfer faktorem pro oxid uhelnatý – TLCO) vzhledem k přítomnosti emfyzému. U pacientů s ACOS je možno poskytnout nemocným léčebné možnosti vyhrazené pro CHOPN [2,4,9,10].
Praktické konsekvence pro klinickou praxi:
- základem objektivizace diagnózy astmatu je funkční vyšetření plic:
- většinou postačuje kvalitně provedená spirometrie, doplněná bronchodilatačním testem
- při trvající diagnostické nejistotě je žádoucí provést steroidní nebo bronchokonstrikční test
- významnou roli v diagnostickém procesu dnes hraje možnost neinvazivní detekce eozinofilního zánětu vyšetřením FENO
- normální koncentrace celkového IgE nevylučuje přítomnost klinicky závažné alergie
- každý astmatik by měl být vyšetřen alergologem ve 2 základních situacích:
- vždy v rámci iniciální diagnózy
- pokud došlo k nevysvětlitelnému zhoršení nemoci
Léčba astmatu
Přestože je astma heterogenní onemocnění, u naprosté většiny nemocných postačuje k jeho plné kontrole velmi jednoduchá, do značné míry uniformní (paušální) léčba zatížená jen minimem nežádoucích účinků; to proto, že většina antiastmatik, včetně kortikoidů, které představují základ léčby, je k dispozici v inhalační formě.
Cílem léčby astmatu je dosažení plné kontroly, tj. nejen odstranění aktuální symptomatologie, ale i zabránění vzniku ireverzibilních remodelačních změn z dlouhodobého hlediska, tj. minimalizovat subklinický (reziduální) zánět [1].
Astmatici se dožadují především rychlého splnění prvého cíle, úkolem a zodpovědností lékařů je – podobně jako u jiných chronických onemocnění – přesvědčit a získat nemocné k soustavné preventivní léčbě i v oligosymptomatickém až asymptomatickém období [2].
Je klinickou zkušeností, že nejčastějšími a zároveň nejzávažnějšími problémy v praktické léčbě astmatu, které dosažení dlouhodobého cíle brání, jsou ze strany pacientů:
- nesoustavnost léčby
- různě intenzivní a různě (i)racionální kortikofobie
- špatná inhalační technika
Každý nemocný astmatem by proto měl být (přiměřeně svému intelektu) adekvátně poučen o chronickém zánětlivém charakteru své nemoci, s tím souvisejících odlišných rolích úlevových vs protizánětlivých/preventivních léků a řádné užívání a aplikace těchto léků by měly být pravidelně kontrolovány [2,18].
Inhalační léčba: zdroj výhod i potíží v léčbě astmatu
Inhalační léčba astmatu skýtá zásadní výhodu v tom, že stejného léčebného efektu je dosaženo řádově nižšími dávkami než při perorálním, resp. parenterálním podání – tím je minimalizováno riziko systémových nežádoucích účinků. V případě úlevových léků je zásadním přínosem i rychlost nástupu jejich efektu ve srovnání s podáním per os.
K ilustraci: 1 tbl salbutamolu obsahuje 2 nebo 4 mg, tj. 2 000–4 000 μg této látky. Srovnatelné úrovně bronchodilatačního efektu je dosaženo inhalačním podáním 1–2 vdechů, jedna dávka obsahuje pouze 100 nebo 200 μg – přičemž asi 70 % bronchodilatační odpovědi je dosaženo během prvých 4 min a plný efekt se rozvine do 30 min.
Potíže s inhalační léčbou astmatu vycházejí ze skutečnosti, že jejich používání vyžaduje jistou míru manuální zručnosti – ať se jedná o práškové (suché) nebo aerosolové (vlhké) systémy, které často kladou nároky i na koordinaci „ruka-mozek“ [19].
V současnosti je u nás k dispozici asi 20 různých druhů inhalátorů, které jsou ve většině klinických situací vzájemně zaměnitelné. Teprve při podávání vysokých dávek inhalačních léků (zvláště IKS) nebo u nemocných se specifickými formami astmatu vystupují do popředí specifika jednotlivých systémů. Typickým případem jsou nemocní s dominujícím nebo perzistujícím postižením malých dýchacích cest (viz SAD). K dostatečné depozici léků do této periferní „tiché“ zóny plic jsou vyvíjeny především vlhké aerosolové dávkovače s vysokým a homogenním zastoupením velmi drobných částic v podobě jemné mlžiny (tzv. ultra/extra-fine částice, resp. soft mist inhalátory) [2,19].
Paušální preventivní (protizánětlivá) léčba: základní pilíř léčby astmatu
Základním pilířem léčby astmatu je trvalé podávání preventivních protizánětlivých léků, mezi nimiž dominantní roli hrají inhalační kortikosteroidy (IKS).
Nízké dávky IKS (tab. 3) jsou prakticky bez nežádoucích účinků včetně systémových, protože množství steroidů, které se dostává do krevního oběhu, je zanedbatelné. Naopak při navyšování dávek IKS do dávek středních, a zvláště pak vysokých, je nutno – s vědomím individuální citlivosti a ohledem na již existující komorbidity – s jejich ev. výskytem počítat.
Table 3. Odhadované klinicky srovnatelné denní dávky IKS (v μg) pro dospělé a děti starší 12 let. Upraveno podle GINA [1] a Evropské respirační společnosti (ERS) a Americké hrudní společnosti (ATS) [20] ![Odhadované klinicky srovnatelné denní dávky IKS (v μg) pro dospělé a děti starší 12 let.
Upraveno podle GINA [1] a Evropské respirační společnosti (ERS) a Americké hrudní společnosti (ATS) [20]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/8770cea2226e6cb2f09d28fd59185a9c.png)
BDP – beklometazon dipropionát BUD – budesonid CFC – chlorofluorokarbon CIC – ciklesonid DPI – inhalační systém pro práškovou formu léku FF – flutikazon furoátu FP – flutikazon propionát HFA – hydrofluoroalkan MF – mometazon furoát * dnes již nejsou k dispozici, uvedeny pro možnost srovnání se staršími odkazy ** nižší hodnota dle GINA, vyšší hodnota dle ERS/ATS Přesnější údaje o ekvipotenci, týkající se FF (flutikazon furoátu) a mikronizovaného BDP nejsou k dispozici. Upraveno podle GINA [1] a Evropské respirační společnosti (ERS) a Americké hrudní společnosti (ATS) [20] S ohledem na tato rizika jsou ve výstavbě tzv. stupňovité léčby astmatu (schéma 3) uváděny alternativy pro situace, v nichž se nedaří dosáhnout plné kontroly nízkými/středními dávkami IKS – namísto navyšování dávek IKS do dávek středních a zvláště vysokých jsou nabízeny možnosti přidání jiných léků – z možných alternativ jsou upřednostňováni inhalační β2-agonisté s dlouhodobým nebo ultradlouhodobým účinkem (LABA, resp. U-LABA – dlouhodobě, tj. 12, resp. 24 hod působící β2-agonisté) [1,2].
Výsledné „paušální“ schéma preventivní léčby astmatu je pro většinu pacientů v zásadě jednoduché (blíže schéma 3): nízká/střední dávka IKS + ev. LABA + event. další léky (antileukotrien, nízká dávka teofylinů, tiotropium).
Schéma 3. Léčebné možnosti astmatu 
Preference (U)-LABA má 2 základní důvody. Prvý vychází z poznání, že (U)-LABA vykazují – na rozdíl od aditivního účinku teofylinů, antileukotrienů a tiotropia – silnější, tzv. synergický efekt založený na vzájemné potenciaci receptorové aktivity obou léků na molekulární úrovni. Druhý, především praktický důvod vychází ze skutečnosti, že ani teofyliny, ani antileukotrieny (u nás pouze montelukast) neexistují v inhalační formě. Naproti tomu (U)-LABA lze kombinovat s IKS do jednoho dvousložkového inhalačního léku – hovoříme o tzv. fixních kombinacích [19].
Používání fixních kombinací IKS/(U)-LABA má v klinické praxi dvojjedinný pozitivní efekt: zvyšuje komplianci pacientů k léčbě a zároveň vyloučí riziko, aby (U)-LABA byla zneužívána jako úlevový lék (viz dále) bez současného podávání IKS.
Pokud jsou IKS a (U)-LABA podávány odděleně, pacienti po užití IKS nevnímají žádný bezprostřední efekt, zatímco po LABA cítí úlevu svých potíží, a mají proto tendenci užívat pouze (U)-LABA v roli úlevového léku. To se týká zvláště formoterolu, jehož bronchodilatační účinek nastupuje nejrychleji. Opomíjení IKS vede ovšem k obnovení eozinofilního zánětu, zvýšení BHR, a tím ke zvýšené potřebě úlevové léčby – kruh se uzavírá a vede jak k riziku exacerbací, tak kumulativních nežádoucích účinků sympatomimetik (hypertenze, tachyarytmie, hyperglykemie) [18].
Od roku 2015 je v ČR k dispozici další možnost steroid šetřící léčby, jíž je používání tiotropia (U-LAMA, anticholinergikum s dlouhodobým účinkem) v systému produkujícím jemnou mlžinu, vyhrazené zatím pro případy, u nichž dochází k exacerbacím navzdory léčbě středně vysokými dávkami IKS + (U)-LABA.
Je jen otázkou času, kdy budou v ČR uvedeny již existující fixní trojkombinace (triplety) obsahující „tři v jednom“, tvořící logické „antistresové“ trio: preventivně působící základní protizánětlivý lék IKS, jej potencující a současně bronchodilatačně působící sympatomimetikum (U)-LABA a oba předchozí v jejich účincích doplňující anticholinergikum (U)-LAMA [15].
Úlevová (bronchodilatační) léčba: indikátor kontroly astmatu
Vedle soustavné preventivní léčby by každý astmatik měl být vybaven rychle působícím úlevovým/záchranným lékem, přičemž jeho častější potřeba – více než 2krát týdně – je zároveň jednou ze známek nedostatečné kontroly [1,2,18].
Preferována jsou rychle a krátkodobě účinkující sympatomimetika, resp. β2-agonisté (short acting β-agonists – SABA), jejichž klasickým představitelem je salbutamol (dále u nás fenoterol a terbutalin). U starších pacientů a nemocných s kardiovaskulárními nemocemi bývají z důvodů menšího rizika NÚ preferována parasympatolytika (ipratropium) nebo lze využít kombinaci β-mimetika s parasympatolytikem. Místo v léčbě astmatu si udržují teofylinové přípravky, i když jejich role se změnila. Dnes jsou především (viz výše) levnou alternativou aditivní léčby k IKS [1,2]. Jako úlevový lék ustoupily do pozadí, protože neexistují v inhalační, ale pouze p.o. a injekční formě.
Režim SMART: výjimka z pravidla
Z doposud uvedeného je zřejmé, že každý astmatik by měl být vybaven 2 typy léků – protizánětlivým lékem k trvalému preventivnímu užívání a dále úlevovým bronchodilatačním lékem pro neočekávané případy dušnosti.
Každé pravidlo mívá své výjimky a nejinak je tomu i zde. Existence fixní kombinace LABA s rychlým nástupem účinku (formoterolu) s IKS v jednom inhalátoru vedla k vyvinutí pragmatického konceptu léčebné strategie označované jako režim SMART, resp. MART (Single Inhaler Maintenance And Reliever Therapy). Tentýž lék/inhalátor je zároveň užíván k pravidelné udržovací léčbě i jako úlevový lék podle potřeby. Přídatná dávka nejenže přinese okamžitou úlevu, ale nemocný si současně aplikuje i dávku preventivního léku a bezděčně tak přispívá k prevenci ztráty kontroly až vzniku exacerbace. Uvedená strategie v klinické praxi ve svých důsledcích snižuje celkovou nálož kortikosteroidů z dlouhodobého hlediska [21]. K režimu (S)MART jsou schváleny kombinace nízkých dávek IKS s formoterolem, nelze užívat kombinace IKS s U-LABA (vilanterol, indakaterol) pro riziko jejich kumulativních nežádoucích účinků [1].
Fenotypicky cílená léčba astmatu: velká pomoc malému počtu nemocných
Vedle obecných preventivních přístupů a stupňovité preventivní paušální farmakoterapeutické léčby se v posledních letech do klinické praxe dostává řada nových léčebných možností, které nejsou použitelné pro všechny nemocné. Tyto možnosti vycházejí z detailnějšího poznání imunologické heterogenity astmatického zánětu na celulární a molekulární úrovni [4,15].
Dnes se většinou jedná o látky peptidové, resp. bílkovinné povahy („malé“ rekombinantní proteiny nebo monoklonální protilátky), zasahující různým způsobem do dílčích mechanizmů zánětu – jsou tedy účinné vždy pouze u části astmatické populace, která musí být dobře definována [22].
Dnešní možnosti této tzv. biologické léčby astmatu jsou cíleny především na dílčí mechanizmy eozinofilního zánětu, k němuž mohou vést jak IgE alergické, tak nealergické stimuly.
Otevřená zůstává otázka vzájemného postavení anti-IgE a antieozinofilně působící terapie u pacientů s významnou alergií a současně významnou eozinofilií.
V širším smyslu lze k fenotypicky cílené léčbě astmatu přiřadit i léčbu antimykotiky a alergenovou imunoterapii (AIT) – i když se v prvém případě jedná o léčbu komplexní nemoci, přesahující rámec vlastního astmatu a ve druhém případě léčbu alergie, ne vlastní nemoci „astma“ – viz dále.
Překvapení v léčbě astmatu přinesla možnost instrumentální léčby astmatu, blížící se více chirurgickým než farmakobiologickým léčebným modalitám – bronchiální termoplastika.
Vyjma alergenové imunoterapie je fenotypicky cílená léčba astmatu centralizována na specializovaná pracoviště národních center pro těžké astma (NCTA, www.tezke-astma.cz).
Do těchto center by měl být odeslán každý astmatik, u kterého se nedaří dostat jeho astma pod kontrolu maximální paušální léčbou a je u něj zvažována, nebo již probíhá dlouhodobá systémová kortikoterapie [23].
Biologická léčba alergie a eozinofilie
Anti-IgE protilátka
Léčba monoklonální anti-IgE protilátkou (tč. k dispozici jediná – omalizumab) je indikována pro pacienty s těžkým alergickým astmatem, u nichž alergie na celoroční alergen hraje zásadní roli v aktuálním obraze nemoci [1,24]. Je vhodné uvést, že k léčbě mohou být vhodní i astmatici, u kterých hladina celkového IgE není zvýšena – řada pacientů s těžkým alergickým astmatem, zvláště ti s užším spektrem alergenů, mívají hodnoty celkového IgE v normálním rozmezí [2].
U dobře vybraných pacientů je dosahováno významné redukce exacerbací, často i snížení až vysazení systémové kortikoterapie, u některých těžkých astmatiků se zcela zásadně mění do té doby nepříznivý obraz nemoci. Lék je podáván 1–2krát měsíčně v s.c. injekcích, v současné době je v ČR léčeno asi 200 nemocných.
Anti-IL5
Interleukin 5 (IL5) je považován za klíčový cytokin zodpovídající za diferenciaci, zrání, migraci a aktivaci lidských eozinofilů. Je produkován především lymfocyty, aktivovanými alergickými, častěji však nealergickými mechanizmy. Svoje efekty spouští vazbou na receptory pro IL5, které jsou lokalizovány na povrchu řady buněk, především však právě eozinofilů.
Anti-IL5 monoklonální protilátky, které se na IL5 váží, znemožňují jeho vazbu na receptory. Tím neutralizují jeho účinky, a jsou proto označovány jako anti-IL5 neutralizační protilátky [22].
První monoklonální protilátkou, která se v roce 2016 dostala do klinické praxe v EU, je mepolizumab, druhou reslizumab [15,25]. Oba léky jsou podávány v intervalu 1 měsíce, prvý z nich je podáván subkutánně, druhý v intravenózní infuzi. V ČR jsou mepolizumab i reslizumab registrovány, nemají však dosud stanoveny podmínky úhrady.
Léčba je určena pro dospělé pacienty s těžkým eozinofilním astmatem alergického i nealergického typu. Indikováni jsou nemocní exacerbující navzdory vysokým dávkám IKS + LABA nebo vyžadující dlouhodobou systémovou kortikoterapii. S tíží eozinofilie v periferní krvi (zvláště nad 300–400 bb/mm3) stoupá pravděpodobnost klinického efektu obou léků – spočívající v asi 50% redukci počtu exacerbací nebo dávek systémové kortikoterapie [25].
Léky ovlivňující působení IL4 a IL13
Interleukiny 4 a 13 jsou strukturálně i funkčně podobné cytokiny, produkované podobně jako IL5 především lymfocyty. Na rozdíl od IL5 jsou však angažované při vzniku eozinofilního zánětu především alergickými mechanizmy – tím, že indukují izotypový přesmyk B-lymfocytů směrem k tvorbě IgE.
Biologika ovlivňující signální dráhy IL4/IL13 jsou cíleny buď na vlastní interleukiny, nebo jejich receptory – jedná se opět o monoklonální protilátky nebo o nízkomolekulární „mutantní“ proteiny (které mohou být podávány i inhalačně) [22]. Bližší specifikace pacientů, kteří budou mít z jednotlivých léků této skupiny (dupilumab, lebrikizumab, pitrakinra) největší profit, se stále hledá. Z teoretických předpokladů je pravděpodobné, že se bude nejspíše jednat o nemocné s výraznou alergií, navozující současně výraznou systémovou eozinofilii.
Bronchiální termoplastika
Metoda využívá fyzikálního principu užívaného mj. při radiofrekvenční ablaci v kardiologii. Během 3 bronchoskopických sezení (v intervalu 3 týdnů) jsou pomocí tenké sondy postupně krátkodobě zahřívány průdušky kalibru do 3 mm na teploty kolem 60 °C. Denaturace bílkovin vede k selektivní redukci hladké svaloviny bronchů s dlouhotrvajícími příznivými efekty na další průběh nemoci [26]. Klinické zkušenosti již přesahují 10 let, v ČR je metoda užívána od přelomu let 2011/2012, ošetřeno bylo již více než 20 nemocných. Nejlepších efektů je dosahováno u těžkých astmatiků s výraznou hypertrofií/hyperplazií hladkého svalstva bronchů, dokladovanou významnou pozitivitou bronchodilatačního testu.
Antimykotika
Zhruba pětina alergických astmatiků vykazuje senzibilizaci vůči plísním. U některých z těchto nemocných dochází časem ke zvláštní situaci, v níž zdroj alergenů, tedy plíseň – nejčastěji Aspergillus fumigatus – víceméně trvale kolonizuje sliznici průdušek. V takovém případě hovoříme o alergické bronchopulmonální aspergilóze (ABPA), v případě jiných plísní o tzv. těžkém astmatu s mykotickou senzibilizací (severe astma with fungal senzitization – SAFS) [27]. Pacienti mívají výrazné známky eozinofilie a vysoké hladiny specifických i celkového IgE (většinou více než 500 IU/ml). Permanentní alergický zánět může vyústit v těžký průběh nemoci s devastací plic a tvorbou bronchiektázii. K léčbě je logicky indikována antimykotická léčba a příznivých efektů je nejčastěji dosahováno pomocí staršího antimykotika itrakonazolu, který působí redukci až eliminaci mykotické populace, a tím i zdroje alergenů. Léčba je zatížena četnými rizikovými interakcemi s řadou léků užívaných v interní medicíně (vycházejících z metabolizace itrakonazolu cytochromy skupiny 3A) a možným negativním inotropním účinkem na srdce.
Alergenová imunoterapie
Alergenová imunoterapie (AIT), která má v ČR velkou tradici, zažívá v léčbě astmatu renesanci [1].
Nejedná se o alternativu ani konkurenci farmakoterapie, ale o léčbu alergické přecitlivělosti – představuje tak smysluplné doplnění komplexní preventivní léčby. Nejlepších výsledků je dosahováno u „mladších“ a lehčích forem astmatu, které bývají provázeny mimoplicními alergickými projevy – nejčastěji alergickou rýmou a konjunktivitidou, pokud je dosud přítomna monosenzibilizace či dominující senzibilizace na jednu skupinu alergenů. Kvalitní alergenové extrakty jsou k dispozici pro všechny 3 základní skupiny pylů (břízovité, trav a pelyňku), domácí roztoče, kočku, psa, nejednoznačné indikace představují plísně (nejčastěji rod Alternaria). Z hlediska praktičnosti léčby se rozrůstá spektrum přípravků k sublinguální (gtt) a perorální (tbl) formě podání.
Praktické konsekvence pro klinickou praxi:
- každý astmatik by měl být adekvátně poučen o podstatě své nemoci a vybaven 2 typy léků:
- protizánětlivým(i) k trvalému preventivnímu užívání
- úlevovým bronchodilatačním pro neočekávané případy dušnosti
- ve všech případech, u nichž je to možné, preferujeme léčbu inhalační:
- z medicínského hlediska jsou pro většinu klinických situací jednotlivé inhalační systémy vzájemně zaměnitelné
- užívání léků a inhalační techniku je žádoucí pravidelně kontrolovat
- každodenní potřeba úlevové bronchodilatační léčby svědčí o nedostatečné kontrole astmatu, jejímiž nejčastějšími příčinami jsou:
- vynechávání preventivních léků nebo špatná inhalační technika
- nepoznané/neovlivněné komorbidity
- nepoznané/neovlivněné nežádoucí vlivy zevního prostředí, často profesní
- astmatiky, jejichž onemocnění se nedaří dostat pod kontrolu monoterapií středně vysokými dávkami IKS, je vhodnější odeslat do péče respiračních specialistů (v našich podmínkách k pneumologovi nebo alergologovi) než je vystavit riziku nežádoucích účinků vysokých dávek IKS
- astmatiky, jejichž onemocnění se nedaří dostat pod kontrolu ani vysokými dávkami IKS v kombinaci s LABA a ev. dalšími léky, je vhodné odeslat na některé z pracovišť sítě Národního centra pro těžké astma (NCTA – http://www.tezke-astma.cz)
doc. MUDr. Milan Teřl, Ph.D.
terl@fnplzen.cz
Klinika pneumologie a ftizeologie LF UK a
FN v Plzni
www.fnplzen.cz
Doručeno do redakce 31. 8. 2017
Přijato po recenzi 26. 9. 2017
Sources
1. GINA (Global Initiative for Asthma). Global Strategy for Asthma Management and Prevention. 2017. Dostupné z WWW: < http://www.ginasthma.org>. [cit. 8/2017].
2. Teřl M, Čáp P, Dvořáková R et al. Doporučený postup diagnostiky a léčby bronchiálního astmatu. GEUM: Semily 2015. ISBN 978–80–87969–08–3.
3. Nathan RA, Thompson PJ, Price D et al. Taking Aim at Asthma Around the World: Global Results of the Asthma Insight and Management Survey in the Asia-Pacific Region, Latin America, Europe, Canada and the United States. J Allergy Clin Immunol Pract 2015; 3(5): 734–742.e5. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jaip.2015.04.013>.
4. Barnes PJ. Cellular and molecular mechanisms of asthma and COPD. Clin Sci (Lond) 2017; 131(13): 1541–1558. Dostupné z DOI: <http://dx.doi.org/10.1042/CS20160487>.
5. Berge M, Hacken NH, Cohen J et al. Small airway disease in asthma and COPD: clinical implications. Chest 2001; 139(2): 412–423. Dostupné z DOI: <http://dx.doi.org/10.1378/chest.10–1210>.
6. Kašák V. Asthma bronchiale. 2. ed. Maxdorf: Praha 2013. ISBN 978–80–7345–325–1.
7. Teřl M, Rybníček O. Asthma bronchiale v příčinách a klinických obrazech. 2. ed. GEUM: Cheb 2008. ISBN 978–80–86256–59–7.
8. Nolte D. Asthma. Das Krankheitsbild. Der Asthmapatient. Die Therapie. 5th ed. Urban&Schwarzenberg: Munchen-Wien-Balatimore 1991 : 81–84. ISBN 978–3541093540.
9. Barnes PJ, Celli BR. Systemic manifestations and comorbidities of COPD. Eur Respir J 2009; 33(5): 1165–1185. Dostupné z DOI: <http://dx.doi.org/10.1183/09031936.00128008>.
10. Koblížek V, Chlumský J, Zindr V et al. Doporučený postup ČPFS pro diagnostiku a léčbu stabilní CHOPN. Aktualizace 2016. Dostupné z WWW: <http://www.pneumologie.cz/guidelines>.
11. Padeletti M, Jelic S, LeJemtel TH. Coexistent chronic obstructive pulmonary disease and heart failure in the elderly. Int J Cardiol 2008; 125(2):209–215. Dostupné z DOI: <http://dx.doi.org/10.1016/j.ijcard.2007.12.001>.
12. Chlumský J, Fišerová J, Kociánová J et al. [Sekce patofyziologie dýchání]. Doporučený postup pro interpretaci základních vyšetření plicních funkcí. Aktualizace 2013. Dostupné z WWW: <(http://www.pneumologie.cz/guidelines/>.
13. Crapo RO, Casaburi R, Coates AL et al. Guidelines for methacholine and exercise challenge testing-1999. Am J Respir Crit Care Med 2000; 161(1): 309–329.
14. Dweik RA, Boggs PB, Erzurum SC et al. [American Thoracic Society Committee on Interpretation of Exhaled Nitric Oxide Levels (FENO) for Clinical Applications]. An official ATS clinical practice guideline: interpretation of exhaled nitric oxide levels (FENO) for clinical applications. Am J Respir Crit Care Med 2011; 184(5): 602–615. Dostupné z DOI: <http://dx.doi.org/10.1164/rccm.9120–11ST>.
15. Gross NJ, Barnes PJ. New Terapies for Asthma and Chronic Obstructive Pulmonary Disease. Am J Respir Crit Care Med 2017; 195(2): 159–166. Dostupné z DOI: <http://dx.doi.org/10.1164/rccm.201610–2074PP>.
16. Terl M, Sedlak V, Cap P et al. Asthma management: A new phenotype-based approach using presence of eosinophilia and allergy. Allergy 2017; 72(9): 1279–1287. Dostupné z DOI: <http://dx.doi.org/10.1111/all.13165>.
17. Mouthon L, Dunogue B, Guillevin L. Diagnosis and classification of eosinophilic granulomatosis with polyangiitis (formerly named Churg-Strauss syndrome). J Autoimmun 2014; 48–49 : 99–103. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jaut.2014.01.018>. Erratum in J Autoimmun 2014; 55 : 94.
18. Teřl M. Léčba astmatu – chyby a omyly každodenní praxe. Medicína pro praxi 2013; 10(3): 97–103.
19. Kašák V. Inhalační systémy v terapii astmatu a chronické obstrukční plicní nemoci. Remedia 2014; 24(4): 315–320.
20. Chung KF, Wenzel SE, Brozek JL et al. International ERS/ATS guidelines on definition, evaluation and treatment of severe asthma. Eur Respir J 2014; 43(2): 343–373. Dostupné z DOI: <http://dx.doi.org/10.1183/09031936.00202013>. Erratum in Eur Respir J 2014; 43(4): 1216.
21. Vogelmeier C, D‘Urzo A, Pauwels R et al. Budesonide/formoterol maintenance and reliever therapy: an effective asthma treatment option? Eur Respir J 2005; 26(5): 819–828.Erratum in Eur Respir J 2005; 26(6): 1191. Eur Respir J 2011; 38(2): 491.
22. Stříž I. Biologická léčba astmatu. Acta Medicinae 2016; 5(10): 13–16.
23. Sedlák V, Chlumský J, Teřl M et al. Doporučený postup diagnostiky a léčby obtížně léčitelného bronchiálního astmatu. Dostupné z WWW: <http://www.pneumologie.cz/guidelines/>.
24. Normansell R, Walker S, Milan SJ et al. Omalizumab for asthma in adults and children. Cochrane Database Syst Rev 2014; (1): CD003559. Dostupné z DOI: <http://dx.doi.org/10.1002/14651858.CD003559.pub4>.
25. Krčmová I, Novosad J. Interleukin 5 a monoklonální anti-IL5 molekuly v léčbě bronchiálního astmatu. Postgraduální medicína 2017; 19(3): 249–255.
26. Castro M, Zangrilli J, Wechsler ME et al. Reslizumab for inadequately controlled asthma with elevated blood eosinophil counts: results from two multicentre, parallel, double-blind, randomised, placebo-controlled, phase 3 trials. Lancet Respir Med 2015; 3(5): 355–366. Dostupné z DOI: <http://dx.doi.org/10.1016/S2213–2600(15)00042–9>.
27. Agarwal R. Severe asthma with fungal sensitization. Curr Allergy Asthma Rep 2011; 11(5): 403–413. Dostupné z DOI: <http://dx.doi.org/10.1007/s11882–011–0217–4>.
Labels
Allergology and clinical immunology Dermatology & STDs Paediatric dermatology & STDs Paediatric pneumology Diabetology Endocrinology Internal medicine Pneumology and ftiseology General practitioner for adults
Article was published inInternal Medicine

2017 Issue 11-
All articles in this issue
- Cílené vyhledávání nemocných s chronickou obstrukční plicní nemocí: stručný přehled
- Asthma bronchiale v kontextu vnitřního lékařství
- Diagnostika a léčba komunitní pneumonie – v jednoduchosti je klíč k úspěchu
- Nozokomiální pneumonie
- Pneumonie u imunokompromitovaných
- Idiopatická plicní fibróza. Umíme ji vždy správně diagnostikovat a léčit?
- Exogenní alergické alveolitidy: minimum pro praxi
- Sarkoidóza – nadále záhadné onemocnění
- Současný přístup k diagnostice, léčbě a prevenci tuberkulózy
-
Non-CF bronchiektázie dospělých: stručný přehled pro praxi
Dokument Sekce chorob s bronchiální obstrukcí České pneumologické a ftizeologické společnosti České lékařské společnosti J. E. Purkyně - Cystická fibróza dospělých
- Kardiovaskulární riziko spánkové apnoe a kazuistika
- Komplikace po transplantaci plic
- Nemalobuněčný karcinom plic
- Malobuněčný karcinom plic: epidemiologie, diagnostika a léčba
- Maligní mezoteliom pleury – dosud nepokořený nádor
- Spirometrie – základní vyšetření funkce plic
- Postavení bronchologie v pneumologické diagnostice
- Ultrasonografické vyšetření hrudníku v rukou lékaře klinika
- Neinvazivní ventilace
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Spirometrie – základní vyšetření funkce plic
- Neinvazivní ventilace
- Pneumonie u imunokompromitovaných
- Malobuněčný karcinom plic: epidemiologie, diagnostika a léčba
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

