-
Medical journals
- Career
Pozdní komplikace jaterní cirhózy – management krvácení do GIT při portální hypertenzi
Authors: Václav Hejda
Authors‘ workplace: Oddělení gastroenterologie a hepatologie I. interní kliniky LF UK a FN Plzeň
Published in: Vnitř Lék 2016; 62(Suppl2): 10-17
Category: Reviews
Jaterní cirhóza je finálním stupněm progresivního vývoje různých jaterních chorob a je spojena s významnou morbiditou a mortalitou. Cirhóza je asociována s řadou potenciálních komplikací, především s rozvojem portální hypertenze. Portální hypertenze s tvorbou ascitu, jaterních a žaludečních varixů s krvácením do horní části trávicího traktu (HČTT) je zlomovým bodem přirozeného vývoje jaterní cirhózy a je spojena s výrazně zhoršenou prognózou pacientů se strmě narůstajícím rizikem jejich mortality. Během posledních 10–20 let bylo dosaženo významné progrese v diagnostice jaterní cirhózy (včetně neinvazivních metod), v primární prevenci první ataky krvácení do HČTT i v terapii akutního krvácení v důsledku moderní farmakoterapie, zlepšených možností terapeutické endoskopie i relativně nových možností zástavy akutního krvácení (jícnové stenty, TIPS apod).
Overview
Jaterní cirhóza je finálním stupněm progresivního vývoje různých jaterních chorob a je spojena s významnou morbiditou a mortalitou. Cirhóza je asociována s řadou potenciálních komplikací, především s rozvojem portální hypertenze. Portální hypertenze s tvorbou ascitu, jaterních a žaludečních varixů s krvácením do horní části trávicího traktu (HČTT) je zlomovým bodem přirozeného vývoje jaterní cirhózy a je spojena s výrazně zhoršenou prognózou pacientů se strmě narůstajícím rizikem jejich mortality. Během posledních 10–20 let bylo dosaženo významné progrese v diagnostice jaterní cirhózy (včetně neinvazivních metod), v primární prevenci první ataky krvácení do HČTT i v terapii akutního krvácení v důsledku moderní farmakoterapie, zlepšených možností terapeutické endoskopie i relativně nových možností zástavy akutního krvácení (jícnové stenty, TIPS apod). Akutní krvácení do HČTT při portální hypertenzi je však stále spojeno s významným rizikem předčasného úmrtí (15–20 %). Včasná diagnostika a kauzální léčba řady jaterních onemocnění může vést ke zpomalení či regresi fibrózy a cirhózy a snad i stupně portální hypertenze a tím i rizika krvácení.
Klíčová slova:
cirhóza – jícnové varixy – léčba krvácení – portální hypertenzeÚvod
Jaterní cirhóza a především komplikace s ní spojené jsou častou příčinou smrti. Globálně je jaterní cirhóza desátou nejčastější příčinou smrti [1,2]. V USA je úmrtí na cirhózu a její komplikace příčinou 35 000 úmrtí ročně, což je 9. nejčastější příčina smrti celkově a 3. nejčastější příčina smrti u osob mezi 45. a 64. rokem věku.
Jaterní cirhóza je zatížena nejen vysokou mortalitou (a to většinou v 5. či 6. dekádě života), ale i vysokými náklady na péči o pacienty s tímto chronickým onemocněním s jeho komplikacemi. Pouze v USA jsou roční náklady na chronickou péči o pacienty s jaterní cirhózou odhadovány na 2,5 miliardy USD [3]. Cirhotici umírají v průměru o 10 let dříve, než je celkový věkový průměr, ženy ještě mnohem dříve.
Jaterní cirhóza je chronické jaterní onemocnění, při kterém postupně dochází k přestavbě jaterní tkáně a cévního řečiště jater. V játrech v důsledku primárního inzultu dochází k nekróze jaterních buněk s následnými zánětlivými změnami s fibrogenezí a tvorbou regenerativních uzlů.
Nejčastější příčiny jaterní cirhózy v současné době odpovídají asi 80 % všech případů jaterní cirhózy. Dochází samozřejmě k určitým změnám, které se týkají převažující etiologie cirhózy jater. V USA je již 2. hlavní etiologií cirhózy u pacientů čekajících na transplantaci jater nealkoholická steatohepatitida [4], onemocnění převážně spojené s obezitou a metabolickým syndromem. Mezi roky 2004 a 2013 se počet těchto pacientů na čekací listině téměř ztrojnásobil.
Nejčastější příčiny jaterní cirhózy [4]
- alkoholické onemocnění jater
- chronická virová hepatitida C
- chronická virová hepatitida B
- nealkoholická steatohepatitida (NASH)
- hereditární hemochromatóza
Hlavní příčinou úmrtí cirhotiků jsou především pozdní komplikace tohoto onemocnění. Mezi pozdní komplikace jaterní cirhózy řadíme především:
- krvácení při portální hypertenzi
- ascites
- spontánní bakteriální peritonitida
- jaterní encefalopatie
- hepatocelulární karcinom
- hepatorenální syndrom
- hepatopulmonární syndrom
- infekční komplikace a sepse
- dalšími komplikacemi mohou být: jaterní hydrotorax, cirhotická kardiomyopatie, portopulmonální syndrom a trombóza portální žíly
Jaterní cirhóza představuje poslední stupeň v rámci přirozeného vývoje jaterní fibrózy (fibrogeneze). V rámci skórování např. pomocí skóre Metavir je označována jako F4 (rozpětí F0–F4), v rámci skóre Ishak je označována bodem 6 na škále 1–6 [5]. Přestože je v rámci těchto skórovacích systémů označována jedním bodem, není cirhóza jater kompletně terminálním stadiem přirozené progrese jaterního onemocnění, ale představuje dynamický proces, který je možné dále rozdělit do několika stadií, která z klinického hlediska významně predikují prognózu pacienta.
Jak ukazují tab. 1 a 2, lze cirhózu jater z klinického hlediska rozdělit na kompenzovanou a dekompenzovanou. Ve velké systematické analýze měli pacienti s kompenzovanou cirhózou medián přežití 12 let, pacienti s dekompenzovanou cirhózou pouze 2 roky [6]. V anglické studii bylo přežití kompenzovaných vs dekompenzovaných cirhotiků 87 % vs 75 % v 1. roce a 67 % vs 45 % po 5 letech [7]. Každé z těchto stadií lze dále dle přítomnosti klinických projevů rozdělit ještě do 2 podskupin. Hlavními klinickými parametry, které odlišují kompenzovanou a dekompenzovanou cirhózu, je přítomnost zásadních komplikací portální hypertenze – ascitu a přítomnost jícnových (žaludečních) varixů a především anamnéza krvácení z jícnových varixů. Dekompenzovaná cirhóza (stadium 3) je tedy definována jako přítomnost ascitu a jícnových varixů a stadium 4 definované přítomností ascitu a jícnových varixů s anamnézou krvácení. V některých posledních studiích se mortalita stadia 3 a 4 vyrovnala, lze usuzovat na vliv efektivnější léčby variceálního krvácení v posledních letech.
Table 1. Stadia jaterního onemocnění a cirhózy a vztah k tlaku v portální žíle (HVPG) 
Table 2. Stadia jaterní cirhózy a mortalita v následujících 12 měsících 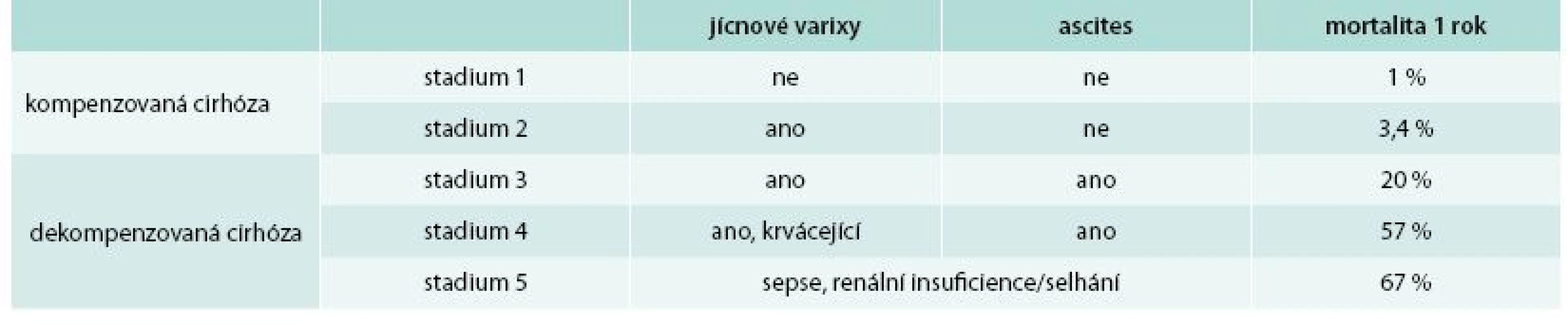
Portální hypertenze
Portální hypertenze, hlavní důsledek jaterní cirhózy, je definována portálním tlakem > 6 mm Hg. Tento tlak může být změřen pouze kanylací jaterních žil a měřením tlaku v zaklínění (hepatic venous pressure gradient – HVPG) [8]. Elevace HVPG je důležitým a nezávislým prediktorem rizika rozvoje dekompenzace jaterní cirhózy (tab. 3), nezávislým ani na hodnocení jiných parametrů, např. syntetických jaterních funkcí či MELD skóre [9,10]. Jícnové varixy se začínají formovat při portálním tlaku > 10 mm Hg. Pokud je v portálním systému stabilní tlak < 10 mm Hg, pak negativní prediktivní hodnota jaterní dekompenzace je 90 % [10]. Riziko variceálního krvácení je vysoké v případě vzestupu HVPG > 12 mm Hg. Vysoký HVPG je rovněž prediktorem celkové mortality cirhotiků (asi 3% vzestup mortality s každým vzestupem 1 mm Hg portálního tlaku) [11]. Velmi vysoké riziko mortality je poté spojeno s HVPG > 20 mm Hg (1roční mortalita 64 % vs 20 % při nižším tlaku) [12]. Snížení HVPG na < 12 mm Hg nebo snížení HVPG alespoň o 20 % je spojeno se snížením rizika rozvoje komplikací portální hypertenze a zlepšení přežití (60% redukce mortality) [6,13].
Table 3. Prediktivní hodnota HVPG 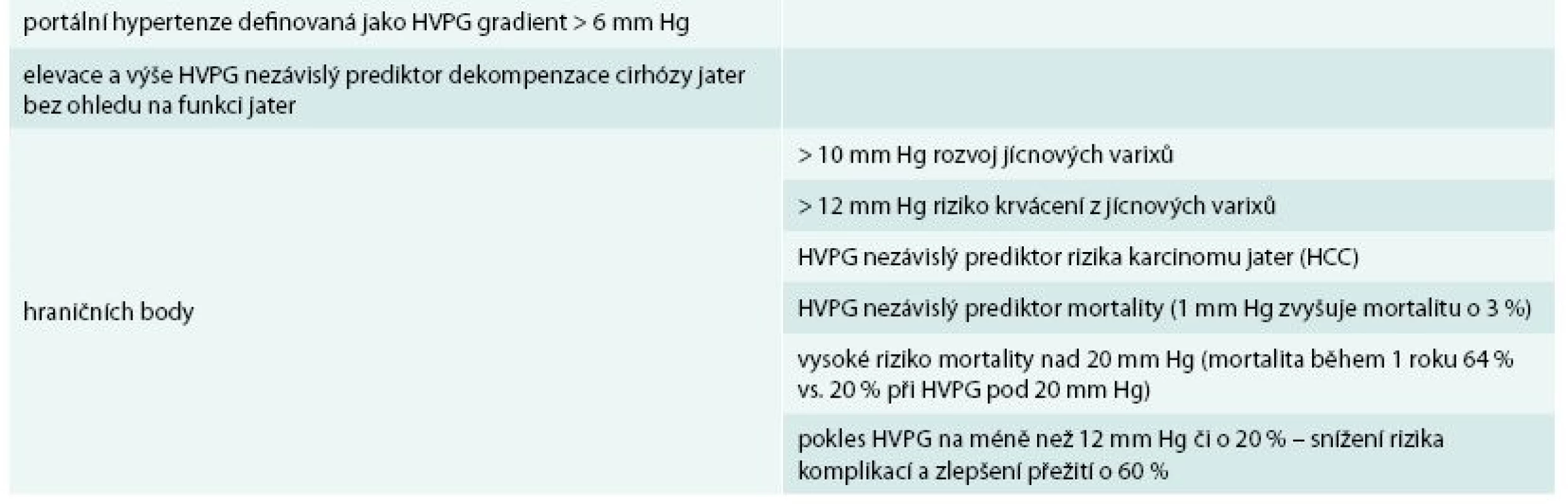
Regrese portální hypertenze
Jak bylo výše uvedeno, cirhóza je dynamický proces a portální hypertenze je finální manifestací jejího vývoje. V poslední době se objevují poměrně přesvědčivé informace o regresi jaterní fibrózy i jaterní cirhózy (přestože je to stále široce diskutované téma) potvrzující předpoklad, že jaterní cirhóza je obousměrně dynamický proces, který může progredovat, ale může i regredovat, a to u celé řady jaterních onemocnění. Základním předpokladem regrese jaterní fibrózy/cirhózy je efektivní léčba základního onemocnění (HBV, HCV, AIH, NASH apod). Hlavní otázkou současnosti je stadium, od kterého je již cirhóza irreverzibilní. Předpokládá se, že pokročilá alterace struktury jater vedoucí k portální hypertenzi je tím bodem, od kterého cirhóza již reverzibilní není. Je však prokázáno, že úspěšná léčba některých onemocnění (např. HCV) brání i v případě přítomné cirhózy rozvoji portální hypertenze a jícnových varixů [14–16]. V některých pracích bylo dokonce prokázáno, že při efektivní léčbě některých onemocnění dochází i ke snížení stupně portální hypertenze [17]. S příchodem velmi účinné léčby HCV v posledních rocích se objevují práce, které dále prokazují, že při vyléčení pacientů s hepatitidou C dochází k regresi stupně portální hypertenze. Recentní práce z vídeňské hemodynamické laboratoře [18] prokazuje regresi stupně portální hypertenze u pacientů s vyléčenou HCV infekcí. Stupeň portální hypertenze byl měřen nejpřesnější metodou (HVPG) a umožňoval srovnání portálních tlaků před léčbou a po léčbě. U pacientů se vstupní portální hypertenzí (před léčbou) bylo možné HVPG měřit po léčbě u celkem 60 pacientů. Ve všech stratifikovaných skupinách portálních tlaků (6–9 mm Hg, 10–15 mm Hg a > 16 mm Hg) došlo ke statisticky signifikantnímu poklesu tlaku v portálním řečišti po úspěšné léčbě. Nejmenší rozdíl (i když statisticky významný – p = 0,018) byl zaznamenán ve skupině s nejtěžším stupněm portální hypertenze (HVPG > 16 mm Hg). Jistě lze spekulovat, zdali pokles stupně portální hypertenze nebude s odstupem času výraznější, neboť v této práci byla hemodynamika měřena krátce po ukončení léčby a dosažení setrvalé virologické odpovědi (SVR), tedy vyléčení.
Vývoj jícnových varixů
Portální hypertenze, která je klinicky vyjádřena především vznikem a formací jícnových (ev. žaludečních) varixů, zřejmě nejlépe definuje závěrečná stadia přirozeného vývoje jaterní cirhózy. U pacientů, kteří zatím nemají jícnové varixy, je pravděpodobnost jejich rozvoje asi 7–8 % ročně [19,20]. Celkově se vyvinou jícnové varixy během života u poloviny pacientů s cirhózou [21] a asi u třetiny těchto pacientů se objeví variceální krvácení [22]. U pacientů s již přítomnými varixy činí pravděpodobnost progrese z malých varixů do rizikovějších velkých varixů asi 7–10 % za rok a riziko progrese je vyšší při vyšším skóre dle Childovy-Pughovy klasifikace, při alkoholické cirhóze s pokračujícím abúzem alkoholu a při nálezu rizikových znamení na varixech (červená znamení).
Roční riziko krvácení z jícnových varixů je 5–15 % [20]. Nejvyšší riziko krvácení během prvních let sledování je samozřejmě u pacientů s velkými varixy.
Prediktory vyššího rizika krvácení [19,20]
- přítomnost dekompenzované cirhózy (Child B nebo C)
- velikost varixů (malé vs velké)
- přítomnost červených znamení během endoskopie
Screening přítomnosti jícnových varixů
Většina pacientů s prokázanou jaterní cirhózou by měla podstoupit gastroskopické vyšetření (ezofagogastroduodenoskopie – EGDS). V době provedené EGDS má asi 30 % pacientů s kompenzovanou cirhózou a 60 % pacientů s dekompenzovanou cirhózou přítomné jícnové varixy [23]. Roční riziko krvácení se potom pohybuje kolem 12 % a každá epizoda variceálního krvácení je spojená s až 15–20% mortalitou [21,24]. Přítomnost a velikost (rizikovost) varixů nám pomůže stanovit klinické stadium jaterní cirhózy (viz výše) a ev. identifikovat pacienty s vysokým rizikem krvácení, kteří by měli podstoupit primární prevenci krvácení [25]. Lze nyní zvolit i alternativní přístupy. Např. u pacientů s HCV cirhózou je riziko přítomnosti významných varixů velmi nízké, pokud je hladina trombocytů > 150 000 a elasticita jaterní tkáně < 20 kPa (vyšetřeno transientní elastografií) [25]. Tyto pacienty je např. vhodné sledovat ročně a hodnotit hladinu trombocytů a elastografii. Pokud trombocyty klesnou < 150 000, nebo elasticita stoupne > 20 kPa, pak je vhodné provést screening přítomnosti portální hypertenze (jícnové varixy, kongestivní gastropatie, žaludeční varixy). Optimální a hlavní metodou je stále EGDS. Byly zkoušeny i alternativní metody, např. kapslová endoskopie, ale zatím bez většího rozšíření a využití.
Neinvazivní metody predikce přítomnosti varixů
V řadě klinických studií se neinvazivní metody detekce signifikantní portální hypertenze testovaly, nicméně žádná z nich zatím nemůže plně nahradit endoskopické vyšetření. Zkoumal se např. poměr hladiny trombocytů k diametru sleziny či sonografické vyšetření distálního jícnu (silnější stěna jícnu v přítomnosti varixů). V poslední době se objevují práce, které se na základě změřené elasticity sleziny (s narůstající portální hypertenzí elasticita sleziny klesá) pokoušejí predikovat přítomnost jícnových varixů. Zvýšená elasticita sleziny (acoustic radiation force impulse – ARFI metoda) je spojena s přítomností portální hypertenze a přítomností jícnových varixů. Nicméně tuto metodu je nutné standardizovat a zatím není uvedena v doporučených postupech [26–28].
Pacienti, kteří nemají varixy při vstupním vyšetření, by měli mít EGDS opakovánu každé 2 roky [21]. Pacienti s malými varixy by měli mít opakovánu EGDS za 1–2 roky a pacienti s dekompenzovanou cirhózou by měli mít EGDS každý rok.
Klasifikace jícnových varixů
Varixy byly dříve klasifikovány dle různých schémat či popisů (F1–F3 nebo dle Sarina atd). Z praktického hlediska se nyní využívá rozdělení varixů podle toho, zda vyžadují preventivní léčbu:
- malé varixy (nevyžadují léčbu)
- malé, rovné varixy, minimálně prominující do lumen jícnu (F1)
- velké varixy (nutné léčit)
- rozšířené, vinuté varixy, které zaujímají méně než třetinu jícnu (F2)
- rozšířené, vinuté varixy, které zaujímají více než třetinu jícnu (F3)
Terapie jícnových varixů
Terapie jícnových varixů zahrnuje:
- primární prevence krvácení z varixů:
- surveillance vývoje varixů
- léčba rizikových varixů
- léčba krvácejících jícnových či žaludečních varixů
- sekundární prevence krvácení z varixů
- kauzální léčba jaterního onemocnění (zabránění dekompenzace, regrese fibrózy, ev. regrese stupně portální hypertenze)
Metody primární prevence krvácení z jícnových varixů: podstatou primární profylaxe je předejít prvnímu krvácení z jícnových (žaludečních) varixů, nebo jej alespoň co nejvíce oddálit.
K primární profylaxi by měli být indikováni pacienti se zvýšeným rizikem krvácení z varixů:
- pacienti s cirhózou stadia Child-Pugh B a C
- pacienti s velkými varixy
- pacienti s varixy s rizikovým znamením (červená znamení, hemocystické skvrny)
Identifikace a léčba pacientů s rizikovými varixy vede ke zlepšení klinického vývoje a prognózy pacientů
Podstatou primární profylaxe jsou následující postupy:
- farmakologická prevence: snížení portálního tlaku, resp. snížení přítoku krve do portálního řečiště (neselektivní betablokátory – nsBB, dle guidelines [25] lze použít propranolol, nadolol a karvedilol); propranolol a nadolol nejsou na českém trhu k dispozici; karvedilol vede navíc ke snížení jaterní vaskulární rezistence [29], a tím ke komplexnějšímu poklesu portálního tlaku
- endoskopická: přímá léčba jícnových varixů (ligace varixů – endoscopic variceal ligation/EVL, sklerotizace se v rámci primární prevence příliš nepoužívá)
Obě metody jsou v primární prevenci krvácení z jícnových varixů (JV) efektivní a jednoznačně lepší než absence jakékoliv léčby. Z některých studií vyplývá, že EVL by měla vykazovat lepší výsledky z hlediska předcházení krvácení ve srovnání s nsBB, ale na druhou stranu je EVL zatížena možností periprocedurálních komplikací [30]. Neselektivní BB mají sice menší riziko komplikací, ale někteří pacienti je z hemodynamického hlediska netolerují. Zdá se, že nsBB by mohly vést i k jisté prevenci (či oddálení vzniku) ascitu [31] nebo snížení rizika spontánní bakteriální peritonitidy v důsledku snížení portálního tlaku [32]. Volba EVL či nsBB závisí na lokálních zkušenostech a eventuálně kontraindikacích léčby nsBB a případně souhlasu pacienta s opakovanými endoskopickými vyšetřeními s jistým procedurálním rizikem. Některá data ukazují, že u pacientů s velkými varixy je EVL účinnější z hlediska primární prevence než nsBB, v tomto případě je možné preferovat EVL [30]. Pro primární profylaxi není doporučena sklerotizace JV (více komplikací, než ostatní 2 metody) a není doporučena kombinovaná terapie nsBB s EVL [21,25], neboť kombinovaná terapie neměla lepší efekt než monoterapie s EVL [33]. Terapie nsBB se musí dobře zvažovat u pacientů s refrakterním ascitem či spontánní bakteriální peritonitidou. Dle výsledků recentních studií [34,35] je u pacientů s refrakterním ascitem léčba nsBB riziková a zkracuje dobu přežití (v důsledku snížení efektivní hodnoty středního arteriálního tlaku MAP) [36] s vyšším rizikem rozvoje hepatorenálního syndromu [35].
Dávka nsBB by měla být titrována dle hodnoty TF nebo dle hodnoty HVPG (klinicky minimálně využívané) [34].
Management akutního krvácení do horní části trávicího traktu při portální hypertenzi
Toto krvácení se objeví asi u třetiny cirhotiků s jícnovými varixy [22]. Dle některých studií se zhruba polovina všech krvácení zastaví spontánně, nicméně dochází k časté a časné recidivě krvácení. Pravděpodobnost dosažení hemostázy je nižší u:
- pacientů s Child-Pugh C jaterní cirhózou
- pacientů s aktivním variceálním krvácením během vstupní endoskopie
- pacientů s HVPG vyšším než 20 mm Hg
Přibližně 70 % neléčených pacientů zemře během 1. roku po iniciálním krvácení na rekurenci krvácení či jaterní selhání, jaterní encefalopatii, refrakterní ascites či infekci. Léčba varixů spočívající v endoskopické EVL či skleroterapii snižuje prokazatelně riziko rekrvácení a mortalitu.
Pokud se vstupní variceální krvácení spontánně zastavilo, pak asi u třetiny těchto pacientů je riziko nového krvácení během následujících 6 týdnů a u 70 % v dlouhodobější perspektivě [37].
Faktory spojené s časnou rekurencí krvácení [22]:
- věk nad 60 let
- alkoholická cirhóza jater
- těžké krvácení vstupně (Hb < 80 g/l)
- trombocytopenie
- encefalopatie
- ascites
- aktivní krvácení během vstupní endoskopie
- krvácení ze žaludečních varixů
- velké varixy s rizikovými znameními
- vysoký HVPG
- renální selhání
Všeobecná opatření u pacientů s variceálním krvácením
Během posledních 20 let došlo při léčbě a managementu krvácení do horní části GIT při portální hypertenzi k významnému pokroku. V 80. letech minulého století byla první ataka variceálního krvácení spojena s téměř 50% rizikem úmrtí. Během následující doby mortalita klesla na současných asi 15–20 % při první atace krvácení [38], přesto samozřejmě zůstává neakceptovatelně vysoká. Hlavními důvody pozitivního vývoje během této doby byl významný rozvoj principů a metod intenzivní péče, dostupná efektivní farmakoterapie a zdokonalení metod endoskopie a endoskopické hemostázy [39].
Iniciální opatření zahrnují hemodynamickou resuscitaci a stabilizaci pacienta (je ale nutné myslet na riziko nadměrného podání krevních transfuzí se zhoršením prognózy [40], spíše volit restriktivní přístup) a úpravu eventuálně přítomné koagulopatie. Pacient by měl rovněž dostat ATB (fluorochinolony či cefalosporiny 3. generace).
Farmakoterapie
Prvním krokem při suspekci na variceální krvácení je farmakoterapie a podání vazoaktivních látek (oktreotid, somatostatin, u nás nejčastěji terlipressin). Vazoaktivní látky podávané v případě aktivního krvácení snižuji portální tlak a přítok do portálního řečiště. Terlipressin je preferované farmakum ve většině zemí. Terlipressin je srovnatelná či lepší vazoaktivní substance v porovnání s ostatními preparáty [41]. Tato léčba by měla být zahájena v případě krvácení do horní části GIT u všech nemocných se známými varixy, ale i u všech pacientů s cirhózou či podezřením na přítomnost cirhózy a nečekat na potvrzení přítomnosti variceálního krvácení. Terlipressin je podáván v iniciální dávce 1–2 mg i.v. a poté podáván 1 mg i.v. každé 4 hod, případně podáván kontinuálně. Tato farmakologická terapie je podávána ještě 3–5 dní po zástavě krvácení. V současnosti se zdá, že kontinuální intravenózní podávání terlipressinu je lépe snášeno, vykazuje stabilní sérovou hladinu, má nižší riziko nežádoucích účinků a při tomto způsobu aplikace postačují k dosažení identického efektu nižší dávky [42]. Vazoaktivní látky jednoznačně zlepšují prognózu pacientů, snižují mortalitu, zlepšují hemostázu, snižují potřebu krevních převodů a zkracují dobu hospitalizace [41]. Po těchto iniciálních opatřeních by měla následovat endoskopie (EGDS) do 12 hod, u nestabilních pacientů urgentní endoskopie do 2 hod od přijetí pacienta (není ale definováno v doporučených postupech). Další postup pak závisí na endoskopickém nálezu.
Endoskopická terapie
Endoskopická terapie je jasnou metodou volby pro definitivní diagnostiku a léčbu variceálního krvácení. Cílem je provést endoskopické vyšetření nejpozději (dle doporučených postupů) do 12 hod [25], v praxi relativně dříve (dle lokálních podmínek). Zásadní podmínkou endoskopické terapie je plná stabilizace pacienta po hemodynamické a ventilační stránce. V jedné době je provedena diagnostika i terapie. V průběhu endoskopické terapie je preferována ligace jícnových varixů (EVL) před sklerotizací (ES), neboť druhá metoda má nesporně více komplikací [25]. Pokud EVL selže či není možná či v závislosti na osobní zkušenosti endoskopisty, je možné použít sklerotizaci varixů [25].
Komplikace endoskopické sklerotizace jsou především ulcerace jícnu, krvácení, dysmotilita jícnu, striktury jícnu, perforace.
Ligace jícnových varixů (EVL) znamená naložení drobných elastických kroužků na prominující jícnové varixy v úseku distálního jícnu, čímž dojde k trombotizování varixu a jeho odloučení s tvorbou mělkého vředu sliznice distálního jícnu.
Obě metody jsou v iniciální terapii zhruba stejně účinné z hlediska dosažení hemostázy, efektivita je u 70–100 % pacientů, řada studií běžně udává úspěšnost 90 %. V metaanalýze randomizovaných studií byla EVL srovnatelná s ES v iniciální hemostáze, ale EVL byla efektivnější ve všech dalších parametrech: nižší riziko opakování krvácení, nižší mortalita, nižší riziko tvorby stenóz a lepší dlouhodobý efekt [43]. Bez ohledu na typ vstupní endoskopické terapie je poté v dalším postupu (sekundární prevence krvácení) indikována EVL.
Management selhání endoskopické terapie
Urgentní endoskopie nevede k plné hemostáze asi u 10–20 % pacientů [22,44]. Samozřejmě pacienti, u kterých nedojde iniciálně k hemostáze, jsou ohroženi exsanguinací, dalšími komplikacemi spojenými s krvácením a úmrtím. U pacientů, u kterých dojde k časné recidivě krvácení, se většinou provádí druhé endoskopické vyšetření se snahou o dokončení hemostázy (nicméně spíše jde o zvyk, neboť přesná data v tomto případě nejsou k dispozici) [25]. V případě, že ani opakování endoskopické terapie nepovede k efektivní hemostáze, je nutné indikovat náhradní řešení:
Balonová tamponáda (Sengstakenova-Blakemorova sonda)
Velmi dočasná možnost zástavy krvácení, většinou používaná nyní jako bridging k metodě s delším efektem (dosažení stabilizace pacienta před zavedením TIPS např.). Nevýhody této terapie jsou:
- omezená doba zavedení (12 hod)
- vysoká frekvence komplikací (včetně rizika ruptury jícnu)
- častá recidiva krvácení po odstranění sondy
- omezená efektivita (iniciální kontrola krvácení byla dosažena v širokém rozmezí 30–90 % pacientů, ve starších studiích) [45]
Zavedení TIPS (transjugulární intrahepatický portosystémový shunt)
Cestou jaterních žil se skrze jaterní tkáň pomocí katétru zavede stent do portální žíly, který slouží jako side-to-side porto-systémový zkrat. Po zavedení tohoto stentu dojde k významnému poklesu portálního tlaku a k hemostáze u 90–100 % pacientů [22]. Absolutními kontraindikacemi jsou srdeční selhání, těžká plicní hypertenze, těžká sepse a pokročilé jaterní selhání (Child C 12 bodů a více). Mezi komplikace patří především jaterní encefalopatie, jaterní dysfunkce až selhání v důsledku snížení perfuze jater a komplikace metody (krvácení, stenóza). V současné době je zřetelný trend indikovat TIPS u vysoce rizikových pacientů (pacienti s významným variceálním krvácením v době endoskopie, s pokročilou jaterní dysfunkcí či selháním jater – Child B-C, max. 13 bodů, se selháním endoskopické metody kontroly krvácení, HVPG nad 20 mm Hg) časně, tzn. během 72 hod po iniciální endoskopii [46,47]. Uvedené studie se zabývaly efektem indikace a provedení časného TIPS vs pokračování ve vazoaktivní terapii + EVL u uvedených rizikových pacientů a nemocné sledovaly 16 měsíců. K recidivě krvácení ve skupině TIPS došlo jen u 1 pacienta proti 14 pacientů ve skupině vazoaktivní + EVL. Pacienti ve skupině TIPS měli rovněž signifikantně lepší přežití (úmrtí 4 pacientů vs 12 pacientů), významně nižší riziko opakování krvácení během následujícího roku (hemostáza 50 % vs 97 % u TIPS). Rovněž délka léčby a pobyt na jednotkách intenzivní péče byla signifikantně delší u pacientů léčených farmakoterapií a EVL. TIPS je tedy spojený se signifikantním snížením mortality i selhání léčby.
Časný TIPS je vhodný rovněž pro pacienty s krvácením ze žaludečních varixů (GOV1 a GOV2) či izolovaných žaludečních varixů. Tento postup je již kodifikován v doporučených postupech [25]. Zůstává však zatím otázkou přesná selekce pacientů, kterým časný TIPS může jednoznačně pomoci (a převýšit rizika této metody).
Implantace samoexpandibilního stentu (SEMS)
Relativně nízká účinnost a vysoké riziko komplikací a nežádoucích účinků zavedení balonové tamponády (viz výše) vedlo k zavedení SEMS do klinické praxe. Tato metoda je rovněž doporučována recentními guidelines (Baveno VI). Je považována za alternativu balonové tamponády při refrakterním variceálním krvácení s vyšší účinností a nižším výskytem komplikací [48] a zdá se, že by tato metoda měla býti preferována v případě, že není k dispozici akutní TIPS. Recentní metaanalýza [49] prokázala, že implantace stentu je technicky schůdná a účinná metoda (96% iniciální úspěch a efektivita). Nejčastější komplikací této metody je migrace stentu a druhou nejčastější komplikací je tvorba ulcerací v distálním jícnu a recidiva krvácení po dosažení iniciální hemostázy. Studie publikované v roce 2016 srovnávala efektivitu balonové tamponády a implantace metalického stentu [50]. V této randomizované kontrolované studii u pacientů se selháním konvenční léčby variceálního krvácení byl SEMS účinnější než balonková tamponáda. Pacienti se SEMS měli lepší kontrolu krvácení (85 % vs 47 %), potřeba transfuzí byla nižší (2 vs 6 ERY jednotek) a hlavně počet závažných komplikací byl nižší (15 % vs 47 %). Zdá se tedy, že SEMS má vyšší účinnost s menším množstvím nežádoucích účinků než balonová tamponáda u pacientů, u nichž selhala běžná kontrola variceálního krvácení.
Chirurgické metody zástavy krvácení
Přestože jsou chirurgické metody zástavy variceálního krvácení velmi účinné z hlediska zástavy krvácení, tak jsou spojeny u pacientů s pokročilou jaterní cirhózou a s významným krvácením s dramaticky vysokou mortalitou, která dosahuje až 50 % [51]. Mezi chirurgické metody patří chirurgické vytvoření porto-systémové spojky (většinou spleno-renální) nebo devaskularizační operace (transekce jícnu dle Sugiury) či skeletizace žaludku. Tyto výkony jsou nyní prováděny extrémně vzácně, většinou se přistupuje k některé z předchozích tří metod.
Experimentální přístupy
V současné době se zkouší aplikace hemostatického prášku (který je již k použití pro krvácející gastroduodenální vředy). Tento prášek se stává kohezivní a adheruje ke stěně GIT v místě, v němž se setká s vlhkostí, přičemž vytváří mechanickou bariéru v místě krvácení, a tím brání jeho pokračování. Prášek byl testován v klinické studii (9 pacientů) s velmi dobrým efektem [52]. Tento postup však bude vyžadovat ještě další výzkum a ověření a zatím není uvedený v doporučených postupech.
Léčba krvácení ze žaludečních varixů
Léčba krvácení ze žaludečních varixů je částečně podobná výše uvedené terapii krvácení z jícnových varixů. Indikováno je časné podání vazoaktivní farmakoterapie (terlipressin) a z hlediska zástavy krvácení je nutné endoskopické vyšetření a v případě selhání této terapie přichází v úvahu především balonková sonda nebo časný TIPS. Endoskopické ošetření varixů v žaludku je však daleko obtížnější než terapie jícnových varixů. V literatuře je popisována jak ligace žaludečních varixů, tak i jejich sklerotizace. Žaludeční varixy však často krvácejí znovu časně po ošetření. Proto je v případě žaludečních varixů vhodné volit spíše jejich obliteraci tkáňovým lepidlem, nejčastěji cyanoakrylátem (Histoacryl). Tento způsob má dle klinických studií nejlepší výsledky a je uveden v doporučených postupech [25,53]. Cyanoakrylátové lepidlo ve vlhkém prostředí (uvnitř varixu) polymerizuje do pevné sraženiny a uzavírá varix. Tuto metodu lze tedy použít jak v léčbě aktivního akutního krvácení, tak i v prevenci recidivy nového krvácení. Cyanoakrylátové lepidlo je lepší než ligace či jiné metody [54]. Intravarikózní injekce cyanoakrylátu je považována za shodně účinnou jako TIPS, ale s menšími riziky a především menší invazivitou. Pro refrakterní krvácení ze žaludečních varixů je indikováno zavedení TIPS.
Závěr
Jaterní cirhóza je závažným chronickým onemocněním s vysokou morbiditou a mortalitou. V průběhu svého vývoje vede u řady pacientů k pozdním komplikacím. Rozvoj portální hypertenze s tvorbou jícnových či žaludečních varixů lze považovat za zlomový bod v přirozeném vývoji cirhózy jater. Přítomnost jícnových varixů a především jejich krvácení predikuje vysokou mortalitu těchto pacientů a jejich krátké přežití. Přestože bylo za několik posledních dekád dosaženo zásadního pokroku jak ve screeningu přítomnosti jícnových varixů (včetně nových neivazivních metod) a v primární prevenci krvácení, tak i v terapii akutního variceálního krvácení (intenzivní péče, farmakoterapie, endoskopické metody, stenty, TIPS) a bylo dosaženo výrazného snížení mortality při první atace krvácení, přesto jsou aktuální data ne zcela uspokojivá (stále trvá mortalita 15–20 %). Je nutné tedy především časně diagnostikovat a léčit pacienty s onemocněním jater, která mohou vést do stadií pokročilé fibrózy a cirhózy. Časná kauzální léčba řady jaterních onemocnění může vést k regresi fibrózy či cirhózy jater a snad též částečně k regresi stupně portální hypertenze, a tím i snížení rizika krvácení.
This study was supported by the grant of Ministry of Health of the Czech Republic – Conceptual Development of Research Organization (Faculty Hospital in Pilsen – FNPl, 00669806).
MUDr. Václav Hejda
hejdav@fnplzen.cz
I. interní klinika LF UK a FN Plzeň
www.fnplzen.cz
Doručeno do redakce 2. 9. 2016
Přijato po recenzi 12. 9. 2016
Sources
1. Udompap P, Kim D, Kim WR. Current and Future Burden of Chronic Nonmalignant Liver Disease. Clin Gastroenterol Hepatol 2015; 13(12): 2031–2041. Dostupné z DOI: <http://dx.doi.org/10.1016/j.cgh.2015.08.015>.
2. Mokdad AA, Lopez AD, Shahraz S et al. Liver cirrhosis mortality in 187 countries between 1980 and 2010: a systematic analysis. BMC Med 2014; 12 : 145. Dostupné z DOI: <http://dx.doi.org/10.1186/s12916–014–0145-y>.
3. Neff GW, Duncan CW, Schiff ER. The current economic burden of cirrhosis. Gastroenterol Hepatol (NY) 2011; 7(10): 661–671.
4. Wong RJ, Aguilar M, Cheung R et al. Nonalcoholic steatohepatitis is the second leading etiology of liver disease among adults awaiting liver transplantation in the United States. Gastroenterology 2015; 148(3): 547–555. Dostupné z DOI: <http://dx.doi.org/10.1053/j.gastro.2014.11.039>.
5. Ishak K, Baptista A, Bianchi L et al. Histological grading and staging of chronic hepatitis. J Hepatol 1995; 22(6): 696–699.
6. D‘Amico G, Garcia-Tsao G, Pagliaro L. Natural history and prognostic indicators of survival in cirrhosis: a systematic review of 118 studies. J Hepatol 2006; 44(1): 217–231.
7. Fleming KM, Aithal GP, Card TR et al. All-cause mortality in people with cirrhosis compared with the general population: a population-based cohort study. Liver Int 2012; 32(1): 79–84. Dostupné z DOI: <http://dx.doi.org/10.1111/j.1478–3231.2011.02517.x>.
8. Albilllos A, Garcia-Tsao G. Classification of cirrhosis: the clinical use of HVPG measurements. Dis Markers 2011; 31(3): 121–128. Dostupné z DOI: <http://dx.doi.org/10.3233/DMA-2011–0834>.
9. Ripoll C, Lastra P, Rincon D et al. Comparison of MELD, HVPG, and their changes to predict clinically relevant endpoints in cirrhosis. Scand J Gastroenterol 2012; 47(2): 204–211. Dostupné z DOI: <http://dx.doi.org/10.3109/00365521.2011.645500>.
10. Ripoll C, Groszmann R, Garcia-Tsao G et al. Hepatic venous pressure gradient predicts clinical decompensation in patients with compensated cirrhosis. Gastroenterology 2007; 133(2): 481–488.
11. Ripoll C, Banares R, Rincon D et al. Influence of hepatic venous pressure gradient on the prediction of survival of patients with cirrhosis in the MELD Era. Hepatology 2005; 42(4): 793–801.
12. Abraldes JG, Villanueva C, Banares R et al. Hepatic venous pressure gradient and prognosis in patients with acute variceal bleeding treated with pharmacologic and endoscopic therapy. J Hepatol 2008; 48(2): 229–236.
13. Albillos A, Banares R, Gonzalez M et al. Value of the heujujkpatic venous pressure gradient to monitor drug therapy for portal hypertension: a meta-analysis. Am J Gastroenterol 2007; 102(5): 1116–1126.
14. Bruno S, Crosignani A, Facciotto C et al. Sustained virologic response prevents the development of esophageal varices in compensated, Child-Pugh class A hepatitis C virus-induced cirrhosis. A 12-year prospective follow-up study. Hepatology 2010; 51(6): 2069–2076. Dostupné z DOI: <http://dx.doi.org/10.1002/hep.23528>.
15. Poynard T, McHutchison J, Manns M et al. Impact of pegylated interferon alfa-2b and ribavirin on liver fibrosis in patients with chronic hepatitis C. Gastroenterology 2002; 122(5): 1303–1313.
16. Marcellin P, Gane E, Buti M et al. Regression of cirrhosis during treatment with tenofovir disoproxil fumarate for chronic hepatitis B: a 5-year open-label follow-up study. Lancet 2013; 381(9865): 468–475. Dostupné z DOI: <http://dx.doi.org/10.1016/S0140–6736(12)61425–1>
17. Roberts S, Gordon A, McLean C et al. Effect of sustained viral response on hepatic venous pressure gradient in hepatitis C-related cirrhosis. Clin Gastroenterol Hepatol 2007; 5(8): 932–937.
18. Mandorfer M, Kozbial K, Schwabl P et al. Sustained virologic response to interferon-free therapies ameliorates HCV-induced portal hypertension. J Hepatol 2016; pii: S0168–8278(16)30238–0. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jhep.2016.05.027>.
19. Groszmann RJ, Garcia-Tsao G, Bosch J et al. Beta-blockers to prevent gastroesophageal varices in patients with cirrhosis. N Engl J Med 2005; 353(21): 2254–2261.
20. Merli M, Nicolini G, Angeloni S et al. Incidence and natural history of small esophageal varices in cirrhotic patients. J Hepatol 2003;38(3):266–272.
21. Garcia-Tsao G, Sanyal AJ, Grace ND et al. Prevention and management of gastroesophageal varices and variceal hemorrhage in cirrhosis. Hepatology 2007; 46(3): 922–938. Erratum in Hepatology 2007; 46(6): 2052.
22. Habib A, Sanyal AJ. Acute variceal hemorrhage. Gastrointest Endosc Clin N Am 2007; 17(2): 223–252, v.
23. Vlachogiannakos J, Goulis J, Patch D et al. Review article: primary prophylaxis for portal hypertensive bleeding in cirrhosis. Aliment Pharmacol Ther 2000; 14(7): 851–860.
24. D‘Amico G, Garcia-Pagan JC, Luca A, Bosch J. Hepatic vein pressure gradient reduction and prevention of variceal bleeding in cirrhosis: a systematic review. Gastroenterology 2006; 131(5): 1611–1624.
25. de Franchis R. Expanding consensus in portal hypertension: Report of the Baveno VI Consensus Workshop: Stratifying risk and individualizing care for portal hypertension. J Hepatol 2015; 63(3): 743–752. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jhep.2015.05.022>.
26. Colecchia A, Montrone L, Scaioli E et al. Measurement of spleen stiffness to evaluate portal hypertension and the presence of esophageal varices in patients with HCV-related cirrhosis. Gastroenterology 2012; 143(3): 646–654. Dostupné z DOI: <http://dx.doi.org/10.1053/j.gastro.2012.05.035>
27. Mori K, Arai H, Abe T et al. Spleen stiffness correlates with the presence of ascites but not esophageal varices in chronic hepatitis C patients. Biomed Res Int 2013; 2013 : 857862. Dostupné z DOI: <http://dx.doi.org/10.1155/2013/857862>.
28. Attia D, Schoenemeier B, Rodt T et al. Evaluation of Liver and Spleen Stiffness with Acoustic Radiation Force Impulse Quantification Elastography for Diagnosing Clinically Significant Portal Hypertension. Ultraschall Med 2015; 36(6): 603–610. Dostupné z DOI: <http://dx.doi.org/10.1055/s-0041–107971>.
29. Bosch J. Carvedilol for portal hypertension in patients with cirrhosis. Hepatology 2010; 51(6): 2214–2218. Dostupné z DOI: <http://dx.doi.org/10.1002/hep.23689>.
30. Li L, Yu C, Li Y. Endoscopic band ligation versus pharmacological therapy for variceal bleeding in cirrhosis: a meta-analysis. Can J Gastroenterol 2011; 25(3): 147–155.
31. Hernandez-Gea V, Aracil C, Colomo A et al. Development of ascites in compensated cirrhosis with severe portal hypertension treated with beta-blockers. Am J Gastroenterol 2012; 107(3): 418–427. Dostupné z DOI: <http://dx.doi.org/10.1038/ajg.2011.456>.
32. Senzolo M, Cholongitas E, Burra P et al. beta-Blockers protect against spontaneous bacterial peritonitis in cirrhotic patients: a meta-analysis. Liver Int 2009; 29(8): 1189–1193. Dostupné z DOI: <http://dx.doi.org/10.1111/j.1478–3231.2009.02038.x>.
33. Sarin SK, Wadhawan M, Agarwal SR et al. Endoscopic variceal ligation plus propranolol versus endoscopic variceal ligation alone in primary prophylaxis of variceal bleeding. Am J Gastroenterol 2005; 100(4): 797–804.
34. Serste T, Melot C, Francoz C et al. Deleterious effects of beta-blockers on survival in patients with cirrhosis and refractory ascites. Hepatology 2010; 52(3): 1017–1022. Dostupné z DOI: <http://dx.doi.org/10.1002/hep.23775>.
35. Mandorfer M, Bota S, Schwabl P et al. Nonselective beta blockers increase risk for hepatorenal syndrome and death in patients with cirrhosis and spontaneous bacterial peritonitis. Gastroenterology 2014; 146(7): 1680–1690. Dostupné z DOI: <http://dx.doi.org/10.1053/j.gastro.2014.03.005>.
36. Ruiz-del-Arbol L, Monescillo A, Arocena C et al. Circulatory function and hepatorenal syndrome in cirrhosis. Hepatology 2005; 42(2): 439–447.
37. Burroughs AK, McCormick PA. Prevention of variceal rebleeding. Gastroenterol Clin North Am 1992;21(1):119–147.
38. Jairath V, Rehal S, Logan R et al. Acute variceal haemorrhage in the United Kingdom: patient characteristics, management and outcomes in a nationwide audit. Dig Liver Dis 2014; 46(5): 419–426. Dostupné z DOI: <http://dx.doi.org/10.1016/j.dld.2013.12.010>.
39. Chalasani N, Kahi C, Francois F et al. Improved patient survival after acute variceal bleeding: a multicenter, cohort study. Am J Gastroenterol 2003; 98(3): 653–659.
40. Villanueva C, Colomo A, Bosch A et al. Transfusion strategies for acute upper gastrointestinal bleeding. N Engl J Med 2013; 368(1): 11–21. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa1211801>. Erratum in N Engl J Med. 2013; 368(24): 2341.
41. Wells M, Chande N, Adams P et al. Meta-analysis: vasoactive medications for the management of acute variceal bleeds. Aliment Pharmacol Ther 2012; 35(11): 1267–1278. Dostupné z DOI: <http://dx.doi.org/10.1111/j.1365–2036.2012.05088.x>.
42. Cavallin M, Piano S, Romano A et al. Terlipressin given by continuous intravenous infusion versus intravenous boluses in the treatment of hepatorenal syndrome: A randomized controlled study. Hepatology 2016; 63(3): 983–992. Dostupné z DOI: <http://dx.doi.org/10.1002/hep.283>.
43. Laine L, Cook D. Endoscopic ligation compared with sclerotherapy for treatment of esophageal variceal bleeding. A meta-analysis. Ann Intern Med 1995; 123(4): 280–287.
44. Bosch J, Abraldes JG, Berzigotti A et al. Portal hypertension and gastrointestinal bleeding. Semin Liver Dis 2008; 28(1): 3–25. Dostupné z DOI: <http://dx.doi.org/10.1055/s-2008–1040318>.
45. Paquet KJ, Feussner H. Endoscopic sclerosis and esophageal balloon tamponade in acute hemorrhage from esophagogastric varices: a prospective controlled randomized trial. Hepatology 1985; 5(4): 580–583.
46. Garcia-Pagan JC, Caca K, Bureau C et al. Early use of TIPS in patients with cirrhosis and variceal bleeding. N Engl J Med 2010; 362(25): 2370–2379. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa0910102>.
47. Garcia-Pagan JC, Di PM, Caca K et al. Use of early-TIPS for high-risk variceal bleeding: results of a post-RCT surveillance study. J Hepatol 2013; 58(1): 45–50. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jhep.2012.08.020>.
48. Hubmann R, Bodlaj G, Czompo M et al. The use of self-expanding metal stents to treat acute esophageal variceal bleeding. Endoscopy 2006; 38(9): 896–901.
49. McCarty TR, Njei B. Self-expanding metal stents for acute refractory esophageal variceal bleeding: A systematic review and meta-analysis. Dig Endosc 2016; 28(5): 539–547. Dostupné z DOI: <http://dx.doi.org/10.1111/den.12626>
50. Escorsell A, Pavel O, Cardenas A et al. Esophageal balloon tamponade versus esophageal stent in controlling acute refractory variceal bleeding: A multicenter randomized, controlled trial. Hepatology 2016; 63(6): 1957–1967. Dostupné z DOI: <http://dx.doi.org/10.1002/hep.28360>.
51. Henderson JM. Salvage therapies for refractory variceal hemorrhage. Clin Liver Dis 2001; 5(3): 709–725.
52. Ibrahim M, El-Mikkawy A, Mostafa I et al. Endoscopic treatment of acute variceal hemorrhage by using hemostatic powder TC-325: a prospective pilot study. Gastrointest Endosc 2013; 78(5): 769–773. Dostupné z DOI: <http://dx.doi.org/10.1016/j.gie.2013.07.037>.
53. Romero-Castro R, Ellrichmann M, Ortiz-Moyano C et al. EUS-guided coil versus cyanoacrylate therapy for the treatment of gastric varices: a multicenter study (with videos). Gastrointest Endosc 2013; 78(5): 711–721. Dostupné z DOI: <http://dx.doi.org/10.1016/j.gie.2013.05.009>.
54. Sarin SK, Jain AK, Jain M et al. A randomized controlled trial of cyanoacrylate versus alcohol injection in patients with isolated fundic varices. Am J Gastroenterol 2002; 97(4): 1010–1015.
Labels
Diabetology Endocrinology Gastroenterology and hepatology Internal medicine
Article was published inInternal Medicine

2016 Issue Suppl2
Most read in this issue- Pozdní komplikace jaterní cirhózy – management krvácení do GIT při portální hypertenzi
- Extrahepatální manifestace infekce HCV
- Reálná data léčby virové hepatitidy C v České republice
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

