-
Medical journals
- Career
Reálná data léčby virové hepatitidy C v České republice
: Libuše Husová
: Centrum kardiovaskulární a transplantační chirurgie, Brno
: Vnitř Lék 2016; 62(Suppl2): 6-9
: Original Contributions
Předkládáme první reálná data o úspěšnosti bezinterferonové léčby chronické hepatitidy C v České republice. Pacienti byli léčeni kombinovanou terapií paritaprevir/ritonavir + ombitasvir + dasabuvir s/nebo bez ribavirinu. Soubor tvořilo 109 pacientů, převážně mužů 62 (57 %), převládajícím genotypem byl genotyp 1b u 101 pacientů (93 %) a v menšině byly genotyp 1a (6/109, 5 %) a genotyp 4 (2/109, 2 %). Byli léčeni jak pacienti dříve neléčení – naivní (43/109, 39 %), tak již v minulosti léčení (66/109, 61 %). Setrvalá virologická odpověď ve 12. týdnu po ukončení terapie (SVR12) byla 100 %, pokud vyloučíme pacienty, kteří nedosáhli SVR12 z jiného důvodu než pro virologické selhání léčby.
Klíčová slova:
dasabuvir – chronická hepatitida C – ombitasvir – paritaprevir/ritonavir – ribavirinÚvod
Virová hepatitida C (HCV) je stále celosvětovým zdravotním a ekonomickým problémem. V průmyslově vyspělých zemích světa je infekce HCV příčinou 40 % případů cirhózy jater, 60 % případů hepatocelulárního karcinomu (HCC) a 30 % indikací pro transplantaci jater. Vyléčení pacientů s HCV je zcela zásadní pro prognózu těchto nemocných, vede ke snížení vzniku komplikací, tj. jaterního selhání a HCC. Léčba HCV přímo působícími perorálními virostatiky (directly acting antivirals – DAA) má velmi vysokou účinnost (až 100 %), téměř žádné nežádoucí účinky a mimořádně příznivý bezpečnostní profil. Problémem mohou být lékové interakce, které však jsou při pečlivé anamnéze odhalitelné a většinou řešitelné. Její nevýhodou je poměrně vysoká cena. Současné možnosti bezinterferonové léčby v České republice představuji kombinace sofosbuviru s jinými DAA bez nebo s ribavirinem (RBV) a kombinace paritapreviru potencovaného ritonavirem + ombitasvir + dasabuvir s nebo bez ribavirinu. Nové léky se stále vyvíjejí a postupně přicházejí i na český trh, koncem roku 2016 nebo v 1. čtvrtletí roku 2017 se očekává dostupnost nové fixní kombinace elbasviru a grazopreviru (Zepatier) a sofosbuviru s velpatasvirem (Epclusa), které mají rovněž mimořádně vysokou účinnost a bezpečnost. Léčba HCV prodělává v posledních 5 letech zcela mimořádné změny. Do praxe se postupně zavádějí nové DAA, která se podávají buď v kombinaci s pegylovaným interferonem (PEG-IFN) a RBV nebo v bezinterferonových (interferon-free) režimech, nebo dokonce v bezribavirinových (ribavirin-free) režimech. Bezinterferonové režimy spočívají v podání 2 nebo více antivirotik, která přímo zasahují v různých místech procesu replikace viru. Výrazné změny v možnostech léčby HCV vedly k rychlým inovacím doporučených postupů. Evropská asociace pro studium jater (EASL – European Association for the Study of the Liver) vydala doporučení léčby HCV v dubnu roku 2014 [1] a během 1 roku došlo k takovému vývoji léčebných možností, že v rámci 50. výročního zasedaní EASL ve Vídni v dubnu roku 2015 byla vydána doporučení nová [2]. V roce 2016 se nová doporučení očekávají na podzim na kongresu EASL, který bude věnován léčbě virové hepatitidy C. Americká asociace pro studium jater (AASLD – American Association for the Study of Liver Diseases) dokonce přestala svá doporučení vydávat v tištěné formě a zpřístupnila je pouze online na webových stránkách, na nichž jsou plynule doplňována o výsledky nových klinických hodnocení. Při každém stažení tohoto doporučeného postupu se k textu automaticky přiřadí datum, ve kterém daná verze platila a byla uživatelem získaná [3]. Z těchto doporučení pak vycházejí česká doporučení z roku 2015 [4]. Paritaprevir/ritonavir, ombitasvir a dasabuvir (Viekirax, Exviera) – tato léčebná kombinace obsahuje v 1 tabletě paritaprevir (inhibitor NS3/4A proteázy) v dávce 75 mg, potencovaný 50 mg ritonaviru, a ombitasvir (inhibitor NS5A) v dávce 12,5 mg. Doporučenou dávkou jsou 2 tablety jednou denně s jídlem. Druhá tableta obsahuje dasabuvir (Exviera), nenukleosidový inhibitor NS5B polymerázy v dávce 250 mg. Užívá se 2krát denně 1 tableta. Kombinace těchto léčiv, která se pro zjednodušení označuje jako 3D režim, blokuje všechny dosud známé úrovně replikace HCV. Ritonavir nepůsobí proti HCV, ovlivňuje farmakokinetiku a umožňuje podávání paritapreviru v nižší dávce a pouze jednou denně. Tato kombinace je určena pro léčbu pacientů infikovaných genotypem 1, v případě infekce genotypem 4 se používá pouze paritaprevir/ritonavir + ombitasvir, tedy bez dasabuviru. Oba léky byly v České republice registrovány 1. 1. 2015 a maximální cena a úhrada (včetně úhradových podmínek) byla stanovena od 15. 1. 2016 [5].
Z bezpečnostní analýzy dosud publikovaných klinických studií s 3D kombinací s nebo bez RBV vyplynulo, že nejčastějšími nežádoucími účinky bylo svědění kůže, únava, nauzea, astenie a nespavost. Příčinou největšího množství nežádoucích reakcí byl RBV, jehož dávku bylo nutno u 7 % pacientů během terapie snížit. Sama 3D kombinace vedla pouze ke svědění kůže. Podstatné je, že závažné nežádoucí účinky léčby se vyskytly u méně než 2,5 % léčených pacientů. Nežádoucí účinky vedly k předčasnému ukončení léčby v 1–2 % případů. Asymptomatické zvýšeni sérové aktivity alaninaminotransferázy (ALT) se obvykle objevilo během prvních 4 týdnů léčby, vždy odeznělo bez terapeutické intervence a nikdy nebylo provázeno vzestupem sérové hladiny bilirubinu. Naopak přechodný vzestup nepřímého bilirubinu v séru byl pozorován u pacientů léčených 3D a RBV, příčinou byla inhibice bilirubinových transportérů QATP1B1 a QATP1B3 paritaprevirem a hemolýza vyvolaná RBV. Vyšší frekvence vzestupu hladin celkového bilirubinu byla zaznamenána u nemocných s jaterní cirhózou. Při současnem užívání léků s estrogeny bylo riziko elevace aktivity ALT vyšší [2]. Použité režimy (s nebo bez RBV), podávané po dobu 12 nebo 24 týdnů, byly dobře tolerovány, výskyt nežádoucích reakcí byl velmi nízký [5].
Výsledky
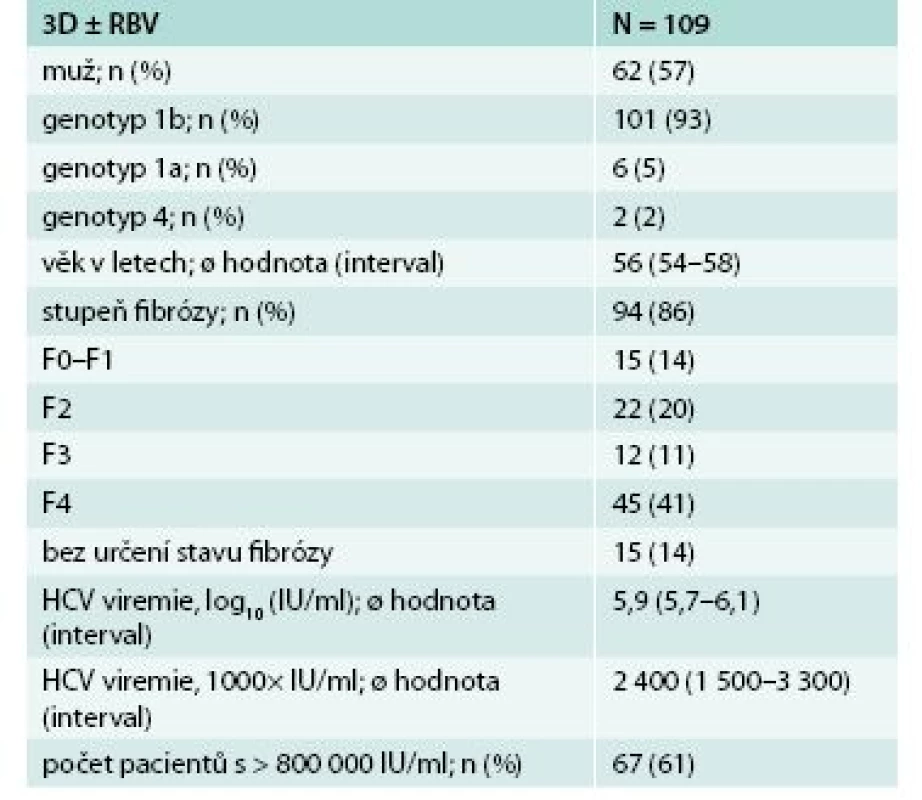
V našem souboru bylo léčeno 109 pacientů 3D režimem s nebo bez ribavirinu. V České republice se na léčbě podílelo celkem 9 center (CKTCH Brno, FN Brno, FN v Motole, FN Olomouc, FN Plzeň, IKEM Praha, Slezská nemocnice v Opavě, ÚVN Praha, VFN Praha). U některých pacientů v době hodnocení léčba stále probíhala nebo nebyli tak dlouho po ukončení léčby, aby bylo možno vyjádřit se k dosažení SVR12. Soubor tvořilo 62 mužů (57 %) a 47 žen (43 %). Většina pacientů měla genotyp 1b, a to 101 pacientů (93 %), genotyp 1a (6/109, 5 %) a genotyp 4 (2/109, 2 %). Průměrný věk pacientů byl 56 let, u většiny pacientů byla pokročilá jaterní fibróza a vysoká viremie, podrobná charakteristika souboru je uvedena v tab. 1. Převážnou část tvořili dříve léčení pacienti (66/109, 61 %), a to jak pacienti relabující po ukončení léčby, tak pacienti, kteří na léčbu neodpověděli, respektive během léčby nedošlo k vymizení viremie (nuloví respondéři), tab. 2. Po 4 týdnech léčby byla negativní viremie u 78 pacientů (72 %), tedy u většiny léčených nemocných. U pacientů, kteří ukončili 12. týden léčby, byla nedetetekovatelná viremie u 64 z 66 pacientů (97 %). Ve 12. týdnu po ukončení terapie (SVR12) bylo hodnoceno 48 pacientů, z toho 46 s negativní viremií (96 %). U 2 pacientů však došlo k přerušení léčby v 1. měsíci léčby z důvodu jiného než virologického selhání léčby, pak podle mITT (modifikované intend-to treat analýzy) SVR12 bylo 100 % (graf 1).
2. Charakteristika pacientů dle předchozí léčby pegylovaným interferonem/ribavirinem (P/R) 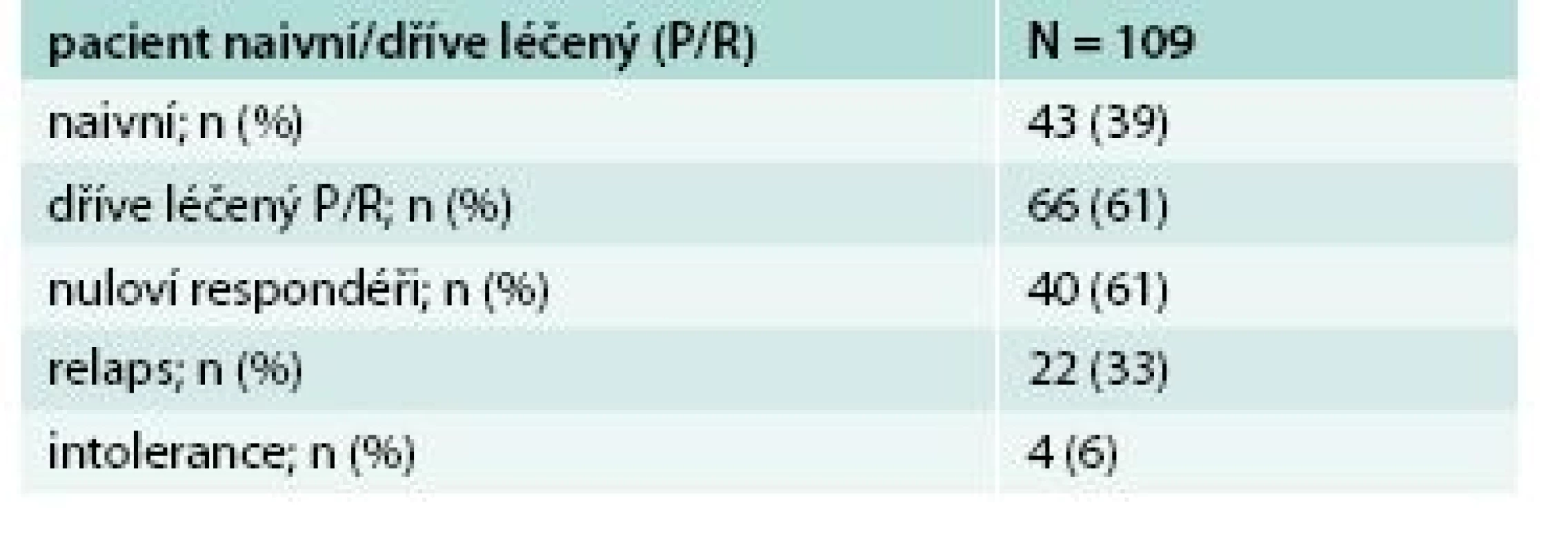
1. Účinnost 3D léčby 
* celkový počet léčených pacientů † mITT SVR12 – nezahrnuje pacienty, kteří nedosáhli SVR12 z jiného důvodu než virologického selhání U skupiny nulových respondérů na předchozí léčbou PEG-IFN a RBV vedlo podání 3D režimu k dosažení SVR12 u všech pacientů. Soubor tvořilo 40 nemocných, převážně muži genotypu 1b (tab. 3). U všech pacientů po 8 týdnech léčby byla negativní viremie. Účinnost léčby byla rovněž velmi vysoká, dosáhla 100 % (SVR12), graf 2.
3. Charakteristika souboru nulových responderů 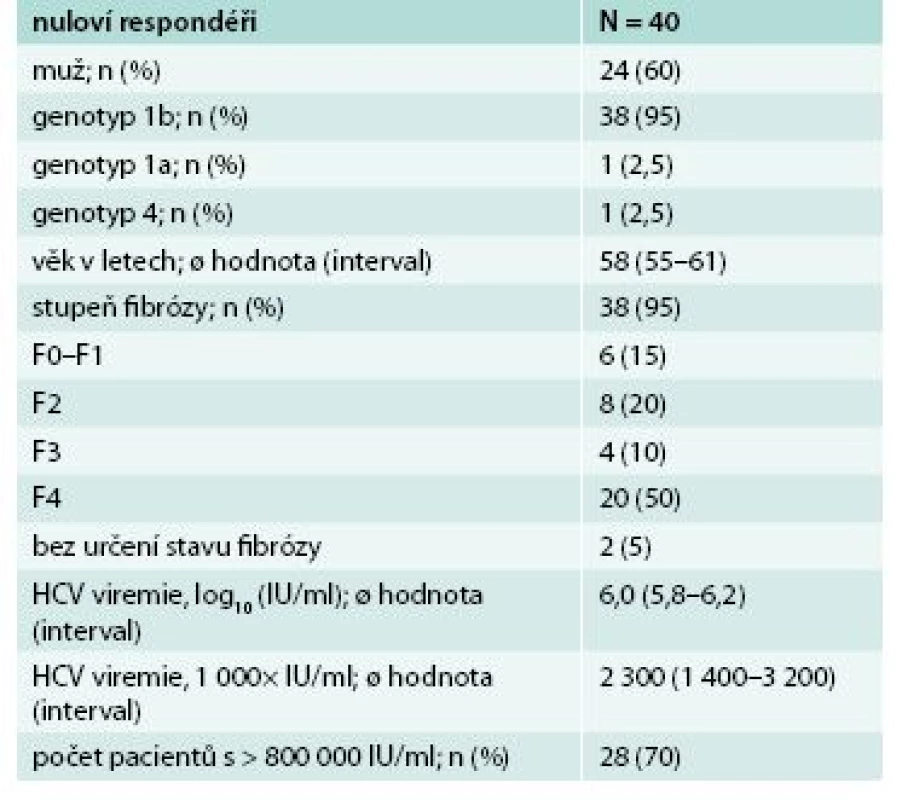
2. Účinnost 3D léčby nulových respondérů 
* celkový počet léčených pacientů Další skupina pacientů s pokročilou jaterní cirhózou, která v předchozím období interferonové terapie byla obtížně léčitelná a s malou nadějí na vyléčení, bezinterferonovou 3D léčbu velmi dobře tolerovala. Léčba byla přerušena jen u jednoho pacienta po 10 dnech pro progredující ikterus a nově diagnostikovaný HCC. V souboru bylo léčeno 43 pacientů, převážně genotypu 1b, podrobná charakteristika souboru je uvedena v tab. 4. SVR12 byla velmi vysoká – 95 %. Pokud vyřadíme pacienta, u kterého léčba byla přerušena z jiného než virologického selhání léčby, pak byla účinnost léčby 100 % (mITT SVR12), graf 3.
4. Charakteristika souboru pacientů s kompenzovanou cirhózou léčenou 3D terapií 
3. Účinnost 3D terapie u pacientů s kompenzovanou jaterní cirhózou 
* celkový počet léčených pacientů † mITT SVR12 – nezahrnuje pacienty, kteří nedosáhli SVR12 z jiného než virologického selhání léčby Velmi zajímavou skupinu tvořili pacienti s rekurující virovou hepatitidou po transplantaci jater. Virová hepatitida C je jednou z předních indikací k transplantaci jater ve většině transplantačních center. Problém spočívá v její časné rekurenci po transplantaci, pokud transplantujeme pacienta s pozitivní viremii, s rychlým rozvojem jaterní cirhózy. V naší skupině bylo léčeno 23 pacientů s rekurující virovou hepatitidou C, převážně muži 15/23 (65 %), všichni s genotypem 1b. Podrobná charakteristika souboru je uvedena v tab. 5. Léčba byla velmi dobře tolerována, bez závažných nežádoucích účinků. Jediným relativním problémem byla nutnost redukce imunosupresivní léčby dle doporučených postupů při současné 3D terapii. U 1 pacienta byla léčba přerušena po 23 dnech pro závažné BILI komplikace, které si vyžádaly reoperaci. Po 8 týdnech léčby byla u všech pacientů vyšetřených v tomto týdnu negativní viremie. SVR12 byla 94 %, a pokud vyřadíme pacienta, u kterého nebyla dosažena setrvalá virologická odpověď z jiného důvodu než virologického selhání léčby, tak byla 100 % (graf 4). Naše výsledky podporují výsledky klinických studií SAPHIRE I, II, PEARL II, III, IV, TURQUIOSE I, II, III o vysoké účinnosti 3D léčby v závislosti na pokročilosti jaterního procesu, daném genotypu a přidání RBV k 3D léčbě [6–10].
5. Charakteristika souboru pacientů po transplantaci jater léčených 3D režimem 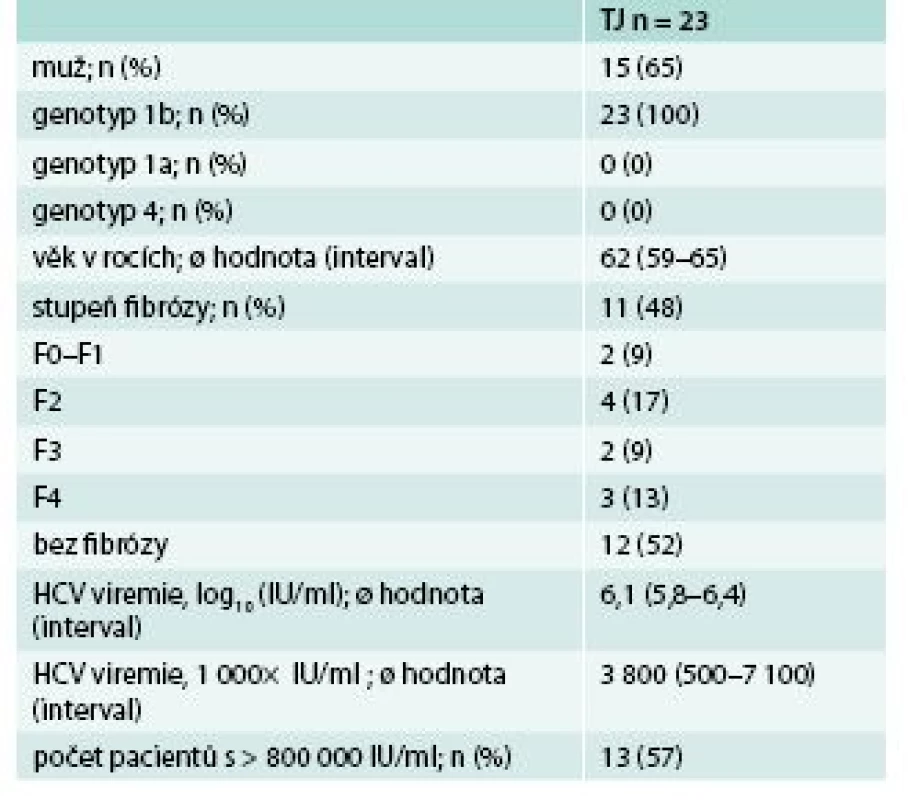
4. Účinnost 3D léčby u pacientů po transplantaci jater 
* celkový počet léčených pacientů † mITT SVR12– nezahrnuje pacienty, kteří nedosáhli SVR12 z jiného než virologického selhání léčby Závěr
Bezinterferonová léčba je zcela revoluční změnou terapeutických možností chronické hepatitidy C. Po vice než 20 letech mizí použití interferonu α se všemi jeho nežádoucími účinky, kontraindikacemi i nutností injekční aplikace. Za absolutní minimum účinnosti se u bezinterferonové léčby bere dosažení SVR v 90 % případů. Většinou je však tohoto cíle dosaženo u více 95 % léčených, v některých podskupinách pacientů je úspěšnost léčby 100 %, a to již po 12 týdnech léčby (v některých případech po 8 týdnech léčby) a s minimem nežádoucích účinků. Naše výsledky s bezinterferonovou 3D terapií zcela potvrzují dobrou snášenlivost i bezpečnost léčby a její vysokou až 100% účinnost.
MUDr. Libuše Husová, Ph.D.
libuse.husova@cktch.cz
Centrum kardiovaskulární a transplantační chirurgie,
Brno
www.cktch.cz
Doručeno do redakce 2. 9. 2016
Přijato po recenzi 12. 9. 2016
Sources
1. [European Association for the Study of Liver]. EASL recommendations on treatment of hepatitis C 2014. J Hepatol 2014; 61(2): 373–395.
2. [European Association for the Study of Liver]. EASL recommendations on treatment of hepatitis C 2015. J Hepatol 2015; 63(1): 199–236.
3. AASLD recommendation for testing, managing, and treating hepatitis C. Dostupné z WWW:
. [15.8.2016]. 4. Urbánek P, Husa P, Šperl J et al. Standardní diagnostický a terapeutický postup chronické infekce virem hepatitidy C (HCV). Klin Mikrobiol Inf Lek 2015; 21(3): 83–98.
5. Urbánek P. Exviera, Viekirax. Gastroent Hepatol 2015; 69(1): 75–80.
6. Feld JJ, Kowdley KV, Coakley E et al. Treatment of HCV with ABT-450/r-ombitasvir and dasabuvir with ribavirin. N Engl J Med 2014; 370(17): 1594–1603.
7. Ferenci P, Bernstein D, Lalezari J et al. ABT-450/rombitasvir and dasabuvir with or without ribavirin for HCV. N Engl J Med 2014; 370(21): 1983–1992.
8. Wyles DL, Sulkowski MS, Eron JJ et al. TURQUOISE-I: 94% SVR12 in HCV/HIV-1 coinfected patients treated with ABT-450/r/ombitasvir, dasabuvir and ribavirin. Hepatology 2014; 60(Suppl 1): 1136A. Conference Report: <http://www.natap.org/2014/AASLD/AASLD_28.htm>.
9. Zeuzem S, Jacobson IM, Baykal T et al. Retreatment of HCV with ABT-450/r-ombitasvir and dasabuvir with ribavirin. N Engl J Med 2014; 370(17): 1604–1614.
10. Andreone P, Colombo MG, Enejosa JV et al. ABT-450, ritonavir, ombitasvir, and dasabuvir achieves 97% and 100% sustained virologic response with or without ribavirin in treatment experienced patients with HCV genotype 1b infection. Gastroenterology 2014; 147(2): 359–365.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2016 Issue Suppl2
Most read in this issue- Late complications of liver cirrhosis – management of gastrointestinal bleeding in the presence of portal hypertension
- Extrahepatic manifestations of HCV infection
- Real data o viral hepatitis C therapy in the Czech Republic
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career