-
Medical journals
- Career
Současné možnosti léčby hyponatremie
: Vladimír Tesař
: Klinika nefrologie 1. LF UK a VFN v Praze
: Vnitř Lék 2016; 62(Suppl 6): 97-101
: Reviews
V posledních 50 letech byly poznány molekulární mechanizmy renální resorpce sodíku a vody a byly vyvinuty molekuly, které s těmito mechanizmy specificky interferují (diuretika, antagonisté receptorů pro vazopresin). Chronická hyponatremie je způsobena relativním nadbytkem volné vody, vyskytuje se u širokého spektra chorob spojených s hypervolemií (srdeční selhání, jaterní cirhóza), normovolemií i hypovolemií a je u pacientů s chronickým srdečním selháním a ascitickou jaterní cirhózou negativním prognostickým faktorem. Vaptany (antagonisté vazopresinu, inhibitory V2 receptoru pro vazopresin) snižují zpětnou resorpci vody v distálním nefronu, zvyšují vylučování volné vody a u normovolemických a hypervolemických stavů spojených s hyponatremií normalizují sérové koncentrace sodíku. Hyponatremii lze (dle příčiny, závažnosti a rychlosti vývoje) korigovat omezením příjmu tekutin, podáním hypertonického roztoku NaCl, diuretiky, perorálním podáním urey a vaptany. Místo vaptanů v léčbě hyponatremie je třeba ještě lépe definovat, v Evropě je možné jejich použití u syndromu nepřiměřené sekrece antidiuretického hormonu (SIADH).
Klíčová slova:
hyponatremie – jaterní cirhóza – srdeční selhání – syndrom nepřiměřené sekrece ADH – tolvaptan – vazopresinHistorický úvod
Rutinní měření sérového sodíku pomocí plamenné fotometrie bylo do klinické medicíny zavedeno teprve v druhé polovině 40. let 20. století [1]. V průběhu 50.–80. let minulého století byly pomocí mikropunkčních a mikroperfuzních studií definovány mechanizmy renální resorpce sodíku a vody [2] a faktory, které resorpci sodíku a vody regulují [3]. Molekulární charakteristika transportních systémů pro ionty, vodu a další anorganické a organické molekuly se rozšířila teprve od začátku 90. let 20. století. V současné době máme velmi přesnou představu, jakým způsobem probíhá v různých částech nefronu zpětná resorpce sodíku [4]. Mechanizmus regulace glomerulární filtrace v závislosti na množství sodíku dodaného k macula densa v distálním nefronu (tzv. tubuloglomerulární zpětná vazba) byl sice popsán již před více než 70 lety [5], ale praktické využití tohoto mechanizmu v terapii onemocnění ledvin je spojeno teprve s inhibitory kontransportu sodíku a glukózy v proximálním tubulu (sodium/glucose cotransporter – SGLT2).
Hyponatremie souvisí obvykle s neadekvátně vysokou zpětnou resorpcí vody v distálním nefronu. Význam zadního laloku hypofýzy pro regulace zpětné resorpce vody byl objeven již v 2. dekádě 20. století a vazopresin (antidiuretický hormon) byl popsán v 50. letech 20. století [6]. Zásadním průlomem pro pochopení mechanizmů zpětné resorpce vody v ledvinách byl ale teprve objev vodních kanálů – aquaporinů [7].
Regulace zpětné resorpce vody v ledvinách
Vazopresin (antidiuretický hormon – ADH) je uvolňován z hypofýzy po stimulaci osmoreceptoru v zadním laloku hypofýzy. Vazopresin snižuje prostřednictvím svého V2 receptoru exkreci volné vody, neovlivňuje ale exkreci osmoticky aktivních látek [8]. Citlivost hypofyzárního osmoreceptoru závisí také na volumovém stavu. Plazmatická osmolalita, při které dochází k aktivaci osmoreceptoru, se při hypovolemii snižuje.
V2 receptory jsou lokalizovány v distálním nefronu na krevním pólu tubulární buňky. Jejich aktivace vazopresinem zvyšuje expresi vodního kanálu aquaporinu 2 na luminální membráně tubulární buňky, a tím zvyšuje zpětnou resorpci vody tubulem. Tento proces vyžaduje aktivaci kaskády intracelulárních mechanizmů (např. cAMP, proteinkinázy A aj), které by se v budoucnu mohly také stát cílem terapeutických intervencí.
Porucha sekrece vazopresinu je příčinou centrálního diabetes insipidus, nefrogenní diabetes insipidus může být důsledkem mutace V2 receptoru nebo aquaporinu 2.
V tomto přehledu se ale dále budu zabývat pouze stavy, které jsou spojeny se zvýšenou zpětnou resorpcí vody v tubulech a jsou obvykle provázeny různě závažnou hyponatremií.
Hyponatremie
Hyponatremie je pokles plazmatické koncentrace sodíku < 135 mmol/l. Hyponatremie se obvykle dělí podle závažnosti na lehkou (130–134 mmol/l), středně těžkou (125–129 mmol/l) a těžkou (< 125 mmol/l) [9]. Hyponatremie, která se vyvinula během méně než 48 hod, je označována jako akutní hyponatremie, hyponatremii trvající déle než 48 hod nebo o jejíž délce nevíme, pokládáme za chronickou hyponatremii. Hyponatremie může být asymptomatická, nebo může mít středně závažné (nauzea bez zvracení, zmatenost, bolesti hlavy) až velmi závažné klinické symptomy (zvracení, křeče, kóma a poruchy dechu a srdečního oběhu). Hyponatremie je často jen jedním z projevů celkové těžkého stavu pacienta a zejména u lehčích forem hyponatremie je nutno vzít v úvahu, že přítomné klinické projevy nemusí být (jen) důsledkem hyponatremie.
U pacientů s nízkou sérovou koncentrací sodíku je vždy nutno vyloučit pseudohyponatremii, která je způsobena zvýšenou solidní frakcí séra (např. při hypertriglyceridemii, monoklonální gamapatii, nebo po podání intravenózních imunoglobulinů). U pacientů s významnou hyperglykemií je nutno výpočtem korigovat měřenou natremii, skutečná natremie je významně vyšší.
V diferenciální diagnostice hyponatremie (tab. 1) je třeba nejdříve vyloučit nehypotonickou hyponatremii, která je obvykle způsobena přítomností osmoticky aktivních solutů (hyperglykemie, podání manitolu, hyperosmolárních kontrastních látek a dále může být přítomna u pacientů s vysokou koncentrací urey v séru – při renálním selhání nebo při zvýšeném katabolizmu). U pacientů s osmolalitou séra < 275 mmol/l jde vždy o hypotonickou hyponatremii [9].
1. Klasifikace hyponatremie dle osmolality plazmy. 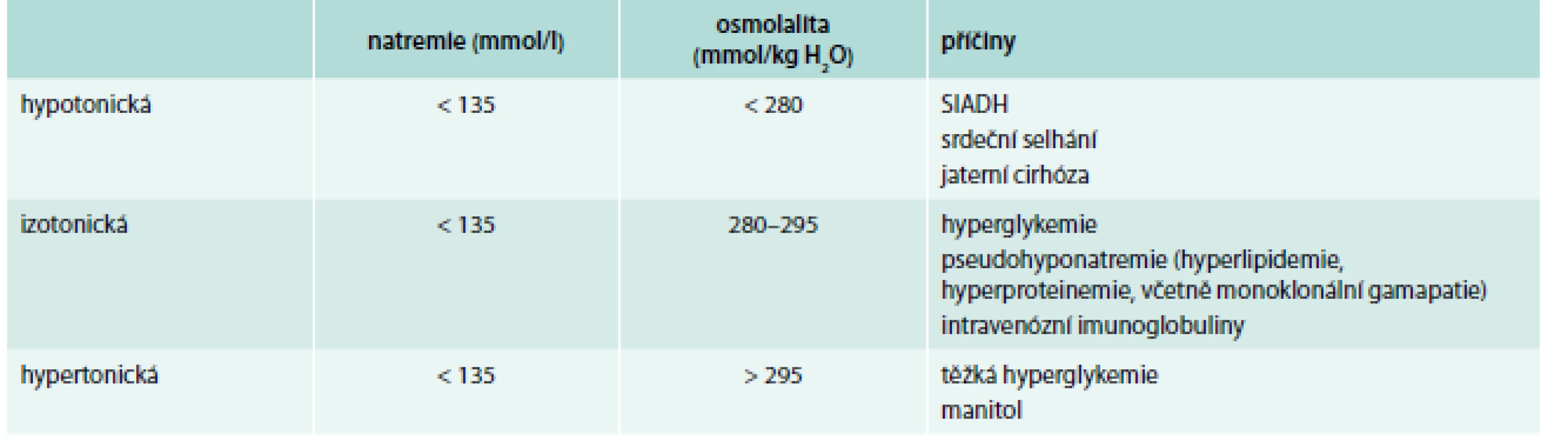
Upraveno podle [9,26] U pacientů s hypotonickou hyponatremií je pak třeba především rozhodnout, zda jde o hyponatremii akutní nebo chronickou a posoudit tíži klinických symptomů spojených s hyponatremií. Akutní hyponatremie se vyskytuje v pooperačním období, někdy může vzniknout v souvislosti s přípravou na koloskopii. Z léků může akutní hyponatremii vyvolat léčba diuretiky, intravenózním cyklofosfamidem, oxytocinem a deriváty vazopresinu (např. terlipresinem nebo desmopresinem) a také některými deriváty amfetaminu.
Vyšetření osmolality moči (ve vzorku moči) nám umožní rozlišit primárně vysoký příjem volné vody (osmolalita moči < 100 mmol/l), např. u primární polydipsie, pijáků piva nebo jiných tekutin s nízkým obsahem osmoticky aktivních látek. U pacientů s osmolalitou moči > 100 mmol/l, je nutno doplnit vyšetření sodíku v moči (vzorku moči).
Koncentrace sodíku v moči < 30 mmol/l je obvykle vyvolána nízkým efektivním arteriálním krevním objemem, buď u hypervolemických pacientů se srdečním selháním, ascitickou jaterní cirhózou nebo nefrotickým syndromem, nebo u hypovolemických pacientů (např. při průjmech, teplotách, ztrátách tekutin do třetího prostoru, či neadekvátní diuretické léčbě v předchozím období).
Pokud je koncentrace sodíku v moči > 30 mmol/l, je nutno vyloučit chronické onemocnění ledvin nebo aktuálně probíhající neadekvátní léčbu diuretiky a u zbylých pacientů opět posoudit volumový stav. U pacientů se sníženým objemem extracelulární tekutiny může být příčinou zvracení, průjem, renální tubulární ztráty (salt-losing nephropathy), nebo syndrom cerebrálně podmíněných ztrát soli (cerebral salt wasting). Vždy je také třeba myslet na nepřiznaný abúzus diuretik. U pacientů se zvýšeným objemem extracelulární tekutiny by mohlo jít (po vyloučení abúzu diuretik, hypotyreózy a adrenální insuficience) o syndrom nepřiměřené sekrece antidiuretického hormonu (syndrome of inappropriate antidiuretic hormone/SIADH – nebo také nověji o syndrom nepřiměřené antidiurézy – syndrome of inappropriate antidiuresis/SIAD).
SIADH může být vyvolán paraneoplastickou produkcí vazopresinu některými tumory (např. malobuněčným karcinomem plic), dále se může vyskytnout u některých plicních infekcí, infekcí a jiných onemocnění centrálního nervového systému, vždy je ale nutné vyloučit možnou lékovou etiologii (antidepresiva, antiepileptika, antipsychotika; některá cytostatika – vinca alkaloidy, ifosfamid, cyklofosfamid, melfalan, metotrexát, či deriváty platiny; analoga vazopresinu a některé další léky).
Chronická hyponatremie je u pacientů s chronickým srdečním selháním [10] i jaterní cirhózou [11] významným negativním prognostickým faktorem a prediktorem mortality. Naopak korekce hyponatremie zlepšuje u pacientů s ascitickou jaterní cirhózou kognitivní funkce [12].
Léčba hyponatremie
K léčbě hyponatremie je třeba přistupovat různě v závislosti na tom, zda jde o akutní či chronickou hyponatremii, jaká je její tíže, jak závažné jsou její symptomy a jaký je objem extracelulární tekutiny (tab. 2) [9,13].
2. Možnosti léčby hyponatremie. 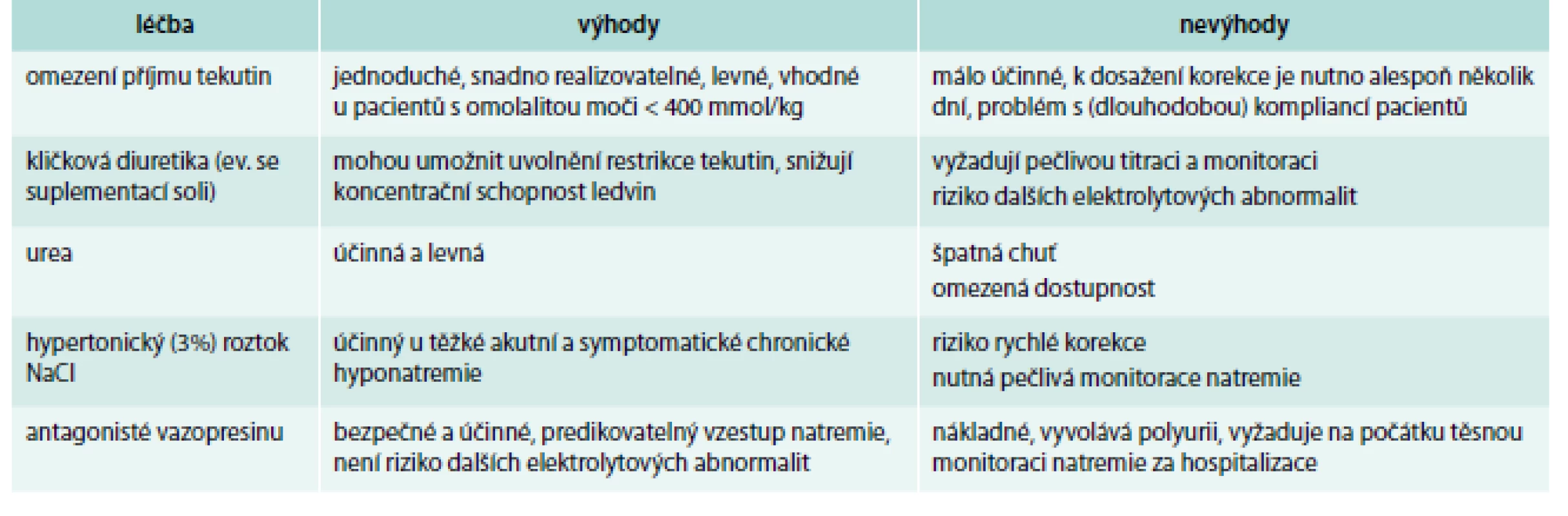
Upraveno podle [9,13,26] U hyponatremie s těžkými klinickými symptomy (akutní i chronické) zahajujeme léčbu podáním 150 ml 3% NaCl během 20 min s následnou kontrolou natremie. Stejnou infuzi je možno ještě jednou opakovat, pokud není dosaženo vzestupu natremie o 5 mmol/l. Po dosažení vzestupu sérového natria o 5 mmol/l není další podávání 3% NaCl vhodné a pokud infuze ještě kape, je třeba ji zastavit. Natremie nemá stoupnout během prvních 24 hod o více než 10 mmol/l, další dny o více než 8 mmol/l/den. Sérové natrium je zpočátku vhodné kontrolovat každých 6–12 hod, další dny alespoň 1krát denně.
Hyponatremii se středně závažnými symptomy lze také léčit jednorázovým podáním 150 ml 3% NaCl během 20 min a i pro ni platí stejná pravidla týkající se vzestupu natremie v prvních 24 hod a dalších dnech léčby.
U chronické hyponatremie bez těžkých nebo středně těžkých klinických projevů se v léčbě omezujeme pouze na případnou (u středně těžké a těžké hyponatremie) restrikci tekutin a omezení přívodu hypotonických roztoků a dále se snažíme zjistit příčinu hyponatremie. Restrikce tekutin je zvláště důležitá zejména u pacientů s hypervolemií.
Akutní asymptomatickou nebo jen mírně symptomatickou hyponatremii léčíme zejména restrikcí tekutin a vyřazením všech faktorů, které mohly přispět k jejímu rozvoji (např. zastavením podávání hypotonických roztoků). Pokud je akutní pokles natremie výraznější (< 125 mmol/l), lze i v těchto případech zvážit jednorázové podání infuze 150 ml 3% NaCl.
U pacientů se SIADH má rovněž zásadní význam restrikce tekutin, která může být doplněna perorální léčbou ureou nebo NaCl.
U pacientů s hyponatremií a hypovolemií je nutno především doplnit objem tekutin izotonickými roztoky.
Hypotonická hyponatremie je charakterizována poklesem osmolarity v CNS a rozvojem edému mozku. Hematoencefalická bariéra je volně prostupná pro vodu, ale nikoli pro sodík [14,15]. K časné, rychlé adaptaci na hyponatremii (pokles objemu mozku) dochází během několika dnů poklesem koncentrace mozkových elektrolytů, během dalších několika dnů se objem mozku normalizuje v důsledku ztráty organických osmolytů. Příliš rychlá korekce hyponatremie vede k osmotické dehydrataci mozku a demyelinizaci [16].
Antagonisté vazopresinu
V průběhu 90. let 20. století se podařilo vyvinout nepeptidové antagonisty V2 receptoru pro vazopresin, které se vyznačují různou mírou selektivity k V2 receptoru (různým stupněm inhibice V1 receptoru). Tolvaptan, s kterým proběhlo nejvíce klinických studií, je vysoce selektivní k V2 receptoru (poměr selektivity V2/V1 je 29) a má poměrně krátký biologický poločas 6–8 hod.
Tolvaptan byl testován ve 2 velkých randomizovaných kontrolovaných studiích (SALT1 a SALT2) u 448 pacientů s euvolemickou (SIADH) nebo hypervolemickou (srdeční selhání, jaterní cirhóza) hyponatremií. Natremie stoupla významně více u pacientů léčených tolvaptanem, a to již 4. den a byla významně vyšší i 30. den studie, vzestup natremie u pacientů léčených tolvaptanem byl významně vyšší u pacientů s mírnou i u pacientů s těžkou hyponatremií [17]. Tolvaptan byl dobře tolerován, pacienti léčení tolvaptanem udávali ve srovnání s placebem častěji žízeň, suchost v ústech a slabost.
Ve studii SALTWATER [18] bylo 111 pacientů, kteří byli původně léčeni tolvaptanem nebo placebem 1 měsíc ve studiích SALT1 a SALT2 převedeno na tolvaptan a sledováno celkem v průměru 701 dní. Tolvaptan udržel po celou dobu sledování stabilní natremii, léčba byla dobře tolerována, nejčastějšími nežádoucími účinky byly žízeň, polakisurie, únava, suchost v ústech, polydipsie a polyurie.
Účinnost a bezpečnost tolvaptanu byla ve studiích SALT1 a SALT2 samostatně hodnocena u 110 pacientů se SIADH [19]. Natremie byla 30. den léčby normalizována ve srovnání s placebem u významně vyššího počtu pacientů léčených tolvaptanem (67 % vs 27 %). Pacienti léčení tolvaptanem měli větší diurézu, větší příjem tekutin a více negativní bilanci tekutin. U pacientů léčených tolvaptanem byla statisticky významně (resp. hraničně významně) zlepšena fyzická i psychická komponenta SF–12. Léčbou tolvaptanem bylo ve srovnání s placebem dosaženo lepší korekce natremie i u 27 hyponatremických pacientů s malignitou [20]. U pacientů s SIADH byla léčba tolvaptanem srovnatelně účinná jako léčba perorální ureou [21].
Tolvaptan byl srovnáván s agonistou ANP carperitidem u 109 pacientů s akutním srdečním selháním [22]. Léčba tolvaptanem byla spojena s větší diurézou, menším poklesem TK, méně nežádoucími účinky a nižší cenou. Ve studii EVEREST [23] bylo 537 pacientů s horšícím se srdečním selháním randomizováno k tolvaptanu nebo placebu a sledováno v průměru 9,9 měsíců.
Tolvaptan neovlivnil celkovou ani kardiovaskulární mortalitu, ale snížil tělesnou hmotnost, zmírnil edémy a zlepšil dušnost. I v této studii byla tolerance tolvaptanu dobrá, hlavními nežádoucími účinky byla žízeň a suchost v ústech. Subanalýza studie EVEREST [24] ukázala podstatně horší prognózu u pacientů s (perzistující) hyponatremií a nižší mortalitu (ve srovnání s placebem) u pacientů s alespoň středně těžkou hyponatremií léčených tolvaptanem. Pacienti léčení tolvaptanem navíc vyžadovali nižší dávky diuretik.
Vaptany v doporučení pro léčbu hyponatremie
Tolvaptan (a konivaptan) je v USA registrován pro léčbu klinicky významné hypervolemické nebo euvolemické hyponatremie, včetně hyponatremie u srdečního selhání a SIADH, v Kanadě je tolvaptan registrován pro klinicky významnou non-hypovolemickou hyponatremii, v Evropě je naproti tomu tolvaptan registrován pouze pro hyponatremii u SIADH [25].
Podobně se výrazně rozcházejí v indikaci léčby hyponatremie vaptany i existující klinická doporučení. Zatímco evropská doporučení [9] nedoporučují použití vaptanů u žádného typu hyponatremie, doporučení amerického panelu expertů [26] doporučují použití vaptanu u pacientů s euvolemickou nebo hypervolemickou hyponatremií s výjimkou pacientů s chronickým onemocněním jater. Panel expertů [26] doporučuje vaptany jako ev. léčbu první volby (vedle restrikce tekutin a zejména u pacientů, kteří z jakéhokoli důvodu nejsou schopni dodržovat restrikci tekutin) u pacientů s SIADH (a podobné stanovisko zaujímají i národní doporučení britská, švédská a španělská), evropská doporučení [9] nedoporučují použití vaptanu ani u pacientů se SIADH.
Jaké jsou důvody pro tak velké rozdíly v registraci vaptanů a mezi jednotlivými doporučeními? Mezi hlavní příčiny zřejmě patří rozdílná dostupnost vaptanů a rozdílné zkušenosti s vaptany, jiná metodologie výběru a hodnocení dostupných důkazů, jak co se týče kvantity i kvality důkazů [25]. V evropských podmínkách lze vaptany použít mimo off-label indikace pouze u pacientů se SIADH, a i v těchto případech při stávajících rozporech mezi různými doporučeními hraje důležitou roli klinický úsudek zkušeného ošetřujícího lékaře.
Vaptany nepochybně patří do rukou lékaře, který má zkušenosti s léčbou hyponatremie. Léčba má být vždy zahájena u pacientů se SIADH, kteří nemají těžké příznaky hyponatremie, a to za pobytu pacienta v nemocnici, neměla by být zahajována bezprostředně po podání infuze hypertonického NaCl, větší opatrnosti (vzhledem k většímu riziku „přestřelení“) je třeba u pacienta s těžkou hyponatremií (Na < 120 mmol/l), natremii je třeba frekventně monitorovat, je třeba uvolnit příjem tekutin a při dosažení koncentrace Na > 125 mmol/l je možno podávání tolvaptanu na 1–2 dny přerušit [27]. Indikace vaptanu by měla být zvážena zejména u pacienta se SIADH, u kterého hyponatremie neodpovídá dostatečně na restrikci tekutin, nebo který není schopen restrikci tekutin dodržovat.
Při dlouhodobé léčbě tolvaptanem je třeba pravidelně kontrolovat jaterní testy. Při dlouhodobém podávání tolvaptanu u pacientů s autosomálně dominantními polycystickými ledvinami došlo totiž u některých pacientů k vzestupu jaterních testů a v jedné studii bylo u pacientů s jaterní cirhózou léčených tolvaptanem ve srovnání s placebem zaznamenáno vyšší riziko gastrointestinálního krvácení. FDA na základě těchto informací vydala v roce 2014 doporučení (http://www.fda.gov/Safety/MedWatch/SafetyInformation/ucm294226.htm), aby nebyl tolvaptan používán u pacientů se známým onemocněním jater.
Jaké jsou výhody tolvaptanu ve srovnání s jinými možnostmi léčby chronické hyponatremie [28]? Pacienti léčení vaptanem velmi ocení možnost ukončit restrikci tekutin. Výraznější úprava natremie může být u pacientů provázena zlepšením neurologické symptomatologie a při léčbě vaptanem dochází méně často než při restrikci tekutin k výrazným výkyvům (poklesům) natremie. Vaptany představují specifickou léčbu některých forem hypotonické hypovolemie a práce s nimi je jednodušší nejen pro pacienta, ale i pro (zkušeného) ošetřujícího lékaře.
Závěry
Tolvaptan (antagonista vazopresinu, inhibitor V2 receptoru pro vazopresin) normalizuje u většiny nemocných s normovolemickou a hypervolemickou hyponatremií sérové koncentrace sodíku. Současná doporučení se výrazně rozcházejí v názoru na jeho použití u pacientů s hyponatremií, v Evropě je tolvaptan registrován pouze pro pacienty se SIADH. Delší zkušenosti a ev. další klinické studie jistě postupně místo tolvaptanu v léčbě hyponatremie upřesní.
prof. MUDr. Vladimír Tesař, DrSc., MBA
vladimir.tesar@vfn.cz
Nefrologická klinika 1. LF UK a VFN v Praze
www.vfn.cz
Doručeno do redakce 28. 8. 2016
Přijato po recenzi 11. 10. 2016
Sources
1. Peitzman SJ. The flame photometer as engine of nephrology: a biography. Am J Kidney Dis 2010; 56(2): 379–386. Dostupné z DOI: <http://dx.doi.org/10.1053/j.ajkd.2010.02.343>.
2. Giebisch G. Coupled ion and fluid transport in the kidney. N Engl J Med 1972; 2878(18): 913–919.
3. Schrier RW, De Wardener HE. Tubular reabsorption of sodium ion: influence of factors other then aldosterone and glomerular filtration rate. First part. N Engl J Med 1971; 285(22): 1231–1243.
4. Palmer LG, Schnermann J. Integrated control of Na transport along the nephron. Clin J Am Soc Nephrol 2015; 10(4): 676–687. Dostupné z DOI: <http://dx.doi.org/10.2215/CJN.12391213>.
5. Bradley SE. Modern concepts of renal structure and function in chronic Bright´s disease. N Engl J Med 1944; 231 : 421–426. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJM194409212311205>.
6. Eknoyan G. A history of diabetes insipidus: paging the road to internal water balance. Am J Kidney Dis 2010; 56(6): 1175–1183. Dostupné z DOI: <http://dx.doi.org/10.1053/j.ajkd.2010.08.002>.
7. Agre P, Sasaki S, Chrispels MJ. Aquaporins: a family of water channel proteins. Am J Physiol 1993; 265(3 Pt 2): F461.
8. Knepper MA, Kwon TH, Nielsen S. Molecular physiology of water balance. N Engl J Med 2015; 372(14): 1349–1358. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMra1404726>.
9. Spasovski G, Vanholder R, Allolio B et al. Clinical practice guideline on diagnosis and treatment of hyponatremia. Nephrol Dial Transplant 2014; 29(Suppl 2): i1-i39. Dostupné z DOI: <http://dx.doi.org/10.1093/ndt/gfu040>.
10. Allen LA, Gheorghiade M, Reid KJ et al. Identifying patients hospitalized with heart failure at risk for unfavorable future quality of life. Circ Cardiovasc Qual Outcomes 2011; 4(4): 389–398. Dostupné z DOI: <http://dx.doi.org/10.1161/CIRCOUTCOMES.110.958009>.
11. Kim WR, Biggins SW, Kremers WK et al. Hyponatremia and mortality among patients on the liver-transplant waiting list. N Engl J Med 2008; 359(10): 1018–1026. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa0801209>.
12. Ahluwalia V, Heuman DM, Feldman G et al. Correction of hyponatremia improves cognition, quality of life, and brain oedema in cirrhosis. J Hepatol 2015; 62(1): 75–82.10. Dostupné z DOI: <http://dx.doi.org/1016/j.jhep.2014.07.033>.
13. Rosner MH. Lixivaptan: a vasopressin receptor antagonist for the treatment of hyponatremia. Kidney Int 2012; 82(11): 1154–1156. Dostupné z DOI: <http://dx.doi.org/10.1038/ki.2012.317>.
14. Adrogué HJ, Madias NE. Hyponatremia. N Engl J Med 2000; 342(21): 1581–1589.
15. Sterns RH. Disorders of plasma sodium – causes, consequences, and correction. N Engl J Med 2015; 372(1): 55–65. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMra1404489>.
16. Sterns RH, Riggs JE, Schochet SS Jr. Osmotic demyelination syndrome following correction of hyponatremia. N Engl J Med 1986; 314(24): 1535–1542.
17. Schier RW, Gross P, Gheorghiade M et al. Tolvaptan, a selective vasopressin V2-receptor antagonist, for hyponatremia. N Engl J Med 2006; 355(20): 2099–2112.
18. Berl T, Quittnat-Pelletier F, Verbalis JG et al. Oral tolvaptan is safe and effective in chronic hyponatremia. J Am Soc Nephrol 2010; 21(4): 705–712. Dostupné z DOI: <http://dx.doi.org/10.1681/ASN.2009080857>.
19. Verbalis JG, Adler S, Schrier RW et al. Efficacy and safety of oral tolvaptan therapy in patients with the syndrome of inappropriate antidiuretic hormone secretion. Eur J Endocrinol 2011; 164(5): 725–732. Dostupné z DOI: <http://dx.doi.org/10.1530/EJE-10–1078>.
20. Salahudeen AK, Ali N, George M et al. Tolvaptan in hospitalized cancer patients with hyponatremia: a double-blind, randomized, placebo-controlled clinical trial on efficacy and safety. Cancer 2014; 120(5): 744–751. Dostupné z DOI: <http://dx.doi.org/10.1002/cncr.28468>.
21. Soupart A, Coffernils M, Couturier B et al. Efficacy and tolerance of urea compared with vaptans for long-term treatment of patients with SIADH. Clin J Am Soc Nephrol 2012; 7(5): 742–747. Dostupné z DOI: <http://dx.doi.org/10.2215/CJN.06990711>.
22. Suzuki S, Yoshihisa A, Yamaki T et al. Acute heart failure volume control multicenter randomized (AVCMA) trial: comparison of tolvaptan and carperitide. J Clin Pharmacol 2013; 53(12): 1277–1285. Dostupné z DOI: <http://dx.doi.org/10.1002/jcph.197>.
23. Konstam MA, Gheorghiade M, Burnett JC Jr et al. Effects of oral tolvaptan in patients hospitalized for worsening heart failure: the EVEREST Outcome Trial. JAMA 2007; 297(12): 1319–1331.
24. Hauptman PJ, Burnett J, Gheorghiade M et al. Clinical course of patients with hyponatremia and decompensated systolic heart failure and the effect of vasopressin receptor antagonism with tolvaptan. J Card Fail 2013; 19(6): 390–397. Dostupné z DOI: <http://dx.doi.org/10.1016/j.cardfail.2013.04.001>.
25. Verbalis JG, Grossman A, Hoybye C et al. Review and analysis of differing regulatory indications and expert panel guidelines for the treatment of hyponatremia. Curr Med Res Oppin 2014; 30(7): 1201–1207. Dostupné z DOI: <http://dx.doi.org/10.1185/03007995.2014.920314>.
26. Verbalis JG, Goldsmith SR, Greenberg A et al. Diagnosis, evaluation, and treatment of hyponatremia: expert panel recommendations. Am J Med 2013; 126(10 Suppl 1): S1-S42. Dostupné z DOI: <http://dx.doi.org/10.1016/j.amjmed.2013.07.006>.
27. Aylwin S, Burst V, Peri A et al. Dos and don´ts in the management of hyponatremia. Curr Med Res Opin 2015; 31(9): 1755–1761. Dostupné z DOI: <http://dx.doi.org/10.1185/03007995.2015.1072706>.
28. Gross P. Treatment of hyponatremia. Intern Med 2008; 47(10): 885–891.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2016 Issue Suppl 6-
All articles in this issue
- Bioimpedometry and its utilization in dialysis therapy
- The results of SPRINT study from the point of nephrology
- Systemic and intraperitoneal inflammation in peritoneal dialysis patients
- Utilisation of salivary markers in nephrology
- IgA nephropathy – research-generated questions
- Gitelman´s syndrome as common cause of hypokalemia and hypomagnesemia
- Osteoporosis – epidemiology and pathogenesis
- Suplemented restricted diet in old patients with chronic renal disease
- Current options of treatment of hyponatremia
-
Chronic dysfunction of a transplanted kidney:
the problem still unresolved - Present possibilities of monitoring the effectiveness of hyponatremia therapy
- Theralite and multiple myeloma
- [Na+] – [Cl-] difference significantly contributes to acidemia in patients with liver cirrhosis
- Prevalence of microalbuminuria in patients with diabetes mellitus in the Czech Republic: Project IDN-Micro
- Plasma and salivary markers of oxidative and carbonyl stress in patients with acute intermittent porphyria
- Metabolic acidosis in chronic kidney disease
- Vitamin D3 supplementation and cellular calcium homeostasis in patients with chronic kidney disease
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Metabolic acidosis in chronic kidney disease
- Current options of treatment of hyponatremia
- Gitelman´s syndrome as common cause of hypokalemia and hypomagnesemia
- Osteoporosis – epidemiology and pathogenesis
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

