-
Medical journals
- Career
Intersticiální plicní procesy a granulomatózy asociované s běžným variabilním imunodeficitem
Authors: Martina Doubková 1; Mojmír Moulis 2; Jana Skřičková 1
Authors‘ workplace: Klinika nemocí plicních a tuberkulózy LF MU a FN Brno, pracoviště Bohunice, přednostka prof. MUDr. Jana Skřičková, CSc. 1; Ústav patologie LF MU a FN Brno, pracoviště Bohunice, přednosta doc. MUDr. Leoš Křen, Ph. D. 2
Published in: Vnitř Lék 2015; 61(2): 119-124
Category: Review
Overview
Běžný variabilní imunodeficit (CVID) patří k nejběžnějším primárním imunitním deficitům a je charakterizován poruchou tvorby imunoglobulinů. Hypogamaglobulinemie se u CVID manifestuje v každém věku, obvykle ale v dospělosti, a není známa závislost výskytu nemoci na pohlaví. Prevalence se odhaduje na 1 : 25 000–1 : 50 000. Patogeneze CVID není plně známa. Základním klinickým respiračním příznakem CVID jsou opakující se infekce dýchacích cest, převážně bakteriální: sinusitidy, bronchitidy, pneumonie, se vznikem bronchiektázií a plicní fibrózy. Intersticiální plicní procesy a granulomatózy se obvykle manifestují již v době diagnózy CVID a jsou většinou špatným prognostickým faktorem onemocnění.
Klíčová slova:
běžný variabilní imunodeficit – granulomatózy – intersticiální plicní procesyÚvod
Intersticiální plicní procesy (IPP) jsou heterogenní skupina převážně chronických nenádorových a neinfekčních onemocnění alveolů a plicního intersticia. Imunopatologický obraz je charakterizován zánětem se zhojením ad integrum nebo přechodem do nevratné plicní fibrózy s destrukcí plicní tkáně fibrotizujícím procesem. IPP dělíme na IPP známých příčin (pneumokoniózy, polékové postižení a jiné), idiopatické intersticiální pneumonie (běžná intersticiální pneumonie – usual interstitial pneumonia UIP, nespecifická intersticiální pneumonie – NSIP a jiné), granulomatózní IPP (sarkoidóza, granulomatózy jiné etiologie), IPP při systémových onemocněních pojiva a ostatní IPP [1].
Klasifikace imunodeficitů je možná z mnoha hledisek. Pro klinickou praxi je využívané dělení podle důsledku, ke kterému určitá porucha vede, na poruchy protilátkové, buněčné, kombinované, fagocytární a komplementové. Běžný variabilní imunodeficit (commmon variable immunodeficiency – CVID) patří k nejběžnějším primárním imunodeficitům, je charakterizovaný hypogamaglobulinemií a je často provázen bakteriálními infekcemi a bronchiektáziemi. CVID není čistě jen onemocnění B-lymfocytů, ale také zahrnuje abnormality v T-lymfocytech, proto jsou u CVID častěji vidět autoimunitní a lymfoproliferativní onemocnění. IPP jsou přítomny obvykle již v době diagnózy CVID a vyskytují se u 5–22 % pacientů s CVID [2–5]. CVID asociovaný s granulomatózním onemocněním (granulomatous disease – GD) se označuje jako CVID/GD [4,6,7]. Kombinace plicních granulomů a lymfoproliferace se nazývá granulomatous lymphocytic interstitial lung disease (GLILD) [3,8,9]. Pojem lymfoproliferace zahrnuje lymfocytární intersticiální pneumonii LIP, folikulární bronchiolitidu, lymfoidní hyperplazii. GLILD je často doprovázeno splenomegalií a difuzní lymfadenopatií se zvýšeným výskytem vzniku lymfomu [9].
Histologicky nacházíme u pacientů s CVID a IPP sarkoid-like granulomy, organizující se pneumonii, folikulární bronchiolitidu, lymfocytární intersticiální pneumonii a nespecifickou intersticiální pneumonii [10]. Nálezy se mohou vyskytovat samostatně nebo se mohou kombinovat [10].
Primární léčbou je substituce imunoglobuliny, dávka se odvíjí od přítomnosti plicních komplikací. IPP je často dlouhodobě stacionární. Prednison je lékem první volby, u progresivního plicního onemocnění je doporučována kombinovaná imunosuprese. Optimální terapie GLILD není známa [3].
Etiopatogeneze
Genetické, environmentální a další příčiny CVID nejsou dosud dostatečně objasněny. CVID byl v několika případech dán do souvislosti s autozomálně recesivními mutacemi genů pro ICOS (inducible costimulatory receptor expressed on activated T cells) [11], BAFF-R (B-cell activating factor receptor) [12], CD19 (cluster of differentiation, membránové antigeny na povrchu hematopoetických buněk) [13,14], CD20 [15], CD21 [16] a CD81 [17]. U 8–10 % pacientů nacházíme heterozygotní i homozygotní mutace genu pro TACI (B-cell receptor transmembrane activator and calcium-modulating cyclophilin ligand interactor) [18–20]. Selektivní imunodeficit IgA predisponuje ke vzniku CVID, proto by pacienti s tímto defektem měli být pravidelně alespoň 1krát ročně kontrolováni. Vztah CVID a IPP není jasný a u různých druhů IPP a granulomů bude pravděpodobně různý. Zvažuje se vliv infekcí (HHV8 – human herpes virus type 8, EBV – Epstein-Barr virus, HIV – human immunodeficiency virus) [21], porucha B-lymfocytů (snížené zastoupení class-switched memory B cells) [22–24], chronická antigenní stimulace s T imunitní odezvou [25], polymorfizmy TNFα (tumor necrosis factor α) [26].
Diagnostika
CVID patří mezi primární imunodeficity. Prevalence se odhaduje na 1 : 25 000–1 : 50 000 [2]. Podle definice je třeba prokázat poruchu specifické protilátkové odpovědi a vyloučit sekundární příčiny snížení hladin imunoglobulinů (leukemie, lymfomy, léky, infekce, ztráty protilátek gastrointestinálním traktem, ledvinami).
Plicní onemocnění při CVID můžeme rozdělit na obstrukční (bronchiektázie – abnormální rozšíření dýchacích cest způsobené opakovanými záněty, obliterující bronchiolitida) a restrikční (intersticiální plicní fibrózy). Další dělení je možné na postižení respiračního traktu jako důsledku recidivujících infekcí se strukturálním postižením a na neinfekční, kterým je věnována tato práce [2].
Diferenciální diagnostika IPP je široká a než stanovíme diagnózu GLILD, měli bychom vyloučit jiné infekční a neinfekční granulomatózy a IPP. GLILD může být první manifestací CVID a může také předcházet i o několik let diagnózu CVID [7]. Odlišení CVID/GD, GLILD a sarkoidózy bývá mnohdy obtížné, protože u GLILD i sarkoidózy jsou přítomny nenekrotizující granulomy. Na rozdíl od sarkoidózy jsou ale lymfocytární intersticiální pneumonie a folikulární bronchiolitida více pozorovány u GLILD [27,28].
Diagnostika plicních postižení při CVID sestává z klinického a fyzikálního vyšetření, plicního funkčního vyšetření, které může prokázat jak normální ventilační plicní parametry, tak restrikční i obstrukční ventilační poruchu s poruchou plicní difuze (přenos krevních plynů přes alveolokapilární membránu), radiologických metod včetně výpočetní tomografie s vysokou rozlišovací schopností (HRCT hrudníku – high resolution computed tomography) (obr. 1 a 2). Charakteristickými nálezy na HRCT hrudníku jsou difuzní bronchiektázie, ztluštění stěny bronchů, difuzní intersticiální změny, centrilobulární noduly, air traping (mozaiková perfuze způsobená „uvězněním, zadržením“ vzduchu v alveolech) [29,30]. Laboratorní hodnoty SACE (serum angiotensin-converting enzyme) a sIL-2R (soluble interleukine-2 receptor) v krvi využívané při monitoraci aktivity sarkoidózy nevykazují rozdílu mezi sarkoidózou a sarkoid-like (granulomy podobné sarkoidóze) granulomy u CVID a nehodí se k diferenciální diagnostice [2,10]. Další vyšetřovací metodou je bronchoskopie s bronchoalveolární laváží a transbronchiální plicní biopsií. Plicní biopsie cestou transbronchiální nebo chirurgickou cestou torakoskopicky by měla být provedena, aby se vyloučilo jiné lymfoproliferativní onemocnění včetně lymfomu [9].
Image 1. Zadopřední snímek hrudníku u pacienta s běžným variabilním imunodeficitem (CVID) a intersticiálním plicním postižením s bronchiektáziemi. Nehomogenní retikulární zastínění je přítomno oboustranně difuzně. RTG-snímky poskytla MUDr. Martina Doubková 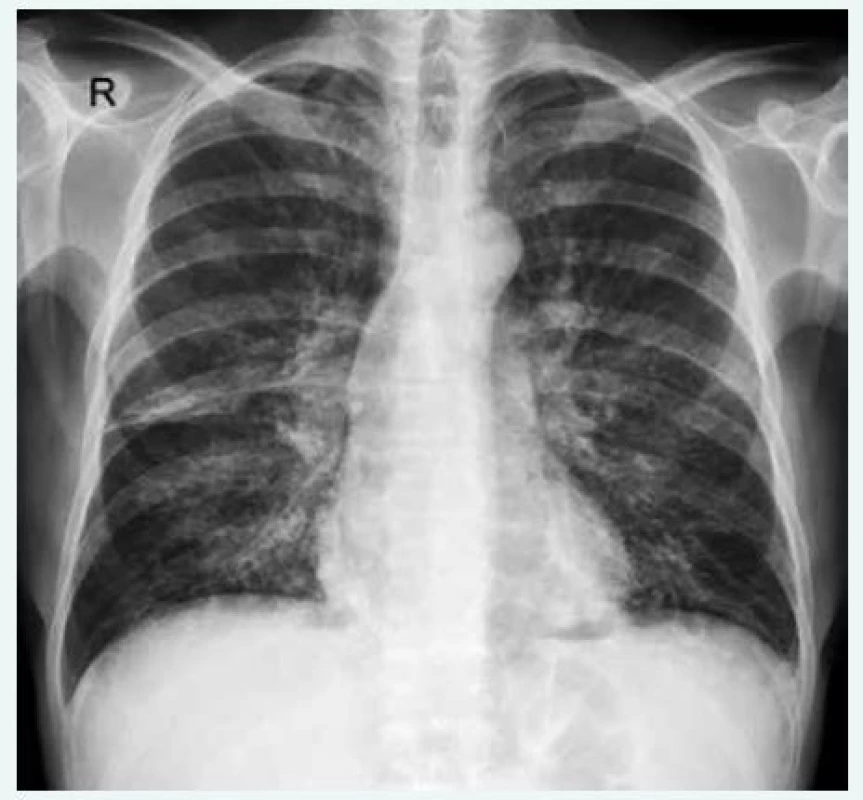
Image 2. CT plic a mediastina a HRCT plic u pacienta s CVID. Difuzně jsou přítomny bronchiektázie a intersticiální plicní proces (histologicky verifikován jako nespecifická intersticiální pneumonie). CT hrudníku poskytla MUDr. Martina Doubková 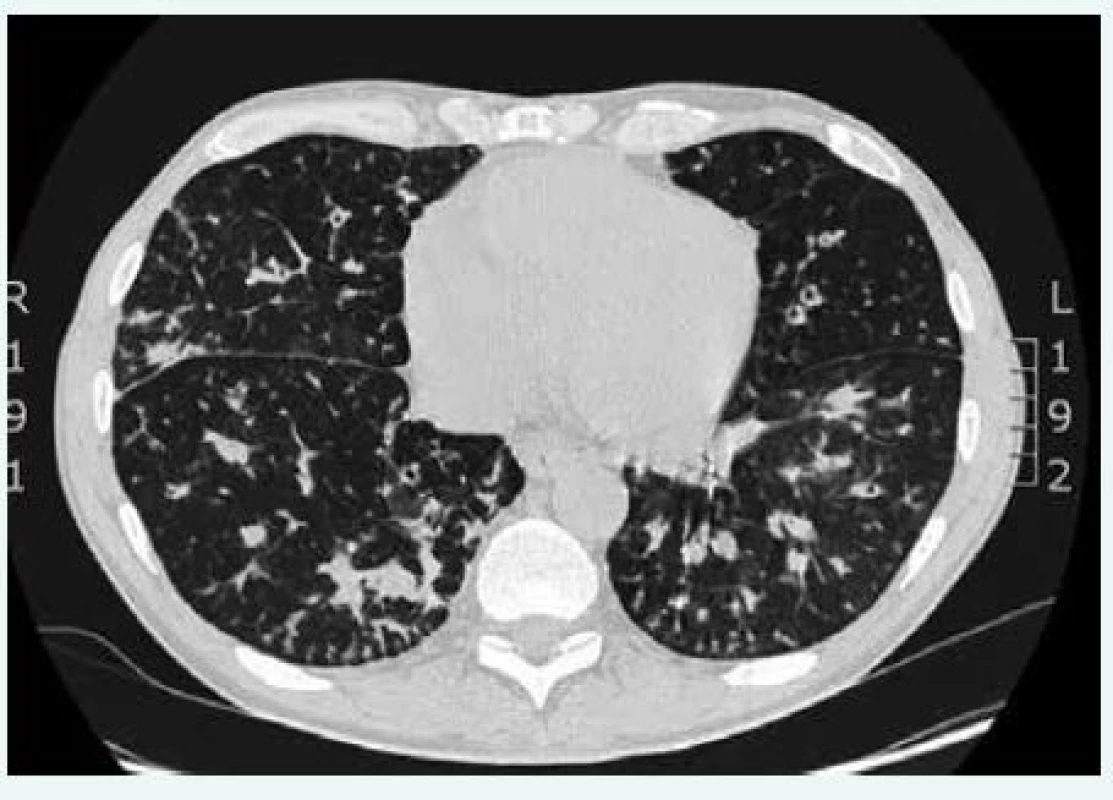
Histologické plicní nálezy asociované s CVID zahrnují sarkoid-like granuloma, organizující se pneumonie (OP), nespecifické intersticiální pneumonie (NSIP), folikulární bronchiolitidy a lymfocytární intersticiální pneumonie (LIP). Tyto nálezy se mohou u jednoho pacienta kombinovat. GLILD je termín zahrnující granulomy a lymproproliferaci (patří sem lymfocytární intersticiální pneumonie, folikulární bronchiolitida, lymfoidní hyperplazie) [2,31].
U poloviny pacientů s plicními granulomy jsou také přítomny granulomy v mimoplicní lokalizaci (slezina, játra, lymfatické uzliny, ledviny, kůže, gastrointestinální ústrojí) [2,5,7,10]. Jedná se většinou o nenekrotizující (nekaseifikující) granulomy [3], pozorovány ale byly i nekrotizující granulomy [32]. Odlišení od sarkoidózy může být obtížné a je nutné odlišit, zda jde o koincidenci sarkoidózy a CVID nebo o CVID/GD nebo GLILD [33]. Ačkoliv má granulomatózní zánět v obou případech určité podobnosti, u CVID/GD je granulom obvykle složen převážně z vágně organizovaného shluku makrofágů, histiocytů a mnohojaderných obrovskobuněčných buněk v kontrastu od dobře definovaných organizovaných granulomů u sarkoidózy (podrobněji histopatologické rozdíly granulomů sarkoidózy a CVID/GD, obr. 3 a obr. 4). Na rozdíl od sarkoidózy, u níž může být pozorována polyklonální hypergamaglobulinemie bez průkazu monoklonální gamapatie, je CVID/GD, GLILD provázen hypogamaglobulinemií, často s progresivním vývojem plicního postižení bez tendence ke spontánní regresi a s rezistencí na kortikoidní léčbu. Častý je výskyt splenomegalie s trombocytopenií a pancytopenií [34]. Ve studii Bouvryho et al 20 pacientů s průkazem granulomů plic a jiných orgánů nebo jiným typem intersticiálního plicního postižení (organizující se pneumonie, folikulární bronchiolitida, lymfocytární intersticiální pneumonie) bylo porovnáváno s kontrolní skupinou 60 pacientů se sarkoidózou. Bylo zjištěno, že u pacientů s CVID ve srovnání se sarkoidózou jsou fenotypické rozdíly ve vyšší frekvenci autoimunitních onemocnění, ve fyzikálním vyšetření plic (u pacientů s CVID významně přítomen poslechový plicní nález krepitací – auskultačně slyšitelné fenomény připomínající rozepínání suchého zipu), nálezu na HRCT hrudníku (u CVID signifikantně vyšší výskyt bronchiektázií, periferních nodulů s hladkými konturami predilekčně v dolních plicních polích, obklopené opacitami mléčného skla a vzduchový bronchogram, na rozdíl od sarkoidózy s perilymfatickým šířením nodulů lokalizovaných převážně v horních a středních plicních polích), v bronchoalveolární tekutině získané laváží (u obou skupin byla nalezena lymfocytární alveolitida, ale u pacientů s CVID převažoval snížený poměr CD4+/CD8+ 1,6 ± 1,1 oproti 5,3 ± 4 u sarkoidóz, poměr subpopulace pomocných a cytotoxických T-lymfocytů). Histopatologickým vyšetřením byly ve skupině s CVID prokázány vedle granulomatózních lézí i jiné typy postižení jako organizující se pneumonie, folikulární bronchiolitida, lymfocytární intersticiální pneumonie (tab. 1 a tab. 2). Mortalita byla vyšší ve skupině pacientů s CVID oproti pacientům se sarkoidózou bez CVID (30 % oproti 0 % ve skupině sarkoidóz) [10].
Image 3. Histologický průkaz granulomů u pacienta s CVID. Granulomy při CVID se podobají granulomům u sarkoidózy. Jsou menší, bez nekróz, na rozdíl od sarkoidózy jsou však hůře ohraničené. Morfologie granulomů při CVID je ovšem variabilní a závisí na případném přidruženém infekčním onemocnění. V literatuře jsou v souvislosti s CVID popisovány také granulomy s kaseózními nekrózami (Histopatologický obrázek poskytl MUDr. Mojmír Moulis) 
Image 4. Histologický průkaz granulomů u pacienta se sarkoidózou. Granulomy při sarkoidóze mají charakteristický vzhled. Jsou menší, ostře ohraničené, poměrně uniformní, bez nekróz a jsou tvořené především epiteloidními histiocyty s nečetnými obrovskými mnohojadernými buňkami Langhansova typu. Obvykle jsou hojné a hustě nakupené (Histopatologický obrázek poskytl MUDr. Mojmír Moulis) 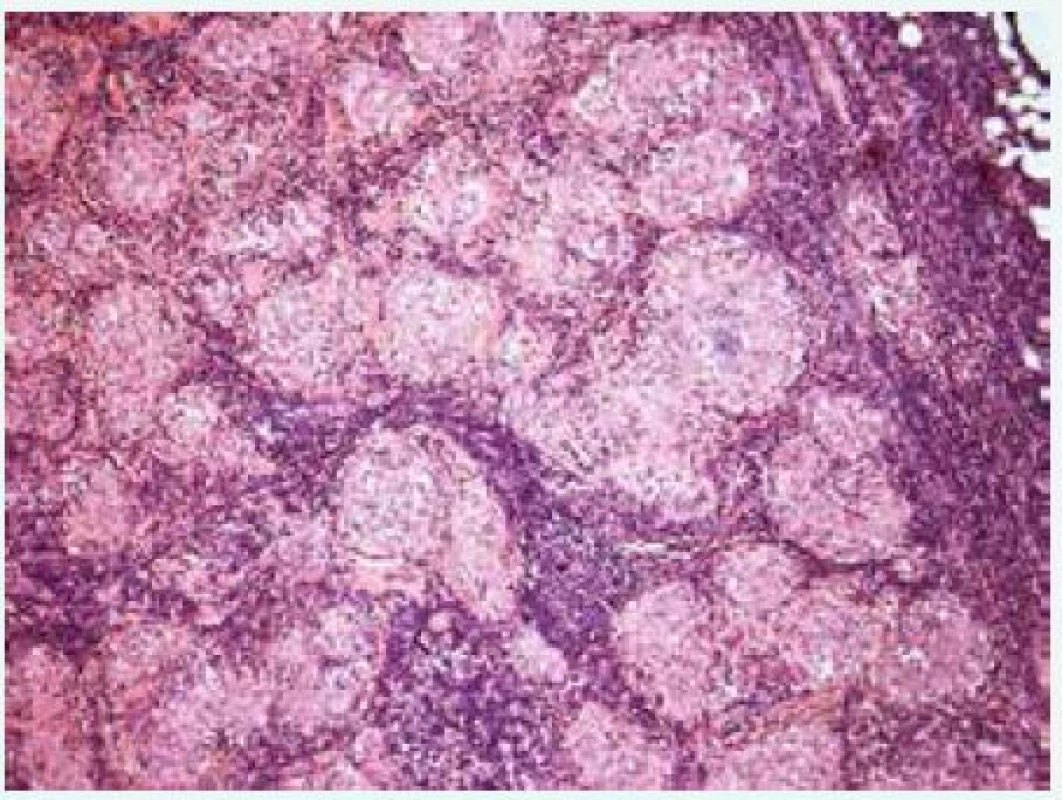
Table 1. Klinické a laboratorní nálezy u GLILD a sarkoidózy. Upraveno podle Bouvryho [9] a Verbskyho [27] ![Klinické a laboratorní nálezy u GLILD a sarkoidózy. Upraveno podle Bouvryho [9] a Verbskyho [27]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/1ac960113f53ca9dd5826cdf8538b4c3.jpg)
počet + – ukazuje vyšší přítomnost dané patologie, poměr CD4+/CD8+ – poměr subpopulace pomocných a cytotoxických T-lymfocytů, norma je 2 : 1, BALte – bronchoalveolární tekutina získaná bronchoalveolární laváží Table 2. Radiologické nálezy u GLILD a sarkoidózy. Upraveno podle Bouvryho [9] a Verbskyho [27] ![Radiologické nálezy u GLILD a sarkoidózy. Upraveno podle Bouvryho [9] a Verbskyho [27]](https://www.prolekare.cz/media/cache/resolve/media_object_image_small/media/image/83875b39e8ddd1428b7206d2be377dda.jpg)
Terapie
Bohužel, chybí kontrolované studie věnující se léčbě CVID a IPP. Optimální terapie není známa, substituce imunoglobuliny není účinná, nezabraňuje progresi. Plicní komplikace CVID vznikají nezávisle na substituční léčbě. Kortikosteroidy jsou nejvíce používané léky, ale nejsou zcela účinné a po jejich vysazení dochází obvykle k návratu nemoci. V retrospektivní studii Boursiquot analyzoval 59 pacientů s CVID/GD [5]. 42 % nemocných s granulomatózním postižením nevyžadovalo léčbu v době diagnózy a bylo stabilních po dobu několika let. Pouze u pacientů s klinickými potížemi, středně těžkým až těžkým plicním funkčním vyšetřením nebo se zhoršováním plicního nálezu byla indikována imunosupresivní léčba spočívající v monoterapii prednisonem nebo v kombinaci s jinými imunosupresivy (cyklofosfamid, cyklosporin, azatioprin, mykofenolát mofetil). Kortikosteroidy se používají v léčbě i u granulomatózního postižení jiných orgánů nežli plic (lymfatické uzliny, játra, slezina) [5].
Vzhledem k tomu, že u GLILD může být přítomen „normální“ skiagram hrudníku a plicní funkční vyšetření bez poruchy, je vhodné provést v čase diagnózy CVID HRCT hrudníku a začít s léčbou včas, abychom zabránili nebo zpomalili vznik nevratné plicní fibrózy [29]. Léčba GLILD je ale svízelná, monoterapie glukokortikoidy je méně účinná a vede ke kompletní remisi jen u některých nemocných [2,5]. Jako steroid šetřící léky jsou přidávána další imunosupresiva, cyklosporin, rituximab, hydroxychlorochin, cyklofosfamid, metotrexát. V práci Chase et al byla prokázána u pacientů s GLILD účinnost kombinované imunosuprese (azatioprin, rituximab) se signifikantním zlepšením HRCT nálezu a plicních funkcí. Kombinovaná imunosuprese byla zvolena proto, že v histologickém vzorku plicní tkáně u GLILD jsou přítomny B - i T-lymfocyty a rituximab ovlivňuje B-lymfocyty (anti-CD20, monoklonální protilátka proti povrchovému antigenu na B-lymfocytech) a azatioprin T-lymfocyty [35]. Kromě glukokortikoidů byly zkoušeny inhibitory anti-TNFα (monoklonální protilátky proti TNFα) s úspěchem pouze v kazuistikách [32,35,36]. Další léčba sestává z plicní rehabilitace, nutriční podpory, řádné léčby infekcí po dobu 2–3 týdnů, preventivní antimikrobiální terapie dle kolonizace bakterií u pacientů s recidivujícími infekcemi, bronchodilatační a mukolytické léčby u pacientů s bronchiektáziemi, preventivní profylaxi Pneumocysty při terapii kortikoidy. V případě plicní progrese je u nemocných s respirační nedostatečností indikována dlouhodobá domácí oxygenoterapie (minimálně 16 hod inhalace kyslíku). S plicními transplantacemi u těchto nemocných mnoho zkušeností není. Diagnóza CVID není kontraindikací k provedení plicní transplantace, i když je provázena infekčními komplikacemi [37].
Prognóza
GLILD je spojována s vyšší mortalitou ve srovnání s pacienty s CVID bez tohoto postižení [4,5,8,10,38–40]. Ve studii Ardenize a Cunninghama ale nebyl zjištěn rozdíl v přežití mezi pacienty s CVID a CVID/GD [7,41]. Ve studii Bouvryho et al bylo přežití pacientů s CVID a IPP ovlivněno výskytem lymfomů, infekčními komplikacemi a nikoliv přítomností IPP [10]. Ve studii Resnicka et al na souboru 473 pacientů s CVID bylo přežití ovlivněno negativně výskytem lymfomu, hepatitidou, chronickým plicním (funkční a strukturální postižení) a gastrointestinálním onemocněním. Přežití nebylo ovlivněno přítomností bronchiektázií, autoimunit, jinými nádory než lymfomy, granulomatózním onemocněním a předešlou splenektomií [38].
Závěr
IPP se manifestují u 5–22 % CVID pacientů a objevují se často již v době diagnózy CVID. Imunologické vyšetření je nedílnou součástí diagnostického a diferenciálně diagnostického algoritmu IPP. Na diagnózu CVID bychom měli pomýšlet u nemocných s IPP, hypogamaglobulinemií a opakujícími se infekcemi zejména respiračního traktu.
MUDr. Martina Doubková
doubkovamartina@seznam.cz
Klinika nemocí plicních a tuberkulózy LF MU a FN Brno
www.fnbrno.cz
Doručeno do redakce 23. 9. 2014
Přijato po recenzi 25. 11. 2014
Sources
1. Travis WD, Costabel U, Hansell DM et al. An official American Thoracic Society/European Respiratory Society statement: update of the international multidisciplinary classification of the idiopathic interstitial pneumonias. Am J Respir Crit Care Med 2013; 188(6): 733–748.
2. Prasse A, Kayser G, Warnatz K. Common variable immunodeficiency-associated granulomatous and interstitial lung disease. Curr Opin Pulm Med 2013; 19(5): 503–509.
3. Park JH, Levinson AI. Granulomatous-lymphocytic interstitial lung disease (GLILD) in common variable immunodeficiency (CVID). Clin Immunol 2010; 134(2): 97–103.
4. Chapel H, Lucas M, Lee M et al. Common variable immunodeficiency disorders: division into distinct clinical phenotypes. Blood 2008; 112(2): 277–286.
5. Boursiquot JN, Lucas M, Patel S et al. Granulomatous disease in CVID: retrospective analysis of clinical characteristics and treatment efficacy in a cohort of 59 patients. J Clin Immunol 2013; 33(1): 84–95.
6. Cunningham Rundles C. Human B cell defects in perspective. Immunol Res 2012; 54(1–3): 227–232.
7. Ardeniz O, Cunningham-Rundles C. Granulomatous disease in common variable immunodeficiency. Clin Immunol 2009; 133(2): 198–207.
8. Bates CA, Ellison MC, Lynch DA et al. Granulomatous-lymphocytic lung disease shortens survival in common variable immunodeficiency. J Allergy Clin Immunol 2004; 114(2): 415–421.
9. Fernández Pérez ER. Granulomatous lymphocytic interstitial lung disease. Immunol Allergy Clin North Am 2012; 32(4): 621–632.
10. Bouvry D, Mouthon L, Brillet PY et al. Granulomatous-associated common variable immunodeficiency disorder: a case-control study versus sarcoidosis. Eur Respir J 2013; 41(1): 115–122.
11. Grimbacher B, Hutloff A, Schlesier M et al. Homozygous loss of ICOS is associated with adult onset common variable immunodeficiency. Nat Immunol 2003; 4(3): 261–268.
12. Warnatz K, Salzer U, Rizzi M et al. B cell activating factor receptor deficiency is associated with an adult onset antibody deficiency syndrome in humans. Proc Natl Acad Sci USA 2009; 106(33): 13945–13950.
13. van Zelm MC, Reisli I, van der Burg M et al. An antibody deficiency syndrome due to mutations in the CD19 gene. N Engl J Med 2006; 354(18): 1901–1912.
14. Kanegane H, Agematsu K, Futatani T et al. Novel mutations in a Japanese patient with CD19 deficiency. Genes Immun 2007; 8(8): 663–670.
15. Kuijpers TW, Bende RJ, Baars PA et al. CD20 deficiency in humans results in impaired T cell independent antibody responses. J Clin Invest 2010; 120(1): 214–222.
16. Thiel J, Kimmig L, Salzer U et al. Genetic CD21 deficiency is associated with hypogammaglobulinemia. J Allergy Clin Immunol 2012; 129(3): 801–810.
17. van Zelm MC, Smet J, Adams B et al. CD81 gene defect in humans disrupts CD19 complex formation and leads to antibody deficiency. J Clin Invest 2010; 120 : 1265–1274.
18. Salzer U, Chapel HM, Webster AD et al. Mutations in TNFRSF13B encoding TACI are associated with common variable immunodeficiency in humans. Nat Genet 2005; 37(8): 820–828.
19. Castigli E, Wilson SA, Garibyan L et al. TACI is mutant in common variable immunodeficiency and IgA deficiency. Nat Genet 2005; 37(8): 829–834.
20. Pan Hammarstrom Q, Salzer U, Du L et al. Reexamining the role of TACI coding variants in common variable immunodeficiency and selective IgA deficiency. Nat Genet 2007; 39(4): 429–430.
21. Wheat WH, Cool CD, Morimoto Y et al. Possible role of human herpesvirus 8 in the lymphoproliferative disorders in common variable immunodeficiency. J Exp Med 2005; 202(4): 479–484.
22. Detkova D, de Gracia J, Lopes-da-Silva, S et al. Common variable immunodeficiency: association between memory B cells and lung diseases. Chest 2007; 131(6): 1883–1889.
23. Wehr C, Kivioja T, Schmidt C et al. The EUROclass trial: defining subgroups in common variable immunodeficiency. Blood 2008; 111(1): 77–85.
24. Warnatz K, Denz A, Drager R et al. Severe deficiency of switched memory B cells (CD27(+)IgM(-)IgD(-)) in subgroups of patients with common variable immunodeficiency: a new approach to classify a heterogeneous disease. Blood 2002; 99(5): 1544–1551.
25. Kohler PF, Cook RD, Brown WR et al. Common variable hypogammaglobulinemia with T-cell nodular lymphoid interstitial pneumonitis and B-cell nodular lymphoid hyperplasia: different lymphocyte populations with a similar response to prednisone therapy. J Alllergy Clin Immunol 1982; 70(4): 299–305.
26. Mullighan CG, Fanning GC, Chapel HM et al. TNF and lymphotoxin-alpha polymorphisms associated with common variable immunodeficiency: role in the pathogenesis of granulomatous disease. J Immunol 1997; 159(12): 6236–6241.
27. Sutor GCH, Fabel H. Sarcoidosis and common variable immunodeficiency. Respiration 2000; 67(2): 204–208.
28. Verbsky JW, Routes JM. Sarcoidosis and common variable immunodeficiency: similarities and differences. Semin Respir Crit Care Med 2014; 35(3): 330–335.
29. Park JES, Beal I, Dilworth JP et al. The HRCT appearance of granulomatous pulmonary disease in common variable immune deficiency. Eur J Radiol 2005; 54(3): 359–364.
30. Torigian DA, LaRosa DF, Levinson AI et al. Granulomatous-lymphocytic interstitial lung disease associated with common variable immunodeficiency. J Thorac Imaging 2008; 23(3): 162–169.
31. Chua I, Quinti I, Grimbacher H. Lymhoma in common variable immunodeficiency: interplay between immune dysregulation, infection and genetics. Curr Opin Hematol 2008; 15(4): 368–374.
32. Hatab AZ, Ballas ZK. Caseating granulomatous disease in common variable immunodeficiency treated with infliximab. J Allergy Clin Immunol 2005; 116(5): 1161–1162.
33. Drajna M, Kolek V, Kalabusová B. Koincidencia CVID a sarkoidózy. Kazuistiky v alergologii, pneumologii a ORL 2007; 4(1): 20–24.
34. Morimoto Y, Routes JM. Granulomatous disease in common variable immunodeficiency. Curr Allergy Asthma Rep 2005; 5(5): 370–375.
35. Chase NM, Verbsky JW, Hintermeyer MK et al. Use of combination chemotherapy for treatment of granulomatous and lymphocytic interstitial lung disease (GLILD) in patients with common variable immunodeficiency (CVID). J Clin Immunol 2013; 33(1): 30–39.
36. Thatayatikom A, Thatayatikom S, White AJ. Infliximab treatment for severe granulomatous disease in common variable immunodeficiency: a case report and review of the literature. Ann Allergy Asthma Immunol 2005; 95(3): 293–300.
37. Buton CM, Milman N, Andersen CB et al. Common variable immune deficienty and lung transplantation. Scand J Infect Dis 2007; 39(4): 362–367.
38. Resnick ES, Moshier EL, Godbold JH et al. Morbidity and mortality in common variable immune deficiency over 4 decades. Blood 2012; 119(7): 1650–1657.
39. Mechanic LJ, Dikman S, Cunningham-Rundles C. Granulomatous disease in common variable immunodeficiency. Ann Intern Med 1997; 127(8 Pt 1): 613–617.
40. Quinti I, Soresina A, Spadalo G et al. Long-term follow-up and outcome of a large cohort of patients with common variable immunodeficieny. J Clin Immunol 2007; 27(3): 308–316.
41. Cunnigham-Rundles C, Bodian C. Common variable immunodeficiency: clinical and immunological features of 248 patients. Clin Immunol 1999; 92(1): 34–48.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2015 Issue 2-
All articles in this issue
- Zlepšil se osud gravidit žen s pregestačním diabetes mellitus za deset let?
- Význam transkutánneho monitorovania tkanivového kyslíka u pacienta s diabetes mellitus s jeho komplikáciami
- Autoimunitní pankreatitida – diagnostický konsenzus
- Intersticiální plicní procesy a granulomatózy asociované s běžným variabilním imunodeficitem
- Vyšetření tenkého střeva pomocí magnetické rezonance
- Nový lék je výrazně účinnější nežli inhibitory ACE u chronického srdečního selhání
- Spontánní bakteriální peritonitida
- Co jsou a co nám přinášejí biosimilars?
- Empagliflozin – nový zástupce inhibitorů transportéru SGLT2 pro léčbu pacientů s diabetem 2. typu
- Autoimunitní pankreatitida – diagnostický konsenzus – editorial
- Akromegalie a medikamentózní léčba – editorial
- Kalcifikující uremická arteriolopatie – editorial
- Inzulinová analoga u pacientů s diabetem a renální dysfunkcí
- Súčasnosť a budúcnosť v manažmente vénových vaskulárnych chorôb
- Akromegalie a medikamentózní léčba
- Raritní případ mnohočetného myelomu: vícečetný solitární plazmocytom kostí bérců a předloktí
- Kalcifikující uremická arteriolopatie – léčba tiosulfátem sodným
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Spontánní bakteriální peritonitida
- Vyšetření tenkého střeva pomocí magnetické rezonance
- Empagliflozin – nový zástupce inhibitorů transportéru SGLT2 pro léčbu pacientů s diabetem 2. typu
- Význam transkutánneho monitorovania tkanivového kyslíka u pacienta s diabetes mellitus s jeho komplikáciami
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

