-
Medical journals
- Career
První české zkušenosti s lenalidomidem v terapii anemických nemocných s myelodysplastickým syndromem s delecí dlouhého ramene 5. chromozomu
Authors: Anna Jonášová 1; Libor Červinek 2; Petra Bělohlávková 3; Jaroslav Čermák 4; Monika Beličková 4; Petr Rohoň 5; Olga Černá 6; Ivana Hochová 7; Magda Šišková 1; Karla Kačmářová 8; Eva Janoušová 9
Authors‘ workplace: I. interní klinika – klinika hematologie 1. LK UK a VFN Praha, přednosta prof. MUDr. Marek Trněný, CSc. 1; Interní hematologická a onkologická klinika LF MU a FN Brno, pracoviště Bohunice, přednosta prof. MUDr. Jiří Mayer, CSc. 2; IV. interní hematologická klinika LF UK a FN Hradec Králové, přednosta doc. MUDr. Pavel Žák, Ph. D. 3; Ústav hematologie a krevní transfuze Praha, ředitel prof. MUDr. Petr Cetkovský, Ph. D., MBA 4; Hemato-onkologická klinika LF UP a FN Olomouc, přednosta prof. MUDr. Tomáš Papajík, CSc. 5; Hematologická klinika 3. LF UK a FN Královské Vinohrady Praha, přednosta prof. MUDr. Tomáš Kozák, Ph. D., MBA 6; Oddělení klinické hematologie 2. LF UK a FN Motol Praha, přednostka prim. MUDr. Ivana Hochová 7; Česká MDS skupina 8; Institut biostatistiky a analýz LF MU Brno, ředitel doc. RNDr. Ladislav Dušek, Ph. D. 9
Published in: Vnitř Lék 2015; 61(12): 1028-1033
Category: Original Contributions
Overview
Myelodysplastický syndrom (MDS) je jedno z nejčastějších hematologických onemocnění ve věku nad 60 let. Přes intenzivní výzkum je však terapie této heterogenní krevní choroby velmi komplikovaná. V posledních letech se objevily 2 nové terapeutické přístupy, a to imunomodulační léčba a demetylační terapie. Zvláště imunomodulační léčba, reprezentovaná preparátem lenalidomid, znamená velký pokrok v léčně anemických nemocných specificky s 5q - aberací. Odpověď, především dosažení transfuzní nezávislosti, se pohybuje v původních studiích kolem 60–80 %. U nás byla tato terapie zahájena v roce 2008. Prezentujeme analýzu 34 nemocných, 31 žen, 3 mužů s mediánem věku 69 (46–80 let), z toho 27 nemocných (79,4 %) mělo diagnózu 5q - syndromu, 5 nemocných diagnózu refrakterní anémie s multilineární dysplazií, 1 nemocný refrakterní anémii s excesem blastů (RAEB 1) a 1 pacient neklasifikovatelný myelodysplastický syndrom/myeloproliferativní syndrom. Data nemocných jsou ukládána do lenalidomidové lišty Českého MDS registru. Jde o nemocné chronicky transfundované s diagnózou MDS s nižším rizikem a 5q - aberací. V našem souboru jsme zaznamenali odpověď na terapii reprezentovanou dosažením kompletní transfuzní nezávislosti u 91 % nemocných. Kompletní cytogenetická odpověď byla dosažena u 15 % nemocných a parciální odpověď u 67 %. U 15 % nemocných byla zjištěna mutace tumor supresorického genu TP53 (3 z 18 vyšetřených nemocných, 2 z nich progredovali do MDS s vyšším rizikem a následně do AML). Lenalidomid byl u většiny nemocných velmi dobře tolerován. Na tomto, byť zatím malém souboru prezentujeme vysokou efektivitu tohoto preparátu a základní principy a problematiku terapie lenalidomidem.
Klíčová slova:
český registr – lenalidomid – myelodysplastický syndrom – terapieÚvod
Myelodysplastický syndrom (MDS) představuje heterogenní skupinu klonálních chorob hemopoetické kmenové buňky charakterizovaných inefektivní hemopoézou, periferní cytopenií, morfologickou dysplazií a nebezpečím transformace do akutní myeloidní leukemie (AML). MDS, zvláště v raných fázích, je vlastně premaligním (preleukemickým) onemocněním. Incidence, která se obecně pohybuje kolem 3,5–4/100 000 za rok, s věkem významně stoupá [1]. U osob nad 60 let je pak 30/100 000, což činí MDS jednu z nejčastějších hematologických malignit v této věkové kategorii. Až do začátku 21. století byla terapie MDS většinou frustrující. V posledních letech byly do léčby uvedeny nové terapeutické přístupy, které aspoň pro část nemocných s MDS znamenají velký posun vpřed [2,3]. Sem patří imunomodulační terapie, představovaná preparátem lenalidomidem (Revlimid, Celgene).
Nejčastější cytogenetickou abnormalitou MDS je delece dlouhého ramene 5. chromozomu (5q-) s výskytem asi u 15–20 % MDS nemocných [4]. Skupina nemocných nesoucích tuto aberaci je relativně heterogenní v klinických projevech v závislosti na dalších faktorech, jako je počet myeloblastů ve dřeni, další cytogenetické aberace, přítomnost mutací a dalších cytopenií [5–8]. Speciální místo zaujímá mezi podskupinami MDS skupina s izolovanou 5q - aberací bez zmnožení blastů, která tvoří samostatnou jednotku podle WHO (World Health Organization) klasifikace. Převážně jde v této skupině o nemocné s 5q - syndromem, který je v otázce přežívání jedním z prognosticky nejpříznivějších syndromů MDS [9]. Bohužel u většiny těchto nemocných se během let vyvine těžká transfuzní závislost se všemi neblahými následky, jako je sideróza orgánů, významné zhoršení kvality života, ale i zhoršení morbidity a celkového přežívání. Cílem terapie těchto nemocných je především dosažení normalizace krevního obrazu a odstranění transfuzní závislosti. Preparát lenalidomid patří mezi imunomodulační léky s významným efektem specificky u nemocných s 5q - aberací. Vede jednak k normalizaci hodnot krevního obrazu, jednak u některých nemocných k vymizení patologického klonu s 5q - aberací. Na terapii lenalidomidem reaguje zhruba 70 % nemocných s aberací 5q - a asi 90 % nemocných splňujících kritéria 5q - syndromu, jak ukazují i naše vlastní zkušenosti (Jonášová et al, přednáška na Olomouckých hematologických dnech, konference České hematologické společnosti, 2013) a výsledky velkých studií MDS 003 a MDS 004 [10,11].
Lenalidomid je již několik let schválen v USA k terapii nemocných s 5q - s významnou anémií. Recentní závěry analýzy nemocných dlouhodobě léčených ze studií MDS 003 a MDS 004 ukazují, že respondenti mají i prodloužené celkové přežívání oproti nemocným nereagujícím na terapii [12]. Opatrnosti je třeba u nemocných s dalšími cytogenetickými aberacemi, zvýšeným počtem blastů, mutací TP53 a trombocytopenií; to jsou nemocní se zvýšeným rizikem časnější progrese choroby, a proto je u nich třeba zvážit agresivnější terapii [13,14]. Ke zvýšení rizika transformace do AML terapie lenalidomidem nevede [15,16]. Jak ukázala studie MDS-002, nemocní bez 5q - dosahují odpovědi pouze asi v 25 % [17].
Terapie lenalidomidem představuje významný pokrok v léčbě anemických nemocných s myelodysplastickým syndromem (MDS) a 5q - aberací. U nás byla tato terapie zahájena v roce 2008. Až do předminulého roku byla přístupna omezenému počtu nemocných pouze v rámci výzkumného protokolu. Od konce roku 2013, kdy byl preparát povolen Evropskou lékovou agenturou, se terapie, stále ještě limitována specifickým povolením v souladu se zněním § 16, Zákona o veřejném zdravotním pojištění č. 48/1997 Sb.,, užívá v celé České republice. V našem sdělení přinášíme naše první zkušenosti s tímto preparátem u nemocných s nízce rizikovým MDS a delecí 5q.
Soubor pacientů a metodiky
V našem souboru jsme analyzovali data 34 nemocných, kteří byli léčeni lenalidomidem v ČR od roku 2008 do konce roku 2014. Data nemocných byla získána z registru České MDS skupiny a byla analyzována ve spolupráci s Institutem biostatistiky a analýz MU Brno. Tab. 1 představuje účast jednotlivých hematologických center na této terapii. Léčeno bylo 34 nemocných, z toho 31 žen a 3 muži s mediánem věku 69 (46–80 let): 27 (nemocných 79,4 %) mělo diagnózu 5q - syndromu, 5 diagnózu (refrakterní anémie s multilineární dysplazií, 1 refrakterní anémie s excesem blastů (RAEB 1) a 1 myelodysplastický syndrom/myeloproliferativní syndrom neklasifikovatelný (u-MDS/MPS). Tab. 2 ukazuje základní laboratorní údaje nemocných. Všichni nemocní měli provedeno klasické cytogenetické vyšetření a fluorescenční in situ hybridizaci (FISH) k potvrzení přítomnosti 5q - aberace. V cytogenetickém vyšetření mělo izolovanou deleci 5q 82,4 % pacientů, kombinaci s další jednou aberací mělo 14,6 % a > 1 další aberace byla přítomna pouze u 1 nemocného (2,9 %). Celkem 18 nemocných bylo vyšetřeno na přítomnost mutace známého tumor-supresorického genu TP53. Pro určení mutačního stavu genu TP53 byla analyzována DNA z mononukleárních buněk kostní dřeně pacientů a byla použita metoda sekvenace nové generace (454 GS Junior, Roche). Průměrná hloubka čtení byla 800 pro sekvenované exony a umožnila nastavit detekční limit pro záchyt mutace na 2 % nádorových buněk ve vzorku. U všech nemocných byla mutace TP53 detekována před zahájením terapie lenalidomidem.
Table 1. Hematologická centra participující na sběru dat do lenalidomidové lišty Českého MDS registru, počty a podíl nemocných v procentech 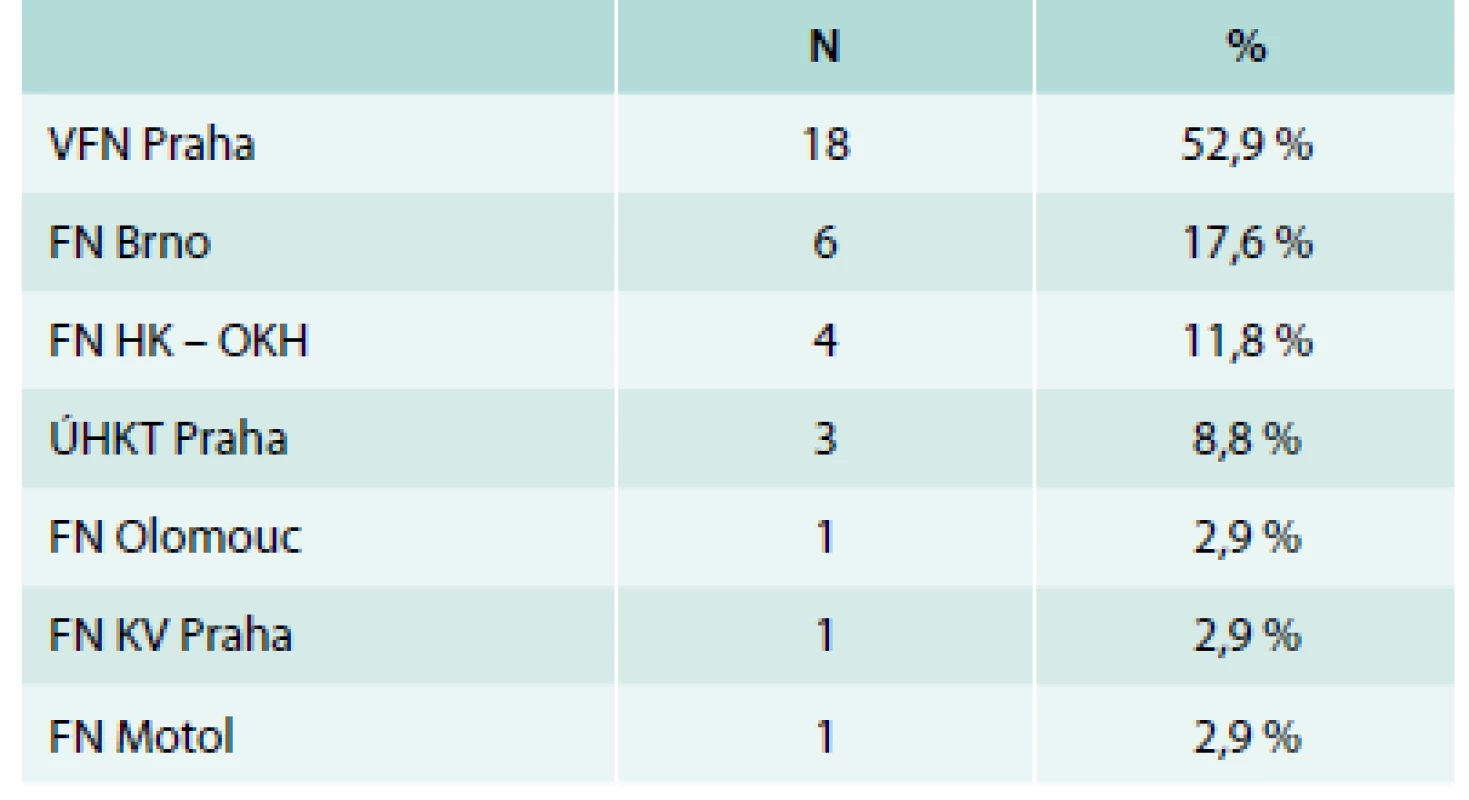
Table 2. Hematologické laboratorní hodnoty nemocných počet vyšetřených nemocných 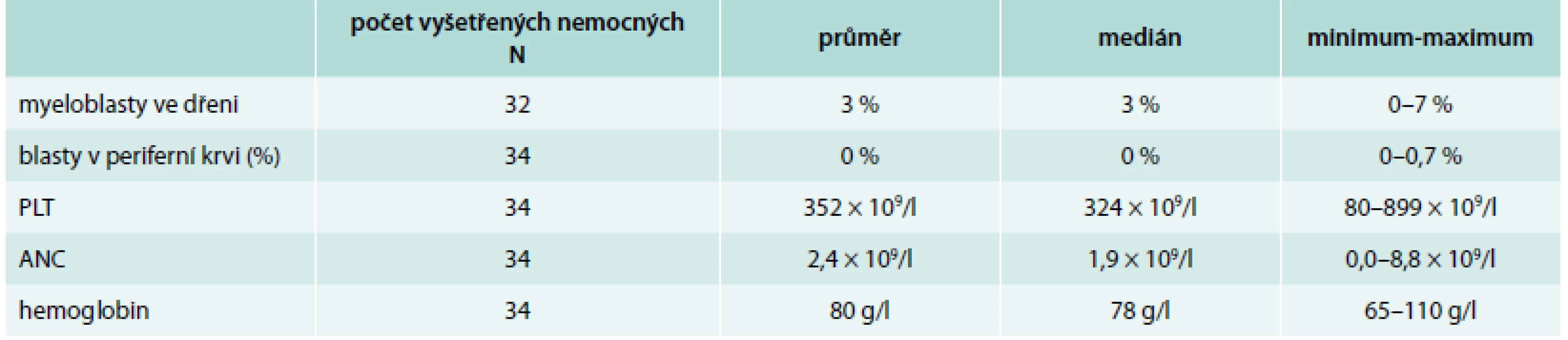
ANC – absolutní hodnoty neutrofilů (absolute neutrophil count) PLT – trombocyty (platelet) Medián doby od diagnózy do zahájení terapie lenalidomidem byl 15 měsíců s rozmezím 1–199. 16 nemocných (47 %) bylo primárně léčeno erytropoetiny (EPO) a pouze 1 z těchto nemocných měl na EPO přechodně trvající odpověď ve smyslu navýšení hemoglobinu a přechodné transfuzní nezávislosti.
Výsledky
Lenalidomid jako terapie první linie byl použit u 47 % nemocných. Medián trvání terapie lenalidomidem byl 10 měsíců (rozmezí 1–54). Terapie byla přerušena u 10 nemocných (29,4 %), z toho u 4 nemocných (1,2 %) z rozhodnutí ošetřujícího hematologa, u 3 (0,8 %) pro nedosažení odpovědi nebo následné selhání odpovědi, u 2 (0,5 %) pro progresi onemocnění do vyššího rizika MDS a u 1 nemocného pro problémy s hrazením léku. U 4 nemocných (1,2 %), u nichž byla terapie přerušena z rozhodnutí ošetřujícího lékaře, tak bylo učiněno pro dobrou a déle trvající odpověď (transfuzní nezávislost – v tomto případě více než 6 měsíců trvající transfuzní nezávislost). Nikdo z těchto nemocných v době analýzy nejevil známky relapsu anémie. 7 nemocných v době analýzy nežilo, z toho 1 zemřel pro progresi onemocnění a transformaci do akutní leukemie (AML), ostatní nemocní na následky komorbidit.
Medián podané dávky byl u nemocných v souhrnu 5 mg s rozmezím 2,5–10 mg. U většiny nemocných zahajuje většina center léčbu dávkou 10 mg/den a později snižuje dávku na 5–2,5 mg trvale.
Léčebnou odpověď jsme hodnotili u 32 nemocných se známou transfuzní závislostí (potřeba 2 a více transfuzních jednotek za měsíc, trvající minimálně 8 týdnů) před zahájením terapie, z toho 29 (tj. 90,6 %) nemocných dosáhlo kompletní transfuzní nezávislosti (hodnoceno podle IWG – International Working Group 2006 kritérií – 8 a více týdnů trvající nezávislost na transfuzích), graf 1. Odpověď,, tak jak je popisováno v literatuře, se objevovala po 2–8 týdnech terapie (medián 4 týdny). U 1 nemocné jsme dosáhli transfuzní nezávislosti až po přidání EPO, byť byla na terapii EPO před zahájením lenalidomidu rezistentní. Odpověď na lenalidomid byla velice dobře reflektována navýšením erytropoézy ve dřeních nemocných, jak ukazuje graf 2. Data k cytogenetické odpovědi byla kompletní u 18 nemocných, u nichž byla kontrolována dřeň opakovaně v průběhu terapie. Kompletní cytogenetické odpovědi (cytogeneticky nedetekujeme patologický klonus, všechny vyšetřované mitózy jsou normální) dosáhli 3 nemocní (15 %). Parciální cytogenetická odpověď (zmenšení patologického klonu o více než 50 %) byla dosažena u 12 nemocných (67 %). Medián doby, v níž byla zaznamenána cytogenetická odpověď, byl 12,2 měsíců od zahájení terapie (rozpětí 3,4–23,1 měsíců). Nutno ale poznamenat, že vzhledem k nedávné registraci léku v Evropě, a tedy i u nás, většina nemocných zahajovala terapii relativně recentně, a tito nemocní tedy nejsou ještě dostatečně dlouho léčeni. Proto procento cytogenetických odezev, ke kterým nejspíše dochází později v průběhu kontinuální terapie, není dosud vysoké. Ze stejného důvodu neuvádíme v naší práci délku trvání odpovědi, která by byla relativně krátkou dobou sledování výrazně zkreslena, zvláště v porovnání s výsledky původních studií [10,11] Mutace známého tumor-supresorického genu TP53, která se vyskytuje u MDS celkem asi u 9 % nemocných a specificky u MDS s 5q - kolem 20 %, byla vyšetřena u 18 nemocných, pozitivní byla u 3 nemocných (15 %) [14]. Tak, jak se popisuje v literatuře, a s ohledem na její negativní prognostický význam, 2 z těchto 3 nemocných progredovali do vyšších rizikových skupin MDS. Dosud nikdo z nemocných bez mutace neprogredoval a netransformoval do AML.
Graph 1. Odpověď na terapii lenalidomidem představovaná dosažením transfuzní nezávislosti 
Graph 2. Vzestup erytropoézy (v % buněk) ve dřeni v průběhu terapie lenalidomidem 
Mezi nežádoucími vedlejšími účinky dominovaly hematologické nežádoucí účinky s trombocytopenií, které se vyskytovaly se u 94 % (70,6 % nemocných se stupněm toxicity 3,4 hodnoceno podle Common toxicity Criteria verse 2006), a neutropenií u 88 % (u 23,5 % byl stupeň toxicity 3,4). V průběhu terapie, tak jak je popisováno v literatuře, docházelo k postupnému nárůstu hodnot neutrofilů a trombocytů. Nicméně hematologická toxicita byla hlavním důvodem redukce vstupní dávky 10 mg na 5 mg, či dokonce v některých případech na 2,5 mg/den. Tab. 3 dokumentuje hematologickou i nejčastější nehematologickou toxicitu včetně stupňů toxicity. Nehematologická toxicita se vyskytla u 70 % nemocných a byla většinou lehčího stupně a dobře zvladatelná. U 20 % nemocných jsme zaznamenali kožní, většinou přechodné a lehčí reakce v podobě suchosti kůže, svědění, vyrážky. 14 % pacientů mělo zažívací obtíže nepřesahující stupen toxicity 2. Jen u 1 nemocné (2,9 %) se vyskytla trombóza žil dolních končetin. U žádného z našich léčených nemocných nebyla terapie ukončena z důvodů nežádoucích účinků.
Table 3. Vedlejší nežádoucí účinky lenalidomidu 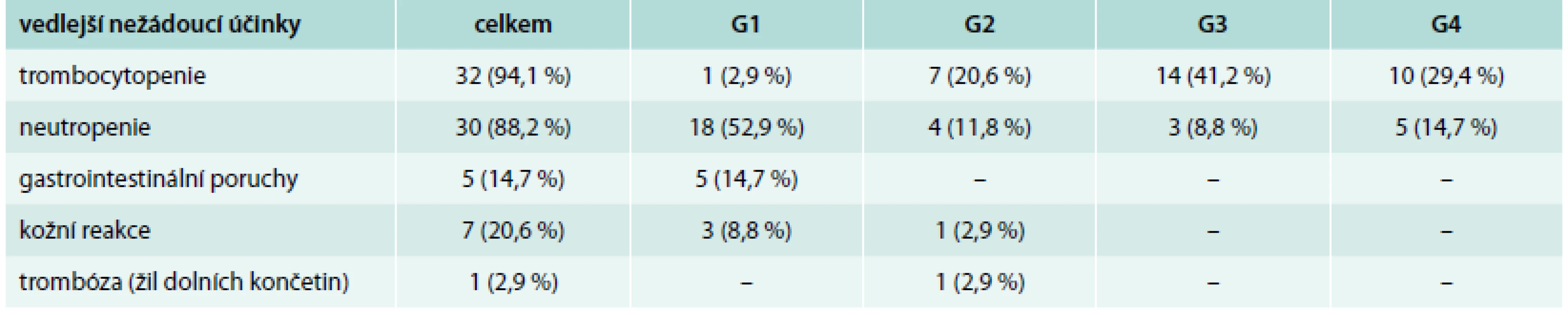
G1–G4 – stupeň (grade) toxicity podle mezinárodního hodnocení toxicity terapie, hodnoceno podle Common toxicity Criteria verse 2006 Diskuse
Dominujícím klinickým znakem MDS jsou cytopenie. Asi 90 % nemocných trpí anémií a z toho více než polovina anémií těžkou s transfuzní závislostí. Dnes již mnohé studie dobře dokumentují negativní prognostický vliv transfuzní závislosti na celkové přežívání [18,19]. Těžší anémie též zhoršuje průběh komorbidit a vede k významnému zhoršení kvality života nemocných. V terapii anémie jsme až dosud byli odkázáni pouze na opakované substituce či terapii erytropoetiny. Ty však většinou mají efekt u nemocných v raných fázích choroby a s anémií lehčího stupně [20,21]. Hledání nových terapeutických možností tak bylo a je zásadní v terapii těchto nemocných.
Velkým přínosem proto bylo zavedení imunomodulační terapie, konkrétně lenalidomidu, do léčby nemocných s MDS. Tato léčba je ale svou vysokou efektivitou specificky vázána na menší podskupinu MDS, což jsou nemocní s aberací 5q-. Jak uvádíme výše, většina dosud proběhlých studií vykazovala odpověď v podobě transfuzní nezávislosti u 60–70 % nemocných [10,11]. V případě 2 největších studií (MDS 003, MDS 004) byli do studie zařazováni i nemocní s dalšími aberacemi, vyšším počtem myeloblastů ve dřeni a event. dalšími cytopeniemi, tedy nikoli pouze nemocní s nízkým stupněm rizika MDS podle IPSS (International Prognostic Scoring System). V našem, byť zatím nevelkém souboru nemocných dosahujeme mnohem vyššího procenta odezev. To lze snadno vysvětlit faktem, že léčíme v naprosté většině nemocné s pravým 5q - syndromem a nízce rizikové nemocné, kteří jsou vynikajícími respondenty na terapii lenalidomidem. Proč právě tato skupina nemocných má tak vysokou citlivost na lenalidomid, není ještě přesně objasněno. Naše recentní práce dokládá souvislost specifické citlivosti na lenalidomid k hladinám cereblonu, proteinu, který je součástí ubiquitin E ligázy a je vazebným místem pro imunomodulační preparáty a jehož exprese z dosud nejasných důvodů je významně vyšší právě u nemocných 5q - [23–25]. Jiné práce vztahují citlivost na lenalidomid ke změněným hladinám a nižší účinnosti určitých kináz, fosfatáz a dalších proteinů, jejichž geny, lokalizované na deletovaném úseku dlouhého raménka 5. chromozomu, jsou haploinsuficientní [26–28].
Naše výsledky potvrzují velkou citlivost buněk s delecí 5q - i relativně velkým procentem cytogenetických odezev [29]. Celková cytogenetická odpověď byla zaznamenána u 82 %. Proti větším studiím ale máme nižší procento kompletních cytogenetických odezev (15 % v naší studii proti 25 % v MDS 004). To může být dáno zatím kratší dobou terapie vzhledem k nedávné registraci léku v České republice a používáním obecně nižších dávek lenalidomidu (převládá dávka 5 mg, dlouhodobě pak i 2,5 mg). Na druhé straně naše dávkování nikterak neovlivňuje procento hematologických odezev a vede k výborné toleranci léku. Velmi dobrý profil nežádoucích účinků lenalidomidu též přispívá k sympatičnosti tohoto perorálního preparátu. Hematologická toxicita je sice v prvních měsících vyšší, většinou ale postupně mizí a neznamená vážnější problém v terapii lenalidomidem. Navíc studie Sekerese dokládá pozitivní korelaci hloubky trombocytopenie a neutropenie v prvních cyklech ke kvalitě odpovědi [30].
Závěr
Závěrem můžeme konstatovat, že jsme v našem souboru MDS nemocných s 5q - aberací a transfuzní závislostí potvrdili vysokou účinnost lenalidomidu a velice dobrou toleranci tohoto preparátu. Lenalidomid představuje významný pokrok v léčbě MDS a vede k markantnímu zlepšení kvality života těchto nemocných.
Článek vznikl za podpory grantů: IGA MZ ČR NT14174–3/2013, IGA MZ ČR NT13836–4/2012, NT13899–4/2012 a PRVOUK-27.
MUDr. Anna Jonášová, Ph.D.
atjonas@hotmail.com, anna.jonasova@vfn.cz
I. interní klinika – klinika hematologie 1. LF UK a VFN, Praha
www.vfn.cz
Doručeno do redakce 11. 4. 2015
Přijato po recenzi 5. 8. 2015
Sources
1. Aul C, Bowen D, Yoshida TY. Pathogenesis, etiology and epidemiology of myelodysplastic syndromes. Haematologica 1998; 83(1): 71–86.
2. Jonášová A - Myelodysplastické syndromy – pokroky v terapii v posledních dvou desetiletích. Vnitř Lék 2013; 59(7): 635–640.
3. Jonášova A, Čermák J, Červínek L et al. První zkušenosti České MDS skupiny s terapií 5-azacytidinem u nemocných s myelodysplastickým syndromem s vyšším rizikem (IPSS střední 2 a vysoké riziko), akutní myeloidní leukemií do 30 % myeloblastů a chronickou myelomonocytární leukemií II. Transfuze Hematol Dnes 2013; 19(3): 125–133.
4. Haase D, Germing U, Schanz J et al. New insights into the prognostic impact of the karyotype in MDS and correlation with subtypes: evidence from a core dataset of 2124 patients. Blood 2007; 110(13): 4385–4395.
5. Brezinova J, Zemanova Z, Bystricka D et al. Deletion of the long arm but not the 5q31 region of chromosome 5 in myeloid malignancies. Leuk Res 2012; 36(3): e43-e45. Dostupné z DOI: http://dx.doi.org/10.1016/j.leukres.2011.11.007.
6. Neuwirtová R, Zemanová Z, Březinová J et al. Jsme oprávněni zařadit nemocné s dvěma samostatnými buněčnými klony a to delecí 5q a trizomií 8 jako podskupinu myelodysplastického syndromu? Transfuze Hematol dnes 2014; 20(1): 25–31.
7. Jonasova A, Cermak J, Neuwirtova R et al. Thrombocytopenia at diagnosis as an important negative prognostic marker in isolated 5q - MDS (IPSS low and intermediate-1). Leuk Res 2012; 36(12): e222-e224. Dostupné z DOI: http://dx.doi.org/10.1016/j.leukres.2012.08.002.
8. Mallo M, Cervera J, Schanz J et al. Impact of adjunct cytogenetic abnormalities for prognostic stratification in patients with myelodysplastic syndrome and deletion 5q. Leukemia 2011; 25(1): 110–120.
9. Van den Berghe H. The 5q - syndrome. Scand J Haematol Suppl 1986; 45 : 78–81.
10. List A, Dewald G, Bennett J et al. Myelodysplastic Syndrome-003 Study Investigators. Lenalidomide in the myelodysplastic syndrome with chromosome 5q deletion. N Engl J Med 2006; 355(14): 1456–1465.
11. Fenaux P, Giagounidis A, Mufti G et al. MDS-004 Lenalidomide del5q Study Group. A randomized phase 3 study of lenalidomide versus placebo in RBC transfusion-dependent patients with Low-/Intermediate-1-risk myelodysplastic syndromes with del5q. Blood 2011; 118(14): 3765–3776.
12. Hellstrom-Lindberg E, Giagounidis A, Selleslag D et al. Update on the safety and long-term outcomes in lenalidomide-treated patients with red blood cell transfusion-dependent low-/int-1-risk myelodysplastic syndromes and del(5q). Haematologica. 2012; 97(Suppl 1): S358–S359.
13. Jädersten M, Saft L, Mufti GJ et al. TP53 mutations in low-risk myelodysplastic syndromes with del(5q) predict disease progression. J Clin Oncol 2011; 29(15): 1971–1979.
14. Kulasekararaj AG, Smith AE, Mufti GJ et al. TP53 mutations in myelodysplastic syndrome are strongly correlated with abberations of chromosom 5, and correlate with adverse prognosis. Br J Haematol 2013; 160(5): 660–672.
15. Kuendgen A, Lauseker M, List AF et al. Lenaidomide does not increase AML progression risk in RBC transfusion-dependent patients with Low - or Intermediate-1-risk MDS with del(5q): a comparative analysis. Leukemia 2012; 27(5): 1072–1079.
16. Germing U, Lauseker M, Hildebrandt B et al. Survival, prognostic factors and rates of leukemic transformation in 381 untreated patients with MDS and del(5q): a multi-center study. Leukemia 2012; 26(6): 1286–1292.
17. Raza A, Reeves JA, List AF et al. Phase 2 study of lenalidomide in transfusion-dependent, low-risk, and intermediate-1 risk myelodysplastic syndromes with karyotypes other than deletion 5q. Blood 2008; 111(1): 86–93.
18. Malcovati L. Red blood cell transfusion therapy and iron chelation in patients with myelodysplastic syndromes. Clin Lymphoma Myeloma 2009; 9(Suppl 3): S305-S311.
19. Cazzola M, Malcovati L. Prognostic classification and risk assessment in myelodysplastic syndromes. Hematol Oncol Clin North Am 2010; 24(2): 459–468.
20. Park S, Grabar S, Kelaidi C et al. for the GFM group (Group Francophone des Myelodysplasies) Predictive factors of response and survival in myelodysplastic syndrome treated with erythropoietin and G-CSF: the GFM experience. Blood 2008; 111(2): 574–582.
21. Hellström-Lindberg E, Gulbrandsen N, Lindberg G et al. Scandinavian MDS Group. A validated decision model for treating the anaemia of myelodysplastic syndromes with erythropoietin + granulocyte colony-stimulating factor: significant effects on quality of life. Br J Haematol 2003; 120(6): 1037–1046.
22. Sokol L, List A. Immunomodulatory therapy for myelodysplastic syndromes. Int J Hematol 2007; 86(4): 301–305.
23. Jonasova A, Bokorova R, Fuchs O et al. High level of full-length cereblon mRNA in lower risk myelodysplastic syndrome with isolated 5q deletion is implicated in the efficacy of lenalidomide. Eur J Haematol 2014; 95(1):27–34. Dostupné z DOI: http://dx.doi.org/10.1111/ejh.12457 .
24. Ito T, Ando H, Suzuki T et al. Identification of a primary target of thalidomide teratogenicity. Science 2010; 327(5971): 1345–1350.
25. Lopez-Girona A, Mendy D, Ito T et al. Cereblon is a direct protein target for immunomodulatory and antiproliferative activities of lenalidomide and pomalidomide. Leukemia 2012; 26(11): 2326–2335.
26. Wei S, Chen X, Rocha K et al. A critical role for phosphatase haplodeficiency in the selective suppression of deletion 5q MDS by lenalidomide. Proc Natl Acad Sci USA 2009; 106(31): 12974–12979.
27. Wei S, Chen X, McGraw K et al. Lenalidomide promotes p53 degradation by inhibiting MDM2 auto-ubiquitination in myelodysplastic syndrome with chromosome 5q deletion. Oncogene 2012; 32(9): 1110–1120.
28. Oliva EN, Cuzzola M, Nobile F et al. Changes in RPS14 expression levels during lenalidomide treatment in Low - and Intermediate-1-risk myelodysplastic syndromes with chromosome 5q deletion. Eur J Haematol 2010; 85(3): 231–235.
29. Ximeri M, Galanopoulos A, Klaus M et al. Effect of lenalidomide therapy on hematopoiesis of patients with myelodysplastic syndrome associated with chromosome 5q deletion. Haematologica 2010; 95(3): 406–414.
30. Sekeres MA, Maciejewski JP, Giagounidis AA et al. Relationship of treatment-related cytopenias and response to lenalidomide in patients with lower-risk myelodysplastic syndromes. J Clin Oncol 2008; 26(36): 5943–5949.
Labels
Diabetology Endocrinology Internal medicine
Article was published inInternal Medicine

2015 Issue 12-
All articles in this issue
- Regionální registr plicní embolie
- Antitrombotická léčba a nevarikózní krvácení do horní části gastrointestinálního traktu
- Výskyt ventilační poruchy plic u osob se silikózou a pneumokoniózou uhlokopa
- První české zkušenosti s lenalidomidem v terapii anemických nemocných s myelodysplastickým syndromem s delecí dlouhého ramene 5. chromozomu
- Vyšetřování tubulární resorpce fosfátů u pacientů s chronickým onemocněním ledvin
- Význam stanovení solubilního receptoru ST2 v diagnostice a prognostické stratifikaci pacientů se srdečním selháním
- Geriatrická multimorbidita – jeden z klíčových problémů současné medicíny
- Karotická stenóza – diagnostika a léčba
-
Studie PATHWAY-2: spironolakton vs placebo, bisoprolol a doxazosin ke stanovení optimální léčby hypertenze rezistentní na léky
Vysoká účinnost spironolaktonu ve snížení krevního tlaku u rezistentní hypertenze - Monoklonální imunoglobulin a kožní nemoci ze skupiny mucinóz – scleredema adultorum Buschke a scleromyxedema: popis 4 případů a přehled léčebných možností
- Nekorigovaná Fallotova tetralógia u 69-ročného pacienta
- Medicína na polární stanici v Antarktidě
- Internal Medicine
- Journal archive
- Current issue
- Online only
- About the journal
Most read in this issue- Karotická stenóza – diagnostika a léčba
- Geriatrická multimorbidita – jeden z klíčových problémů současné medicíny
- Vyšetřování tubulární resorpce fosfátů u pacientů s chronickým onemocněním ledvin
- Výskyt ventilační poruchy plic u osob se silikózou a pneumokoniózou uhlokopa
Login#ADS_BOTTOM_SCRIPTS#Forgotten passwordEnter the email address that you registered with. We will send you instructions on how to set a new password.
- Career

